Вирусы после пересадки почки
Обновлено: 13.05.2024
Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
Российский научный центр хирургии им. акад. Б.В. Петровского, РАМН, Москва
Российский научный центр хирургии им. акад. Б.В. Петровского, РАМН, Москва
Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
Клиническая и бактериологическая характеристика инфекционно-воспалительных осложнений у больных после родственной трансплантации почки
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2014;(8): 37‑42
Волынчик Е.П., Большаков Л.В., Богомолова Н.С., Кузнецова С.М. Клиническая и бактериологическая характеристика инфекционно-воспалительных осложнений у больных после родственной трансплантации почки. Хирургия. Журнал им. Н.И. Пирогова. 2014;(8):37‑42.
Volynchik EP, Bol'shakov LV, Bogomolova NS, Kuznetsova SM. Clinical and bacteriological characteristic of infectious purulent complications in patients after related renal transplantation. Pirogov Russian Journal of Surgery = Khirurgiya. Zurnal im. N.I. Pirogova. 2014;(8):37‑42. (In Russ.).
Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
Изучены частота и характер инфекционно-гнойных и неинфекционных осложнений у реципиентов родственных почек в раннем послеоперационном периоде. Исследована микрофлора, доминирующая при инфекционных процессах в мочевыводящих путях, а также антибиотикочувствительность микрофлоры: Pseudomonas aeruginosa, Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae, Citrobacter freundii, Staphylococcus epidermidis, Enterococcus faecalis, Candida albicans. Объектом исследования явились 182 штамма микроорганизмов (бактерий и грибов рода Candida), выделенных из мочи больных с пересаженной почкой в раннем послеоперационном периоде (от 2 сут до 3 мес). Разработаны схемы профилактики, терапии и режимы дозирования антимикробных препаратов, что дало возможность снизить частоту инфекционных осложнений.
Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
Российский научный центр хирургии им. акад. Б.В. Петровского, РАМН, Москва
Российский научный центр хирургии им. акад. Б.В. Петровского, РАМН, Москва
Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
Введение
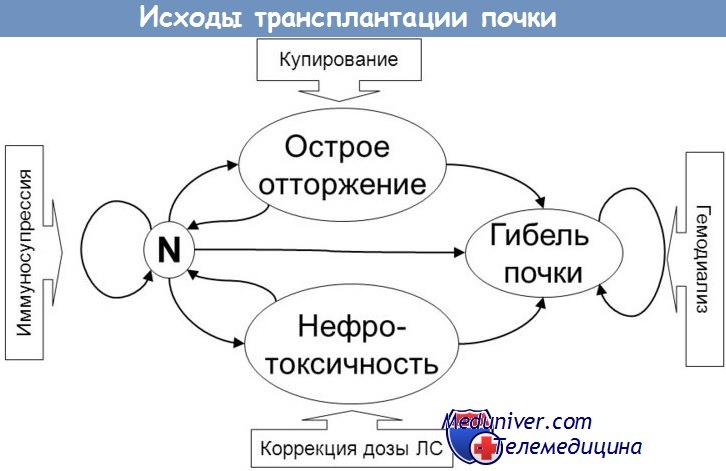
Трансплантация почки является методом выбора при лечении больных хронической почечной недостаточностью в терминальной стадии (ХПН). Эта операция улучшает качество жизни больных. Несмотря на достигнутые результаты при трансплантации почки, в клинической трансплантологии остается ряд серьезных проблем. Одной из таких проблем являются инфекционно-воспалительные осложнения, возникающие в раннем послеоперационном периоде и отрицательно влияющие на функцию почечного трансплантата и его выживаемость. Развивающиеся в раннем послеоперационном периоде инфекционно-воспалительные осложнения, наряду с острым канальцевым (тубулярным) некрозом пересаженной почки, урологическими осложнениями, лимфоцеле, вирусной инфекцией и др. во многом определяют ближайшие и отдаленные результаты трансплантации почки [2, 12].
Совершенствование иммуносупрессии, улучшение хирургической техники, применение новых поколений антимикробных препаратов, введение медикаментозной профилактики ряда инфекций за последние полтора десятилетия способствовали заметному сокращению количества инфекционных осложнений после трансплантации органов [1, 5, 10]. Инфекционно-воспалительные осложнения все-таки остаются серьезной проблемой и приобретают еще большую актуальность ввиду роста резистентности нозокомиальной флоры из-за необходимости частого назначения антибиотиков у больных, ожидающих трансплантацию почки и находящихся на перитонеальном и гемодиализе [15]. Однако следует отметить, что у авторов нет единого мнения в отношении длительности антибактериальной терапии. Так, R. de Souza и соавт. [17] считают, что лечение путем пролонгирования антибактериальной терапии ведет к росту резистентности микрофлоры.
E. El Amari и соавт. считают, что следует ограничить применение антибиотиков при бессимптомной бактериурии у реципиентов почечного трансплантата [11]. По данным H. Green и соавт., длительная антибактериальная терапия снижает риск послеоперационной бактериурии на 87% [14]. L. Linares и соавт. [15] установили наличие полирезистентной бактериальной флоры у 14% больных, что достоверно ухудшало прогноз течения заболевания. Наиболее часто полирезистентность выявлялась у E. coli, Klebsiella spp., Citrobacter spp., Morganella morganii spp., P. aeruginosa, Acinetobacter baumannii. Enterococcus spp. и метициллинрезистентного Staphylococcus aureus. Различные применяемые протоколы иммуносупрессии по-разному влияют на частоту возникновения, течения и клинические проявления различных инфекций. По данным Н.П. Домниковой и соавт. [4], у больных со стойким иммунодефицитом чаще высевается грамположительная флора, проявляющаяся антибиотикорезистентностью. Эффективное лечение инфекционно-воспалительных осложнений возможно лишь при применении адекватной антибактериальной терапии [3, 7]. Одной из проблем у реципиентов почечного трансплантата остается инфекция мочевыводящих путей. Она проявляется бактериальной колонизацией мочевыводящих путей, а также изолированным присутствием бактерий в образце мочи (даже в сочетании с лейкоцитами) при отсутствии клинических проявлений мочевой инфекции (бессимптомная бактериурия). Причиной развития микозов после трасплантации органов были грибы рода Candida [8, 16]. Несмотря на профилактическое применение антибиотиков широкого спектра действия, наиболее распространенной причиной сепсиса (и бактериемии) у реципиентов после трансплантации почки остаются грамотрицательные возбудители [6, 13].
Материал и методы
С 2007 по 2012 г. аллотрансплантация родственных почек по поводу ХПН в РНЦХ им. акад. Б.В. Петровского была выполнена 209 больным. Возраст больных колебался от 1 до 51 года. При этом пересадка была выполнена у 129 (61,7%) детей в возрасте от 1 года до 16 лет. Лиц мужского пола было 48 (23%), женского - 32 (15,3%).
В основном это были больные с хроническим гломерулонефритом, двусторонним уретерогидронефрозом, гемолитико-уремическим синдромом, синдромом Альпорта, двусторонним нефросклерозом.
Осложнения были выявлены у 45 (21,5%) больных, в том числе у 26 (12,4%) развились инфекционные осложнения, у 19 (9,1%) - не инфекционные. После трансплантации почки применяли двух- и трехкомпонентные протоколы супрессии. Индукционную иммуносупрессию осуществляли двукратным введением кэмпоса или симулекта, в некоторых наблюдениях - другими иммунодепрессантами - АТГАМ (лошадиный антитимоцитарный гаммаглобулин), ОКТ 3 (моноклональные антитела). Для плановой иммуносупрессии применяли кортикостероиды, циклоспорин А, програф, адваграф, майфортик, неорал, сертикан. В предоперационном периоде с целью профилактики инфекционных осложнений в посттрансплантационном периоде санировали очаги инфекции. Проанализированы хирургические, урологические и инфекционные осложнения, а также функции трансплантированных почек в раннем послеоперационном периоде. Материалом для бактериологических анализов служили кровь, раневое отделяемое, бронхиальный лаваж, мокрота, моча. Большинство исследований (90%) приходится на анализы мочи, которым было уделено особое внимание. Объектом исследования явились 182 штамма микроорганизмов (бактерий и грибов рода Candida), выделенных из мочи больных с пересаженной почкой в ранний послеоперационный период (от 2 дней до 3 мес). Выделение и идентификацию микрофлоры проводили согласно общепринятым методикам, а также с использованием автоматического анализатора Vitek-2 Compact. Полученную информацию анализировали с использованием отечественной компьютерной системы Микроб-2.
Нашей целью явилось изучение этиологической структуры возбудителей инфекционных осложнений у реципиентов родственных почек, особенностей инфекции мочевыводящих путей, а также обоснование рекомендации по применению рациональной антибиотикотерапии с учетом чувствительности к антибиотикам.
Результаты и обсуждение
Исследована этиологическая структура микрофлоры, выделенной из мочи от больных, которым произведена родственная аллотрансплантация почки в РНЦХ им. акад. Б.В. Петровского за период 2007-2012 гг. При бактериологическом исследовании крови на стерильность в большинстве исследований роста микрофлоры не получено. В нашем отделении трансплантации почки в отделяемом из ран преимущественно выделяли золотистый и эпидермальный стафилококки. При этом преобладал эпидермальный стафилококк, отличавшийся более высокой устойчивостью к антибактериальным препаратам. По данным литературы, частота раневой инфекции после трансплантации почки составляет от 2 до 25%. Чаще всего раневая инфекция развивается в течение 3-4 нед после оперативного вмешательства и связана с техническими проблемами операции. До 60% всех штаммов, выделенных из раневого отделяемого, составляют золотистый и эпидермальный стафилококки. При исследовании отделяемого из нижних отделов трахеобронхиального дерева (мокрота, бронхиальный лаваж) в основном выделяли синегнойную палочку, золотистый стафилококк и грибы рода Candida, более низким был удельный вес бактерий рода Klebsiella и рода Acinetobacter.

Поскольку большинство (более 90%) анализов приходится на мочу, этому исследованию было уделено особое внимание. В раннем послеоперационном периоде более чем у половины больных выявлена высокая степень бактериурии (100 000 и более микробных клеток в 1 мл мочи). Этим больным проводили эмпирическую, а по получении бактериологических данных и этиотропную антимикробную/противогрибковую терапию и постоянный бактериологический мониторинг. Продемонстрировано, что, как правило, при высокой степени бактериурии доминировала грамотрицательная флора: Pseudomonas aeruginosa (17,0%), Klebsiella pneumoniae (14,8%), Escherichia coli (12,6%), Enterobacter cloacae (11,5%) и Citrobacter freundii (5,5%). Из грамположительных бактерий преобладали Staphylococcus epidermidis (6,0%) и микроорганизмы рода Enterococcus (4,8%) - E. faecalis и E. faecium (табл. 1).
Определена чувствительность 6 наиболее часто выделяемых при высокой степени бактериурии грамотрицательных и грамположительных микроорганизмов более чем к 20 антимикробным средствам - ампициллину, амоксициллину клавуланату, пиперациллину в сочетании с тазобактамом, цефазолину, цефотаксиму, цефтазидиму, цефоперазону в комбинации с сульбактамом, цефепиму, имипенему, меропенему, амикацину, нетилмицину, гентамицину, полимиксину, ципрофлоксацину, левофлоксацину, моксифлоксацину, оксациллину, ванкомицину, линезолиду, эритромицину, клиндамицину, кларитромицину, фузидину, рифампицину, а также к противогрибковым препаратам: амфотерицину, нистатину, кето- и итроконазолам, флуконазолу, клотримазолу, вариконазолу, флуцитозину.
За 2007-2012 гг. выполнено 50 583 бактериологических исследования, проанализированы 1433 биопробы клинического материала. Выявлено, что штаммы Р. aeruginosa сохраняли высокую чувствительность к полимиксину (96,8%), имипенему (74,2%) и амикацину (71,0%). Е. coli была высокочувствительна к имипенему (100%), полимиксину (95,7%), амикацину (78,3%), а также к цефоперазону в сочетании с сульбактамом (82,6%). С. freundii был высокочувствителен к имипенему (100%), полимиксину (90%) и амикацину (70%). Штаммы К. pneumoniae оказались высокочувствительны к имипенему (100%), полимиксину (96,3%), меропенему (77,8%) и амикацину (59,3%). Е. cloacae имел 100% чувствительность к имипенему и полимиксину. К меропенему и амикацину количество чувствительных культур составило соответственно 80,9 и 52,4%. S. epidermidis был высокочувствителен к линезолиду и ванкомицину (по 100%), фузидину и рифампицину (по 90,9%) и моксифлоксацину (72,7%). Следует отметить, что фузидин и линезолид при лечении инфекций мочевыводящих путей не используются, поскольку обнаруживаются в моче в низких концентрациях, что недостаточно для получения терапевтического эффекта.
Доля грибов рода Candida не превышала 7,1%.
Инфекционные осложнения развились у 26 (12,4%) больных: пиелонефрит - у 9 (4,9%), пневмония - у 6 (3,26%), в том числе у 3 бактериальная, у 3 пневмоцистная, сепсис - у 5 (2,7%), раневая инфекция - у 3 (1,4%), туберкулез легких - у 2 (1,1%), микоз пищевода - у 1. Как правило, инфекционные осложнения были бактериальными, при этом исключение составили 4 наблюдения: в 3 выявлена пневмоцистная пневмония и в 1 - микоз пищевода. Из 5 больных сепсисом 2 умерли, что составило 40%.

У 19 (9,1%) больных наблюдали осложнения неинфекционного характера (табл. 2): у 14 (6,7%) - урологические осложнения, у 2 - гематому забрюшинного пространства и у 3 - кровотечение (несостоятельность артериального и венозного анастомозов).

Изучены функциональные аспекты пересаженной почки. После 209 пересадок почек нормальная их функция отмечена у 183 (87,6%) больных, сниженная - у 23 (11%). Трансплантат не функционировал у 3 больных, у которых в раннем послеоперационном периоде была произведена трансплантатэктомия (табл. 3).
Частота, характер и тяжесть инфекционных осложнений в значительной степени зависят от срока после трансплантации почки. Их вероятность наиболее высока в ранние сроки после операции и может составлять 95% - это обычные внутрибольничные бактериальные или грибковые инфекции хирургической раны, легких, мочевого тракта или сосудистого доступа независимо от применения иммуносупрессии. В этом периоде могут быть инфекции, полностью не излечимые вследствие неадекватной терапии: это недолеченные пневмонии, инфекции, связанные с диализным доступом. Серьезным осложнением этого периода являются септические состояния. Чаще это инфицирование синегнойной палочкой, золотистым стафилококком, разными видами грибов Candida, кишечной палочкой и другой грамотрицательной флорой, вирусной инфекцией. Основными причинами развития инфекционных осложнений в раннем посттрансплантационном периоде являются:
1) дисфункция трансплантата, требующая усиления иммуносупрессии;
2) ранняя повторная операция;
3) продолжительное использование катетеров, мочеточниковых стентов, длительная вентиляция легких;
4) несостоятельность анастомозов или формирование жидкостных скоплений, гематом;
5) кортикостероиды: поддерживающая и пульс-терапия;
6) раневая инфекция, развивающаяся в течение 3-4 нед после операции и связанная с техническими проблемами операции.
До 60% всех штаммов, полученных из раневого отделяемого, составляют представители рода Staphylococcus, в основном эпидермальный стафилококк. Распространенность смешанных инфекций в последние годы значительно увеличилась. При наличии инфицированных лимфоцеле, гематом, мочевых затеков требуется чрескожное или открытое дренирование.
Как показывают данные литературы, цефалоспорины третьего поколения нашли наибольшее применение в периоперационной профилактике инфекционных осложнений. Наилучшее время для введения первой дозы препарата - за 15 мин до операции вместе с началом вводного наркоза, что обеспечивает максимальную концентрацию препарата в тканях операционной раны к моменту разреза, когда начинается контаминация раны. Кратность введения препарата определяется периодом его полувыведения.
Мы использовали комбинацию цефотаксима с ванкомицином и вориконазолом. Дозу назначали в зависимости от массы тела больного. Профилактика продолжалась от 3 до 5 сут до удаления дренажей.
Эмпирическую антибактериальную/антигрибковую терапию при инфекционных осложнениях проводили при соответствующих клинических симптомах (жалобы больных на дизурические явления и т.п.) или при выделении микрофлоры в большом количестве (100 000 микробных клеток и более) и плановом исследовании мочи. Бактериологическое исследование мочи у больных с вышеуказанными симптомами проводили до применения антибиотиков.
Препараты назначали незамедлительно всем больным, у которых выявлена высокая степень бактериурии, при этом принимали во внимание данные ретроспективного анализа о возможном возбудителе и его чувствительности к антибиотикам за прошедший период.
В дальнейшем после идентификации микрофлоры и определения ее чувствительности к антибиотикам терапию корригировали (увеличивали дозу препарата или меняли антимикробный/антифунгальный агент). При дозировании препарата учитывали функцию трансплантата и режим гемодиализа. Отмечено, что у некоторых больных после проведения этиотропной антибиотикотерапии происходила смена возбудителя, в ряде эпизодов - неоднократно. В этих случаях также вначале применяли превентивную терапию, а затем определяли чувствительность микрофлоры к антибиотикам и назначали этиотропную противомикробную или антигрибковую терапию. После проведения этиотропного лечения были получены следующие результаты: из 6 больных с пневмонией 1 умер, у 3 больных с раневой инфекцией было достигнуто полное заживление ран. У всех 9 больных с пиелонефритом наступила полная ремиссия. Из 5 больных с сепсисом 2 умерли. Пациентке с очаговым туберкулезом верхней доли левого легкого в фазе уплотнения с марта 2011 г. по сентябрь 2012 г. проводили антибактериальную, противотуберкулезную терапию, а с ноября 2012 г. - курс противорецидивного противотуберкулезного лечения. В результате отмечена выраженная положительная рентгенологическая динамика в виде значительного рассасывания инфильтративных и очаговых изменений верхней доли левого легкого. Больная выписана по месту жительства для продолжения терапии с удовлетворительной функцией пересаженной почки.
Таким образом, в раннем послеоперационном периоде более чем у половины больных выявлена высокая степень бактериурии. Как правило, при высокой степени бактериурии доминировала грамотрицательная флора. В результате наших исследований определены антибиотики, эффективные в отношении выделенных микроорганизмов, что дает возможность их применения в случаях неотложной и экстренной эмпирической терапии. Антибиотикопрофилактика с использованием цефотаксима доказала, что наилучшее время для введения первой дозы препарата - за 15 мин до операции с вводным наркозом, что обеспечивает максимальные концентрации препарата в тканях операционной раны к моменту разреза, когда начинается контаминация. Профилактику проводили в послеоперационном периоде до удаления дренажей (от 3 до 5 сут). Несмотря на применяемую нами антибиотикопрофилактику, инфекционные осложнения наблюдали у 26 (12,4%) больных. При дозировании препаратов учитывали функцию трансплантата и режим гемодиализа. При особо тяжелом течении инфекционных осложнений в послеоперационном периоде следует учитывать участие в инфекционном процессе вирусов - цитомегаловирусной инфекции, вируса Эпштейна-Барр, ВК (полиомавируса). При этом необходимо использовать специфическую терапию, активную в отношении перечисленных видов сопутствующих осложнений. В результате нашего исследования разработаны схемы профилактики и режимы дозирования антибактериальных препаратов, что позволило снизить частоту инфекционных осложнений до 12,4%, раневой инфекции до 1,4%.
Осложнения трансплантации почек. Последствия иммуносупрессии
Самой частой причиной смерти в течение первого года после трансплантации является инфекция, особенно цитомегаловирусная. Определение титра антицитомегаловирусных антител должно входить в обязательную программу обследования донора и реципиента. ЦМВ-инфекция может быть как первичной (т. е. передаваться реципиенту с трансплантированной почкой или компонентами крови), так и связанной с реактивацией вируса у реципиента с положительными результатами серологических проб вследствие иммуносупрессивной терапии. В последнем случае заболевание проявляется через 1-3 мес. После трансплантации.
Иммуносупрессия остается необходимым условием трансплантации. К сожалению, применение иммунодепрессантов может вызывать репликацию вируса Эпштейна-Барр с развитием потенциально смертельного посттрансплантационного лимфопролиферативного заболевания в 1-2 % случаев. В 2001 г. в Северной Америке это наблюдалось у 121 из 7545 детей, которым с 1987 по 2000 г. проводилась трансплантация почки (1,7 %). Однако обследование на ВИЧ-инфекцию не проводилось. По данным одного французского центра, посттрансплантационное лимфопролиферативное заболевание наблюдалось у 16 из 1420 взрослых больных, не инфицированных ВИЧ (1,1 %; средний возраст — 45,5 года (27-64 лет)). Лимфопролиферативный процесс у маленьких детей в течение первого года после трансплантации остается основной причиной тяжелой заболеваемости и смертности.
Его необходимо диагностировать по возможности раньше, обращая пристальное внимание на лихорадку, лимфаденопатию, симптомы со стороны ЖКТ (объемные образования в животе, кровотечения, боль, непроходимость, перфорация, асцит), судороги и другие нарушения ЦНС, а также бессимптомные объемные образования в грудной клетке и средостении у перенесших трансплантацию больных. Помимо клинического обследования требуются биопсия тканей и все возможные лабораторные исследования: определение РНК вируса Эпштейна-Барр и ЦМВ в крови (с помощью ПЦР и саузерн-блоттинга), а также определение скрытой экспрессии мембранного белка 1 на парафиновых или замороженных тканевых срезах.
Лимфопролиферативное заболевание, возникшее менее чем через 1 год после трансплантации, обычно имеет более благоприятный прогноз и при снижении доз или отмене иммунодепрессантов может регрессировать. Из упомянутых выше 16 больных с тяжелым лимфопролиферативным заболеванием в поздние сроки после трансплантации 11 получали полную химиотерапию (протокол CHOP: циклофосфамид, доксорубицин, винкристин и преднизолон), у 6 пациентов наблюдалась полная и постоянная ремиссия. Лечение по этому протоколу не оказывало нефротоксического действия, и в тех случаях, когда после противоопухолевой терапии приходилось кратковременно снижать дозы или отменять иммунодепрессанты, реакция отторжения трансплантата не развивалась.
Улучшение прогноза для ВИЧ-инфицированных больных (в результате создания средств эффективной специфической терапии) позволяет рассматривать возможность трансплантации почки и им. Однако это требует соблюдение определенных условий. В течение 2 лет до трансплантации у ВИЧ-инфицированного больного не должно быть никаких оппортунистических инфеккций, его состояние должно быть стабильным, и должен хорошо переносить специфическую терапию. Обязательные условия включают также строгое соблюдение врачебных рекомендаций, отсутствие вирусной РНК в крови, достаточное колиство СD4-лимфоцитов и отсутствие осложнений.
Возобновление патологии клубочков в трансплантированной почке. В трансплантате возможны любые рекуррентные гломерулопатии, и в 5-10 % случаев потеря аллотранплантатов происходит именно по этой причине, наиболее часто, по-видимому, возобновляется фокально-сегментарный гломерулосклероз — с трудом поддающееся лечению заболевание, механизм развития которого остается неизвестным.
Гемолитико-уремический синдром (ГУС) не возобновляется, но может быть возникать de novo. В 1-3 % случаев его причиной является семейный вариант неинфекционного ГУС (вероято, наследственный), в остальных — использование ингибиторов кальциневрина (циклоспорина и др.). Однако зто более характерно для транспланции костного мозга, чем почки. Факторами риска неинфекционного ГУС после трансплантации почки является семейное заболевание (аутосомно-доминантное или рецессивное наследование), проведение трансплантации ранее 0,5-1 года после полной ремиссии заболевания у реципиента и использование циклоспорина (если этот синдром развился при предыдущей трансплантации, то рекомендуется применять лишь низкие дозы циклоспорина).
Известны также случаи de novo развития этого синдрома после трансплантации почки от живых родственников с семейным нарушением синтеза простациклина, после приема оральных контрацептивов и при посттрансплантационном лечении антилимфоцитарным иммуноглобулином.
Инфекции после трансплантации почки ребенку
Инфекции остаются важнейшей причиной заболеваемости и смертности у больных с пересаженными почками.
1. Бактериальные инфекции после трансплантации почки. Чаще всего встречаются пневмония и инфекции мочевых путей. Последние могут быстро переходить в уросепсис и иногда бывают ошибочно приняты за острое отторжение трансплантата.
2. Вирусные инфекции после трансплантации почки. Особую опасность представляют герпесвирусы (цитомегаловирус, вирус простого герпеса, вирус varicella-zoster и вирус Эпштейна—Барр). У детей младшего возраста первый контакт с этими вирусами часто бывает уже после трансплантации почки, и тогда первичная инфекция на фоне иммунодепрессантов может протекать у них очень тяжело.
Частота этих заболеваний существенно возрастает после лечения антилимфоцитарными препаратами или пульс-терапии большими дозами глюкокортикоидов. В таких случаях показана профилактика герпесвирусных инфекций.
а) Цитомегаловирус. Цитомегаловирусная инфекция может протекать в виде носительства (вирус персистирует в лимфоидной ткани). Серологические пробы на цитомегаловирус положительны приблизительно у 30% детей старше 5 лет и у 60% подростков. Следовательно, чем младше ребенок, тем выше риск первичной цитомегаловирусной инфекции при трансплантации почки от инфицированного донора.
Она может проявляться лихорадкой, лейкопенией, тромбоцитопенией, пневмонией, язвами ЖКТ, гепатитом, гломерулопатией и почечной недостаточностью, острым отторжением трансплантата и подавлением иммунитета. Установлена связь между цитомегаловирусной инфекцией и хроническим отторжением при трансплантации любых органов. Для лечения и профилактики применяют иммуноглобулин против цитомегаловируса, нормальный иммуноглобулин для в/в введения в высоких дозах и противовирусные препараты — ацикловир, валацикловир, ганцикловир и валганцикловир.
Профилактическое лечение ганцикловиром показано серонегативным реципиентам почки от серопозитивного донора.
б) Вирус varicella-zoster. У детей старшего возраста, перенесших трансплантацию почки, вирус varicella-zoster чаще всего вызывает опоясывающий лишай — локальные пузырьковые высыпания в пределах одного дерматома. У детей младшего возраста возможна быстропрогрессирующая тяжелейшая инфекция с энцефалитом, пневмонией, печеночной недостаточностью, панкреатитом и ДВС-синдромом.
Серонегативным детям в течение 72 ч с момента случайного контакта с больным необходимо ввести иммуноглобулин против вируса varicella-zoster, в 75% случаев это существенно облегчает протекание инфекции. До трансплантации ребенка следует вакцинировать против вируса varicella-zoster. При появлении ветряночной сыпи у ребенка с пересаженной почкой необходимо немедленно ввести ацикловир парентерально. Опоясывающий лишай менее склонен к диссеминации, но ацикловир все же показан.
в) Вирус Эпштейна—Барр. Примерно 50% детей серонегативны в отношении вируса Эпштейна— Барр, и приблизительно 75% из них после трансплантации почки инфицируются. Инфекция вирусом Эпштейна—Барр даже на фоне иммунодепрессантов в большинстве случаев протекает бессимптомно. В то же время у 0,5—2% детей после трансплантации почки возникает лимфопролиферативный синдром, часто обусловленный инфекцией вирусом Эпштейна—Барр на фоне интенсивной иммуносупрессивной терапии.
Он может проявляться лихорадкой, потерей веса, гепатоспленомегалией, поносом, увеличением лимфоузлов, а при поражении ЦНС — неврологической симптоматикой. Лечение включает резкое снижение доз иммунодепрессантов, а при наличии очагов высокой степени злокачественности — химиотерапию и антилимфоцитарные средства.
г) Вирус простого герпеса. Типичные герпетические изъязвления около рта при применении иммунодепрессантов встречаются часто и обычно излечиваются при приеме ацикловира внутрь.
3. Пневмоцистная пневмония после трансплантации почки. Для профилактики пневмоцистной пневмонии после трансплантации показан 3—6-месячный курс триметоприма/сульфаметоксазола.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

Введение. Пересадка почки является наиболее распространенным видом органной трансплантации и одним из эффективных методов лечения больных с терминальной стадией хронической почечной недостаточности (ХПН). На 2002 по Беларуси в аппарате “искусственная почка” нуждалось 1184 человека, по Витебску — 104 человека. Трансплантация почки по сравнению с лечением программным гемодиализом или перитонеальным диализом обеспечивает более полную медицинскую и социальную реабилитацию пациентов, сокращает стоимость лечения больных терминальной ХПН. Важнейшей проблемой современной трансплантологии остается профилактика инфекционных осложнений. Развитие фарминдустрии и применение современных иммунодепрессантов на фоне совершенствования методов профилактики, диагностики и лечения инфекций за последние годы значительно снизило количество осложнений инфекционной природы после проведения трансплантации органов. И не смотря на это не существует идеальных иммуносупрессантов способных обеспечить длительную функцию трансплантата без развития отторжения и при этом обеспечивать достаточный уровень резистентность организма к инфекциям. Среди причин летальности пациентов после трансплантации почки эта группа осложнений продолжает занимать одно из ведущих мест. По данным разных авторов, частота инфекционных осложнений в течение первого года после пересадки почки, приводящих к летальным исходам, составляет от 2,6 % до 51,7 % [1], а среди реципиентов старше 60 лет инфекции являются причиной смерти в 18–43 % случаев [2]. Иммуносупрессивная терапия способствует развитию вирусных инфекций в 50 % случаев [3], и лидирующую роль среди них занимает цитомегаловирусная инфекция [4]. В зарубежных публикациях широко обсуждаются основные предрасполагающие факторы развития инфекций, необходимость и длительность антибиотикопрофилактики, влияние иммунизации и сроков ее проведения на повышение резистентности организма. Так, R. de Souza и соавт. [5] считают, что лечение путем пролонгирования антибактериальной терапии ведет к росту резистентности микрофлоры. E. El Amari и соавт. считают, что следует ограничить применение антибиотиков при бессимптомной бактериурии у реципиентов почечного трансплантата [6]. По данным H. Green и соавт., длительная антибактериальная терапия снижает риск послеоперационной бактериурии на 87 % [7]. L. Linares и соавт. [8] установили наличие полирезистентной бактериальной флоры у 14 % больных, что достоверно ухудшало прогноз течения заболевания. На базе семи Канадских Центров по пересадке почки проведено двойное слепое рандомизированное исследование обоснованности приема левофлоксацина в течение 3 месяцев с целью профилактики последующей бактериемии в посттрансплантационном периоде, и доказана не только необоснованность данного предположения, но и выявлен риск развития высоко резистентных штаммов [9]. И не смотря на широкий спектр рациональных схем профилактики и лечения предлагаемых авторов, все они сходятся во мнении, что длительный курс применения антибактериальных препаратов чаще приводит к развития полирезистентных форм микроорганизмов, чем к положительным результатам.
Цель. Изучить частоту встречаемости отдельных микроорганизмов в биологических жидкостях (моче и мокроте) у пациентов после трансплантации трупной почки. Оценить резистентность микрофлоры к антибиотикам разных групп. Определить удельный вес осложнений инфекционного характере среди осложнений возникающих у пациентов после трансплантации трупной почки.
Материалы иметоды. Проведен анализ 50 историй болезни пациентов с гетеротопической трансплантацией выполненой с сентября 2015 по февраль 2017 г. Для оценки факторов риска послеоперационных осложнений и степени санации хронических очагов инфекции использовались данные микробиологического исследования мочи и мокроты. Для диагностики ранних послеоперационных осложнений и анализа высеваемой флоры использовались клинико-микробиологический методы (определение степени значимой лейкоцитурии, микроорганизмов и их чувствительности к антибактериальным препаратам), ультразвуковое исследование.
Результаты иобсуждение. За период с сентября 2015 г. по февраль 2017 г. на базе ВОКБ выполнено 50 гетеротопических аллотрансплантаций трупной почки пациентам с терминальной стадией хронической болезни почек. Среди пациентов 27 мужчин и 23 женщины. Возраст пациентов колебался от 23 до 67 лет. Основной причиной развития хронической болезни почек являлся ХГН — 23 пациента(46 %), поликистоз почек — 10 пациентов(20 %), хронический пиелонефрит — 6 пациентов (12 %), ХПН обусловленная АГ — 4 пациента (8 %), ХПН обусловленная СД — 3 пациента(8 %), ВАМС гидронефроз — 1 пациент (2 %). Как видно из данных таблицы в структуре терминальных ХБП преобладает хронический гломерулонефрит. Средний возраст пациентов составил 49,9±2,4, среднее время пребывания на диализе 26,1±4,2месяца, средняя длительность пребывания в листе ожидания 20,1±4,0 месяца, что указывает на необходимость развития трансплантологии с целью улучшения качества жизни трудоспособного населения. Среди более редких причин развития ХБН в нашем исследовании выделяют ВАМС с развитием гидронефроза почки и ХПН, нейрогенный мочевой пузырь.
Причины ХБН
Количество,% от всех
Длительность пребывания на диализе, мес
Длительность пребывания влисте ожидания, мес
Читайте также:

