Вирусы при раке желудка
Обновлено: 22.04.2024
Что такое рак желудка?
Рак желудка — это злокачественная опухоль, формирующаяся из клеток слизистой оболочки органа.
Несмотря на распространенность этого типа новообразований, каждый случай требует индивидуального подхода и разработки стратегии диагностики, лечения, а также тщательного стадирования. По мере развития, новообразование прорастает стенку желудка, может распространяться на соседние органы, метастазировать в отдаленные внутренние органы
Характерные черты заболевания
Рак желудка имеет ряд специфических черт:
Причины рака желудка
Среди причин рака желудка называют:
- Преклонный возраст
- Осложненная наследственность
- Неправильное питание, гиподинамия, ожирение
- Наличие хронических заболеваний ЖКТ
- Полипоз желудка
- Курение, злоупотребление алкоголем
Виды рака желудка
В подавляющем большинстве, около 90% всех клинических случаев, речь идет об аденокарциноме.
Помимо аденокарциномы выделяют и другие виды опухоли желудка:
- Плоскоклеточный рак.
- Дифференцированный рак желудка.
- Железисто-плоскоклеточный рак и др.
По формам роста выделяют:
- Грибовидные опухоли. Такая опухоль склонна к позднему метастазированию, имеет экзофитный рост, четко отграничена от окружающих тканей.
- Опухоль изъязвленная. Имеет блюдцеобразную форму, углубление по центру. Также как и в первом случае четко отграничена от окружающих тканей и поздно метастазирует.
- Язвенно-инфильтративная опухоль. Прорастает стенки органа, не имеет четких границ.
- Диффузно-инфильтративная опухоль. Представляет собой смешанную форму. Имеет вид многочисленных изъязвлений, склонна к инфильтративному росту.
Исходя из расположения, могут быть:
- Опухоль дна желудка.
- Передней стенки.
- Задней стенки.
- Кардиальной зоны.
- Малой кривизны.
- Большой кривизны.
- Пилорической части.
Симптомы и первые признаки
- Чувство слабости.
- Нарушения со стороны психики: апатичность, индифферентное отношение к окружающему миру, депрессивное состояние.
- Чувство распирания в надчревной области.
- Диспепсические явления, среди которых: тошнота, длительно протекающая изжога.
- Резкое снижение веса (немотивированное, вне диеты).
- Болевой синдром различной степени интенсивности.
- Нарушения сна.
- Чувство переполненности желудка, плохой аппетит.
Отличить признаки рака желудка не просто. Точку в вопросе ставят диагностические мероприятия.
На развитых стадиях заболевания наблюдаются следующие симптомы опухоли желудка:
- Резкое снижение массы тела.
- Рвота без облегчения состояния.
- Тошнота.
- Ноющие боли, иррадиирующие в спину, поясницу. Чем более развита опухоль, тем интенсивнее боль.
- Кровотечения из ЖКТ, обусловленные разрушением сосудов. Проявляются рвота с кровью, черный стул и т.д.
- Анемия.
Как выглядит рак желудка?
На представленном фото рака желудка представлен внешний вид опухоли по стадиям развития.
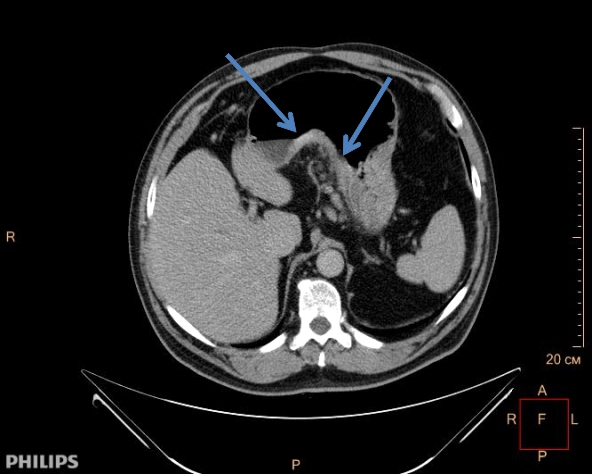
Диагностика
Диагностика необходима, чтобы ответить на следующие вопросы:
- Оценка размеров злокачественной опухоли и ее распространенности.
- Определение локализации процесса.
Диагностика включает в себя два типа исследований: Выявление опухоли и оценку степени распространения опухолевого процесса для выработки оптимальной тактики лечения.
Методы диагностики
- Рентгенография желудка. Заключается в рентгенографическом исследовании органа с применением специального контрастирующего вещества, которое пациент выпивает до проведения процедуры. Это безболезненный и информативный способ обследования.
- ФГДС (фиброгастродуоденоскопия). Минимально инвазивное исследование, в ходе которого в желудок больного вводится специальный гибкий зонд с источником света и миниатюрной камерой. Позволяет визуально оценить состояние пищевода, желудка, начальных отделов тонкого кишечника. Параллельно с выполнением исследования производится забор биоматериала.
- Биопсия. Суть этого исследования состоит в заборе участка ткани для гистологического анализа. Может проводиться как во время ФГДС, так и в процессе проведения операции.
- Компьютерная томография. Дает возможность получить детальнейшие изображения структур желудка. Процедура абсолютно безболезненна и длится не долее 10-15 минут.
- Эндоузи (эндоскопическое ультразвуковое исследование). Процедура по своему характеру схожа с ФГДС, однако аппарат для ее проведения имеет дополнительный датчик, позволяющий более детально оценить глубину прорастания опухоли в слои стеки желудка.
- Лапароскопия. Минимально инвазивная операция, проводимая как в диагностических, так и в лечебных целях. Суть ее состоит во введении в брюшную полость через точечные разрезы специальных инструментов. Проводится под общим наркозом.
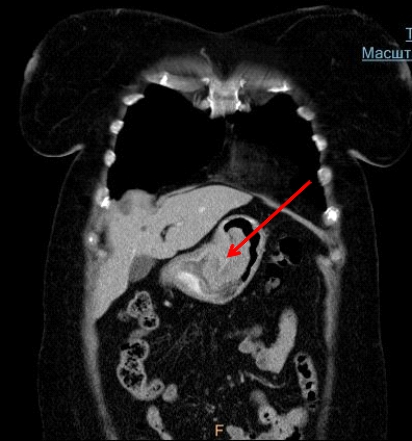
Оценка общего состояния здоровья больного.
- Общий анализ крови. Проводится с целью оценить количество гемоглобина, форменных элементов крови (лейкоцитов, эритроцитов, тромбоцитов). Для точности исследование следует выполнять натощак.
- Биохимия крови. Проводится для оценки количества АЛТ, АСТ, билирубина, амилазы, билирубина, глюкозы, альбумина и других показателей.
- Общий анализ мочи. Проводится для оценки работы выделительной системы человека.
- ФВД (функция внешнего дыхания). Проводится для оценки состояния легких. Суть исследования состоит в определении жизненного объема легких.
- Электрокардиография. Назначается для оценки функционального состояния сердца.
- ЭхоКГ (эхокардиография). Назначается для оценки анатомии и функционального состояния сердца.
Методы лечения
Возможны следующие методы лечения рака желудка:
- Основным методом лечения больных раком желудка является хирургический.
Операция может производиться классическим либо лапароскопическим способами. В ходе хирургического вмешательства может быть удалена часть желудка или весь желудок, части окружающих органов, лимфоузлы и т.д. Все зависит от размера новообразования и его распространенности на другие органы.
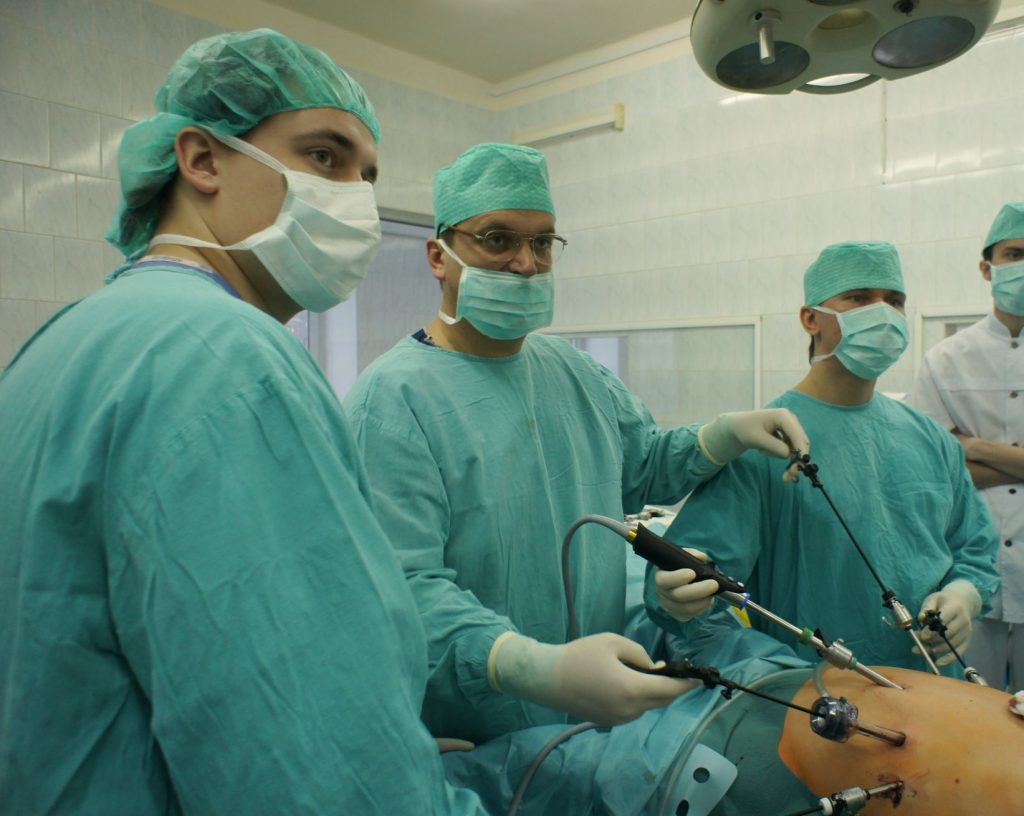
Также может применяться в качестве паллиативной меры химиотерапия.
Прогноз рака желудка
Выживаемость зависит от степени распространения опухолевого процесса и общего состояния больного. В целом, можно представить следующие цифры прогноза при раке желудка:
- При I стадии заболевания пятилетняя выживаемость максимальна и достигает 90%.Около трех четвертей пациентов добиваются полного излечения.
- При IV стадии прогноз крайне неблагоприятный: смертность достигает 95%.
Противопоказания при лечении рака желудка
Существует несколько противопоказаний для оперативного вмешательства:
- Тяжелое состояние больного при болезнях сердца, легких, почек, печени.
- Наличие генерализованного опухолевого процесса.
В первом случае при переходе основных заболеваний в фазу компенсации возможно поставить вопрос о возможности хирургического лечения.
Лечение после операции
- Химиотерапия. Это внутривенное введение специальных препаратов, убивающих раковые клетки. Применяется после операции или в качестве самостоятельного метода терапии.
- Лучевая терапия. Применяется при диффузно растущих опухолях как метод дополнительного лечения либо назначается в паллиативных целях.
- Эндоскопические манипуляции. Применяются для улучшения состояния больных, не способных питаться естественным путем и т.д.
Профилактика рака желудка
Профилактика предполагает изменение рациона. В нем должно быть больше растительной пищи. Не стоит злоупотреблять копчеными, жареными и жирными продуктами. Они обладают канцерогенными свойствами. Также нельзя переедать. На алиментарные причины приходится порядка 35% всех случаев возникновения рака.
Необходимо отказаться от злоупотребления алкоголем, курения. Также важно своевременно лечить воспалительные заболевания желудка, такие как гастрит. Хронический воспалительный процесс — это благодатная почва для развития рака желудка.
Рак желудка — тяжелая и крайне опасная патология. Для ее лечения необходимо приложить максимум усилий, но не всегда это бывает оправдано. Куда проще предотвратить страшную болезнь. Чтобы это сделать, достаточно придерживаться указанных рекомендаций, и каждый год проходить профилактические осмотры.
Вирусы умеют паразитировать на всех формах клеточной жизни, включая человека, животных, растения, грибы и даже бактерии. Согласно современным представлениям, вирусы — не просто возбудители заболеваний, а глобальная сеть передачи генетической информации. Они играют огромную роль в развитии экосистем — и ее еще только предстоит изучить полностью.
Все вирусы можно условно разделить на две группы:
Профессиональные убийцы
Более века назад врачи заметили, что у некоторых онкологических пациентов с инфекциями опухоли самостоятельно регрессируют. Например, в конце XIX века были описаны случаи регрессии лейкозов при гриппе. Стало понятно, что некоторые вирусы помогают организму бороться с онкологическими патологиями. Конечно же, вскоре у ученых появилась идея использовать этот эффект для лечения.
Генная инженерия позволяет существенно улучшить онколитические вирусы, усилить их полезные способности. Это можно сделать, вырезав у возбудителя определенные исходные гены или вставив новые.
Вирусный десант
В качестве одного из кандидатов на роль рассматривают мезенхимальные стволовые клетки, полученные от самого пациента. Они не только являются отличным транспортом, но и способны усиливать противоопухолевые свойства онколитических вирусов.
Помощники иммунотерапии
Ученые считают, что онколитические вирусы станут отличным дополнением к уже существующим методам лечения в онкологии: химиотерапии, лучевой терапии, хирургии и особенно иммунотерапии.
Современная иммунотерапия сделала огромный шаг вперед, когда появились препараты из группы ингибиторов контрольных точек. Эти лекарства блокируют определенные молекулы, которые подавляют иммунную систему, мешают ей бороться со злокачественными опухолями.
Однако, ингибиторы контрольных точек эффективны только у 20–30% пациентов. Почему на них не реагируют остальные больные — зачастую сложно сказать. Возможно, у некоторых людей изначально возник иммунный ответ на злокачественную опухоль, а потом он был заблокирован. В таком случае иммунотерапия помогает, она снимает блокировку. У остальных иммунная реакция изначально не развивалась — поэтому ингибиторы контрольных точек не работают. И именно в таких случаях способны помочь онколитические вирусы. Когда в опухолевой ткани развивается инфекционный процесс, повышаются шансы на то, что иммунная система среагирует одновременно и на опухоль, и на инфекцию.
Рак — это не инфекционное заболевание, и заразиться раком нельзя ни через еду, ни через секс, ни воздушно-капельным путём. По крайней мере, среди людей он так не распространяется. Даже если трансплантировать раковые клетки здоровому человеку, они не приживутся.

Единственное, что может в этом смысле передаваться от человека к человеку, это предрасположенность к развитию рака. Во-первых, детям от родителей могут достаться гены, которые повышают риск развития некоторых видов онкологических заболеваний. Во-вторых, есть вирусы и бактерии, которые тоже могут способствовать возникновению рака.
Врачи знают, что делать, когда к ним обращаются пациенты, имеющие наследственную предрасположенность к развитию онкологических заболеваний, — на этот случай есть хорошие руководства. А вот с вирусами и бактериями дела обстоят сложнее: некоторые из них достаточно подробно исследованы, но многие находятся только на стадии изучения. Сейчас известно, что только в редких случаях у людей, заражённых этими вирусами или бактериями, развивается рак. Обычно этому способствует какой-то дополнительный фактор вроде курения или серьёзно ослабленной иммунной системы, поэтому часто основное направление борьбы — это как раз устранение таких дополнительных рисков.
Рак и вирус папилломы человека (ВПЧ)
Может провоцировать: рак шейки матки, влагалища, вульвы, пениса, анального канала, рта, горла, головы, шеи.
Как передаётся: чаще всего половым путём (при вагинальном, анальном и оральном сексе). Существует 150–200 типов ВПЧ, но только около 10 способны привести к раку.
Как предотвращать и лечить: вопреки мнению многих гинекологов, нельзя избавиться от ВПЧ с помощью иммуностимуляторов, противовирусных препаратов и физиопроцедур. Ни один из этих способов не доказал свою эффективность и нигде в мире не используется. В большинстве случаев организм справляется с вирусом самостоятельно за год или два. Иногда этого не происходит — в таком случае выше вероятность развития рака (процесс занимает 10–20 лет).
Чтобы вовремя обнаружить патологические изменения на шейке матки, женщинам с 25 до 30 лет рекомендуется раз в 3 года делать Пап-тест. С 30 до 65 лет — раз в 5 лет делать Пап-тест или тест на ВПЧ. На случай обнаружения предраковых изменений, есть сразу несколько вариантов, как не допустить развития онкологического заболевания. Это, например, криокоагуляция, удаление тканей лазером или радионожом.
Презервативы и латексные салфетки (для орального секса) помогают предотвратить заражение ВПЧ и хламидиозом, который, по всей видимости, при наличии онкогенного типа вируса папилломы человека способствует развитию рака. Но презервативы и латексные салфетки эффективны не на 100 процентов. Сейчас существуют вакцины, которые позволяют защититься от двух распространённых онкогенных типов ВПЧ (они, в частности, отвечают за 70 процентов случаев рака шейки матки). Однако прививаться можно только женщинам и мужчинам до 26 лет и лучше до начала половой жизни. Минимальный возраст, с которого разрешается использовать вакцину, 9 лет.
Хеликобактер пилори и рак
Может провоцировать: рак желудка.
Как передаётся: фекально-оральным путём и через поцелуи.
Как предотвращать и лечить: защититься от заражения хеликобактер пилори очень сложно, поэтому она есть у двух из трёх взрослых. Так как эта бактерия вызывает рак лишь у малого количества людей, то проверяться на её наличие рекомендуется далеко не всем. В первую очередь это надо делать людям, у которых есть/была язва желудка или двенадцатиперстной кишки (хеликобактер пилори является причиной язвенной болезни). Если бактерия обнаружена, то применяются антибиотики. Тестирование всех поголовно и назначение антибиотиков людям, которые не имеют никаких симптомов, но имеют хеликобактер пилори, чревато большим вредом от тестов и лекарств. И этот вред перевешивает возможную пользу.
Вирус Эпштейна-Барр (ВЭБ)
Может провоцировать: рак носоглотки, лимфому желудка, лимфому Ходжкина, лимфому Беркитта. Его наличие связывается с повышенным риском развития этих видов рака у жителей Африки и Юго-Восточной Азии.
Как передаётся: воздушно-капельным путём, через посуду. У некоторых людей при заражении развивается инфекционный мононуклеоз (длительная лихорадка, больное горло, увеличение многих лимфатических узлов), а у кого-то никаких особых симптомов не возникает.
Как предотвращать и лечить: из-за способа передачи предотвратить заражение ВЭБ очень сложно, в США этот вирус есть у большинства подростков. Как и любой вирус из группы герпесов, ВЭБ остаётся с человеком навсегда, поэтому избавиться от него невозможно никакими средствами (в том числе противовирусными).

Вирус гепатита B и вирус гепатита C
Может провоцировать: рак печени.
Как передаётся: через незащищённый секс, заражённые иглы, стоматологические и маникюрные инструменты.
Как предотвращать и лечить: сейчас детей уже в роддоме прививают от гепатита B. Однако многие взрослые родились раньше, чем ввели такую практику, поэтому им стоит привиться хотя бы теперь. От гепатита C вакцины нет, поэтому тут актуальны только более простые способы профилактики: защищённый секс, использование одноразовых шприцов. Если человек заразился гепатитом B или C, то проводится лечение, которое помогает уменьшить повреждение печени и снизить риск развития рака печени.
Может провоцировать: саркому Капоши (поражаются кожа, лимфоузлы и др.).
Как передаётся: половым путём. Возможно также через кровь и слюну.
T-лимфотропный вирус человека 1-го типа
Может провоцировать: лимфолейкоз, неходжкинскую лимфому (а именно взрослый T-клеточный лейкоз-лимфому — в России встречается редко).
Как передаётся: при половом акте, через кровь. В России заражения регистрируются очень редко.
Как предотвращать и лечить: профилактика заражения заключается в том, чтобы использовать презервативы и латексные салфетки, чистые иглы. Если вирус всё-таки попал в организм, то избавиться от него с помощью лекарств уже невозможно.
Вирус иммунодефицита человека (ВИЧ)
Может провоцировать: саркому Капоши, инвазивный рак шейки матки, неходжкинскую лимфому и многие другие виды онкологических заболеваний.
Как передаётся: при половом акте, через кровь.
В данной обзорной статье приведены современные представления о роли Helicobacter pylori (H. pylori) в генезе рака желудка (РЖ). Одной из распространенных злокачественных опухолей у человека является РЖ. Ежегодно в мире регистрируется около одного миллиона случаев РЖ, при этом умирает более 2/3 больных. Связано это с поздней диагностикой, высокой долей запущенных и распространенных опухолей желудка, высокой агрессивностью, ранним и частым метастазированием, а также некоторыми биологическими особенностями опухоли. В последние годы доказана этиологическая роль такого инфекционного агента, как H. Pylori, в генезе различных раковых заболеваний, в том числе РЖ. Так, было выявлено, что около 800 тыс. случаев РЖ связаны с данной бактерией. Это произошло благодаря новым методам диагностики, таким как иммуноблоттинг. При этом показано, что H. pylori поражает в основном не кардиальный отдел желудка, вызывая злокачественное перерождение слизистой оболочки. Лечение геликобактерной инфекции желудка на основе этиотропной терапии является эффективной мерой профилактики рака желудка. При этом лечение H. pylori должно начаться как можно раньше, в ранней стадии заболевания.

1. IARC. Monographs on the evaluation of carcinogenic risks to humans volume 100b: a review of human carcinogens: biological agents. Lyon: International Agency for Research on Cancer. 2012. P. 235.
2. de Martel C., Ferlay J., Franceschi S., Vignat J., Bray F., Forman D. Global burden of cancers attributable to infections in 2008: a review and synthetic analysis. Lancet Oncol. 2012. vol. 13. P. 607–615.
3. Helicobacter and Cancer Collaborative Group. Gastric cancer and Helicobacter pylori: a combined analysis of 12 case control studies nested within prospective cohorts. Gut. 2001. vol. 49. P. 347–353.
4. Ferlay J., Shin H.R., Bray F., Forman D., Mathers C., Parkin D.M. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int. J. Cancer. 2010. vol. 127. P. 2893–2917.
5. Manuel Amieva, Richard M Peek Jr. Pathobiology of Helicobacter pylori-Induced Gastric Cancer. Gastroenterology. 2016. vol. 150 (1). P. 64–78.
6. Wang F., Meng W., Wang B., Qiao L. Helicobacter pylori-induced gastric inflammation and gastric cancer. Cancer Lett. 2014. vol. 10. no. 345 (2). P. 196–202.
7. Lee Y.C., Chiang T.H., Chou C.K., Tu Y.K., Liao W.C., Wu M.S., Graham D.Y. Association Between Helicobacter pylori Eradication and Gastric Cancer Incidence: A Systematic Review and Meta-analysis. Gastroenterology. 2016 vol. 150 (5). P. 1113–1124.
8. Jin Young Park, David Forman, Langgeng Agung Waskito, Yoshio Yamaoka and Jean E. Crabtree. Epidemiology of Helicobacter pylori and CagA-Positive Infections and Global Variations in Gastric Cancer. Toxins. 2018. vol. 10. no. 163. P. 8–20.
9. Mitchell H., English D.R., Elliott F., Barret J.H., Giles G.G., Forman D. Immunoblotting using multiple antigens is essential to demonstrate the true risk of Helicobacter pylori infection for gastric cancer. Aliment. Pharmacol. Ther. 2008. vol. 28. P. 903–910.
10. González C.A., Megraud F., Buissonniere A., Lujan Barroso L., Agudo A., Duell E.J. Helicobacter pylori infection assessed by ELISA and by immunoblot and noncardia gastric cancer risk in a prospective study: the Eurgast-EPIC project. Ann. Oncol. 2012. vol. 23. P. 1320–1324.
11. Simán J.H., Engstrand L., Berglund G., Florén C.H., Forsgren A. Evaluation of western blot CagA seropositivity in Helicobacter pylori seropositive and seronegative subjects. Clin. Diagn. Lab. Immunol. 2005. vol. 12. P. 304–309.
12. Plummer M., van Doorn L.J., Franceschi S., Kleter B., Canzian F., Vivas J., Lopez G., Colin D. Helicobacter pylori cytotoxin-associated genotype and gastric precancerous lesions. J. Natl. Cancer Inst. 2007. vol. 99. P. 1328–1334.
13. González C.A., Figueiredo C., Lic C.B., Ferreira R.M., Pardo M.L., Ruiz Liso J.M., Alonso P., Sala N., Capella G., Sanz-Anquela J.M. Helicobacter pylori cagA and vacA genotypes as predictors of progression of gastric preneoplastic lesions: a long-term follow-up in a high-risk area in Spain. Am J Gastroenterol. 2011. vol. 106. P. 867–874.
14. Tsukamoto T., Nakagawa M., Kiriyama Y., Toyoda T., Cao X. Prevention of Gastric Cancer: Eradication of Helicobacter Pylori and Beyond. Int. J. Mol. Sci. 2017. vol. 3. no. 18 (8). P. 1699.
15. Suzuki H., Mori H. Gastric Cancer after Helicobacter pylori Eradication. Gan To Kagaku Ryoho. 2018. vol. 45(8). P. 1123–1127.
16. Thorell K., Bengtsson-Palme J., Liu O.H., Palacios Gonzales R.V., Nookaew I., Rabeneck L., Paszat L., Graham D.Y., Nielsen J., Lundin S.B., Sjöling Å. In Vivo Analysis of the Viable Microbiota and Helicobacter pylori Transcriptome in Gastric Infection and Early Stages of Carcinogenesis. Infect Immun. 2017. vol. 20. no. 85 (10). P. 00031–17.
17. Sgambato D., Miranda A., Romano L., Romano M. Gut microbiota and gastric disease. Minerva Gastroenterol Dietol. 2017. vol. 63. no. 4. P. 345–354.
18. Wroblewski L.E., Peek R.M. Jr. Helicobacter pylori, Cancer, and the Gastric Microbiota. Adv. Exp. Med. Biol. 2016. vol. 908. P. 393–408.
19. Alarcón T., Llorca L., Perez-Perez G. Impact of the Microbiota and Gastric Disease Development by Helicobacter pylori. Curr Top Microbiol Immunol. 2017. vol. 400. P. 253–275.
20. Sheh A., Fox J.G. The role of the gastrointestinal microbiome in Helicobacter pylori pathogenesis. Gut Microbes. 2013. vol. 4. no. 6. P. 505–531.
21. Kusters J.G., van Vliet A.H., Kuipers E.J. Pathogenesis of Helicobacter pylori infection. Clin. Microbiol. Rev. 2006. Vol. 19 (3). P. 449–490.
22. Park C.H., Lee A.R., Lee Y.R., Eun C.S., Lee S.K., Han D.S. Evaluation of gastric microbiome and metagenomic function in patients with intestinal metaplasia using 16S rRNA gene sequencing. Helicobacter. 2019. vol. 24. no. 1. P.12547. DOI: 10.1111/hel.12547.
23. Liu K.S., Wong I.O., Leung W.K. Helicobacter pylori associated gastric intestinal metaplasia: Treatment and surveillance. World J. Gastroenterol. 2016. vol. 21. no. 22 (3). P. 1311–1320.
24. Chen H.N., Wang Z., Li X., Zhou Z.G. Helicobacter pylori eradication cannot reduce the risk of gastric cancer in patients with intestinal metaplasia and dysplasia: evidence from a meta-analysis. Gastric Cancer. 2016. vol. 19. P. 166–175.
25. Li W.Q., Ma J.L., Zhang L., Brown L.M., Li J.Y., Shen L., Pan K.F., Liu W.D., Hu Y., Han Z.X. Effects of Helicobacter pylori treatment on gastric cancer incidence and mortality in subgroups. J. Natl. Cancer. Inst. 2014. vol. 106. P. 180–185.
Согласно каскадной теории рака Корреа, некардиальный рак желудка обычно развивается через ряд изменений слизистой оболочки – от неатрофического до атрофического гастрита, кишечной метаплазии, затем дисплазии до аденокарциномы желудка. Поэтому атрофический гастрит и кишечная метаплазия обычно считаются предопухолевыми поражениями желудка. Инфекция Helicobacter pylori (H. pylori) является важным инициирующим и стимулирующим этапом этого каскада канцерогенеза желудка. Исследованиями, проведенными в последние годы, подтверждено, что хроническое инфицирование специфической бактерией H. pylori вызывает определенную разновидность рака желудка (РЖ) – некардиальный рак, а иногда неходжкинскую лимфому из мантийных клеток [1].
Эти оценки глобального бремени основаны на соответствующей доле H. pylori, которая представляет собой долю раковых заболеваний, не имевших места, если бы H. pylori отсутствовал в мировом населении [4]. Количественная оценка этой доли требует точной оценки как относительного риска, так и распространенности инфекции в отдельных случаях. Этим усилиям препятствовала низкая чувствительность серологических тестов в случаях НККЖ [5]. Атрофия желудка является предвестником развития РЖ, который снижает бактериальную нагрузку и, следовательно, приводит к снижению антительного ответа, снижая чувствительность серологических тестов. Наиболее надежными считаются проспективные исследования, в которых проба крови для исследования H. pylori была взята задолго до постановки диагноза рака желудка. Так, некоторые авторы использовали объединенный анализ 11 исследований, в которых забор крови происходил по крайней мере за 10 лет до развития РЖ [6]. При этом обобщенный анализ показал, что средний показатель распространенности H. pylori в случаях болезни, по сравнению с контролем, составил 90 %, а соответствующий относительный риск составил 5,9, что дает долю на H. pylori, равную 74,7 % для НККЖ. При этом эта оценка доли H. pylori в НККЖ может быть заниженной. В последние годы накопились данные о том, что такой метод диагностики, как иммуноблоттинг (western blot), более чувствителен к обнаружению антител против H. pylori, чем иммуноферментный анализ (ИФА) [7].
Цель обзора – изучить по данным литературы роль геликобактера пилори в развитии рака желудка, в частности некардиального типа опухоли, а также провести оценку атрибутивной доли H. pylori в глобальном бремени рака желудка.
Материалы и методы исследования
Результаты исследования и их обсуждение
Несколько опубликованных исследований по НККЖ напрямую сравнивали ИФА с иммуноблоттингом, и все они были с использованием коммерческого теста Helico Blot 2.1 (Genelabs Diagnostics, Сингапур). При этом исследователи подчеркивают роль CagA-позитивных штаммов H. pylori, поскольку тест Helico Blot 2.1 включает полоску 116kDa (CagA) для обнаружения антител против CagA. Также было показано, что все случаи, которые были положительными для H. pylori, тоже были CagА-положительными (65/65). В другом исследовании все случаи, за исключением одного, тоже были CagА-позитивными (81/82) [9]. Следующее исследование не сообщило о конкретных результатах для CagА теста. Как отмечают C.A. Gonzalez и др. (2012 г.), доля для H. pylori может быть недооценена недифференцированной и неправильной классификацией статуса H. Pylori. Тест Helico Blot 2.1 имеет чувствительность 95,6 % (95 % доверительный интервал (ДИ) = 91,5–99,6) и специфичность 92,6 % (95 % ДИ: 91,5–96,2) [10].
Другие проспективные исследования показали стабильно более высокую распространенность H. pylori среди случаев рака и стабильно более высокие относительные риски при использовании иммуноблоттинга по сравнению с ИФА, тогда как в исследовании случай-контроль не было обнаружено различий между результатами ИФА и иммуноблоттингом [11]. Поиск литературы также обнаружил поперечное исследование среди 54 китайских пациентов, проходивших эндоскопию верхних отделов ЖКТ с использованием более раннего теста Helico Blot 2.0 [12]. При объединении результатов трех проспективных исследований распространенность случаев рака составляет 82,6 % по ИФА и 94,6 % по иммуноблоттингу, а относительный риск равен 4,77 (95 % ДИ: 3,56–6,39) и 17,0 (95 % ДИ: 11,6–25,0) соответственно. По данным иммуноблоттинга доля H. pylori при НККЖ составляет 89,0 %. По сравнению с предыдущей оценкой доли в 74,7 % это означает, что приблизительно 120 000 дополнительных случаев НККЖ связаны с инфекцией H. pylori, в общей сложности около 780 000 случаев (6,2 % вместо 5,2 % всех раковых заболеваний). Таким образом, инфекция H. pylori была ответственна за 36,3 % из 2,2 млн случаев рака, вызванных инфекциями во всем мире в 2008 г. Эта доля выше у мужчин (46,7 %), чем у женщин (26,2 %), и выше в более развитых (50,3 %), чем в менее развитых регионах (32,7 %) [13].
На рисунке показано распределение раковых заболеваний, обусловленных инфекционным агентом, в пределах более развитых и менее развитых регионов мира. Как отмечалось, H. pylori является одним из четырех инфекционных агентов, которые доминируют в инфекционных причинах рака. Другие инфекционные причины – это вирус папилломы человека (вызывающий рак шейки матки, некоторые аногенитальные и орофарингеальные виды рака); вирус гепатита В (гепатоцеллюлярная карцинома) и вирус гепатита С (гепатоцеллюлярная карцинома и неходжкинская лимфома). С учетом пересмотренной доли Н. pylori, данный фактор остается наиболее важным инфекционным агентом, вызывающим рак, особенно в более развитых странах, где он несет половину бремени связанных с инфекцией раковых заболеваний. В мало развитых государствах, как видно из рисунка, эта доля в 1,5 раза ниже. Однако для гепатитов В и С, наоборот, распространенность их в неразвитых странах выше, чем в экономически развитых государствах [14].
В других проспективных исследованиях, проведенных в Европе, Японии и Австралии, было показано, что множественный антиген иммуноблоттинга существенно увеличивает обнаружение H. pylori по сравнению с ИФА в случаях, но не в контроле. Это дифференциальное увеличение приводит к более высоким коэффициентам шансов для НККЖ. В отличие от этого, аналогичные результаты для ИФА и иммуноблоттинга в исследовании методом случай-контроль показывают, что иммуноблоттинг не может обязательно преодолеть известную трудность обнаружения H. pylori методом ИФА у людей с прогрессирующими предраковыми поражениями [15].
Данные о более высокой доле для H. pylori при НККЖ поступают исключительно из групп низкого риска. Стандартизованный по возрасту уровень заболеваемости РЖ у мужчин составляет 4,9 на 100 000 человеко-лет в Швеции, 6,7 в Австралии и колеблется между 4,9 и 11,0 (медиана 7,5) в 10 европейских странах, участвующих в Европейском проспективном исследовании. Таким образом, люди с инфекцией H. pylori относятся к подгруппе высокого риска. Экстраполяция этой оценки и доли в 89,0 % на мировое население, включая страны с высоким риском развития РЖ, оправдана отсутствием других сильных факторов риска. Эти оценки включены в модель неправильной классификации для оценки доли с поправкой на ложноположительные и отрицательные результаты. Это дало 95 % ДИ от 89,8 % до 100,0 % для атрибутивной доли. Несмотря на то, что ДИ соответствует 100 %, этих статистических данных недостаточно для классификации H. pylori как необходимой причины НККЖ. Так, показано, что около 10 % карцином желудка содержат вирус Эпштейна – Барр (ВЭБ). Роль ВЭБ и его взаимодействие с H. pylori до конца не изучены: возможно, что ВЭБ является самостоятельной причиной, но меньших случаев НКРЖ [16].

Распространенность инфекций в странах мира
Распространенность CagA в случаях рака составила 96,0 %, а относительный риск CagA составил 11,3 (95 % ДИ: 5,64–22,7), в отличие от низкой распространенности и нулевого относительного риска для H. pylori в целом. Это подкрепляет выводы предыдущих исследований, которые дополнили обнаружение H. pylori методом иммуноблоттинга CagA. Эти предыдущие исследования были основаны на гипотезе, что антитела CagA более устойчивы, чем антитела к поверхностным антигенам H. pylori, и поэтому являются более чувствительным маркером к прошлому инфицированию CagА-положительным штаммом. Следует, однако, отметить, что эта гипотеза принимается не всеми авторами и дополнительные доказательства роли СagA-позитивных штаммов H. pylori получены в результате исследований предраковых поражений, которые позволяют выявлять и типировать их с помощью ПЦР на биоптатах желудка. Такие исследования показали сильную поперечную связь между cagA-позитивными штаммами и тяжестью предраковых поражений и повышенную прогрессию среди CagА-позитивных штаммов, которые также имеют более вирулентный генотип vacA s1/m2 [17].
Аденокарцинома желудка является одной из ведущих причин смертности от рака во всем мире, а инфекция Helicobacter pylori является самым сильным известным фактором риска развития этого заболевания. Хотя когда-то считалось, что желудок является стерильной средой, теперь известно, что в нем обитает много видов бактерий, что приводит к сложному взаимодействию между H. pylori и другими обитателями желудочной микробиоты. В дополнение к роли факторов вирулентности H. pylori, генетических полиморфизмов хозяина и диеты, в настоящее время становится ясно, что компоненты желудочно-кишечной микробиоты могут также влиять на патогенез, вызванный геликобактером пилори. Так, L.E. Wroblewski и др. (2016 г.) обсудили новые данные, касающиеся микробиоты желудка у людей и животных, а также изменения, происходящие в составе микробиоты желудка в присутствии инфекции H. pylori, которые могут увеличить риск развития РЖ [18].
В дополнение к этому T. Alarcon и др. (2017 г.) считают, что другие микроорганизмы, помимо H. pylori, могут колонизировать слизистую оболочку желудка и что разнообразная экосистема микробиоты желудка отличается от полости рта и пищевода, а также от тонкого и толстого кишечника. H. pylori, по-видимому, является наиболее важным членом желудочной микробиоты с наибольшим относительным изобилием, когда он присутствует, но когда он отсутствует, желудок имеет разнообразную микробиоту. Протеобактерии, Firmicutes, Actinobacteria, Bacteroidetes и Fusobacteria являются наиболее распространенными типами, как у H. pylori-позитивных, так и у H. pylori-негативных пациентов. Комменсальная флора желудка может играть определенную роль в канцерогенности, ассоциированной с H. pylori, и описаны различия в составе микробиоты желудка у больных РЖ, кишечной метаплазией и хроническим гастритом. Микробиота желудка постепенно изменялась от неатрофического гастрита к кишечной метаплазии и далее к раку желудка (тип кишечный) [19].
Несмотря на потенциальные преимущества эрадикации H. pylori в профилактике РЖ, остается еще более спорным вопрос о том, будет ли наличие предопухолевых поражений исключать преимущества эрадикации в профилактике рака. Тем не менее, основываясь на последних данных, лечение H. pylori все еще должно быть рекомендовано лицам с существующими предопухолевыми поражениями в надежде снизить риск развития РЖ. Недавно пересмотренные руководящие принципы из восточных стран (Китай, Япония и Корея) и Европы (доклад Маастрихтского консенсуса IV) поддерживают эрадикацию H. pylori для снижения риска развития РЖ [25].
Helicobacter pylori является первым официально признанным бактериальным канцерогеном и одним из наиболее известных патогенов человека, так как более половины населения мира колонизировано этой грамотрицательной бактерией. Если не лечить, колонизация обычно сохраняется на всю жизнь. Обсемененность желудка геликобактером пилори служит пусковым фактором в генезе различных желудочно-кишечных заболеваний, от хронического гастрита без клинических проявлений до язвы желудка. При отсутствии лечения это может привести к раку желудка или лимфоме. Исход заболевания является результатом сложного взаимодействия между хозяином и бактерией. Полиморфизм генов иммунной системы хозяина и секреция желудочной кислоты в значительной степени определяют способность бактерии колонизировать определенную желудочную нишу. Бактериальные факторы вирулентности, такие как цитотоксин-ассоциированный ген патогенности белка CagA и вакуолизирующий цитотоксин VacA, способствуют этой колонизации слизистой оболочки желудка и впоследствии, по-видимому, модулируют иммунную систему хозяина. Иммуноблоттинг предпочтительнее ИФА в диагностике не кардиального рака желудка. Эрадикация H. pylori является наилучшим подходом в предотвращении развития и последующего прогрессирования предопухолевых поражений желудка. Лечение H. pylori в идеале должно проводиться на ранней стадии до развития предопухолевых поражений желудка, чтобы иметь наилучший долгосрочный результат.
Читайте также:

