Вирусы с иммунотропным действием
Обновлено: 24.04.2024
Ведущая роль в структуре ОРВИ принадлежит гриппу, так как вирусы гриппа вызывают эпидемии и пандемии. В России число ежегодно болеющих гриппом достигает 30 млн человек, а ежегодный суммарный экономический ущерб от ОРВИ оценивается в 40 млрд руб., составля
Ведущая роль в структуре ОРВИ принадлежит гриппу, так как вирусы гриппа вызывают эпидемии и пандемии. В России число ежегодно болеющих гриппом достигает 30 млн человек, а ежегодный суммарный экономический ущерб от ОРВИ оценивается в 40 млрд руб., составляя около 80% ущерба от всех инфекционных болезней. Сегодня очевидной становится необходимость качественно новых подходов к профилактике и лечению гриппа и ОРВИ, ибо даже вакцинация против гриппа не может защитить от возбудителей ОРВИ. По частоте инфицирования грипп составляет около 15% (тип А — 12%, В — 3%), парагрипп до 50%, аденоинфекции до 5%, РС — 4%, микоплазма 2,7%, энтеровирусы 1,2%, смешанные инфекции около 23% случаев. К группе высокого риска относятся дети, у которых заболевания респираторного тракта составляют до 90% всей инфекционной патологии и 65% от всех регистрируемых заболеваний.
Исследования иммунопатогенеза гриппа и ОРВИ убедительно показали, что вирусы гриппа, как и другие респираторные вирусы, грубо вмешиваются в сбалансированную систему цитокинов, а механизм иммунной защиты при гриппе и ОРВИ в целом, по мнению Г. Ф. Железниковой, В. В. Ивановой (2007), до конца еще не раскрыт. Неоднозначны литературные данные о характере цитокинового ответа при гриппе и ОРВИ. Сведения об изменении цитокинового профиля носят фрагментарный характер и не позволяют оценить сходство или различие цитокинового ответа при инфицировании разными респираторными вирусами.
Широкая распространенность респираторных вирусов обуславливает решающее значение этих агентов в становлении механизмов противоинфекционного иммунитета. Около 70% всех респираторных инфекций вызываются респираторными вирусами, среди которых чаще всего встречаются миксовирусы (вирусы гриппа, парагриппа, РС-вирус) и аденовирусы. Нередко возбудителем ОРВИ является микоплазма пневмонии и вирус простого герпеса. Вместе с тем только вирус гриппа вызывает опустошительные пандемии с высокой заболеваемостью и смертностью.
Вирус гриппа попадает в организм человека через дыхательные пути вместе с каплями влаги и частицами пыли. Чем меньше величина капель и частиц, тем глубже проникает вирус в дыхательные пути. Репродукция вируса происходит в клетках эпителия слизистой оболочки дыхательных путей. Пораженные клетки отторгаются, продукты их распада попадают в кровь, вызывая интоксикацию организма. Вирус, активируя систему протеолиза, повреждает клетки эндотелия сосудов, что приводит к повышению их проницаемости и дополнительному повреждению тканей. Центральным звеном в антивирусной защите клеток при гриппозной инфекции является дс-РНК-зависимая протеинкиназа и индукция интерферона 1 го типа. Гибель клеток (вирусиндуцированный апоптоз) при гриппе наступает через 20–40 часов после начала репликации вируса.
Гибель клеток сопровождается активацией дс-РНК-зависимой протеинкиназы, а высокая ее активность и синтез интерферона 1 го типа потенцируют апоптоз, в котором непосредственное участие принимают и вирусные белки (NA и NS1). На этом уровне и решается судьба инфицированной клетки. Продуктом индукции интерферона 1 го типа является Мх-белок, который подавляет активность вирусной РНК-зависимой РНК-полимеразы. Таким образом, угнетается репликативная активность вируса, а следовательно, интерферон 1 го типа является важным фактором защиты от вирусной инфекции на первом уровне. Защита верхних и нижних отделов респираторного тракта осуществляется также разными субпопуляциями лимфоцитов, которые контролируются интерфероном 1 го типа. Главными эффекторами противовирусного клеточного ответа в нижних отделах респираторного тракта являются вирусспецифические цитотоксические лимфоциты (ЦТЛ) СD8+, правда, накопление этих клеток требует определенного времени. Генерация ЦТЛ CD8+ более успешна, если антигенпредставляющими клетками (АПК) служат дендритные клетки, способные к активации, под влиянием очень малого количества вирусного белка.
Снижение иммунологической резистентности и глубокое подавление функциональной активности различных компонентов иммунной системы приводят к возникновению вторичных бактериальных осложнений.
Таким образом, терапия гриппа и ОРВИ должна быть комплексной, адекватной этиологии и тяжести течения заболевания и направленной на все звенья патогенеза этого широко распространенного и нередко тяжелого заболевания. Особые требования должны предъявляться к этиотропным и патогенетическим средствам для лечения гриппа и ОРВИ.
Препараты, применяемые для терапии респираторных вирусных инфекций, должны способствовать элиминации возбудителя; стимулировать защитные силы организма; корректировать возникающие в процессе болезни функциональные нарушения.
Сегодня постоянно увеличивается арсенал лекарственных средств, используемых при гриппе и ОРВИ, отличающийся разнообразием и охватывающий все возможные способы влияния на инфекционный процесс. Он включает химиопрепараты этиотропного действия, средства для иммунокорригирующей, патогенетической и симптоматической терапии (табл. 1).
Сюда же относятся и антибиотики широкого спектра действия для профилактики и постгриппозных бактериальных осложнений [6].
Следует отметить значительный вклад академика АМН СССР А. А. Смородинцева, профессора Н. П. Чижова, а также многих других сотрудников НИИ гриппа СЗО РАМН в разработку противовирусных препаратов и стратегию их применения при ОРВИ и гриппе.
Противовирусные препараты — вещества, обладающие антивирусной активностью, представлены этиотропными средствами (химиопрепараты — истинные химические соединения различных классов), патогенетическими лекарственными средствами являются препараты неспецифического действия — интерфероны, их индукторы и, частично, иммунотропные препараты [4].
Существует несколько способов контроля вирусных инфекций. Неспецифический тип контроля, обеспечиваемый препаратами неспецифического действия (интерфероны, их индукторы и иммунотропные препараты), является наиболее эффективным, его антивирусный спектр очень широкий, но длительность эффекта короткая. Специфический тип контроля обеспечивается вакцинацией против основных заболеваний, согласно Национальному календарю прививок, его эффективность и длительность эффекта высокая, но спектр узкий. Химический тип контроля реализуется химиопрепаратами, активность узкая, длительность высокая [6, 17].
Химиопрепараты являются средством этиотропной терапии заболеваний дыхательных путей, поэтому основным показателем их клинической пригодности служит химиотерапевтический индекс (отношение специфической эффективности к токсичности). К основным недостаткам антивирусных химиопрепаратов относится узкий спектр действия и формирование резистентных вирусных штаммов, что сводит на нет эффективность терапии. Резистентность обусловлена мутациями в том вирусном белке, который является мишенью действия для препарата. Лекарственная устойчивость является результатом изменений наследственных свойств вирусов и развивается при многократном применении препаратов [5, 14].
Еще в 70 е годы прошлого столетия для лечения гриппа были предложены ингибиторы функции М2 белка — препараты первой группы, препараты адамантанового ряда: римантадин, амантадин, а несколько позже появилась новые лекарственные формы римантадина — Альгирем и Орвирем. Альгирем — это полимерный препарат с улучшенными фармакологическими свойствами. Все эти препараты блокируют места связывания вируса с поверхностью клеточной мембраны. Подавление репродукции вируса гриппа сопровождается индукцией интерферона как второго уровня защиты, усиливая химиотерапевтическое действие препарата. Нежелательные эффекты римантадина возникают при длительном назначении высоких доз или при их кумуляции в организме. Более того, в последние годы появились сведения об устойчивости штаммов вируса гриппа А к этим препаратам. Резистентность препарата обусловлена мутациями в положениях 26, 27, 30, 34 М2 белка.
Разработка ингибиторов нейраминидазы (осельтамивира и занамивира) явилась новым значительным достижением в области фармакотерапии гриппа. Известно, что нейраминидаза — это фермент, играющий определенную роль в начальных стадиях проникновения вируса в клетку и контролирующий процесс почкования и высвобождения вирусных частиц от мембран инфицированных клеток. Еще в 1999 г. появился первый ингаляционный ингибитор нейраминидазы — занамивир (Реленза). Препарат обладает низкой системной биодоступностью, выводится почками и не обладает лекарственным взаимодействием.
Проведенными доклиническими исследованиями установлено, что препарат Арбидол благодаря особенностям своего химического строения относится к препаратам с низкой токсичностью (ЛД > 3000 мг/кг массы тела животных). Показана хорошая переносимость препарата различными животными, отсутствие аллергогенного, мутагенного и тератогенного действия. Препарат прошел и большие клинические испытания с участием более чем 14 тысячи пациентов. Его использовали в период эпидемии гриппа А и В, в том числе и в период эпидемического сезона гриппа 2009–2010 гг. Как показали клинические исследования, Арбидол сокращает общую продолжительность заболевания, выраженность и длительность отдельных симптомов гриппа, а также способствует снижению риска развития постгриппозных осложнений, в том числе и у пожилых пациентов.
Максимальный клинический эффект при лечении гриппа и ОРВИ негриппозной этиологии может быть получен при сочетанном применении химиопрепаратов с препаратами неспецифического действия либо при использовании только препаратов патогенетической направленности: интерферонов их индукторов и иммуномодуляторов, обладающих противовирусной активностью.
Представляется закономерным включение индукторов интерферона 1 го и 2 го типа, к которым и относится Циклоферон, Амиксин, Кагоцел, Ларифан и др., в комплексное лечение гриппа и ОРВИ.
Индукторы интерферона обладают универсально широким диапазоном антивирусной активности (этиотропное действие) и выраженным иммуномодулирующим эффектом, не обладают антигенностью, синтез эндогенного интерферона сбалансирован, контролируется организмом, предотвращая побочные эффекты, характерные для экзогенно вводимых интерферонов. Однократное введение индуктора приводит к длительной циркуляции эндогенного интерферона (при введении циклоферона до 72 часов, а при введении Амиксина — до 48 часов, Кагоцела до пяти суток) [4, 6–17].
Наиболее перспективным и безопасным для применения в детской практике является отечественный препарат Циклоферон. Взаимодействие при высокой концентрации препарата с ДНК в клетках индуцирует транскрипцию генов, препарат транспортируется в ядро и ядрышки, где происходит их накопление, увеличивая время пребывания препарата в клетках, повышая интерферонпродуцирующую активность. Достоинством циклоферона является его полифункциональность — сочетание широкого спектра фармакологических эффектов.
Нормализация показателей клеточного иммунитета и концентрации иммуноглобулина А наблюдается при комбинированном применении Циклоферона и Биовестина-лакто. Увеличивается число детей, не болеющих ОРВИ в течение 3–6 месяцев после приема препаратов, обеспечивается снижение повторных ОРВИ и осложнений, снижается кратность (в 2,2 раза) и длительность острых эпизодов (на 2,7 дня), восстанавливается нормальная флора слизистых оболочек носа и зева. Как показали многочисленные исследования, Циклоферон обладает эпидемиологической эффективностью (индекс эффективности 2,9 при колебаниях от 2,4 до 3,4, при показателе защиты от 58,5% до 67,1%), отмечено снижение уровня заболеваемости в 2,9 раза. Кроме того, Циклоферон обладает цитопротективным действием на слизистую оболочку полости носа, снижает степень деструкции плоского и цилиндрического эпителия, повышает содержание лизоцима, увеличивает уровень S-IgA в слюне.
При включении Циклоферона в терапию микоплазменной инфекции сокращается лихорадочный период, интоксикация, уменьшается длительность катарального симптома, бронхиальной обструкции (в среднем на 3–1,6 дня). Улучшение клинической симптоматики происходит на фоне усиления макрофагальной активности, активации синтеза интерферона (в 1,5–1,9 раза), снижения уровня TNF, нарастания концентрации иммуноглобулина А, включая и секреторный его компонент, у 67–87% пациентов [8].
В период повышенного подъема заболеваемости гриппом A/H1N1 (sw)/09/04 осенью 2009 года проведена оценка эффективности Циклоферона. При своевременно начатом лечении, у взрослых больных уменьшался синдром интоксикации, исчезали катаральные явления к пятому дню болезни. Снижение температурной реакции отмечено на вторые сутки, а ее нормализация наступала к четвертым суткам приема препарата, без использования антибактериальных средств. Защита от гриппа и ОРВИ наблюдалась у 76,5% медицинских работников, контактирующих с больными гриппом и ОРВИ в осенний период 2009 года [19].
К поздним индукторам интерферона относится наш отечественный препарат Амиксин. Амиксин — это современный препарат, обладающий прямым противовирусным эффектом и одновременно способностью стимулировать выработку собственного интерферона в человеческом организме. Действующее вещество Амиксина — тилорон — усиливает образование в организме интерферонов не только клетками иммунной системы (лейкоцитами), но и клетками печени, а также кишечника. Иммуномодулирующий эффект Амиксина выражается в усилении образования антител (в зависимости от дозы препарата), восстановлении нормального баланса между Т-хелперами и Т-супрессорами, повышении активности клеток иммунной системы.
Амиксин способствует образованию позднего интерферона, пик его продукции приходится на 18 часов от момента введения препарата. Полностью исчезает из кровотока к 48 часам (рис.).
.jpg)
Препарат рекомендован для лечения гепатита А, В, энтеровирусных инфекций, для профилактики ОРЗ и гриппа, лечения хламидиоза, герпеса, энцефалитов, цитомегаловирусной инфекции.
Препарат при многократном введении в дозах, в несколько раз превышающих рекомендованные в настоящее время терапевтические дозы, может кумулироваться организмом и проявлять токсичность (химико-терапевтический индекс 2–4). При рациональном применении Амиксина в соответствии с инструкцией по медицинскому применению, введение препарата не влияет на параметры крови и хорошо переносится больными.
Из иммунотропных препаратов, обладающих интерферониндуцирующей активностью, следует остановиться на Имунофане, Бронхо-мунале, Рибомуниле, ИРС-19. Мишенью для препаратов являются фагоцитарные клетки. Препараты повышают функциональную активность фагоцитов, синтез провоспалительных цитокинов, усиливают активность естественных (натуральных) киллеров. Препараты рекомендуются для коррекции иммунного дисбаланса, профилактики и лечения инфекционно-воспалительных заболеваний ЛОР-органов у детей [16–17].
Рибомунил, Имунофан, ИРС-19, Имудон также являются средством патогенетической терапии. Препараты представляют собой микробные лиофилизированные лизаты, эффект которых направлен на повышение антиинфекционной и противовоспалительной активности организма. Иммуностимулирующее действие препаратов выражается в стимуляции иммунотропных клеток, повышая активность клеток фагоцитов ретикулярной системы эндотелия. Иммуностимулирующие препараты оказывают влияние на фагоцитирующие клетки (нейтрофилы, моноциты), влияя на окислительный метаболизм полиморфно-ядерных нейтрофилов, а также лимфоциты.
Кроме этого, отмечается увеличение содержания в слюне лизоцима, обладающего бактерицидной активностью. При воспалении слизистой оболочки дыхательных путей (ларингит, трахеит, бронхит) важное значение имеет прием противокашлевых препаратов центрального действия (при сухом непродуктивном кашле, а также при продуктивном кашле, когда он ухудшает качество жизни пациента). В этих случаях возникает проблема выбора препарата, способного снять раздражение дыхательных путей и одновременно облегчить отхождение мокроты. Существует ряд противокашлевых, муколитических и отхаркивающих препаратов отечественного и зарубежного производства. К таким препаратам относятся: Коделак Бронхо, Стоптуссин, Линкас, Гербион.
Коделак Бронхо — это комбинированный препарат, оказывающий муколитическое, противовоспалительное и отхаркивающее действие. Препарат назначается детям с 12 летнего возраста и взрослым. Применение его не рекомендуется у беременных, кормящих матерей и у лиц с заболеваниями печени.
Стоптуссин повышает секрецию бронхиальных желез и снижает вязкость слизи. Повышение секреции вызывается как прямым действием препарата на бронхиальные железы, так и рефлекторным путем, за счет стимуляции афферентных парасимпатических волокон, оказывающих влияние на дыхательный центр.
Сироп Линкас — комплексный фитопрепарат, действие которого обусловлено свойствами входящих в его состав компонентов: адхатоды сосудистой, солодки гладкой, перца длинного, фиалки душистой, иссопа лекарственного, алтея лекарственного, зифуса настоящего, альпинии галанга. Сироп Линкас уменьшает кашель и облегчает боль в горле, обладает отхаркивающим и муколитическим действием.
Для лечения кашля с первых дней жизни можно использовать бальзамы и сиропы Эвкабал, его натуральные фитокомпоненты безвредны, поэтому применяются для лечения больных любого возраста. Бальзам можно использовать даже для лечения детей, начиная с трех месяцев, а сироп — с 6 месячного возраста.
К сосудосуживающим назальным препаратам относится препарат, содержащий адреномиметик альфа-ксилометазолин (Ксимелин спрей в дозировке 0,5% — для детей от двух до шести лет; спрей 0,1% — для детей старше 9 лет). Появился новый Ксимелин Эко — в виде дозированного спрея, в двух дозировках: 0,05% и 1%, с двух до 10 лет, и 0,1% — старше 10 лет и взрослым. Препарат не содержит консервантов, поэтому его можно использовать для лиц с атопическим состоянием.
Таким образом, список лекарственных препаратов, разрешенных для применения, постоянно расширяется, эти препараты занимают достойное место, обеспечивая улучшение качества оказания медицинской помощи больным с ОРВИ и гриппом.
Литература
О. И. Киселев*, доктор медицинских наук, профессор, академик РАМН
Т. В. Сологуб**, доктор медицинских наук, профессор
М. Г. Романцов**, доктор медицинских наук, профессор
*ГУ НИИ гриппа МЗ РФ, **СПбГМА им. И. И. Мечникова, Санкт-Петербург
При высоких нагрузках или врожденных дефектах в иммунной системе могут возникать различные нарушения, которые подразделяют на три основные группы:
1) количественная или функциональная недостаточность того или иного звена иммунной системы, что ведет к развитию иммунодефицитных состояний. Особняком от них стоит СПИД, который является инфекционным заболеванием и вызывается ВИЧ (вирус иммунодефицита человека);
2) нарушения в распознавании антигена и, как следствие, развитие аутоиммунных заболеваний;
3) неадекватный, очень сильный иммунный ответ, проявляющийся аллергическими реакциями и заболеваниями.
Чаще всего среди нарушений иммунной системы встречаются иммунодефицитные состояния и аллергические заболевания. Препараты, влияющие на аллергические реакции, будут рассмотрены далее. Остановимся на средствах лечения и профилактики иммунодефицитных состояний. Их называют иммуностимуляторами и вместе с иммунодепрессантами включают в группу иммуномодуляторов (в научной литературе можно найти также термин "иммунотропные лекарственные средства"). Иммунодепрессанты (или иммуносупрессанты) применяются тогда, когда необходимо преодолеть нежелательные реакции иммунной системы. Это имеет важное значение, например, при пересадке тканей и органов, при некоторых аутоиммунных заболеваниях (системная красная волчанка, ревматоидный артрит и другие). Иммуностимуляторы активируют фагоцитоз, выработку антител и другие функции клеток иммунной системы.
Длительные тяжелые заболевания, воздействие неблагоприятных факторов окружающей среды, постоянные умственные и физические перегрузки, врожденные дефекты иммунитета - вот основные причины, приводящие к развитию иммунодефицитных состояний. При продолжительном или очень сильном воздействии чужеродных агентов и веществ (антигенов), или при попадании их в ослабленный организм, иммунная система оказывается не способной в достаточной степени противостоять им и компенсировать вызванные ими воздействия. Возникает иммунодефицит, и последующее действие этих или других антигенов приводит к развитию заболеваний. Как врожденные, так и приобретенные иммунодефициты характеризуются легкостью заражения инфекциями и тяжелым их течением. И это естественно, так как именно иммунной системе отводится основная роль в борьбе с микроорганизмами. Угнетению иммунитета может способствовать и применение лекарственных средств, в частности предназначенных именно для борьбы с инфекциями. Например, достоверно известно, что антибактериальные средства рифампицин, изониазид, тетрациклины и аминогликозидные антибиотики угнетают иммунитет.
Иммуностимуляторы
Свойствами иммуностимуляторов могут обладать соединения различной природы и химического строения.
Во-первых, это вещества микробного происхождения главным образом бактериального и грибкового, а также их синтетические и полусинтетические аналоги. Примеров таких препаратов достаточно: Бронхо-мунал, ИРС-19, Ликопид, Постеризан, Рибомунил, Эксальб и другие.
Вторую подгруппу иммуностимуляторов образуют препараты животного происхождения. Как вы уже знаете, вилочковая железа (тимус), костный мозг, селезенка относятся к органам иммунной системы и содержат биологически активные вещества, оказывающие на нее регулирующее действие. Поэтому экстракты, полученные из этих органов, содержат те же вещества и оказывают иммуномодулирующее действие. К ним относятся препараты Тимактид, Тимоптин, Тактивин. Активирует процессы иммунитета также препарат Деринат, действующее вещество которого представляет собой вытяжку из молоки осетровых рыб.
Третьей и в настоящее время стремительно развивающейся подгруппой иммуностимуляторов являются цитокины и препараты, стимулирующие их синтез в организме. Цитокины вырабатываются клетками иммунной системы и с их помощью эти клетки обмениваются информацией и координируют свою работу. Наиболее известные цитокины - интерфероны, интерлейкины, колониестимулирующие факторы. Они являются естественными регуляторами иммунитета, в том числе противоопухолевого. Большие успехи в их получении достигнуты с внедрением генно-инженерных технологий, которые позволяют нарабатывать большие количества этих эндогенных веществ.
Препараты, стимулирующие биосинтез интерферонов (индукторы интерферона), - сравнительно новое и перспективное направление в иммунотерапии. В настоящее время уже известен ряд таких препаратов: Амиксин, Полудан, Циклоферон, и число их постоянно растет.
Получено несколько синтетических соединений, оказывающих выраженное влияние на иммунную систему. Например, Имунофан, Полиоксидоний. У некоторых, давно применяемых в практической медицине лекарств, таких как Декарис, Дибазол, дополнительно выявлены иммуностимулирующие свойства и для них добавлены новые показания к назначению: иммунодефицитные состояния. Интересно, что Декарис, наряду с иммуностимулирующим эффектом, обладает антигельминтным и успешно применяется как противоглистное средство.
Усиливают иммунные реакции многие растительные (эхинацея, женьшень, элеутерококк и другие) и биогенные (мумие, прополис и другие) препараты. Эти средства, а также витамины и микроэлементы (в особенности цинк, магний, селен) часто объединяют в группу так называемых адаптогенов, то есть средств, помогающих организму приспосабливаться, стимулирующих его защиту от воздействий окружающей среды, стресса, повышенных умственных и физических нагрузок. Эти вещества и комплексы защищают важнейшие органы человека (в том числе надпочечники, вилочковую железу) и способствуют восстановлению и нормализации деятельности иммунной системы. В последнее время все больше появляется биологически активных пищевых добавок, содержащих адаптогены, которые расширяют возможности комплексной терапии иммунодефицитных состояний.
Иммунодепрессанты
Иммунодепрессанты - средства, угнетающие иммунные реакции. Это необходимо, во-первых, при пересадке органов и тканей. В настоящее время врачи могут пересадить человеку практически любой орган (трансплантат), включая сердце. Но заставить организм принять пересаженный орган или ткань удается далеко не всегда. Всему виной иммунные реакции, приводящие к разрушению трансплантата или, как говорят специалисты, к отторжению его. Другой случай - аутоиммунные заболевания, когда из-за врожденных дефектов иммунная система начинает реагировать на "свое" как на "чужое". Начинается саморазрушение организма. В этих случаях также приходится прибегать к помощи иммунодепрессантов. И, наконец, аллергические реакции, вызванные неадекватным, сверхсильным иммунным ответом на антиген (в данном случае аллерген). Применение иммунодепрессантов в этих случаях позволяет ослабить аллергические реакции, смягчить их проявления - зуд, отеки, воспаление.
Таким образом, иммунодепрессанты используются для подавления реакций отторжения трансплантатов и для лечения аутоиммунных и аллергических заболеваний.
Как вы уже знаете, одним из основных механизмов иммунной защиты является выработка антител клетками иммунной системы (в основном, лимфоцитами). Поэтому можно предположить, что все вещества, оказывающие отрицательное влияние на развитие и функции таких клеток, будут обладать активностью иммунодепрессантов.
К ним относятся противоопухолевые средства, и в первую очередь те, действие которых основано на подавлении деления клеток (так называемые цитостатики). К сожалению, цитостатики действуют как на здоровые, так и на опухолевые клетки, не разбирая, кто друг, а кто враг (справедливости ради, следует добавить, что рост опухоли тормозится более действенно). Они действительно подавляют иммунный ответ в целом, влияя как на кроветворение, так и на созревшие клетки. Но этот эффект скорее побочный, так как используют их, главным образом, все-таки в качестве противоопухолевых средств.
Свойствами иммунодепрессантов обладают глюкокортикоиды (смотри главу 2.3 "Гормональные средства . "), которые также применяют при пересадке органов и тканей, для лечения аутоиммунных и аллергических заболеваний. Кроме того, они обладают противовоспалительной активностью и их часто назначают при воспалительных процессах.
Помимо цитостатиков и глюкокортикоидов, имеется ряд более специфических иммунодепрессантов - азатиоприн, гидроксихлорохин, даклизумаб, циклоспорин и другие, однако ни один из них не обладает достаточной избирательностью действия, поэтому при их применении возможно снижение общих защитных функций организма, угнетение кроветворения, активация вторичных инфекций и другие нежелательные эффекты.
Резюме: актуальность проблемы респираторных вирусных заболеваний обусловлена их чрезвычайно широким распространением, зачастую тяжелым течением, возможностью развития жизнеугрожающих осложнений и высоким экономическим ущербом, наносимым обществу в целом. В статье в сравнительном аспекте рассматриваются различные лекарственные средства, используемые в комплексной терапии острых респираторных вирусных инфекций у детей.
Ключевые слова: респираторные инфекции, индукторы интерферона, иммуномодуляция, дети, Циклоферон®
Abstract: the urgency of the problem of respiratory viral diseases is due to their extremely high spread, often severe, the possibility of developing life-threatening complications and the high economic damage caused to society as a whole. The article in a comparative aspect discusses the various drugs, used for the prevention and treatment of acute respiratory viral infections in children.
Keywords: respiratory infections, interferon inductors, immunomodulation, children, Cycloferon®
Этиологическими факторами данной группы заболеваний являются около 300 эпителиотропных вирусов, из которых наиболее часто встречающимися у детей являются риновирусы, парагрипп, аденовирусы, грипп. В последние годы нарастает удельный вес таких возбудителей, как корона-, бока- и метапневмовирусы. Также ежегодно увеличивается доля различных микст-инфекций, вызывающих более тяжелое по течению респираторное заболевание, что существенно усложняет диагностику и лечение таких пациентов.
Клинические симптомы респираторных вирусных инфекций у детей во многом похожи и проявляются различной по степени тяжести и длительности лихорадкой, интоксикацией, катаральным синдромом и поражением дыхательных путей (табл. 1).
Таблица 1. Тропизм различных вирусов, вызывающих ОРВИ
| Вирус | Наиболее часто поражаемый орган |
| Гриппа | Трахея, носоглотка, сосуды |
| Парагриппа | Гортань |
| Аденовирус | Глотка, конъюнктива, кишечник |
| Риновирус | Полость носа |
| Реовирус | Носоглотка, кишечник |
| Коронавирус | Носоглотка, бронхи, кишечник |
| РС-вирус | Бронхиолы, альвеолы |
| Бокавирус | Носоглотка, кишечник |
| Метапневмовирус | Носоглотка, трахея, бронхи |
При гриппе на первый план выходит выраженный интоксикационный синдром и лихорадка, аденовирусная инфекция характеризуется болью в горле, конъюнктивитом, продуктивным кашлем, нередко - развитием обструктивного синдрома и болями в животе; при парагриппе часты ларингиты с развитием стеноза гортани, а при респираторно-синцитиальной инфекции -бронхит и/или бронхиолит с выраженным и длительным обструктивным синдромом. Однако различия симптоматики в зависимости от этиологии вирусного заболевания не всегда четко различимы, следовательно, практикующему врачу важно иметь в своем арсенале средства, одинаково эффективные для профилактики и лечения как гриппа, так и других ОРВИ.
Выбор метода лечения ОРВИ у детей зависит от возраста ребенка, клинической картины заболевания, выраженности симптомов, степени тяжести и наличия осложнений. Лечение обязательно должно включать режим, диету, медикаментозную и немедикаментозную терапию. Лекарственная терапия респираторных заболеваний у детей ориентирована на использование всего арсенала современных препаратов, отвечающих определенным критериям [3, 4]:
- высокая эффективность относительно большинства возбудителей;
- минимальный спектр побочных эффектов;
- отсутствие токсичности;
- сочетание противовирусного и иммуномодулирующего эффекта;
- наличие различных лекарственных форм;
- этиотропные, действующие на возбудителя заболевания;
- патогенетические (иммуномодулирующие), исправляющие нарушения системы иммунитета, возникающие и развивающиеся в процессе болезни;
- симптоматические, предназначенные для купирования отдельных симптомов заболевания.
Таблица 2. Механизм действия различных противовирусных препаратов, применяемых при ОРВИ
| Действие | Механизм действия | Препарат |
| Ингибиторы нейраминидазы | Конкурентно и избирательно ингибирует нейроминидазу, что нарушает проникновение вируса в здоровые клетки, тормозит выход вирионов из инфицированной клетки | Осельтамивир, занамивир |
| Блокатор М-йонного канала (адамантаны) | Блокирует специфические ионные М-2 каналы, что приводит к нарушению процесса дезинтеграции вириона и высвобождению рибонуклеопротеида | Ремантадин, орвирем |
| Блокатор слияния, индуктор ИФН | Ингибирует слияние липидной вирусной оболочки с клеточной мембраной | Арбидол |
| Ингибитор РНК и ДНК вирусов | Конкурентное подавление образования гуанозин трифосфата, приводящее к нарушению синтеза вирусных РНК и ДНК | Рибавирин |
Так, ингибиторы нейраминидазы обладают избирательной активностью только против вирусов гриппа типа А и В, эффективны при назначении не позднее 48 ч от начала клинических симптомов заболевания, оказывают раздражающее действие на слизистую оболочку респираторного и пищеварительного тракта, вызывают тяжелые аллергические реакции вплоть до развития токсического эпидермального некролиза, а также имеют высокую стоимость. Препараты из группы адамантинов также обладают избирательной активностью против вируса гриппа А, вызывают побочные эффекты со стороны желудочно-кишечного тракта в виде тошноты и рвоты, нервной системы, проявляющиеся галлюцинациями и психозом, аллергическими реакциями. Кроме того, все противовирусные препараты эффективны только при раннем их применении, не позже 24-48 ч и приводят к возникновению штаммов вирусов с низкой чувствительностью или резистентностью к терапии. Лекарственная устойчивость является результатом мутаций вирусов и развивается, как правило, при многократном использовании препарата [5, 6].
Основными патогенетически действующими группами препаратов являются интерфероны и их индукторы. Интерфероны - это группа биологически активных белков или гликопротеидов, синтезируемых клеткой в процессе защитной реакции на чужеродные агенты (экзогенные и/или эндогенные). Образование и действие интерферона составляет важнейший механизм врожденного (естественного) иммунитета. Доказано, что течение и исход вирусных инфекций во многом зависит от способности системы интерферона быстро реагировать на внедрение возбудителя [7]. Всего в настоящее время описано более 100 различных эффектов интерферонов, основными из которых являются:
- подавление роста внутри- и внеклеточных инфекционных агентов вирусной и невирусной (хламидии, простейшие, бактерии) природы;
- антипролиферативная активность;
- антитуморогенный эффект;
- антимутагенный эффект;
- антитоксическое действие;
- радиопротективный эффект;
- иммуномодулирующий эффект(подавление или усиление продукции антител, стимуляция макрофагов, усиление фагоцитоза и др.).
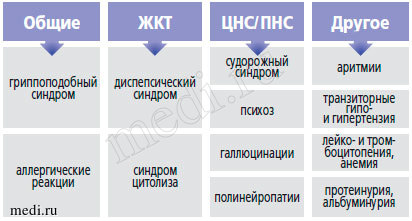
Рис. 1. Побочные эффекты препаратов интерферонового ряда
Таблица 3. Классификация индукторов интерферона (Ершов Ф.И., Романцов М.Г., Петров А.Ю., 2008)
| Химическая природа | Препарат |
| А. Синтетические соединения с основной интерферон-индуктивной активностью | |
| Низкомолекулярные: Флуореноны Акриданоны Олигопептиды Производное имидазо (4,5-С) квинолина | Амиксин Циклоферон® аллокин-альфа имиквимод |
| Полимеры (дс-РНК) | Полудан, полигуацил |
| Б. Природные соединения с основной интерферон-индуктивной активностью | |
| Полифенолы | Кагоцел, мегосин, саврац рагосин, гозалидон |
| Полимеры (дс-РНК) | Ридостин, ларифан |
| Производные флавонидов и аминокислот | протефлазид |
| В. Иммунотропные препараты с вторичной интерферон-индуктивной активностью | |
| Т-миметики | Тимоген, тактивин, изопринозин, гроприносин, иммунофан |
| Иммуномодуляторы бактериального происхождения - эубиотики | Лактобактерин, биоспорин |
| Вакциноподобные препараты | Бронхомунал, рибомунил, ИРС-19, уроваксом |
| Липополисахариды | Пирогенал, продигиозан |
| Производные нуклеиновых кислот | Натрия нуклеинат |
| Препараты пурина и пиримидина | Метилурацил, пентоксил |
| Производные бензимидазола | Дибазол |
| Производные индола | Арбидол |
| Растительные иммунокорректоры | Родиола розовая, экстракт эхинацеи |
| Г. Препараты других фармакологических групп с вторичной интерферон-индуктивной активностью | |
| Метилксантины | Теофиллин, эуфиллин, дипиридамол, кофеин |
| Производные изохинолина | Папаверин, дротавирин |
| Производные бензофурана | Кордарон |
| Производные хромена | Интеркордин |
Среди индукторов интерферона в профилактике и лечении ОРВИ у детей широко применяется препарат Циклоферон®, являющийся синтетическим производным акридонуксусной кислоты. Препарат повышает уровень интерферона α/β-типа в органах и тканях, содержащих лимфоидные элементы: в слизистой тонкого кишечника, селезенке, печени, легких, активирует стволовые клетки костного мозга, стимулируя образование гранулоцитов, преодолевает гематоэнцефалический барьер. Циклоферон® обладает чрезвычайно широким спектром биологической активности: прямым противовирусным, иммуномодулирующим и противовоспалительным действиями. Прямая противовирусная активность Циклоферона® доказана относительно различных респираторных вирусов и гриппа А и В, вируса простого герпеса 1-го и 2-го типов, цитомегаловируса, гепатитов В и С, клещевого энцефалита, вируса папилломы человека. Препарат нарушает репликацию вирусов, блокирует инкорпорацию вирусных ДНК и РНК в капсиды, что приводит к увеличению количества дефектных вирусных частиц и снижает вирус-индуцированный синтез белка в клетках. Иммунотропное действие препарата реализуется путем активации фагоцитов, Т-лимфоцитов и NK-клеток, нормализации баланса между CD4+- и СБ8+-клетками, снижении уровня В-лимфоцитов в периферической крови, с одновременным повышением синтеза высокоаффинных антител и индукции синтеза мРНК для ИФН-γ[12; 13]. Противовоспалительное действие Циклоферона® обусловлено ингибированием основных провоспалительных цитокинов (IL-1-p, IL-8, IL-10 и TNF-ot).
Циклоферон® относится к ранним индукторам интерферона, так как пик его выработки приходится на период от 4 до 8 ч с момента приема, что позволяет рекомендовать препарат для купирования вирусного заболевания на ранней стадии или в качестве экстренной профилактики. Кроме того, Циклоферон® хорошо сочетается с симптоматическими препаратами, вакцинами, химиопрепаратами, препаратами интерферона, усиливая действие последних и уменьшая побочные эффекты от их применения, что позволяет получить оптимальный фармакотерапевтический эффект. Исследование эффективности применения Циклоферона® в комплексном лечении ОРВИ у детей, проведенное Е.И. Кондратьевой, выявило более быстрое купирование симптомов интоксикации и выраженности катаральных явлений, обусловленное противовоспалительным и цитопротективным действием на слизистую оболочку дыхательных путей, а также увеличением уровня секреторного IgA. М.В. Гаращенко в своем исследовании отмечает почти 10-кратное уменьшение числа заболевших ОРВИ в период эпидемического подъема заболеваемости на фоне применения Циклоферона® (6 и 58% соответственно), а также более легкое течение и отсутствие осложнений [14; 15].
Помимо высокой эффективности, препарат отличается высоким профилем безопасности, который подтверждается отсутствием токсичности, аллергенности, мутагенности, хорошей растворимостью в биологических средах и проникновением в ткани, быстрым выведением из организма и отсутствием кумуляции [16].
Таким образом, широкий спектр биологической активности при низкой токсичности, наличие иммуномодулирующего действия позволяют рекомендовать Циклоферон® как препарат первой линии в лечении острых респираторных инфекций у детей. Для наибольшей эффективности рекомендуется начинать применять Циклоферон® как можно раньше, дополняя его препаратами направленного этиотропного действия и иммуномодуляторами, что обеспечит достижение оптимального фармакотерапевтического эффекта.
В статье описана группа препаратов, рекомендованных МЗ РФ к применению на территории РФ, охарактеризованная как иммуномодуляторы с противовирусной активностью. Представлены их биологические эффекты, дана характеристика препаратов и описана их клиническачя значимость. Акцентируется внимание на преимуществах этой группы препаратов и указаны их недостатки. Подробно описаны результаты фармакотерапевтической эффективности клинически перспективного, ориентированного в педиатрическую практику, метилглюкамина акридонацетата ( циклоферона). Показана его эффектив-ность, изученная в плацебо-контролируемых и сравнительно-контролируемых исследованиях при социально-значимых заболеваниях у детей (ВИЧ-инфекция, вирусные гепатиты, респираторные инфекции, кишечные инфекции). Обсуждаются полученные результаты фармакотерапевтической эффективности препарата на этапе пострегист-рационных исследований.

К иммуномодулирующим средствам И.С.Фрейдлин (1989) относит препараты химической и биологической природы, способные модулировать (угнетать или стимулировать) реакции иммунитета. Они (препараты) воздействуют на иммунокомпетентные клетки, на процессы созревания, миграции, кооперации, а также на взаимодействие этих клеток и их продуктов ( цитокинов) с соответствующими мишенями [21]. Следовательно, лечение той или иной патологии иммунотропными средствами есть иммунотерапия; кроме того, к иммунотерапии необходимо относить методы лечения заболеваний, направленные на нормализацию нарушений в иммунной системе и основанные на использовании иммунотропных средств при заболеваниях, в патогенезе которых имеются нарушения, затрагивающие систему иммунитета[ 22]
По мнению Хаитова Р.М.(2003), основным критерием для назначения иммуномодуляторов является клиническая картина заболевания, проявляющаяся хроническим инфекционно-воспали-тельным процессом, трудно поддающимся адекватному антиинфекционному лечению [23 ].
К лекарственным препаратам с выраженными иммуномодулирующими средствами следует отнести интерфероны и их индукторы поскольку главное фармакологическое свойство этих препаратов - противовирусное, но интерферон как составляющая часть цитокиновой сети организма является иммунорегуляторной молекулой, оказывающей действие на все клетки иммунной системы [ 10, 23].
Таблица 1. Классификация индукторов интерферона [цит.по 10]
Синтетические соединения
Природные соединения
Индукторы интерферонов разных групп
Изучение эффективности индукторов при различных экспериментальных вирусных инфекциях выявило спектр активности этих препаратов и позволило наметить основные пути их дальнейшего клинического применения [ 8,9,14].
Таблица 2. Клиническое значение индукторов интерферона, разрешенных к применению МЗРФ (цит.по 8,14)
Амиксин
Кагоцел
Неовир
Полудан
Герпетический кератит и кератоконъюктивит икератоконьюнктивит
Ридостин
Известно, что одним из свойств индукторов интерферона является формирование в организме стойкой неспецифической резистентности длительный период времени после их введения, который может продолжаться иногда неделями. Сформировавшаяся резистентность не может быть объяснена только действием эндогенного интерферона, синтезированного в ответ на введение индуктора, так как этот интерферон выводится из организма гораздо раньше. Резистентность, по-видимому, является следствием непосредственного влияния индукторов интерферона на клеточный и гуморальный иммунитет, что требует углубленного и детального изучения [9].
Применяемые в клинике индукторы интерферона, индуцируют синтез смеси альфа, бета, гамма- интерферонов в разных пропорциях. Они хорошо сочетаются с другими индукторами, интерферонами разных типов, иммуномодуляторами и химиотерапевтическими средствами. Важно особо подчеркнуть, что комбинированное их введение с другими препаратами часто приводит к синергидному эффекту.
Хотя активность индукторов практически аналогична активности интерферонов, но они ( индукторы) имеют свои "точки приложения" в иммунной системе.
Например, амиксин вызывает медленную продукцию интерферона Т-лимфоцитами, а циклоферон вызывает быструю продукцию интерферона В-лимфоцитами.
Заметно отличаются индукторы и по способности "включать" синтез интерферона в различных органах (мозг, легкие, печень, селезенка и др.), что определяет тактику их использования при различных вариантах органной патологии. Так низкомолекулярные препараты (циклоферон, амиксин) способны преодолевать гематоэнцефаличесий барьер, поэтому активны при вирусных энцефалитах.
У индукторов интерферона есть достоинства, выходящие за рамки только "включения" системы интерферона. Как недавно показано в наших исследованиях, циклоферон вызывает образование ряда провоспалительных и противовоспалительных цитокинов. Это очень важное обстоятельство позволяет рассматривать данный препарат как биорегулятор цитокиновой сети.
Необходимо отметить и некоторые преимущества [9,10] индукторов интерферона:
- в отличие от наиболее широко используемых в настоящее времярекомбинантных интерферонов они не обладают антигенность ;
- синтез ИФН при введении индукторов сбалансирован и контролируется организмом, что предотвращает побочные эффекты, наблюдаемые при передозировке ИФН;
- даже однократное введение индукторов приводит к длительной продукции ИФН в терапевтических дозах, тогда как срок полужизни этих препаратов составляет 20 минут.
Наконец, некоторые индукторы интерферона обладают уникальной способностью "включать" синтез интерферона в определенных популяциях клеток и органов, что в ряде случаев имеет определенные преимущества перед поликлональной стимуляцией иммуноцитов интерферонами.
Эта группа препаратов не лишена и недостатков:
- в отдельных случаях их применение не сопровождается синтезом эндогенного продукта вследствии гипореактивности;
- относительно высокая токсичность амиксина, образование устойчивых комплексов с ДНК;
- невозможность преодоления гематоэнцефалического барьера ларифаном и ридостином, невозможность синтеза эндогенного продукта при пероральном применении;
Основными условиями для медицинского применения индукторов интерферона служат:
- специфическая активность;
- низкая токсичность;
- отсутствие мутагенности, канцерогенности, эмбриотоксичности.
Для правильного использования индукторов интерферона, когда их биологические эффекты выявляются наиболее полно, необходимо знать:
- какие клетки продуцируют интерферон в ответ на введение индуктора,
- какой тип интерферона индуцируется в органах-мишенях [9].
Характеристика индукторов интерферона ( цит.по 8,14)
Амиксин- стимулирует образование альфа/бета и гамма интерферонов, усиливает антителообразование,обладает антибактериальным и противовирусным действием.Пик накопления интерферона в крови (60-120 МЕ/мл) отмечается через 12-18 часов после приема, затем полностью исчезает из кровотока к 72 часам.В лейкоцитах человека индуцированный интерферон не превышает 120 МЕ/мл.
Противопоказания: болезни почек, аллергические заболевания
Ридостин - стимулирует продукцию раннего интерферона альфа/бета типов, отмечается два пика продукции: ранний через 4 часа, поздний - к 48 часам. Уровень интерферона снижается к 72 часам от момента введения препарата.
Наибольшей чувствительностью к препарату обладают лейкоциты больных гриппом, генитальным герпесом.
Наибольшей чувствительностью к препарату обладают лейкоциты больных генитальным герпесом, гриппом, ангиной, ОРВИ.
Арбидол - противовирусный препарат с интерферониндуцирующей активностью,оказывает ингибирующее действие на вирусы гриппа А,В; стимулирует фагоцитоз и антителообразование,Стимулирует гуморальные и клеточные реакции иммунитета.
Клинически наиболее перспективными классами соединений среди ароматических углеводородов оказались низкомолекулярные производные акридина - акридона - препарат циклоферон - метилглюкамина акридонацетат [3 ].
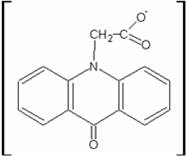
ЦИКЛОФЕРОН
Метилглюкамина акридонацетат
ДОЗА ДЛЯ ДЕТЕЙ -10 мг/кг массы тела.
Клинические исследования эффективности циклоферона проводились у детей и включали плацебо-контролируемые, сравнительно-контро-лируемые исследования. Мы приводим ниже основные результаты, полученные при исследовании эффективности препаратов циклоферона при различной патологии.
Вирусные гепатиты. Исследования проводились у детей, страдающих вирусными хроническими гепатитами с парентеральным механизмом заражения. В результате законченных исследований, установлено, что первичная ремиссия наблюдалась у 47,2%, а стабильная ремиссия у 55,4%, причем полная ремиссия установилась у 44,4% больных, рецидивы заболевания регистрировались лишь в 5,6% случаев.
При ВИЧ-инфекции установлен выраженный лечебный эффект на стадиях IIБ,IIB - IIIА за счет стабилизации иммунного статуса и снижения репликативной активности вируса ( менее 200 копий РНК/ВИЧ в мл).Препарат оказывал наилучшее иммуномодулирующее действие при числе СD4 менее 500, но не ниже 200, при уровне вирусной нагрузке до 30 тысяч копий в 1 мл.
Повышение эффективности лечения гастродуоденальной патологии ( хронический гастродуоденит) с использованием циклоферона увеличилось на 20%. Терапия была направлена на элиминацию H.pylori, а также повышение иммунной защиты организма.
При наблюдении в катамнезе за детьми, страдающими хроническими эрозивными гастродуоденитами, после терапии циклофероном, отмечен рецидив у 6.0% больных, против 17-20.0% больных, получавших стандартный курс терапии [11].
Результаты, вызывающие определенный интерес отмечены при использовании таблетированной лекарственной формы циклоферона в комплексной терапии острых кишечных инфекций [12,19,20].
Микробиологическая санация организма регистрировалась у 90,3% больных получавших циклоферон при дизентерии, сальмонеллезе, а применение циклоферона при сальмонеллезной инфекции обеспечило нормализацию микроэкологии просвета толстой кишки, увеличение индигенной анаэробной и факультативно-анаэробной флоры, элиминацию возбудителя и условно-патогенной микрофлоры, повышение уровня местного секреторного иммуноглобулина А. Включение циклоферона в терапию ротавирусных инфекций у детей приводило к стимуляции синтеза противоротавирусных антител ( до 0.58 отн.ед., против 0.36-0.39 до начала терапии и у больных группы сравнения), обеспечивая быструю санацию кишечника от возбудителя.
В настоящее время проводятся посттрегистрационные исследования эффективности циклоферона при нейроинфекциях.[1] Позитивные результаты получены при серозном менингите. Санация ликвора и длительность стационарного лечения были достоверно короче (11.7 дней, против 18.7), быстрее купировались менингеальные симптомы Цереброастенический синдром возникал гораздо реже, в сравнении с детьми, получавших стандартную терапию. При вирусных энцефалитах отмечали купирование судорожно-коматозного статуса, регресс очаговой неврологической симптоматики, формирование минимального органического дефицита на МРТ - только в случае раннего начала терапии.
При клещевых нейроинфекциях отмечено сокращение лихорадочного периода и сроков санации ликвора, что привело к сокращению длительности пребывания в стационаре, а также к быстрейшему купированию менингеальных симптомов. В катамнезе в течение года не отмечено хронизации процесса.
Анализ клинического течения заболевания при бактериальных менингитах не выявил особой разницы в группе больных, получавших циклоферон и в группе сравнения; Но в группе больных, получавших циклоферон, обратное развитие субдурального выпота происходило на фоне консервативной терапии, а в группе сравнения в половине случаев, пришлось прибегнуть к дренированию субдурального пространства.
Таким образом, фармакотерапевтическая эффективность циклоферона при столь широкой патологии обеспечивается его механизмом действия, включающим противовирусный, интерферониндуцирующий, иммунокорригирующий и противовоспалительный компоненты [17, с.99-109].
Читайте также:

