Вирусы в нервных узлах
Обновлено: 18.04.2024
Для цитирования: Камчатнов П.Р., Евзельман М.А., Чугунов А.В. Постгерпетическая тригеминальная невралгия – возможности предупреждения и лечения. РМЖ. 2014;6:454.
В основе заболевания лежит реактивация вируса Varicella zoster, способного на протяжении длительного периода времени персистировать в ганглиях заднего рога. Соответственно, в отношении тройничного нерва областью их нахождения является гассеров узел. В случае возникновения определенных условий, благоприятных для активации вируса, развивается заболевание. Считается, что факторами риска для его реактивации являются пожилой возраст или, наоборот, инфицирование в детском возрасте (до 18 мес.), состояние иммуносупрессии различного происхождения (приобретенный иммунодефицит, онкологические заболевания, иммуносупрессивная терапия), внутриутробный контакт с вирусом ветряной оспы. Заболевание реализуется в условиях снижения клеточного иммунитета, обусловленного различными причинами.
Вирус герпеса может передаваться от человека к человеку, в частности, в тех случаях, когда индивидуум не переносил ветряной оспы или не был своевременно вакцинирован по поводу данной инфекции. Заболевание не склонно к рецидивированию. Считается, что рецидивы наблюдаются примерно у 6% пациентов, причем период от первого эпизода до рецидива может составлять несколько десятилетий [5]. Клинический опыт свидетельствует о том, что рецидив может быть обусловлен возникшим у пациента заболеванием, наличие которого негативным образом сказывается на состоянии и характере иммунного ответа.
Клинические проявления
Развитию заболевания предшествует продромальный период, который характеризуется лихорадкой, тошнотой, диффузной головной болью, которые, нарастая, могут наблюдаться на протяжении нескольких суток. Характерным является нарастание локальных болей, которые имеют характер нейропатических, а также неприятный жгучий, колющий оттенок зуда, способных сопровождаться аллодинией, гиперестезией и гиперпатией. Как правило, такого рода боли локализованы в области последующих высыпаний и ограничиваются зоной одного или нескольких соответствующих дерматомов. В подавляющем большинстве случаев указанные проявления носят односторонний характер, хотя у отдельных пациентов они могут распространяться и на противоположную половину туловища [8]. Боль может носить исключительно интенсивный характер, что нередко симулирует ряд соматических заболеваний, в частности плеврит, острый инфаркт миокарда, почечную колику. Поражение гассерова узла может вызвать трудности при проведении дифференциальной диагностики со стоматологическими заболеваниями, поражением придаточных пазух носа.
На фоне указанных симптомов появляются гиперемия и множественные макулопапулярные высыпания, которые впоследствии приобретают характер везикулярных. Пузырьки заполнены прозрачным бесцветным серозным содержимым. В случаях благоприятного течения заболевания высыпания могут быль локализованы только в отдельной части дерматома. Появление новых высыпаний возможно на протяжении 5–7 дней. Через несколько суток от момента появления первых высыпаний содержимое их становится мутным (так называемая стадия пустуляции). В последующем, при отсутствии осложнений, на месте имевшихся высыпаний образуются сухие корочки, которые отпадают через 2–3 нед. В этих зонах могут оставаться рубцовые изменения или зоны измененной пигментации. Заболевание, как правило, имеет благоприятный прогноз, характеризуется монофазным течением и в незначительной степени обладает тенденцией к рецидивированию.
Диагностика может быть затруднена до появления характерных высыпаний. После их возникновения правильная постановка диагноза обычно не вызывает трудностей. Подтверждение диагноза возможно при проведении полимеразной цепной реакции, позволяющей выявить ДКН вируса Varicella zoster в содержимом имеющихся высыпаний.
Осложнения
Среди возможных осложнений следует отметить локальные инфекционные поражения, обусловленные инфицированием поврежденных кожных покровов стрептококком или стафилококком, вплоть до развития целлюлита. При вовлечении в патологический процесс офтальмической ветви тройничного нерва возможно развитие кератита, способного привести к тяжелым последствиям в виде поражения роговицы, вплоть до монокулярной слепоты. Редко встречаются поражения герпетической инфекцией ткани головного мозга (с развитием энцефалита) или его оболочек с возникновением серозного менингита.
Одним из наиболее частых и достаточно тяжелых осложнений ганглионита гассерова узла, обусловленного герпетической инфекцией, является постгерпетическая невралгия. Патогенез указанного состояния достаточно сложен и включает в себя по меньшей мере два основных механизма [5]. Во-первых, в его развитии принимает участие повышение возбудимости первичных афферентов вследствие поражения периферических нейронов. В результате этого возникают избыточная возбудимость ноцицепторов и, как следствие, формирование центральной сенситизации. Клинически такая совокупность патофизиологических процессов проявляется возникновением боли и развитием аллодинии. Во-вторых, вследствие дегенерации ноцицептивных нейронов возникает деафферентация вышерасположенных сенсорных систем, обусловливающая их гиперактивность. В результате этого наблюдается формирование боли, которая, однако, не сопровождается аллодинией. По мнению авторов, у одного пациента возможно сочетание обоих механизмов, с чем связано своеобразие болевого синдрома и различий в эффективности проводимой терапии.
Данное патологическое состояние характеризуется всеми типичными для нейропатического болевого синдрома клиническими характеристиками. Установление диагноза возможно в том случае, если боль сохраняется на протяжении не менее 30 сут после наступления полного заживления имеющихся высыпаний.
Факторами риска развития постгерпетической тригеминальной невралгии являются возраст старше 60 лет, женский пол, наличие продромального периода, множественность высыпаний, а также высокая интенсивность болевого синдрома в дебюте заболевания [6]. По мнению авторов исследования, болевой синдром умеренной интенсивности, не сопровождающийся развитием в последующем постгерпетической невралгии, наблюдается у более молодых пациентов и, вероятно, связан с обширным локальным повреждением тканей и воспалительным процессом при наличии множественных высыпаний. Следует подчеркнуть значимость возрастного фактора как важного предиктора развития болевого синдрома – у пациентов, перенесших опоясывающий герпес в возрасте старше 90 лет, постгерпетическая невралгия возникает примерно в половине случаев [5]. Неблагоприятным прогностическим фактором развития болевого синдрома является выявление вируса Varicella zoster в крови.
Как и в отношении подавляющего большинства хронических нейропатических болевых синдромов, исключительно важную роль в развитии постгерпетической невралгии играет совокупность психосоциальных факторов. Наличие предшествующих депрессивных и тревожных расстройств, недостаточная социальная адаптированность пациента, нарушение социальных связей, проживание вне семьи и др. могут повышать вероятность развития болевого синдрома.
Течение постгерпетической невралгии может быть различным. У части пациентов наблюдается значительный регресс или полное исчезновение имеющегося болевого синдрома за период времени около полугода. К сожалению, возможно менее доброкачественное течение, когда болевой синдром приобретает хронический характер и приводит к инвалидизации пациента и резкому снижению качества его жизни [10]. Риск возникновения тяжелого болевого синдрома нарастает с возрастом, так, более чем у 5% пожилых больных интенсивный болевой синдром сохраняется более 12 мес. [5]. Особенности течения заболевания могут быть связаны с различиями патогенеза болевого синдрома, направленностью и интенсивностью компенсаторных реакций организма, а также с эффективностью и адекватностью проводимой терапии, в частности, ее своевременным началом.
Достаточно часто наряду с развитием постгерпетической невралгии у пациентов наблюдаются двигательные нарушения в виде периферических парезов черепных нервов (наиболее часто – лицевого нерва) [1]. Данная форма герпетической инфекции известна в качестве синдрома Рамсея Ханта. Не получено убедительных данных о прогностической значимости моторных нарушений в отношении частоты и длительности болевого синдрома.
Лечение
Вероятно, несоблюдение указанного правила привело к тому, что результаты систематизированного обзора, посвященного изучению результатов противовирусной терапии, не смогли подтвердить ее эффективность в отношении предупреждения развития невралгии через 4 и 6 мес. после появления высыпаний [7]. Эти данные свидетельствуют о необходимости правильного выбора пациентов для достижения желаемого эффекта и своевременного начала лечения.
Для достижения терапевтического эффекта в виде уменьшения риска развития постгерпетической невралгии необходимо применение валацикловира (Вирдел) в суточной дозе 1000 мг 3 раза на протяжении 7 сут. Возможно использование и местных лекарственных форм противовирусных препаратов, но достижение терапевтического эффекта возможно только при их системном введении в адекватных суточных дозировках и достаточном сроке лечения. Препарат Вирдел хорошо переносится, возможно его одновременное применение с другими лекарственными средствами.
В качестве средства, потенцирующего лечебные эффекты валацикловира, предлагается одновременное назначение глюкокортикоидов. Имеются данные о том, что комбинированная терапия способна снизить интенсивность болевого синдрома в острой стадии заболевания [12]. Менее убедительны сведения о способности глюкокортикоидов уменьшить риск формирования постгерпетической невралгии. Авторы проведенных в этом направлении исследований указывают на то, что использование глюкокортикоидов ассоциировано с повышенным риском развития нежелательных побочных эффектов, в частности, обострения язвенной болезни желудка, гипергликемии, присоединения локального инфекционного процесса, причем частота такого рода осложнений повышается с возрастом. Несомненно, что проведение комбинированной терапии требует всестороннего учета возможного положительного ее эффекта и связанного с лечением риска побочных реакций, обусловленного состоянием конкретного пациента.
В том случае, если у больного имеется стойкая постгерпетическая невралгия, наблюдающаяся в отдаленном периоде после заживления высыпаний, лечение больного требует других подходов. В данной ситуации могут быть использованы представители трициклических антидепрессантов (амитриптилин, нортриптилин), которые обладают достаточно высокой эффективностью. Вместе с тем, несмотря на хороший противоболевой эффект, широкое применение этих препаратов ограничивается частым возникновением нежелательных побочных реакций, в особенности при их назначении в высоких дозировках. Достижение противоболевого эффекта при снижении риска побочных эффектов возможно за счет назначения антидепрессантов, обладающих способностью ингибировать обратный захват как серотонина, так и норадреналина. Следует отметить, что противоболевой эффект антидепрессантов при постгерпетической невралгии, как и при других нейропатических болевых синдромах, не связан только с их антидепрессивным эффектом.
Для лечения пациентов с постгерпетической невралгией традиционной широко применяются противоэпилептические препараты, в частности карбамазепин. В настоящее время распространение получили новые лекарственные средства, фармакологические эффекты которых реализуются вследствие взаимодействия с рецепторами гамма-аминомасляной кислоты – основного тормозного медиатора в центральной нервной системе (габапентин, прегабалин). Отмечается их лучшая переносимость по сравнению с противоэпилептическими препаратами предыдущих поколений. В ряде стран при постгерпетической невралгии используются слабые или даже сильные опиоиды.
Интерес представляет возможность применения локальных форм лекарственных препаратов. Так, показано, что местное использование препаратов лидокаина может быть целесообразным при наличии болевого синдрома, сопровождающегося аллодинией. Имеются также сведения о возможной эффективности капсаицина у пациентов с постгерпетической невралгией. Следует отметить, что его широкое применение ограничивается не всегда удовлетворительной переносимостью терапии.
Таким образом, имеющиеся сведения об эффективности использования валацикловира (Вирдел) у пациентов с опоясывающим герпесом позволяют рекомендовать его широкое применение у данного контингента больных. Своевременное начало лечения, правильный отбор больных для назначения препарата способны повысить эффективность проводимой терапии, профилактировать развитие постгерпетической невралгии.

Инфицирование нейротропными вирусами, а также местные индуцированные иммунные реакции могут необратимо нарушить сложную структурную и функциональную архитектуру ЦНС, часто оставляя пациента с неблагоприятным или фатальным прогнозом. Помимо немедленных и прямых эффектов, существует несколько неврологических расстройств, часто связанных с аутоиммунными механизмами, которые, как предполагается, являются отсроченными вирусными расстройствами: рассеянный склероз, синдром Гийена-Барре, нарколепсия и летаргический энцефалит. Нейротропные патогены могут попадать в головной мозг различными путями, включая ретроградный аксональный транспорт по двигательным и обонятельным нейронам, гематогенное распространение через гематоэнцефалический барьер (ГЭБ), менингеально-спинномозговой барьер, путем прямого инфицирования эндотелиальных клеток или путем распространения инфицированных лейкоцитов через ГЭБ в паренхиму головного мозга. Существует неудовлетворенная потребность в понимании механизмов, которые приводят к нейропатологическим или иммунопатологическим изменениям, возникающим после проникновения вируса в ЦНС или другие части тела, и клинических проявлений, связанных с этими изменениями.
Ниже описан ряд нейротропных вирусов
Альфавирусы
Род Alphavirus группы Togaviridae семейство включает группу оболочечных одноцепочечных РНК-вирусов с положительным смыслом, большинство из которых передаются комарами. Как правило, инфицирование людей альфавирусами , такими как O'nyong-nyong и вирус реки Росс, проявляется лихорадкой, макуло-папулезной сыпью и полиартритом, тогда как заражение вирусами энцефалита лошадей нового мира (EEV) может привести к потенциально летальному энцефалиту. К энцефалитным альфавирусам, вызывающим озабоченность общественного здравоохранения, относятся альфавирусы нового мира, вирус восточного энцефалита лошадей (EEEV), вирус венесуэльского энцефалита лошадей (VEEV) и вирус западного энцефалита лошадей (WEEV). Совсем недавно вирус Чикунгунья Старого Света (CHIKV) также был связан с энцефалитом. Учитывая, что случаи WEEV стали редкими и спорадическими, в этой главе основное внимание уделяется неврологическим проявлениям EEEV.
Герпесвирусы
Герпесвирусы представляет собой древнее семейство оболочечных двухцепочечных ДНК-вирусов, широко распространенных в животном мире. На основании геномных и биологических свойств герпесвирусы делятся на три подсемейства: α-, β- и γ-вирусы. Альфа-герпесвирусы имеют короткий репродуктивный цикл и устанавливают латентный период в нейронах сенсорных ганглиев. Бета- и гамма-герпесвирусы имеют более ограниченный диапазон типов клеток и относительно медленно реплицируются в клеточной культуре. В то время как бета-герпесвирусы могут сохранять латентность во многих типах клеток и органах (например, в секреторных железах, лимфоцитах и почках), гамма-герпесвирусы ограничены определенными субпопуляциями лимфоцитов, включая В- и Т-клетки. Среди восьми вирусов герпеса человека (HHV) подсемейство альфа включает вирусы простого герпеса типа 1 (HSV-1) и -2 (HSV-2) и вирус ветряной оспы (VZV). Цитомегаловирус человека (ЦМВ) и вирусы розеолы HHV-6 и -7 принадлежат к бета-подсемейству, а онкогенное гамма-подсемейство состоит из вирусов Эпштейна-Барр (EBV) и HHV-8. Первичная инфекция HHV, обычно в раннем детстве через орофациальный путь, как правило, протекает бессимптомно или в легкой форме (например, ветряная оспа и детская розеола, вызванная VZV и HHV-6 соответственно) и не требует терапии. Отличительной чертой герпесвирусов является установление пожизненной латентности в определенных типах клеток и прерывистая реактивация, приводящая к бессимптомному выделению вируса или рецидиву заболевания. В то время как врожденный иммунитет предотвращает распространение вируса во время первичной инфекции, адаптивный иммунитет имеет решающее значение для контроля латентного периода. Следовательно, тяжелые HHV-инфекции чаще встречаются у взрослых, ранее не инфицированных HHV, и у пациентов с ослабленным иммунитетом, но также связаны с анатомическим очагом инфекции. Инфицирование HHV иммунно-привилегированных участков, таких как ЦНС и глаза, может привести к потенциальным заболеваниям, угрожающим зрению или даже жизни, соответственно. В то время как HSV и VZV попадают в ЦНС трансаксональным путем, остальные шесть HHV распространяются в мозг гематогенным путем внутри лимфоцитов. Высокая распространенность инфекций HHV во всем мире свидетельствует об их потенциальной этиопатогенной роли в заболеваниях ЦНС, которые могут быть монофазными, рецидивирующими или даже хроническими. представляют интерес клинические и патологические особенности ключевых HHVs, связанных с дисфункцией ЦНС.
Вирус простого герпеса
HSV-инфекция, вызванная первичной или реактивацией латентного вируса, является наиболее частой причиной инфекционного энцефалита у людей . Инкубационный период HSV-1 после первичной инфекции составляет 2–12 дней, тогда как у HSV-2 инкубационный период у восприимчивых лиц составляет 3–7 дней. HSV-1 является причиной до 90% случаев HSV-энцефалита (HSE), в то время как HSV-2 встречается реже и чаще проявляется клинически как менингит. Предрасполагающими факторами являются сахарный диабет, злокачественные новообразования и состояния, нарушающие иммунную систему. Интересно, что дефекты в TLR3-интерфероне (IFN) и интерферон-зависимых путях предрасполагают к ВПГ-энцефалиту, особенно у детей. Таким образом, TLR3-опосредованный иммунный ответ в ЦНС может играть важную роль в борьбе с локальной инфекцией HSV. Клинически у пациентов с HSE наблюдаются головная боль, лихорадка и изменение психического состояния, такое как спутанность сознания, психоз, а также изменение сознания от сонливости до ступора и комы. При предрасположенности HSV к поражению лобных и височных долей у пациентов с HSE также могут быть судороги. У пациентов с ослабленным иммунитетом HSE может быть атипичным, заболевание может быстро развиваться и угрожать жизни. МРТ-сканирование пациентов с HSE часто показывает гиперинтенсивность на флэр- и Т2-взвешенных изображениях, соответствующую цитотоксическому отеку в этих областях
Цитомегаловирус человека (ЦМВ) имеет самый большой геном среди HHV и вызывает множество заболеваний, от самоизлечивающихся до летальных с клиническими симптомами, проявляющимися у некоторых пациентов через 3–12 недель после заражения. Неврологические расстройства, вызванные ЦМВ, в основном у пациентов с иммуносупрессией из-за реактивации ЦМВ, включают пояснично-крестцовый полирадикуломиелит, продольный обширный поперечный миелит и энцефалит . До появления АRТ ЦМВ был наиболее частой оппортунистической инфекцией ЦНС у больных СПИДом. Неврологические заболевания ЦМВ, особенно энцефалит, трудно диагностировать из-за атипичных клинических и нейровизуализационных особенностей. Исследования тканей головного мозга, пораженных HCMV, показывают, что базальные ганглии, промежуточный мозг и ствол головного мозга являются основными местами инфицирования HCMV. Анализ in situ показал, что большинство цитомегалических клеток происходит из инфицированных астроцитов, но HCMV также был обнаружен в нейронах, астроцитах, олигодендроцитах, эпендиме, сосудистом сплетении и эндотелиальных клетках. Нейропатология HCMV может проявляться в виде слабовыраженного энцефалита с распространенными узлами микроглии, часто ассоциированными с небольшим количеством цитомегалических клеток, или в виде некротизирующего вентрикулоэнцефалита с обильными внутриядерными тельцами-включениями. Врожденная инфекция HCMV является серьезной проблемой общественного здравоохранения, вызывая тяжелые неврологические заболевания у младенцев, приводящие к умственной отсталости, церебральному параличу и нейросенсорной тугоухости.
Вирус Эпштейн - Барр
Вирус Эпштейна-Барр является возбудителем инфекционного мононуклеоза (ИМ) у ранее не инфицированных детей и молодых людей с клиническими симптомами, проявляющимися через 4–6 недель после заражения. Менее 5 % первичных EBV-инфекций вызывают поражение ЦНС, которое проявляется в виде менингита, энцефалита, церебеллита, краниальной или периферической невропатии и полирадикуломиелита. Неврологическое вовлечение может возникать незадолго до, во время или после инфекционного мононуклеоза или даже в его отсутствие. Полирадикуломиелит чаще всего является постинфекционным аутоиммунно-опосредованным синдромом, и пациенты хорошо реагируют на стероидную терапию, часто назначаемую в сочетании с противовирусными препаратами . Заболевания ЦНС, связанные с EBV, могут быть вызваны первичной инфекцией или реактивацией, но также могут быть связаны с хронической инфекцией EBV. В отличие от HSV и VZV, в очагах энцефалита человека, вызванного EBV, не обнаруживается присутствие вирусного белка и нуклеиновых кислот, что ставит под сомнение прямое нейропатическое действие вируса. Сообщается, что мозжечок и базальные ганглии в равной степени вовлекаются во время инфекции EBV, наряду с полушариями головного мозга. Сообщалось, что пациенты с изолированным поражением серого или белого вещества полушария достигли хорошего выздоровления, в то время как почти у половины пациентов с поражением таламуса развились осложнения. Самая высокая смертность была среди пациентов с изолированным поражением ствола головного мозга . Нейропатология характеризуется лептоменингеальной мононуклеарной воспалительной инфильтрацией, периваскулярной манжеткой и периодической периваскулярной демиелинизацией. Текущие данные свидетельствуют о том, что EBV-индуцированная патология ЦНС является иммуноопосредованной.
Вирус герпеса 6 типа
Два варианта HHV-6, HHV-6A и -B, недавно были повторно классифицированы как отдельные HHV на основании различий в эпидемиологии, клеточном тропизме и ассоциации с заболеванием . В то время как ни одно заболевание не было четко связано с HHV-6А, HHV-6В может привести к субитумной экзантеме, инкубационный период которой составляет 1-2 недели. По сравнению с другими лимфотропными HHV инфекция HHV6 также проявляет нейротропные характеристики. Неврологические осложнения первичной инфекции HHV6, в основном HHV-6B, в детском возрасте включают судороги, гемиплегию, менингоэнцефалит и остаточную энцефалопатию, исходы которых остаются неопределенными. Плохой прогноз наблюдался у детей с субитум-ассоциированным энцефалитом и фебрильным эпилептическим статусом. Кстати, реактивация HHV-6 у взрослых пациентов после трансплантации, в основном после трансплантации костного мозга с участием HHV-6B, может быть возбудителем миелита, менингита и посттрансплантационного острого лимбического энцефалита . Нейропатология человека состоит из периваскулярных мононуклеарных клеточных манжет, расположенных в гиппокампе (лимбический энцефалит), лобной и островковой коре, связанных с кровоизлияниями. В височной коре была описана заметная потеря нейронов с глиозом и узелками микроглии. Нет ни вирусных включений, ни воспалительной демиелинизации, ни паренхиматозного некроза, ни менингеального воспаления. Иммунохимически антиген HHV-6 находится в ядрах нейронов гиппокампа и в астроцитах.
Ортомиксовирусы
Материнский грипп был связан с шизофренией и биполярным расстройством (BD) у потомства. Ранние исследования пренатального гриппа и шизофрении были экологическими, связывая эпидемии гриппа в популяции с пациентами, которые находились бы внутриутробно во время этих эпидемий. При заражении гриппом в первом триместре риск развития шизофрении увеличивался в семь раз. Однако во второй половине беременности не наблюдалось повышенного риска развития шизофрении при контакте с гриппом, что указывает на специфичность для раннего и среднего периода беременности. Дополнительные исследования показали, что материнский грипп был связан с более чем четырехкратным статистически значимым увеличением риска возникновения биполярного расстройства.
Нейроинфекции – группа инфекционных патологий, которые вызываются бактериями, вирусами, грибками или простейшими, характеризуются преимущественной локализацией возбудителя в ЦНС и признаками поражения ее отделов. Клинические проявления представлены менингеальным, интоксикационным, ликвородинамическим синдромами, вегетососудистыми расстройствами. В процессе диагностики используются анамнестические данные, результаты физикального, общеклинического лабораторного, серологического, бактериологического или вирусологического исследования. В ходе лечения назначаются антибиотики или противовирусные препараты, патогенетические и симптоматические средства.
МКБ-10
Общие сведения
Нейроинфекции – сравнительно распространенная группа патологий. По данным статистики, инфекционные поражения ЦНС достигают 40% в структуре неврологической заболеваемости. Основную часть составляют бактериальные и вирусные менингиты, распространенность которых в различных географических регионах находится в пределах 5-12 случаев на 100 000 населения в год. Для большинства болезней, входящих в данную группу, характерна осенне-зимняя сезонность. Они могут встречаться среди всех возрастных категорий населения, но основную часть пациентов составляют дети до 10-12 лет и лица, не получившие вакцины согласно календарю прививок.

Причины нейроинфекций
Этиология инфекционного поражения структур центральной нервной системы зависит от вида заболевания. В большинстве эпизодов источником заражения становится больной или здоровый человек-носитель. Способствующими факторами являются постоянный контакт с большим количеством людей, ЧМТ, иммунодефицитные состояния, хронические соматические патологии, беспорядочная половая жизнь. Выделяют следующие механизмы инфицирования:
- Воздушно-капельный. Реализуется при кашле, чихании, разговоре. Характерен для возбудителей бактериальных и вирусных менингитов, энцефалитов, полиомиелита, герпетической инфекции.
- Контактно-бытовой. Подразумевает передачу инфекционного агента при прямом контакте с больным, носителем или инфицированными предметами быта. Это один из путей распространения герпес-вирусов, полиомиелита, сифилиса.
- Фекально-оральный. Тип передачи, при котором возбудитель выделяется вместе с испражнениями, проникает в организм с продуктами питаниями или водой. Может реализовываться при герпес-инфекции, вирусах ЕСНО и Коксаки, ботулизме, полиомиелите.
- Половой. При этом варианте заражение происходит во время полового акта через слизистые оболочки половых путей. Таким способом распространяется ВИЧ-инфекция, сифилис, реже – вирусы-возбудители менингитов, энцефалитов.
Патогенез
Для каждой формы нейроинфекции характерны свои патогенетические особенности, но механизмы развития большинства синдромов и симптомов, как правило, аналогичны при всех вариантах этой группы заболеваний. Инфекционный синдром обуславливают комплексы антиген-антитело и токсины возбудителей, которые оказывают деструктивное воздействие на ЦНС, провоцируя нарушения тонуса сосудов, метаболизма и гемодинамики в целом. Менингеальный синдром развивается при воспалительном поражении мозговых оболочек и повышении внутричерепного давления. Вегетативные расстройства вызываются как прямым контактом инфекционных агентов с центрами автономной нервной системы, так и опосредованным воздействием через внутричерепную гипертензию. Ликвородинамические изменения потенцируются усиленной продукцией спинномозговой жидкости на фоне раздражения сосудистых сплетений и блокадой пахионовых грануляций, усложняющей процесс ее резорбции.
Классификация
Использование систематизации обусловлено необходимостью объединить между собой большое количество разнородных инфекционных патологий с вовлечением нервной системы. В зависимости от характера морфологических изменений, клинических особенностей и конкретного возбудителя в неврологии различают несколько групп поражений ЦНС инфекционного происхождения. Основными вариантами нейроинфекций являются:
1. Энцефалиты. Заболевания с воспалением ткани головного мозга. Наиболее распространенными считаются клещевой, герпетический, ветряночный и краснушный энцефалиты. Проявления зависят от типа возбудителя, могут включать общемозговые, очаговые симптомы, системную интоксикацию разной степени выраженности.
2. Менингиты. Болезни, при которых наблюдается поражение мозговых оболочек. Характеризуются наличием менингеального и интоксикационного синдромов, с учетом особенностей воспалительного процесса подразделяются на:
- Гнойные. Провоцируются бактериями, простейшими или грибами, могут быть первичными либо вторичными. К первичным относятся менингиты, вызванные менингококком, пневмококками, гемофильной палочкой. Вторичные поражения являются осложнением гнойных процессов других локализаций – околоносовых пазух, среднего уха и пр.
- Серозные. Сопровождаются преимущественно лимфоцитарным плеоцитозом. В роли возбудителей выступают туберкулёзная палочка, вирус паротита, энтеровирусы Коксаки и ЕСНО.
3. Полиомиелит. Поражение ЦНС, вызванное РНК-содержащим вирусом полиомиелита. Может протекать в двух формах: непаралитической (менингеальной, абортивной, инаппарантной) и паралитической (спинальной, мостовой, бульбарной, энцефалитической).
4. Абсцесс головного мозга. Представляет собой ограниченное капсулой скопление гнойных масс в тканях мозга. Может иметь отогенное, риногенное, метастатическое или посттравматическое происхождение. Проявляется системной интоксикацией, очаговой неврологической симптоматикой, реже – эпилептическим и гипертензивным синдромами.
5. Опоясывающий лишай. Вариант хронической нейроинфекции, обусловленный герпесвирусом человека III типа – Варицелла-Зостер. Наблюдается персистенция возбудителя в спинномозговых ганглиях с активацией при снижении иммунитета или травмах. К основным симптомам относятся острая боль, герпетические высыпания в области 1-2 дерматомов.
6. Нейросифилис. Инфекционная патология, провоцируемая бледной трепонемой. На ранней стадии поражения ЦНС отмечаются общеинфекционные, общемозговые и очаговые симптомы с нарушением функций II, III, VI, VIII пар черепно-мозговых нервов. На поздних стадиях развивается прогрессирующая деменция, выявляются психические расстройства, инсультоподобная симптоматика.
7. Ботулизм. Инфекционное заболевание, вызываемое Clostridium botulinum и сопровождающееся прерыванием передачи нервных импульсов в холинэргических синапсах. Обнаруживаются признаки поражения двигательных ядер ствола мозга, передних рогов.
8. НейроСПИД. Обусловлено инфицированием вирусом иммунодефицита человека. Зачастую представлено первичными поражениями ЦНС: энцефалопатиями, рецидивирующими ВИЧ-менингитами, вакуолярной миелопатией. Проявления разнообразны, включают парезы, афазии, атаксию, мнестические расстройства, психопатологические нарушения.
Симптомы нейроинфекций
Менингальный синдром возникает при вовлечении в патологический процесс мозговых оболочек, состоит из общемозговой симптоматики, мышечно-тонических и корешковых симптомов. В первую группу входит интенсивная диффузная распирающая головная боль; фотофобия, повышенная чувствительность к звукам и свету, рвота без тошноты, не приносящая облегчения. Зачастую наблюдается нарушение сознания по типу галлюцинаций, бреда, оглушения, сопора. У детей возможны фебрильные судороги. Мышечно-тонические и радикулярные проявления включают в себя ригидность затылочных мышц, симптомы Кернига, Брудзинского, Лессажа, Гордона, Менделя, Бехтерева и др.
Вегетативно-сосудистые расстройства при нейроинфекциях могут носить симпатоадреналовый, вагоинсулярный или смешанный характер. В первом случае обнаруживается учащение сердечного ритма, повышение артериального давления, чрезмерная потливость и жажда, во втором – брадикардия, артериальная гипотония, обильное мочеиспускание. При смешанном варианте симптомы из разных групп сочетаются между собой. Нарушение нормальной циркуляции ликвора может протекать по гипертензивному и гипотензивному типу. Более характерной для нейроинфекций является внутричерепная гипертензия, сопровождающаяся угнетением сознания, судорожными и дислокационными синдромами.
Диагностика
Диагностическая программа при инфекциях ЦНС основывается на анамнезе, физикальном исследовании, общеклинических и специфических лабораторных тестах. Лучевые методы диагностики используются редко, зачастую – с целью дифференциации с объемными поражениями нервной системы. Программа обследования больного может включать следующие процедуры:
- Выяснение анамнеза. При общении с пациентом или его родственниками лечащий инфекционист или невролог осуществляет детализацию имеющихся жалоб, выясняет динамику их развития. Важную роль играет эпидемиологический анамнез – контакт с инфекционными больными или выезд за границу на протяжении последних 21 дней.
- Общий и неврологический статус. При осмотре врач определяет уровень сознания, изучает кожу и слизистые оболочки с целью поиска высыпаний, определяет частоту сердечных сокращений и артериальное давление. При установлении неврологического статуса специалист оценивает тонус затылочных мышц, выявляет специфические симптомы, характерные для различных неврологических синдромов.
- Общеклинические лабораторные тесты. В общем анализе крови помимо повышения СОЭ отмечаются следующие изменения: при бактериальной инфекции – высокий нейтрофильный лейкоцитоз, при вирусной – лейкоцитоз со смещением лейкоцитарной формулы вправо, при ВИЧ-инфекции и тяжелых иммунодефицитах – лейкопения. Показатели биохимического анализа крови зависят от сопутствующих поражений внутренних органов.
- Спинномозговая пункция. При нейроинфекциях существует два основных варианта изменений ликвора (белково-клеточных диссоциаций) – по гнойному и серозному типу. При первом типе СПЖ мутная, имеет определенный окрас (белый, желтоватый), наблюдается нейтрофильный плеоцитоз от 1 000, повышение уровня белка от 1,0 г/л. При серозной форме ликвор прозрачный, опалесцирует, при цитологическом исследовании обнаруживается лимфоцитарный плеоцитоз более 100, уровень белка составляет выше 0,4 г/л.
- Серологическое исследование. Заключается в определении повышенного уровня антител в крови при помощи реакций подавления гемагглютинации, связывания комплемента или нейтрализации. Применяется ИФА, в ходе которого выявляется специфический IgM к возбудителю. Проводится ПЦР для уточнения ДНК или РНК инфекционного агента.
- Вирусологическая или бактериологическая диагностика. Предполагает определение возбудителя заболевания в крови или спинномозговой жидкости пациента путем посева образцов на специфические питательные среды. После идентификации патогенного агента целесообразно уточнение чувствительности к основным антибактериальным препаратам.
Лечение нейроинфекций
Все нейроинфекции являются показанием к госпитализации больного в инфекционный или неврологический стационар. При тяжелом состоянии, необходимости непрерывного контроля жизненно важных функций (дыхание, сердцебиение), пациента транспортируют в отделение ОРИТ. Лечебная программа включает следующие мероприятия:
- Этиотропная терапия. Основной целью является элиминация возбудителя из организма больного. Вначале используются препараты широкого спектра действия. После получения результатов серологического и бактериологического исследований медикаменты заменяют антибактериальными или противовирусными средствами, к которым выявленный возбудитель проявил наибольшую чувствительность.
- Патогенетические препараты. Применяются для борьбы с системной интоксикацией, отеком головного мозга и нарушениями гомеостаза, для коррекции водно-электролитного баланса, десенсибилизации и стимуляции иммунитета. Назначаются плазмозаменители, диуретики, глюкокортикостероиды, антигистаминные средства, интерфероны, донорские и искусственные иммуноглобулины, антикоагулянты.
- Симптоматические средства. К этой категории относятся медикаменты, купирующие отдельные симптомы и улучшающие общее состояние больного: анальгетики, жаропонижающие, противорвотные медикаменты, антиконвульсанты, нейролептики.
- Хирургическое лечение. Характер оперативного вмешательства зависит от обнаруженных изменений. Операция может потребоваться в случае абсцесса, туберкуломы головного мозга, компрессии спинного мозга при туберкулезном спондилите, больших областях некроза при опоясывающем лишае.
Прогноз и профилактика
Исход нейроинфекции определяется типом заболевания, общим состоянием больного, своевременностью и полноценностью лечения. В большинстве случаев вовремя поставленный диагноз и адекватная терапия позволяют сохранить жизнь пациента, минимизировать риск развития осложнений. При некоторых формах нейроинфекций, например – энцефалитах, летальность достигает 50-80%. Специфическая профилактика представлена вакцинами против конкретных возбудителей: вирусов герпеса, ботулизма, клещевого энцефалита, кори, полиомиелита, менингококка и т. д. Неспецифические превентивные мероприятия направлены на укрепление иммунитета, своевременное лечение иммунодефицитных состояний и предотвращение контакта с потенциальными носителями инфекционных заболеваний.
1. Инфекционные поражения головного мозга: учебное пособие/ Гладкий П.А., Сергеева И.Г., Тулупов А.А. – 2015.
Герпетический энцефалит — это диффузное или очаговое поражение мозгового вещества, вызванное герпесвирусами ВПГ-1, ВПГ-2, Varicella Zoster. Основные симптомы болезни: фебрильная лихорадка, прогрессирующее угнетение сознания, судорожные приступы. По завершении острого периода инфекции в течение длительного времени сохраняются резидуальные неврологические нарушения. Для установления диагноза необходимо проведение ПЦР-диагностики ликвора, томографии головного мозга, электроэнцефалограммы. Лечение патологии включает противовирусные препараты, противоотечную, нейрометаболическую и противосудорожную терапию.
МКБ-10
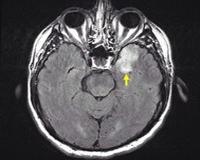
Общие сведения
Энцефалит герпетического происхождения составляет до 15-20% всех вирусных воспалительных процессов в мозговой ткани. Симптомы встречаются с частотой 4-5 случаев на 1 млн. населения, причем до трети больных составляют дети, а еще около 20% приходится на возрастную категорию старше 60 лет. Заболевание не теряет своей актуальности в современной неврологии, поскольку для успешного исхода патологии необходимо вовремя поставить диагноз и начать лечение, а промедление в оказании медицинской помощи чревато смертью пациента.

Причины
Болезнь в 95% случаев вызывается вирусом простого герпеса 1 типа, что объясняется высокой распространенностью возбудителя. По данным ВОЗ, около 2/3 населения мира в возрасте до 50 лет инфицированы ВПГ-1. На втором месте по частоте находится Varicella Zoster Virus (VZV) — возбудитель ветряной оспы, опоясывающего герпеса. Энцефалит, вызванный ВПГ-2, встречается редко, преимущественно у иммунокомпрометированных пациентов.
Ведущим среди факторов риска служит сниженный иммунный статус. Герпетическая инфекция протекает латентно, активизируется на фоне нарушения общей резистентности организма (при переохлаждении, стрессе, менструации у женщин). В группе риска находятся люди с врожденными и приобретенными иммунодефицитами, больные, получающие лечение иммуносупрессивными препаратами. К триггерам относят реинфицирование другими штаммами герпесвирусов, сопровождающееся аутоиммунными реакциями.
Патогенез
Первичное заражение ВПГ-1, как правило, происходит в детстве при попадании вирусных частиц на слизистые оболочки, после чего возбудитель начинает размножаться, мигрирует в нервные ганглии, где длительное время находится в состоянии латентной инфекции. Заражение ВПГ-2 наблюдается после начала сексуальной жизни через слизистые половых путей, а дальнейший путь развития патогена сходен с ВПГ-1.
Симптомы болезни в большинстве случаев возникают при реактивации инфекции под действием провоцирующих факторов. Герпесвирусы проникают в головной мозг гематогенным путем либо по нервным стволам (через тройничный или обонятельный нерв). Из гассерова узла они распространяются на таламус, подкорковые ядра, кору больших полушарий. При распространении по ольфакторному тракту первой страдает лимбическая система (гиппокамп, височная кора).
Симптомы герпетического энцефалита
В типичном течении острого мозгового воспаления выделяется несколько последовательных стадий: ранняя, период разгара болезни, регресс признаков, стадия остаточных явлений. В 70% патология манифестирует с внезапно возникшей высокой лихорадки (более 39°С), сопровождающейся интенсивными головными болями в лобно-височной зоне, сильной сонливостью, рвотой, не связанной с приемом пищи.
На вторые-третьи сутки симптомы дополняются нарушениями сознания: больные начинают путаться во времени и пространстве, не узнают родственников, испытывают разнообразные галлюцинации. По мере усугубления тяжести состояния появляются фокальные или генерализованные судорожные припадки. Изредка наблюдается оперкулярный автоматизм — повторяющиеся причмокивающие или сосательные движения.
В среднем через 3 дня заболевание переходит в стадию разгара. Основное проявление — глубокое угнетение сознания вплоть до комы. Пациенты не отвечают на звуковые и тактильные раздражители, однако двигательные реакции на болевые стимулы остаются в пределах нормы. Также могут возникать симптомы декортикации или децеребрации, аритмичное дыхание, двусторонние моторные нарушения.
Если пациенту было предоставлено комплексное лечение, с 3-4 недели начинается обратное развитие симптомов герпетического энцефалита. Этот этап длится от нескольких месяцев до 1 года, характеризуется постепенным восстановлением временно утраченных неврологических функций. По окончании третьей стадии около 80% больных имеют стойкие резидуальные (остаточные) явления, которые могут сохраняться пожизненно.
Осложнения
В остром периоде прогностическим неблагоприятным является прогрессирование отека мозга, что чревато его вклинением. При височно-тенториальной форме вклинения возникает триада признаков: потеря сознания, гемипарез, анизокория. Симптомами транстенториальной формы являются отсутствие реакции зрачков на свет, фиксация глазных яблок по срединной линии, двусторонний гипертонус мышц. Зачастую нарушается работа дыхательного центра.
Патология имеет тяжелое течение, при отсутствии своевременной медицинской помощи летальность достигает 70%. Даже если проводится этиотропное лечение, смертельный исход регистрируется у 15-20% пациентов, чаще у младенцев, пожилых людей, больных из группы риска. У выздоровевших полный регресс неврологической симптоматики наблюдается только в 20% случаев, а остальные сталкиваются с резидуальными симптомами.
Наиболее опасным хроническим осложнением заболевания считается прогрессирующее вегетативное состояние (акинетический мутизм), характеризующийся необратимым разрушением высших психических функций. У больных сохранено сознание, витальные функции (дыхание, кровообращение), однако полностью отсутствует познавательная деятельность. Такие пациенты не говорят, не реагируют на внешние раздражители, требуют постоянного ухода.
К типичным последствиям герпетической формы энцефалита относится синдром Клювера-Бьюси, при котором развиваются тяжелые длительные расстройства психической и когнитивной сферы. Симптомы расстройства включают ажитированное состояние, агрессивность, патологическую гиперсексуальность. Также наблюдаются интеллектуальные нарушения, проблемы с концентрацией внимания, ослабление памяти.
Диагностика
Обследованием пациента занимаются инфекционисты, неврологи, врачи экстренной помощи и реанимационного отделения. Заподозрить энцефалит удается по острому началу, наличию фебрильной лихорадки, сочетанию общемозговых и очаговых симптомов. Для подтверждения заболевания, уточнению этиологии воспалительного процесса назначаются следующие методы исследования:
Лечение герпетического энцефалита
Консервативная терапия
Герпетический энцефалит характеризуется быстрым нарастанием неврологического дефицита, прогрессированием общемозговых симптомов, поэтому комплексное лечение должно начинаться в максимально ранние сроки. Наилучшие шансы на полное выздоровление у пациентов, которые начали получать этиотропные препараты в первые сутки манифестации болезни. Лечение заболевания включает следующие группы медикаментов:
Реабилитация
Благотворное влияние на состояние ЦНС после перенесенного герпетического энцефалита оказывают витаминные комплексы (витамины группы В, аскорбиновая кислота) в сочетании с антиоксидантами. Восстановительное лечение также включает ноотропы и нейрометаболические препараты для улучшения когнитивных мозговых функций. Коррекция иммунологического статуса проводится адаптогенами, актопротекторами, неспецифическими иммуномодуляторами.
Для восполнения энергозатрат организма, стимуляции репаративных процессов показано адекватное по калорийности и витаминному составу энтеральное питание. Большое внимание уделяется физиотерапевтическим процедурам, массажу и лечебной физкультуре, направленным на улучшение двигательной функции. При наличии показаний рекомендуются занятия с логопедами, дефектологами.
Прогноз и профилактика
Несмотря на проводимое этиотропное лечение, прогноз при герпетическом энцефалите остается неблагоприятным, показатель летальности составляет 15-20%. У большинства выздоровевших сохраняется неврологический дефицит. Для предупреждения заболевания необходима рациональное лечение герпеса кожи и слизистых оболочек, своевременное консультирование больных с диссеминированной герпетической инфекцией.
2. Менингиты и энцефалиты: уч. пос. для врачей/ Д. А. Валишин, Р. Т. Мурзабаева, А. П. Мамон, М. А. Мамон, Л. В. Мурзагалеева. — 2012.
3. Герпетическое поражение нервной системы/ М.Н. Лебедюк, М.Э. Запольский, Ю.И. Горанский// Украинский журнал дерматологии, венерологии, косметологии. — 2011. — №2.
4. Герпетический энцефалит/ Т.В. Матвеева, Н.В. Токарева, Г.А. Шакирзянова// Неврология. — 2006. — №16.
Читайте также:

