Влияет ли лизоцим на вирусы
Обновлено: 18.04.2024
Ключевые слова: мукозальный иммунитет, микробиота, антибиотики, иммуносупрессия, инфекции, антибиотикорезистентность, иммуномодуляция, заместительная терапия.
Microbiota, mucosal immunity and antibiotics: the fineness of the interaction
I.G. Kozlov
D. Rogachev National Medical Research Center for Pediatric Hematology, Oncology and Immunology, Moscow
Обзорная статья посвящена тонкостям взаимодействия микробиоты, мукозального иммунитета и антибиотиков
Введение
Иммунология в первые два десятилетия ХХI в. продолжала радовать многочисленными открытиями, целый ряд которых имел практическую направленность и позволил расшифровать патогенез многих заболеваний, понять механизмы действия некоторых часто используемых лекарственных препаратов. В этот промежуток времени наибольший интерес с точки зрения практической медицины представляют результаты трех взаимопересекающихся направлений фундаментальных исследований, а именно изучение мукозального иммунитета (иммунитет барьерных тканей) и открытие сигнальных рецепторов врожденного иммунитета (pattern-recognition receptors — PRR), характеристика нормальной микрофлоры (микробиоты) и описание ее взаимодействия с барьерным иммунитетом, а также последствия применения антибиотиков на систему мукозальный иммунитет/микробиота.
Мукозальный иммунитет и сигнальные рецепторы врожденного иммунитета
Микробиота: иммунологические механизмы симбиоза
Состав
Микробиота присутствует у любого многоклеточного организма, и ее состав специфичен для каждого вида организмов. Существуют различия и внутри вида в зависимости от условий жизни и особенностей питания отдельных особей.
У человека микробиота насчитывает более 1000 видов микроорганизмов (бактерий, вирусов, грибов, гельминтов, простейших), хотя в точности этот параметр оценить весьма затруднительно (т. к. многие виды не высеваются, и оценка проведена на основании многопараметрического параллельного секвенирования ДНК) [24–27]. Объем микробиоты оценивается в 1014 клеток, что в 10 раз больше количества клеток в организме человека, а количество генов в микробиоте в 100 раз больше, чем у хозяина [3, 28–31].
Количество и состав микробиоты на различных этажах МАЛТ также существенно отличаются. Наиболее бедная микробиота выявляется в нижних отделах дыхательного тракта и дистальных отделах урогенитального тракта (раньше считалось, что они стерильны, однако последние исследования показывают присутствие нормофлоры и там) [32]. Самая большая микробиота населяет тонкий и толстый кишечник, и она является наиболее исследованной.
В микробиоте кишечника, безусловно, преобладают бактерии, а среди них — анаэробы, относящиеся к родам Firmicutes (95% Clostridia) и Bacteroides. Представители родов Proteobacteria, Actinobacteria, Verrucomicrobia и Fusobacteria представлены в значительно меньшей степени [26, 27, 33, 34]. Бактерии в кишечнике существуют в двух состояниях, образуя мозаичную межвидовую биопленку в верхней части слизистого слоя или находясь в планктонной форме в пристеночной части просвета. Считается, что состав и количество кишечной микрофлоры достаточно стабильны и поддерживаются как за счет межвидового сдерживания, так и за счет воздействий со стороны макроорганизма [30].
Функции
Взаимодействие микробиоты и МАЛТ
Антибиотики и иммуносупрессия
Варианты преодоления иммуносупрессии, вызванной антибиотиками
Тема непрямой микробиота-опосредованной иммуносупрессии в результате назначения антибиотиков только начинает становиться актуальной для медицинского профессионального сообщества. Но учитывая ее важность для самых разных областей медицины и нарастающую проблему антибиотикорезистентности, в ближайшее время можно ожидать многочисленные попытки решить эту проблему. Некоторый опыт в данной области уже имеется.
Трансплантация фекальной микробиоты (ТФМ)
Использование пробиотиков
МАМР и их минимальные биологически активные фрагменты (МБАФ)
Заключение
Целью открытого сравнительного наблюдения стала оценка клинико-лабораторной эффективности лизоцимсодержащего препарата Лизобакт® в комплексной терапии острых респираторных заболеваний у 60 детей. Как показали результаты, включение лизоцимсодержащего препарата Лизобакт® в традиционную схему терапии острых респираторных инфекций у детей способствовало более быстрому купированию интоксикации (лихорадки, вялости, снижения аппетита), катаральных явлений (гиперемии слизистой оболочки ротоглотки, ринита, кашля), а также восстановлению микробиоценоза полости рта и глотки. Это выражалось в увеличении количества и активности облигатной микрофлоры, снижении активности факультативных и остаточных микроорганизмов, нормализации баланса аэробных и анаэробных популяций микроорганизмов и восстановлении процессов протеолиза и муцинообразования, сопровождавшемся нормализацией уровня секреторного IgA в ротоглотке. Следовательно, введение лизоцимсодержащего препарата Лизобакт® в схему комплексной терапии острых респираторных вирусных инфекций обеспечивает восстановление местного гомеостаза ротовой полости к концу периода ранней реконвалесценции.
- КЛЮЧЕВЫЕ СЛОВА: острая респираторная инфекция, ОРВИ, иммунитет, стрептококки, стафилококки, Лизобакт
Целью открытого сравнительного наблюдения стала оценка клинико-лабораторной эффективности лизоцимсодержащего препарата Лизобакт® в комплексной терапии острых респираторных заболеваний у 60 детей. Как показали результаты, включение лизоцимсодержащего препарата Лизобакт® в традиционную схему терапии острых респираторных инфекций у детей способствовало более быстрому купированию интоксикации (лихорадки, вялости, снижения аппетита), катаральных явлений (гиперемии слизистой оболочки ротоглотки, ринита, кашля), а также восстановлению микробиоценоза полости рта и глотки. Это выражалось в увеличении количества и активности облигатной микрофлоры, снижении активности факультативных и остаточных микроорганизмов, нормализации баланса аэробных и анаэробных популяций микроорганизмов и восстановлении процессов протеолиза и муцинообразования, сопровождавшемся нормализацией уровня секреторного IgA в ротоглотке. Следовательно, введение лизоцимсодержащего препарата Лизобакт® в схему комплексной терапии острых респираторных вирусных инфекций обеспечивает восстановление местного гомеостаза ротовой полости к концу периода ранней реконвалесценции.
Таблица 1. Динамика уровня секреторного иммуноглобулина A (мкг/л) в слюне у больных ОРИ в зависимости от проводимой терапии
Таблица 2. Динамика метаболической активности микрофлоры ротовой полости у детей с ОРИ с учетом проводимой терапии (M ± m)
Острые респираторные заболевания (ОРЗ) остаются актуальной проблемой мирового здравоохранения. В большей степени ОРЗ подвержены дети. В настоящее время идентифицировано свыше 200 инфекционных агентов, вызывающих ОРЗ [1]. Острые респираторные инфекции, в частности пневмонии, – одна из распространенных причин смерти в детском возрасте. По данным Всемирной организации здравоохранения, от 1,4 до 1,8 млн детей в возрасте до пяти лет ежегодно умирают от пневмонии, что превышает суммарное количество летальных исходов от СПИДа, малярии и кори в мире [2, 3]. У 80% детей в возрасте до трех лет регистрируется не менее одного случая острых инфекций среднего уха, к семи годам этот показатель возрастает до семи случаев не менее чем у 40% детей [4]. Высокая распространенность циркулирующих респираторных вирусов в детской популяции, их видовое и генетическое разнообразие, контагиозность, а также нестойкость и строгая типоспецифичность иммунитета становятся причиной частых повторных заболеваний, что в свою очередь может приводить к формированию рецидивирующих и хронических воспалительных процессов органов дыхания. Среди бактериальных возбудителей ключевую роль играют пиогенные стрептококки, особенно бета-гемолитический стрептококк группы A, а также стрептококки групп C и G, Mycoplasma рneumoniae, Chlamydia pneumoniae, Arcanobacterium haemolyticum, Haemophilus influenzae, Moraxella catarrhalis.
Слизистые оболочки верхних дыхательных путей служат резервуаром для разнообразного микробного сообщества – как комменсалов, так и указанных выше потенциальных патогенов [5], которые в определенных условиях реализуют свойства возбудителя и вызывают развитие инфекционного процесса. Ключевым моментом развития ОРЗ является колонизация слизистой оболочки бактериальными возбудителями. Эволюционно сформированная система мукозального иммунитета, обеспечивающая поддержание колонизационной резистентности, включает целый комплект функциональных элементов. В частности, ОРЗ обусловлены различными нарушениями в системе специфической и неспецифической резистентности организма, связанными с преморбидным фоном и иммунодефицитным состоянием на фоне инфекционного процесса [6]. Как известно, у детей способность организма к выработке интерферона, равно как и содержание секреторного IgA, лизоцима, снижены [7]. В то же время не только состояние иммунной защиты, включающей неспецифические (тканевые барьеры, макрофаги, естественные киллеры, лизоцим, комплемент, острофазовые белки, цитокины и др.), а также специфические факторы, определяет развитие и течение патологического процесса и саногенеза. Способность бактерий преодолевать антимикробную защиту организма хозяина характеризует адаптационные возможности микробных клеток и обусловливает присоединение бактериальных осложнений при острых респираторных вирусных инфекциях (ОРВИ), а их персистенция как форма симбиоза микробов и организма человека становится причиной повторных эпизодов респираторных инфекций. Один из таких механизмов – защита (изоляция) пептидогликана клеточной стенки от факторов иммунитета путем ее экранирования, продукции секретируемых протеаз, инактивирующих защиту хозяина (антилизоцимная, антиинтерфероновая, антикомплементарная активность), образования форм с отсутствием (дефектом) клеточной стенки бактерий (L-формы, микоплазмы), а также антигенная мимикрия [7].
Лизоцим (эндогенный и алиментарный) является одним из древнейших факторов неспецифической защиты организма. В настоящее время лизоцим относят к полифункциональным белкам, поскольку помимо известной ферментативной активности (в частности, мурамидазной) они способны к неферментативному действию на клетки, включающему прежде всего связывание с цитоплазматической мембраной и нарушение ее проницаемости, в результате чего проявляется выраженный антимикробный эффект, имеющий место и после потери их мурамидазной активности. С учетом мембранотропной активности исследователи отнесли лизоцим к группе антимикробных белков и пептидов (АМБП) – перспективной альтернативы антибиотикам для борьбы с возбудителями ряда заболеваний [8, 9]. АМБП являются важной составляющей врожденного иммунитета.
Лизоцим содержится во всех тканях и биологических жидкостях организма – слюне, слезной жидкости, носовом секрете, сыворотке крови, слизистой оболочке кишечника, участвует в подержании колонизационной резистентности и ограничивает размножение в этих средах сапрофитов. В высокой концентрации он также содержится в гранулах полиморфноядерных лейкоцитов и макрофагах легких. При разрушении этих клеток лизоцим выделяется во внеклеточную жидкость. Установлено, что при нарушении динамического равновесия между организмом и окружающей средой резко снижается уровень эндогенного лизоцима [10]. Лизоцим и лизоцимсодержащие препараты применяются для восполнения дефицита эндогенного лизоцима. Доказан иммуномодулирующий механизм действия лизоцима, заключающийся в нормализации функций нейтрофилов и макрофагов, клеточных и ряда гуморальных факторов иммунитета. Особый интерес представляют данные о его регулирующем эффекте в отношении микрофлоры различных биотопов.
Для оценки клинико-лабораторной эффективности препарата Лизобакт® проведено открытое сравнительное наблюдение в параллельных группах.
Материал и методы
У всех пациентов заболевание протекало в среднетяжелой форме, чаще отмечалось сочетание острого ринофарингита и поражения дыхательных путей в виде острого ларинготрахеита – 18 (60%) и 15 (50%) больных и острого бронхита – 9 (30%) и 3 (10%) пациентов соответственно. На момент госпитализации у всех пациентов наблюдались катаральные явления, симптомы интоксикации. Более половины участников относились к категории часто болеющих, поскольку имели четыре и более случая ОРИ за предыдущий год.
Результаты и обсуждение
При анализе динамики регресса клинических симптомов ОРИ в исследуемых группах было установлено, что использование препарата лизоцима обеспечивало более раннее купирование лихорадки (3,8 ± 1,2 и 4,96 ± 1,1 суток соответственно; р 2 , p 0,05)).
Таким образом, динамика содержания секреторного IgA в слюне детей с ОРИ подтверждает опосредованное иммуномодулирующее влияние препарата Лизобакт®, обусловленное, по всей видимости, снижением микробной нагрузки и восстановлением нормобиоценоза слизистой оболочки ротоглотки. В то же время традиционная терапия не обеспечивает нормализации показателей местного иммунитета.
Для подтверждения гипотезы о положительном влиянии лизоцима на состояние микрофлоры ротоглотки было проведено исследование метаболитного профиля образцов слюны, собранных при поступлении в стационар и на 14-й день лечения. Установлено, что у больных ОРИ исходно наблюдалось снижение (в 2,5 раза) абсолютной концентрации короткоцепочечных жирных кислот (КЦЖК) по сравнению с нормой (норма > ОРВИ (1,01 ± 0,05 > 0,39 ± 0,09 мг/г)). Это свидетельствовало о сниженной активности и численности популяций микроорганизмов индигенной (облигатной) микрофлоры полости рта и глотки в результате внедрения вируса и развития воспалительного процесса.
У пациентов с ОРВИ, получавших лизоцимсодержащий препарат в составе комплексной терапии, после проведенного курса лечения абсолютное содержание КЦЖК увеличилось (табл. 2).
При исследовании профилей отдельных КЦЖК выявлено повышение относительного содержания пропионовой кислоты (до 0,182 ± 0,006 Ед) у 80% больных при снижении уровня уксусной кислоты (до 0,797 ± 0,007 Ед). Данный факт может говорить об увеличении численности и активизации анаэробного звена микрофлоры, представленного в основном популяциями микроорганизмов рода Bacteroides, пропионибактерий и др. Однако у 8 (20%) пациентов до лечения повышался в основном уровень уксусной кислоты (до 0,878 ± 0,008 Ед), что могло быть обусловлено активацией аэробных микроорганизмов (стрептококков, стафилококков и др.), относящихся к факультативной и остаточной микрофлоре. При этом в обоих случаях нарушение качественного состава микроорганизмов сопровождалось снижением активности и количества облигатной, в том числе молочнокислой, флоры (в частности, бифидобактерий, лактобацилл).
После курса терапии у пациентов основной группы профиль кислот фактически нормализовался, что могло означать восстановление активности облигатной микрофлоры и нормализацию баланса аэробно-анаэробных популяций микроорганизмов. В группе сравнения прослеживалась аналогичная тенденция, однако достоверных изменений со стороны качественного содержания кислот не выявлено.
При изучении суммарного относительного содержания изокислот (рИзоСn) у больных исследуемых групп исходно отмечалось их снижение. Как известно, изомеры КЦЖК образуются в результате жизнедеятельности микроорганизмов, утилизирующих пептиды. Аэробные микроорганизмы (стрептококки и стафилококки), некоторые бациллы рассматриваются как сильнейшие протеолитики. Анаэробные микроорганизмы также обладают способностью к протеолизу, но их активность менее выражена. Следовательно, протеолитическая активность аэробных и анаэробных популяций факультативных и остаточных микроорганизмов у больных ОРВИ до проведения терапии была несколько снижена. На фоне лечения относительное содержание изокислот в основной группе увеличилось (в группе сравнения осталось сниженным). Это говорило о восстановлении протеолитической активности указанных популяций микроорганизмов у пациентов, получавших лизоцимсодержащий препарат.
Было изучено отношение суммы изокислот к кислотам с неразветвленной цепью у больных до и после проводимой терапии. Его исходное снижение могло быть обусловлено истончением слоя приэпителиальной защиты и муцинообразования. В основной группе после лечения отмечалось его повышение, что свидетельствовало о восстановлении слоя приэпителиальной защиты. В то же время в группе сравнения имело место незначительное повышение данного параметра.
Включение лизоцимсодержащего препарата Лизобакт® в традиционную схему терапии ОРИ у детей способствовало более быстрому купированию интоксикации (лихорадки, вялости, снижения аппетита), катаральных явлений (гиперемии слизистой оболочки ротоглотки, ринита, кашля). Положительные изменения микробиоценоза полости рта и глотки на фоне применения препарата Лизобакт®, а именно повышение количества и активности облигатной микрофлоры, снижение активности факультативных и остаточных микроорганизмов, нормализация баланса аэробно-анаэробных популяций микроорганизмов и восстановление процессов протеолиза и муцинообразования, сопровождались нормализацией уровня секреторного IgA в ротоглотке.
Таким образом, включение лизоцимсодержащего препарата Лизобакт® в комплексную терапию ОРИ обеспечивает восстановление местного гомеостаза ротовой полости к концу периода ранней реконвалесценции.
Флеминг в ходе исследований обнаружил присутствие лизоцима в разных органах, тканях и жидких средах, даже в выделениях животных. В последствии предположил, что данный фермент обладает противомикробной активностью в отношении макроорганизмов и не ошибся.
Интересные факты о лизоциме
В 1965 году Дэвид Чилтон Филлипс открыл трёхмерную структуру лизоцима с помощью рентгеновской кристаллографии, которая и была взята за основу этого класса ферментов.
Лизоцим – каталитический белок, в химическом составе которого присутствуют все 20 аминокислот. Это значит, что для его синтеза в организм человека с пищей должны поступать белки разной природы как растительные, так и животные, ведь именно последние содержат 8 незаменимых. Веганы, полностью исключающие из рациона животный белок, более сильно подвержены вторжению инфекции, так как их естественная защита подорвана отсутствием в тканях и на слизистых, которые имеют прямой контакт с внешней средой, лизоцима.
Подтверждена широкая распространенность этого белка в организме: содержится лизоцим в слюне, слезной жидкости, крови, слизистой носа, пищеварительном тракте, печени, внутренних половых органах и хрящах. Костный мозг так же содержит лизоцим. Максимальная его концентрация отмечена в слюне и секрете молочных желез.
Лизоцим в ротовой полости держится не постоянно. При частом сплевывании слюны происходит его потеря навсегда, может, стоит задуматься о своем здоровье?
Принцип действия лизоцима

Лизоцим относится к мукопептид-гликогидролазам, имея сродство к определенным химическим связям, способен резать клетку в тех местах, где они присутствуют, лишая защиты. Большинство бактерий без клеточной мембраны являются нежизнеспособными.
Терапевтический эффект лизоцима определяется его противомикробным действием, которое зависит от ферментативной активности белка. Лизоцим частично или полностью лизирует (растворяет) клеточные оболочки тех микробов, у которых они состоят из хитинов, мукопептидов и глюкозаминопептидов, таким образом, исходя из особенностей строения клеточной стенки, более чувствительными к нему оказываются грамположительные бактерии.
Лизоцим: применение
Антибактериальное действие лизоцима осуществляется по двум механизмам: ферментативному (гидролиз) и катионному, если у бактерии формируется резистентность (клеточная мембрана видоизменяется), гидролиз становится невозможным и тогда срабатывает второй механизм (молекулы белка встраиваются в клеточную стенку бактерий и образуют в ней поры, лишая микроорганизмы естественной защиты)
Противовирусное - лизоцим способствует выработки интерферона, участвуя в формировании неспецифического иммунного ответа
Противогрибковое - лизоцим активен в отношении некоторых дрожжевых грибков, в частности рода Candida, способен подавлять их рост, не вызывая полной гибели. Также повышает эффективность флуконазола и тербинафина
Противомикробная активность (разрушает биопленки бактерий и грибов)
Иммуномодулирующее действие (противовоспалительный эффект), как следствие мурамидазной активности белка. Фрагменты разрушенных микробных клеток запускают активацию иммунитета.
Лизоцим способен помочь в разных ситуациях: проблемы с кишечником и желудком, обморожения, ожоги, гнойные раны, ангина, отит, блефарокератит аллергической природы.
Лизоцим в продуктах. Где он содержится?

Для применения в пищевой, косметической и в фармацевтической промышленности используется лизоцим из белка куриных яиц.
Рекордсменом по содержанию данного белка считается сырое козье молоко, только при условии, что животное употребляло натуральный корм и свободно паслось на пастбищах с разнотравьем. А также кисломолочная продукция, изготовленная из качественного молока крупного и мелкого рогатого скота: сыр, кефир, варенец, кумыс, йогурт, айран, творог.
На что стоит обратить внимание?
При снижении концентрации лизоцима в слюне может происходить учащение инфекционных и воспалительных процессов, что свидетельствует о важной роли лизоцима в местном иммунитете. Недостаток лизоцима во внутренней среде ослабляет защитные силы организма и может стать причиной развития аутоиммунных заболеваний.
Как повысить иммунитет с помощью лизоцима?
Овсянников В.Г. 1 Торопкина Ю.Е. 1 Краскевич В.В. 1 Алексеев В.В. 1 Бойченко А.Е. 1 Алексеева Н.С. 1 Краскевич Д.А. 2
Лизоцим – это антибактериальный агент, который является одним из главных факторов врожденного иммунитета. Впервые он был упомянут еще в 1909 г. Лизоцим расщепляет β-1,4-гликозидную связь муреинового слоя клеточной стенки бактерий, усиливает хемотаксис, обладает сорбционными свойствами в отношении микрофлоры, способствует повышению фагоцитарной активности лейкоцитов и стимуляции антителогенеза. Зона присутствия лизоцима практически не имеет границ: он обнаружен в крови, легких, почках в слюне, в слёзной жидкости, селезенке, в плаценте и других тканях. Его титр находится в постоянстве, что обусловлено не только разрушением клеток и освобождением лизоцима, но также продукцией и выделением его неповрежденными клетками. Также он способен останавливать опухолевый процесс, инактивируя изоантигены, путем расщепления полисахаридных цепей мурамина стенки клеточных мембран. Лизоцим активно используется при лечении острых пневмоний у детей и реанимационных больных, в стоматологии в виде непосредственно лекарства при пародонтите, остром очаговом пульпите, а также при лечении инфекционно-воспалительных заболеваний слизистой оболочки полости рта, десен и гортани: гингивите, стоматите. Лизоцим является компонентом зубных паст и ополаскивателей рта.

1. Дорофейчук В.Г. Механизм защитной функции лизоцима: фундаментальное и прикладное знание // Нижегородский мед журнал. 1996. № 2. С. 9-13.
4. Fink M.E., Finch S.C. Serum muramidase and granulocyte turnover. Proc. Soc. Exp. Biol. Med. 1968. no. 127 (2). P. 365–367.
5. Fleming A. On a remarkable bacteriolytic element found in tissues and secretions. Proc. R. Soc. London. 1922. no. 93. P. 306–317.
7. Чахов О.В., Горюнов А.Г. Образование лизоцима культурой гистиоцитов-макрофагов. Антибиотики. 1965. № 6. С. 507–511.
8. Жуковская Н.А., Ликина Т.Н. К вопросу о неспецифическом защитном действии лизоцима на организм. Антибиотики. 1968. № 10. С. 920–923.
10. Donaldson D., Roberts R., Larsen H.S., Tew J. Interrelationship between serum betalysin, lysozyme and antibody complement system in killing Escherichia coli. Infect. & Immunology. 1974. № 10 (3). P. 657–666.
11. Callewaert L., Michiels C.W. Lysozymes in the animal kingdom. J Biosci. 2010. no.35(1). P. 127–60.
12. Блашкова С.Л., Фазылова Ю.В. Особенности гигиенического ухода у пациентов с проявлениями дерматозов на слизистой оболочке рта // Пародонтология. 2018. № 2. С. 59-57.
13. Галимова И.А., Усманова И.Н., Герасимова Л.П., Хуснаризанова Р.Ф., Усманов И.Р., Котова Ю.Б. Изучение особенностей состояния микробиома и местного иммунитета у пациентов с хроническими рецидивирующими афтами полости рта. // Уральский медицинский журнал. 2019. № 9(177). С. 11-14.
14. Шевкунова Н.А. состояние местного иммунитета полости рта у больных сахарным диабетом 2 типа при потере зубов // Успехи современной науки. 2016. № 2. С. 92-94.
15. Герасимова А.А., Кабирова М.Ф., Герасимова Л.П., Минякина Г.Ф., Сисина О.В. Уровень сенсибилизации к аллергенам грибковой этиологии и состояние местного иммунитета при заболеваниях слизистой оболочки полости рта // Проблемы стоматологии. 2017. № 1. С. 56-60.
16. Пудяк В.Е. Особенности комплексного лечения воспалительных заболеваний пародонта // Вестник Алматинского государственного института усовершенствования врачей. 2019. № 4. С. 52-55.
17. Арутюнов А.В., Сирак С.В. Морфологическая оценка влияния разработанной комбинированной лекарственной композиции на репаративные процессы при экспериментальном пульпите // Эндодонтия Today. 2015. №3. С. 31-34.
19. Кобылкина Т.Л. Экспериментальная оценка репаративного дентиногенеза при пульпите//Научный альманах. 2016. № 12-2(26). С. 292-298. DOI: 10.17117/na.2016.12.02.292
20. Иванов В.Н., Улитовский С.Б., Яременко А.И. Зубная паста, содержащая смесь лизатов бактерий // Патент РФ № 2496468. Патентообладатели Иванов В.Н., Улитовский С.Б., Яременко А.И. 2013. Бюл. № 30.
22. Bardes J.M., Waters С., Motlagh Н., Wilson A. The Prevalence of Oral Flora in the Biofilm Microbiota of the Endotracheal Tube. Am Surg. 2016. no. 82 (5). P. 403-406.
24. Халатов В. А., Гулин А. В., Невзорова Е. В. Иммунологические показатели слюны у жителей Липецкой области // Вестник российских университетов. Математика. 2015. Т. 20. Вып.2. С 354-356.
25. Wu T., Wu C., Fu S., Wang L., Yuan C., Chen S., Hu Y. Integration of lysozyme into chitosan nanoparticles for improving antibacterial activity. Carbohydr. Polym. 2017. no. 155. P. 192–200.
26. Stapleton A., Noor M.R., Soulimane T., Tofail S.A.M. Physiological Role of Piezoelectricity in Biological Building Blocks. Electrically Active Materials for Medical Devices. World Scientific, 2016. P. 237-251. DОI: 10.1142/9781783269877_0017.
27. Мордвинова В.А., Оносовская Н.Н., Тетерева Л.И. К вопросу применения консервантов в сырах // Переработка молока. 2018. № 1. С. 26-28.
29. Шингарева Т.И. Исследование ингибиторов технически вредной микрофлоры в производстве сырной продукции // Сыроделие и маслоделие. 2019. № 3. С. 44-45.
30. Давидович Е.А. Лизоцим содержащие композиции в составе лечебного питания детей // Экологическая безопасность в АПК. 2010. N 3. С. 876.
31. Плецитый Д.Б. Лизоцим, как фактор естественной резистентности // Биологическая роль лизоцима и его лечебное применение. Караганда, 1972. С. 163-167.
32. Дягилев В.В. Фагоцитарные реакции у больных предраком и раком гортани // Фагоцитоз и иммунитет: тез. докл. Всесоюз. симпоз., посвящ. 100-летию создания И.И. Мечниковым фагоцитар. теории иммунитета (г. Москва, 14-18 ноябрь 1983 г.) / Под общ. ред. Р.В. Петрова. М., 1983. C. 85-86.
34. Овсянников В.Г., Алексеев В.В., Бойченко А.Е., Алексеева Н.С., Абрамова М.В. Активность лизоцима при формировании острой соматической боли у старых крыс // Владикавказский медико-биологический вестник. 2014. Т. 20. № 29. С. 29-31.
Лизоцим является старейшим универсальным ферментом белковой природы, встречающимся у всех живых форм. Он образован одной полипептидной цепью, состоящей из 127–130 аминокислотных остатков. В настоящий момент изучено множество материалов, которые свидетельствуют о регуляции иммунных и метаболических процессов лизоцимом [1]. Установлено, что он инициирует синтез лимфокинов, которые участвуют в дифференцировке и регуляции роста клеток, и обладает бактериолитическим эффектом [2]. Это подтверждается тесной анатомо-физиологической связью лизоцима с зонами, где интенсивно протекают процессы метаболизма, осуществляется активное клеточное деление. Сам лизоцим также имеет большое значение в регуляции и контроле дифференцировки тканей [3]. Учитывая его важность в работе гуморального врожденного неспецифического иммунитета, а также подверженность действию факторов внешней и внутренней среды, мы провели исследование и обобщили современные данные по изменению активности лизоцима в различных условиях.
Цель исследования: научный поиск роли лизоцима как компонента врожденного иммунитета и диагностикума различных патологий.
Лизоцим (муромидаза) — гуморальный фактор врожденного иммунитета, фермент лизосомального происхождения лейкоцитов крови (рис. 1).
Рис. 1. Молекула лизоцима
Молекула лизоцима обладает бактериолитическим эффектом за счет расщепления β-1,4-гликозидной связи между N-ацетилглюкозамином (рис. 2) и N-ацетилмурамовой кислотой (рис. 3), которые являются основными компонентами клеточной стенки бактерий. В результате расщепления этой связи изменяется проницаемость клеточной стенки [1, 4]. В первую очередь лизоцим обнаруживается в слюне, грудном молоке, слизи носоглотки, слёзной жидкости, слизистой оболочке желудочно-кишечного тракта и т.д. Лизоцим в большом количестве содержится в слюне, это объясняет ее антибактериальные свойства. Его основной источник — макрофаги/моноциты, нейтрофилы, поэтому он постоянно присутствует в организме. В плазме крови концентрация лизоцима обычно составляет от 4 до 13 мг/л, а в моче у здоровых лиц обнаруживаются только следы. Концентрация лизоцима также весьма высока в грудном молоке человека (около 400 мг/л). В сутки у здорового человека синтезируется около 500 мг лизоцима, однако в плазме крови он находится непродолжительное время, так как выводится почками на 75% в течение 1 ч. Превышение уровня лизоцима в плазме и моче может наблюдаться при ряде патологических состояний и находится под мониторингом в течение нескольких лет, так как может быть возможным маркером моноцитарного лейкоза. Превышение концентрации также может иметь место у людей, страдающих миелопролиферативными расстройствами: так, при нормальной функции почек у них производство лизоцима увеличивается до 4 раз [4].
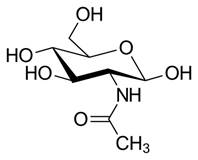
Рис. 2. N-ацетилглюкозамин
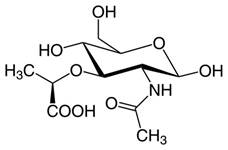
Рис. 3. N-ацетилмурамовая кислота
Кроме оказания бактерицидного и бактериостатического эффекта, лизоцим усиливает хемотаксис, обладает противовоспалительным действием, сорбционными свойствами в отношении микрофлоры, способствует репарации тканей, способен нейтрализовать некоторые микробные токсины, повышает фагоцитарную активность лейкоцитов, активирует комплемент и стимулирует антителогенез.

Рис. 4. П.Н. Лащенков

Рис. 5. А. Флеминг
В 1965 г. Дэвид Чилтон Филлипс методом рентгеновской кристаллографии получил первую модель лизоцима. Он стал вторым белком и первой ферментной структурой, которая была установлена с помощью рентгеновской кристаллографии. Также лизоцим стал первым изученным ферментом, который содержал все 20 стандартных аминокислот [6].
О.В. Чахов в 1965 г. обнаружил, что у здорового человека концентрация лизоцима находится в постоянстве [7]. В 1968 г. Н.А. Жуковской установил, что за счет распада клеток-продуцентов происходит поддержание базального уровня лизоцима [8]. А.Н. Маянский в своей работе в 1983 г. описал, что поддержание уровня лизоцима связано не только с высвобождением лизоцима из разрушенных клеток, но и с продукцией и выделением его из неповрежденных клеток [9].
D. Donaldson в 1974 г. вместе с соавторами доказал, что если удалить лизоцим из крови, то это снизит ее бактерицидные свойства на 49% [10]. О.В. Бухарин в своих исследованиях показал, что уровень лизоцима наглядно отображает состояние врожденного иммунитета у человека [2].
Callewaert L. и соавторы в 2010 г. на основе аминокислотной последовательности и биохимических свойств описали 3 типа лизоцима: C-тип (куриный), G-тип (гусиный), и I-тип (беспозвоночных). Лизоцимы C-типа преимущественно присутствуют у хордовых и у разных классов членистоногих. Лизоцимы G-типа обнаружены у представителей хордовых и у некоторых двустворчатых моллюсков. Беспозвоночные, как известно, продуцируют лизоцимы I-типа. Лизоцим у млекопитающих был обнаружен в изобилии в крови и печени, в секретах, включая слёзы, мочу, слюну и молоко, на поверхностях слизистой оболочки (где он может достигать концентраций до 1 мг/мл) и в фагоцитах, в том числе в макрофагах, нейтрофилах и дендритных клетках [11].
В настоящее время лизоцим имеет большое значение в стоматологии, так как он используется для лечения и оценки эффективности лечения, являясь интегральным показателем неспецифической резистентности организма. Пародонтологическое лечение зависит от состояния неспецифической защиты полости рта [12, 13, 14]. У пациентов с общесоматической патологией, имеющих благоприятное состояние интегрального показателя неспецифической резистентности организма, отмечена более высокая эффективность комплексного лечения пародонтита и лечения инфекционно-воспалительных заболеваний слизистой оболочки полости рта, десен и гортани: стоматита, афтозных изъязвлений, катаральных явлений верхних отделов дыхательных путей, эрозии слизистой оболочки полости рта различной этиологии, гингивита, герпетических поражений слизистой оболочки полости рта [15, 16].
Созданы зубные пасты для лечения острого очагового пульпита, в состав которых входит лизоцим. Они имеют высокую проникающую способность и стимулируют репаративные процессы пульпы зуба, а также обладают обезболивающим, выраженным противовоспалительным и антисептическим действием 17.
Разработаны пасты, в состав которых входят, помимо лизоцима, лизаты бактерий. Они увеличивают содержание лизоцима слюны и количество иммунокомпетентных клеток в ней, активируют фагоцитоз [20].
Созданы ополаскиватели для рта с лизоцимом для больных, находящихся в критическом состоянии в отделениях реанимации и интенсивной терапии в условиях искусственной вентиляции легких. Такие пациенты входят в зону риска развития внутрибольничной пневмонии. А ополаскиватели с лизоцимом предотвращают развитие инфекции [22, 23].
Лизоцим может быть диагностическим показателем в слюне, изменяемым под действием патогенных факторов окружающей среды. Он служит критерием реактивности организма, который показывает угнетение тканевых бактерицидных субстанций и напряжение адаптационных и гомеостатических резервов, является отражением состояния здоровья [24].
По результатам исследований ученых Университета Лимерика лизоцим обладает пьезоэлектрической активностью в моноклинной и тетрагональной фазах. Она в несколько раз выше, чем у основного пьезоэлектрика кварца, что позволяет использовать лизоцим в генерации электрических зарядов в клетках. Это означает, что лизоцим можно применять в качестве батареи в работе кардиостимуляторов и для генерации электрических сигналов при стимуляции нервных окончаний непосредственно в организме [26].
Лизоцим активно используется в современной пищевой промышленности, поскольку является натуральным консервантом. Благодаря своей эффективности в устранении маслянокислых бактерий наиболее часто он применяется при изготовлении сыров, технология производства которых требует длительного созревания 27.
Кроме того, производятся лечебно-профилактические сыры. Они содержат, помимо лизоцима, бифидобактерии и пребиотик из лактулозы. Эти сыры используют при лечении дисбактериоза у детей с гастродуоденитами и дисфункциями кишечника, а также у детей с острым миелобластным и лимфобластным лейкозом в стадии ремиссии.
В сочетании с химиотерапией лизоцим предотвращает резкое снижение содержания бифидобактерий и способствует элиминации условно-патогенной микрофлоры кишечника [30].
Лизоцим способен инактивировать изоантигены, которые имеют в составе гликопротеины и гликозаминогликаны. Изоантигенами в естественных условиях являются все виды опухолей. Их инактивация происходит путем расщепления полисахаридной цепи мурамина клеточных мембран, включая цитолемму [31]. Снижение уровня лизоцима, который способен инактивировать изоантигены, способствует развитию опухолевого процесса. При онкологических заболеваниях дефицит эндогенного фермента определяется в сыворотке крови при дифференциальной диагностике пигментных новообразований глаза. В эксперименте на крысах при лимфосаркоме наблюдалось снижение уровня лизоцима в периферической крови, а у большинства онкологических больных отмечается снижение всех показателей фагоцитарной активности [32]. Дефицит эндогенного лизоцима, несмотря на многофакторность развития онкологического процесса, служит одним из условий, способствующих возникновению и прогрессированию опухолевого образования.
Исследовано влияние острой соматической боли на уровень лизоцима у взрослых крыс. После нанесения раздражителя уже через 2 минуты увеличивается активность лизоцима в периферической крови, а через 3 часа после начала эксперимента наблюдается медленное снижение. Это можно объяснить всплеском активности лизоцима как ответной реакцией на болевое раздражение, а впоследствии наступают стадия рефрактерности клеток-продуцентов и катаболизм лизоцима, находящегося в крови [33, 34].
Выводы. В ходе анализа литературы и исследований, проведенных на базе кафедры патологической физиологии Ростовского государственного медицинского университета, были рассмотрены историческая направленность изучений лизоцима, а также современные векторы научного поиска роли лизоцима как компонента врожденного иммунитета и диагностикума различных патологий.
Инфекционно-воспалительные заболевания верхних дыхательных путей (ВДП) являются наиболее распространенными среди заболеваний органов дыхания. Среди ведущих проблем в терапии инфекционного воспаления слизистой ВДП выделяют разнообразие инфекционных агентов, формирование биопленок, угнетение нормальной микрофлоры, отсутствие возможностей проведения точного, быстрого лабораторного анализа спектра микробиоты слизистой оболочки ВДП, риск развития суперинфекции и осложнений на фоне лечения химическими антисептиками и антибактериальными препаратами. Все это диктует необходимость более тщательного и рационального подхода к выбору терапии инфекционно-воспалительных заболеваний ВДП, в частности, с использованием препаратов, сохраняющих собственную микрофлору, являющуюся фактором мукозального иммунитета, и имеющих широкий спектр действия на различные патогены. Организм человека вырабатывает многочисленные противомикробные факторы, которые могут уменьшить влияние колонизирующих организмов.. Одним из этих противомикробных факторов является естественный антисептик лизоцим, который обнаруживается в высоких концентрациях в жидкостях на поверхности слизистых оболочек.. Результаты проведенных клинических и лабораторных исследований доказали эффективность лизоцимсодержащих препаратов, что увеличивает перспективы их более широкого применения в педиатрической практике.
Ключевые слова: лизоцим, пиридоксин, бактерии, вирусы, респираторные инфекции, биопленки, тонзиллофарингит, микробиом.
Для цитирования: Мухортых В.А. Рациональный подход к терапии при инфекционно-воспалительных заболеваниях верхних дыхательных путей в детском возрасте. РМЖ. Медицинское обозрение. 2021;5(11):755-761. DOI: 10.32364/2587-6821-2021-5-11-755-761.
V.A. Mukhortykh
Federal Research Center for Nutrition & Biotechnology, Moscow, Russian Federation
Infectious inflammatory diseases of the upper respiratory airways are the most common among respiratory disorders. Issues in the management of infectious inflammation in upper airway mucosa are the diversity of infective agents, generation of biofilms, suppression of normal microflora, the lack of accurate and rapid laboratory tests for the analysis of the microbiota of upper airway mucosa, the risk of superinfection and complications after treatment with chemical antiseptics and antibacterial drugs. All these factors underscore the need for a more careful and rational approach to selecting therapy for the upper respiratory airways’ infectious inflammatory diseases, particularly preparations that preserve human microflora (a factor of mucosal immunity) and are characterized by a broad spectrum of activity on various pathogens. In addition, the human organism produces a variety of antimicrobial factors that relieve the burden of colonizing microbes. One of these antimicrobial factors, lysozyme, is a natural antiseptic found in high concentrations in fluids on mucosal surfaces. The results of clinical and laboratory studies have proven the effectiveness of lysozyme-containing drugs, which increases the prospects for their wider application in pediatric practice.
Keywords: lysozyme, pyridoxine, bacteria, viruses, respiratory infections, biofilms, tonsillopharyngitis, microbiome.
For citation: Mukhortykh V.A. The rational treatment approach to infectious inflammatory diseases of the upper respiratory airways in children. Russian Medical Inquiry. 2021;5(11):–761 (in Russ.). DOI: 10.32364/2587-6821-2021-5-11-755-761.
Введение
Инфекционно-воспалительные заболевания верхних дыхательных путей (ВДП) являются наиболее распространенными среди заболеваний органов дыхания и занимают одну из лидирующих позиций в структуре общей заболеваемости [1]. Инфекции ВДП, включая назофарингит, фарингит, тонзиллит и средний отит, составляют до 87,5% от общего числа случаев респираторных инфекций. Основными возбудителями инфекций ВДП являются вирусы, тропные к респираторному эпителию, инфицирование которыми в дальнейшем предрасполагает к развитию вторичной бактериальной инфекции, имеющей более тяжелое клиническое течение. Вирус внедряется в организм через клетки слизистой оболочки носоглотки и ротоглотки, являющиеся входными воротами для инфекции.
Развитию инфекции в ВДП способствуют высокие контагиозность, патогенность, вирулентность вирусов, бактериальная суперинфекция с образованием биопленок, с одной стороны, и/или недостаточность иммунного ответа — с другой. Наибольшему риску заболеваемости подвержены дети ввиду незрелости и нестабильности их иммунной системы.
В осенне-зимние месяцы возникают эпидемии респираторных вирусных инфекций. Внешние факторы, способствующие сезонности респираторных вирусных инфекций, известны давно. Двумя основными факторами, способствующими сезонности вирусных инфекций, являются изменения параметров окружающей среды (температура, влажность) и социальное поведение человека [2, 3].
Выделяют различные факторы, предрасполагающие к развитию инфекции в ВДП. В последние годы также было показано, что загрязнение воздуха вызывает окислительный стресс в организме, что приводит к образованию свободных радикалов, которые, в свою очередь, могут повреждать дыхательную систему, снижая устойчивость к вирусным и бактериальным инфекциям [4]. Кроме того, дефицит витаминов A, B6, B12, фолиевой кислоты, C, D, E и микроэлементов цинка, селена, меди, магния играет важную роль в иммунной системе, увеличивает восприимчивость к инфекционным заболеваниям [5]. В результате происходит снижение защитного барьера слизистых оболочек дыхательных путей, врожденного иммунитета. Считается, что аллергические заболевания играют особую роль в стимулировании рецидива инфекционно-воспалительных заболеваний ВДП, поскольку у пациентов с аллергией нарушается физиологический иммунный ответ, а аллергическое воспаление способствует предрасположенности к инфекциям [6]. К другим предрасполагающим факторам можно отнести социальные факторы: сокращение времени прогулок на свежем воздухе, пассивное курение, раннее посещение детских дошкольных учреждений, стрессовые факторы. Совокупность триггеров приводит к изменениям врожденного иммунитета, играющего главенствующую роль в защите от инфекций у детей. Установлено, что при нарушении динамического равновесия между организмом и окружающей средой происходит резкое снижение уровня эндогенного белка лизоцима, естественного противомикробного фактора слизистых оболочек полости рта и глотки [7].
Сложности терапии инфекций ВДП у детей
Применение противовирусных препаратов и иммуномодулирующих средств, по имеющимся на сегодняшний день сведениям о результатах лечения инфекционно-воспалительных заболеваний ВДП у детей, не позволяет сделать однозначный вывод об их эффективности/неэффективности, безопасности и переносимости. Арсенал средств, используемых для лечения респираторных заболеваний вирусной этиологии у детей, ограничен.. Противовирусные средства действуют избирательно.. Появляются штаммы вирусов, формирующие резистентность к противовирусным препаратам [8]. Следует также обратить внимание на то, что показанием к назначению иммуномодуляторов является наличие клинических признаков иммунной недостаточности (повышенная инфекционная заболеваемость и отсутствие эффекта от стандартной фармакотерапии). Наличие только сниженных показателей в иммунограмме, без клинических проявлений иммунодефицита, не требует назначения иммуномодуляторов, а является основанием для повторного исследования показателей иммунного статуса с целью уточнения природы выявленных изменений. Нередко при повторном исследовании иммунного статуса все показатели оказываются нормальными, поскольку даже у здоровых людей возможны транзиторные снижения параметров иммунной системы [9].
Сложности терапии связаны также с малообоснованным назначением антибактериальных препаратов, образованием бактериальных микропленок, особенностями несформированного иммунитета в детском возрасте. По данным исследований, при инфекционных заболеваниях ВДП антибиотики назначают в 20% случаев [10]. Следует отметить, что именно антибиотики являются практически единственной группой лекарственных средств, которая почти в 50% случаев применяется нерационально и необоснованно [11]. Последствия необоснованного назначения антибиотиков хорошо известны [12] и включают рост резистентности микроорганизмов [13], риск развития побочных эффектов и неблагоприятное соотношение пользы и риска, а также увеличение затрат на лечение [14]. Показано, что такое применение антибактериальных препаратов значительно влияет на состав микробного сообщества за счет уменьшения микробного разнообразия. Нарушение микробного сообщества ВДП приводит к увеличению количества грамотрицательных бактерий (Burkholderia spp., Comamonadaceae, Bradyrhizobiaceae и Enterobacteriaceae), а также Moraxella catarrhalis, Haemophilus influenzae, Streptococcus pneumoniae, с которыми связаны частые респираторные инфекции [15, 16]. В нормальных условиях эти бактерии не могут конкурировать в своей биологической нише, но из-за устойчивости к антибиотикам (например, H. influenzae и Chlamydia pneumoniae демонстрируют устойчивость к β-лактамным антибиотикам; S. pneumoniae — к аминогликозидам, фторхинолонам и β-лактамным антибиотикам) они способны колонизировать слизистую оболочку при лечении антибиотиками, становиться патогенными [17, 18] и вызывать суперинфекцию ВДП. Напротив, изобилие известных комменсалов, таких как Dolosigranulum и Corynebacterium, которые связаны со снижением риска инфицирования ВДП и стабильностью микробиоты, на фоне лечения антибиотиками снижается [19, 20].
В последние годы серьезную озабоченность вызывают заболевания ВДП, сопровождающиеся образованием бактериальных микропленок, включая заболевания среднего уха, риносинусит и фаринготонзиллит [21, 22]. Биопленки — это стратегический способ выживания, созданный бактериями, и основная причина их устойчивости к системной антибиотикотерапии [23]. Значительное присутствие биопленок было продемонстрировано у детей, страдающих рецидивирующими инфекциями ВДП [24]. Биопленки могут время от времени выделять многочисленные бактериальные колонии, вызывающие рецидив респираторных инфекций [25], что приводит к сложностям с подбором адекватной этиотропной терапии.
Основными особенностями инфекционного воспаления ВДП у детей являются: разнообразие инфекционных агентов, угнетение нормальной микрофлоры и нарушение микробиоценоза, отсутствие точного и быстрого лабораторного анализа спектра микробиоты слизистой оболочки ВДП, бактериальные биопленки, а также риски развития суперинфекции и осложнений на фоне терапии антибиотиками и химическими антисептиками, подавляющими рост комменсалов [33, 34]. Немаловажную роль играет незрелость иммунной системы. Отсюда вытекают основные требования к препаратам для местного применения: широкий спектр действия на патогенную микрофлору, воздействие на биопленки, способствующий повышению мукозального иммунитета эффект, отсутствие резистентности, быстрое купирование клинических симптомов, восстановление качества жизни, снижение риска суперинфекции и риска осложнений, а также хорошая переносимость и безопасность. В связи с этим проблема выбора адекватной и обоснованной терапии инфекционно-воспалительных заболеваний ВДП не утрачивает актуальности для врачей различных специальностей (оториноларингологов, педиатров, терапевтов, аллергологов), что диктует необходимость более тщательного и рационального подхода к выбору терапии инфекционно-воспалительных заболеваний ВДП.
Отдельно стоит отметить сложности или ошибки в этиотропной терапии, в частности сложности с быстрой диагностикой конкретного инфекционного агента, вызвавшего заболевание, спектра микробиоты, участвующей в формировании мукозального иммунитета, неоправданное или несвоевременное назначение антибактериальных препаратов.
Современный подход к терапии антисептическими средствами, содержащими лизоцим
Роль лизоцима в местном иммунитете
Организм человека вырабатывает многочисленные противомикробные факторы, которые могут уменьшить влияние колонизирующих микроорганизмов.. Одним из них является естественный антисептик лизоцим, который обнаруживается в жидкостях организма и на поверхности слизистых оболочек [35]. Лизоцим продуцируется эпителием и является основным компонентом гранул нейтрофилов, которые могут быть задействованы при остром воспалении слизистой оболочки [36–38]. Лизоцим оказывает противовирусное действие, снижая абсорбцию вируса и его проникновение в клетки-мишени, связывает вирусные ДНК/РНК и подавляет репликацию вирусов.. Являясь эволюционно древней и консервативной молекулой врожденного иммунитета, он имеет разный по молекулярным механизмам, но универсальный противовирусный эффект в отношении различных вирусов [39]. Лизоцим обладает различными антибактериальными свойствами [40, 41]. Его ферментативная мурамидазная активность гидролизует β-1,4-гликозидную связь между N-ацетилглюкозамином и N-ацетилмурамовой кислотой, дисахаридными остатками основной цепи пептидогликана (ПГ). При этом образуется мурамилдипептид — мощный природный стимулятор иммунитета. Гидролиз нитей гликана приводит к разрушению клеточной стенки и бактериальному лизису. Кроме того, лизоцим обладает высокой катионностью и может уничтожать определенные бактерии независимо от гидролитической активности ПГ [41, 42], вызывая образование пор на мембране бактериальной клетки, с ее последующей осмотической гибелью, а также увеличивая проницаемость мембран для других антибактериальных и противомикробных средств. Таким образом, сочетание ферментативного и катионного механизма уничтожения бактерий снижает вероятность полного ускользания патогенных бактерий от антибактериального действия лизоцима и формирования к нему резистентности [39]. Показано, что лизоцим модулирует иммунный ответ хозяина на инфекцию. Опосредованное переваривание лизоцимом ПГ приводит к активации множества семейств рецепторов врожденного иммунитета, которые стимулируют провоспалительные реакции. Локализация проявления активности лизоцима (особенно внутриклеточного), чувствительность ПГ к перевариванию лизоцимом, а также количество и состав факторов, высвобождаемых в результате, — все это модулирует активацию врожденного иммунитета [43–45]. Хотя лизоцим важен для стимулирования провоспалительного ответа, он также играет роль в системном ограничении воспаления на участках слизистой оболочки, что приводит к уменьшению патологического процесса, вызванного воспалением [40, 42]. Лизоцим разными способами снижает окислительный стресс, способствует устранению воспаления, вызванного фагоцитами. Лизоцим играет важную роль в ограничении роста бактерий на слизистых оболочках, где он может не только контролировать потенциально патогенные бактерии, но и ограничивать чрезмерный рост микробиоты для предотвращения дисбактериоза. Внеклеточный лизоцим также расщепляет мультимерные ПГ на растворимые фрагменты, которые активируют рецепторы NOD в эпителиальных клетках слизистой оболочки, что приводит к секреции хемотаксических и активирующих факторов для нейтрофилов и макрофагов.. Эти фагоциты поглощают бактерии в фагосомы, содержащие лизоцим и другие ферменты деградации, которые высвобождают фрагменты ПГ и другие молекулярные структуры, связанные с микробами, и дополнительно активизируют провоспалительные пути [46, 47]. В недавних исследованиях было продемонстрировано свойство лизоцима подавлять способность к образованию биопленок у многих видов бактерий (метициллин-чувствительные и метициллин-резистентные S. aureus, Streptococcus pyogenes, Pseudomonas aeruginosa и др.) [48–50]. Так, например, низкие концентрации лизоцима могут быть полезны для предотвращения образования биопленок грамотрицательными бактериями, такими как Escherichia coli и Klebsiella pneumoniae [51]. В отношении Candida albicans было показано дозозависимое действие на биопленки: ингибирующий эффект лизоцима наблюдался при концентрациях 1000 мкг/мл усиливали рост биопленок [49].
Клиническая эффективность лизоцимсодержащих препаратов
Эффективность данного препарата продемонстрирована в лечении пациентов с острыми инфекциями ВДП [7, 53] и реабилитации часто болеющих детей при респираторных заболеваниях [54]. Особое значение приобретает использование этого препарата при обострениях хронических тонзиллитов и фарингитов [55–57]. Включение лизоцимсодержащего препарата в общепринятую терапию хронического аденоидита и экссудативного среднего отита у детей способствовало выраженному снижению содержания патогенных микроорганизмов и росту облигатной микрофлоры слизистой оболочки носоглотки, снижению клинических симптомов уже через 10 сут, особенно ринореи и снижения слуха, в основной группе в сравнении с контрольной группой, получавшей традиционное лечение [58]. По данным Г.Н. Никифоровой и соавт. [57], Лизобакт ® способствует купированию воспалительного процесса и предупреждению бактериального суперинфицирования: через 8 сут после начала лечения в основной группе, получавшей лизоцимсодержащий препарат, в 77% случаев не было обнаружено новых патогенов, тогда как в контрольной группе новый патоген не обнаружили в 53% случаев. В ряде исследований отмечалась достоверная нормализация уровня секреторного IgA, что свидетельствует об иммуномодулирующем влиянии препарата на слизистую оболочку [7].
Заключение
Таким образом, включение лизоцимсодержащего препарата Лизобакт ® в комплексную терапию инфекционно-воспалительных заболеваний ВДП повышает ее эффективность.. Препарат Лизобакт ® способствует нормализации микробиоценоза слизистых оболочек при инфекциях ВДП у детей, не вызывая резистентности микроорганизмов к лечению, предупреждает суперинфекцию и развитие осложнений. Все перечисленное позволяет включить данный препарат в комплексную терапию инфекционно-воспалительных заболеваний ВДП в детском возрасте.
Благодарность
Acknowledgements
The technical edition is supported by JSC "Bosnalijek".
Сведения об авторе:
Прозрачность финансовой деятельности: автор не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует..
Статья поступила 17.08.2021.
Поступила после рецензирования 09.09.2021.
Принята в печать 04.10.2021.
About the author:
Valeriy A. Mukhortykh — C. Sc. (Med.), junior researcher, Federal Research Center for Nutrition & Biotechnology, 21, Kashirskoe road, Moscow, 115446, Russian Federation; ORCID iD 0000-0001-8549-9493.
There is no conflict of interests.
Received 17.08.2021.
Revised 09.09.2021.
Accepted 04.10.2021.
Читайте также:

