Влияние ферментов на вирусы
Обновлено: 18.04.2024
Современная стратегия и тактика терапии инфекционных болезней в большинстве случаев предусматривают комплексное лечение больных с использованием разнообразных этиотропных средств, иммуноориентированной и иных видов патогенетической терапии и симптоматиче
Современная стратегия и тактика терапии инфекционных болезней в большинстве случаев предусматривают комплексное лечение больных с использованием разнообразных этиотропных средств, иммуноориентированной и иных видов патогенетической терапии и симптоматической терапии.
Этими соображениями в свое время была вызвана необходимость поиска, изучения и внедрения в повседневную практику вспомогательных средств обеспечения и усиления основного лечения, так называемой сервис- и бустер-терапии.
В последние годы в этом качестве с большим успехом стала широко использоваться системная энзимотерапия (СЭТ). Разнообразие полезных свойств полиферментных препаратов вобэнзима, флогэнзима и вобэ-мугоса — противовоспалительный, противоотечный, анальгезирующий, фибринолитический, иммуномодулирующий, реологический эффекты — позволяет использовать их в комплексном лечении очень широкого круга заболеваний.
Разработанный М. Вольфом и К. Рансбергером более 40 лет назад первый препарат для системной энзимотерапии — вобэнзим — содержит протеолитические ферменты, которые способны эффективно воздействовать на самые разные физиологические и патофизиологические процессы в организме.
В большинстве случаев при лечении инфекционных больных используется этиотропная терапия антибактериальными, противовирусными, антимикотическими, антипротозойными и прочими средствами. Можно добиться усиления их воздействия на инфекционный агент (бустер-терапия), создания лучших условий для их работы и/или специального обеспечения, в том числе уменьшения выраженности, вплоть до полного устранения побочного действия лекарств (сервис-терапия), путем использования полиферментных препаратов.
Главные механизмы интегрального клинического потенцирования действия этиотропных препаратов (А. П. Ремезов, Г. Ю. Кнорринг) перечислены ниже.
Бустер-эффекты
- Улучшение условий доставки этиотропных препаратов вследствие обеспечения всасывания, улучшения микроциркуляции крови, в том числе в очаге воспаления, конкурентного взаимодействия с транспортными белками крови — a-2-макроглобулином и прочими, усиления некролиза, расщепления детрита в очаге воспаления, т. е. усиления эффекта санации; эффект очищения клеточной мембраны как клетки-хозяина (носителя), так и возбудителя, увеличение проницаемости мембран.
- Улучшение доступности рецепторного аппарата клетки-носителя и возбудителя (особенно важно для некоторых противовирусных средств).
- Снижение кислотности среды в очаге воспаления, особенно — в полостях, улучшающие условия для работы антибиотиков.
Сервис-эффекты
- Снижение выраженности побочных эффектов этиотропных препаратов.
- Уменьшение токсичности, гепатопротекция, уменьшение выраженности вторичного (ятрогенного) МДК.
- Уменьшение частоты и/или выраженности флатуленции, метеоризма, тошноты, болей в животе, диареи, кожного зуда, фотодерматита и других эссенциальных побочных эффектов антибиотикотерапии.
В первую очередь, полиферментные средства существенно повышают концентрацию антибактериальных препаратов в крови (см. рисунок 1).
Еще одним важным обоснованием применения СЭТ в терапии инфекционных болезней является прямое участие полиферментных препаратов в разносторонней функции желудочно-кишечного тракта. Во-первых, полиферментные системы как пищеварительный агент (прежде всего — папаин, бромелаин) активны в толстой кишке, где рН среды смещен в кислую сторону. Тем самым обеспечивается глубокий протеолиз белков и гликопротеидов, что, по-видимому, лишает условно-патогенные (и патогенные) микробы условий для роста и пищевых субстратов, в то время как неприхотливые компоненты нормальной, сбалансированной микробиоценотической системы кишечника (например, микробы-сахаролитики) не нуждаются в белках для своей жизнедеятельности. Во-вторых, иммуномодулирующие свойства полиферментного препарата, прежде всего стимуляция макрофагов, позволяют противостоять антигенной гиперстимуляции с последующим истощением иммунитета. В-третьих, в условиях углубляющегося микробиоценотического дисбаланса кишечника нарастающий эндо- и экзотоксикоз приводит к сенсибилизации организма и создает риск возникновения и развития пищевой аллергии.
К настоящему времени накоплено достаточно много сведений, касающихся влияния энзимов на иммунную систему, что позволяет комплементарно использовать их в схемах иммуноориентированной терапии.
Наконец, еще одно из довольно давно описанных свойств системных полиэнзимных препаратов — перекисное окисление липидов и протеинов — лежит в основе многочисленных метаболических эффектов, которые уже начали использовать в лечении вирусных гепатитов, гиперлипидемии, а также при детоксикации.
В конце 70-х — начале 80-х гг. XX века в клинических исследованиях неоднократно использовалась способность энзимов повышать концентрацию антибиотиков в крови, облегчать их проникновение в ткани и тем самым повышать эффективность лечения.
В 80-х и 90-х гг. было проведено большое количество клинических исследований, в которых чаще всего сравнивалась эффективность препаратов вобэ-мугос и ацикловир при опоясывающем герпесе (Scheef, Konig, Ahumada, Kleine, Klaschka, Mendoza, Billingham). Большинство исследований продемонстрировало равную эффективность этих препаратов, однако после применения препарата вобэ-мугос как побочные нежелательные эффекты, так и последующие невралгии появлялись реже, чем в случае с ацикловиром. Успехи энзимотерапии при опоясывающем герпесе (herpes zoster) дали импульс к применению ее в лечении инфекций, вызванных вирусом herpes simplex 1 и 2 типа.
Благоприятные воздействия препаратов СЭТ вместе с их минимальными побочными действиями подвигли Stauder и Kabil (1997) к тому, чтобы использовать флогэнзим в комплексной терапии хронического вирусного гепатита С с высокоактивной вирусной репликацией. Эффективность такого лечения существенно превышала действенность терапии только интерфероном или только рибаверином. При этом элиминация вируса по результатам ПЦР достигла 50%. Hartman и Mikazans (1996) использовали комплексную терапию гонореи антибиотиками с вобэнзимом. Сравнение лабораторных и клинических результатов исследования однозначно говорят в пользу группы, получавшей комплексную терапию антибиотиками и вобэнзимом: произошла существенная нормализация количества Т-лимфоцитов и их подгрупп, пришел к норме индекс CD4+/CD8+, и приблизилась к норме концентрация ИК. Вобэнзим повышает терапевтическую эффективность традиционного лечения тяжелых форм гонореи.
Успех работы проф. Т. Г. Сухих соавтор. (1997), посвященной использованию вобэнзима в терапии некоторых инфекций, передающихся половым путем (ИППП), побудил Mikazans и Hartman (1996) взяться за проверку эффективности препарата в лечении синдрома Рейтера, при этом результаты исследования оказались положительными.
Недавно было предложено использовать вобэнзим для того, чтобы облегчить выявление некоторых ИППП. Его разжижающее действие на секреты дополнительных половых желез улучшает отток секретов и ускоряет появление возбудителей ИППП на слизистых (А. Д. Юцковский, 2002).
В ряде работ последних лет также показана возможность потенцирования вобэнзимом эффективности применения СЭТ в терапии некоторых инфекций: А. А. Хрянин (1999–2001) — урогенитальные инфекции; А. М. Лила соавт. (2000) — реактивные артриты; С. Н. Калинина, О. Л. Тиктинский соавт. (2002) — урогенитальные инфекции; В. Н. Ткачук соавт. (2000) — пиелонефриты; Н. В. Стрижова соавт. (2000-2001) — хронические сальпингоофориты; А. К. Мирзабалаева (2002) — актиномикоз гениталий; Ю. А. Спесивцев соавт. (2001) — гнойно-септические заболевания и многих других авторов.
Нами в цикле работ 1996–2003 гг. также была выявлена высокая эффективность СЭТ в комплексной терапии целого ряда инфекционных заболеваний: хламидийной, герпесвирусной, иерсиниозной инфекций.
Для исследования были выбраны 200 больных с ХИ, 200 больных с ПГГ, а также по 45 пациентов с острым иерсиниозным мезаденитом и острым иерсиниозным артритом в возрасте от 18 до 45 лет. В двух группах в каждую из которых входили по 150 пациентов с ХИ и ПГГ, а также в двух группах, включавших по 30 пациентов с иерсиниозным мезаденитом и артритом, в составе комплексной терапии назначался вобэнзим в дозе 10 таблеток три раза в день за 40 мин до еды с достаточным количеством воды. В двух других группах, включавших по 50 больных с ХИ или ПГГ каждая, а также в группах, в которые входили по 15 пациентов с иерсиниозным мезадентом и артритом, проводилось аналогичное комплексное лечение, но без использования вобэнзима. Эти группы рассматривались как контрольные. В общей сложности у больных определялись 68 специальных показателей иммунитета. Было достоверно установлено, что использование вобэнзима дает выраженный многосторонний эффект: повышение качества жизни, увеличение эрадикации бактериальных возбудителей и сокращение сроков выделения ВПГ, снижение риска развития специфических урогенитальных и экстрагенитальных, а также неспецифических осложнений (простатита, вульвовагинита, хронических артропатий (хронических артритов), дисбактериоза, хронического мезаденита), а в случае их возникновения — существенно ускоряет выздоровление.
Таким образом, назначение СЭТ в комплексном лечении инфекционных больных обосновано следующими свойствами полиэнзимных препаратов:
- эффект потенцирования действия антибактериальных препаратов основных фармакологических групп — пенициллинов (в том числе полусинтетических), цефалоспоринов, аминогликозидов, линкозамидов, макролидов, тетрациклинов, фторхинолонов, производных имидазола и др. При этом влияние протеолитических энзимов, входящих в состав препаратов системной энзимотерапии, на концентрации, и в конечном итоге — на клиническую эффективность различных антибактериальных препаратов, следует признать неспецифическим. Т. е. речь идет об опосредованном влиянии на процессы всасывания и, возможно, транспорта антибиотиков, улучшении состояния микроциркуляторного русла в очаге воспаления;
- иммуномодулирующее действие препаратов системной энзимотерапии, в первую очередь, за счет увеличения количества и активации Т-лимфоцитов и NK-клеток, стимуляции процессов микробицидности, восстановления интерферон-продуцирующей функции лейкоцитов;
- уменьшение степени выраженности побочных эффектов от антибактериальной терапии, в том числе и дисбиотических изменений при комбинировании этих лекарственных средств с препаратами системной энзимотерапии.
Приведенные данные позволяют считать обоснованным включение препаратов системной энзимотерапии в комплексы лечения инфекционных больных, при этом для уточнения тонких механизмов потенцирования эффективности основной терапии, безусловно, требуются дальнейшие исследования.
По вопросам литературы обращайтесь в редакцию
А. П. Ремезов, кандидат медицинских наук
Г. Ю. Кнорринг, кандидат медицинских наук
Медицинская академия последипломного образования, Санкт-Петербург
Вирусы могут размножаться только внутри клетки-хозяина, перестраивая ее работу так, что клетка начинает производить новые вирусные частицы. Это серьезно нарушает работу самой клетки и в большинстве случаев ведет к ее гибели. Процесс проникновения и размножения вируса в ней сложный и содержит много стадий, но специальные лекарства могут блокировать его на различных этапах.
В случае с ВИЧ это выглядит так.
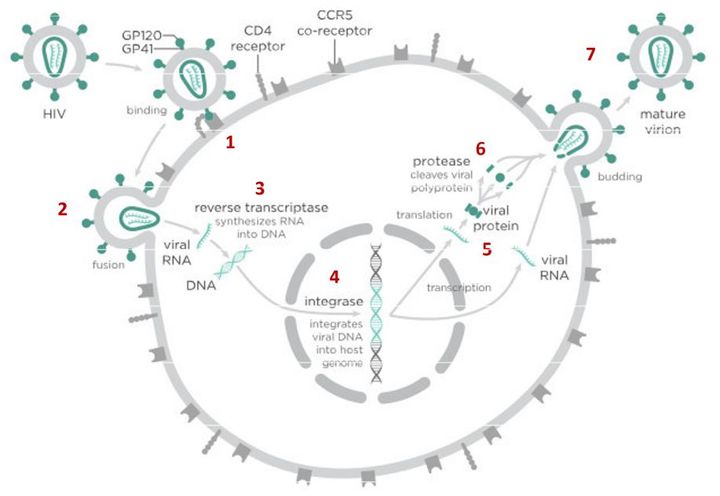
На первом этапе (цифра 1 на схеме) вирус проникает в клетку.
На этом этапе работает другой препарат против ВИЧ — маравирок. Молекула этого лекарства связывается с рецептором CCR5 и блокирует его, что не позволяет вирусу перейти к следующему этапу проникновения в клетку и останавливает заражение. Но у этого вещества есть недостаток — дело в том, что некоторые типы вируса иммунодефицита человека используют на втором этапе другой рецептор — CXCR4. Такому вирусу маравирок не помешает проникнуть в клетку.
(На этом видео можно увидеть как протекает этот и другие этапы репликации вируса в клетке)
После того как вирусная частица приклеилась к рецепторам CD4 и CCR5/CXCR4 и закрепилась на поверхности клетки, другой специальный белок вируса gp41 соединяет оболочку вируса с мембраной клетки-мишени и помогает вирусу проникнуть внутрь клетки (цифра 2 на схеме).
На этом этапе остановить вирус может другая группа препаратов — ингибиторы слияния, например, энфувиртид. Препарат связывается с вирусным белком gp41 и нарушает его работу.
Следующий важный этап (на схеме обозначен цифрой 3) — обратная транскрипция. Для того чтобы клетка начала производить вирусные частицы, вирус должен встроить свою генетическую информацию в ДНК клетки-хозяина.
На этом этапе размножение вируса блокирует очень большое количество препаратов из двух классов — нуклеозидные ингибиторы обратной транскриптазы (НИОТ — ламивудин, абакавир, тенофовир) и ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ — эфавиренз, рилпивирин).
Принцип действия у веществ из обеих групп похожий: молекула лекарства связывается с обратной транскриптазой вируса, нарушает ее работу и так блокирует перенос генов вируса из РНК в ДНК. Это не позволяет генам вируса встроиться в ДНК клетки-хозяина и начать производство новых вирусных частиц.
На следующем этапе инфицирования (цифра 4 на схеме) готовая вирусная ДНК проникает в ядро и встраивается в ДНК клетки-хозяина с помощью специального вирусного фермента — интегразы.
Работу этого фермента блокируют ингибиторы интегразы, например, долутегравир, не позволяя ДНК вируса встроиться в наши гены.
После того как вирусная ДНК встраивается в ДНК клетки-хозяина, клетка получает неправильную программу и начинает производить вирусные белки и РНК, необходимые для сборки новых частиц вируса (цифра 5 на схеме), используя для этого структуры, которые в норме производят собственные белки клетки. Такая перенастройка производства белка сильно нарушает работу клетки и через некоторое время вызывает ее гибель. Лекарств, которые бы влияли на этот этап размножения вируса, нет, так как здесь вирус использует собственные ферментные системы клетки-хозяина и блокирование их работы какими-то веществами навредит здоровым клеткам.
После синтеза вирусных белков клеткой-хозяином в работу вступает еще один фермент вируса — протеаза (цифра 6 на схеме). Дело в том, что белки ВИЧ синтезируются в виде длинных цепочек белков-предшественников, но они неактивные. Протеаза разрезает эти цепочки на более короткие фрагменты, которые становятся активными белками вируса: из одних собирается вирусная оболочка, другие выполняют функции ферментов (обратная транскриптаза, интеграза, протеаза, о которых мы говорили выше). Класс лекарств, нарушающих работу вирусной протеазы (ингибиторы протеазы), включает большое количество препаратов от достаточно старого лопинавира до современного дарунавира. Основной недостаток препаратов этого класса — высокая степень перекрестной устойчивости: если вирус приобретает устойчивость к одному препарату, скорее всего, на него не подействует ни один другой препарат из этого класса.
На последнем этапе (цифра 7 на схеме) вирусные частицы собираются из готовых компонентов (синтезированных клеткой вирусных белков и РНК), как конструктор, и покидают клетку-хозяина. Лекарств, которые бы тормозили эти процессы, пока не существует.
ВИЧ имеет высокую склонность к мутациям, что позволяет ему быстро приобретать устойчивость к лекарствам. Мутации изменяют форму молекул ферментов вируса. Если при этом форма изменится существенно, то фермент не сможет нормально работать и такой вирус размножаться перестанет — это вредная для вируса мутация. Однако в некоторых случаях — при полезных мутациях — форма молекулы фермента меняется не сильно, а так, что сам фермент продолжает нормально работать, но молекула лекарства уже не может с ним связаться.
Поэтому для эффективного подавления размножения ВИЧ обычно назначают три разных препарата из разных групп, влияющих на разные ферменты вируса, блокируя его воспроизводство на разных этапах. Исключением является группа ингибиторов обратной транскриптазы (НИОТ и ННИОТ) — эти лекарства связываются с разными участками молекулы вирусного фермента, поэтому могут назначаться вместе, несмотря на то, что относятся к одной группе. В условиях такой терапии вирусу очень трудно выработать устойчивость, потому что одновременно должно произойти несколько полезных мутаций в разных генах вируса, а это бывает крайне редко.
Есть несколько перспективных технологий, например, CRISPR/Cas9, которые могут позволить полностью удалить вирусную ДНК из организма человека, но пока ни одна из них не прошла все необходимые исследования для подтверждения эффективности и безопасности. Исследования продолжаются.

У РНК-содержащих ретровирусов сначала происходит обратная транскрипция генома в ДНК, затем ее интеграция в клеточные хромосомы и лишь после этого транскрипция генов.
Цитопатические эффекты при вирусных инфекциях разнообразны, они определяются как вирусом, так и клеткой и сводятся к разрушению клетки (цитолитический эффект), сосуществованию вируса и клетки без гибели последней (латентная и персистирующая инфекция) и трансформации клетки.
Вовлеченность организма в инфекционный процесс зависит от ряда обстоятельств - количества погибших клеток, токсичности вирусов и продуктов распада клеток, от реакций организма, начиная от рефлекторных и заканчивая иммунными. Количество погибших клеток влияет на тяжесть инфекционного процесса. Например, будут ли поражены при гриппе только клетки носа и трахеи или вирус поразит клетки эпителия альвеол, зависит тяжесть и исход болезни.
Хотя вирусы и не образуют типичных токсинов, однако и вирионы, и вирусные компоненты, накапливающиеся в пораженных тканях, выходя в кровоток, оказывают токсическое действие. Неменьшее токсическое действие оказывают и продукты распада клеток. В этом случае действие вирусной инфекции столь же неспецифично, как и действие патогенных организмов, убивающих клетки и вызывающих их аутолиз. Поступление токсинов в кровь вызывает ответную реакцию - лихорадку, воспаление, иммунный ответ. Лихорадка является преимущественно рефлекторным ответом на поступление в кровь и воздействие на ЦНС токсичных веществ.
Если лихорадка - общий ответ организма на вирусную инфекцию, то воспаление - это местная многокомпонентная реакция. При воспалении происходят инфильтрация пораженных тканей макрофагами, утилизация продуктов распада, репарация и регенерация. Одновременно развиваются реакции клеточного и гуморального иммунитета. На ранних стадиях инфекции действуют неспецифические киллеры и антитела класса IgM. Затем вступают в действие основные факторы гуморального и клеточного иммунитета. Однако гораздо раньше, уже в первые часы после заражения, начинает действовать система интерферона, представляющая семейство секреторных белков, вырабатываемых клетками организма в ответ на вирусы и другие стимулы. Описанные явления относятся к так называемой острой репродуктивной вирусной инфекции. Взаимодействие вируса и клеток может происходить, как отмечалось выше, без гибели последних. В этом случае говорят о латентной, т.е. бессимптомной или персистирующей хронической вирусной инфекции. Дальнейшая экспрессия вируса, образование вирусспецифических белков и вирионов вызывает синтез антител, на этой стадии латентная инфекция переходит в персистирующую и появляются первые признаки болезни.
Репродукция вируса в клетках сопровождается развитием цитопатических процессов, специфичных для разных вирусов и для разных типов инфекционных процессов. Цитопатические процессы при вирусных инфекциях разнообразны, они определяются как вирусом, так и клетками, причем специфика их больше "задается" клеткой, нежели вирусом, и сводится в основном к разрушению клеток, сосуществованию вируса и клеток без гибели последних и трансформация клеток. Несмотря на значительные различия цитоцидного действия разных вирусов, в общем, они сходны. Подавление синтеза клеточных макромолекул - нуклеиновых кислот и белков, а также истощение энергетических ресурсов клетки ведут к необратимым процессам, заканчивающимся гибелью пораженной клетки. Повреждение клеток вирусами, их отмирание и распад переносят вирусную инфекцию с клеточного уровня на уровень организма в целом.
При встрече организма с вирусной инфекцией продукция интерферона (растворимого фактора, вырабатываемого вирус-инфицированными клетками, способного индуцировать антивирусный статус в неинфицированных клетках) становится наиболее быстрой реакцией на заражение, формируя защитный барьер на пути вирусов намного раньше специфических защитных реакций иммунитета, стимулируя клеточную резистентность, - делая клетки непригодными для размножения вирусов.
Продукция и секреция цитокинов относятся к самым ранним событиям, сопутствующим взаимодействию микроорганизмов с макрофагами. Этот ранний неспецифический ответ на инфекцию важен по нескольким причинам: он развивается очень быстро, поскольку не связан с необходимостью накопления клона клеток, отвечающих на конкретный антиген; ранний цитокиновый ответ влияет на последующий специфический иммунный ответ.
Интерферон активирует макрофаги, которые затем синтезируют интерферон-гамма, ИЛ-1, 2, 4, 6, ФНО, в результате макрофаги приобретают способность лизировать вирус-инфицированные клетки.
Интерферон-гамма является специализированным индуктором активации макрофагов, который способен индуцировать экспрессию более 100 разных генов в геноме макрофага.
Продуцентами этой молекулы являются активированные Т-лимфоциты (Тh1-тип) и естественные киллеры (NK-клетки). Интерферон-гамма индуцирует и стимулирует продукцию провоспалительных цитокинов (ФНО, ИЛ-1, 6), экспрессию на мембранах макрофагов, антигенов МНС II; гамма-интерферон резко усиливает антимикробную и противовоспалительную активность путем повышения продукции клетками супероксидных радикалов, а усиление иммунного фагоцитоза и антителоопосредованной цитотоксичности макрофагов под влиянием гамма-интерферона связано с усилением экспрессии Fc-рецепторов для JgG. Активирующее действие интерферона-гамма на макрофаги опосредовано индукцией секреции этими клетками ФНО -альфа. Этот пик наблюдается совместно с ФНО-альфа. Максимум продукции ИЛ-4 наступает через 24-48 ч с момента активации клеток. При этом ИЛ-4 рассматривается как цитокин, ограничивающий иммуновоспалительные реакции и снижающий ответ организма на инфекцию, угнетая при этом экспрессию гамма-интерферона. Интерферон-гамма ин витро усиливает фагоцитарную активность нейтрофилов, что обусловлено усилением экспрессии Fc-рецепторов и поверхностных белков семейства интегринов на нейтрофилы. Это позволяет нейтрофилам осуществлять цитотоксические функции и фагоцитоз. В качестве основных эффекторных клеток воспалительного процесса, они обеспечивают элиминацию инфекта из организма.
Взаимодействие цитокина с клеткой определяется универсальной биологической системой, специфическим механизмом которой является рецепторный аппарат, связанный с восприятием метаболического кода. Для проявления биологической активности цитокина необходимо присутствие на поверхности чувствительных клеток специфических рецепторов, которые могут экспрессироваться параллельно с синтезом цитокина. Рецепторы цитокинов представляют собой комплексы, состоящие из двух и более рецепторных молекул, которые объединяются на мембране клетки-мишени и образуют высокоаффинный рецепторный комплекс. Большинство рецепторов состоит из отдельных молекул, связывающих цитокины, которые ассоциируются после связывания лиганда с сигналпередающим рецепторным компонентом; часть рецепторов существует как растворимые изоформы, способные связывать и растворять цитокины, а часть функционирует как многокомпонентные блоки; механизм комплексирования субъединиц рецепторов объясняет плейотропные и дублирующие эффекты цитокинов, имеющих большое структурное сходство. Рецепторы ИЛ-10 имеют гомологию рецепторов интерферона, и подобно ИЛ-10 индуцирует экспрессию в моноцитах гена Fc- рецептора. Для полного функционирования цитокиновой системы необходимы повышение уровня цитокина в ответ на инфект и экспрессия нормального количества рецепторов к ним на клетках. Изменение рецепторов после их связывания с цитокином заключается в интернализации комплексов цитокин - рецептор внутрь клетки. На поверхности клеток рецептор появляется заново, постепенно синтезируясь в течение 24-36 ч (время появления рецепторов интерферон-альфа). В этот период клетки остаются чувствительными к последующим дозам цитокина, чем объясняется эффективность введения препаратов интерферона и их индукторов три раза в неделю.
При антигенной стимуляции клеток трансдукция сигнала с активированного рецептора на генетический аппарат осуществляется с помощью внутриклеточных регуляторных систем, компоненты которых (белки мембран, ферментов, хроматина) связываются с чувствительными к ним последовательностями ДНК. После связывания цитокина (интерферон) с поверхностными клеточными мембранными рецепторами происходит активация ферментов протеинкиназы-С (ПКС), тирозинкиназы, ц-АМФзависимой протеинкиназы, серин-треонинкиназы. Интерферон-альфа активирует tyk 2 и jak 1-киназы, а интерферон-гамма активирует jak 1 и 2-киназы. Далее факторы транскрипции перемещаются в ядро клетки и связывают гены раннего ответа.
Первый ответ клеток на цитокин - это быстрая индукция генов раннего ответа ("immediate early" генов), в число которых и входит ген интерферон-гамма. Стимуляция экспрессии этих генов важна для выхода клеток из Go-стадии и перехода в Gi-стадию и дальнейшей прогрессии клеточного цикла. Их индукция происходит после активации рецепторов роста на клеточной мембране и активации протеин-киназной системы. Гены раннего ответа являются ключевыми регуляторами клеточной пролиферации и дифференцировки, кодируют белки, регулирующие репликацию ДНК.
Таким образом, при активации клеток происходит стимуляция генов раннего ответа, что ассоциируется с изменением фаз клеточного цикла. Основная протективная роль в иммунном ответе, направленном против внутриклеточных паразитов (грибы, простейшие, вирусы, микобактерии туберкулеза), принадлежит клеточным механизмам. Способность перечисленных возбудителей переживать и размножаться внутри клеток делает их защищенными от действия антител и системы комплемента. Резистентность к антимикробным факторам макрофагов позволяет им длительно переживать внутри этих клеток. Для элиминации возбудителя необходим специфический клеточно-опосредованный ответ. Его специфичность определяется антигенраспознающими СД8+-Т-лимфоцитами, которые пролиферируют, активируются и формируют клон эффекторных цитотоксических лимфоцитов. Решающий момент специфического иммунного ответа - это ответ СД4+Т-лимфоцитов с хелперной направленностью на распознавание антигена. На этом этапе определяется форма иммунного ответа: либо с преобладанием гуморального иммунитета, либо с преобладанием клеточных реакций (ГЗТ). Направление дифференцировки СД4 + -лимфоцитов, от которого зависит форма специфического иммунного ответа, контролируется цитокинами, образующимися в ходе воспалительной реакции. Так, в присутствии ИЛ-12 и интерферон-гамма СД4 + -лимфоциты дифференцируются в воспалительные Тh1-клетки, начинают продуцировать и секретировать интерлейкин-2, интерферон-гамма, ФНО и определяют клеточный характер специфического иммунного ответа. Присутствие ИЛ-12 обеспечивается его продукцией макрофагами, а интерферон-гамма - естественными киллерами, активированными в раннюю фазу ответа на внутриклеточно паразитирующие бактерии и вирусы. В отличие от этого, в присутствии ИЛ-4 СД4 + -лимфоциты дифференцируются в хелперы Тh 2, которые начинают продуцировать и секретировать ИЛ-4, ИЛ-5, ИЛ-6 и запускают гуморальный иммунный ответ, т.е. синтез специфических антител - иммуноглобулинов. Воспалительные Тh 1-лимфоциты нужны для борьбы с внутриклеточными паразитами, а Тh 2 хелперы нужны для элективной защиты от внеклеточных паразитов.
Вирусная инфекция может вызывать быстрое подавление экспрессии ряда клеточных генов (из которых наиболее изучены интерфероновые гены и гены, кодирующие дс-РНК-зависимые ферменты -2,5-ОАС и ПК-дс), принимающих участие в антивирусном действии. Специальные исследования механизма антивирусного действия интерферонов и дс-РНК в клеточных и бесклеточных системах показали ключевую роль в этом процессе вышеуказанных ферментов. ПК-дс, взаимодействуя с дс-РНК, фосфорилируется и в активной форме фосфорилирует регуляторные факторы транскрипции и трансляции, из которых наиболее изучен инициирующий фактор трансляции (eIF2).
ПК-дс выполняет регуляторную роль в системе клеточной пролиферации на уровне факторов трансляции и активации ряда генов цитокинов. Вероятно, существует связь между подавлением транскрипции мРНК и ПК-дс, угнетением общего синтеза клеточного белка при вирусных инфекциях и накоплением в ядрах клеток белка нуклеокапсида и белка NSP2. Фрагментация клеточных хромосом, наблюдающаяся на ранних сроках вирусной инфекции, может быть одной из причин подавления экспрессии генов, участвующих в противовирусном ответе.
Есть основания предполагать участие белков NSP2 в регуляции активности генов цитокинов - низкомолекулярных белковых регуляторных веществ, продуцируемых клетками и способных модулировать их функциональную активность. Нарушения в системе цитокинов приводят к нарушению кооперативных взаимодействий иммунокомпетентных клеток и нарушению иммунного гомеостаза.
В последние годы показано, что ИЛ- 12, относящийся к провоспалительным цитокинам, является ключевым для усиления клеточно-опосредованного иммунного ответа и инициации эффективной защиты против вирусов.
Средства терапии гриппа и ОРЗ можно разделить на этиотропные, иммунокорригирующие, патогенетические и симптоматические. Приоритет принадлежит этиотропным препаратам, действие которых направлено непосредственно на возбудитель инфекции. Все препараты этиотропного действия целесообразно рассматривать с учетом их точек приложения в цикле репродукции вирусов гриппа и других ОРЗ.
Применение химиопрепаратов для профилактики и лечения гриппа и ОРЗ относится к базовой терапии и является общепризнанным мировым стандартом. Многолетние клинические исследования достоверно выявили их высокую лечебно-профилактическую значимость. Химиотерапевтические средства представлены тремя основными группами: это блокаторы М2-каналов (амантадин, ремантадин); ингибиторы нейраминидазы (занамивир, озельтамивир) и ингибиторы протеаз (амбен, аминокапроновая кислота, трасилол). Препараты оказывают прямое антивирусное действие, нарушая различные фазы репликативного цикла вирусов. Несколько особняком стоит группа вирулицидных препаратов, применяемых местно для предотвращения адсорбции и проникновения вирионов в клетки.
Вирусы могут размножаться только внутри клетки-хозяина, перестраивая ее работу так, что клетка начинает производить новые вирусные частицы. Это серьезно нарушает работу самой клетки и в большинстве случаев ведет к ее гибели. Процесс проникновения и размножения вируса в ней сложный и содержит много стадий, а значит, специальные лекарства могут тормозить его на различных этапах.
В случае с ВИЧ это выглядит так.

по теме

Лечение
Лучшие научпоп-статьи 2018 года
После того как вирусная частица приклеилась к рецепторам CD4 и CCR5/CXCR4 и закрепилась на поверхности клетки, другой специальный белок вируса gp41 соединяет оболочку вируса с мембраной клетки-мишени и помогает вирусу проникнуть внутрь клетки (цифра 2 на схеме). На этом этапе остановить вирус может другая группа препаратов — ингибиторы слияния, например, энфувиртид. Препарат связывается с вирусным белком gp41 и нарушает его работу.

На этом этапе размножение вируса блокирует очень большое количество препаратов из двух классов — нуклеозидные ингибиторы обратной транскриптазы (НИОТ — ламивудин, абакавир, тенофовир) и ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ — эфавиренз, рилпивирин). Принцип действия у веществ из обеих групп похожий: молекула лекарства связывается с обратной транскриптазой вируса, нарушает ее работу и так блокирует перенос генов вируса из РНК в ДНК. Это не позволяет генам вируса встроиться в ДНК клетки-хозяина и начать производство новых вирусных частиц.
На следующем этапе инфицирования (цифра 4 на схеме) готовая вирусная ДНК проникает в ядро и встраивается в ДНК клетки-хозяина с помощью специального вирусного фермента — интегразы. Работу этого фермента блокируют ингибиторы интегразы, например, долутегравир, не позволяя ДНК вируса встроиться в наши гены.
После того как вирусная ДНК встраивается в ДНК клетки-хозяина, клетка получает неправильную программу и начинает производить вирусные белки и РНК, необходимые для сборки новых частиц вируса (цифра 5 на схеме), используя для этого структуры, которые в норме производят собственные белки клетки. Такая перенастройка производства белка сильно нарушает работу клетки и через некоторое время вызывает ее гибель. Лекарств, которые бы влияли на этот этап размножения вируса, нет, так как здесь вирус использует собственные ферментные системы клетки-хозяина и блокирование их работы какими-то веществами навредит здоровым клеткам.
по теме

Лечение
Ошибка системы. Почему в регионах опять не хватает таблеток от ВИЧ
После синтеза вирусных белков клеткой-хозяином в работу вступает еще один фермент вируса — протеаза (цифра 6 на схеме). Дело в том, что белки ВИЧ синтезируются в виде длинных цепочек белков-предшественников, но они неактивные. Протеаза разрезает эти цепочки на более короткие фрагменты, которые становятся активными белками вируса: из одних собирается вирусная оболочка, другие выполняют функции ферментов (обратная транскриптаза, интеграза, протеаза, о которых мы говорили выше). Класс лекарств, нарушающих работу вирусной протеазы, включает большое количество препаратов от достаточно старого лопинавира до современного дарунавира. Основной недостаток препаратов этого класса — высокая степень перекрестной устойчивости: если вирус приобретает устойчивость к одному препарату, скорее всего, на него не подействует ни один другой препарат из этого класса.
На последнем этапе (цифра 7 на схеме) вирусные частицы собираются из готовых компонентов (синтезированных клеткой вирусных белков и РНК), как конструктор, и покидают клетку-хозяина. Лекарств, которые бы тормозили эти процессы, пока не существует.
ВИЧ имеет высокую склонность к мутациям, что позволяет ему быстро приобретать устойчивость к лекарствам. Мутации изменяют форму молекул ферментов вируса. Если при этом форма изменится существенно, то фермент не сможет нормально работать и такой вирус размножаться перестанет — это вредная для вируса мутация. Однако в некоторых случаях — при полезных мутациях — форма молекулы фермента меняется не сильно, а так, что сам фермент продолжает нормально работать, но молекула лекарства уже не может с ним связаться.
Поэтому для эффективного подавления размножения ВИЧ обычно назначают три разных препарата из разных групп, влияющих на разные ферменты вируса, блокируя его воспроизводство на разных этапах. Исключением является группа ингибиторов обратной транскриптазы (НИОТ и ННИОТ) — эти лекарства связываются с разными участками молекулы вирусного фермента, поэтому могут назначаться вместе, несмотря на то, что относятся к одной группе. В условиях такой терапии вирусу очень трудно выработать устойчивость, потому что одновременно должно произойти несколько полезных мутаций в разных генах вируса, а это бывает крайне редко.
Есть несколько перспективных технологий, например, CRISPR/Cas9, которые могут позволить полностью удалить вирусную ДНК из организма человека, но пока ни одна из них не прошла все необходимые исследования для подтверждения эффективности и безопасности. Исследования продолжаются.
Читайте также:

