Влияние гепатит у крыс
Обновлено: 18.04.2024
Все грызуны (хомяки, песчанки, крысы, мыши, морские свинки) — прекрасные домашние животные. Однако, домашние грызуны, даже если они выглядят чистыми и здоровыми, могут нести бактерии или вирусы, опасные для человека.
Чаще всего встречаются такие болезни как: геморрагическая лихорадка с почечным синдромом (HFRS), лептоспироз, лимфоцитарный хориоменингит, болезнь крысиного укуса (RBF), сальмонеллез.
Геморрагическая лихорадка с почечным синдромом (HFRS)
Геморрагическая лихорадка с почечным синдромом (HFRS) представляет собой группу клинически подобных заболеваний, вызваемых хантавирусами семейства Bunyaviridae.
Симптомы Геморрагической лихорадки с почечным синдромом (HFRS) обычно развиваются в течение 1–2 недель после контакта с инфицированными материалами, в редких случаях могут развиваться до 8 недель. Начальные симптомы появляются внезапно и включают в себя сильные головные боли, боли в спине и брюшной полости, лихорадку, озноб, тошноту и нарушение зрения. У людей может быть покраснение лица, воспаление или покраснение глаз, сыпь. Поздние симптомы могут включать понижение кровяного давления, острый шок, острую почечную недостаточность, которые могут вызвать сильную перегрузку жидкости. Тяжесть заболевания варьируется в зависимости от вируса, вызывающего инфекцию. Инфекции вируса Hantaan и Dobrava обычно вызывают серьезные симптомы, тогда как вирус Seoul, Saaremaa и Puumala имеют более умеренное течение. Полное восстановление от болезни крыс может занять недели или месяцы.
Геморрагическая лихорадка с почечным синдромом встречается во всем мире. Вирус Haantan широко распространен в Восточной Азии, особенно в Китае, России и Корее. Вирус Puumala встречается в Скандинавии, Западной Европе и Западной России. Вирус Dobrava встречается в основном на Балканах, а вирус Seoul встречается во всем мире. Вирус Saaremaa находится в Центральной Европе и Скандинавии. В Америке хантавирусы вызывают другое заболевание, известное как хантавирусный легочный синдром.
Хантавирусы переносятся и передаются грызунами. Люди могут заразиться этими вирусами и заболеть геморрагической лихорадкой с почечным синдромом после вдыхания аэрозоля мочи, помета или слюны инфицированных грызунов или после контката с пылью из их гнезд и клеток. Инфицирование может также произойти, когда зараженная моча или другие материалы непосредственно попадают на поврежденную кожу или слизистые оболочки глаз, носа или рта. Кроме того, люди, которые работают с живыми грызунами, могут быть заражены хантавирусами через укусы инфицированных грызунов. Передача от одного человека к другому может произойти, но крайне редка.
Серая или норвежская крыса (Rattus norvegicus) является резервуаром для вируса Seoul.
Лептоспироз у крыс
Лептоспироз — бактериальное заболевание, поражающее людей и животных. Вызывается бактериями рода Leptospira. У людей отмечают большую вариабельность симптомов, некоторые из которых могут быть приняты за другие болезни. У некоторых инфицированных пациентов вообще нет симптомов.
Без лечения лептоспироз может привести к повреждению почек, менингиту (воспаление оболочек головного мозга и спинного мозга), печеночной недостаточности, респираторного дистресса и даже смерти.
Бактерии, вызывающие лептоспироз, распространяются с мочой зараженных животных. Моча может попасть в воду или почву, и бактерии могут выжить там в течение недель и даже месяцев. Многие виды диких и домашних животных являются переносчиками лептоспироза. Переносчиками могут быть (не окончательный перечень): крупный рогатый скот, свиньи, лошади, собаки, грызуны, дикие животные.
У инфицированных животных может не проявляться клинических признаков. Зараженные животные могут продолжать выделять бактерии в окружающую среду непрерывно или периодически в течение нескольких месяцев и даже нескольких лет.
Люди могут заразиться через:
- Контакт с мочой (или другими жидкостями организма, за исключением слюны) от инфицированных животных
- Контакт с водой, почвой или пищей, загрязненной мочой зараженных животных
Бактерии могут проникать в организм через кожу или слизистые оболочки (глаза, нос или рот), особенно, если кожа повреждена. Питье загрязненной воды может также вызвать инфекцию. Вспышки лептоспироза обычно вызваны употреблением загрязненной воды, например, после паводка. Передача от человека к человеку встречается редко.
Лимфоцитарный хориоменингит
Лимфоцитарный хориоменингит (LCM), является инфекционным вирусным заболеванием. Переносится грызунами, возбудитель — вирус лимфоцитарного хориоменингита (LCMV), представитель семейства Arenaviridae, который первоначально был выделен в 1933 году.
Основной хозяин вируса LCM — обычная домовая мышь, Mus musculus. Инфекция в популяции домовых мышей может варьировать в зависимости от географического положения. Домовые мыши могут передавать вирус на протяжении всей жизни, не проявляя никаких признаков болезни. Другие грызуны, например, хомяки, не являются естественными резервуарами, но могут заразиться вирусом лимфоцитарного хориоменингита LCM от диких мышей у заводчика, в зоомагазине или дома. Люди с большей вероятностью заражаются вирусом лимфоцитарного хориоменингита от домовых мышей, но также есть данные об инфицировании от других домашних грызунов.
Лимфоцитарный хориоменингит чаще всего проявляется неврологическими симптомами, как следует из названия, хотя бессимптомная инфекция или умеренная лихорадка является более распространенным клиническим проявлением.
У инфицированных людей первые симптомы обычно появляются через 8–13 дней после контакта с вирусом. Начальная фаза может продолжаться до недели, обычно начинается с одного или нескольких симптомов: лихорадка, недомогание, отсутствие аппетита, мышечные боли, головная боль, тошнота и рвота. Другие симптомы появляются реже: боль в горле, кашель, боль в суставах, боль в груди, боль в тестикулах и боль в околоушной слюнной железе. Кроме того, связанная с беременностью инфекция ассоциируется с врожденной гидроцефалией, хориоретинитом и умственной отсталостью.
Болезнь крысиного укуса
Болезнь крысиного укуса (RBF) — инфекционное заболевание, которое может быть вызвано двумя различными бактериями. Streptobacillus moniliformis — мелкая полиморфной, грамотрицательной аэробной палочка, или спирохетой Spirillum minus. Болезнь крысиного укуса, вызванная Streptobacillus moniliformis, чаще встречается в Северной Америке, тогда как болезнь крысиного укуса Содоку, вызванная Spirillum minus, встречается в основном в Азии. Люди обычно заражаются от инфицированных грызунов и при употреблении зараженной пищи или воды. Без лечения болезнь крысиного укуса (RBF) может быть серьезным или даже смертельным заболеванием.
Существует несколько способов заражения. Наиболее распространенными являются:
- Укусы или царапины инфицированных грызунов (таких как крысы, мыши и песчанки)
- Обращение с больными грызунами (даже без укуса или царапин)
- Потребление продуктов питания или напитков, загрязненных бактериями
Болезнь крысиного укуса не передается от одного человека к другому. Симптомы болезни крысиного укуса различаются в зависимости от возбудителя.
Streptobacillus moniliformis (Стрептобациллез) вызывает лихорадку, рвоту, головную боль, боли в мышцах, сыпь. Симптомы обычно проявляются через 3–10 дней после контакта с инфицированным грызуном, но могут быть появиться и через 3 недели. К этому времени любой укус или царапина обычно заживают.
В течение 2–4 дней после начала лихорадки сыпь может появляться на руках и ногах. Затем один или несколько суставов могут стать опухшими, красными или болезненными.
Spirillum minus (болезнь Содоку) вызывает лихорадку (которая может повторяться неоднократно), язвы в области укуса, отек вокруг раны, увеличение лимфатических узлов, сыпь (происходит после частичного заживления раны). Эти симптомы обычно возникают через 7-21 день после контакта с зараженным грызуном.
Симптомы, связанные с лихорадкой Хаверхилла (Болезнь крысиного укуса, которой заражаются при употреблении инфицированной пищи или воды), могут отличаться от симптомов, которые возникают поcле укусов и/или царапин. Наиболее заметные различия могут включать более выраженную рвоту и боль в горле.
Сальмонеллез
Сальмонеллы представляют собой группу бактерий рода Salmonella, которые могут вызывать диарею у людей. Эти бактерии передаются через фекалии людей или животных другим людям или животным. Животные могут быть бессимптомными носителями. Грызуны, как рептилии, могут передавать сальмонеллы людям.
Булекбаева Л.Э. 1 Ерлан А.Е. 1 Рыспекова Ш.О. 2 Джусипбекова Б.А. 2 Алпысбаева К.К. 2 Артыкбаева У.С. 2
Статья посвящена исследованию морфологических свойств крови и лимфы, реогепатографии и уровень кровоснабжении сосудов у крыс. При экспериментальном токсическом гепатите у крыс лимфатическая система вовлекается в патологический процесс. Возрастает уровень тромбогенных процессов не только в крови, но и в лимфе. Изменение реогепатографии обуславливаются нарушением оттока в паренхиме, изменением эластичности сосудов печени и развитием артериовенозных шунтов.

2. Забродский П.Ф., Германчук В.Т. Влияние тетрахлорметана на показатели иммунной системы // Бюлл. экспер. биол. и мед. – 2004. – № 1. – С. 56–57.
3. Камалов Ю.Р., Северов М.В., Олейникова Е.Б. Значение ультразвукового исследования вен портальной системы для выявления синдрома портальной гипертензии у больных циррозом печени.// Тез.1-го съезда Ассоциации специалистов ультразвуковой диагностики в медицине. – М., 1991. – С. 96.
4. Клишина И.М. Влияние гомогената трутеновых личинок на уровень белка и нуклеиновых кислот в условиях токсической гепатопатии // Матер. 55-ой регион. конф. по фармации, фармакологии и подготовка кадров. – Пятигорск, 2000. – С. 195–196.
5. Копылова Л.Е., Саркова Е.В., Асташов В.В. Лимфатический регион печени матери и потомства при беременности, осложненной действием экотоксикантов.// Бюлл. СО РАМН. – 2008. – № 5. – С. 38–43.
6. Кунцевич Г.И., Скуба Н.Д., Белолапотко Е.А. Роль комплексного ультразвукового исследования в дифференциальной диагностике очаговых образований печени. Методические рекомендации. – М., 1997. – C. 45.
7. Юрова Е.Г., Асташов В.В., Казаков О.В. Структура брыжеечных лимфатических узлов у крыс с хроническим токсическим гепатитом и в условиях его коррекции лазерным излучением и фитосорбционными комплексами // В кн.: Проблемы экспериментальной клинической и профилактической лимфологии. – Новосибирск, 2002. – С. 389–391.
8. Raom R., Kuman K.V et. al. Влияние фруктозы на активность синтезы оксид азота под действием CCl4 // Indian J. Exp. Biol. – 2001. – V. 39, № 1. – P. 68–69.
9. Zhang J., Zong Ch., Li D., Zhan R. Взаимосвязь между локальной ренин-ангиотензин-альдестероновой системой и фиброзом печени крыс // Word. Chin. J. Dig. – 2002. – V. 10, № 4. – P. 397–400.
У крыс после введения внутрибрюшинно CCl4 (100 мкг/кг) через 24 часа развивался выраженный гепатит. Отмечено снижение активности синтеза оксида азота в эндотелиальных и гладкомышечных клетках кровеносных сосудов [8]. Острое отравление тетрахлорметаном per os крыс в дозе 0,75 ЛД50 через 4 суток вызывало снижение основных гуморальных и клеточных иммунных реакций [2].
При хроническом токсическом гепатите крыс, вызванном введением 4-х хлористого углерода, наблюдалось увеличение паракортикальной зоны в брыжеечных лимфатических узлах, что свидетельствует, по мнению авторов, об усилении иммунного ответа по гуморальному типу [7].
После трехкратного введения 50 % масляного раствора CCl4 через день крысам отмечено снижение в печени нуклеиновых кислот на 16 % и общего белка на 18 % по сравнению с показателями интактных животных [4].
Хроническая интоксикация животных тетрахлорметаном вызывала выраженные дистрофические и воспалительные изменения в печени и в регионарных лимфатических узлах. При беременности у самок и у потомства эти изменения сохранялись, но были выражены меньше. Авторы считают, что в этих условиях у животных лучше сохранялась дренажно-детоксикационная функция лимфатической системы [5]. Радиоиммунным методом установлено увеличение содержания ренина, ангиотензина I и II, альдестерона и активности ангиотензин-конвертирующего фермента при токсическом гепатите, вызванным введением CCl4 крысам [9].
В последние годы среди неинвазивных методов диагностики хронического гепатита и портальной гипертензии важное место отводится ультразвуковым исследованиям [7, 1].
Материалы и методы исследования
Эксперименты проведены на 102 половозрелых белых лабораторных крысах-самцах линии Вистар, массой 180-250 гр. Для создания модели токсического гепатита использовали 50 % масляный раствор четыреххлористого углерода (CCl4), который вводился внутрибрюшинно (0,3 мг/кг) один раз в течение 3 суток через день. Наличие токсического гепатита у крыс было подтверждено гистологическими и биохимическими исследованиями.
Острые опыты проводились на 2 группах крыс: 1-я группа крыс – контрольная (24 интактных крыс) и 2-я группа – это крысы с моделью токсического гепатита (78 крыс) с соблюдением основных принципов Хельсинской конвенции о гуманном отношении к лабораторным животным. Через 15 суток после интоксикации крыс 4-х хлористым углеродом под эфирным наркозом прижизненно регистрировали лимфоток из грудного и кишечного лимфатического сосуда.
Морфологический состав крови у крыс с токсическим гепатитом изучали на гематологическом анализаторе SYSMEXKX-219 (Япония). Время свертывания крови и лимфы определяли по Сухареву, вязкость – на вискозиметре ВК-4, рН – на анализаторе OSMETECHOPTITMССА (США).
Определение морфологического состава лимфы проводили в камере Горяева с сеткой Бюркера. Определяли число лейкоцитов, лейкоцитарную формулу – в сухих мазках лимфы, окрашенных по методу С.П. Романовского. Для изучения гистологических препаратов использовали световой микроскоп Leica – DМ-1000.
Полученный материал обработан на компьютере вариационно-статистическим методом с использованием критерия Стьюдента.
Результаты исследования и их обсуждение
Результаты реогепатографического исследование у крыс контрольных группы представляли собой чередующие систолические волны достаточной амплитуды, с закругленной вершиной и диастолическим подъемом. Скорость быстрого кровенаполнения составляла в контроле 1,02 ± 0,06 Ом/с, скорость медленного кровенаполнения 0,15 ± 0,02 Ом/с. На фоне токсического гепатита наблюдали, что форма кривой характеризовалась появлением заостренной и зазубренной, а в некоторых случаях платообразной вершины.
Результаты исследований на крысах с токсическим гепатитом показали противоречивые данные, в одних случаях наблюдали увеличение амплитуды систолической волны на 65 %.Скорость быстрого кровенаполнения составляла 6,06 ± 0,5 Ом/с, а медленного кровенаполнения – 4,05 ± 0,02 Ом/с. В других случаях наблюдали уменьшение амплитуды диастолической и систолической волны на 45 %, с одновременным уменьшением скорости быстрого кровенаполнения до 0,70 ± 0,02 Ом/с, но возрастала скорость медленного кровенаполнения (рисунок).
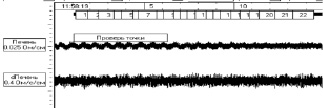
а) реогепатограмма контрольной группыу крыс
б) реогепатограмма на фоне токсического гепатита у крыс
Кривая реогепатограммы у крыс с контрольной группой и на фоне токсического гепатита
По мнению некоторых авторов, изменение кривой реогепатограммы происходит разнонаправлено, но, в основном, зависит от этиологии заболеваниях [9]. При вирусной этиологии происходит снижение амплитуды систолической волны, при токсическом гепатите происходит обратный эффект т.е. идет увеличение амплитуды систолической волны.
Изучение скорости кровотока методом лазерной ультразвуковой доплерографии у крыс на фоне хронической затравки СCl4 показало, что скорость линейного кровотока в воротной вене снижалась, а в печеночной артерии скорость кровотока повышалась по сравнению с контрольной группой. Пульсационный индекс и индекс периферического сопротивления уменьшались в воротной вене и в печеночной артерии на 25 % .Изменение этих показателей указывает на наличие нарушения гемодинамики печени на фоне токсического гепатита у крыс и начальным формированием проявлений портальной гипертензии (таблица).
Проведенными исследованиями продемонстрировано, что адопция ликвора от интактных крыс, не влияет на показатели иммунного статуса крыс с моделью токсического гепатита, предположительно, за счет угнетения пластических процессов, обусловленного печеночной дисфункцией. Напротив, реципиенты ликвора с моделью токсического гепатита подверглись значительному снижению показателей иммунного статуса, вследствие адопции ликвора от крыс с аналогичной моделью, воспроизведенной за 14 дней до адопции, за счет сбоя центральных механизмов поддержания иммунного гомеостаза. Также, продемонстрировано, что адопция ЦСЖ от доноров с моделью гепатита, стимулирует рост показателей активности иммунной системы у изначально интактных крыс, вероятно, за счет адаптационной интенсификации регуляторных импульсов со стороны центра поддержания иммунного гомеостаза.

Известно, что вирусный гепатит, как и любое другое заболевание, сопровождающееся нарушением синтетической функции печени, является системной патологией, протекающей с поражением многих систем и органов [3] .В этой связи, множество работ посвящено изучению патогенетической картины печеночных патологий и разработке стратегии лечения гепатитов, главным образом вирусных. Для достижения объективных результатов важным является применение адекватной экспериментальной модели гепатопатологического процесса. Имеются указания на то, что модель хронического токсического гепатита является оптимальной для изучения вирусных гепатитов [1]. Моделирование гепатитов способствует познанию их патогенеза, в том числе и с позиции роли центральных иммунорегуляторных влияний на их течение, поскольку статус иммунной системы, безусловно, играет важную роль в исходе заболеваний печени. С другой стороны, нарушение иммунитета при печеночных патологиях представляет интерес ввиду значимости печени в поддержании гомеостаза, в том числе и нейроиммуноэндокринного. Таким образом, перспективными представляются разработки, касающиеся изучения взаимодействия нейроиммунитета и печени.
Цель исследования.
Оценить изменение иммунологических показателей у крыс с хроническим токсическим гепатитом под влиянием адопции аллогенного ликвора, обладающего различной степенью иммунотропной активности.
Материал и методы исследования.
В работе приведены данные, полученные от 32 крыс линии Brown Norway, весом 160-180г. Оперативное вмешательство осуществлялось под гексеналовым наркозом (доза - 70мг./кг., внутрибрюшинно). Для воспроизведения модели хронического токсического гепатита (ХТГ) был использован гелиотрин, вводимый внутрибрюшинно в дозе 50 мг/кг массы тела один раз в неделю в течение 35 дней [2]. Адопция цереброспинальной жидкости (ЦСЖ) в III желудочек мозга проводилась раз в сутки согласно стандартной стереотопографии на аппарате WPI (Berlin, Germany) [6]. Количественное определение показателей иммунного статуса проводили с использованием набора дифференцировочных маркеров (Sandoz Pharma AG, Switzerland). Статистическая обработка результатов проводилась с расчетом критерия Стъюдента, различия считали достоверными при значении p≤0,05.
Полученные результаты и их обсуждение.
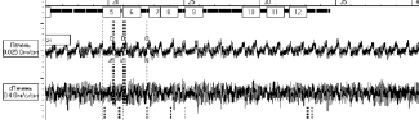
В проведенных ранее экспериментах было показано, что крысы Brown Norway (BN) с ХТГ имеют достоверно сниженные показатели иммунного статуса по сравнению с нормальными показателями интактных крыс. Примечательно, что при двукратном (в среднем) снижении количества клеток оцениваемых лейкоцитарных элементов, процентное соотношение показателей иммунограммы не изменялось. Вероятно, число всех типов клеток лейкоцитарного звена уменьшилось за счет генерализованного угнетения метаболической функции печени и последующего подавления центральных звеньев иммунорегуляции, что подтверждается исследованиями отдельных авторов [10]. В этой связи, проведено три серии экспериментов направленных на определение степени вовлеченности иммунокомпетентного микроокружения гипоталамуса в механизмы супрессирования иммунной системы при ХТГ.
Задачей первой экспериментальной группы крыс являлось изучение влияния адопции аллогенного ликвора, полученного от интактных крыс линии Sprague Dawley (SD) на показатели иммунного статуса при ХТГ. Полученные данные свидетельствуют, что ни один из оцениваемых показателей, за исключением общего пула лимфоцитов, каких-либо значимых количественных изменений не претерпел, количество нейтрофилов, мононуклеаров, В-лимфоцитов, Т-лимфоцитов, NK-клеток и лейкоцитов в целом незначительно колебалось в ту или иную сторону. Лишь абсолютное число лимфоцитов в периферической крови животных изучаемой группы достоверно возросло на 9% в сравнении с их количеством в крови контрольной группы крыс с ХТГ, но без манипуляций с составом ЦСЖ. (табл.1).
Таблица 1. Влияние адопции аллогенного ликвора на иммунный статус крыс с ХТГ
показатели иммунитета (×10 6 /L)
крысы с ХТГ (контроль)
ХТГ + адопция интактной ЦСЖ
ХТГ + адопция ЦСЖ от крыс с ХТГ
крысы без ХТГ + адопция ЦСЖ от крыс с ХТГ
Примечания: во всех сравниваемых группах n = 8
a - достоверно по отношению к контрольной группе крыс
b - достоверно по отношению к группе крыс с адопцией аллогенной интактной ЦСЖ
* - достоверно по отношению к группе интактных крыс
Таким образом, исследованиями продемонстрировано, что аллогенная адопция ЦСЖ полученной от интактных крыс, не оказывает значимого влияния на показатели активности иммунной системы крыс с моделью ХТГ. По данным ряда авторов, стимуляция центральных звеньев иммунорегуляции ведет к избирательной модуляции нарушенных звеньев периферической иммунной системы, возвращая супрессированные либо гиперактивированные механизмы реализации иммунных процессов к физиологически нормальным значениям [5]. Казалось бы, внутрижелудочковое введение нормальной ЦСЖ, имеющей физиологичный состав иммунотропных компонентов и обладающей способностью модулировать подавленную активность центра поддержания иммунного гомеостаза, должно ослабить интенсивность иммуносупрессии у крыс с токсическим гепатитом, однако этого не произошло. Отсутствие какого-либо воздействия адопции ЦСЖ на активность иммунитета экспериментальной группы крыс, возможно, обусловлено неспособностью периферической иммунной системы прореагировать на смену вектора центральной эфферентной импульсации (в условиях "искусственной оптимизации" состава ЦСЖ), за счет тотального подавления анаболических (пластических) процессов в организме реципиентов ЦСЖ, имеющих печеночную дисфункцию.
Результаты, полученные во второй серии экспериментов, направленных на изучении роли ликвора полученного от аллогенных крыс-доноров, на которых за 14 дней до забора ЦСЖ была воспроизведена аналогичная модель ХТГ, демонстрируют, что животные изучаемой группы с ХТГ (реципиенты ЦСЖ) подверглись значительному снижению показателей иммунного статуса, вследствие адопции ликвора. Так, количество лейкоцитов в изучаемой группе было достоверно снижено в сравнении с контрольной группой крыс с ХТГ (без адопции ЦСЖ) и в сравнении с группой крыс (первой экспериментальной серии) с ХТГ и с адопцией ЦСЖ от интактных животных линии SD. Аналогичные изменения были характерны и в отношении нейтрофилов и клеток мононуклеарного ряда. Общий пул лимфоцитов, включая Т- и В-популяции и натуральные киллеры, также подвергся значительному снижению числа клеток в периферической крови. Анализ показателей иммунограммы позволяет предполагать, что адопция аллогенной ЦСЖ в гипоталамическое ликворное микроокружение крыс реципиентов ЦСЖ ведет к угнетению активности иммуноцитов периферической крови за счет сбоя центральных механизмов поддержания иммунного гомеостаза. Указанное подавление иммунитета крыс реципиентов ликвора, полученного от особей с моделью патологии усугубленной с течением времени, возможно, обусловлено замещением собственного ликвора, донорским ликвором, с составом биоактивных субстанций (главным образом цитокинов) истощенным моделью токсического гепатита более прогрессировавшего у крыс доноров ЦСЖ. Таким образом, адопция "декомпенсированного" ликвора от крыс с прогрессировавшей с течением времени моделью токсического гепатита индуцирует ускорение повреждения функций периферической иммунной системы реципиентов ЦСЖ, за счет экспериментально спровоцированной дезрегуляции механизмов поддержания иммунного гомеостаза в гипоталамусе, как результат адопции "декомпенсированного" (истощенного) ликвора. С другой стороны, возможен и иной механизм снижения активности периферической иммунной системы. По утверждению ряда авторов, угнетение периферических иммунных процессов может являться результатом компенсаторного действия центральных иммунотропных импульсов, направленных на предотвращение цитокиновой гиперсекреции в условиях патологии [4;9].
В третьей серии экспериментов оценивалось влияние адопции аллогенной ЦСЖ от крыс с моделью ХТГ на состояние иммунной системы изначально интактных крыс. Анализ полученных данных позволяет судить о том, что аллогенная адопция ЦСЖ от крыс с моделью патологии ведет к повышению показателей иммунограммы у крыс реципиентов ЦСЖ. В частности, общее количество лейкоцитов повысилось на 13% в сравнении с тем же показателем у интактных крыс. Число нейтрофилов, клеток мононуклеарного ряда и общий пул лимфоцитов также статистически значимо возросли. Среди клеток лимфоцитарного ряда достоверное увеличение клеточности имело место среди В-популяции лимфоцитов и натуральных киллеров. В то же время, общее число Т-лимфоцитов и, в частности, их хелперная и эффекторная субпопуляции не проявили значимого увеличения, однако тенденция к повышению числа клеток наблюдалась для обеих оцениваемых субпопуляций Т-клеток. Таким образом, показано, что центральное введение ЦСЖ, полученной от доноров с моделью гепатита, стимулирует рост показателей активности периферической иммунной системы. Возможным механизмом действия адоптированной ЦСЖ является адаптационное усиление интенсивности иммунорегуляторных импульсов со стороны центра поддержания иммунного гомеостаза в гипоталамусе. Указанная интенсификация иммуностимулирующих гипоталамических импульсов, возможно, обусловлена составом адоптированной ЦСЖ, свидетельствующим о глубоком подавлении активности периферической иммунной системы, вызванном моделью токсического гепатита в организме донора ЦСЖ. Вероятно, обедненный цитокиновый состав адоптированной ЦСЖ индуцирует компенсаторное повышение концентрации цитокинов в ЦСЖ и, следовательно, периферической крови реципиентов ликвора, т.е. происходит активация иммунной системы экспериментальной группы крыс без ХТГ, обусловленная искусственно спровоцированной ложной афферентной сигнализацией в центр поддержания иммунного гомеостаза. Предложенная гипотетическая схема стимуляции иммунитета изначально интактных крыс реципиентов ЦСЖ согласуется с утверждением отдельных авторов о том, что введение различных иммунологически активных субстанций в ІІІ желудочек мозга позволяет изменять вектор иммунотропных влияний гипоталамуса в желаемом направлении [7;8].
Заключение.
- Адопция аллогенной интактной ЦСЖ в гипоталамическое ликворное микроокружение, не оказывает значимого влияния на показатели активности иммунной системы крыс с моделью ХТГ.
- Адопция аллогенной ЦСЖ, полученной от крыс с ХТГ, смоделированным за 14 дней до адопции, ведет к угнетению активности иммуноцитов периферической крови за счет интенсификации сбоя центральных механизмов поддержания иммунного гомеостаза у крыс реципиентов ликвора с аналогичной моделью ХТГ, вызванной позднее.
- Адопция аллогенной ЦСЖ, полученной от крыс с ХТГ, индуцирует компенсаторное повышение количества иммуноцитов периферической крови у изначально интактных реципиентов ликвора, т.е. имеет место активация иммунной системы крыс без ХТГ, обусловленная ложной активирующей афферентной сигнализацией в центр поддержания иммунного гомеостаза.
Работа выполнена при поддержке Научного Комитета НАТО (грант FEL.RIG.980765).
Крысы заражают людей гепатитом, и никто не знает каким образом.
В 2018 году специалисты по инфекционным заболеваниям из Университета Гонконга столкнулись с необычным пациентом.
У 56-летнего мужчины, перенесшего пересадку печени, наблюдались аномальные функции печени без какой-либо очевидной причины.
Тесты показали, что его иммунная система реагирует на гепатит Е, но они не смогли найти человеческий штамм вируса гепатита Е в его крови.
Напомним, что гепатит Е - это заболевание печени, которое также может вызвать лихорадку, желтуху и увеличение печени. Вирус встречается в четырех видах, которые циркулируют у разных животных; в то время было известно, что только один из этих четырех видов заражает человека.
С помощью тестов для этого человеческого штамма Гев-негатива исследователи переработали диагностический тест, провели его снова-и впервые в истории обнаружили у человека крысиный гепатит Е.
С тех пор как было проведено это первое исследование, еще 10 жителей Гонконга получили положительный результат на крысиный гепатит Е, также известный как крысиный Гев. Последний случай заболевания произошел неделю назад: 30 апреля у 61-летнего мужчины с аномальной функцией печени был положительный результат теста.
По данным Всемирной Организации Здравоохранения, человеческий штамм гепатита Е обычно передается через фекальное загрязнение питьевой воды.
Но крысиный штамм представляет собой новую загадку: никто точно не знает, как эти люди заражаются. За два года, прошедшие с момента открытия, исследователям еще предстоит определить точный путь передачи вируса от крыс к человеку. У них есть теории - возможно, пациенты пили зараженную воду, как обычный человеческий штамм, или обращались с зараженными предметами, - но ничего окончательно не доказано.
61-летний пациент был особенно озадачен; в его доме не было ни крыс, ни крысиных экскрементов, ни у кого другого в его доме не было симптомов, и у него нет недавней истории путешествий.
Ученые тестируют популяции крыс по всему городу, чтобы попытаться определить кластеры, прежде чем они смогут перейти к людям, что дало данные о том, сколько грызунов в городе несут крысиный Гев и в каких районах больше всего крыс.
Но многое еще остается неизвестным. Они не знают, как долго длится инкубационный период этого вируса - то есть сколько времени требуется пациентам, чтобы заболеть после воздействия. Они все еще пытаются найти лечение, так как лекарство, используемое для лечения человеческого варианта гепатита Е, имеет смешанные результаты на пациентах
Не зная, как вирус переходит от крыс к людям, очень трудно предотвратить дальнейшие инфекции - или даже понять смысл всех данных, собранных исследователями. Например, люди, живущие в зараженных крысами районах, теоретически должны быть подвержены более высокому риску, однако некоторые инфицированные пациенты прибывают из районов с низкой численностью крыс.
Помимо 11 случаев заболевания в Гонконге, только один случай был подтвержден во всем мире - мужчина из Канады, который ранее путешествовал в Африку. Он отправился в больницу после того, как испытал крапивницу, тошноту, сильную желтуху и воспаленние печени.
Это слепое пятно в медицине и возможность того, что вирус заражает людей во всем мире без каких-либо мер контроля, подвергая риску некоторые из наиболее уязвимых людей общества: пожилых людей, общины, затронутые ВИЧ, людей с уже существующими заболеваниями и многих других.
К сожалению, сейчас в медицине с каждым годом становится больше слепых пятен. Это связано с непрекращающимся изменением мира вокруг нас. Меняется природная обстановка, становится больше токсинов, уровень стресса растет, бактерии и микробы эволюционируют и мутируют. Именно поэтому профессионалы в сфере медицины нужны особенно остро. И поэтому для них так важно регулярно проходить курсы по медицинской переподготовке, которые вы можете найти на сайте нашего центра поддержки бизнеса.
Даже в условиях эпидемии можно и нужно учиться . Переходите на наш сайт и подбирайте удобные вариант обучения с нами!
1. Левенкова М.В. Свойства и регуляция активности глюкозо-6-фосфатдегидрогеназы в условиях оксидативного стресса в печени крыс при токсическом гепатите: дис. … канд. биол. наук. – Воронеж, 2006. – 180 с.
2. Крыльский Е.Д. Содержание диеновых конъюгатов в тканях крыс при экспериментальном ревматоидном артрите / Е.Д. Крыльский, Т.Н. Попова, Е.М. Кирилова // Пути и формы совершенствования фармацевтического образования. Создание новых физиологически активных веществ: материалы 5-й международной научно-методической конференции “Фармобразование-2013”. – Воронеж, 2013. – С. 356-359.
3. Попова Н.А. Модели экспериментальной онкологии // Соросовский Образовательный Журнал. – 2000. – Т. 6, № 8. – С. 33-38.
Одним из методов познания сложных механизмов развития патологических процессов в организме является биологическое моделирование. Для создания моделей, которые могли бы быть максимально полезными, необходимо выбрать один или два существенных признака, общих для оригинала и модели. Организм человека подвергается действию физических, химических, биологических, социальных факторов, что приводит в ряде случаев к развитию патологического процесса или болезни. Исследования, проводимые на животных, позволяют ответить на ряд вопросов, касающихся пусковых механизмов, общих звеньев патогенеза, и принципов терапии и профилактики ряда болезней. В настоящее время возможно воспроизвести в экспериментальных условиях практически любую модель патологии. Приведем несколько примеров видов моделирования патологических процессов на животных.
Создание модели экспериментального токсического гепатита. Для создания модели экспериментального токсического гепатита часто используется ССl4, который является органоспецифическим токсином, обладающим гепатотропным эффектом. После суточной пищевой депривации крысам с помощью специального зонда в пищевод вводят ССl4 в вазелиновом масле (доза – 0,064 мл на 100 г веса животного). Максимальный цитолиз гепатоцитов наблюдается на 3-4 сутки после однократного введения ССl4 /1/. Печень крыс, подвергнутых токсическому гепатиту, используется для дальнейших биохимических, морфологических, гистологических и других исследований. СС14-гепатит характеризуется развитием некроза, белковой и жировой дистрофии гепатоцитов, локализованных преимущественно в центральной зоне печеночной дольки, где максимальна активность зависимых от цитохрома Р-450 монооксигеназ и преобладает продукция повреждающих метаболитов гепатотоксина. Создание моделей патологических состояний на животных также позволяет изучать влияние новых гепатопротекторов на процессы регенерации паренхимы печени.
Создание моделей аутоиммунных заболеваний на примере ревматоидного артрита. Аутоиммунную патологию можно характеризовать как атаку иммунной системы против органов и тканей собственного организма, в результате которой происходят их структурно-функциональные повреждения. Морфологические изменения при аутоиммунных болезнях характеризуются воспалительными и дистрофическими изменениями в поврежденных органах. В клетках паренхимы выявляются зернистая дистрофия и некроз. В кровеносных сосудах отмечается мукоидное и фибриноидное набухание и некроз их стенок, тромбоз, вокруг сосудов формируются лимфоцитарно-макрофагальные и плазмоцитарные инфильтраты. В соединительной ткани стромы органов выявляются дистрофия в форме мукоидного и фибриноидного набухания, некроз и склероз. В селезенке и лимфатических узлах выражена гиперплазия, интенсивная инфильтрация лимфоцитами, макрофагами и плазматическими клетками. Адъювантный артрит у крыс. Хроническое иммунное воспаление моделируют у крыс субплантарным введением в правую заднюю лапу 0,1 мл адъюванта Фрейнда. Воспалительная реакция, как правило, оценивается в динамике каждые 2 дня /2/. Могут учитываться также и другие симптомы генерализованной реакции организма на введение адъюванта (отек ушей, хвоста, полиартрит, ухудшение общего состояния, снижение массы тела, гибель). Первичная реакция (отек на правой лапе) оценивается онкометрически на 3-й день после инъекции адъюванта. Вторичная иммунологическая реакция (отек на левой лапе) оценивается на 14-й день после введения адъюванта (при профилактической схеме введения) или на 25-й день (при лечебной схеме введения).
Модели экспериментальной онкологии. Арсенал моделей экспериментальной онкологии включает спонтанные, перевиваемые и индуцированные опухоли животных, культуры опухолей человека и животных, опухоли человека, привитые животным, и молекулярно-генетические модели. Спонтанныеопухоли обнаруживаются у животных, не подвергшихся каким-либо воздействиям со стороны экспериментатора. Показано, что у кроликов часто возникает вызываемая ДНК-содержащим вирусом спонтанная папиллома. Она представляет собой доброкачественные бородавчатые разрастания на коже ушей, которые впоследствии превращаются в злокачественную опухоль, метастазирующую в легкие и лимфоузлы. Эта модель с успехом применяется для решения проблем вирусологии и иммунологии опухолей. Из домашних животных в большей степени опухолями поражаются собаки. У них возникают опухоли разных органов, чаще молочных желез. Спонтанные опухоли собак иногда используют на последних предклинических этапах испытания противоопухолевых химических соединений. Опухоли могут быть индуцированы различными видами облучения, химическими канцерогенами, онковирусами. Модели индуцированных вирусами опухолей животных, а также модели злокачественно трансформированных под влиянием вирусов клеток, культивируемых в условиях in vitro, позволили не только раскрыть многие тайны вирусного канцерогенеза, но и создать общую концепцию молекулярных механизмов возникновения опухолей. Молекулярно-генетические модели. С развитием молекулярной биологии появилась возможность исследования механизмов злокачественной трансформации на молекулярном уровне. Интересующий экспериментатора ген может быть выделен из генома, клонирован (то есть получено много его копий) и расшифрована его структура. Кроме того, ген может быть перенесен в геном другого животного, которое будет называться трансгенным. Манипулирование с генами позволяет также осуществить выбивание (нокаут) определенного гена /3/.
Моделирование гипертонической болезни. В опытах на животных (собаки, обезьяны) была показана принципиальная возможность моделирования гипертонической болезни путем создания тяжелых невротических расстройств. Использование столкновения наиболее сильных врожденных рефлексов – полового и оборонительного приводило к невротическим состояниям со стойкими соматическими нарушениями в виде стабильного повышения артериального давления. В этих и других опытах было установлено, что сердечно-сосудистая патология, гипертоническая болезнь как ее изначальное проявление – наиболее частое соматическое проявление неврозов /4/.
Таким образом, моделирование патологических состояний на животных помогает выяснить этиологию, патогенез заболеваний, методы лечения и профилактики. Биологическое моделирование также широко используется на доклинической стадии при исследовании механизмов действия новых лекарственных препаратов.
Читайте также:

