Внутриутробный гепатит от чего
Обновлено: 26.04.2024
Для цитирования: Садова Н.В., Заплатников, Шипулина О.Ю. и др. TORCH-синдром: клиническая диагностика и этиологическая верификация. РМЖ. 2014;3:194.
TОRCH-синдром, или TОRCH-инфекции, – это обобщенное название, используемое для обозначения группы внутриутробных инфекций (ВУИ). В основе термина, который предложил Andre J. Nahmias в 1971 г., лежит сокращение (по первым буквам) латинских названий наиболее часто верифицируемых врожденных инфекций:
T – токсоплазмоз (Тoxoplasmоsis)
О – другие инфекции (Оther)
R – краснуха (Rubella)
С – цитомегалия (Cytomegalia)
Н – инфекции, вызванные вирусом простого герпеса (Herpes).
ВУИ – инфекционно-воспалительные заболевания плода и новорожденного. Несмотря на то, что ВУИ имеют различную этиологию, их объединяют общие эпидемиологические закономерности и сходные клинические проявления [1–3, 7–9]. ВУИ возникают в результате анте- или интранатального инфицирования плода.
ВУИ считаются одной из наиболее острых проблем современной медицины, решение которой возможно только при междисциплинарном подходе и совместной работе специалистов-медиков различных профилей (акушеры-гинекологи, инфекционисты, неонатологи, педиатры, эпидемиологи). Актуальность ВУИ обусловлена целым рядом факторов, главными среди которых являются:
– широкая распространенность потенциальных возбудителей среди всех групп населения;
– бессимптомное течение или отсутствие патогномоничных клинических симптомов;
– высокий риск развития патологии у плода или новорожденного при первичном инфицировании женщины во время беременности;
– возможность обострения латентной инфекции у иммунокомпрометированных женщин во время беременности с потенциальным риском внутриутробного заражения плода;
– существенное место ВУИ в структуре неблагоприятных исходов беременности (выкидыши, мертворождение, преждевременные роды);
– тератогенное влияние возбудителей ВУИ на эмбриогенез и ранний фетогенез, приводящее к развитию у плода врожденных пороков. Неблагоприятное влияние внутриутробного инфекционно-воспалительного процесса с поражением ЦНС, сердца, печени, почек и других органов и систем;
– высокий уровень летальности среди новорожденных и грудных детей с манифестными формами ВУИ;
– неблагоприятное воздействие ВУИ на состояние здоровья детей в последующие периоды постнатального развития, в ряде случаев приводящее к инвалидизации и снижению качества жизни в целом.
Истинная частота врожденных инфекций до настоящего времени не установлена, хотя, по данным ряда авторов, распространенность внутриутробного инфицирования в некоторых случаях может достигать 10–15%.
ВУИ во многом определяют уровень перинатальной и младенческой смертности, а также инвалидизацию выживших детей. В подавляющем большинстве случаев источником инфекции для плода является мать. Механизм передачи инфекции – вертикальный. В антенатальный период передача инфекции может происходить трансовариальным, трансплацентарным и восходящим путями, в интранатальный период – контактным, алиментарным. Ятрогенное инфицирование плода встречается крайне редко и только в тех случаях, когда нарушены правила асептики при проведении инвазивных методов пренатальной диагностики (амниоцентез, кордоцентез и др.) и лечения (введение лекарственных средств и препаратов крови через сосуды пуповины и др.) [2, 5, 8, 9].
При антенатальном инфицировании этиология ВУИ представлена, как правило, различными вирусами (цитомегаловирус, вирус краснухи, Коксаки и ЕСНО-вирусы и др.), токсоплазмой и микоплазмой. Интранатальное заражение характеризуется более широким спектром возбудителей и зависит от особенностей микробного пейзажа слизистых оболочек родовых путей матери. Наиболее часто в этот период происходит инфицирование плода такими микроорганизмами, как стрептококки группы В, различные энтеробактерии, стафилококки, герпес-вирусы, ВИЧ, микоплазмы, уреаплазмы, хламидии, грибы и др.
Фактором риска внутриутробного инфицирования плода является отягощенный соматический, акушерско-гинекологический и инфекционный анамнез. При этом риск инфицирования значительно повышается при воспалительных заболеваниях урогенитального тракта, неблагоприятном течении беременности (инфекционные заболевания, тяжелый гестоз, угроза прерывания, патологическое состояние маточно-плацентарного барьера) и патологических родах.
Прогноз при ВУИ зависит от срока гестации, в котором произошло инфицирование, особенностей возбудителя (патогенные свойства, тропность и т. д.), функционального состояния иммунной системы матери, состояния маточно-плацентарного барьера и др. Наиболее часто инфицирование плода и развитие тяжелых форм ВУИ отмечают в тех случаях, когда во время беременности женщина переносит первичную инфекцию.
Инфицирование в период эмбриогенеза приводит к самопроизвольному выкидышу или возникновению тяжелых, несовместимых с жизнью пороков развития (табл. 1). Проникновение возбудителя в организм плода в ранний фетальный период ведет к развитию инфекционно-воспалительного процесса, который характеризуют преобладание альтернативного компонента и формирование в поврежденных органах фиброзно-склеротических деформаций. Инфицирование плода в поздний фетальный период может приводить как к поражению отдельных органов и систем, так и к генерализованному воспалению (гепатит, кардит, менингоэнцефалит, хориоретинит, поражение органов кроветворения и др.) (табл. 1). При интранатальном инфицировании клиническая манифестация ВУИ в подавляющем большинстве случаев происходит в ранний неонатальный период, но может отмечаться и в последующие недели жизни.
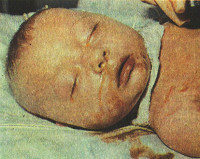
Клинические проявления TОRCH-синдрома в подавляющем большинстве случаев зависят не только от этиологии, но и от сроков беременности, когда произошло инфицирование. Манифестные формы ВУИ у новорожденных имеют сходные клинические проявления. При этом очень часто дети рождаются раньше срока или с признаками задержки внутриутробного развития, гепатоспленомегалией. Нередко у детей с ВУИ отмечаются желтуха, экзантемы, дыхательные и разнообразные неврологические нарушения, геморрагические синдромы, анемия (рис. 1). При этом необходимо особо подчеркнуть крайне низкую достоверность диагноза, если используется анализ только клинических особенностей заболевания. В то же время достоверную верификацию этиологии ВУИ следует провести как можно раньше, учитывая, что в настоящее время возможно применение эффективных этиотропных лекарственных препаратов для целого ряда ВУИ (ацикловир – при врожденном герпесе, бензилпенициллин – при врожденных сифилисе и стрептококковой В инфекции, ампициллин – при врожденном листериозе, макролиды – при внутриутробных микоплазмозе, хламидиозе и уреаплазмозе, пириметамин + сульфаниламид или спирамицин – при врожденном токсоплазмозе и др.).
Применяя ПЦР, целесообразно использовать современные методики количественного определения ДНК или РНК инфекционных агентов, основанные на амплификации с гибридизационно-флуоресцентной детекцией продуктов анализа в режиме реального времени, а также параллельно тестировать несколько биологических сред (кровь, спинномозговая жидкость, моча, назофарингеальные мазки, эндотрахеальные аспираты и др.). Подобный подход достоверно увеличивает клиническую информативность проводимых исследований, позволяет оценить динамику развития инфекционного процесса и эффективность этиотропной терапии.
Критериями верификации этиологии ВУИ является выявление у новорожденного ребенка специфических IgM и/или генома (ДНК, РНК) возбудителя. Косвенным лабораторным признаком ВУИ определенной этиологии является детекция специфических IgG c низким индексом авидности при отсутствии специфических IgM (рис. 2). Диагностическое значение низкоавидных специфических IgG существенно повышается, если при параллельном серологическом обследовании матери у нее выявляют высокоавидные специфические IgG [2, 5, 8, 10].
Таким образом, в настоящее время имеются высокочувствительные и высокоспецифичные методы лабораторной диагностики, которые позволяют быстро и с высокой степенью достоверности верифицировать этиологию заболевания, что определяет возможность раннего начала этиотропной терапии для улучшения прогноза ВУИ.
Врожденные гепатиты у детей – это группа гетерогенных заболеваний, возникающих в результате внутриутробного воздействия патогенных факторов на печень плода. Клинически такие патологии могут проявляться холестатическим синдромом, гепатоспленомегалией, отставанием в психофизическом развитии, неврологической симптоматикой. Лабораторная диагностика основывается на определении уровня АлАТ, АсАТ, билирубина, щелочной фосфатазы, HBs- HBe- HBc-антигенов, РСК, ПЦР, ИФА. Основное лечение – этиотропная терапия, коррекция рациона и водно-электролитного баланса. При необходимости проводится патогенетическая фармакотерапия, хирургическая коррекция или трансплантация печени.
Общие сведения
Врожденные гепатиты у детей – это полиэтиологическая группа острых или хронических воспалительных, дистрофических и пролиферативных заболеваний печени, возникающих во внутриутробном периоде либо во время родов. Суммарная распространенность всех форм составляет 1:5 000-10 000. Среди всех новорожденных порядка 15% инфицируются трансплацентарно и 10% – непосредственно во время родов. Вероятность развития врожденного гепатита у детей зависит от этиологического фактора. При остром вирусном гепатите В она составляет до 90%, при HCV-инфекции – около 5%. Прогностически благоприятными формами врожденных гепатитов у детей считаются холестатические, неблагоприятными – с выраженной гепатоцеллюлярной недостаточностью. Во втором случае летальность на первом году жизни достигает 40%.

Причины врожденных гепатитов у детей
Ведущую роль в этиологии врожденных гепатитов у детей играют вирусные инфекции из группы TORCH: цитомегаловирус, вирусы гепатита В и простого герпеса человека, вирусы Эпштейна-Барр, ECHO, краснухи. Также развитие этой группы патологий могут вызывать перенесенные во время беременности бактериальные и паразитарные заболевания: сифилис, листериоз, туберкулез, токсоплазмоз. К факторам риска со стороны матери относятся бесконтрольный прием медикаментов с гепатотоксическими свойствами, употребление алкоголя, табачных изделий, наркотических веществ. Со стороны ребенка спровоцировать развитие врожденного гепатита у детей могут наследственные ферментопатии: муковисцидоз, галактоземия, дефицит α1-антитрипсина и тирозина. Довольно часто точную этиологию определить не удается. В таком случае устанавливается диагноз идиопатический врожденный гепатит.
Механизм заражения при врожденных гепатитах у детей основывается на трансплацентарной (вертикальной) передаче вирусных или инфекционных агентов от матери к ребенку или их интранатальной аспирации вместе с околоплодными водами. Реже заражение происходит при контакте кожи и слизистых оболочек ребенка с инфицированными родовыми путями. Развитие врожденного гепатита во внутриутробном периоде обычно происходит в III триместре. Риск заражения ребенка в первой половине беременности при остром гепатите В или С составляет до 10%. Воздействие TORCH-инфекций на плод в I-II триместре может привести к спонтанному аборту.
В основе патогенеза врожденных гепатитов у детей помимо структурных изменений гепатоцитов (баллонной или вакуольной дистрофии и др.) лежит холестатический синдром. Его главное морфологическое проявление – имбибиция цитоплазмы желчными пигментами и образование желчных тромбов в начальных отделах внутрипеченочных ходов. Также при врожденных гепатитах у детей возможна гипо- или аплазия внепеченочных отделов желчевыводящих путей, что еще больше усугубляет холестаз.
Симптомы врожденных гепатитов у детей
Первые симптомы бактериальных врожденных гепатитов у детей возникают на 2-3 сутки после рождения. Как правило, отмечается субфебрильная или фебрильная температура тела, диарея, увеличение печени. Часто развиваются пневмонии и инфекционно-токсический шок, появляются признаки энцефалита. В зависимости от возбудителя наблюдаются характерные клинические особенности. Для ЦМВ характерны геморрагии, микроцефалия или гидроцефалия, поражения сетчатки, легких и почек. При краснухе отмечается незаращение артериальной протоки, поражение хрусталика и внутреннего уха. Токсоплазмозный врожденный гепатит у детей сопровождается кожными высыпаниями, гидро- и микроцефалией, хориоретинитом. При герпес-вирусном гепатите, помимо других симптомов, возникают высыпания на коже, слизистых оболочках рта и конъюнктивы, а также геморрагический синдром и ДВС-синдром. При заболевании сифилитической этиологии формируется специфическая сыпь на коже и слизистых, обнаруживается периостит.
Диагностика и лечение врожденных гепатитов у детей
Диагностика врожденных гепатитов у детей включает в себя сбор анамнеза, объективное обследование ребенка, лабораторные анализы и инструментальные методы исследования. Анамнестические данные дают возможность определить, в каком возрасте возникли первые признаки заболевания и какими они были. Также они могут указывать на потенциальные этиологические факторы. При физикальном обследовании педиатром внимательно осматриваются все кожные покровы и видимые слизистые оболочки на предмет желтухи и высыпаний. Оцениваются размеры печени и селезенки, размеры живота, определяются возможные неврологические расстройства.
При врожденных гепатитах у детей наблюдаются неспецифические изменения лабораторных анализов. Наиболее информативными являются печеночные трансаминазы – АлАТ и АсАТ, уровень которых значительно повышается. Также отмечается повышение уровня билирубина (как прямой, так и непрямой фракций), щелочной фосфатазы. При исследовании кала удается выявить отсутствие в нем желчи (ахолия), в моче определяется наличие уробилина. В диагностике врожденных гепатитов у детей крайне важными являются вирусологические и иммунологические исследования, которые позволяют установить этиологию заболевания. Среди них используются определение HBs- HBe- HBc-антигенов в крови, Ig M и G при ИФА, бактериальные посевы крови и ликвора, ПЦР и РСК.
Среди инструментальных методов исследования при врожденных гепатитах у детей информативными могут быть УЗИ и биопсия. При ультразвуковом исследовании определяются структурные изменения паренхимы печени, желчного пузыря и желчевыводящих путей. Пункционная биопсия печени используется с целью подтверждения диагноза на фоне нечеткости клинической картины и лабораторных результатов. По данным цитологического исследования тканей печени при врожденных гепатитах у детей может выявляться фиброз, склероз или некроз печеночных ацинусов, наличие гигантских клеток, лимфо- и плазмоцитарная инфильтрация, имбибиция цитоплазмы желчными пигментами.
Специфическое этиотропное лечение врожденных гепатитов у детей осуществляется в соответствии с их этиологией. При идиопатических формах применяется только патогенетическая и симптоматическая терапия. Проводится коррекция рациона ребенка, при подтверждении острой патологии у матери показан перевод на искусственные смеси, в других случаях – грудное вскармливание, нормализация водно-электролитного баланса. Смеси, применяемые у таких детей, должны быть богатыми на триглицериды, кальций, фосфор, цинк и водорастворимые витамины. При наличии холестатического синдрома в рацион ребенка также включают витамины A и E. Помимо коррекции питания могут назначаться гепатопротекторы, желчегонные, глюкокортикостероиды, интерфероны в зависимости от клинической ситуации. При наличии структурных аномалий или атрезии желчевыводящих путей выполняется их хирургическая коррекция. В тяжелых случаях врожденного гепатита у детей показана трансплантация печени.
Прогноз и профилактика врожденных гепатитов у детей
Прогноз при врожденном гепатите у детей зависит от этиологии, тяжести состояния ребенка и эффективности лечения. Показатель смертности на первом году жизни составляет 25-40%. Сюда преимущественно относятся формы, которые сопровождаются выраженной гепатоцеллюлярной недостаточностью. Еще у 35-40% детей формируются хронические заболевания печени и различные осложнения. Наиболее распространенными среди них являются холестатический синдром, синдромы недостаточности витаминов D, E и K, цирроз печени и фиброзирующий хронический гепатит, портальная гипертензия и острая печеночная недостаточность, энцефалопатия, задержка физического развития.
Специфическая профилактика врожденных гепатитов у детей проводится при выявлении у матери в крови HBs-антигенов или подтверждении диагноза острого гепатита. Таким детям уже в первый день жизни осуществляется вакцинация донорскими иммуноглобулинами и рекомбинантной вакциной. В 1 и 6 месяцев показана повторная вакцинация без иммуноглобулинов. Неспецифические профилактические меры включают в себя контроль над используемой донорской кровью и медицинским инструментарием, антенатальную охрану плода, регулярное посещение женской консультации и прохождение соответствующих обследований во время беременности.
Внутриутробные инфекции – группа заболеваний плода и новорожденного, развивающихся вследствие заражения в дородовом периоде или в родах. Внутриутробные инфекции могут приводить к гибели плода, самопроизвольному аборту, задержке внутриутробного развития, преждевременным родам, формированию врожденных пороков, поражению внутренних органов и ЦНС. Методы диагностики внутриутробных инфекций включают микроскопические, культуральные, иммуноферментные, молекулярно-биологические исследования. Лечение внутриутробных инфекций проводится с использованием иммуноглобулинов, иммуномодуляторов, противовирусных, антибактериальных препаратов.

Общие сведения
Внутриутробные инфекции – патологические процессы и заболевания, обусловленные антенатальным и интранатальным инфицированием плода. Истинная распространенность внутриутробных инфекций не установлена, однако, согласно обобщенным данным, с врожденными инфекциями рождается не менее 10% новорожденных. Актуальность проблемы внутриутробных инфекций в педиатрии обусловлена высокими репродуктивными потерями, ранней неонатальной заболеваемостью, приводящей к инвалидизации и постнатальной гибели детей. Вопросы профилактики внутриутробных инфекций лежат в плоскости рассмотрения акушерства и гинекологии, неонатологии, педиатрии.

Причины внутриутробных инфекций
Внутриутробные инфекции развиваются в результате инфицирования плода в дородовом периоде или непосредственно во время родов. Обычно источником внутриутробной инфекции для ребенка выступает мать, т. е. имеет место вертикальный механизм передачи, который в антенатальном периоде реализуется трансплацентарным или восходящим (через инфицированные околоплодные воды) путями, а в интранатальном - аспирационным или контактным путями.
Реже происходит ятрогенное инфицирование плода в период беременности при проведении женщине инвазивной пренатальной диагностики (амниоцентеза, кордоцентеза, биопсии ворсин хориона), введении плоду препаратов крови через сосуды пуповины (плазмы, эритроцитарной массы, иммуноглобулинов) и т. д.
В антенатальном периоде инфицирование плода обычно связано с вирусными агентами (вирусами краснухи, герпеса, цитомегалии, гепатита В и С, Коксаки, ВИЧ) и внутриклеточными возбудителями (токсоплазмоза, микоплазмоза).
В интранатальном периоде чаще происходит микробная контаминация, характер и степень которой зависит от микробного пейзажа родовых путей матери. Среди бактериальных агентов наиболее распространены энтеробактерии, стрептококки группы В, гонококки, синегнойная палочки, протей, клебсиелла и др. Плацентарный барьер непроницаем для большинства бактерий и простейших, однако при повреждении плаценты и развитии фетоплацентарной недостаточности, может произойти антенатальное микробное инфицирование (например, возбудителем сифилиса). Кроме этого, не исключается и интранатальное вирусное заражение.
Факторами возникновения внутриутробных инфекций служат отягощенный акушерско-гинекологический анамнез матери (неспецифические кольпиты, эндоцервициты, ЗППП, сальпингофориты), неблагополучное течение беременности (угроза прерывания, гестозы, преждевременная отслойка плаценты) и инфекционная заболеваемость беременной. Риск развития манифестной формы внутриутробной инфекции существенно выше у недоношенных детей и в том случае, когда женщина инфицируется первично во время беременности.
Известно, что тяжесть проявлений инфекционного процесса у беременной и у плода может не совпадать. Бессимптомное или малосимптомное течение инфекции и у матери может вызвать тяжелые поражения плода, вплоть до его гибели. Это связано с повышенным тропизмом вирусных и микробных возбудителей к эмбриональным тканям, преимущественно ЦНС, сердца, органа зрения.
Классификация
Этиологическая структура внутриутробных инфекций предполагает их деление на:
- вирусные (вирусный гепатит, герпес, краснуха, ОРВИ, цитомегалия, эпидемический паротит, энтеровирусная инфекция)
- бактериальные (туберкулез, сифилис, листериоз, сепсис)
- паразитарные и грибковые (микоплазмоз, токсоплазмоз, хламидиоз, кандидоз и др.)
Для обозначения группы наиболее распространенных внутриутробных инфекций используется аббревиатура TORCH-синдром, объединяющий токсоплазмоз (toxoplasmosis), краснуху (rubella), цитомегалию (cytomegalovirus), герпес (herpes simplex). Буквой О (other) обозначаются другие инфекции, в числе которых - вирусные гепатиты, ВИЧ-инфекция, ветряная оспа, листериоз, микоплазмоз, сифилис, хламидиоз и др.).
Симптомы внутриутробных инфекций
Наличие внутриутробной инфекции у новорожденного может быть заподозрено уже во время родов. В пользу внутриутробного инфицирования может свидетельствовать излитие мутных околоплодных вод, загрязненных меконием и имеющих неприятный запах, состояние плаценты (полнокровие, микротробозы, микронекрозы). Дети с внутриутробной инфекцией часто рождаются в состоянии асфиксии, с пренатальной гипотрофией, увеличенной печенью, пороками развития или стигмами дисэмбриогенеза, микроцефалией, гидроцефалией. С первых дней жизни у них отмечается желтуха, элементы пиодермии, розеолезных или везикулезных высыпаний на коже, лихорадка, судорожный синдром, респиратрные и кардиоваскулярные расстройства.
Ранний неонатальный период при внутриутробных инфекциях нередко отягощается интерстициальной пневмонией, омфалитом, миокардитом или кардитом, анемией, кератоконъюнктивитом, хориоретинитом, геморрагическим синдромом и др. При инструментальном обследовании у новорожденных могут обнаруживаться врожденная катаракта, глаукома, врожденные пороки сердца, кисты и кальцификаты мозга.
В перинатальном периоде у ребенка отмечаются частые и обильные срыгивания, мышечная гипотония, синдром угнетения ЦНС, серый цвет кожных покровов. В поздние сроки при длительном инкубационном периоде внутриутробной инфекции возможно развитие поздних менингитов, энцефалитов, остеомиелита.
Рассмотрим проявления основных внутриутробных инфекций, составляющих TORCH-синдром.
Врождённый токсоплазмоз
Внутриутробное инфицирование одноклеточным протозойным паразитом Toxoplasma Gondii приводит к тяжелым поражениям плода – задержке развития, врожденным порокам развития мозга, глаз, сердца, скелета.
После рождения в остром периоде внутриутробная инфекция проявляется лихорадкой, желтухой, отечным синдромом, экзантемой, геморрагиями, диареей, судорогами, гепатоспленомегалией, миокардитом, нефритом, пневмонией. При подостром течении доминирую признаки менингита или энцефалита. При хронической персистенции развивается гидроцефалия с микроцефалией, иридоциклит, косоглазие, атрофия зрительных нервов. Иногда встречаются моносимптомные и латентные формы внутриутробной инфекции.
К числу поздних осложнений врожденного токсоплазмоза относятся олигофрения, эпилепсия, слепота.
Врождённая краснуха
Внутриутробная инфекция возникает из-за заболевания краснухой при беременности. Вероятность и последствия инфицирования плода зависят от гестационного срока: в первые 8 недель риск достигает 80%; последствиями внутриутробной инфекции могут служить самопроизвольное прерывание беременности, эмбрио- и фетопатии. Во II триместре риск внутриутробного инфицирования составляет 10-20%, в III – 3-8%.
Дети с внутриутробной инфекцией обычно рождаются недоношенными или с низкой массой тела. Для периода новорожденности характерна геморрагическая сыпь, длительная желтуха.
Классические проявления врожденной краснухи представлены триадой Грега: поражением глаз (микрофтальмией, катарактой, глаукомой, хориоретинитом), ВПС (открытым артериальным протоком, ДМПП, ДМЖП, стенозом легочной артерии), поражением слухового нерва (сенсоневральной глухотой). В случае развития внутриутробной инфекции во второй половине беременности у ребенка обычно имеется ретинопатия и глухота.
Кроме основных проявлений врожденной краснухи, у ребенка могут выявляться и другие аномалии: микроцефалия, гидроцефалия, расщелины нёба, гепатит, гепатоспленомегалия, пороки развития мочеполовой системы и скелета. В дальнейшем внутриутробная инфекция напоминает о себе отставанием ребенка в физическом развитии, ЗПР или умственной отсталостью.
Врождённая цитомегалия
Внутриутробное заражение цитомегаловирусной инфекцией может приводить к локальному или генерализованному поражению многих органов, иммунодефициту, гнойно-септическим осложнениям. Врожденные дефекты развития обычно включают микроцефалию, микрогирию, микрофтальмию, ретинопатию, катаракту, ВПС и др. Неонатальный период врожденной цитомегалии осложняется желтухой, геморрагическим синдромом, двусторонней пневмонией, интерстициальным нефритом, анемией.
К отдаленным последствиям внутриутробной инфекции относятся слепота, нейросенсорная глухота, энцефалопатия, цирроз печени, пневмосклероз.
Врождённая герпетическая инфекция
Внутриутробная герпес-инфекция может протекать в генерализованной (50%), неврологической (20%), слизисто-кожной форме (20%).
Генерализованная внутриутробная врожденная герпетическая инфекция протекает с выраженным токсикозом, респираторным дистресс-синдромом, гепатомегалией, желтухой, пневмонией, тромбоцитопенией, геморрагическим синдромом. Неврологическая форма врожденного герпеса клинически проявляется энцефалитом и менингоэнцефалитом. Внутриутробная герпес-инфекция с развитием кожного синдрома сопровождается появлением везикулярной сыпи на кожных покровах и слизистых оболочках, в т. ч. внутренних органов. При наслоении бактериальной инфекции развивается сепсис новорожденных.
Внутриутробная герпес-инфекция у ребенка может приводить к формированию пороков развития - микроцефалии, ретинопатии, гипоплазии конечностей (кортикальной карликовости). В числе поздних осложнений врожденного герпеса - энцефалопатия, глухота, слепота, задержка психомоторного развития.
Диагностика
В настоящее время актуальной задачей является пренатальная диагностика внутриутробных инфекций. С этой целью на ранних сроках беременности проводится микроскопия мазка, бактериологический посев из влагалища на флору, ПЦР-исследование соскоба, обследование на TORCH-комплекс. Беременным из группы высокого риска по развитию внутриутробной инфекции показана инвазивная пренатальная диагностика (аспирация ворсин хориона, амниоцентез с исследованием амниотической жидкости, кордоцентез с исследованием пуповинной крови).
Возможно выявление эхографических маркеров внутриутробных инфекций с помощью акушерского УЗИ. К косвенным эхографическим признакам внутриутробного инфицирования относятся маловодие или многоводие; наличие гиперэхогенной взвеси в околоплодных водах или амниотических тяжей; гипоплазия ворсин хориона, плацентит; преждевременное старение плаценты; отечный синдром плода (асцит, перикардит, плеврит), гепатоспленомегалия, кальцификаты и пороки развития внутренних органов и др. В процессе допплерографического исследования кровотока выявляются нарушения плодово-плацентарного кровотока. Кардиотокография обнаруживает признаки гипоксии плода.
После рождения ребенка с целью достоверной верификации этиологии внутриутробной инфекции используются микробиологические (вирусологические, бактериологические), молекулярно-биологические (ДНК-гибридизация, ПЦР), серологические (ИФА) методики обследования. Важное диагностическое значение имеет гистологическое исследование плаценты.
По показаниям новорожденные с внутриутробными инфекциями в первые сутки жизни должны быть осмотрены детским неврологом, детским кардиологом, детским офтальмологом и др. специалистами. Целесообразно провести ЭхоКГ, нейросонографию, офтальмоскопию, исследование слуха методом вызванной отоакустической эмиссии.
Лечение внутриутробных инфекций
Общие принципы лечения внутриутробных инфекций предполагают проведение иммунотерапии, противовирусной, антибактериальной и посиндромной терапии.
Иммунотерапия включает применение поливалентных и специфических иммуноглобулинов, иммуномодуляторов (интерферонов). Противовирусная терапия направленного действия осуществляется, главным образом, ацикловиром. Для противомикробной терапии бактериальных внутриутробных инфекций используются антибиотики широкого спектра действия (цефалоспорины, аминогликозиды, карбапенемы), при микоплазменной и хламидийной инфекциях – макролиды.
Посиндромная терапия внутриутробных инфекций направлена на купирование отдельных проявлений перинатального поражения ЦНС, геморрагического синдрома, гепатита, миокардита, пневмонии и т. д.
Прогноз и профилактика
При генерализованных формах внутриутробных инфекций летальность в неонатальном периоде достигает 80%. При локальных формах возникают серьезные поражения внутренних органов (кардиомиопатии, ХОБЛ, интерстициальный нефрит, хронический гепатит, цирроз и т. д.). Практически во всех случаях внутриутробные инфекции приводят к поражению ЦНС.
Профилактика внутриутробных инфекций заключается в проведении предгравидарной подготовки, лечении ЗППП до наступления беременности, исключении контактов беременной с инфекционными больными, коррекции программы ведения беременности у женщин групп риска. Женщины, ранее не болевшие краснухой и не получавшие прививки против краснухи, должны быть вакцинированы не позднее, чем за 3 месяца до предполагаемой беременности. В ряде случаев внутриутробные инфекции могут являться основанием для искусственного прерывания беременности.
Гепатит В у детей – инфекционное поражение печеночной паренхимы, вызываемое гепатотропным вирусом типа В. Специфические проявления гепатита В у детей развиваются в желтушном периоде, когда появляется потемнение мочи, обесцвечивание кала, желтая окраска глазных склер, слизистых и кожных покровов, тяжесть и боль в правом подреберье. Диагностика гепатита В у детей проводится на основании клинико-лабораторных данных (симптоматики, биохимического анализа крови, определения маркеров). Базовая терапия гепатита В у детей включает диету, интерферонотерапию, дезинтоксикационную терапию, назначение гепатопротекторов, сорбентов, витаминов; в тяжелых случаях – плазмаферез и гемосорбцию.
Общие сведения
Гепатит В у детей (парентеральный или сывороточный гепатит) – специфическое вирусное воспаление печени, протекающее в острой или хронической форме. Возбудителем гепатита В у детей является ДНК-содержащий вирус, высоко патогенный и чрезвычайно устойчивый к воздействиям окружающей среды. При инфицировании ребенка вирусом гепатита В в перинатальном периоде или грудном возрасте вероятность хронического поражения печени возрастает до 70-90%. У 20-35% людей, инфицированных гепатитом В в детстве, в дальнейшем развивается цирроз печени или первичная гепатоцеллюлярная карцинома. Профилактика и повышение эффективности лечения гепатита В у детей служит одной из приоритетных задач педиатрии.

Причины гепатита В у детей
Гепатит В у детей является типичной антропонозной инфекцией; источником заражения выступают как больные люди, так и вирусоносители. Основными путями инфицирования детей гепатитом В служат трансплацентарный (внутриутробное заражение), интранатальный (в процессе родов), постнатальный (послеродовый).
Трансплацентарный путь передачи реализуется в 6-8 % всех зафиксированных случаев. Особенно часто инфицирование плода происходит на фоне фетоплацентарной недостаточности и отслойки плаценты. Внутриутробное инфицирование плода вирусом гепатита В грозит преждевременными родами. Интранатальная передача вируса гепатита В у детей (около 90%) обусловлена контактом ребенка с биологическими жидкостями и кровью инфицированной матери при прохождении по родовым путям. Постнатальное заражение ребенка происходит в процессе кормления грудью или ухода за младенцем: при нарушении целостности кожи и слизистых оболочек у ребенка, тесном контакте с инфицированной матерью, выделении вируса с кровью из трещин сосков.
В более старшем возрасте заражение детей гепатитом В может происходить при использовании общих полотенец, мочалок, зубных щеток и др. предметов гигиены, а также половым путем (у подростков). Не исключается возможность инфицирования детей гепатитом В при проведении гемотрансфузии, инвазивных лечебно-диагностических процедур. Риск развития гепатита В повышен у детей, находящихся на почечном диализе. Высока вероятность инфицирования среди подростков-наркоманов, использующих общие иглы и шприцы.
Незрелость иммунной системы детей обусловливает быстрое распространение вируса гепатита В через жидкие среды организма и поражение паренхимы печени. Обычно острая форма гепатита В у детей протекает быстро и заканчивается выздоровлением с выработкой стойкого пожизненного иммунитета к вирусу. При латентном, бессимптомном течении гепатита В у детей во взрослом возрасте может быть случайно выявлено рубцовое изменение ткани печени. Дети с хроническим гепатитом В являются пожизненными вирусоносителями.
Симптомы гепатита В у детей
Циклическое течение гепатита В у детей включает инкубационный (латентный), преджелтушный, желтушный периоды и период реконвалесценции.
Продолжительность инкубационного периода составляет 2-4 месяца и определяется инфицирующей дозой, путем заражения и возрастом ребенка. В случае переливания инфицированных компонентов крови длительность латентного течения гепатита В у ребенка уменьшается до 1,5-2 месяцев, при других путях заражения может увеличиваться до 4-6 месяцев. Чем меньше возраст ребенка, тем непродолжительнее инкубационный период. На данном этапе клинические проявления гепатита отсутствуют, однако в конце периода в крови обнаруживаются маркеры гепатита В (НВsAg, НВeAg, анти-НВсAg IgM) и высокая активность печеночных ферментов.
В преджелтушном периоде, который длится от нескольких часов до 2-3 недель, преобладает общая инфекционная астения (слабость, вялость), миалгии и артралгии, кожные высыпания, абдоминальный синдром, срыгивания, рвота, снижение аппетита, метеоризм, понос. Иногда первыми клиническими признаками гепатита В у детей служат потемнение мочи и обесцвечивание кала. В крови отмечается повышенный уровень трансаминаз и прямого билирубина, обнаруживается ДНК вируса.
Период желтухи при гепатите В у детей может длиться от 7-10 дней до 1,5-2 месяцев. Появлению желтухи во всех случаях предшествует изменение цвета мочи и кала. Интенсивность желтушного окрашивания кожи и видимых слизистых оболочек нарастает в течение 7 дней и сохраняется еще 1-2 недели. В отличие от гепатита А, при гепатите В с появлением желтухи обще состояние не улучшается, а интоксикационный синдром, напротив, усиливается: температура тела повышается до 38°С, нарастает вялость, заторможенность, адинамия. У детей с гепатитом В может отмечаться появление пятнисто-папулезной сыпи на коже, артериальная гипотония, увеличение размеров печени, иногда – селезенки. На высоте желтушного периода в крови регистрируется максимальная активность трансаминаз, снижение ПТИ, гипоальбуминемия.
При благоприятном течении гепатита В у детей заболевание оканчивается периодом реконвалесценции, который продолжается 3-4 месяца. Постепенно исчезает желтуха, нормализуется аппетит, сон, активность, показатели крови. Гепатит В у детей может иметь острое (до 3 мес.), затяжное (до 6 мес.) и хроническое (более 6 мес.) течение.
У грудных детей преобладают среднетяжелые и тяжелые формы гепатита В, возможны летальные исходы вследствие злокачественного течения заболевания. В последнем случае у детей быстро нарастает картина печеночной энцефалопатии, печеночной недостаточности, развивается печеночная кома.
Диагностика гепатита В у детей
Постановке обоснованного диагноза способствует осмотр ребенка педиатром и детским инфекционистом, анализ сведений о развитии и течении заболевания (цикличность, характерная симптоматика), эпидемиологический анамнез (предшествующие гемотрансфузии, инъекции, инвазивные манипуляции, операции) и т. п.
Основная роль в диагностике гепатита В у детей принадлежит лабораторным методам: обнаружению маркеров (HBsAg, HBeAg, анти-HBs, анти-НВе, анти-НВс), изменению биохимических показателей крови (повышению уровня билирубина и увеличению активности трансфераз).
При подозрении на гепатит В у детей в преджелтушном периоде следует исключить грипп, ОРВИ, пищевые токсикоинфекции, артрит; в желтушном периоде - вирусные гепатиты А, С, Е, желтую лихорадку, инфекционный мононуклеоз, цитомегаловирусную инфекцию, синдром Жильбера, ЖКБ, холангит, панкреатит, цирроз печени и пр. С целью дифференциальной диагностики дополнительно проводятся МР холангиография, УЗИ печени и желчного пузыря, сцинтиграфия печени, пункционная биопсия печени.
Лечение гепатита В у детей
Дети с диагностированным гепатитом В подлежат госпитализации в инфекционное отделение. В течение всего желтушного периода показан постельный режим, затем – щадящий режим. Назначается диета (стол №5 по Певзнеру) с преобладанием молочно-растительной, механически и химически щадящей пищей, обильное питье.
Базисная лекарственная терапия гепатита В у детей включает витамины групп В, С, А, Е; спазмолитики (папаверин, дротаверин), гепатопротекторы, желчегонные средства. При тяжелых формах гепатита В у детей показаны интерфероны, дезинтоксикационная терапия, трансфузии плазмы и альбумина, при необходимости - глюкокортикоиды, гепарин, мочегонные препараты, плазмаферез, гемосорбция.
Диспансерное наблюдение реконвалесцентов проводится в течение 1 года (каждые 3 месяца) с осмотром кожи и видимых слизистых, определением размеров печени и селезенки, оценкой цвета мочи и кала, определением лабораторных показателей. Детям, перенесшим гепатит В, рекомендуется санаторное лечение в учреждениях гастроэнтерологического профиля.
Прогноз и профилактика гепатита В у детей
Типичные формы гепатита В у детей, как правило, заканчиваются выздоровлением. Переход в хроническую форму отмечается в 2-18% случаев. Перенесенный в детстве гепатит В сопровождается формированием стойкого пожизненного иммунитета.
Осложнениями гепатита В у детей могут являться хронический гепатит или цирроз печени, резко повышающие риски развития гепатоцеллюлярной карциномы во взрослом возрасте. При злокачественном течении гепатита В у детей летальность крайне высока (75%).
Самым надежным способом профилактики гепатита В у детей является вакцинация, которая осуществляется трехкратно: в первые сутки после рождения ребенка, 1 и 6 месяцев жизни рекомбинантными вакцинами Регевак, Энджерикс В, Эувакс В, Комбиотех и др. Вакцинация против гепатита В обеспечивает 95% защиту от инфекции на 15 лет.
Неспецифическая профилактика гепатита В у детей предполагает использование одноразового медицинского инструментария, тщательную обработку и стерилизацию многоразовых инструментов, обследование доноров, проведение трансфузионной терапии по строгим показаниям.
Для цитирования: Московская И.А., Карпова З.С., Наумова В.А. и др. Перинатальный гепатит В и С - проблемы диагностики, лечения и профилактики. РМЖ. 2003;16:909.
Центр детской гепатологии, Тула
П еринатальная передача вирусов гепатитов В (HBV) и С (HCV) от матери ребенку может реализоваться пренатально (трансплацентарно), интранатально (во время родов) или постнатально – во время ухода за новорожденным [11].
Большинство проведенных в этой области исследований посвящено изучению риска инфицирования детей, родившихся у больных острой и хронической формами гепатитов, а также носителей различных маркеров вирусов [6, 12].
Клинические проблемы диагностики, лечения и исходов перинатального инфицирования, а также их связь с выраженностью проявлений гепатита у матери однозначного решения пока не получили. Р.Ю. Кольнер отмечала трудность дифференциальной диагностики гепатита у детей грудного возраста, что наряду с отсутствием настороженности врачей, нечеткостью клинических проявлений приводит к поздней госпитализации [5].
Наблюдение в динамике за пациентами, поступавшими в Детскую инфекционную больницу г. Тулы в первые месяцы после рождения, позволило нам накопить определенный опыт и оценить необычайную сложность для повседневной клинической практики проблем диагностики, лечения и профилактики перинатального инфицирования вирусами гепатитов [8].
Задачи настоящего исследования включают вопросы:
– Клинические проявления и исходы перинатальной HBV–инфекции.
– Частота перинатальной передачи младенцам HCV–инфекции и длительность циркуляции у них материнских специфических антител.
– Клинические проявления и исходы перинатальной HCV–инфекции.
– Клиническая эффективность интерферонотерапии при перинатальном инфицировании вирусами гепатитов В и С.
– Иммунологическая эффективность вакцины Engerix–B у рожденных женщинами с HBs –антигенемией.
По данным В.Ф. Учайкина с соавт. перинатальная инфекция HBV протекает в двух вариантах: преимущественно как персистентная малосимптомная инфекция с формированием так называемого первично–хронического гепатита и очень редко как манифестная острая циклическая инфекция. При манифестном врожденном гепатите В с рождения появляется выраженная желтуха, интенсивность которой быстро нарастает и продолжается от 2–3 недель до 2–3 месяцев [9]. У всех 42 детей, родившихся в Москве у женщин с персистирующей HBs–антигенемией и обследованных в динамике в клинике НИИ вирусологии, желтуха отсутствовала, клиническая симптоматика была скудной, гиперферментемия незначительной и не во вех случаях, HBs–антигене мия была транзиторной (максимальный период обнаружения HBsAg в крови – 144 дня) [11].
Среди наших пациентов перинатальный гепатит В диагностирован у 13 детей, в том числе у 2 завершивших курс вакцинопрофилактики против гепатита В. Матери 9 из них перенесли во время беременности острый вирусный гепатит В с исходом в выздоровление, у 4 диагностирован ХГВ.
Один ребенок, мама которого болела в 3 триместре беременности, в возрасте 3 месяцев был госпитализирован в отделение реанимации с клиникой фульминантного гепатита В, с летальным исходом. У 12 больных сформировался первично–хронический гепатит В. При оценке степени активности и стадии процесса мы использовали классификацию хронического гепатита у детей, предложенную В.Ф. Учайкиным с соавт [10]. Впервые госпитализированы в возрасте от 24 дней до 11 месяцев 7 больных, остальные в более старшем возрасте. Длительность наблюдения с момента госпитализации за 4 детьми полтора года, за двумя – 3,5 года, за шестью – 5–6 лет. Поводом для направления в стационар семи из них были гепато–лиенальный синдром, явления интоксикации, отставание в физическом развитии, изменения функции почек, пяти – обнаружение HBsAg при обследовании в связи с HBs–антигенемией у мамы во время беременности. При поступлении общее состояние этих 12 больных расценивалось как средней тяжести, отмечались плотная консистенция и увеличение размеров печени (на 2–6 см), у 7 – увеличение селезенки. Желтухи ни у одного ребенка не было. Нарушения функции почек (у 9) при динамическом наблюдении расценены нефрологами, как проявления пиелонефрита или интерстициального нефрита, ассоциированного с HBV–инфекцией. Функциональные пробы печени были изменены у всех больных: повышение активности АЛТ до 2,2–20 норм, АСТ до 2–12, ЩФ до 1,5–2,3 норм, у четырех – холестерина и b -липопротеидов. Диспротеинемия проявлялась повышением в сравнении с возрастной нормой g - и/или b -фракций глобулинов, снижением сулемовой пробы до 1,5–1,6 мл. Маркеры HBV–HBsAg, anti–HB cor Ig M – или Ig M + Ig G выявлены у всех больных, DNA HBV – у 11. При этом HBsAg определялся у всех больных в течение всего периода наблюдения, длительная (более 6 месяцев) репликативная активность HBV выявлена у 9.
При ультразвуковом исследовании печени у всех больных отмечено увеличение размеров, чаще за счет правой доли, повышение эхогенности паренхимы до 21 – 24 (в среднем 23±1,12 при возрастной норме 19,0±0,86), у 8 – закругление контуров, у 5 – уплотнение стенок воротной вены. Повышение гистоплотности паренхимы печени документировалось даже у самых маленьких (в возрасте 1 месяца) пациентов. При динамическом исследовании УЗ – картина соответствовала слабовыраженному фиброзу у 4, умеренному у 5, выраженному у 3 больных. Результаты морфологических исследований биоптатов печени у 3 больных соответствовали ультразвуковым признакам фиброза.
У 5 детей гепатит характеризовался низкой, у 2 умеренной, у 5 – выраженной активностью. У 3 из 5 детей с выраженной активностью ХГВ документировано антенатальное инфицирование, поскольку HBsAg у них был обнаружен на первом месяце жизни как перинатальный исход острого гепатита В у матерей.
Диагноз перинатального гепатита С чрезвычайно ответственен, поскольку определяет тактику ведения пациента, индивидуальный календарь прививок.
Под нашим наблюдением находилось 98 пар – матери, у которых во время беременности обнаружены антитела к вирусу гепатита С (anti–HCV), и их новорожденные дети. Сроки наблюдения – от 1,5 до 7 лет. В анамнезе 22 матерей были инфузии препаратов крови и/или оперативные вмешательства, у 29 парентеральное введение наркотиков, у 42 источник выяснить не удалось, у 5 детей инфицированы оба родителя. У 84 женщин обнаружена RNA HCV, генотипирование проведено у 15, в 11 случаях определен генотип 1b, в 4 – 3a.
На грудном вскармливании находилось 9 детей, материнское молоко в родильном доме получали 11, искусственное вскармливание с рождения – 87. У всех 9 детей, родившихся у женщин, у которых RNA HCV не обнаруживалась, anti–HCV в течение 6 месяцев элиминировали. Из 84 детей, рожденных женщинами, у которых RNA HCV обнаруживалась, у 66 (78,6%) anti–HCV элиминировали в возрасте от 5 до 12 месяцев. У 18 (21,4%) антитела определялись более 1,5 лет. У этих 18 детей была обнаружена RNA HCV – впервые в возрасте до 1 месяца у 6, в 3 месяца у 8 (из них у 2 в 1месяц RNA HCV не обнаружена), в 6–7 месяцев у 4 (из них у 2 в 1 месяц не обнаружена). У 5 детей RNA HCV обнаруживается и в возрасте старше 1 года: у трех в возрасте от 1 до 2 лет, у одного 6 лет, у одного 7,5 лет (срок наблюдения). Кроме того, из 8 родившихся у матерей со смешанной HCV и ВИЧ–инфекцией у 4 anti–HCV элиминировали в возрасте 12–15 месяцев, у 4 (50%) обнаружена HCV RNA, констатирована перинатальная передача HCV. Рожденные женщинами с HCV и ВИЧ–инфекцией наблюдаются с мамами в центре профилактики.
У 4 детей перинатальная HCV–инфекция протекала как острый гепатит, с повышением активности АЛТ и АСТ до 4–10 норм, с гипербилирубинемией, у 2 – за счет конъюгированной фракции, обнаружением anti–HCV и RNA HCV, с затяжным течением и исходом в выздоровление.
У 14 детей перинатальная HCV–инфекция проявлялась умеренной гепатомегалиeй, повышением до 2–6 норм активности АЛТ и АСТ, изменениями количественнных критериев эхографии печени. В этой группе у 5 наступило выздоровление, у 3 стабильная или длительная ремиссия (все 8 пролечены Вифероном), у 6 (в том числе у 3 пролеченных Вифероном) сформировался первично–хронический гепатит С с умеренной активностью.
При диагностировании хронического гепатита В, С проводится лечение Вифероном в суппозиториях, или Рофероном–А, или Интроном А внутримышечно из расчета 3 млн МЕ/м 2 тела [9]. Достоверной разницы частоты достижения ремиссии при монотерапии различными препаратами интерферона получено не было. Необходимость постоянных инъекций, побочные явления и возможные осложения ограничивают применение парентеральных препаратов в педиатрии. К применению у детей раннего возраста разрешен только интерферон a2b в суппозиториях (Виферон) [7].
Доза препарата – 3 млн МЕ/м 2 поверхности тела ребенка. Схема применения: 2 недели ежедневно 2 раза в сутки, затем трижды в неделю курсами от 6 до 9 месяцев. Катамнестическое наблюдение проведено за 10 пролеченными Вифероном по поводу перинатальной HВV и 15 –HСV – инфекцией.
Из 15 перинатально инфицированных HCV, завершивших лечение и обследованных в динамике, у 8 констатировано выздоровление с элиминацией RNA HCV и anti–HCV (в том числе у 3 детей с острым гепатитом). Из 7 больных хроническим гепатитом С (в том числе у одного ребенка как исход острого гепатита) у 4 наступила стабильная или длительная ремиссия, у 3 (20%) остается умеренная активность, постоянно обнаруживается anti–HCV и RNA HCV, прогрессируют признаки фиброза. У всех 3 детей, не получавших Виферон, сформировался хронический гепатит, с умеренной активностью, гепато–лиенальный синдром.
Все мамы при поступлении и в динамике обследованы, консультированы гепатологом, 6 из них – в Клинике им. В.В. Василенко ММА.
Приводим сведения о больной и двух ее детях с перинатальным гепатитом.
Через 5 дней после рождения первого ребенка мама была госпитализирована в инфекционное отделение, где диагностирован острый вирусный гепатит С, тяжелая клиническая форма. В дальнейшем сформировался и до настоящего времени диагностируется ХГС. Постоянно повышена до 2–3 норм активность АЛТ и АСТ. Определяются anti–HCV и RNA HCV, генотип 1b.
Ребенок П.С. родился 6.02.1996 г, в возрасте 8 дней поступил в отделение патологии новорожденных по поводу желтухи. При обследовании – билирубин 196 ммоль/л, реакция прямая. В отделение гепатитов ДИБ госпитализирован в возрасте 3 месяцев по поводу гепато–лиенального синдрома. При обследовании – anti–HCV и RNA HCV обнаружены, активность АЛТ и АСТ повышена до 8 норм. УЗИ – повышена гистоплотность паренхимы до 24 ед, нарушено соотношение долей, признаки фиброза. Получал комлексную терапию, в том числе Виферон курсами (рис. 1). В настоящее время – длительная ремиссия.
Рис. 1. Аминотрансферазы и маркеры HCV у больного перинатальным гепатитом СП.С. родился 6.02.1996 года
Ребенок П.М. родился 5.08.1999 г, с рождения наблюдался, получал Виферон (рис. 2). В возрасте 2 лет 11 месяцев констатировано выздоровление с элиминацией anti–HCV.
Рис. 2. Аминотрансферазы и маркеры HCV у больного перинатальным гепатитом СП.М. родился 5.08.1999 года
Нет оснований для оптимизма в плане безусловного профилактического эффекта от вакцинопрофилактики ГВ у рожденных женщинами с HBs–антигенемией. По данным М.В. Базаровой с соавторами [1], у 15 из 235 (6,4%) обследованных детей, рожденных женщинами с HBs–антигенемией, в возрасте 12 месяцев (перед четвертой прививкой) был обнаружен HBsAg. Harrison T.J. и Zuckerman A.J. пришли к заключению, что в организме матери присутствуют варианты HBV с генетическими отклонениями. Составляя незначительную часть всей вирусной популяции, они ускользают от нейтрализации при элиминации вирусов дикого типа и затем становятся доминирующим вариантом у новорожденных. Ускользающие от поствакцинального иммунитета мутанты были выявлены у вакцинированных и инфицированных детей [13].
Мы проводили вакцинопрофилактику и клинико– лабораторное наблюдение за 57 детьми, рожденным женщинами с HBs –антигенемией. При проведении поствакцинального скрининга HBsAg при отсутствии протективных антител обнаружен у 2. У остальных 55 титр anti–HBs превысил 100 МЕ/л, у 47 (82,4%) – был более 1000 МЕ/л. Представляют интерес результаты динамического определения поствакцинального иммунитета у детей, родившихся у женщин с персистирующей НВs–антигенемией . У 11 обследованных после 1 и 2 введения введения вакцины антитела не обнаруживались. У 20 детей выполнено два исследования по количественному определению anti–НВs – через месяц после третьего введения вакцины (в возрасте 3 месяца) и через месяц после четвертой вакцинации (в возрасте 13 месяцев). После трех иммунизаций отмечена выработка антител. Исследование после четырех введений продемонстрировало значительный бустерный эффект. Концентрацию anti–НВs выше 1000 МЕ/л выявили у 84,6%. Длительность латентной фазы первичного иммунного ответа, во время которой происходит представление антигена иммунокомпетентным клеткам и запуск пролифервации антигенспецифичных клонов клеток–антителпродуцентов, должна учитываться при оценке риска для новорожденного реализации HBV–инфекции.
Таким образом, при перинатальной HBV– инфекции отмечено формирование хронического гепатита у 12, острый фульминантный гепатит у 1 больного.
Перинатальная передача вируса гепатита С документирована у 18 детей, рожденных женщинами с anti–HCV и RNA HCV. Из 18 у 4 перинатальное инфицирование клинически проявилось в форме острого гепатита (у 1 с исходом в ХГ), у 8 протекало с минимальными клиническими проявлениями, у 6 сформировался хронический гепатит с умеренной активностью.
Эффективность Виферона зависела от этиологии гепатита. Применение Виферона оказалось эффективным у 12 (80%) детей с перинатальным инфицированием HCV: у 8 (в том числе 3 с острым гепатитом) наступило выздоровление, у 4 – ремиссия. Из 10 получавших виферон по поводу перинатального первично–хронического гепатита В ремиссия наступила у 4. Отмечена хорошая переносимость и безвредность препарата.
Учитывая угрозу реализации перинатальной HBV– инфекции у рожденных женщинами с HBs –антигенемией, необходимо в процессе вакцинации определять HBsAg, проводить функциональные пробы печени.
Дети, рожденные женщинами с anti–HCV, должны находиться под наблюдением до исключения или верификации перинатальной инфекции с определением активности цитолитических ферментов, anti–HCV и RNA HCV не реже 1 раза в 3 месяца для своевременного назначения лечения.
1. Базарова М.Ф., Шахгильдян И.В., Кузина Л.Е., Чешик С.Г. Вакцинопрофилактика гепатита В среди новорожденных, родившихся у женщин с персистирующей HBs – антитинемией. // Проблемы внутриутробной инфекции плода и новорожденного. : Материалы 111 съезда Российской ассоциации специалистов перинатальной медицины 11–13 сентября 2000 года, г.Москва.– М., 2000,с.241–243.
2. Воробьев А.А. /под редакцией/ Микробиология и иммунология. М,1999,420с
3. Горячева Л.Г., Шилова И.В, Мукомолова А.Л. Диагностика различных форм HCV–инфекции у детей. // Гепатит В,С и D – проблемы диагностики, лечения и профилактики. : Тезисы докладов V научно–практической конференции . М., 2003. с 65–66.
4. Ершова О.Н, Шахгильдян И.В., Кузин С.Н., Самохвалов Е.И, Кириллова И.Л., Розова А.В. Распространенность НС–вирусной инфекции у беременных женщин и частота перинатальной передачи вируса гепатита С. // Гепатит С (Российский консенсус):Тез. Докл. научно–практической конференции 26–27 сентября 2000 г.– М., 2000.– с.38–39
5. Кольнер Р.Ю. Болезнь Боткина у детей. Киев,1965. 255 с
6. Кузин С.Н. Сравнительная эпидемиологическая характеристика гепатитов с парентеральным механизмом передачи возбудителей в России и других странах СНГ: Автореф.дисс. . д–ра мед.наук.– М., 1998. –52с.
7. Малиновская В.В. Новый отечественный комплексный препарат Виферон и его применение в перинатологии и педиатрии при инфекционной патологии. Росс. вестник перинатологии и педиатрии, 1999, т.44, 3, 36–43
8. Московская И.А. HBV – инфекция у детей раннего возраста. //Педиатрия, 2003, № 3, с. 19–23.
9. Учайкин В.Ф., Нисевич Н.И., Чередниченко Т.В. Вирусные гепатиты от А до TTV у детей. М., 2003: 234–242, 418.
10. Учайкин В.Ф., Чередниченко Т.В., Писарев А.Г. Оценка течения хронического гепатита у детей.//Росс. Журнал гастроэнтерологии, гепатологии, колопроктологии, 2000 т Х, №2, с 48–53.
11. Шахгильдян И.В, Михайлов М.И.. Онищенко Г.Г. Парентеральные вирусные гепатиты. М.,2003: 196–203.
12. Шехтман М.М. Острые вирусные гепатиты: перинатальные исходы. // Акушерство и гинекология, 2000, № 4,с 3–6.
13. Harrison TJ, Zuckerman AJ. Hepatitis B virus antibodi escape mutants. // Drug News Perspect 1993; 6; 271–3.
14. Hitoshi Tajiri, Yoko Miyoshi, Shunpel Funato et al. Prospectiv studi of mother – to–infant transmisson of hepatitis C virus. // Pediatr Infect Dis J, 2001; 20:10–14.
Читайте также:

