Выделение вирусов из клетки
Обновлено: 07.05.2024
Физико-химическое изучение любого вируса, как правило, начинается с разработки метода его выделения и очистки. Обычно исходный материал представляет собой культуральную жидкость, тканевый экстракт и т.д. Во всех этих случаях вирус находится в смеси с большим количеством разнообразных балластных веществ – белков, пигментов, структурных компонентов клеток и т.п. Без удаления этих примесей невозможно проводить биохимические исследования вирусов.
Для очистки большинства вирусов с успехом применяют дифференциальное ультрацентрифугирование. Центрифугирование в градиенте плотности сахарозы делает возможным более тонкое разделение частиц, седимен- тационные свойства которых незначительно отличаются друг от друга. Методом равновесной седиментации в градиентах плотности цезиевых солей можно разделить частицы, обладающие различной плотностью.
В случае, если вирусы приходится выделять из больших объемов биологических жидкостей, прибегают к высаливанию сернокислым аммонием, осаждению органическими растворителями, осаждению в изоэлектрической точке. Наряду с этим используется ионообменная хроматография, гельфильтрация и т.д. Короче говоря, большинство методов, используемых для очистки белков, применимо и к вирусам. Однако существует и ряд специфических методов, применяемых для очистки только вполне определенных вирусов.
Например, миксовирусы можно очистить, используя их способность адсорбироваться на эритроцитах.
Общей схемы, пригодной для очистки любого вируса, в настоящее время не существует. Поскольку свойства вируса, так же как и химические свойства примесей, могут значительно варьировать у различных вируссодержащих материалов, то и выбор приемов очистки будет зависеть от каждого конкретного случая.
Высокоочищенные вирусы можно получить только благодаря применению целого ряда методов.
Идеальным методом выделения вирусов был бы тот, который обеспечил бы сохранение их биологической активности при полном разрушении клеточных компонентов и мембран. Однако такого метода нет. В зависимости от характера исходного материала и природы вируса приемы извлечения вирусов различны.
Выделение вирусов из зараженных клеток
Размалывание. Этот способ широко применяется в тех случаях, когда приходится работать с большим количеством вируссодержащего материала. Наиболее простым и почти универсальным приспособлением для размельчения нативной животной ткани является обычная или электрическая мясорубка.
Обработка ультразвуком. Очень широко используется также дезинтеграция клеток, зараженных вирусами, при помощи ультразвука. Если обрабатывать жидкость ультразвуком, то при определенной интенсивности звука (около 20 кГц/с) в среде возникает явление кавитации. Благодаря очень быстрому чередованию давления и разрежения возникает большое число крошечных воздушных пузырьков, которые, разрываясь, образуют вокруг себя область с интенсивной ударной волной. При этом возникает мгновенный жесткий локальный градиент давления, который и разрушает клетки.
На практике часто обработка ультразвуком сочетается с другими способами дезинтеграции, такими, как осмотический шок в дистиллированной воде (протопласты бактерий и грибов), многократное замораживание и оттаивание (ткани животных), гомогенизация, что значительно уменьшает время обработки ультразвуком. Последнее благоприятно сказывается на выходе инфекционных вирусных частиц, поскольку ультразвуковая обработка приводит к значительному разогреву озвучиваемой суспензий.
Концентрирование и очистка вирусов
Осаждение солями. Вирусы, подобно белкам, осаждаются из водных растворов при определенных концентрациях солей, которые разрушают взаимодействие между молекулами воды и полярными группировками оболочки вируса. Вирус агрегирует и выпадает в осадок. Наиболее часто для этого применяют сульфат аммония.
Несмотря на простоту и дешевизну, метод высаливания сульфатом аммония обладает двумя недостатками. Во-первых, он неспецифичен для вирусов, поскольку вместе с ними высаливаются и белки клетки-хозяина, во-вторых, при этой процедуре происходит деструкция некоторых вирусов.
Осаждение в изоэлектрической точке. Большинство вирусов преципитирует в кислой зоне pH, поскольку их изоэлектрические точки лежат в пределах 3,5-6,5.
Осаждение в изоэлектрической точке – наиболее простая и доступная операция из всех применяемых методов концентрирования и очистки вирусов. Однако при pH ниже 5,0 также выпадают в осадок многие белки клетки-хозяина, что ограничивает возможность применения этого метода. К тому же подобная процедура не всегда желательна при очистке некоторых лабильных вирусов.
Осаждение спиртами. При добавлении к вируссодержащей суспензии охлажденного метанола или этанола вирус преципитирует вследствие уменьшения (как и в рассмотренном выше случае обработки сульфатом аммония) степени гидратации его белковой оболочки. Оптимальная концентрация спирта для каждого вируса подбирается эмпирически. Эта величина колеблется от 15 до 35% . Процедура проводится при максимально возможных низких температурах для избежания денатурации вирусных частиц. Метанол более выгодно использовать, чем этанол, так как, применяя его, можно работать при более низких температурах.
Однако этот метод так же, как и метод высаливания сульфатом аммония, имеет недостатки. Он неспецифичен для вирусов (осаждается значительное количество балластных белков) и не может быть использован для некоторых вирусов животных, которые не устойчивы к спиртам (сложные вирусы, содержащие липопротеидные оболочки).
Обработка ферментами. Благодаря особой структурной организации вирионов, большинство вирусов, несмотря на их нуклеопротеидную природу, устойчиво к действию протеолитических ферментов и нуклеаз, в то время как клеточные нуклеиновые кислоты и белки легко разрушаются этими ферментами. Используя эту различную чувствительность вируса и клеточных примесей к ферментам, можно при помощи ферментов провести частичную очистку вирусов.
Ультрафильтрация. Метод концентрирования и очистки вирусов с помощью мембранных ультрафильтров имеет преимущества перед другими методами, как один из наиболее мягких и щадящих. Мембранные фильтры изготавливают из этерифицированной целлюлозы. Размер пор у фильтров разных типов варьирует от 0,01 до 8 мк. Фильтры устойчивы к температуре (до 125°С), к воздействию разбавленных кислот и щелочей и неполярных растворителей. В идеале, используя последовательную ультрафильтрацию через две мембраны с убывающим размером пор (одна задерживает частицы более крупные, чем вирус, а вторая – только вирус), можно получить в чистом виде любой вирус. Недостатком метода является то, что часто происходит засорение фильтра или адсорбция вируса на фильтре.
Скорость осаждения частиц, приведенная к единице центробежного ускорения (коэффициент седиментации, S), является специфической характеристикой макромолекул и выражается формулой

где х – расстояние от оси вращения, см; t – время, с; ω – угловая скорость, рад/с.
Коэффициент седиментации имеет размерность времени, так как со имеет размерность, обратную времени (радиан – величина безразмерная). Значения коэффициента седиментации для различных макромолекул имеют величины порядка 10 -14 -10 -13 с. Для удобства величина 10 -13 принята за единицу коэффициента седиментации. Эту величину обозначают S (единица Сведберга).
Коэффициент седиментации обычно зависит от концентрации изучаемого вещества. На практике бывает необходимым знать седиментационные характеристики веществ при оседании в сравнимых и идеальных условиях, т.е. условиях, когда взаимодействие между частицами отсутствует. Для этого величина коэффициента седиментации, измеренная в воде при 20°С, рассчитывается для бесконечного разведения раствора и обозначается как S°20,w – константа седиментации.
В современных ультрацентрифугах достигается скорость вращения ротора 60 000 об/мин и выше. Для частиц, находящихся на расстоянии 5-6 см от оси вращения, эта скорость соответствует центробежной силе, превышающей силу тяжести в 250 тыс. раз.
Ядра клетки оседают при 800 g, митохондрии – при 10 000 g9 а большинство вирусов – при 30 000-100 000 g за 0,5-3 ч. При низкоскоростном центрифугировании из вируссодержащей суспензии удаляются обломки клеток и их компоненты. Затем при центрифугировании над осадка при 100 000 g осаждают вирусные частицы, а основная часть белков и других низкомолекулярных соединений остается в надосадочной жидкости. Таким образом, с помощью цикла дифференциального центрифугирования удается разделить вирусную суспензию на ряд фракций, содержащих однородные по скорости седиментации частицы.
Следует отметить, что для большинства вирусов использование только одного метода дифференциального центрифугирования недостаточно, чтобы получить высо- коочищенную вирусную суспензию. Как правило, конечный препарат содержит некоторые нормальные компоненты клеток, имеющие очень близкие с вирусами седиментационные характеристики. К сожалению, многие вирусы, особенно палочкообразные, могут образовывать после центрифугирования осадки, которые затем очень трудно вновь суспензировать.
Ультрацентрифугирование в градиенте плотности. Это понятие относится к скоростному центрифугированию частиц в столбе жидкости с плотностью, увеличивающейся по направлению от оси ротора. Такой градиент плотности может быть образован с помощью, например, сахарозы, глицерина, фиколла или солей тяжелых металлов (цезия, рубидия).
Существуют две наиболее важные разновидности метода:
- метод зонального ультрацентрифугирования;
- метод изопикнического (или равновесного) ультрацентрифугирования.
Метод зонального ультрацентрифугирования для разделения частиц в зависимости от коэффициента седиментации применяется с 1953 г. При этом исследуемую суспензию наслаивают на преформированный градиент. Градиент обычно готовят пологим, и если центрифугирование продолжать длительно, то все частицы могут осесть. Поэтому центрифугирование надо прекращать до момента оседания частиц. Но вместе с тем времени должно быть достаточно для того, чтобы частицы могли мигрировать через градиент. В результате указанной процедуры в центрифужной пробирке формируются зоны, каждая из которых состоит из частиц с близкими седиментационными свойствами.
Для извлечения вируса из центрифужной пробирки содержимое ее фракционируют. Обычно это осуществляется путем прокалывания дна пробирки и последовательного сбора фракций.
Рассмотрим принцип работы самоустанавливающегося изоплотностного градиента (рис. 2.1).

Рис. 2.1. Схематическое изображение разделения двух вирусов с различной плавучей плотностью путем равновесного ультрацентрифугирования в градиенте плотности CsCl
Левую центрифужную пробирку наполняют водным раствором CsCl (р = 1,28 г/мл), в котором суспензируется некоторое количество вируса осповакцины и вируса гриппа. После центрифугирования в течение 20 ч при 41 000 об/мин молекулы CsCl концентрируются на дне пробирки, образуя градиент плотности. При этом вирионы из нижней части градиента всплывают (так как они легче, чем находящийся здесь раствор CsCl), а вирионы из верхней части градиента, наоборот, осаждаются – до зоны, которая имеет ту же плотность, что и частицы вируса. В данном случае это зоны с плотностью 1,28 г/мл (вирус осповакцины) и 1,25 г/мл (вирус гриппа).
Разрешение, достигаемое при ультрацентрифугировании в градиентах плотности CsCl и Cs2SО4, очень велико. Например, при помощи этого метода удается легко разделить частицы бактериофагов, отличающиеся друг от друга по плотности всего на 0,05 г/мл. Этому различию в плотности соответствует относительное различие в содержании ДНК порядка 1%.
Адсорбционная хроматография. Метод основан на различной степени адсорбции вирусов и примесей при фильтровании через слой твердого адсорбента. Решающее значение имеют поверхностные свойства вирусной частицы и адсорбента, а также состав буфера, в котором суспензирован вирус. При элюировании соответствующим буфером вирусные частицы могут быть отделены от примесей. В качестве адсорбентов в вирусологической практике обычно используются фосфат кальция, гидроксилапатит, фосфат алюминия, цеолит.
Хроматография на молекулярных ситах (гельфильтрация). Метод основан на способности пористых материалов разделять смесь веществ по размеру и молекулярной массе компонентов. Молекулярные сита не обладают сорбционным сродством к фракционируемым веществам. Обычно в качестве таких пористых материалов применяют гранулированные гели полисахаридов (сефадексы, агароза), полиакриламид (биогели) и пористое порошковое стекло.
Схематически процесс гельфильтрации можно представить следующим образом (рис. 2.2). Молекулы более крупные, чем размер пор в гранулах, не проникают внутрь них и поэтому движутся по колонке с жидкой фазой вне гранул. Мелкие молекулы проникают внутрь гранул и движутся относительно медленнее. Степень проникновения зависит от размера и формы молекул. Вследствие этого элюирование молекул из слоя гранул геля происходит в порядке уменьшения размера молекул. Когда из колонки элюируются все молекулы, она вновь готова к следующему эксперименту. Эта автоматическая регенерация – одно из преимуществ гельфильтрации.

Рис. 2.2. Схема фракционирования вируса и примеси на колонке с молекулярным ситом
Метод гельфильтрации нашел широкое применение в вирусологической практике, так как он наиболее безвреден для лабильных вирусов. Кроме того, он очень удобен при использовании на последней стадии очистки многих вирусов, поскольку при этом можно удалить из препаратов сульфат аммония и другие низкомолекулярные вещества (например, использующиеся для формирования градиентов плотности).
Ионообменная хроматография. Ионообменниками называют такие соединения, которые содержат фиксированные заряженные функциональные группы и подвижные противоионы. Последние могут обратимо обмениваться с другими ионами того же заряда, не изменяя физических свойств нерастворимой матрицы. Ионообменниками могут быть органические и неорганические соединения – алюмосиликаты, синтетические смолы, полисахариды, целлюлоза и т.д.
Тип ионообменника определяется активностью групп в матрице. Введение фенольных, карбоксильных или сульфогрупп придает матрице катионообменные свойства, а введение алифатических или ароматических аминогрупп – анионообменные свойства (табл. 2.1).
Разделение компонентов при этом виде хроматографии осуществляется не за счет разницы в их размерах, а за счет различий в их зарядах. Фракционирование вируссодержащих смесей, нанесенных на колонки, осуществляется пропусканием через колонку буферных растворов с возрастающей ионной силой или же растворов с возрастающей (или убывающей) величиной pH.
Применяя ионообменники, удается сравнительно легко и быстро проводить препаративную очистку и концентрирование различных вирусов. В то же время имеются сообщения и о неудачах при использовании метода ионообменной хроматографии для очистки вирусов. Некоторые вирусы при элюции с ионообменников теряют до 90% активности.
Таблица 2.1. Основные типы целлюлозных ионообменников

Критерии чистоты вирусных препаратов
Вирусный препарат можно считать чистым, если в нем не обнаруживаются какие-либо посторонние примеси. Определение степени загрязненности зависит от чувствительности применяемых методов исследования. Следует помнить, что применяя какой-либо один метод, нельзя доказать гомогенность препарата.
Важным критерием чистоты считается кристаллизация. Часто как доказательство чистоты вирусного препарата используется наличие спектра поглощения в ультрафиолете, характерного для нуклеопротеидов.
Важнейшим методом оценки гомогенности вирусной суспензии является наблюдение за скоростью седиментации частиц при ультрацентрифугировании в градиенте плотности сахарозы. Требованием для гомогенного препарата является симметричность соответствующего ему пика на седиментационной диаграмме.
Еще более чувствительным критерием гомогенности служит наличие одного пика при равновесном ультрацентрифугировании в градиенте плотности CsCl или Cs2SC>4.
Применение метода электронной микроскопии для выявления примесей целесообразно, если этот материал имеет достаточный размер и по внешнему виду отличается от вируса.
Примесь клеточных веществ, которые способны диффундировать и обладают антигенными свойствами, можно выявить с помощью очень чувствительных серологических методов, таких, как иммунодиффузия и иммуноэлектрофорез.
Для вирусов с хорошо установленным элементарным составом (например, ВТМ) такие методы, как определение отношения фосфора к азоту, позволяют обнаружить примеси, содержащие азот или фосфор, если они присутствуют в значительном количестве. При определенных обстоятельствах могут быть применены также более сложные химические методы, например анализ концевых групп белков, позволяющих обнаружить всего-навсего одну аминокислоту.
Из вышеизложенного следует, что для вирусных препаратов нет одного вполне удовлетворительного метода определения чистоты. Поэтому в практической работе используют и критически сопоставляют результаты, полученные при помощи как можно большего числа разнообразных методов.

Обзор
Автор
Редакторы
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Эволюция и происхождение вирусов
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии [7]. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек [8]. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков [9]?
Строение вирусов и иммунный ответ организма

Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).

Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор [13–15].

Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).

Причины поражений в борьбе с ВИЧ
Тем не менее нельзя сказать, что ничего не делается в борьбе с ВИЧ и нет никаких подвижек в этом вопросе. Сегодня уже определены перспективные направления в исследованиях, главные из которых: использование антисмысловых молекул (антисмысловых РНК), РНК-интерференция, аптамерная и химерная технологии [12]. Но пока эти антивирусные методы — дело научных институтов, а не широкой клинической практики*. И потому более миллиона человек, по официальным данным ВОЗ, погибают ежегодно от причин, связанных с ВИЧ и СПИДом.

Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирусы Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается еще несколькими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда (Дж. Гудсмит с коллегами), изучая иммунный ответ на ВИЧ-вакцину, обнаружили так называемый феномен антигенного импринтинга [23]. Он был описан еще в далеком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.

Открытие биологов из МГУ — Нефёдовой и Кима, — о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной, версии.

Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, которыми быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов* и даже вируса Эбола. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году**. А ведь по всему миру сейчас насчитывается 150 млн человек — носителей вируса гепатита С! И, по данным ВОЗ, каждый год от этой инфекции умирает 350-500 тысяч человек [33]. Для сравнения — от лихорадки Эбола в 2014-2015 гг. (на состояние по июнь 2015 г.) погибли 11 184 человека [34].
* — Коронавирусы — РНК-содержащие вирусы, поверхность которых покрыта булавовидными отростками, придающими им форму короны. Коронавирусы поражают альвеолярный эпителий (выстилку легочных альвеол), повышая проницаемость клеток, что приводит к нарушению водно-электролитного баланса и развитию пневмонии.

Рисунок 8. Электронная микрофотография воссозданного вируса H1N1, вызвавшего эпидемию в 1918 г. Рисунок с сайта phil.cdc.gov.
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению ученых, главные причины — это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие загрязнения среды обитания и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой, преодолев тысячи километров.

Обзор
Человеческая Т-клетка (синий), атакованная ВИЧ (желтый). Вирус ориентирован на Т-клетки, которые играют важную роль в иммунной реакции организма против вторжений, таких как бактерии и вирусы.
Автор
Редакторы

Вопрос о происхождении вирусов
Существует три основные теории возникновения вирусов:
Зарождение жизни. Идея последнего универсального общего предка: каким он мог бы быть и что ему предшествовало?

Рисунок 1. Схема трехдоменной классификации, предложенная Вёзе. В основании этой схемы должен находиться последний универсальный общий предок (англ. last universal common ancestor, LUCA).
Самый сильный аргумент в пользу существования LUCA — сохранившаяся общая система экспрессии генов (передачи наследственной информации от гена с образованием РНК или белков), одинаковая для всех живущих организмов. Все известные клеточные формы жизни используют один и тот же генетический код из 20 универсальных аминокислот и стоп-сигналов, закодированных в 64 кодонах (единицах генетического кода). Трансляция генетической информации в процессе синтеза белков по заданной матрице выполняется рибосомами, состоящими из трех универсальных молекул РНК и примерно 50 белков, из которых 20 так же одинаковы для всех организмов.
В 2010 году американский биохимик Даглас Теобальд математически проверил вероятность существования LUCA [6]. Он выбрал 23 белка, встречающихся у организмов из всех трех доменов, но имеющих разную структуру у различных видов. И исследовал эти белки у 12 различных видов (по четыре из каждого домена), после чего использовал компьютерное моделирование различных эволюционных сценариев, чтобы понять, при каком из них наблюдаемая картина будет наиболее вероятной. Оказалось, что концепция, включающая существование универсального предка, значительно вероятнее концепций, где его нет. Еще более вероятна модель, основанная на существовании общего предка, но допускающая обмен генами между видами [7].
Предположение о том, что LUCA был прокариотической клеткой, похожей на современные, часто принимается по умолчанию. Однако мембраны архей и бактерий имеют разное строение (рис. 2). Получается, что общий предок должен был обладать комбинаторной мембраной. Новая информация о мембранах LUCA появилась в 2012 году, когда несколько групп ученых подробно проанализировали историю генов всех ферментов биосинтеза компонентов липидов у бактерий, архей и эукариот [8].

Рисунок 2. Строение мембранных липидов бактерий (справа) и архей (слева)
Родственными у архей и бактерий оказались ферменты для синтеза терпеновых спиртов и пришивания полярных голов к спиртам. Значит, эти реакции мог проводить и LUCA. Проще всего было предположить, что липиды LUCA состояли из одного остатка терпенового спирта, остатка фосфата и полярной группы (серина или инозитола). Подобные липиды были синтезированы искусственно. Образующиеся из них мембраны обладают высокой подвижностью по сравнению с современными мембранами, хорошо пропускают ионы металлов и малые органические молекулы. Это могло позволять древним протоклеткам поглощать готовую органику из внешней среды даже без транспортных белков.
Реконструкции LUCA методами сравнительной геномики указывают на то, что это должен быть сложный организм без обширного ДНК-генома (геном, состоящий из нескольких сотен РНК-сегментов или ДНК провирусного типа). Но даже если считать возможность существования общего предка доказанной, остается загадкой, в какой среде он мог бы появиться.

Рисунок 3. Сценарий вирусного мира в гипотезе доклеточного происхождения вирусов подпись
Предполагается, что идеальные условия для формирования жизни существовали вблизи термальных геоисточников (морских или наземных) в виде сети неорганических ячеек, обеспечивающих градиенты температуры и рН, способствующих первичным реакциям, и предоставляющих универсальные каталитические поверхности для примитивной биохимии [10].
Эти отсеки могли быть населены разнородной популяцией генетических элементов. Вначале сегментами РНК. Затем более крупными и сложными молекулами РНК (один или несколько белок-кодирующих генов). А позднее и сегментами ДНК, которые постепенно увеличивались (рис. 3).
Такие простейшие генетические системы использовали неорганические соединения из раствора и продукты деятельности других генетических систем. Сначала они должны были подчиняться индивидуальному отбору ввиду большого разнообразия. Но ясно, что важным фактором такого отбора была способность передавать генетическую информацию, то есть, копировать себя. Присутствие одновременно в одной ячейке молекул, способных копировать РНК, кодировать полезные белки и управлять синтезом новых молекул, давало больше шансов выживать в каждой отдельной ячейке. И в такой системе рано или поздно должны были появиться паразитирующие элементы. А если это так, то вирусные элементы стоят у самых истоков эволюции [11].
Возникновение паразитов — неизбежное последствие эволюционного процесса

Рисунок 4. Схематическое представление структуры модели эволюции РНК-подобной системы. На втором этапе цепочки последовательностей начинают соединяться комплементарными связями сами с собой. В результате у двух видов (cat-C и cat-A) возникает вторичная структура молекулы, которая обладает каталитическим свойством. Она ускоряет собственную репликацию (или репликацию несвернувшихся соседей). Два вида при этом приобретают паразитические свойства (par-G и par-U). Пояснения в тексте.
Таким образом, паразитарные репликаторы способствуют эволюции разнообразия, вместо того, чтобы мешать этому разнообразию. Это также делает существующую систему репликатора чрезвычайно стабильной при эволюции паразитов.
Согласно гипотезе Черной Королевы, чтобы поддержать свое существование в постоянно эволюционирующем мире, вид должен реагировать на эти эволюционные изменения и должным образом приспосабливаться к среде. Поэтому, если мы говорим о вирусах как о паразитах, мы обязаны представлять себе взаимоотношения вируса с хозяином. В борьбе с вирусом хозяева развивают новые защитные механизмы, а паразиты отвечают, развивая механизмы для атаки и взлома защиты. Этот процесс может длиться бесконечно либо до вымирания одной из противоборствующих сторон. Так множественные системы защиты составляют существенную часть геномов всех клеточных организмов, а взлом защиты — одна из основных функций генов у вирусов с большими геномами .
Механизмы клеточной защиты против вирусов
Механизмы защиты от вирусов стандартны, поскольку все вирусы уникальны, и приспособиться к каждому не представляется возможным. Это такие механизмы как:
- Деградация РНК (вирусных и клеточных) — РНК-интерференция;
- Угнетение синтеза белков (вирусных и клеточных);
- Ликвидация зараженных клеток — апоптоз (программируемая клеточная смерть);
- Воспаление.
Получается, что клетка борется с вирусом, нарушая собственные обмен веществ и/или структуру. Защитные реакции клетки — это в основном самоповреждающие механизмы.
Вирус заражает конкретную клетку потому, что его механизмы нападения направлены именно против данного типа клеток. Это такие механизмы как:
- Угнетение синтеза клеточной РНК;
- Угнетение синтеза клеточных белков;
- Нарушение клеточной инфраструктуры и транспорта;
- Подавление/включение апоптоза и других видов клеточной смерти.
Схемы защитных приемов клетки и противозащиты вирусов во многом идентичны. Вирусы и клетки применяют одни и те же приемы. Для подавления синтеза вирусных белков клетка использует интерферон, а чтобы подавить образование интерферона, вирус угнетает синтез белков.
Поскольку узнавание вируса неспецифическое, клетка не может знать намерения конкретного вируса. Она может бороться с вирусом лишь стандартными приемами, поэтому ее оборонные действия часто могут быть чрезмерными.
Понятие о вирусном геноме, типы вирусных генов, концепция генов-сигнатур
В исследовании, проведенном вирусологом Евгением Куниным и его коллегами [16], анализ последовательностей вирусных геномов выявил несколько категорий вирусных генов, принципиально отличающихся по происхождению. Можно обсуждать, какая степень дробности классификации оптимальна, но четко различаются пять классов, укладывающихся в две более крупные категории.
Гены с четко опознаваемыми гомологами у клеточных форм жизни:
- Гены, присутствующие у узких групп вирусов (обычно это гены, гомологичные генам хозяев этих вирусов).
- Гены, консервативные среди большой группы вирусов или даже нескольких групп и имеющие относительно отдаленные клеточные гомологи.
Таким образом, отличительные особенности генов-сигнатур:
- Происхождение из первичного пула генов;
- Наличие лишь очень отдаленных гомологов среди генов клеточных форм жизни, из чего можно сделать вывод, что они никогда не входили в геномы клеточных форм;
- Необходимость для репродукции вирусов.
Из всего вышесказанного следует, что эти гены переходили от вируса к вирусу (или к элементу, подобному вирусу) на протяжении четырех миллиардов лет эволюции жизни, а вирусные геномы появились благодаря перемешиванию и подгонке друг к другу генов в гигантской генетической сети, которую представляет собой мир вирусов. Многочисленные гены клеточных форм жизни также пронизывают эту сеть, прежде всего благодаря геномам крупных вирусов, таких как NCDLV и крупным бактериофагам, которые позаимствовали множество генов от своих хозяев на разных этапах эволюции. Однако большинство заимствованных генов сами по себе не критичны для репликации и экспрессии вирусного генома (исключая некоторые случаи возможного неортологичного замещения генов-сигнатур); обычно эти гены участвуют во взаимодействии между вирусом и хозяином. Таким образом, несмотря на интенсивный взаимообмен генами с хозяевами, вирусы всегда происходят от других вирусов.
Вирусы, встроенные в геном, и горизонтальный перенос генов
В процессе эволюции многие вирусы встроились в геномы клеточных форм жизни путем горизонтального переноса генов (ГПГ). Впервые горизонтальный перенос был описан в 1959 году, когда ученые продемонстрировали передачу резистентности к антибиотикам между разными видами бактерий. В 1999 году Рави Джайн, Мария Ривера и Джеймс Лейк в своей статье писали о произошедшей значительной передаче генов между прокариотами [17]. Этот процесс, по-видимому, оказал некоторое влияние также и на одноклеточные эукариоты. В 2004 году Карл Вёзе опубликовал статью, в которой утверждал, что между древними группами живых организмов происходил массивный перенос генетической информации. В древнейшие времена преобладал процесс, который он называет горизонтальным переносом генов. Причем, чем дальше в прошлое, тем это преобладание сильнее [18].
Горизонтальный перенос генов — процесс, в котором организм передаёт генетический материал другому организму, не являющемуся его потомком. Горизонтальная передача генов реализуется через различные каналы генетической коммуникации — процессы конъюгации, трансдукции, трансформации, переноса генов в составе плазмидных векторов, вирусов, мобильных генетических элементов (МГЭ).
Трансдукция — перенос бактериофагом (агентами переноса генов, АПГ) в заражаемую клетку фрагментов генетического материала клетки, исходно содержавшей бактериофаг [19]. Такой бактериофаг обычно переносит лишь небольшой фрагмент ДНК хозяина от одной клетки (донор) к другой (реципиент). В зависимости от типа трансдукции — неспецифической (общей), специфической или абортивной, геном фага или хозяина-бактерии может быть изменен тем или иным образом:
- При неспецифической трансдукции (рис. 5) ДНК клетки-хозяина включаются в частицу фага (дополнительно к его собственному геному или вместо него);
- При специфической трансдукции гены фага замещаются генами хозяина;
- При абортивной трансдукции внесённый фрагмент ДНК донора не встраивается в ДНК хозяина-реципиента, а остаётся в цитоплазме и не реплицируется. Это приводит к тому, что при клеточном делении он передаётся только одной из дочерних клеток и затем теряется в потомстве.

Рисунок 5. Схема общей трансдукции
Наиболее известным примером специфической трансдукции служит трансдукция, осуществляемая фагом λ. Поскольку этот фаг при переходе в состояние профага включается в хромосому бактерий между генами, кодирующими синтез галактозы и биотина, именно эти гены он может переносить при трансдукции.
Вот несколько примеров важных эволюционных событий, связанных с молекулярным одомашниванием:
- Ферменты теломеразы, служащие для восстановления концевых участков хромосом, возможно, ведут свое происхождение от обратных транскриптаз, кодируемых ретровирусами и ретротранспозонами [22];
- Белки RAG, играющие ключевую роль в системе адаптивного иммунитета, по-видимому, происходят от прирученных транспозаз — ферментов, кодируемых транспозонами;
- Ген Peg10, необходимый для развития плаценты, был позаимствован древними млекопитающими у ретротранспозона (рис. 6) [23].

Рисунок 6. Роль гена Peg10 в эмбриональном развитии. Ученые под руководством Рюичи Оно из Токийского медицинского университета Японии показали, что у мышей с выключенным геном Peg10 нарушается развитие плаценты, от чего эмбрион погибает через 10 дней после зачатия [24].
В 2008 году в ходе целенаправленного поиска неиспорченных вирусных генов в геноме человека исследователи нашли два очень похожих друг на друга ретровирусных гена (их назвали ENVV1 и ENVV2), которые, по всей видимости, находятся в рабочем состоянии [25]. Это гены белков оболочки ретровируса. Каждый из них входит в состав своего эндогенного ретровируса (ЭРВ), причем все остальные части этих ЭРВ давно не функционируют.
Вирусные гены ENVV1 и ENVV2 у человека и обезьян работают в плаценте и, скорее всего, выполняют следующие функции:
Таким образом, как минимум три полезных применения нашли себе вирусные гены в плаценте приматов. Это показывает, что генетические модификации, которым ретровирусы подвергают организмы, в долгосрочной перспективе могут оказаться полезными или даже определить развитие вида. И с учетом всего вышесказанного древо доменов должно выглядеть как на схеме ниже (рис. 7).

Рисунок 7. Горизонтальный перенос генов в рамках трехдоменного дерева
Заключение
Возникновение паразитов — обязательная черта эволюционирующих систем репликаторов, а соревнование хозяев и паразитов движет эволюцию тех и других. Любой организм является результатом миллионов лет борьбы клеток с невероятно разнообразным миром вирусов. Их действия и их эволюция пронизывают всю историю клеточной эволюции, и сейчас меняется само наше представление о них. Когда-то вирусы считали деградировавшими клетками, но чем больше мы узнаем о вирусах, тем очевиднее, что их роль в общей эволюции значительна. И невероятно много нам еще предстоит узнать.
Главная задача биологии — это развитие представлений у человека о живых организмах, о многообразии видов, обо всех закономерностях развития живых существ, а также об их взаимодействии с окружающей природой. Предмет основы безопасности жизнедеятельности (ОБЖ) позволяет получить знания и умения, которые помогут сохранить жизнь и здоровье в опасных ситуациях. Эти ситуации всегда возникают неожиданно, но, тем не менее, большинство из них предсказуемы и к ним можно подготовиться заранее. ОБЖ учит нас предвидеть возможные опасности и минимизировать потери от той или иной ситуации. Сегодня мы сталкиваемся с новым видом вирусной опасности COVID-19,о котором поговорим с точки зрения биологии и ОБЖ.
Что такое вирус?
Вирус — это неклеточный инфекционный агент. Сегодня нам известно около 6 тысяч различных вирусов, но их существует несколько миллионов. Вирусы не похожи друг на друга и могут иметь как форму сферы, спирали, так и форму сложного асимметричного сплетения. Размеры вирусов варьируются от 20 нм до 300 нм.
Как устроен вирус?
В центре агента находится генетический материал РНК или ДНК, вокруг которого располагается белковая структура — капсид.
Капсид служит для защиты вируса и помогает при захвате клетки. Некоторые вирусы дополнительно покрыты липидной оболочкой, т.е. жировой структурой, которая защищает их от изменений окружающей среды.
Вирусолог Дэвид Балтимор объединил все вирусы в 8 групп, из которых некоторые группы вирусов содержат 1-2 цепочки ДНК. Другие же содержат 1 цепочку РНК, которая может удваиваться или достраивать на своей матрице ДНК. При этом каждая группа вирусов производит себя в различных органеллах зараженной клетки.
Вирусы имеют определенный диапазон хозяев, т.е. он может быть опасен для одних видов и абсолютно безвреден для других. Например, оспой болеет только человек, а чумкой только некоторые виды плотоядных. Вирус не способен выжить сам по себе, поэтому активируется только в хозяйской клетке, используя ее ресурсы и питательные вещества. Цель вируса — создание множества копий себя, чтобы инфицировать другие клетки!
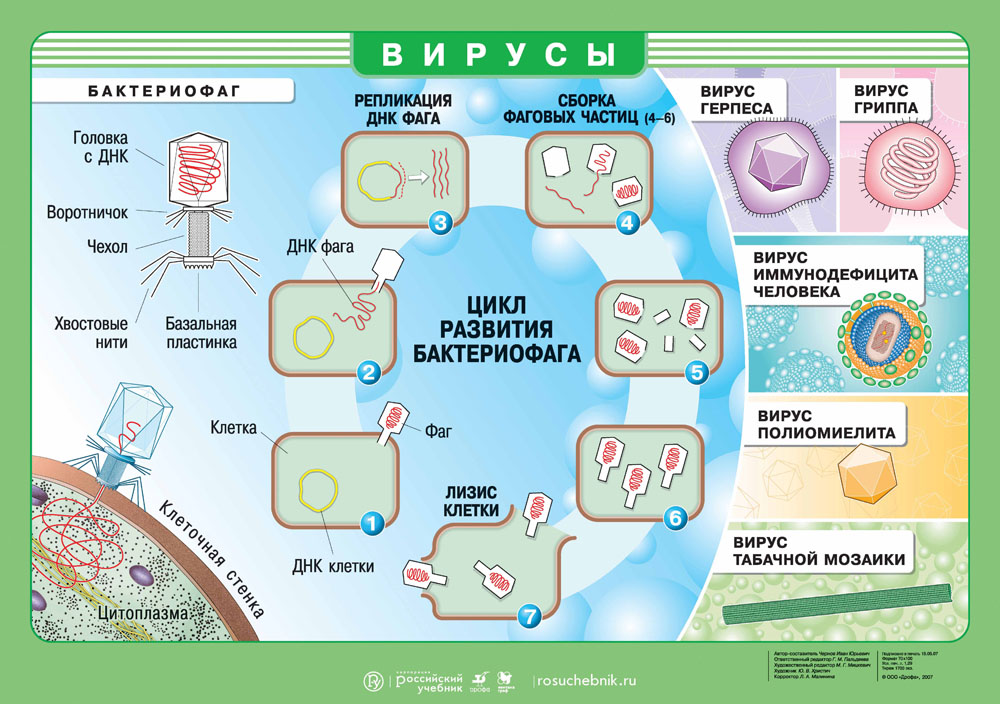
Как вирус попадает в организм?
- через физические повреждения (например, порезы на коже)
- путём направленного впрыскивания (к примеру, укус комара)
- направленного поражения отдельной поверхности (например, при вдыхании вируса через трахею)
- к эпителию слизистых оболочек (это например вирус гриппа)
- к нервной ткани (вирус простого герпеса)
- к иммунным клеткам (вирус иммунодефицита человека)

Геном вируса встраивается в одну из органелл или цитоплазму и превращает клетку в настоящий вирусный завод. Естественные процессы в клетке нарушаются, и она начинает заниматься производством и сбором белка вируса. Этот процесс называется репликацией. И его основная цель — это захват территории. Во время репликации генетический материал вируса смешивается с генами клетки хозяина — это приводит к активной мутации самого вируса, а также повышает его выживаемость. Когда процесс репликации налажен, вирусная частица отпочковывается и заражает уже новые клетки, в то время как инфицированная ранее клетка продолжает производство.
Выход вируса
Вирус создал множество собственных копий, клетка оказывается изнуренной из-за использования ее ресурсов. Больше вирусу клетка не нужна, поэтому клетка часто погибает и новорожденным вирусам приходится искать нового хозяина. Это и есть заключительная стадию жизненного цикла вируса.
Скорость распространения вирусной инфекции
Размножение вирусов протекает с исключительно высокой скоростью: при попадании в верхние дыхательные пути одной вирусной частицы уже через 8 часов количество инфекционного потомства достигает 10³, а концу первых суток − 10²³.
Вирусная латентность
Как вирус распространяется?
- воздушно-капельный (кашель, чихание)
- с кожи на кожу (при прикосновениях и рукопожатиях)
- с кожи на продукты (при прикосновениях к пище грязными руками вирусы могут попасть в пищеварительную и дыхательную системы)
- через жидкие среды организма (кровь, слюну и другие)
Почему с вирусами так тяжело бороться?
Сегодня людям уже удалось победить некоторые вирусы, а некоторые взять под жесткий контроль. Например, Оспа (она же черная оспа). Болезнь вызывается вирусом натуральной оспы, передается от человека к человеку воздушно-капельным путем. Больные покрываются сыпью, переходящей в язвы, как на коже, так и на слизистых внутренних органов. Смертность, в зависимости от штамма вируса, составляет от 10 до 40 (иногда даже 70%), На сегодняшний день вирус полностью истреблен человечеством.
Кроме того, взяты под контроль такие заболевания, как бешенство, корь и полиомиелит. Но помимо этих вирусов существует масса других, которые требуют разработок или открытия новых вакцин.
Коронавирус
Виновником эпидемии, распространяющейся сегодня по миру, стал коронавирус, вирусная частица в 0,1 микрона. Свое название он получил благодаря наростам на своей структуре, своеобразным шипам. Внутри вируса спрятан яд, с помощью которого он подчиняет себе зараженный организм. Этот вирус воздействует не только на человека, но и на птиц, свиней, собак и летучих мышей. В настоящий момент выделяют от 30 до 39 разновидностей коронавирусной инфекции. Но для человека патогенно всего 6. И как любой другой вирус COVID-19 мутирует.

К наиболее распространенным симптомам COVID-19 относятся повышение температуры тела, сухой кашель и утомляемость. К более редким симптомам относятся боли в суставах и мышцах, заложенность носа, головная боль, конъюнктивит, боль в горле, диарея, потеря вкусовых ощущений или обоняния, сыпь и изменение цвета кожи на пальцах рук и ног. Как правило, эти симптомы развиваются постепенно и носят слабо выраженный характер. У некоторых инфицированных лиц болезнь сопровождается очень легкими симптомами.
Сколько же может жить этот вирус вне организма? Все зависит от типа вируса и от той поверхности, на которую вирусы попали. В качестве примера было рассмотрено 3 вируса, по которым велись исследования. Изучали время, на которое может задерживаться вирус на различных поверхностях. Данные приведены в таблице.

Поскольку пока не изобретено вакцины от COVID-19, в целях защиты от инфекции самым важным для нас является соблюдение гигиены.
Гигиена — раздел медицины, изучающий влияние жизни и труда на здоровье человека и разрабатывающая меры (санитарные нормы и правила), направленные на предупреждение заболеваний, обеспечение оптимальных условий существования, укрепление здоровья и продление жизни.
Сегодня следует соблюдать определенные правила гигиены:
- Соблюдение режима труда и отдыха, не допускающего развития утомления и переутомления.
- Выполнение условий, обеспечивающих здоровый и полноценный сон (свежий воздух, отсутствие шума, удобная постель, оптимальная продолжительность).
- Правильное здоровое питание в соответствии с потребностями организма.
- Комфортный микроклимат в жилище (температура, влажность и подвижность воздуха, естественная и искусственная освещенность помещений).
- Содержание в чистоте тела и тщательный уход за зубами.
- Спокойное и корректное поведение в конфликтных ситуациях.


Обзор
Автор
Редакторы
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Эволюция и происхождение вирусов
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии [7]. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек [8]. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков [9]?
Строение вирусов и иммунный ответ организма

Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).

Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор [13–15].

Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).

Причины поражений в борьбе с ВИЧ
Тем не менее нельзя сказать, что ничего не делается в борьбе с ВИЧ и нет никаких подвижек в этом вопросе. Сегодня уже определены перспективные направления в исследованиях, главные из которых: использование антисмысловых молекул (антисмысловых РНК), РНК-интерференция, аптамерная и химерная технологии [12]. Но пока эти антивирусные методы — дело научных институтов, а не широкой клинической практики*. И потому более миллиона человек, по официальным данным ВОЗ, погибают ежегодно от причин, связанных с ВИЧ и СПИДом.

Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирусы Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается еще несколькими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда (Дж. Гудсмит с коллегами), изучая иммунный ответ на ВИЧ-вакцину, обнаружили так называемый феномен антигенного импринтинга [23]. Он был описан еще в далеком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.

Открытие биологов из МГУ — Нефёдовой и Кима, — о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной, версии.

Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, которыми быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов* и даже вируса Эбола. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году**. А ведь по всему миру сейчас насчитывается 150 млн человек — носителей вируса гепатита С! И, по данным ВОЗ, каждый год от этой инфекции умирает 350-500 тысяч человек [33]. Для сравнения — от лихорадки Эбола в 2014-2015 гг. (на состояние по июнь 2015 г.) погибли 11 184 человека [34].
* — Коронавирусы — РНК-содержащие вирусы, поверхность которых покрыта булавовидными отростками, придающими им форму короны. Коронавирусы поражают альвеолярный эпителий (выстилку легочных альвеол), повышая проницаемость клеток, что приводит к нарушению водно-электролитного баланса и развитию пневмонии.

Рисунок 8. Электронная микрофотография воссозданного вируса H1N1, вызвавшего эпидемию в 1918 г. Рисунок с сайта phil.cdc.gov.
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению ученых, главные причины — это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие загрязнения среды обитания и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой, преодолев тысячи километров.
Читайте также:

