Высокотехнологичной медицинской помощи при гепатите с
Обновлено: 18.04.2024
Гепатит С – это хроническое антропонозное вирусное заболевания, вызываемое инфицированием вирусом гепатита С. Возникает воспаление печеночных клеток-гепатоцитов и их повреждение. Вирусный гепатит С бывает хроническим и острым.
По данным ВОЗ во всем мире болеют хроническим гепатитом С около 150-170 миллионов человек. Приблизительно у 10-15% людей заболевание переходит т в цирроз печени и, возможно, рак.
Ежегодно от цирроза печени и рака, связанных с гепатитом С, умирают около 350-500 тыс. человек.
Причины возникновения гепатита С
Основным механизмом заражения является передача здоровому человеку от больного вируса гепатита С через кровь.
Пути передачи гепатита С
- Использование парентеральных наркотиков при совместном использовании устройств для инъекций
- При оказании медицинской помощи (повторное использование или недостаточная стерилизация медицинского оборудования- шприцев и игл)
- При переливании крови и/или продуктов крови, зараженной вирусом гепатита С
- При незащищенном половом акте с больным гепатитом С
- Передача от матери, инфицированной вирусом гепатита С, внутриутробно ее ребенку
- Гепатит С не передается через грудное вскармливание, пищевые продукты, воду, при бытовых контактах (объятиях, поцелуях)
Симптомы гепатита С
От момента заражения до клинических проявлений проходит от 2-4 недель до 6-12 месяцев. Клинические проявления самого заболевания являются нестрого специфическими:
- Общая слабость
- Снижение аппетита
- Повышенная утомляемость
- Диспепсия, проявляющаяся в виде тошноты, горечи во рту, чередования запоров с диареей, боли в эпигастрии и в правом подреберье
- Иногда наблюдается субфебрилитет
- Редко желтушность кожный покровов, склер
Появление симптомов
- Увеличение в объеме живота, сосудистые звездочки на коже живота, нарастание слабости, наличие “головы медузы”
- Стойкая желтуха
- Кровоточивость десен
- Кожный зуд
Диагностика:
Основные способы диагностики гепатита С:
- Биохимический анализ крови (на маркеры повреждения печени и оценки функции - уровень АЛТ, АСТ, ГГТП, общего белка и его фракций, билирубина, уровень креатинина, мочевины, глюкозы)
- Короткая коагулограмма
- Общий анализ крови (количество лейкоцитов, тромбоцитов, уровень гемоглобина, СОЭ)
- Определение ВИЧ-инфекции, HBsAg, Anti-HBc, anti-HBs, anti-HAV
- Количественное определение РНК вируса гепатита С
- Определение генотипа вируса гепатита С
Лечение гепатита С
Назначается специфическая противовирусная терапия. Существуют множество схем лечения и зависит от генотипа вируса гепатита С:
Хронический гепатит С – заболевание печени, вызванное вирусом гепатита С, длительностью 6 и более месяцев. В 10 – 40% случаев хронический гепатит С прогрессирует до цирроза печени, а в 5% случаев до гепатоцеллюлярной карциномы (чаще у пациентов с циррозом или выраженным фиброзом).
Пользователи протокола: гастроэнтерологи, инфекционисты, терапевты, врачи общей практики, а также врачи смежных специальностей, осуществляющие ведение и лечение пациентов с гепатитом С на разных стадиях заболевания.
Методология: Протокол разработан на основе Клинических руководств ведущих международных сообществ (EASL, AASLD, CASL, SASL, FASL, EACS, РОПИП) и адаптирован с учетом используемых на территории Казахстана методов диагностики и лечения. Классификация рекомендаций, использованная в данном протоколе, представлена в Таблице 1.
Таблица 1. Классификация рекомендаций
Классификация
Клиническая классификация
Общепринятой классификации ХГС не существует. При постановке диагноза необходимо указывать вирусологический статус (генотип и вирусную нагрузку), активность (биохимическую и/или гистологическую), а также стадию заболевания (по данным непрямой эластографии или морфологического исследования).
Диагностика
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Перечень основных и дополнительных диагностических мероприятий
(+) исследования необходимые для пациентов с ЦП
Хронический гепатит С протекает бессимптомно или малосимптомно и может сопровождаться такими неспецифичными симптомами как:
• Депрессия (оценивается у всех пациентов с использованием шкалы Бека)
• сахарный диабет 2 типа
При сборе анамнеза следует учитывать указания на гемотрансфузии, трансплантацию органов и тканей, небезопасные инвазивные (немедицинские) манипуляции, принадлежность в группам риска (потребители наркотиков, лица с беспорядочными половыми связями, пациенты, находящиеся на хроническом гемодиализе, пациенты с онкогематологическими заболеваниями, лица, живущие с ВИЧ и другими парентеральными инфекциями, сексуальные партнеры лиц с ВГС, медицинские работники, дети, рожденные от HCV-инфицированных матерей, лица с измененными функциональными пробами печени). Лицам с указанными факторами риска необходим профилактический скрининг на наличие ВГС (anti-HCV).
При физикальном обследовании на начальной стадии ХГС патологии не выявляется, за исключением незначительной гепатомегалии. По мере прогрессирования заболевания может отмечаться увеличение и уплотнение печени. Спленомегалия и другие стигмы хронического заболевания печени могут проявляться на более поздних стадиях.
Вирусный гепатит С преимущественно протекает бессимптомно. При переходе хронического гепатита С в цирроз в 6,4% случаев отмечаются симптомы, обусловленные дисфункцией печени и портальной гипертензией:
В ряде случаев ВГС выявляется у пациентов с ГЦК, которая, как правило, протекает бессимптомно, кроме случаев запущенной стадии, когда опухоль достигает значительных размеров, вызывая ухудшение функции печени (желтуха, асцит, печеночная энцефалопатия), боли в верхнем правом квадранте, астенизацию и потерю веса.
ОАК с подсчетом тромбоцитов. Могут быть выявлены анемия (в результате гиперспленизма, кровотечений из ВРВ), лейкопения, тромбоцитопения (в результате гиперспленизма и прямого миелодепрессивного влияния ВГС), ускорение СОЭ (при инфекционных осложнениях).
Биохимический профиль включает определение показателей АЛТ, АСТ, ГГТП, альбумина, билирубина, щелочной фосфатазы, МНО или ПВ, а также рутинных (глюкозы, креатинина, холестерина) и некоторых специфических показателей, таких как, гамма-глобулины, IgG (скрининг аутоиммунного гепатита), сывороточное железо и ферритин (скрининг гемохроматоза и вторичной перегрузки железом), церулоплазмин (скрининг болезни Вильсона-Коновалова), АФП (скрининг ГЦК). Активность АЛТ и АСТ может быть минимальной ( < ВГН), слабовыраженной (< 5 ВГН), умеренной (5-10 ВГН), выраженной (>10 ВГН) и не всегда коррелирует с гистологической активностью. Уровень билирубина при ХГС, как правило, нормальный. Его увеличение может наблюдаться при остром гепатите или свидетельствовать об ухудшении деятельности печени на поздней стадии заболевания, что также сопровождается снижением уровня альбумина и увеличением МНО или ПВ. Показатели щелочной фосфатазы и ГГТП могут увеличиваться при остром гепатите и оставаться на уровне нормы при хроническом гепатите.
В план клинического лабораторного обследования включаются также ОАМ, копрограмма.
- anti-HCV, маркеры других парентеральных инфекций таких как ВГВ (HBsAg, HBeAg, anti-HBs, anti-HBe, anti-HBc total/IgM), ВГD (anti-HDV у носителей HBsAg), ВИЧ (anti-HIV), а также (при подозрении на острый гепатит) ВГА (anti-HAV) и ВГЕ (anti-HEV)
Качественное определение HCV RNA с помощью высокочувствительной ПЦР в режиме реального времени с нижним лимитом определения 15 МЕ/мл на автоматических анализаторах закрытого типа.
• В случае подозрения на острый ВГС или у иммуносупрессивных пациентов необходимо определение HCV RNA (рекомендация А1)
• Если тест на anti-HCV положительный, необходимо определить HCV RNA, чувствительным молекулярным методом (рекомендация А1)
• Пациенты с положительным тестом anti-HCV и отрицательным молекулярным тестом на HCV RNA должны быть протестированы на HCV RNA через 3 месяца для подтверждения элиминации вируса (рекомендация А1).
− ИФА (+) в 50% в момент острых проявлений, поэтому ПЦР при подозрении на ОГС проводится во всех, в том числе, ИФА (–) случаях
Количественное определение HCV RNA с помощью высокочувствительной ПЦР в режиме реального времени с нижним лимитом определения 15 МЕ/мл на автоматических анализаторах закрытого типа, а также определение генотипа ВГС.
В настоящий момент известно 6 различных типов вируса, которые обозначаются цифрами от 1 до 6. Также существует подтипы, обозначаемые буквами (например, подтип 1а и 1b). На территории РК преимущественно распространенны генотипы 1b, 2 и 3.
Функциональные пробы щитовидной железы (ТТГ)
Тест на беременность
Определение полиморфизма гена интерлейкина – 28В. Результат анализа полиморфизма в гене ИЛ28В полезен в прогнозе эффективности лечения и принятии решения о выборе режима терапии у пациентов с ВГС 1 генотипа. 1
Инструментальные исследования
Радиологическое исследование
Радиологическое исследование печени (в первую очередь УЗИ) позволяет идентифицировать признаки стеатоза, выраженного фиброза и перехода в цирроз печени (закругление контуров печени, неравномерность поверхности и крупнозернистость паренхимы печени), признаки портальной гипертензии и тромбоза (увеличение диаметра, кавернозная трансформация, наличие тромбов воротной и селезеночной вен, асцит, спленомегалия), а также наличие объемных образований (ГЦК). Могут использоваться и другие визуализирующие технологии (КТ, МРТ).
Эндоскопическое исследование
При прогрессировании хронического гепатита С в цирроз диагностика портальной гипертензии может, помимо прочих методов, осуществляться путем эндоскопического обследования, позволяющего выявить варикозное расширение вен (пищевода и желудка) и портальную гастропатию.
Оценка тяжести заболевания печени должна проводиться до ПВТ. Выявление пациентов с циррозом печени имеет особое значение, так как эффективность ПВТ обратно пропорциональна стадии фиброза. Отсутствие выраженного фиброза имеет значение при принятии решения о времени начала ПВТ. Пациенты с явными клиническими признаками цирроза не нуждаются в биопсии печени для оценки стадии фиброза. Пациенты с признаками цирроза печени должны быть обследованы на ГЦК. Выраженный фиброз может быть у пациентов с нормальной активностью АЛТ, поэтому оценка степени тяжести заболевания должна проводиться независимо от показателей АЛТ. Пункционная биопсия остается эталонным методом оценки стадии фиброза печени. Риск тяжелых осложнений при биопсии очень низок (от 1/4000 до 1/10000). У пациентов с нарушением свертываемости крови можно использовать трансюгулярную биопсию печени с одновременной оценкой давления в портальной вене. При ХГС альтернативные, неинвазивные методы (непрямая эластография и биомаркеры) могут быть использованы вместо биопсии. Непрямая эластография может быть использована для оценки стадии фиброза печени у пациентов с ХГС, но необходимо учитывать факторы, которые могут повлиять на достоверность результатов, например выраженная активность заболевания, ожирение. Оба метода (непрямая эластография и биомаркеры) точны при оценке цирроза и нулевого фиброза, но менее точны при промежуточных стадиях фиброза. Комбинирование биомаркеров и непрямой эластографии повышает точность оценки стадии фиброза и уменьшает необходимость в проведении ункционной биопсии. В случае противоречивых результатов биомаркеров и непрямой эластографии, можно использовать пункционную биопсию печени. Гистологическая оценка также необходима при смешанной этиологии (например, ВГС с ВГВ, метаболическим синдромом, алкоголизмом или аутоиммунными заболеваниями).
Пункционная биопсия печени (ПБП) – относительно безопасный метод оценки морфологических изменений печени у пациентов с ХГС. ПБП позволяет оценить выраженность фибротического процесса и некровоспалительных изменений. Результаты ПБП легко интерпретируются и поддаются полуколичественной оценке. ПБП проводится в динамике с целью оценки прогрессирования поражения печени при ХГС. ПБП – единственный доступный метод, позволяющий оценить вклад сопутствующих заболеваний (стеатогепатит, гемохроматоз, аутоиммунный гепатит и т.д.) в патологическом процессе и их влияние на течение и эффективность лечения ХГС. Необходимо помнить, что ПБП имеет ряд ограничений. В частности, имеет значение опыт врача, проводящего пункцию, и морфолога, оценивающего морфологические изменения; малый объем образцов ткани печени; инвазивность и дискомфорт для пациентов; риск развития осложнений. ПБП требует строгого выполнения правил ее выполнения в условиях специализированных отделений и наличия квалифицированных морфологов.
2. Всем пациентам перед выполнением биопсии печени должно быть выполнено УЗИ ОБП. Данное исследование позволяет выявить анатомический вариант строения печени и наличие очаговых образований в ее паренхиме, что может потребовать проведения прицельной биопсии под визуальным контролем.
3. В течение недели перед проведением пункции необходимо определить количество тромбоцитов и протромбиновое время (ПВ), либо протромбиновый индекс (ПИ)
• Если количество тромбоцитов ≥90 000 /мм3, то манипуляцию можно выполнять рутинным способом (чрескожная биопсия печени)
• Если ПВ удлинено менее чем на 3 сек. в сравнении с контрольным значением (предоставляется лабораторией, в которой выполняется исследование образца крови), ПИ не менее 70%, тромбиновое время (ТВ) и активированное частичное тромбопластиновое время (АЧТВ) не превышают 1,5 нормы, биопсию можно проводить чрескожным доступом
• Во всех других случаях решение о выполнении биопсии печени принимается на индивидуальной основе путем оценки пользы и риска от планируемой манипуляции. В случае строгой необходимости в проведении биопсии печени у пациентов с гипокоагуляцией или низким количеством тромбоцитов в некоторых случаях может быть оправдана заместительная терапия
4. Перед биопсией необходимо подписать у пациента информированное согласие, в котором доступно описана методика манипуляции и возможные осложнения.
5. Во время выполнения биопсии врач и пациент должны быть в постоянном контакте. Больной четко и своевременно должен выполнять команды врача. При повышенной возбудимости пациента и отсутствии признаков печеночной недостаточности возможно назначение седативных препаратов.
6. Выбор иглы для биопсии целесообразно осуществлять с учетом личного опыта оператора. В повседневной практике удобны в применении иглы Менгини и иглы типа Tru-cut.
7. Врачи, личный опыт которых не превышает 20 манипуляций, выполняют биопсию в присутствии и под контролем более опытного доктора в условиях специализированного гепатологического центра.
9. Активное наблюдение пациентов в течение 8 часов и первой ночи после манипуляции должно проводиться в условиях медицинской организации. Оценка результатов ПБП проводится с применением полуколичественных шкал описания степени некро-воспалительных изменений и стадии фиброза ткани печени (см. Таблицы 3 и 4).
Таблица 3. Морфологическая диагностика степени некровоспалительной активности гепатита
*Для определения стадии заболевания печени чаще применяется шкала METAVIR
К преимуществам метода относятся:
• Неинвазивность
• Воспроизводимость
• Больший чем при биопсии оцениваемый объем ткани печени (в 100-200 раз больше)
• Быстрота и удобство применения (обследование занимает в среднем 5 мин)
• Немедленный результат
• Оценка эффективности терапии
• Возможность обследования детей
• Высокой биохимической активности (АЛТ/АСТ выше верхнего лимита нормы в 3 и более раз)
• Не менее 60% успешных измерений.
Таблица 5. Интерпретация результатов непрямой эластографии
Что такое гепатит А (болезнь Боткина)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Вирусный гепатит А (Hepatitis A viruses, HAV) — острое инфекционное заболевание, вызываемое вирусом гепатита А, клинически характеризующееся синдромом общей инфекционной интоксикации, синдромом нарушения пигментного обмена, синдромами энтерита, холестаза, увеличением печени и в некоторых случая селезёнки, сопровождающееся нарушением функции печени, преимущественно доброкачественного течения.
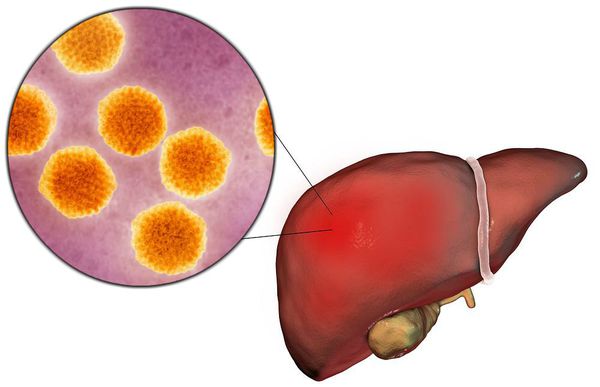
Этиология
семейство — пикорнавирусы (Picornaviridae)
вид — вирус гепатита А (HAV)
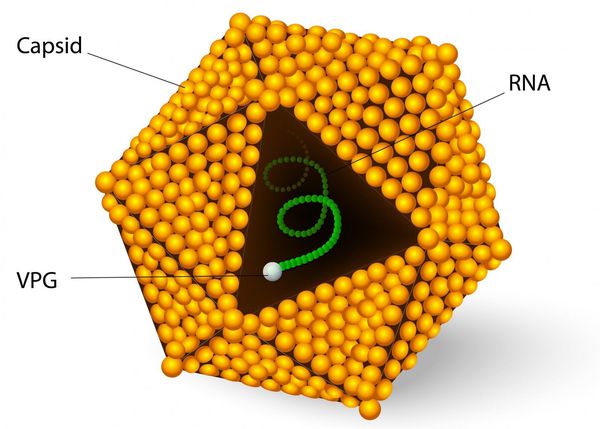
Во внешней среде очень устойчив: при температуре окружающей среды около 4°C сохраняется несколько месяцев, при 2°C — несколько лет, при замораживании очень длительно, при комнатной температуре — несколько недель. В растворе хлорсодержащих средств (0,5-1 мг/л) гибнет в течение часа, при 2,0-2,5 мг/л — в течение 15 минут, ультрафиолетовое облучение приводит к гибели в течение минуты, при кипячении сохраняется до 5 минут. В кислой среде желудка не погибает.
Наиболее значимым маркером вирусного гепатита А являются антитела класса М (анти-HAV IgM), которые образуются в начальный период заболевания и выявляются до 5 месяцев. Появление анти-HAV IgG (маркера перенесённой ранее инфекции) начинается с 3-4 недели заболевания. Антиген вируса выявляется в каловых массах за 7-10 дней до начала манифестных (явно выраженных) проявлений болезни. [1] [2] [4]
Эпидемиология
Заражение гепатитом А происходит при контакте с источником инфекции — живым человеком (больной различными формами заболевания и вирусоноситель). Больные с типичными формами являются главным источником распространения вируса (от конца скрытого и всего желтушного периодов).
Ежегодно в мире регистрируется примерно 1,5 млн случаев заболевания (количество субклинических и бессимптомных форм сложно даже представить). Смертность по миру в 2016 г., по данным ВОЗ, составила 7134 человек [10] .
Условно существует территориальное распределение по уровням инфицирования населения: высокий, средний и низкий.
Районы с высоким уровнем инфицирования это преимущественно Юго-Восточная Азия, Средняя Азия, Африка, Центральная Америка (плохие санитарные условия и низкий доход) — большинство населения к периоду взросления уже переболели и имеют иммунитет, вспышки болезни встречаются редко.
Районы со средним уровнем инфицирования — страны с переходной экономикой, развивающиеся, имеющие различия в санитарно-гигиенических условиях на территории одного региона, например Россия (большая часть населения к периоду взросления не болела и не имеет иммунитета к вирусу, возможны большие вспышки болезни).
Районы с низким уровнем инфицирования — развитые страны с высоким уровнем дохода и хорошими санитарно-гигиеническими условиями, например США, Канада, Европа, Австралия. Большинство людей не имеет иммунитета и не болела, вспышки случаются редко и чаще среди групп риска [7] .
В окружающую среду вирус выделяется преимущественно с фекалиями.
Механизм передачи: фекально-оральный (пути — водный, контактно-бытовой, пищевой), парентеральный (редко при переливании крови), половой (орально-анальный контакт).
Восприимчивость населения высокая.
Факторы риска заражения:
- высокая скученность населения;
- несоблюдение правил личной гигиены и правил хранения, обработки и приготовления продуктов питания;
- неудовлетворительное состояние объектов водоснабжения;
- бытовой очаг заболевания.
Кто находится в группе риска
- путешественники (особенно в страны жаркого климата и с плохими социальными условиями);
- гомосексуалисты;
- люди, употребляющие наркотики (любые), алкоголики;
- медработники (непривитые и не болевшие);
- бездомные;
- люди, имеющие постоянные контакты (в силу профессии или иных причин) с мигрантами из неблагополучных по гепатиту А регионов.
Характерна осенне-весенняя сезонность, повышенная привязанность к жарким южным регионам.
Иммунитет после перенесённого заболевания стойкий, пожизненный, то есть повторно заболеть нельзя [1] [3] [4] [7] [10] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы гепатита А
Заболевание начинается постепенно. Инкубационный период гепатита А протекает 7-50 дней.
Синдромы вирусного гепатита А:
- общей инфекционной интоксикации;
- нарушения пигментного обмена (желтуха);
- энтерита (воспаление слизистой тонкой кишки);
- холестаза (уменьшение количества желчи, поступающей в двенадцатиперстную кишку);
- гепатолиенальный (увеличение печени и селезёнки);
- отёчный;
- нарушения функции печени.
Типичное течение болезни — это желтушная форма болезни средней степени тяжести (устаревшее название — желтуха или болезнь Боткина).
Начальный период болезни (преджелтушный) имеет продолжительность от 2 до 15 дней и может протекать по нескольким вариантам:
При осмотре обнаруживается увеличение печени и, в меньшей степени, селезёнки, чувствительность края печени, повышение ЧСС (пульса), носовые кровотечения. В конце периода моча темнее, а кал становится светлее.
Следующий период (желтушный) длительностью около 7-15 дней характеризуется снижением выраженности симптомов предшествующего периода (то есть с появлением желтухи самочувствие улучшается). Усиливается желтушное окрашивание склер, кожных покровов и слизистой оболочки ротоглотки. Моча приобретает цвет тёмного пива, кал белеет. Присутствует общая слабость, недомогание, плохой аппетит, чувство тяжести и переполненности в правом подреберье, больной расчёсывает себя из-за зуда кожи (лихенификация), появляются петехии (мелкие кровоизлияния) на коже.
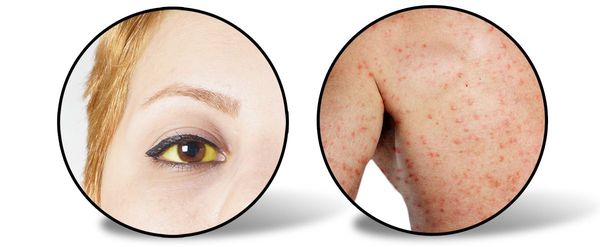
При врачебном исследовании выявляется увеличение печени и селезёнки, явственно положителен симптом Ортнера (болезненность при поколачивании ребром ладони по правой рёберной дуге), гипотония (может быть и нормотония), токсическая брадикардия (снижение ЧСС), появляются периферические отёки, возможны боли в суставах (артралгии).
Далее при благоприятном течении заболевания (которое наблюдается в большинстве случаев) происходит регресс клинической симптоматики, осветление мочи и потемнение кала, более медленное спадение желтушности кожи, склер и слизистых оболочек.
Под нетипичным течением болезни подразумеваются лёгкие безжелтушные формы гепатита А (отсутствие симптомов или лёгкая слабость без желтухи, тяжесть в правом подреберье), фульминантные формы.
Факторы, увеличивающие риск тяжёлого течения гепатита А:
Последствия для беременных
У беременных гепатит А протекает в целом несколько тяжелее, чем у небеременных. Примерно в 36 % случаев возможно развитие слабости родовой деятельности, преждевременные роды (31-37 неделя) и послеродовые кровотечения. Вирус не проникает через плаценту, то есть какого-то специфического действия на плод не оказывает. В грудном молоке вирус не содержится [1] [2] [4] [7] .
Патогенез гепатита А
Воротами для проникновения вируса является слизистая оболочка органов желудочно-кишечного тракта, где происходит его первичное размножение в эндотелиальной выстилке тонкого кишечника и мезентериальных лимфоузлах.
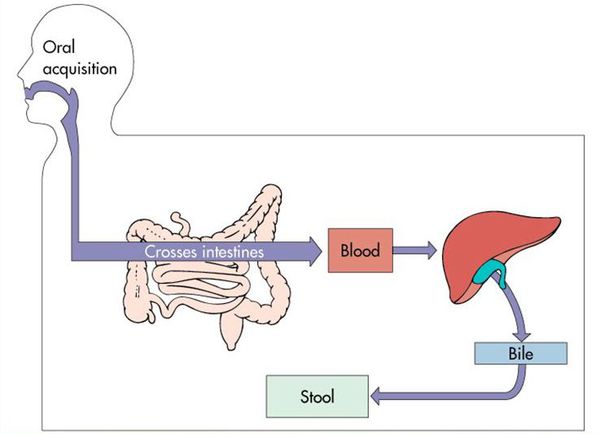
Далее происходит гематогенное распространение вирусных частиц и проникновение их в печень, где они локализуются в ретикулогистиоцитарных клетках Купфера и гепатоцитах. В результате этого происходит повреждение клеток:
- проникновение вируса в клетку;
- захват лизосомой;
- разрушение белковой оболочки вируса;
- сборка белков по программе вирусной РНК;
- встраивание этих белков в цитолемму клетки;
- образование патологических пор в оболочке клетки;
- поступление внутрь клетки ионов натрия и воды;
- баллонная дистрофия (разрушение ультраструктур клетки и образование крупных вакуолей) с последующим некрозом (его объём, как правило, ограничен);
- гибель клетки и лимфоцитарная иммунная реакция, приводящая к основному объёму поражения.
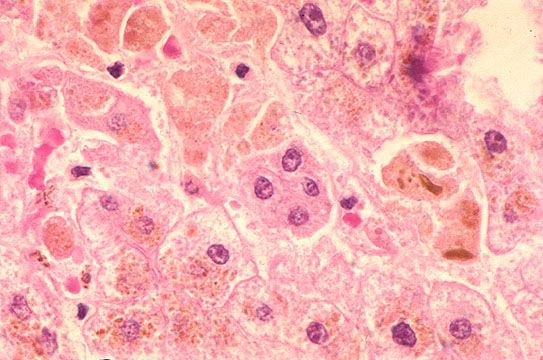
В дальнейшем вирус попадает в желчь, с ней он проникает в кишечник и выводится в окружающую среду с фекалиями. Вследствие компетентных реакций иммунной защиты размножение вируса заканчивается, и он покидает организм больного. [2] [3] [4]
Классификация и стадии развития гепатита А
По степени разнообразия проявлений выделяют две формы гепатита А:
- клинически выраженная (желтушная, безжелтушная, стёртая);
- субклиническая (инаппарантная).
По длительности течения также выделяют две формы гепатита А:
- острая циклическая (до трёх месяцев);
- острая затяжная (более трёх месяцев).
Степени тяжести гепатита А:
- лёгкая;
- среднетяжёлая;
- тяжёлая;
- фульминатная (молниеносная).
Согласно МКБ-10 (Международной классификации болезней десятого пересмотра), заболевание подразделяют на три вида:
- В15. Острый гепатит А;
- В15.0. Гепатит А с печёночной комой;
- В15.9. Гепатит А без печёночной комы. [2][4]
Осложнения гепатита А
Заболевание может привести к следующим осложнениям:
- печёночная кома (дисфункция центральной нервной системы, связанная с тяжёлым поражением печени — встречается крайне редко);
- холецистохолангит (выраженные боли в правом подреберье, нарастание желтухи и зуда кожи);
- гемолитико-уремический синдром, преимущественно у детей (гемолитическая анемия, тромбоцитопения, острая почечная недостаточность);
- развитие аутоиммунного гепатита I типа.
Гепатит А не приводит к формированию хронических форм, однако из-за выраженного воспалительного процесса возможно появление длительных резидуальных (остаточных) явлений:
- дискинезия (нарушение моторики) желчевыводящих путей;
- постгепатитная гепатомегалия (увеличение размеров печени из-за разрастания соединительной ткани);
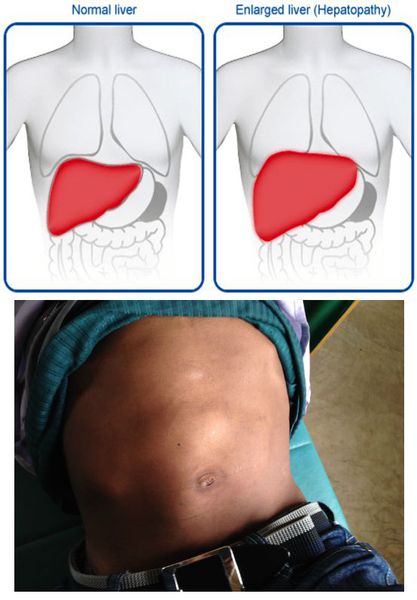
- постгепатитный синдром (повышенная утомляемость, аснено-невротические проявления, тошнота, дискомфорт в правом подреберье). [1][5]
Диагностика гепатита А
Методы лабораторной диагностики:
- Клинический анализ крови — нормоцитоз или лейкопения, лимфо- и моноцитоз, нейтропения, СОЭ в норме или снижена.
- Биохимический анализ крови — повышение общего билирубина и в большей степени его связанной фракции (реакция Эрлиха), повышение аланинаминотрансферазы и аспартатаминотрансферазы, снижение протромбинового индекса, повышение тимоловой пробы (снижение альбуминов и повышение гамма-глобулинов), повышение гамма-глутамилтранспептидазы, щелочной фосфатазы и другие показатели.
- Биохимический анализ мочи — появление уробилина и желчных пигментов за счёт прямого билирубина. Ранее, особенно в вооруженных силах, для выявления больных на начальной стадии практиковалось использование пробы Разина: утром производится опускание индикаторной полоски в мочу (при наличии уробилина она меняет цвет), и военнослужащий с подозрением на заболевание госпитализировался для углублённого обследования. Тест на уробилин становится положительным в самом начале заболевания — в конце инкубационного периода из-за болезни печёночной клетки.
- Серологические тесты — выявления анти-HAV IgM и анти-HAV IgG методом ИФА (иммуноферментного анализа) в различные периоды заболевания и HAV RNA с помощью ПЦР-диагностики (полимеразной цепной реакции) в острый период.
- Ультразвуковое исследование органов брюшной полости — увеличение печени и иногда селезёнки, реактивные изменения структуры печёночной ткани, лимфаденопатия ворот печени.
Обследование лиц, бывших в контакте с больным
Лица, контактирующие с больным вирусным гепатитом А, подлежат осмотру врачом-инфекционистом с последующим наблюдением до 35 дней со дня разобщения с больным. Наблюдение включает термометрию, осмотр кожных покровов, определение размеров печени и селезёнки, а также лабораторное обследование (АЛТ, общий билирубин, антитела классов М и G к вирусу гепатита А вначале и через три недели от первичного обследования).
Дифференциальная диагностика проводится со следующими основными заболеваниями:
- в начальный период: ;
- гастрит, гастроэнтероколит;
- полиартрит;
- энтеровирусная инфекция;
- в желтушный период: ;
- псевдотуберкулёз; ;
- желтухи другой этиологии (гемолитическая болезнь, токсические поражения, опухоли ЖКТ и другие заболевания);
- гепатиты другой этиологии (вирусные гепатиты В, С, Д, Е и другие, аутоиммунные гепатиты, болезнь Вильсона — Коновалова и т.п.) [1][2][3][4][9] .
Лечение гепатита А
Этиотропная терапия (направленная на устранение причины заболевания) не разработана.
Медикаменты
В зависимости от степени тяжести и конкретных проявлений назначается инфузионная терапия с глюкозо-солевыми растворами, обогащёнными витаминами. Показано назначение сорбентов, препаратов повышения энергетических ресурсов, при необходимости назначаются гепатопротекторы, в тяжёлых случаях — гормональные препараты, препараты крови, гипербарическая оксигенация и плазмаферез.
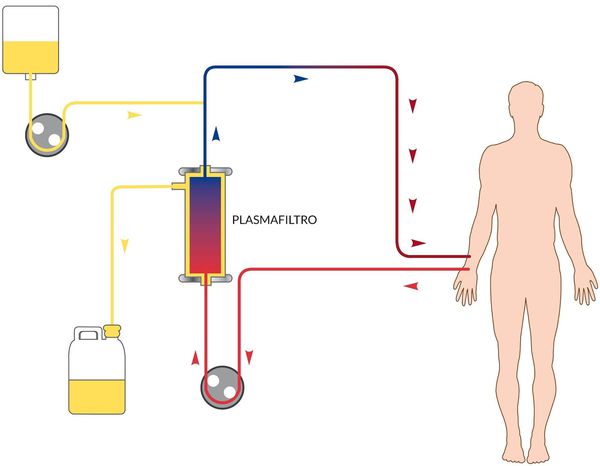
Нужна ли госпитализация
В случае лёгких форм гепатита А лечение может проводиться на дому (при наличии условий). Госпитализация потребуется, начиная со среднетяжёлых форм, лицам групп риска по тяжёлому течению, пациентам с осложнёнными формами, беременным и детям. Каких-либо особенностей при дальнейшем лечении вирусного гепатита А у детей нет.
Режим постельный или полупостельный. При гепатите А нарушаются процессы образования энергии в митохондриях, поэтому предпочтителен длительный отдых.
Лечение в стационаре и выписка
Лечение гепатита А проходит в инфекционном отделении больницы. Выписка пациентов происходит после появления стойкой и выраженной тенденции к клиническому улучшению, а также улучшения лабораторных показателей.
Критерии выписки больных:
- стойкая и выраженная тенденция к клиническому улучшению (отсутствие интоксикации, уменьшение размеров печени, регресс желтухи);
- стабильное улучшение лабораторных показателей (нормализация уровня билирубина, значительное снижение уровня АЛТ и АСТ).
При неосложнённых формах реконвалесценты (выздоравливающие больные) подлежат наблюдению в течении трёх месяцев с осмотром и обследованием не реже одного раза в месяц. [2] [3] [6]
Физиотерапия
В фазе реконвалесценции, особенно при затяжных формах болезни, возможно применение физиотерапевтических методов лечения:
- грязевых аппликаций на область правого подреберья;
- акупунктуры;
- массажа проекции области печени, желчного пузыря, желчевыводящих протоков.
Диета
Показана диета № 5 по Певзнеру — механически и химически щадящая, употребление повышенного количества жидкости и витаминов, запрет алкоголя. Исключается острое, жареное, копчёное, ограничивается кислое и соль. Все блюда готовятся на пару, тушатся, отвариваются и подаются только в тёплом виде.
Прогноз. Профилактика
Прогноз заболевания, как правило, благоприятный. Пациенты выздоравливают спустя 1-3 месяца после выписки из стационара. В редких случаях заболевание приобретает затяжной характер.
Критерии излеченности:
- отсутствие интоксикации;
- полная нормализация уровня билирубина, АЛТ и АСТ;
- нормализация размеров печени и селезёнки;
- появление в крови антител к вирусу гепатита А класса G (Anti-HAV-IgG).
Неспецифические мероприятия, позволяющие снизить количество случаев инфицирования:
- обеспечение условий и факторов потребления безопасной питьевой воды (водоснабжение);
- обеспечение и контроль за соблюдением утилизации сточных вод (канализационное хозяйство);
- контроль за качеством обследования персонала, связанного с пищевой промышленностью;
- контроль и соблюдение технологии хранения, приготовления и транспортировки пищевых продуктов и воды.
К личным профилактическим мерам относится тщательное мытьё рук после посещения туалета, смены подгузников, а также перед приготовлением или приёмом пищи.
Вакцинация
Специфическим профилактическим мероприятием является проведение иммунизации против гепатита А: практически у 100% привитых двукратно людей вырабатывается стойкий иммунитет, предотвращающий развитие заболевания. Вакцинация — это самый лучший способ предотвратить заражение.
Справка: что такое гепатит С
Вирусные гепатиты — это инфекционные заболевания, поражающие печень. Существуют разные вирусные гепатиты (их обозначают латинскими буквами). Симптомы заболеваний могут быть схожими (а чаще всего их вообще нет), но их возбудители по-разному распространяются и влияют на организм человека. Например, гепатит А — это кратковременная инфекция, а В и С могут протекать десятилетиями, незаметно повреждая печень. С распространением гепатитов А и В успешно борются с помощью прививок, а вот против гепатита С вакцины не существует.
Заражение вирусом гепатита С обычно происходит через контакт с кровью инфицированного человека:
- через шприц у лиц, употребляющих инъекционные наркотики (по статистике это наиболее распространенный способ заражения);
- при незащищенном сексе (риск выше при более травматичных формах, например, анальном сексе);
- через нестерильные медицинские инструменты (например, при экстренных вмешательствах в ограниченных условиях, при стоматологических процедурах и др.);
- через предметы личного пользования (например, бритву);
- при нарушении условий переливания крови (встречается редко, так как компоненты и доноры крови проходят тщательный отбор и обследование);
- от инфицированной матери новорожденному.
Основной способ диагностики гепатита С — анализ крови. Поэтому сложно назвать реальное количество людей, которые являются носителями этого вируса. В 2021 году некоторые эксперты говорили о том, что в России гепатитом С могут быть заражены около 5,7 млн человек.
— Как гепатит С лечили раньше?
— Сначала для терапии использовали рибавирин — неспецифический противовирусный препарат, у которого есть немало побочных эффектов. Потом его стали использовать в комбинации с препаратами интерферона, задача которого — усилить иммунный противовирусный ответ в организме. Но и у интерферона есть побочные явления и нередко — противопоказания к применению. Существуют заболевания, при которых применение интерферона невозможно или дает очень высокие риски осложнений. Зачастую приходилось выбирать, кому из больных проводить терапию по этой схеме, а кому отказывать. Эффективность тоже была заведомо невысокой, можно даже сказать, мы играли в лотерею. Переносимость интерферона, сопутствующие заболевания, риск нежелательных явлений, изменение показателей крови, стадия цирроза печени и в целом состояние печени на момент лечения — от всего этого зависело, можно ли было назначать лечение. Плюс мы выявляли у пациентов определенные генетические показатели, при которых его применение заведомо могло быть малоэффективным.
— Таких пациентов совсем не лечили?
— Гепатопротекторы бесполезны при гепатите?
— Итак, старая схема давала высокие риски, побочные эффекты и низкую эффективность. Что удалось изменить в новых рекомендациях?
— Принципиальный момент, который, наверное, будет самым важным для всех нас — и для пациентов, и для врачей, — возможность назначать терапию на любой стадии хронического гепатита С. Не запущенные стадии, как было раньше, когда у пациента уже возникали фиброз и цирроз печени. Сейчас у нас единственное показание к лечению, как и во всем мире, что мне очень приятно, — это сам факт выявления вируса гепатита С в крови. Поэтому врачам теперь не нужно решать, кому назначать противовирусную терапию, а кому — нет.
— Терапию теперь можно проводить сразу после того, как вирус обнаружили в крови?
— По современным российским рекомендациям это нужно сделать не позднее трех месяцев после обнаружения вируса в крови — возможно начать терапию сразу, иногда понаблюдать 6–12 недель. Это можно делать, потому что в определенных случаях организм побеждает вирус сам. Процент таких больных действительно есть, хотя он намного ниже, например, чем в случаях с гепатитом В (он реже становится хроническим).
— Мы убрали это слово, сейчас такого подхода нет. Конечно, приоритет все равно дается пациентам с циррозом печени или с другими рисками (например, с раком печени и вирусным гепатитом или поражением других органов). Пациенты после после пересадки печени получают лечение незамедлительно, так как инфицирование нового органа наступает неизбежно.
— Схема лечения тоже изменилась?
— Это еще один принципиальный момент, над которым мы целенаправленно работали. Из рекомендаций исчезли препараты интерферона. Это влечет за собой целый ряд позитивных изменений. Как я уже говорил, интерферон многими пациентами переносится тяжело, возникают побочные эффекты, и результаты невысоки, особенно при циррозе печени.
Теперь мы перешли полностью на таблеточные схемы, их эффективность приближается к 100%. Это позволяет бюджетным медицинским учреждениям больше не тратить деньги на закупку интерферона, а закупать только таблеточные формы лекарств и использовать безинтерфероновые высокоэффективные схемы. При этом нужно сказать, что большая часть тех препаратов, которые есть в мире и, в частности, в западных странах, присутствуют и в России.
— Новые схемы лечения эффективнее прежних?
— Они перекрывают все существующие в России типы вирусов гепатита С. Это так называемая пангенотипная схема: когда одна таблетка, одна комбинация препаратов, может вылечить все типы вирусов. К примеру, в России встречаются в основном три типа вируса гепатита С (1а, 1b, 3), и их раньше по разным причинам не всегда удавалось лечить эффективно, особенно на стадии цирроза. Сейчас эта проблема уже не имеет значения. Во всем мире принята следующая концепция упрощенного подхода к лечению: выявляют вирус, но не определяют ни его количество, ни его разновидность, для того чтобы выбрать конкретный препарат. Вместо этого назначают лекарства, которые одинаково эффективны при разных вариантах инфекции.
Ценностно-ориентированное здравоохранение (ЦОЗ) в настоящее время является новаторским направлением в медицинской индустрии, однако практические аспекты реализации данной стратегии в нашей стране до настоящего времени не формулировались. В статье рассматриваются принципы и задачи ЦОЗ, его роль и значение для результат-ориентированного здравоохранения. На примере реализуемой в Москве инновационной модели лекарственного обеспечения по механизму риск-шеринга (разделения рисков) продемонстрирована взаимосвязь финансовых стимулов и результатов лечения пациентов с хроническим гепатитом С.
Внаши дни разработка инновационных лекарственных препаратов в сочетании с появлением и внедрением новаторских медицинских технологий привели к закономерному изменению парадигмы оказания медицинской помощи. Если еще недавно решение насущных проблем здравоохранения заключалось непосредственно в изобретении/наличии самой новой медицинской технологии, то сегодня особое значение приобретает поиск наиболее ценных медицинских технологий, обладающих достаточной эффективностью при умеренной цене. Данный подход начал формироваться за рубежом в начале двухтысячных годов и получил название Value-Based Healthcare (ценностноориентированное здравоохранение [ЦОЗ]). Отличи тельной чертой ЦОЗ является фокус на оптимизации соотношения между затратами на лечение и его результатами [1,2]. Результат-ориентированное здравоохранение (РОЗ) предполагает количественную оценку клинических результатов (исходов) и параметров экономической и социальной выгоды. Сдерживание роста затрат является ключевой проблемой современных систем здравоохранения. Не вызывает сомнений, что единственным приемлемым способом, позволяющим это сделать без ущерба для качества, является оптимизация или повышение эффективности расходов на здравоохранение. Особый интерес вызывают изменения, произошедшие в оказании медицинской помощи и лекарственном обеспечении больных с инфекцией, вызванной вирусом гепатита С (HCV).
Социальная и экономическая значимость проблемы вирусных гепатитов в Российской Федерации определяется, прежде всего, высокой заболеваемостью хроническими формами: в 2015 г. по ориентировочным расчетам экспертов экономический ущерб для страны от впервые установленного ХГС составил 1 888 721,6 тыс. руб. Рейтинговый анализ величин экономического ущерба, нанесенного отдельными инфекционными болезнями в 2005-2015 гг., показал, что острый и хронический гепатит С остаются на прежних позициях [16].
Однако важным обстоятельством, снижающим эффективность терапии HCV-инфекции в России, сегодня является несвоевременное использование имеющегося ресурса в виде трехкомпонентных интерферонсодержащих схем противовирусной терапии (ПВТ) у людей трудоспособного возраста с минимальным или умеренно выраженным фиброзом. Лечение HCV-инфекции на продвинутых стадиях фиброза печени и цирроза печени в исходе ХГС, в том числе осложненного развитием гепатоцеллюлярной карциномы, является весьма трудоемким и экономически затратным, так как требует междисциплинарного подхода, применения дорогостоящих лекарственных препаратов и/или хирургических вмешательств в рамках высокотехнологичной медицинской помощи (трансплантация печени и/или почки).
На фоне расцвета возможностей новых медицинских технологий в лечении HCV-ассоциированных заболеваний системы здравоохранения во всем мире сталкиваются с одной и той же проблемой – попытки стабильного обеспечения медицинской помощью популяционно значимого числа пациентов путем сдерживания затрат приводят к уменьшению охвата целевой популяции и непосредственно пропускной способности системы. Отсутствия доступа к ПВТ в необходимом объеме и недостаточно эффективное использование имеющегося ресурса (с точки зрения фармакоэкономики) представляет собой существенную нагрузку на бюджет. Решением этой проблемы может быть разумное использование потенциала ПВТ с целью достижения максимальной частоты УВО при максимальном охвате ПВТ инфицированных пациентов. Стратегия лекарственного обеспечения определяется системой здравоохранения каждого государства и отличается в разных странах. Общемировая тенденция в лечении больных ХГС за счет государственных средств состоит в прагматичном управлении как спектром противовирусных препаратов, возмещаемых государством, так и соотношением данных препаратов [18,19]. Большинство стран Европы имеют национальные программы по лечению ХГС. По данным Института информатизации здравоохранения (IMS Institute for Healthcare Informa tics), Испания, Италия, Германия и Франция являются лидерами в Европе по числу пациентов, получивших противовирусную терапию ХГС [20]. Вместе с этим в каждом государстве ЕС собственный государственный орган здравоохранения определяет политику в отношении выбора программ лекарственного обеспечения: частым вариантом возмещаемого лечения является соглашение о разделении рисков (СРР) (RSA, Risk sharing agreement) между плательщиком (государством) и производителем препаратов. Традиционно детали данных соглашений (в первую очередь финансовые) остаются известными лишь участвующим сторонам.
Спецификой российской действительности является наличие двух направлений лекарственного обеспечения – “федерального” и “регионального”, в рамках которых производится организация медицинской помощи больным ХГС 24. С недавнего времени лекарственная терапия у пациентов, инфицированных HCV, может проводиться за счет средств ОМС в рамках территориальной программы государственных гарантий бесплатного оказания медицинской помощи (Специа лизированные клинико-статистические группы №21–25 для проведения лекарственной терапии ХГС) в соответствие с плановыми объемами Государ ствен ного задания в субъекте РФ согласно Методическим рекомендациям по способам оплаты специализированной медицинской помощи за счет средств ОМС (совместное письмо Минздрава России №11-8/10/2-8266 и Феде раль ного фонда обязательного медицинского страхования [ФОМС] №12578/26/и от 22.12.2016 с разъяснениями, данными в Инструкции по группировке случаев, в том числе правилам учета дополнительных классификационных критериев – письма ФОМС №12708/26-2/и от 27.12.2016 и №2715/26-2/и от 07.03.2017).
Столичная целевая региональная программа, направленная на повышение качества оказания медицинской помощи жителям города Москвы, страдающим ХГС, и снижение смертности от инфекционных заболеваний, стартовала с 2016 г. согласно распоряжению Прави тельства Москвы №723-РП от 15 декабря 2015 г. Данная программа разработана для лекарственного обеспечения граждан, страдающих ХГС и не имеющих право на получение государственной социальной помощи в виде набора социальных услуг (социально-значимая категория пациентов – москвичи трудоспособного возраста), в рамках реализации Государственной программы “Развитие здравоохранения города Москвы (Столичное здравоохранение)” на 2012-2020 гг. Выше указанная программа предполагает реализацию национальной стратегии профилактики, диагностики и лечения вирусных гепатитов в соответствии с рекомендациями Всемирной организации здравоохранения (ВОЗ) (Global health sector strategy on viral hepatitis, 2016-2021). По данным Городского регистра больных с хроническим вирусным гепатитом В и С на базе Центра по лечению хронических вирусных гепатитов инфекционной клинической больницы №1 в 2016 г. в Москве противовирусную терапию за счет бюджетных средств получили 1953 пациента: 1525 были обеспечены противовирусным лечением за счет региональной программы, а 428 – за счет средств федерального бюджета. Количество пациентов, которым необходимо проведение противовирусной терапии HCV-инфекции, в Москве не является постоянным. Однако с учетом распространенности HCV-инфекции, численности населения Москвы в 2016 г. (12 301 126 чел.) и наличия показаний к противовирусной терапии фактически у всех пациентов с диагностированным ХГС, можно заключить, что оно составляет как минимум 8702 человека. Как указано выше, в РФ доминирует генотип 1b (56,4%), поэтому минимальное расчетное число пациентов с HCV 1b генотипа, имеющих показания к назначению противовирусной терапии, составляет 4908 человек.
- пациенто-ориентированность;
- персонализированный учет исходов и финансовых затрат на лечение;
- оплата за результат, а не за процесс.
Вариантом реализации данной модели с последующей возможностью широкомасштабного внедрения в практическое здравоохранение является концепция разделения рисков – инновационный подход к организации лекарственного обеспечения пациентов с различными заболеваниями. Анализ мирового опыта применения СРР позволил определить стороны, заинтересованные во внедрении схем, и их роли в процессе заключения соглашений. Так, производители видят в СРР способ расширения продаж дорогостоящих препаратов, а плательщики – экономию бюджетных средств [35]. Особое внимание стоит обратить на то, что среди многообразия вариантов СРР особо предпочтительными являются случаи лекарственного обеспечения на коротком временном отрезке с возможностью оценки “генерального” исхода (реконвалесценция). Данные примеры договоров являются популярными вариантами разделения рисков “Р4Р” – pay for performance (плата за действие) или pay for cure (плата за излечение) 38.
Организация медицинской помощи в городе Москве всегда находится на передовой и характеризуется целесообразным использованием актуальных подходов и медицинских технологий. Открытость и гибкость московской системы здравоохранения позволили в текущем году провести подготовительный этап реализации пилотного проекта инновационной модели лекарственного обеспечения больных c HCV 1b генотипа cимепревиром с применением инновационной модели лекарственного обеспечения в рамках СРР. Доста точ ная эффективность в сочетании с приемлемой стоимостью лечения – два очевидных факта, сделавшие трехкомпонентную интерферонсодержащую схему на основе симепревира наиболее распространенной в рамках СРР в мире [19]. На сайтах национальных органов здравоохранения ряда стран (США, Великобритания, Франция и Канада) можно найти некоторую информацию о данных соглашениях. Согласно заключению Национального института здоровья и клинического совершенствования Великобритании (NICE) по состоянию на январь 2015 г. возмещение расходов на противовирусную терапию симепревиром возможно в случае достижения пациентом клиренса HCV RNA в результате 12-недельного лечения. Французским национальным органом здравоохранения (HAS) в 2014 г. рекомендовано включить симепревир в список возмещаемых лекарственных препаратов. Канадская экспертная комиссия по лекарственным препаратам (CADTH) в июне 2014 г. рекомендовала включение симепревира в комбинации с пегилированным интерфероном-α (ПегИФН) и рибавирином для лечения ХГС, вызванного вирусом 1-го генотипа, у взрослых с компенсированным заболеванием печени при соблюдении ряда условий, причем стоимость противовирусной терапии тремя препаратами по мнению CADTH не должна превышать стоимость других существующих в указанное время противовирусных препаратов прямого действия.
Симепревир – ингибитор NS3/4A-протеазы HCV, который нековалентно и обратимо блокирует ключевой фермент репродукции HCV. Исследования показали, что in vitro и in vivo симепревир имеет выраженную противовирусную активность в отношении HCV 1, 2, 4, 5 и 6-го генотипов. В доклинических исследованиях in vitro и in vivo признаков генотоксичности, репродуктивной токсичности, эмбрио- и фетотоксичности симепревира и неблагоприятного влияния препарата на пре- и постнатальное развитие не выявлено [42,43]. У первичных пациентов с ХГС, вызванным вирусом 1 генотипа, частота УВО при лечении симепревиром в составе комбинированной ПВТ составила 80,4% (результаты исследований QUESTI + QUESTII). Принимая во внимание особенность российской популяции больных (доминирование HCV субгенотипа 1b), предполагается исключительно высокая эффективность симепревира в Российской Федерации (частота УВО более 90%). Результаты комбинированной ПВТ, включающей симепревир, в отличие от двухкомпонентной ПВТ, не зависят от пола, возраста, расы, индекса массы тела, исходной вирусной нагрузки, генотипа ИЛ-28В, стадии фиброза печени (в том числе у больных с компенсированным циррозом печени), субгенотипа HCV 1-го генотипа при отсутствии мутации Q80K. Следует отметить, что доминирование субгенотипа 1b в российской популяции больных, инфицированных HCV 1-го генотипа, делает проблему мутации Q80K незначимой [44].
Полученные в рандомизированных многоцентровых клинических исследованиях данные позволили сформулировать правила прекращения терапии симепревиром. Если уровень HCV RNA снижается менее 25 МЕ/мл через 4 недели (даже если при этом определяется HCV RNA) и не определяется через 12 недель, то частота достижения УВО является высокой. В то же время она крайне низкая, если HCV RNA продолжается определяться через 4 и 12 недель после начала лечения (≥25 МЕ/мл) [45,46]. Соответственно, в последнем случае трехкомпонентную ПВТ, включающую симепревир, следует прекратить. Правила досрочного прекращения ПВТ действуют менее чем у 5% больных и позволяют избежать нарастания резистентности к симепревиру и неэффективных затрат финансовых средств 49.
Пилотный проект по инновационной модели лекарственного обеспечения планируется реализовать в период 2017-2021 гг. Данный вариант лекарственного обеспечения не противоречит ФЗ-44 и ФЗ-223, а проведение закупки лекарственных препаратов происходит в стандартном порядке (электронный аукцион), определенном Законом №44-ФЗ, с применением типовых (стандартных) форм документации о закупке и контракта, обычно используемых заказчиком. Законода тельство позволяет реализовывать инновационные модели лекарственного обеспечения за счет средств ОМС. Оценка эффективности и результативности трехкомпонентной терапии с симепревиром будет производиться на основании частоты достижения быстрого и раннего вирусологического ответа. В случае их отсутствия неэффективно затраченный препарат будет компенсироваться производителем, что позволит без дополнительных затрат расширить охват терапией дополнительного числа пациентов.
Ожидается, что излечение популяционно значимого числа пациентов с HCV 1b генотипа с умеренно выраженным фиброзом печени (F0-3 по шкале METAVIR) приведет к значительному уменьшению масштаба проблемы HCV-инфекции в московском регионе и позволит достичь оптимального результата при снижении финансовой нагрузки на бюджет города Москвы.
Реализуемая программа оказания медицинской помощи и лекарственного обеспечения пациентов с ХГС в Москве является свидетельством закономерного перехода от главенства процесса к РОЗ, так как оплата за лекарственный препарат в данном случае зависит от результата лечения. При этом внедрение СРР в рамках государственных программ позволяет обеспечить пациентам доступ к наиболее эффективным технологиям лечения. Концентрация на достижении улучшенных результатов, которые действительно важны как для пациентов, так и для государства, позволит повысить качество медицинской помощи, снизить вариабельность результатов лечения, улучшить доступ к медицинской помощи и в целом повысить эффективность затрат на здравоохранение.
Читайте также:

