Ядро вируса гепатита с
Обновлено: 26.04.2024
всем мире. В настоящее время абсолютно очевидны серьезные проблемы, связанные с данной инфекцией: высокая частота формирования хронических форм, бессимптомное течение, манифестация заболевания на поздних стадиях (цирроз печени), четкая ассоциация с развитием гепатоцеллюлярной карциномы. Ассамблея ВОЗ в 2016 г определила глобальную стратегию по борьбе с вирусными гепатитами, предполагающую элиминацию этих инфекций к 2030 г. Важнейшими целями этой программы, принятой 194 странами мира, являются сокращение числа новых случаев заражения вирусными гепатитами на 90% и числа случаев смерти от него на 65% по сравнению с уровнем 2016 г.
Актуальность проблемы объяснима еще и фактом выявления значительной частоты коинфекции ВГС и вирусом гепатита В (ВГВ). Маркеры вируса гепатита В (ВГВ) обнаруживаются у пациентов с ХГС в 22% случаев, что определяет важность вакцинации больных ХГС без коинфекции ВГВ против вирусного гепатита В. Установлена низкая частота перинатальной передачи ВГС от матерей с ХГС детям (3,5%), в то время как у женщин с сочетанием ХГС и ВИЧ-инфекции перинатальная передача ВГС составяет 14–16%.
Группы риска по заражению ВГС: медицинские работники; лица, использующие инъекционные наркотики; пациенты с ВИЧ; лица, которым были сделаны татуировки с помощью нестерильных инструментов; пациенты, получающие переливание крови или ее компонентов до 1992 г., пациенты отделений гемодиализа, дети, рождённые от матерей с ВГС.
Большинство пациентов с ОГС не демонстрируют каких-либо симптомов заболевания, у некоторых из них наступает спонтанная элиминация вируса, с которой ассоциируются следующие факторы: женский пол, молодой возраст, течение заболевания с клинической симптоматикой, клиренс РНК ВГС в течение 4 недель от начала клинической манифестации заболевания, генотип интерлейкина 28В (ИЛ 28В) СС. Однако ни один из этих параметров не может лечь в основу предсказания характера течения заболевания у каждого конкретного пациента.
Хронический гепатит С - хроническое заболевание печени, продолжающееся более 6 месяцев, в основе которого лежат инфицирование и поражение печени ВГС и манифестирующее морфологически некротическими, воспалительными и фибротическими изменениями печеночной ткани различной степени тяжести.
Диапазон исходов инфекции, вызванной ВГС, широк и колеблется от минимального до тяжелого поражения печени, включая развитие ЦП и ГЦК. Через 20– 30 лет после инфицирования ВГС вероятность развития ЦП колеблется от 4 до 45%. Прогрессирование фиброза печени имеет нелинейный характер и длится, как правило, в течение 20–40 лет от момента инфицирования. У части больных этот процесс происходит чрезвычайно медленно.
Выделен ряд факторов, которые могут оказывать отрицательное влияние на естественное течение гепатита С: возраст старше 40 лет к моменту инфицирования, мужской пол, раса (неевропейская), злоупотребление алкоголем, ожирение, нарушение обмена железа, метаболический синдром и др.
Верификация диагноза гепатита С основывается на обнаружении специфических маркеров гепатита С – определение суммарных антител к гепатиту С и маркерного спектра, состоящего из антител к структурным и неструктурным белкам вируса класса М и G.
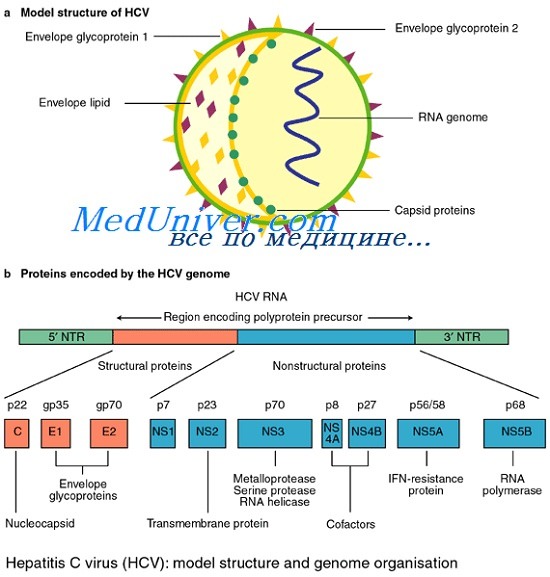
Структурные белки (core- белок - ядерный, белки оболочки -Е1 и Е2, необходимы для формирования вирусного капсида. Основным структурным белком вируса гепатита С является core-протеин, который обладает РНК-связывающей активностью и образует нуклеокаспид вируса. Именно с этим структурным белком связывают прямое цитопатическое действие вируса С на печеночную клетку. Одновременно с этим показано, что данный белок обладает онкогенным эффектом. В эксперименте было установлено, что core-протеин вируса гепатита С подавляет процесс апоптоза и тем самым способствует развитию опухолевого процесса. Однако до настоящего времени все еще не выяснено, коррелирует ли наличие core-протеина с уровнем РНК и различных генотипов вируса.
Антитела класса М к core-антигену начинают выявляться в крови, начиная с 2 недели от начала заболевания, могут циркулировать как при остром, так и хроническом течении заболевания. Обнаружение антител класса М у новорожденного ребенка от матери, инфицированной гепатитом С, означает внутриутробное инфицирование плода. Антитела класса G начинают синтезироваться через 3-4 недели от начала заболевания, их циркуляция достаточно длительная.
Неструктурные белки (p7, NS2, NS3, NS4A, NS4B, NS5A и NS5B) выполняют различные регуляторные функции. Неструктурный белок NS2 является цинк-зависимой протеиназой, а NS3 - серин-протеиназой, участвующей в сборке вириона. Функция NS4 недостаточно известна, хотя предполагается, что этот белок участвует в качестве Ко-фактора для NS3 серин-протеазы [3]. Достаточно хорошо выяснена функция белка NS5. Изучено, что данный белок является РНК- зависимой РНК-полимеразой - ферментом, который крайне необходим для синтеза вирусной РНК, т.е. репликации вируса С. Установлено, что NS5A подавляет активность интерферона. G. Reyes (2002) показал, что NS5A ингибирует процесс апоптоза и тем самым становится фактором канцерогенеза.
При положительном результате на суммарные антитела в вирусу гепатита С (анти-HCV) обязательно необходимо проводить подтверждающее исследование, используя тест на выявление маркеров гепатита и определение РНК вируса с помощью полимеразной цепной реакции в реальном времени.
- диагностика гепатита С;
- подтверждение положительных и сомнительных результатов скрининговых исследований.
Положительный результат: инфицированность вирусом гепатита С (необходимо дополнительно выявлять HCV РНК и подтверждать наличие антител определение подтверждающего теста с определением антител к структурным и неструктурным антигенам).
Если в подтверждающем тесте выявлены антитела только к одному из неструктурных антигенов вируса, результат считается неопределенным. Такие пациенты должны быть обследованы на наличие РНК вируса гепатита С, а через 2-3 недели от момента первого забора крови повторно исследовать кровь на наличие антител к гепатиту С.
Несмотря на высокую точность ИФА, на результаты диагностики могут повлиять: тяжелые иммунодефицитные состояния; беременность; рассеянный склероз; обострения респираторных заболеваний; вакцинация; аутоиммунные системные заболевания соединительной ткани; гематологические недоброкачественные опухоли; систематическое проведение гемодиализа.
Вирус гепатита С и его геном
Вирус гепатита С (HCV) идентифицирован в 1989 году американскими исследователями под руководством М. Houghton, когда была выделена нуклеиновая кислота при экспериментальном заражении шимпанзе и в дальнейшем получена ДНК-копия, которую использовали для создания библиотеки клонов. Скрининг образцов из этой библиотеки позволил выявить клон, экспрессирующий антиген, который реагировал с антителами из сывороток людей, больных посттрансфузионным гепатитом ни А ни В.
Далее был получен рекомбинантный белок, который содержал последовательность из 363 аминокислотных остатков вирусного белка. Эту последовательность обозначили как С-100-3 и использовали в качестве антигена при создании иммуноферментной тест-системы.
Геном вируса гепатита С представлен однонитевой позитивной линейной молекулой РНК, состоящей из 9379 оснований и кодирующей полипротеин из ЗОН аминокислот, который под действием вирусных и клеточных протеаз нарезается на отдельные вирусные белки. Таксономический анализ выявил принадлежность вируса гепатита С к семейству Flaviviridae самостоятельному роду Hepacivirus.
Проведенный анализ нуклеотидных последовательностей изолятов вируса гепатита С различных частей его генома сделал возможным классификацию этого вируса. Наиболее удобной в настоящее время является номенклатура P. Simmonds et al, 1993, основанная на анализе последовательностей области NS5. Эта классификация, а также разработанная примерно в это же время система Н. Okamoto et al., 1992 стала общепринятой. К наиболее распространенным в мире генотипам вируса гепатита С относят: la, lb, 2а, 2b и 3а. Эти генотипы распространены в странах Западной Европы и в Америке, причем преобладающим является генотип lb.
Совсем другое распределение генотипов HCV в странах центрального Востока и Северной и Центральной Африки. Генотип 4, главным образом 4а, доминирует в Египте, Йемене, Кувейте, Ираке, Саудовской Аравии, Заире, Бурунди, Габоне. На юге Африке наиболее часто встречается генотип 5а, который в других частях мира находили исключительно редко. Генотип 3 выявлен в странах Западной Европы, в Сингапуре, Таиланде, Мьянме и Восточной Индии. Всего выделено 9 подтипов третьего генотипа HCV.
В России также проведены исследования по определению структуры генотипов ВГС, циркулирующих в различных ее регионах. Наиболее часто — 60-70 % случаев определен генотип HCV lb. Далее следуют генотипы За, 1а, и 2а. Так, в 1998 году Е. В. Лисицина во Владимирской области выявила следующую структуру генотипов HCV: lb — 72,9 %, 2а — 2,9 %, 2Ь — 2,9 % и За — 15,7 %. В 5,7 % случаев с имеющимся набором праймеров генотип определить не удалось.
При этом было отмечено, что у лиц различного возраста структура генотипов различается. У лиц в возрасте 7-14 лет генотип It и За выявлен с одинаковой частотой —42,9%. Среди лиц старше 50 лет генотип lb выявлен в 90% случаев, тогда как За не определен вовсе.
Белки и антигены вируса гепатита С. Диагностика ВГС
Сегодня известно минимум 10 структурных и неструктурных белков, кодируемых геномом HCV. К структурным белкам относят core, envelop 1 и envelop 2. Белок core является белком нуклеокапсида, тогда как envelop 1 и envelop 2 — гликопротеины внешней оболочки вируса. В структурной зоне кодируется также белок р7, функция которого не ясна, однако аналогия с другими представителями семейства Flaviviridae позволяет предположить, что его функция связана с высвобождением вириона из инфицированной клетки.
Этот белок отщепляется клеточной пептидазой от envelop 2, но не во всех случаях, что обусловливает существование envelop 2 в виде двух форм более и менее протяженной.
Неструктурная область генома HCV кодирует 6 белков — NS2, NS3, NS4A, NS4B, NS5A и NS5B. Белок NS2 является вирусной металлозависимой протеиназой. Белок NS4A действует как эффектор или кофактор для NSЗ-протеолитической активности в NS4A/NS4B, NS4B/NS5A, NS5A/NS5B сайтах нарезания полипротеина вируса.
В настоящее время фрагменты структурных и неструктурных белков, полученных генноинженерным путем (рекомбинантные белки) или с помощью химического синтеза, используют в качестве антигенов при конструировании иммуноферментных тест-систем. Первое поколение иммуноферментных тест-систем появилось на рынке в 1989 году и было основано на прямом ИФА. В качестве иммуносорбента были использованы фрагменты двух белков, NS3 и NS4, обозначаемых как 5-1-1 и С100-3.
Одновременно были разработаны и подтверждающие тесты на основе иммуноблота с рекомбинантными белками (RIBA). Чувствительность этих тест-систем первого поколения составляла только 64% для ИФА и 55% для иммуноблота. Тест-системы второго поколения появились на рынке в 1991 году. В качестве антигенов, сорбированных на твердой фазе, в этих тест-системах использовали капсидные белки (фрагмент с22-3) и антигены неструктурных регионов NS3 (фрагменты с200 и сЗЗс) и NS4, что позволило повысить чувствительность и специфичность исследований. Поскольку гуморальный иммунный ответ на капсидные антигены (структурные белки) нагинается быстрее, гем на неструктурные белки, период от инфицирования до выявляемой сероконверсии удалось уменьшить до двух месяцев.
Подтверждающие тест-системы на основе иммуноблота позволяли идентифицировать участвующие в реакции антигены. Результаты, полученные при помощи этих тест-систем, интерпретировали как положительные лишь при реакции антител, находящихся в исследуемом субстрате, по крайней мере, с двумя антигенами, тогда как при наличии реакции лишь с одним из антигенов результат считали неопределенным. Было установлено, что специфичность второго поколения тест-систем зависела от источника антигенов. В 1993 году на рынке появилось третье поколение тест-систем. В дополнение к вышеупомянутым антигенам в этих тест-системах используются также антигены, аминокислотная последовательность которых соответствует иммунодоминантным участкам NS5 белков.
В тест-системах первого, второго и третьего поколений в качестве антигенов использовались или рекомбинантные, или синтетические пептиды. В настоящее время можно выделить также тест-системы четвертого поколения, в которых в качестве иммуносорбента используют сочетания рекомбинантных и синтетических пептидов.
Опыт применения тест-систем различных поколений в мире очень большой. Было установлено, что если с помощью тест-систем первого или второго поколения у больных с острым вирусным гепатитом С антитела выявляли на 10-16, а в ряде случаев и 25-30 неделе от начала заболевания, то диагностикумы третьего поколения позволяли сократить этот срок до 2-3 недель. Согласно обобщенным данным чувствительность тест-систем первого, второго и третьего поколений составляет соответственно 70-80%, 92-95% и 97%.
В то же время, по данным С. Colin, 2001, чувствительность тест-систем третьего поколения составила 98,9% у пациентов с хроническими заболеваниями печени и 97,2% на специальных контрольных панелях сывороток. Достижение высокой чувствительности иммуноферментных тест-систем 3 и 4 поколения сопряжено с некоторыми проблемами в обеспечении специфичности исследований, что в ряде случаев может приводить к появлению ложноположительных результатов. В литературе имеются данные о возможных погрешностях в специфичности ELISA 3 тест-систем. Они являются общими для всех ELISA тест-систем, включая тест-системы для диагностики СПИДа.
Ложнопозитивные результаты могут быть следствием повышенного содержания в образцах гамма-глобулинов (сыворотки пациентов африканской расы, миеломная болезнь, ревматоидные факторы), заболеваний печени (цирроз, рак), аутоиммунных заболеваний (коллагенозы, аутоиммунные гепатиты), других вирусных инфекций (ВИЧ, гепатит В) и длительного хранения сывороток в меняющихся температурных условиях. Проведение какой-либо иммунизации также может сопровождаться повышением частоты ложнопозитивных реакций. Рекомендуемые в настоящее время меры по устранению этой проблемы следующие: а) повторная постановка образца в этой же ИФТС; б) повторная детекция anti-HCV в другой ИФТС; в) использование подтверждающих тестов на основе ИФА и иммуноблота.
Однако использование предлагаемых способов подтверждения результатов зачастую приводят к расхождениям в их итоговой трактовке, что показано исследованиями российских и зарубежных исследователей.
В настоящее время производители ИФТС для детекции anti-HCV достигают высокой чувствительности или за счет более полного выявления антител к NS3 или антител к антигенам core. Сравнительные исследования, выполненные на различных группах риска и специальных контрольных панелях показали, что тест-системы, лучше выявлявшие антитела к NS3, оказались несколько более чувствительными, чем тест-системы, лучше выявлявшие антитела к антигенам core. Их чувствительность составляла, соответственно 99,9% и 98,6%.
Гепатит B (ВГВ, HВV) - острое вирусное заболевание. Характеризуется поражением печени и различными внепечёночными проявлениями. Протекает остро или хронически, в желтушной (35%) или безжелтушной (65%) формах. Основной путь передачи инфекции через кровь и биологические жидкости (медицинские манипуляции, сперма, слюна). Важен и трансплацентарный путь передачи. Инкубационный период – от 1 до 6 месяцев.
Вирус гепатита В (hepatitis B virus, HBV) относится к семейству Hepadnoviridae. Геном вируса представлен молекулой ДНК размером 3200 п.н, HBV имеет сферическую форму. Внешняя оболочка (толщиной 7 нм) образована поверхностным антигеном HBV - HBsAg. Вирус гепатита В является псевдоретровирусом, т. е. его ДНК может частично встраиваться в геном гепатоцитов. В состав ядерного (нуклеарного) белка входят HBcAg и HBeAg. HBcAg в крови не выявляется, его можно определить только в печеночных клетках, Но антитела к нему начинают вырабатываться раньше других антител.
При остром гепатите В и при обострении хронического вирусные частицы можно обнаружить в гепатоцитах и сыворотке крови больного. При интегративной форме ХГ В и в стадии ремиссии ДНК в сыворотке крови не выявляется.
Основой лабораторной диагностики гепатита В является определение его серологических маркеров в сыворотке крови : HBsAg, HВeAg, анти-НВс класса IgM и , анти-НВс суммарные, анти-НВеAg. В зависимости от фазы заболевания и течения вирусного гепатита В спектр серологических маркеров выглядит по-разному.
Антитела к HBcoreAg класса G появляются практически одновременно с анти-НВсore класса M и циркулируют на всем протяжении заболевания. Более того, после перенесенного заболевания они выявляются в сыворотке крови пожизненно, определяясь в низких концентрациях. Поэтому при отсутствии информации о перенесенном вирусном гепатите В анти-HBcore суммарные антитела являются надежным маркером ранее эпизода инфицирования, перенесенного заболевания и наличия постинфекционного иммунитета.
Обнаружение суммарных антител к core Ag является важным и ранним маркером данной инфекции.
Различные сочетания серологических маркеров инфицирования вирусом гепатита В и их интерпретация.
| HBsAg | HBeAg | Анти НВ core IgM | Анти НВ core сумм | Анти НВеAg | Анти НВs | Интерпретация: |
| + | + | + | + | - | - | Острый гепатит В |
| + | - | + | + | - | - | Острый гепатит В, мутантный штамм |
| + | - | +/- | + | + | - | Острый гепатит В, период сероконверсии. |
| + | + | +/- | + | -/+ | - | Хронический активный гепатит В |
| +/- | -/+ | -/+ | + | +/- | - | Хронический интегративный гепатит В |
| - | - | - | + | -/+ | + | Паст-инфекция (перенесенный вирусный гепатит В) |
| - | - | - | - | - | + | Состояние после иммунизации |
Показания к исследованию:
-диагностика острого вирусного гепатита В
-диагностика паст-инфекции вирусного гепатита В
Референсные значения: отрицательный результат
Метод исследования: твёрдофазный иммуноферментный анализ
Единицы измерения: -
Положительный результат:
-острый вирусный гепатит В ( при наличии HBsAg и anti-HBcore IgM )
-хронический вирусный гепатит В
-ранее перенесенный вирусный гепатит В (другие маркеры гепатита В отрицательны) -материнские антитела, определяемые у новорожденных и детей до 1,5 лет (при наличии гепатита В у матери ребенка)
Отрицательный результат:
-отсутствие инфицированности вирусом гепатита В
-инкубационный период (антитела начинают синтезироваться с 7 дня от начала клинических симптомов)
Читайте также:

