Заболевание почек при вирусных гепатитах
Обновлено: 05.05.2024
Изучение хронических вирусных поражений печени выявило широкий спектр внепеченочных проявлений хронического гепатита В (ХГВ), а впоследствии, при открытии вируса гепатита С, и хронического гепатита С (ХГС). В России ведущая роль в изучении системности поражения при вирусных заболеваниях печени принадлежит исследованиям, проведенным в клинике им. Е.М.Тареева: изучение хронического активного гепатита как системного заболевания (Апросина З.Г., 1974, 1981 гг.), внепеченочных поражений при ХГС (Игнатова Т.М., 2000 г., Русских А.В., 2004 г., Милованова С.Ю., 2005 г., Карпов С.Ю., 2005 г.); при ХГВ (Ильянкова А.А., 2001 г., Абдурахманов Д.Т., 2003 г., Ибрагимова М.М., 2004 г., Крель П.Е., 1995 г., Тэгай С.В., 2003 г., Русских А.В., 2004 г.), поражения системы крови (Гусейнова Л.А., 1981 г.), легких (Дроздова А.С., 1989 г.), почек (Потапова А.В., 1989 г., Косминкова Е.Н., 1992 г.), синдрома Шегрена (Лопаткина Т.Н., 1980 г., Чернецова О.В., 2004 г.), системных васкулитов при вирусных гепатитах (Семенкова Е.Н., 1994).
В развитии внепеченочных поражений основное значение имеют иммунные реакции, возникающие в ответ на репликацию вирусов гепатита В или С в печени, в тканях лимфоидного и нелимфоидного происхождения. Предположения о наличии внепеченочных сайтов репликации вирусов гепатита В и С возникли в связи с наблюдением случаев быстро развивающегося острого гепатита у пациентов с вирусным циррозом печени после пересадки здоровой донорской печени. Инфицирование донорского органа у больных после ортотопической трансплантации печени объяснялось внепеченочной локализацией вирусов [1]. Помимо иммунных нарушений в возникновении системных поражений имеет значение прямое цитопатическое действие вирусов гепатита. Нередко внепеченочные поражения (ВПП) являются единственным проявлением вирусной инфекции и могут определять прогноз и тактику лечения заболевания.
Особенности хронического гепатита В с внепеченочными проявления гепатита
Внепеченочные проявления гепатита встречаются у 10-20% больных хроническим гепатитом В и включают широкий спектр поражений различных органов и систем [2]. Поражения кожи, наблюдаемые при острых и хронических болезнях печени, обусловленных HBV, весьма вариабельны и включают макулярные, макулопапулярные, папуловезикулярные высыпания, рецидивирующую крапивницу, петехии, пурпуру, узловатую эритему, скарлатиноподобную сыпь, гангренозную пиодермию, витилиго, гиперпигментацию и изъязвления в области нижних конечностей, аллергический капиллярит, пурпуру Шенлейна-Геноха 3.
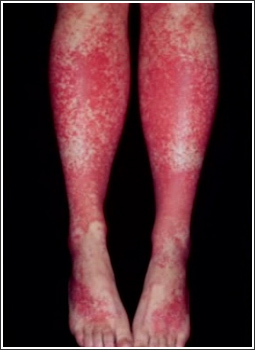
Смешанная криоглобулинемия (СКГ) встречается среди больных ХГВ в 3-17% случаев, может проявляться кожной пурпурой, артритами и/или артралгиями, поражением почек, синдромом Рейно [5, 6, 8, 9]. Поражение почек при ХГВ протекает в трех формах – хронический гломерулонефрит (ХГН), тубулоинтерстициальный нефрит (ТИН), в рамках васкулита при узелковом полиартериите, ассоциированном с HBVинфекцией 12. Частота поражения почек при ХГВ составляет 14%, в том числе ХГН – 12,6%, ТИН – 1,4% [11]. В клубочках выявляются депозиты различных антигенов HBV, включая HBsAg, HBeAg, HBcAg; у части больных в ткани почки была обнаружена HBV ДНК [13]. ИК могут активировать комплемент и вызывать поражение клубочков путем формирования мембраноатакующих комплексов и дальнейшего каскада реакций, таких как индукция протеаз, оксидативное повреждение и разрушение цитоскелета нефрона [14]. Узелковый полиартериит (УП) является системным васкулитом с поражением средних и мелких артерий. Циркулирующие ИК, содержащие вирусные белки, вовлекаются в патогенез УП, ассоциированного с HBV инфекцией [15]. По данным Е.Н. Семенковой, инфицирование вирусом гепатита В выявляется в 56,9% случаев УП. [16] Отмечено, что почти все случаи HBV-ассоциированного УП связаны с инфекцией вируса гепатита В дикого типа, характеризующейся HBe-антигенемией и высокой репликацией HBV. Предположительно повреждение почек происходят в результате отложения вирусных HBeAg-HBeAb ИК [15]. В целом, хроническая HBV-инфекция демонстрирует широкий спектр внепеченочных поражений, в генезе которых имеют значение как иммунокомплексные реакции, так и реакции гиперчувствительности замедленного типа.
Рис.1. Пурпура на коже нижних конечностей у больного хроническим гепатитом С
Внепеченочные проявления гепатита В могут длительно маскировать поражение печени, являясь ведущими клиническими проявления гепатита болезни и нередко определяющими прогноз заболевания. Однако, с введением программ массовой вакцинации против вируса гепатита В инфицированность населения начала снижаться. А после открытия в 1989 году вируса гепатита С все большее значение стало придаваться изучению обширного спектра поражений при этой инфекции.
Особенности хронического гепатита С с внепеченочными проявления гепатита
Согласно различным исследованиям, от 40 до 74% пациентов, инфицированных вирусом гепатита С, могут иметь хотя бы одно внепеченочное проявление (ВПП) за время течения болезни [17, 18, 19]. Более того, ВПП могут являться первым признаком HCV инфекции в отсутствии у ряда больных признаков поражения печени. Основной особенностью ХГС является частое развитие внепеченочных поражений преимущественно иммунокомплексного генеза, в первую очередь обусловленных смешанной криоглобулинемией (СКГ), выявляемой у 19-56% больных [18, 20, 21]. Только небольшая группа больных ХГС с СКГ (менее 15%) имеет симптомное течение – криоглобулинемический синдром [21, 22].
Распространенность смешанной криоглобулинемии увеличивается с длительностью HCV-инфекции в организме и продолжительностью заболевания и чаще наблюдается у женщин на 2-м-3-м десятилетии болезни. В некоторых исследованиях показано, что длительность HCV инфекции у больных ХГС со СКГ почти в 2 раза выше, чем у пациентов без СКГ, у 40% больных со СКГ выявляют признаки цирроза печени [20]. В настоящее время установлено, что вирус гепатита С имеет высокий тропизм к мононуклеарам периферической крови, которые могут служить его резервуаром и местом репликации. Вирус гепатита С связывается с лигандом CD81 на поверхности В-лимфоцитов через Е2-белок, что приводит к активации этих лимфоцитов. На первом этапе продуцируются только поликлональные криоглобулины, затем доминирующий клон В-клеток начинает продуцировать моноклональные иммуноглобулины. Смешанная криоглобулинемия является причиной системного васкулита с поражением сосудов мелкого и среднего калибра с возможным вовлечением в патологический процесс различных органов и систем [18, 23, 24]. Известно, что при ХГС васкулиты могут быть обусловлены не только СКГ, но и (со значительно меньшей частотой) – иммунными комплексами, не обладающими свойствами преципитировать на холоде, то есть не содержащими IgM РФ [18, 25, 26]. Поражение кожи чаще всего (95% случаев) представлено кожным васкулитом от пурпуры (лейкоцитокластический васкулит) и петехий на нижних конечностях (рис. 1) до выраженных некротических язв. Биопсия кожи в местах повреждений выявляет иммунокомплексный васкулит мелких сосудов с мононуклеарной инфильтрацией. HCV-антитела выявляются в кожных повреждениях в 40% случаев [19]. Пурпура у больных ХГС без СКГ характеризуется меньшей распространенностью и отсутствием язвенно-некротических изменений кожи по сравнению с больным со СКГ [27]. Синдром Рейно при ХГС часто является ранним клиническим проявлением КГ-синдрома, как правило, протекает без дигитальных некрозов. Однако, при высоком криокрите частота дигитальных некрозов увеличивается [10, 27]. Поражение мышц. Миалгии часто наблюдаются при ХГС, особенно в рамках КГ-синдрома в сочетании с артралгиями, кожным васкулитом.
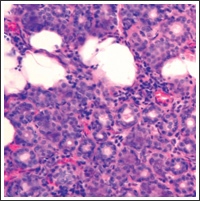
Рис. 2. Очаговая лимфоцитарная инфильтрация слюнной железы, характерная для синдрома Шегрена
По данным клиники им. Е.М.Тареева частота поражения легких была выше у больных без СКГ (11,3%), чем с КГ (6,3%). В группе пациентов без КГ поражение легких характеризовалось развитием фиброзирующего альвеолита, у больных с КГ наблюдалась картина легочного васкулита [27]. Поражение сердца. Имеются наблюдения миокардита хронического течения на фоне HCV-инфекции. Поражение миокарда, ассоциированное с HCV-инфекцией, может быть обусловлено: прямым (вирусным) воздействием на миокард; непрямым (иммунологическим) механизмом поражения и апоптозом клеток, обусловленным внутренними и внешними сигналами [34]. Имеются данные о прямом повреждающем действии на миокард core-белка вируса. Иммуноопосредованный путь повреждения миокарда осуществляется при участии В-клеток, Т-клеток и макрофагов. Обнаружение (+) и (-)-цепей HCV РНК в ткани миокарда у больных миокардитом, дилатационной миокардиопатией и (+)-цепи HCV РНК в миокарде больных гипертрофической кардиомиопатией, сочетающихся с HCV-инфекцией, позволяют обсуждать возможность репликации HCV в ткани миокарда. Обсуждается также роль реакций клеточного иммунитета на тканевые антигены вируса и индуцированные им аутоантигены, роль иммунных комплексов в патогенезе поражения миокарда. Кроме того, не исключается роль цитокинов (продуцируемых активированными вирусом иммуноцитами), которые через механизм повышения продукции оксида азота вызывают отрицательный инотропизм и повреждение сердечной мышцы [35].
Поражение суставов. Артралгии и/или артриты встречаются у 21-74% больных ХГС [19, 24]. Артриты при хронической HCV-инфекции могут рассматриваться как часть аутоиммунного процесса (например, в связи с криоглобулинемией) или как независимый процесс. Описано два вида поражения суставов: полиартрит мелких суставов, подобный ревматоидному артриту, который встречается очень редко и имеет мягкое течение; и неэрозивный олигоартрит с вовлечением средних и крупных суставов, часто интермиттирующего течения, как правило, связанный с криоглобулинемией. Ревматоидный фактор в сыворотке крови выявляется в 50-80% случаев. Антитела к циклическому цитруллиновому пептиду (АЦЦП) обнаруживаются менее, чем у 6% больных с HCV-ассоциированным артритом, что можно использовать для дифференциального диагноза ревматоидного артрита и поражения суставов в рамках HCV-инфекции [19]. Синдром Шегрена (СШ). У больных ХГС с высокой частотой (14-77%) выявляются морфологические признаки лимфоцитарного сиалоаденита и поражение слезных желез (у 26-50%).
Морфологические изменения малых слюнных желез характеризовались небольшой воспалительной инфильтрацией (рис. 2) и распространенным фиброзом ацинарной ткани [36, 37]. Клинически ксерофтальмия и ксеростомия имеют субклиническое течение у 73,8% больных, клинически очевидный СШ отмечается у больных ХГС с КГ [37]. Синдром Шегрена у больных является фактором риска развития злокачественной В-клеточной лимфомы, особенно при сочетании со СКГ [38]. Поражение щитовидной железы. Прямая связь между HCV-инфекцией и заболеванием щитовидной железы до конца не установлена, однако, поражение щитовидной железы (особенно гипотиреоз) чаще встречается среди больных ХГС, чем в общей популяции. У 13% больных, инфицированных HCV, выявляется гипотиреоз и у 25% обнаруживаются антитиреоидные антитела. В 30% случаев поражение щитовидной железы выявляется в ходе ПВТ. В связи с этим остается открытым вопрос, является ли нарушение функции щитовидной железы вирус-индуцированным или нежелательным эффектом противовирусной терапии. ПВТ, возможно, вызывает развитие нарушения функции щитовидной железы de novo или вызывает обострение уже существующего субклинического поражения щитовидной железы [39, 40].
Как и при ХГВ, внепеченочные проявления гепатита ХГС создают определенные трудности в дифференциальном диагнозе ХГС, определяя у части больных неблагоприятный прогноз криоглобулинемического васкулита, поражения почек, В-клеточной лимфомы. Особенности лечения хронических гепатитов В и С с системными проявления гепатита. Адекватный подход к лечению хронических вирусных гепатитов с внепеченочными проявлениями гепатита включает в себя две независимые, но тесно связанные цели. Первая – эрадикация вируса или снижение вирусной нагрузки с помощью этиотропной противовирусной терапии. Вторая – патогенетическое лечение аутоиммунных нарушений с использованием иммуносупрессивной терапии и/или плазмафереза с целью контроля образования иммунных комплексов. По мнению большинства исследователей, для лечения хронической HBV-инфекции оптимальна комбинированная терапия: использование препаратов, различающихся по механизму действия, – сочетание ИФН-? с аналогами нуклеоз(т)идов, сочетание нескольких аналогов нуклеоз(т)идов. Преимуществом интерферона-? является более низкая частота рецидивов после отмены препарата, а аналогов нуклеоз(т)идов – отсутствие нежелательных эффектов, в том числе иммуностимулирующего действия, что обусловливает его применение у больных с внепеченочными проявлениями гепатита и декомпенсированным циррозом печени. В ряде случаев при наличии миокардита, тубулоинтерстициального нефрита, полимиозита оправдано применение иммуносупрессивной терапии, несмотря на усиление репликации вируса гепатита В под влиянием стероидов [6,43-46]. Лечение ХГС со СКГ направлено на подавление вирусной репликации и угнетение В-клеточной пролиферации. Эрадикация HCV при противовирусной терапии приводит к исчезновению СКГ и регрессу клинических проявлений, но часть больных ХГС не отвечает на ПВТ, у ряда пациентов отмечаются выраженные нежелательные эффекты лечения. Применение кортикостероидов при хроническом вирусном гепатите с аутоиммунными нарушениями может приводить к увеличению вирусной нагрузки. В то же время, известно, что интерферонотерапия может вызывать ухудшение таких внепеченочных проявлений HCV-инфекции, как периферическая нейропатия, миокардит, тубуло-интерстициальный нефрит, полимиозит. Недавно было предложено использовать ритуксимаб (химерные моноклональные антитела к CD20) в качестве анти-В-клеточной терапии у больных ХГС с криоглобулинемией, не отвечающих на ПВТ [47, 48]. Его действие связано с быстрым, но обратимым, угнетением CD20+ В-клеток в периферической крови [49, 50]. Ряд исследований свидетельствуют об эффекте ритуксимаба у больных ХГС с периферической нейропатией и комбинации ритуксимаба и плазмафереза у больных ХГС с криоглобулинемическим васкулитом [47, 51], а также эффективность ритуксимаба и ПВТ у больных ХГС с КГ-гломерулонефритом и сосудистой пурпурой [23, 52]. Таким образом, лечение больных хроническими вирусными гепатитами с внепеченочными проявления гепатита не разработано, представляет серьезные проблемы и нуждается в дальнейшем изучении и выработке тактики.
Гломерулонефрит при хроническом вирусном гепатите у детей
Мембранозная нефропатия при вирусном гепатите В была впервые описана в 1969 г. С тех пор подобные случаи регистрировались у детей по всему миру, но наиболее часто в азиатских странах. В большинстве таких случаев на стадии хронического носительства вируса гепатита В развиваются протеинурия или нефротический синдром.
Признаков текущего или перенесенного поражения печени у большинства заболевших детей нет, хотя активность аминотрансфераз в сыворотке обычно слегка повышена. Уровень компонентов комплемента С3 и С4 может быть снижен (у 15—64% больных). Прогноз весьма благоприятный: у 95% детей через 5—7 лет после постановки диагноза наступает спонтанная ремиссия. Одновременно из крови исчезает HBeAg и появляются антитела к вирусу гепатита В. У взрослых прогноз хуже.
Лечение иммунодепрессантами противопоказано, так как у детей высок риск перехода хронического гепатита в активную стадию. Интерфероны при гломерулонефрите на фоне хронического гепатита В у детей неэффективны. Изучаются новые схемы противовирусной терапии. На фоне хронического вирусного гепатита В может развиться состояние, напоминающее сывороточную болезнь, и реже мезангиокапиллярный или быстропрогрессирующий гломерулонефрит.
Мезангиокапиллярный гломерулонефрит на фоне хронического вирусного гепатита С был впервые описан у группы взрослых больных в 1993 г. С тех пор взаимосвязь между этими двумя заболеваниями подтвердилась, хотя ее степень сильно различается в разных группах населения.
Описан также мезангиокапиллярный гломерулонефрит в пересаженной почке у больных с хроническим вирусным гепатитом С. В ряду причин мезангиокапиллярного гломерулонефрита у детей хронический вирусный гепатит С занимает одно из последних мест.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Поражение почек при инфекционных заболеваниях. Почки при гепатитах и ГЛПС
В основе патогенеза поражения почек при инфекционных болезнях лежат интоксикация и как следствие ее - расстройства гемодинамики, в первую очередь снижение или резкое падение артериального давления (коллапс, шок), нарушения микроциркуляции (особенно повышение сосудистой проницаемости и развитие сладж-феномена), а также водно-электролитные и другие обменные и гормональные сдвиги. При некоторых инфекционных болезнях, например, геморрагической лихорадке с почечным синдромом, поражение почек, равно как и других органов, связано с нарушением нервно-трофических функций.
Диагностика поражений почек при инфекционных болезнях основывается на клинических симптомах (боль в пояснице, олигоанурия, полиурия, дизурические явления, отеки), на изменениях в моче (протеинурия, эритроцитурия, лейкоцитурия, цилиндрурия и др.) В последние десятилетия существенную помощь в дифференциальной диагностике оказывают ультразвуковое исследование почек, аксиальная компьютерная томография, радиоизотопное и ангиографическое исследования и др.
Инфекционные болезни, при которых почки поражаются первично, единичны. Наиболее ярким примером первичного вирусного поражения почек может служить геморрагическая лихорадка с почечным синдромом. Близки к ней по тяжести поражения почек лептоспирозы, при которых локализация лептоспир в почках более постоянна, чем в печени. При некоторых формах вирусных гепатитов В и особенно Е почки поражаются опосредованно после первичной репликации вируса в гепатоцитах и вызываемых им поражений паренхимы печени с расстройством многих видов обмена (гепаторенальный синдром).
Отвергнуть одновременное вирусное поражение почек при гепатитах не представляется возможным В опытах анафилаксии с десенсибилизацией на морских свинках при исследовании гомогенатов ткани почек, умерших от токсической гепатодистрофии при вирусном гепатите, нам удалось показать наличие в них антигена, не содержащегося в почках погибших от случайной травмы (1964-1973). Вирусное поражение и печени, и почек с большей долей вероятности имеет место при желтой лихорадке.
При ГЛСПС, начинающейся остро, появляются лихорадка, боль в пояснице, жажда, рвота, быстро нарастает интоксикация. Морфологическим эквивалентом болезни, как писал Е.М. Тареев, является геморрагический межуточный нефрит с кровоизлияниями с некротическими изменениями канальцев Этим изменениям предшествует поражение различных отделов ЦНС и периферической нервной системы с кровоизлияниями в железах внутренней секреции, прежде всего в надпочечниках и передней доле гипофиза, реже в других эндокринных органах. Даже прикосновение к поясничной области вызывает боль.
В связи с отеком, гиперемией и увеличением размеров почек резкое поколачивание может привести к разрыву капсулы почки и смертельному внутреннему кровотечению(!). При ГЛСПС в начальной стадии развивается олигурия, вплоть до анурии с последующей полиурией на 2-й неделе болезни Печень слегка увеличена. В крови умеренный лейкоцитоз в начале болезни сменяется лейкопенией; тромбоцитопения, РОЭ увеличена. Умеренно повышена активность трансфераз. Высокие уровни мочевины и креатинина. В моче большое количество белка, цилиндры, эритроциты; лейкоциты в небольшом количестве. ГЛСПС регистрируется в любое время года (у дачников часто в начале летнего сезона, что обусловлено контактом с экскрементами полевых мышей) Ареал болезни очень широк (Дальний Восток, Урал, Средняя и Верхняя Волга, Самарская, Тверская, Ярославская области и другие регионы). В последнее десятилетие наблюдается учащение случаев заболеваний ГЛСПС в Подмосковье.
Болезнь имеет тяжелое и среднетяжелое течение. Заболевают дачники, грибники, охотники и рыболовы В начале заболевания больным ставят, как правило, ошибочные диагнозы гриппа или ОРВИ, иерсиниоза или лептоспироза.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Как проявляется хронический гепатит B?
Довольно часто человек является носителем вируса гепатита В даже сам не подозревая этого. Гепатит B страшен тем, что протекает незаметно и бессимптомно, и зачастую обнаруживается только при плановом обследовании других заболеваний. Обычная желтушная форма не всегда бывает при гепатите В, поэтому острый гепатит В не указывает, что до этого пациент не являлся носителем вируса. Очень часто факторами риска заражения вирусным гепатитом становятся переливание крови, операции, походы к стоматологу или гинекологу, татуировки и т.п. Поэтому рекомендовано регулярно проходить диагностику на выявление вируса гепатита В.
Хронический гепатит B не проявляется какими- то особенными симптомами. Это может быть общая слабость или снижение аппетита, присущее многим другим заболеваниям, периодическая тупая боль в правом подреберье, тошнота. Такие симптомы очень часто характеры для дискинезии желчевыводящих путей, которая является последствием хронического вирусного гепатита В.
Очень редко вирус гепатита B проявляется болью в мышцах и суставах. В 10 – 20% случаев гепатит В вызывает поражение кожи и почек.
Очень важно обращать внимание и своевременно лечить воспалительные заболевание печени, которые в течение полугода могут перерасти в хронический гепатит. Хроническому гепатиту также свойственны следующие проявления:
- диспепсические нарушения,
- астеновегетативные расстройства,
- нарушения работы печени,
- увеличение печени и селезёнки,
- нарушение белкового обмена,
- содержание в крови печёночных ферментов.
Хронический гепатит В протекает в лёгкой форме, но нередко прогрессирует. При обострении хронического вирусного гепатита пациент обычно жалуется на быструю утомляемость, тошноту и рвоту, иногда наблюдаются кожные высыпания, кровотечение из носа, пожелтение склер.
При таких симптомах обязательно следует сдать биохимические анализы крови, в которых вирус гепатита B проявляется увеличенным присутствием печеночных ферментов и белка.
Крайне редко случаются внепечёночные проявления гепатита В, описанные в медицинской практике. Необычные проявления вируса гепатита В связаны со странной реакцией иммунной системы против собственных тканей организма. К таким синдромам относятся гломерулонефрит, криоглобулинемия, узловатая эритема.
Не является исключением ещё одна редкая форма хронического вирусного гепатита с холестазом, когда больной ощущает невероятный зуд и проявляется пожелтение кожи. В крови в большом количестве присутствует билирубин. Такая форма гепатита способствует мгновенному развитию цирроза печени.
Обострение хронического вирусного гепатита В может быть вызвано острыми респираторными вирусными заболеваниями или другими инфекционными заболеваниями, не исключено употребление алкоголя в больших количествах и повышенная физическая нагрузка.
- Вернуться в оглавление раздела "Лечение инфекций."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Ключевые слова: хронический вирусный гепатит В, хроническая болезнь почек, аллотрансплантация почки, противовирусная терапия, аналоги нуклеозидов.
Для цитирования: Омарова Х.Г., Макашова В.В. Хронический гепатит в на фоне хронической болезни почек. РМЖ. Медицинское обозрение. 2020;4(11):710-713. DOI: 10.32364/2587-6821-2020-4-11-710-713.
Kh.G. Omarova 1,2 , V.V. Makashova 1
1 Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being, Moscow, Russian Federation
2 LLC “SM–Clinic”, Moscow, Russian Federation
Keywords: chronic hepatitis B, chronic kidney disease, renal allotransplantation, antiviral treatment, nucleoside analogues.
For citation: Omarova Kh.G., Makashova V.V. Chronic hepatitis B in a woman with chronic kidney disease. Russian Medical Inquiry. 2020;4(11):710–713. DOI: 10.32364/2587-6821-2020-4-11-710-713.
Актуальность
Хроническая инфекция вирусом гепатита В (hepatitis B virus, HBV) является одной из основных проблем здравоохранения. HBV в настоящее время во всем мире инфицированы 350–400 млн человек. Распространенность HBV-инфекции в разных странах колеблется от 0,1% до 20% [1, 2], ежегодно около 1 млн человек умирают от заболеваний, связанных с вирусным гепатитом В (ВГВ) [3]. 10–30% больных хроническим гепатитом В (ХГВ) имеют повышенный риск развития цирроза печени [4], а у 5–10% пациентов развивается гепатоцеллюлярная карцинома [5].
Особую сложность лечения больных ХГВ представляет его сочетанное течение с другими заболеваниями — в частности, с патологией почек. Трансплантация почки на сегодняшний день является самым оптимальным методом лечения хронической болезни почек (ХБП) в терминальной стадии хронической почечной недостаточности, т. к. способствует наиболее полной реабилитации пациентов. Однако выживаемость реципиента и приживление почечного трансплантата в значительной мере зависят от характера течения послеоперационного периода [6]. В России среди причин смертности больных после трансплантации почки ведущее место занимают кардиоваскулярная патология (24%) и инфекционные осложнения (25%), зачастую возникающие на фоне массивной иммуносупрессивной терапии [7, 8].
Клиническое наблюдение
Пациентка Г., 38 лет, обратилась на прием 23.11.2015. Направлена нефрологом на консультацию к гепатологу по поводу повышения уровня трансаминаз до 3 норм на фоне ХГВ. В момент осмотра жалоб не предъявляла. Общее состояние расценивалось как удовлетворительное.
Anamnesis morbi. Считает себя больной с 5 лет, когда была диагностирована врожденная аномалия развития мочевыделительной системы (ВАРМС) — гипоплазия левой почки, почечно-мочеточниковый рефлюкс справа. Выполнена антирефлюксная операция справа. Программный гемодиализ проводился с 2000 по 2004 г., сформирована артериовенозная фистула левого предплечья. HBsAg впервые выявлен в 2005 г. Инфицирование связывает с перенесенной в 2004 г. в Китае аллотрансплантацией почки справа по поводу ХБП 5-й степени в исходе ВАРМС. С февраля 2005 г. принимала ламивудин, в 2011 г. после переезда в Россию самостоятельно прекратила прием препарата.
Аллергологический анамнез: не отягощен.
Перенесенные заболевания: острые респираторные инфекции 1–2 раза в год.
Оперативное лечение: артериовенозная фистула левого предплечья в 2000 г., аллотрансплантация почки справа в 2004 г.
Гинекологический анамнез: менархе в 12 лет. Замужем. Беременностей не было.
Status praesens. Температура — 36,6 0 С, частота дыхания — 18/мин. Артериальное давление — 110/70 мм рт. ст. Рост — 158 см, вес — 47 кг. Состояние удовлетворительное. Сознание ясное. Ориентация в пространстве и времени не нарушена. Телосложение астеническое. Видимые костные деформации не определяются. На левом предплечье в верхней трети артериовенозная фистула. Кожа чистая, обычной окраски, влажность умеренная. Экзантема и отеки отсутствуют. Слизистые розовые. Склеры не иктеричны. Лимфатические узлы не увеличены. Дыхание через нос свободное. Слизистые носовых ходов розовые. Кашель отсутствует. Грудная клетка обычной формы, активно участвует в акте дыхания. Перкуторно над легкими ясный легочный звук. Аускультативно дыхание в легких везикулярное, равномерно проводится во все отделы. Хрипы отсутствуют. Область сердца визуально не изменена. Аускультативно тоны сердца ясные, ритмичные. Язык влажный, не обложен налетом. Небные миндалины не увеличены. Живот обычной формы, не вздут, активно участвует в акте дыхания. При пальпации живот мягкий, безболезненный во всех отделах. Симптомы раздражения брюшины и пузырные симптомы отсутствуют. Перкуторно печень не увеличена. При пальпации край печени мягко-эластичной консистенции, не выступает из-под края реберной дуги, безболезненный. Перкуторно селезенка не изменена, не пальпируется. Дизурии нет. Симптом поколачивания отрицательный с обеих сторон.
С 13.12.2015 была начата противовирусная терапия энтекавиром по 0,5 мг/сут. На фоне лечения вирусная нагрузка снизилась незначительно: за 1 мес. — до 7,8×10 6 МЕ/мл, через 3,5 мес. (05.04.2016) — до 3,5×10 6 МЕ/мл. При этом уровень трансаминаз не только не нормализовался, но и стал нарастать: АЛТ до 92 Ед/л и АСТ до 78 Ед/л, в связи с чем терапия энтекавиром была прекращена. Подтверждена генотипическая резистентность к энтекавиру и выявлена чувствительность к тенофовиру. С июня 2016 г. начата терапия тенофовиром в дозе 300 мг/сут ежедневно. Через 3 нед. от начала терапии в связи с повышением уровня креатинина до 112 мкмоль/л (по согласованию с нефрологом) проведена следующая коррекция режима приема препарата — тенофовир 300 мг через день. Через 3 мес. после изменения режима приема тенофовира наблюдалась положительная динамика: нормализация уровня трансаминаз, снижение вирусной нагрузки до 4,6 ×10 3 МЕ/мл, уменьшение уровня креатинина до 99–102 мкмоль/л (от 20.09.2016). Через 1 год приема тенофовира, к июню 2017 г., вирусная нагрузка составляла менее 10 2 МЕ/мл; по данным фиброэластометрии, уменьшилась степень фиброза печени с F2 до F0 (с 8,7 до 6,9 кПа), появились anti-HBe, но HBeAg продолжал определяться, т. е. полной сероконверсии HBeAg не произошло, ядерные антитела класса IgМ все еще определялись в анализах от 31.08.2018. Отрицательного влияния препарата на функциональное состояние почек выявлено не было.
По последним данным от 20.07.2020, креатинин — 105,3 мкмоль/л, мочевина — 5,39 ммоль/л, скорость клубочковой фильтрации — 56,4 мл/мин/1,73 м 2 (норма — более 60), АЛТ — 19,4 Ед/л, АСТ — 27,7 Ед/л, т. е. все анализы — в пределах нормальных значений.
В настоящее время пациентка продолжает получать иммуносупрессивную терапию, витамин D и нуклеозидный аналог тенофовир по 300 мг через день. При последнем исследовании крови методом полимеразной цепной реакции (ПЦР) от 20.07.2020 ДНК HBV не определяется (чувствительность метода ПЦР — менее 10 МЕ/мл).
Заключение
Данное клиническое наблюдение показывает, что длительный прием (в течение 6 лет) аналога нуклеозида первого поколения (ламивудина) с последующей самостоятельной его отменой, перерыв в противовирусной терапии и возникновение рецидива с выраженным цитолитическим синдромом, вероятно, способствовали развитию резистентности к энтекавиру. И только при назначении тенофовира был получен положительный вирусологический ответ.
Таким образом, тенофовир можно использовать у пациентов с ХБП 5-й степени после аллотрансплантации почки при удовлетворительном функционировании трансплантата, регулярном контроле биохимических показателей и при изменении режима приема противовирусного препарата (под контролем уровня креатинина — в данном случае по 300 мг 1 раз в 2 дня) для подавления реактивации HBV-инфекции на фоне иммуносупрессивной терапии.
Уникальность описываемого наблюдения состоит в том, что, с одной стороны, проводимая реципиенту высокодозная иммуносупрессивная терапия, как и ХГВ, негативно влияет на функциональное состояние печени, а с другой стороны, терапия ХГВ, которая становится необходимой при высокой вирусной нагрузке и повышенной активности печеночных ферментов, может существенно снизить эффективность приживления трансплантата, вплоть до развития реакции отторжения. В данном клиническом наблюдении важно было постоянно контролировать функцию трансплантата при проведении противовирусной терапии: пациентка получала противовирусную терапию сначала нуклеозидным аналогом первого поколения ламивудином в течение 6 лет, а затем, после 4-летнего перерыва, был назначен энтекавир. Возникновение резистентности к энтекавиру привело к необходимости его замены на тенофовир. Был получен положительный эффект — ДНК HBV перестала выявляться через 1 год после начала терапии и не определяется до настоящего времени. Кроме того, степень фиброза F2 уменьшилась до F0 по шкале METAVIR (по данным фиброэластометрии печени).
Сведения об авторах:
Макашова Вера Васильевна — д.м.н., профессор, ведущий научный сотрудник ФБУН ЦНИИ Эпидемиологии Роспотребнадзора; 111123, Россия, г. Москва, ул. Новогиреевская, д. 3А; ORCID iD 0000-0002-0982-3527.
About the authors:
Khadizhat G. Omarova — Cand. of Sci. (Med.), researcher of the Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being, 3A, Novogireevskaya str., Moscow, 111123, Russian Federation; gastroenterologist and hepatologist of LLC “SM–Clinic”, 42 build. 12, Volgogradskiy av., Moscow, 109316, Russian Federation; ORCID iD 0000-0002-9682-2230.
Vera V. Makashova — Doct. of Sci. (Med.), leading researcher of the Central Research Institute of Epidemiology of the
Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being, 3A, Novogireevskaya str., Moscow, 111123, Russian Federation; ORCID iD 0000-0002-0982-3527.
Читайте также:

