Задержки мочи при герпесе
Обновлено: 25.04.2024
В статье обсуждаются особенности течения герпетической инфекции, а также ее роль в возникновении и рецидивировании циститов и уретритов. Рассматриваются прямые и серологические методы лабораторной диагностики герпетической инфекции.
Приводятся два основных подхода к лечению герпетической инфекции: эпизодическая и супрессивная терапия. Отмечается, что стандартная терапия аналогами нуклеозидов способна эффективно устранять симптоматику уретритов и циститов герпетической этиологии.
- КЛЮЧЕВЫЕ СЛОВА: герпетические инфекции, герпес, инфекции мочевыводящих путей, урология
В статье обсуждаются особенности течения герпетической инфекции, а также ее роль в возникновении и рецидивировании циститов и уретритов. Рассматриваются прямые и серологические методы лабораторной диагностики герпетической инфекции.
Приводятся два основных подхода к лечению герпетической инфекции: эпизодическая и супрессивная терапия. Отмечается, что стандартная терапия аналогами нуклеозидов способна эффективно устранять симптоматику уретритов и циститов герпетической этиологии.
Роль герпетической инфекции как причины урологических заболеваний часто недооценивается. Это связано с нехарактерной для герпетического процесса клинической картиной, которой сопровождаются эти заболевания. Однако, учитывая высокую распространенность герпетической инфекции в популяции, в некоторых случаях можно предполагать вирусную этиологию тех заболеваний, которые принято связывать с бактериальной природой процесса, в частности, циститов и уретритов.
Считается, что после первичной инфекции, вызванной вирусом простого герпеса (ВПГ) II типа, у пациентов впоследствии возникнет минимум один рецидив, а у 38% – более 6 рецидивов в год [1]. Важно также отметить тот факт, что после разрешения клинических проявлений ВПГ может выделяться с поверхности внешне здоровой кожи. Далеко не всегда герпетическая инфекция протекает типично с появлением характерных для этой инфекции клинических проявлений в виде пузырьковых высыпаний. Типичные проявления герпетической инфекции встречаются лишь в 20% случаев, в то время как в 60% случаев она протекает атипично, а еще в 20% случаев – вообще бессимптомно. При этом пациенты с бессимптомным вирусовыделением могут инфицировать своих половых партнеров [2].
Приведенная клиническая ситуация подтверждает, что правильный диагноз может быть поставлен только на основании лабораторного исследования. Эмпирическое назначение лечения даже при кажущемся получении положительного эффекта нельзя считать оправданным. В частности, нет оснований для назначения антибиотиков или противогрибковых средств без обнаружения бактериальной или грибковой флоры соответственно. Отсутствие этой флоры может свидетельствовать о наличии вирусной инфекции, когда антибактериальные и антимикотические препараты совершенно неэффективны, а якобы положительный эффект, полученный после их назначения, связан с самостоятельным прекращением очередного рецидива герпетической инфекции.
Рецидивы, сменяющиеся периодами ремиссии, весьма характерны именно для этой инфекции. Так, в одном из исследований были диагностированы атипичные проявления герпетической инфекции, включая геморрагический цистит. Поводом для обследования на герпетическую инфекцию явился именно хронический рецидивирующий характер течения заболевания [3]. Экспериментальные исследования показали, что клетки эпителия мочевого пузыря человека (HT-1376) чувствительны к ВПГ так же, как к Chlamydia trachomatis и другим уропатогенным бактериям [4].
Для диагностики герпетической инфекции используют методы прямого выявления вируса из материала, полученного из очагов поражения, а также серологические методы для выявления антител против ВПГ I и II типов.
Прямое выявление ВПГ Выявление вируса с использованием прямых методов рекомендовано во всех случаях обнаружения генитального герпеса. Материалом для исследования служат мазки из основания высыпаний (покрышка удаляется при помощи иглы или скальпеля) [13].
- Культуральное исследование. Особого внимания заслуживает так называемый быстрый культуральный метод, при котором результат получают уже через 24 часа, что, при сохранении всех преимуществ культурального исследования, делает метод привлекательным для практического использования [9].
- Выявление вирусных антигенов путем ферментативного иммуносорбентного анализа (ELISA).
- Иммунофлюоресцентный метод.
- Выявление вирусных нуклеиновых кислот с помощью методов амплификации нуклеиновых кислот (МАНК). Благодаря высокой чувствительности и постоянному совершенствованию технологий МАНК сегодня являются основными методами прямого выявления ВПГ из очагов поражения.
Серологические методы диагностики герпетической инфекции Типоспецифический иммунный ответ после первичной инфекции развивается через 8–12 недель. Следует принять во внимание, что большинство коммерческих тестов на антитела к ВПГ не являются типоспецифическими и не в состоянии отличить антитела к ВПГ I типа от антител к ВПГ II типа. Если использовать не типоспецифические тесты, возможны диагностические ошибки. К типоспецифическим тестам относят:
- иммуноферментный анализ на основе гликопротеина G (gG1, gG2);
- вестерн-блоттинг (тесты на антитела к ВПГ I типа менее чувствительны и специфичны, чем для ВПГ II типа).
Для полной серологической характеристики инфекции необходимы типоспецифические тесты на антитела к ВПГ как I типа, так и II типа [14].
- эпизодическая терапия, которая подразумевает лечение каждого отдельного эпизода обострения герпетической инфекции;
- супрессивная противовирусная терапия, в ходе которой осуществляется постоянный прием противовирусных препаратов с целью предупреждения рецидивов и возможности передачи инфекции другим лицам.
Для каждого пациента терапия должна подбираться индивидуально, и, кроме того, со временем она может корректироваться при изменении частоты обострений, тяжести клинической картины или социального статуса пациента [15–18].
Эпизодическая терапия герпетической инфекции Все международные рекомендации предлагают назначать внутрь аналоги нуклеозидов: ацикловир, валацикловир или фамцикловир. В адекватной дозировке все препараты одинаково эффективно уменьшают тяжесть и продолжительность обострений генитального герпеса. Ранее рекомендовалось применять 5-дневные курсы лечения этими препаратами, однако сравнительные исследования не обнаружили преимуществ 5-дневных курсов терапии перед более короткими схемами лечения, которые и вошли в последние рекомендации Международного союза по борьбе с инфекциями, передаваемыми половым путем (International Union against Sexually Transmitted Infections, IUSTI) [14]. Важно начинать лечение как можно раньше, желательно в течение первых 24 часов после начала обострения. Рекомендуемые IUSTI схемы эпизодического лечения (курс лечения 5 дней):
- ацикловир 200 мг внутрь 5 р/сут или
- ацикловир 400 мг внутрь 3 р/сут в течение 3–5 дней или
- валацикловир 500 мг внутрь 2 р/сут или
- фамцикловир 125 мг внутрь 2 р/сут.
- ацикловир 800 мг внутрь 3 р/сут в течение 2 дней или
- фамцикловир 1000 мг внутрь 2 р/сут в течение 1 дня или
- валацикловир 500 мг внутрь 2 р/сут в течение 3 дней.
Супрессивная терапия герпетической инфекции Как правило, супрессивную терапию рекомендуют пациентам с частотой обострений 6 и более в год, однако в последнее время были проведены исследования с участием пациентов с более мягким течением инфекции, которые показали, что состояние пациентов всех групп улучшалось при снижении количества обострений в течение года. При выборе супрессивной терапии следует принимать во внимание не только частоту рецидивов и их влияние на качество жизни конкретного пациента, но и стоимость и неудобство режима дозировки такой терапии. Редкие клинически выраженные рецидивы все же будут возникать у большинства пациентов и на фоне супрессивного лечения. Рекомендуемые схемы лечения включают:
- Ацикловир 800 мг/сут ежедневно (по 200 мг 4 р/сут или по 400 мг 2 р/сут). При выборе варианта терапии стоит оценивать вероятность приверженности пациента ежедневной 4-кратной схеме приема препарата.
- Валацикловир 500 мг/сут однократно при частоте рецидивов менее 10 в год и по 250 мг 2 р/сут или 1000 мг 1 р/сут при частоте рецидивов более 10 в год.
- Фамцикловир 250 мг 2 р/сут.
В случае недостаточного клинического ответа на проводимую супрессивную терапию доза как валацикловира, так и фамцикловира может быть удвоена. В ходе супрессивной терапии следует оценивать необходимость дальнейшего приема препаратов не менее чем 1 раз в год. По желанию пациента возможно прекращение приема препаратов, что позволит заново оценить частоту рецидивов и, возможно, пересмотреть тактику лечения [15]. У ряда пациентов возможно использование коротких курсов супрессивной терапии (например, на время отпуска, экзаменов и т.д.). Cупрессивный эффект проявляется не ранее чем через 5 дней от начала приема препаратов [16]. При лабиальном герпесе известна схема однодневного лечения валацикловиром (Валтрекс®) по 2 г с интервалом в 12 часов (суммарная доза 4 г) [17, 18]. Учитывая тот факт, что причиной герпетического уретрита часто оказывался ВПГ I типа, полученный в результате орально-генитальных контактов, в нашем исследовании мы использовали именно такую схему для лечения пациентов с герпетическим уретритом, получив хороший терапевтический эффект в кратчайшие сроки (89,4% к 7-му дню после лечения) [9].
Герпетическая природа циститов и уретритов является одной из возможных причин рецидивирования этих заболеваний, поэтому при определении этиологии уретритов и циститов следует проводить обследование на ВПГ. Уретриты у мужчин, развившиеся в результате незащищенных орально-генитальных контактов, характеризуются достоверно более частой ассоциацией с ВПГ I типа. Стандартная терапия аналогами нуклеозидов способна эффективно устранять симптоматику уретритов и циститов герпетической этиологии.
В большинстве случаев герпетическая инфекция имеет доброкачественное клиническое течение.
Она проявляется возникновением болезненных пузырьков на половых органах.
Тем не менее, эти пузырьки через несколько дней исчезают.
На их месте образуются корочки.
А уже через 1-2 недели от перенесенного заболевания практически не остается следов.
Тяжелое течение герпетической инфекции с осложнениями характерно только для лиц с иммунодефицитными состояниями или ослабленных пациентов на фоне соматических заболеваний.
Неблагоприятные формы герпетической инфекции:
- частые и тяжелые рецидивы;
- присоединение бактериальной суперинфекции;
- глубокое воспаление кожи с формированием рубцовых изменений;
- генерализация герпетической инфекции с поражением внутренних органов.
Поражение герпесом центральной нервной системы
Герпетическая инфекция с поражением ЦНС протекает преимущественно в форме менингоэнцефалита.
В основном поражаются передние отделы больших полушарий.
Другие клинические формы, которые встречаются значительно реже:
- энцефаломиелит;
- менингит;
- миелит;
- энцефаломиелорадикулит.
Одновременно могут поражаться структуры периферической нервной системы.
Доказано, что вирус герпеса способен вызывать неврит лицевого нерва.
Для герпетического энцефалита характерно различное клиническое течение.
Оно может быть абортивным, инсультоподобным, затяжным.
Но классическое течение герпетического поражения ЦНС следующее:
- острое начало;
- значительная лихорадка;
- резкая головная боль;
- повторяющаяся рвота, иногда без тошноты;
- раннее появление менингеальных симптомов.
В анализе ликвора отмечаются такие изменения:
- плеоцитоз;
- большое количество лимфоцитов (больше 1000 клеток в мкл);
- много белка (от 1 грамма на литр);
- высокое давление ликвора.
Эти изменения сохраняются в течение нескольких недель после противовирусной терапии.
Герпетический энцефалит – тяжелое заболевание с неблагоприятным прогнозом.
Смертность достигает 70%.
У выздоровевших сохраняется неврологический дефицит в 50% случаев.
Нередко развиваются психические расстройства, галлюцинации, делирий, шизофреноподобный синдром.
Рецидивирующий герпетический энцефалит
Представляет собой результат диффузного или очагового герпетического поражения головного мозга.
Обострения сменяются ремиссиями.
Вирус может годами находиться в латентном состоянии.
Но при снижении иммунитета симптомы возвращаются.
Изначально появляются такие симптомы:
- лихорадка;
- цефалгия;
- снижение аппетита;
- несвязная речь;
- спутанность сознания;
- нарушение ориентации во времени и пространстве.
Нередко больные не узнают родственников.
Возможна повышенная агрессивность, галлюцинации.
Ранняя стадия протекает до 3 дней.
Затем начинается стадия разгара.
Для неё характерно выраженное угнетение сознания, вплоть до комы.
Возможна смерть из-за отека мозга и дислокации ствола.
Человек не реагирует на внешние раздражители.
Дыхание становится неритмичным.
Нарушается функция черепных нервов.
Неблагоприятным прогностическим фактором является повышение тонуса мышц.
Затем следует стадия обратного развития симптомов.
Она начинается через месяц.
Продолжается от нескольких месяцев до года.
В 20% случаев все неврологические нарушения уходят.
У остальных наблюдаются остаточные явления.
Возможно такое последствие герпетического энцефалита как синдром Клювера-Бьюси.
Основные проявления:
- расстройство внимания;
- агрессия;
- ослабление памяти;
- усиленное либидо.
Через несколько лет возможны обострения энцефалита.
Обычно они протекают не настолько тяжело, как первичный эпизод воспаления головного мозга.
Хронический герпетический энцефалит
При хронической форме заболевания симптомы нарастают медленно.
Такой тип течения характерен для лиц пожилого возраста.
Нарастают такие признаки:
- слабость;
- ухудшение памяти;
- снижение внимания.
Возможна постоянная субфебрильная температура тела.
Прогрессирует слабоумие, вплоть до развития деменции.
Одним из вариантов течения заболевания является синдром хронической усталости.
Человек жалуется на слабость, сонливость, снижение работоспособности.
Герпетический менингит
Характеризуется поражением мягких оболочек мозга.
Чаще всего это последствие герпеса 2 типа, реже – 1 типа.
По мнению некоторых авторов, до 30% всех пациентов с генитальными формами герпеса отмечают слабо выраженные симптомы менингита.
Они отмечают светобоязнь, головные боли.
В некоторых случаях симптомы менингита выражены достаточно сильно.
Появляются головные боли.
Возникает ригидность мышц затылка.
Становятся положительными менингеальные симптомы.
Температура тела увеличивается до 40 градусов и больше.
Возможные осложнения:
- инфекционно-токсический шок;
- отек мозга.
Нередко они наблюдаются одновременно и становятся причиной смерти пациента.
В случае выздоровления существует высокая вероятность рецидива в течение ближайших 2-3 лет.
Герпетические радикуломиелопатии
Имеют рецидивирующее течение.
Поражаются корешки спинномозговых нервов.
Чаще всего страдает поясничный отдел.
Симптомы:
- онемение кожи;
- боль в области ягодиц, бедер;
- учащение или задержка мочи;
- снижение тонуса ректального сфинктера, возможно недержание кала.
Реже возникают трофические нарушения.
Отмечается сухость кожи ног, выпадение волос.
При нарушении микроциркуляции возможен цианоз.
В целом прогноз при этой форме герпетической инфекции благоприятный.
Большинство нарушений со временем уходят.
Но возможна высокая частота рецидивов.
В этом случае происходит необратимое повреждение структур спинного мозга.
Происходит демиелинизация спинномозговых нервов и поражение аксонов.
В итоге возможно формирование устойчивой невралгии.
Боли сохраняются даже в периоды ремиссии заболевания.

О последствиях генитального герпеса
рассказывает врач гинеколог
Гаряева Ирина Владимировна
Содержание данной статьи проверено и подтверждено на соответствие медицинским
стандартам врачем дерматовенерологом, урологом, к.м.н.
Ленкиным Сергеем Геннадьевичем
| Наименование | Срок | Цена |
|---|---|---|
| Прием венеролога | 900.00 руб. | |
| ДНК Herpes simplex virus II типа | 1 д. | 300.00 руб. |
Последствия герпеса при беременности
Это вторая по частоте (после краснухи) причина выкидышей среди инфекционных факторов.
Заражение плода происходит на фоне виремии матери.
Возможные осложнения:
- самопроизвольный аборт;
- преждевременные роды;
- задержка внутриутробного развития плода;
- неонатальная инфекция у ребенка после рождения.
Инфицирование герпесом новорожденных
Заражение ребенка герпесом от матери уже после родов – относительно нечастое явление.
Это происходит лишь в 1 случае на 5000 родов.
То есть, риск составляет около 0,2%.
Но если инфицирование происходит, то протекает герпетическая инфекция у новорожденного очень тяжело.
Это связано с неполноценность иммунной системы младенца.
Значительно чаще передается инфекция во время родов или внутриутробно.
Это происходит приблизительно в 5% случаев.
Проявления заболевания у ребенка:
- поражение кожи, появление на ней пузырьков;
- воспаление глаз;
- воспаление структур ЦНС с развитием гидроцефалии.
При внутриутробном заражении клиническая картина проявляется уже в первые сутки жизни ребенка.
Но чаще ребенок заражается при прохождении через родовые пути.
По приблизительным оценкам такой путь инфицирования имеет место в 85% случаев.
Наибольший риск заражения присутствует, если у матери на момент родов наблюдается активное течение герпетической инфекции.
То есть, имеются клинические проявления заболевания – обнаруживаются пузырьки или папулы на половых органах.
С меньшей вероятностью заражение происходит при субклинической форме герпеса.
Риск передачи зависит также от ряда других факторов:
- уровень антител в материнском организме;
- продолжительность безводного промежутка;
- использование инструментов при родоразрешении, повреждающих кожу малыша.
Неонатальная герпетическая инфекция
Если последствием герпеса у матери стало заражение ребенка, это заболевание у него протекает в одной из трех клинических форм:
1. Кожная.
Характеризуется поражением только кожи и слизистых.
На ней появляются элементы сыпи.
При отсутствии лечения легкая форма может обернуться осложнениями.
2. Энцефалит.
Ребенок вяло сосет грудь, у него лихорадка и низкая подвижность.
Отмечаются изменения в ликворе.
Смертность при этой форме при естественном течении (без медицинской помощи) достигает 50%.
3. Диссеминированная форма.
Вирус попадает в кровь.
Он проникает сразу в несколько органов.
Возможно поражение печени, легких, надпочечников.
Смертность достигает 90%.
Даже в случае этиотропного лечения ацикловиром возможно сохранение остаточного неврологического дефицита по причине поражения структур ЦНС.
Как предотвратить инфицирование герпесом ребенка?
Всех беременных обследуют на герпетическую инфекцию.
Проводятся различные диагностические тесты.
Для выявления вируса берут мазки и проводят ПЦР для выявления ДНК вируса герпеса.
Проводят также исследование крови на антитела.
Такая диагностика позволяет не только понять, есть ли у женщины герпес, но также определить давность заражения и оценить риск передачи заболевания ребенку.
Наибольший риск отмечается, если во время беременности женщина впервые заразилась герпесом.
В этом случае у неё ещё нет в крови антител.
Затем они появляются, но авидность их низкая.
Поэтому достаточной защиты от вируса нет.
Наиболее неблагоприятная ситуация – когда беременная заражается за 1-2 месяца до родов.
Тогда риск развития герпеса у ребенка составляет 50-70%.
В таком случае показано оперативное родоразрешение.
Его по возможности проводят ещё до разрыва плодных оболочек.
Этот метод позволяет предотвратить инфицирование в 90% случаев.
Существует также медикаментозная профилактика.
Беременная принимает валацикловир.
Он подавляет репликацию вируса и снижает риск заражения ребенка.
Этот препарат может применяться у беременных.
Исследования показали, что его использование в дозировках, в 30 раз превышающих терапевтические, у животных не дают никакого негативного эффекта на плод.
Опыт применения у людей подтверждает эту информацию.
Профилактика также проводится ребенку.
Ему вводят ацикловир внутривенно.
Значительно меньше риск инфицирования ребенка, если незадолго до родов происходит рецидив герпетической инфекции.
Клинически это определяется как наличие вируса по результатам ПЦР в присутствии высокоавидных антител в крови.
Благодаря иммунной защите, вероятность заражения составляет всего 5%.
В этой ситуации кесарево сечение не делают.
Возможно проведение профилактики ацикловиром.
Новорожденному этот препарат назначают с профилактической целью только в случае дополнительных факторов риска передачи герпеса:
- преждевременных родов;
- длительного безводного периода;
- множественных очагах поражения у матери.
Если у беременной женщины выявлены антитела к герпесу, но ПЦР отрицательная, это говорит о том, что в организме есть вирус.
Но если обострений во время беременности нет, то риск передачи заболевания ребенку минимальный.
Он составляет в среднем 0,1%
В этом случае не требуется ни кесарево сечение, ни профилактика ацикловиром.
Но у женщины за несколько дней до родов берут мазок и проверяют при помощи ПЦР на вирус герпеса.
Если вирусовыделения нет, никакие профилактические мероприятия не требуются.
Хотя врач для перестраховки может взять у новорожденного мазки с конъюнктивы в первые сутки после рождения для исследования на вирус простого герпеса.
Таким образом, чтобы предотвратить последствия герпеса у ребенка, если мать является носителем вируса, необходимо сделать следующее:
- обследоваться во время беременности и непосредственно перед родами;
- при необходимости выполнить кесарево сечение;
- в большинстве случаев достаточно профилактики ацикловиром, который принимают в последние недели перед родами;
- по показаниям ацикловир вводится новорожденному ребенку.
Последствия генитального герпеса у мужчин
У пациентов мужского пола возможны осложнения в результате тяжелого воспаления кожных покровов и слизистых.
При глубоком воспалении происходит рубцевания тканей.
Причем наличие рубцов создает не только эстетический дефект, но и приводит к функциональным нарушениям.
Возможно развитие фимоза или стриктур уретры.
Фимоз развивается в результате появления высыпаний на крайней плоти.
Повторяющиеся рецидивы приводят к тому, что рубцовой ткани образуется все больше и больше.
Хотя фиброзная ткань часто незаметна, и замещает все возникшие кожные дефекты, она делает препуций менее эластичным.
В результате происходит постоянное его сужение.
Вначале мужчина не может обнажить головку пениса во время эрекции.
Затем этого невозможно добиться и в состоянии покоя.
Потому что крайняя плоть не растягивается вследствие потери эластичности.
Проблема решается только хирургическим методом.
При естественном течении заболевания рано или поздно происходит ущемление головки – парафимоз.
Это опасное осложнение, которое чревато некротическими процессами в результате нарушения кровообращения.
Возможно также развитие стриктур уретры.
Приблизительно у 30% мужчин герпес поражает её дистальный отдел.
При повторяющихся рецидивах появляются рубцы.
В результате происходит локальное сужение мочеиспускательного канала.
Это нарушает процесс мочеиспускания.
Данное последствие герпеса тоже требует хирургического лечения.
Как избежать последствий герпеса?
В случае возникновения генитального герпеса, обратитесь в нашу клинику.
Наши услуги:
- обследование на герпетическую инфекцию беременных;
- профилактика выкидышей или неонатального герпеса;
- лечение герпетической инфекции противовирусными препаратами;
- поддерживающая терапия для профилактики обострений и осложнений;
- восстановление иммунитета.
Негативные последствия чаще всего возникают у пациентов с иммунодефицитными состояниями.
Мы проведем диагностику состояния иммунной системы и проведем коррекцию.
Благодаря использованию вакцины от герпеса, иммуномодуляторов и противовирусных средств, риск осложнений удается снизить до минимума.
При подозрении на последствия генитального герпеса обращайтесь к автору этой статьи – дерматовенерологу в Москве с многолетним опытом работы.
При хроническом простатите / синдроме хронической тазовой боли IIIА (ХП/СХТБ) обнаруживают повышенное содержание лейкоцитов в секрете предстательной железы, однако стандартный диагностический поиск микробных агентов чаще всего безуспешен. Внедрение в широкую практику молекулярно-генетических исследований сделало возможным глубже изучить роль вирусных агентов при этом заболевании. Вирусы герпеса человека 6 типа (ВГЧ-6) обладают тропизмом к нервным клеткам, в связи с чем изучают их роль при нейродегенеративных заболеваниях и болевых синдромах. Уникальность этого вируса состоит в способности встраиваться в теломерную область хромосом и передаваться по наследству. Представлено клиническое наблюдение, в ходе которого при ХП/СХТБ в урогенитальных образцах выявлен ВГЧ-6 в клинически значимых титрах. ВГЧ-6 оказался единственным вероятным этиологическим агентом этого заболевания. Проведенная противовирусная терапия с применением комбинации аналога нуклеозида (валацикловир) 1000 мг/сут в течение 90 дней и препарата интерферона α-2b с антиоксидантами в форме ректальных суппозиториев по 3 млн МЕ 2 р/сут в течение 10 дней, а затем 3 р/нед. еще в течение 3 нед. показала хороший клинический и вирусологический эффект.
Ключевые слова: хронический простатит, хроническая тазовая боль, вирус герпеса 6 типа, противовирусная терапия.
Для цитирования: Ковалык В.П., Юрлов К.И., Гомберг М.А. и др. Ассоциация вируса герпеса человека 6 типа с синдромом хронической тазовой боли: клиническое наблюдение. РМЖ. 2021;6:53-55.
Association of human herpesvirus 6 with chronic pelvic pain syndrome: a clinical case
V.P. Kovalyk 1 , K.I. Yurlov 2 , M.A. Gomberg 3 , A.N. Shuvalov 2 , V.V. Malinovskaya 2 , A.A. Kusch 2
1 Federal Research and Clinical Center of the Federal Medical Biological Agency, Moscow
2 National Research Center for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya, Moscow
3 Moscow Scientific and Practical Center of Dermatovenereology and Cosmetology, Moscow
In chronic prostatitis/chronic pelvic pain syndrome IIIA (CP/CPPS) there is an increased WBC count in the prostate gland secret, but the standard diagnostic search for microbial agents is commonly unsuccessful. During the introduction of molecular genetics into clinical practice, the number of studies on the role of viral agents in this disease began to increase. Human herpesvirus 6 (HHV-6) has a tropism to nerve cells, and therefore, their role in neurodegenerative diseases and pain syndromes is being studied. The uniqueness of this virus is the possibility of its embedding in the chromosome telomere and its congenital transmission. The article presents a clinical case of HHV-6 detection in urogenital samples in the presence of CP/CPPS in clinically significant titers. HHV-6 was the only probable etiological agent of this disease. The conducted antiviral therapy using a combination of a nucleoside analog (Valacyclovir) (1000 mg per day for 90 days and interferon α-2b drug with antioxidants in rectal suppositories of 3 million IU 2 times a day for 10 days, then 3 times a week for 3 weeks) showed a good clinical and virological effect.
Keywords: chronic prostatitis, chronic pelvic pain, herpesvirus 6, antiviral therapy.
For citation: Kovalyk V.P., Yurlov K.I., Gomberg M.A. et al. Association of human herpesvirus 6 with chronic pelvic pain syndrome: a clinical case. RMJ. 2021;6:53–55 (in Russ.).
Эпидемиология, патофизиология и возможная связь ВГЧ-6 с клиническими синдромами
Вирус герпеса человека 6 типа (ВГЧ-6) впервые был обнаружен в 1986 г. у ВИЧ-положительного пациента, который страдал от лимфопролиферативного заболевания [1].
Так же как цитомегаловирус и вирус герпеса 7 типа, ВГЧ-6 относят к бета-герпесвирусам. Имеются его две различные подгруппы: ВГЧ-6А и ВГЧ-6В, которые на 95% генетически тождественны. Через 20 лет после открытия ВГЧ-6 различия между его вариантами достигли такой значимости, что их стали рассматривать как два разных вида.
ВГЧ-6 состоит из капсида икосаэдрической формы, окруженного тегументом в липидной оболочке диаметром около 200 нм [2].
Более 90% людей приобретают ВГЧ-6В в раннем детстве в виде внезапной экзантемы между 6 мес. и 2 годами после утраты материнских протективных антител. Инфицирование ВГЧ-6А происходит в более позднем возрасте и не сопровождается какими-либо симптомами. Антитела к ВГЧ-6 обнаруживают более чем у 90% населения развитых стран [3]. После первичной инфекции ВГЧ-6А и ВГЧ-6В пожизненно остаются в организме в латентном состоянии и могут реактивироваться, вызывая литическую инфекцию. В макроорганизме ВГЧ-6А и ВГЧ-6В обнаруживают в различных тканях и органах: в клетках головного мозга, в миндалинах, слюнных железах, почках, печени, лимфатических узлах, яичках, в эндотелиальных клетках, моноцитах и макрофагах. ВГЧ-6А и ВГЧ-6В — Т-лимфотропные вирусы, но предпочтительными локусами латентной инфекции являются клетки центральной нервной системы (ЦНС), костного мозга и мононуклеары периферической крови [4]. Латентный вирус может реактивироваться у иммунокомпетентных, и, что бывает значительно чаще, у иммунокомпрометированных лиц. Реактивация ВГЧ-6 ассоциирована с эпилептическими припадками, энцефалитом и отторжением трансплантата [5–7].
ВГЧ-6 инфицирует CD4 + -лимфоциты, приводя к снижению их уровня, что может быть кофактором прогрессии СПИДа, однако для доказательства требуются дальнейшие исследования [8].
ВГЧ-6 обладает тропизмом к нейронам и дендритным клеткам ЦНС. Из двух вариантов более нейровирулентным является ВГЧ-6А, что подтверждается его повышенной концентрацией в бляшках головного мозга при рассеянном склерозе. Другие герпесвирусы человека при латенции находятся в виде кольцевидной эписомы в ядре клеток хозяина. Однако ВГЧ-6А и ВГЧ-6В могут интегрироваться в хромосомы и передаваться вертикально через герминативные клетки. Частота хромосомной интеграции в популяции здоровых доноров крови составляет 0,8–1,5% [9]. Интегрированный геном вируса локализуется в концевых областях хромосом — теломерах. У лиц, которые унаследовали хромосомную интеграцию ВГЧ-6, обнаруживают одну копию вируса на клетку организма. Подозревать вирусную интеграцию следует при концентрации вируса 10 5 копий/мл и выше.
Данные за участие ВГЧ-6 в возникновении болевых синдромов немногочисленны. Так, А. Krumina et al. [10] сообщают о достоверной ассоциации ВГЧ-6 с фибромиалгией. У 23 из 43 пациентов с этим заболеванием была обнаружена ДНК ВГЧ-6 в периферической крови, в то время как в группе контроля инфекцию выявляли лишь у 3 из 50 человек. При этом у 29 из 43 больных фибромиалгией имелись различные степени повреждения А-дельта- и С-нервных волокон, нарушения температурной и болевой чувствительности.
Кроме того, уже более 25 лет обсуждают роль ВГЧ-6 при рассеянном склерозе [11, 12]. Среди прочих причин ВГЧ-6 рассматривают в качестве одного из самых значимых инфекционных триггеров, запускающих аутоиммунный процесс при этом заболевании. Вирусы обнаруживали в пробах тканей ЦНС, а серологические исследования по выявлению анти-ВГЧ-6 антител сыворотки крови и ликвора указывают на ассоциацию этого вируса с рассеянным склерозом. Кроме того, имеются данные in situ детекции вирусной ДНК. При этом частота болевого синдрома (в том числе тазового) у пациентов с рассеянным склерозом достигает 50–80%.
Следует отметить, что диагностировать инфекцию ВГЧ-6 на основе клинических проявлений зачастую трудно, что препятствует назначению этиологически обоснованного лечения. Лабораторную диагностику инфекции ВГЧ-6 проводят с помощью серологических и молекулярно-генетических исследований. Наиболее информативным является количественное определение вирусной ДНК в периферической крови и в других биологических жидкостях с помощью полимеразной цепной реакции (ПЦР) в реальном времени. Так как при первичном заражении и даже при реактивации ВГЧ-6 инфекция может протекать бессимптомно, условно определены концентрации ДНК ВГЧ-6, которые характеризуют активную, клинически выраженную инфекцию — 1000 копий/мл и выше.
В связи с тем что многие вопросы патогенеза, диагностики и лечения инфекций ВГЧ-6 пока не решены, представляет интерес клиническое наблюдение с успешной попыткой практического решения данных вопросов.
Клиническое наблюдение
Пациент О., 49 лет, обратился с жалобами на жжение в уретре, боль периодического характера в промежности, мошонке, неприятные ощущения при мочеиспускании, во время и после эякуляции.
Из анамнеза: в течение длительного времени болеет хроническим простатитом. Ежегодно проходил терапию антибактериальными и противовоспалительными препаратами, физиолечение — с временным эффектом. В юности отмечал частые рецидивы генитального герпеса. Другие инфекции, передаваемые половым путем, отрицает.
Сопутствующие заболевания: болезнь Паркинсона, принимает леводопу 200 мг/сут, бенсеразид 50 мг/сут. По рекомендации врача-невролога выдерживает режим повышенных физических нагрузок (езда на велосипеде 25–40 км в день). Болезнь проявляется периодически возникающим тремором пальцев рук.
Пальцевое ректальное исследование: предстательная железа 4×4 см, болезненная, мягко-эластической неоднородной консистенции, асимметрична за счет увеличенной правой доли, без очаговых уплотнений, слизистая над железой подвижна.
Индекс симптомов хронического простатита (chronic prostatitis symptom index) CPSI — 15 (боль — 8, нарушения мочеиспускания — 2, влияние симптомов на повседневную жизнь — 5), качество жизни (quality of life) QoL — 4, что соответствует умеренной степени тяжести тазовой боли.
Методом ПЦР Chlamydia trachomatis, Mycoplasma genitalium, Trichomonas vaginalis, Neisseria gonorrhoeae, Ureaplasma spp., Mycoplasma hominis, вирус простого герпеса (ВПГ) 1, 2 типа не выявлены.
При исследовании секрета предстательной железы (СПЖ) содержание лейкоцитов 0–4 в поле зрения, лецитиновые зерна — скудно. Общий анализ мочи в пределах нормы, в мазке из уретры выявлены лейкоциты 0–1–0 в поле зрения.
При бактериологическом исследовании до постмассажной пробы мочи: Staphylococcus epidermidis 10 4 КОЕ/мл в обеих пробах, что соответствует абактериальному ХП/СХТБ.
Клиническим материалом служили: цельная кровь, соскоб из уретры (СУ), СПЖ, эякулят. Получены следующие результаты: ДНК ВПГ-1, ВПГ-2, вируса Эпштейна — Барр и цитомегаловируса не обнаружена. ДНК ВГЧ-6 обнаружена в высоких концентрациях во всех изученных клинических материалах: в СУ — свыше 4 млн копий/мл, в СПЖ — 925 тыс. копий/мл, в эякуляте — 177 тыс. копий/мл. Высокое содержание ВГЧ-6 в крови (600 тыс. копий/мл) позволило предположить хромосомную интеграцию вируса.
При урофлоуметрии: максимальная скорость потока мочи (Qmax) — 17,3 мл/с, средняя скорость (Qav) — 8,6 мл/с, при объеме мочеиспускания — 157 мл. При ТРУЗИ: объем предстательной железы — 46 см 3 без очагов узловой гиперплазии, визуализируются кальцинаты вдоль уретры.
При получении результатов вирусологического исследования пациент подтвердил, что ранее у него уже выявляли ВГЧ-6 и он проходил лечение в одной из клиник г. Москвы за 2 года до обращения по данному поводу.
Диагноз: синдром хронической тазовой боли IIIВ, хроническая герпесвирусная инфекция 6 типа.
Проведено лечение: валацикловир 500 мг по 1 таблетке 2 р/сут в течение 3 мес., ВИФЕРОН ® (интерферон α-2b с антиоксидантами — витаминами Е и С) в форме ректальных суппозиториев, по 1 суппозиторию 3 млн МЕ 2 р/сут в течение 10 дней, затем 3 р/нед. еще в течение 3 нед.
В ходе лечения у пациента двукратно проводили повторные исследования СПЖ — через 2 нед. и 4 нед. от начала лечения. Содержание лейкоцитов составило 40–60 в поле зрения, ввиду чего первоначальный диагноз был изменен на ХП/СХТБ IIIА.
К концу терапии самочувствие субъективно улучшилось. Наиболее заметное улучшение проявлялось в виде снижения жжения уретры, уменьшения болей во время и после семяизвержения. Оценка по шкале CPSI на 90-й день составила 8 (4+1+3) баллов, по шкале QoL — 2 балла, т. е. отмечено снижение всех показателей.
Микроскопия СПЖ: лейкоциты 10–15 в поле зрения, содержание лецитиновых зерен — умеренно. Вирусологическое исследование обнаружило значительное снижение концентрации ВГЧ-6 (табл. 1).

Пальцевое ректальное исследование: предстательная железа 4×4 см, практически безболезненная при пальпации, мягко-эластической консистенции, асимметричная за счет увеличения правой доли, без очаговых уплотнений, слизистая над железой подвижна.
Субъективно течение имеющегося нейродегенеративного заболевания не изменилось за время наблюдения.
Таким образом, у пациента единственным вероятным этиологическим агентом ХП/СХТБ IIIА явился ВГЧ-6. На фоне специфической противогерпетической терапии и интерферонотерапии отмечалось уменьшение боли, симптомов дизурии, улучшение клинических и лабораторных показателей (концентрация вируса, оценка по шкале CPSI). Высокие конечные концентрации ВГЧ-6 при хорошем клиническом ответе можно объяснить возможной хромосомной интеграцией вируса, при которой каждая клетка организма содержит его генетический материал.
Важно отметить, что основной жалобой пациента было жжение в уретре, при этом максимальная концентрация вируса оказалась именно в этом урогенитальном локусе. В результате противовирусной терапии, включавшей препарат ВИФЕРОН ® (интерферон α-2b с антиоксидантами — витаминами Е и С) в форме ректальных суппозиториев, удалось снизить концентрацию вируса в содержимом уретры на два порядка, что оказалось достаточным для устранения уретральных симптомов.
Последующие годы наблюдения за данным пациентом показали, что симптомы ХП/СХТБ имели легкую степень тяжести и не заставляли пациента обращаться за медицинской помощью. В будущем более действенной терапией в данном случае может быть геномное редактирование с помощью коротких палиндромных повторов, регулярно расположенных группами, которое показало хороший антивирусный эффект на лабораторных животных [13].
Заключение
Широкое распространение ВГЧ-6 и возможность его верификации с помощью ПЦР послужили началом интенсивного изучения этого вируса. Оказалось, что ВГЧ-6 может быть ассоциирован с энцефалитом, эпилептическими припадками, болевыми синдромами, что обусловлено его нейротропизмом. Особенно большая концентрация ВГЧ-6 наблюдается в случае его хромосомной интеграции в околотеломерную область. При этом вирус начинает передаваться по наследству по законам Менделя.
В представленном клиническом случае ВГЧ-6 явился вероятной причиной абактериального хронического простатита. Противовирусная терапия, направленная на подавление репликации ВГЧ-6 и активацию антивирусной активности организма, показала хороший вирусологический эффект в виде снижения вирусной нагрузки, что сопровождалось достижением устойчивой клинической ремиссии у пациента с тазовым болевым синдромом.
Благодарность

Одними из наиболее тяжёлых осложнений, связанных с реактивацией вируса ветряной оспы, являются неврологические осложнения. Механизм их развития до конца не изучен, однако большинство учёных склоняется к постинфекционной иммуно-опосредованной теории повреждения миелиновых оболочек за счёт перекрёстного реагирования антител против белковой оболочки вируса ПГ с основным белком миелина (MBP). Помимо этого, VZV опосредованно (через ВНС) может спровоцировать нарушение функций внутренних органов (мочевой пузырь или кишечник). Jeremy A. Grekin et al описали случай, в котором первым симптомом опоясывающего герпеса с поражением крестцовых дерматомов стала острая задержка мочи.
Мужчина 27-и лет обратился в отделение неотложной помощи с жалобами на продолжающееся в течение 3 суток затруднение в мочеиспускании. Других симптомов не отмечалось, исследования мочи и крови не проводились, однако врачи предположили, что это инфекция мочевыводящих путей, и назначили антибактериальную терапию (ципрофлоксацин). После приёма антибиотика у пациента развилась острая аллергическая реакция (диффузная крапивница) и он обратился за медицинской помощью повторно. После использования дифенгидрамина и преднизолона проявления крапивницы уменьшились, и пациент смог помочиться.
Дальнейшие позывы к мочеиспусканию отсутствовали, однако ультразвуковое исследование (УЗИ) органов малого таза выявило переполненный мочевой пузырь. При катетеризации мочевого пузыря было получено ~780 мл мочи. УЗИ почек, осмотр простаты и половых органов не позволили выявить какой-либо патологии. В анализах мочи и крови не было признаков, указывающих на наличие инфекции или на нарушения функции почек. Пациент указал на эритематозные высыпания на коже верхней части левой ягодицы, ~2 см в диаметре. По его словам, сыпь появилась с утра. Однако врачи при проведении первичного осмотра не придали значения данной сыпи, интерпретировав её как побочную реакцию на антибиотик. Пациент находился под наблюдением в течение трёх часов и был выписан после самостоятельного, почти полного, опорожнения мочевого пузыря, подтверждённого УЗИ.
Через два дня мужчина обратился к дерматологу из-за распространения сыпи на ягодице (рис. 1А) и периодических приступов жгучей боли в этой области. К этому времени вокруг первичного очага появились везикулезные высыпания, ограниченные верхней половиной левой ягодицы. Такие же высыпания были обнаружены в промежности слева (рис. 1В) и на задней поверхности мошонки (рис. 1С). Мочеиспускание оставалось затруднённым. Пациент указал на перенесённую в детстве ветряную оспу, и врачи предположили диагноз опоясывающего герпеса. Была назначена противовирусная терапия (пероральный валацикловир по 1000 мг 3 раза в сутки, в течение 7 дней) и тамсулозин (0,4 мг в сутки) для коррекции дизурии.
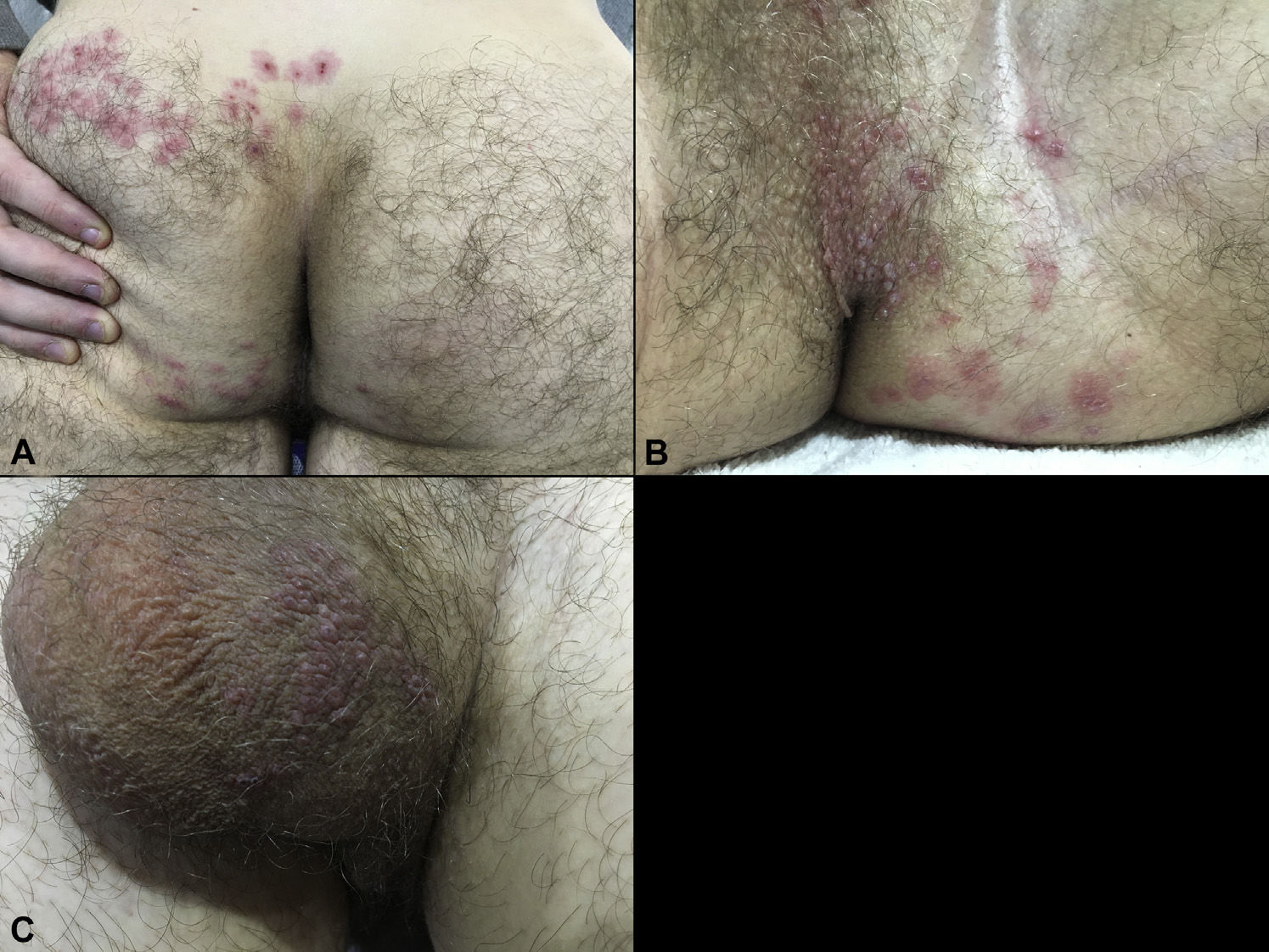
На следующий день после начала терапии пациент отметил восстановление мочеиспускания. Высыпания на коже полностью исчезли в течение 3 недель без развития характерных осложнений. Серологические исследования через 3 месяца после выздоровления выявили повышение уровня IgG к вирусу ветряной оспы, при этом не отмечалось повышения уровня IgG к вирусам простого герпеса 1 и 2 типов. При дальнейшем наблюдении подобных эпизодов у пациента не отмечалось.
Поражение крестцовых дерматомов наблюдается у 4–8% больных опоясывающим герпесом. Частота нарушений мочеиспускания в таких случаях не установлена, хотя в одном из ретроспективных исследований >28 % пациентов с опоясывающим герпесом крестцовой области имели те или иные признаки поражения висцеральных нервов, однако сразу оговоримся, что данное исследование довольно старое. Общие пути крестцовых нервов с парасимпатическими и висцеральными афферентными волокнами, контролирующими мочеиспускание, могут объяснить затруднение и отсутствие позывов при переполненном мочевом пузыре. Наблюдение особенно интересно тем, что жалобы на нарушения мочеиспускания появились за несколько дней до появления сыпи. В большинстве подобных случаев везикулезная сыпь появлялась до жалоб на затруднение отхождения мочи или одновременно с ними. Кроме этого, данный пациент при сборе анамнеза не предъявлял вышеописанных жалоб, тогда как похожие жалобы обычно отмечались у пожилых пациентов. В литературе описан только один случай развития нарушений мочеиспускания на фоне опоясывающего герпеса у молодого человека, но тот страдал острым интеркуррентным заболеванием – лихорадкой цуцугамуши с осложненным течением.
В вышеописанном случае диагноз стал очевидным только после появления характерных для VZV высыпаний в пределах дерматомов S2–S4 с вовлечением в процесс мошонки, что характерно для опоясывающего герпеса с поражением nervus pudendus. Поэтому авторы призывают помнить, что одной из возможных причин острой задержки мочи при недостатке чётких клинических признаков, указывающих на ту или иную нозологию, может быть опоясывающий герпес, даже при отсутствии характерных для него высыпаний.
Источник
Grekin J. A., Mehregan D. A. Sacral zoster with a primary complaint of difficulty voiding //JAAD case reports. – 2017. – Т. 3. – №. 6. – С. 509-511.
Читайте также:

