Желудочное кровотечение при гепатите и циррозе
Обновлено: 22.04.2024
Рвота кровавая (haematemesis, vomitus. cruentus; син. гематемезис) - рвота кровью или с примесью крови к рвотным массам; возникает при желудочном кровотечении.
Рвота "кофейной гущей" - кровавая рвота, при которой рвотные массы имеют черно-коричневый цвет, обусловленный образованием солянокислого гематина при взаимодействии крови с соляной кислотой желудочного сока.
Является не заболеванием, а симптомом. Как правило, сочетается с другим главным признаком кровотечения из верхних отделов желудочно-кишечного тракта (ЖКТ) - меленой Мелена - выделение кала в виде липкой массы черного цвета; обычно признак желудочно-кишечного кровотечения.
Подробно более чем в 50% случаев.
Период протекания
Минимальный период протекания (дней): 1
Максимальный период протекания (дней): не указан
Развивается непосредственно после начала кровотечения из верхних отделов ЖКТ.
Этиология и патогенез
Причиной кровавой рвоты являются кровотечения из верхних отделов желудочно-кишечного тракта.
К четырем самым распространенным причинам кровотечения из верхних отделов желудочно-кишечного тракта относятся:
Данные заболевания ответственны за более чем 90% всех случаев кровотечения из верхних отделов ЖКТ, когда можно точно установить место поражения.
Пептическая язва
Является, возможно, самой распространенной причиной кровотечения из верхних отделов ЖКТ. В основной массе случаев язвы выявляются в двенадцатиперстной кишке (ДПК). Риск возникновения значительного кровотечения присутствует приблизительно у 20-30% больных с документально подтвержденными язвами. При отсутствии в анамнезе типичных для язвенной болезни данных, тем не менее следует иметь ее в виду, та как кровоизлияние может быть и начальным проявлением пептической язвы.
Гастрит
Развитие гастрита может обуславливаться недавним употреблением алкогольных напитков или приемом противовоспалительных средств (ацетилсалициловая кислота, индометацин).
Эрозии или симптоматические язвы у больных с гастритом часто возникают вследствие больших травм, хирургических вмешательств при тяжелых системных заболеваниях, в особенности у пострадавших от ожога и при повышении внутричерепного давления.
Гастрит предполагают, основываясь на соответствующих клинических данных, так как типичные физикальные признаки гастрита неизвестны.
Для подтверждения диагноза, как правило, проводится гастроскопия (рентгенологическое обследование обычно не позволяет выявить гастрит).
Синдром Маллори-Вейсса
Данный синдром всё чаще выявляется в качестве причины острых кровотечений из верхних отделов ЖКТ с помощью эзофагогастродуоденоскопии. К синдрому Маллори-Вейсса относится разрыв слизистой оболочки в месте соединения пищевода с желудком, который часто проявляется позывами на рвоту или некровавой рвотой в анамнезе, вслед за чем появляется кровавая рвота.
Другие патологии
Кровавая рвота, имеющая источником пищевод, может являться также следствием повреждений, вызванных внедрением инородных тел или аневризмой аорты, вскрывшейся сквозь стенку пищевода.
Возможен разрыв атеросклеротических аневризм аорты в просвет тонкой кишки, который почти всегда заканчивается смертью больного. Подобный разрыв может также произойти после реконструктивной операции на артериях с образованием свища между синтетическим протезом и просветом кишки. Внезапному массивному кровотечению из аортокишечного свища может предшествовать небольшая кровоточивость. Внезапное кровотечение может возникнуть после травмы, которая привела к разрыву печени, в результате чего кровь может попасть в желчные протоки (т.е. гемобилия).
Клиническая картина
Cимптомы, течение
Распознать кровавую рвоту в большинстве случаев не трудно по темному, даже черному, цвету свернувшейся крови, имеющей кислую реакцию и смешанной с остатками пищи.
При внезапных, очень обильных кровотечениях кровь может иметь светло-красный цвет. Рвота алой кровью означает, что источник кровотечения находится скорее всего в пищеводе, так как кровь не успела вступить в реакцию с соляной кислотой в желудке. Однако при массивном кровотечении из желудка и невысокой секреции соляной кислоты в нем, а также при локализации язвы желудка в кардиальном отделе, в рвотных массах может отмечаться примесь неизмененной крови.
Аналогично рвота кофейной гущей не всегда означает, что источник кровотечения находится именно в желудке или двенадцатиперстной кишке. При проглатывании крови и последующей рвоте так называемая "пищеводная" кровь может иметь цвет кофейной гущи с прожилками алой крови.
Факторы риска развития постлигатурного кровотечения у больных с циррозом печени
Журнал: Эндоскопическая хирургия. 2016;22(4): 30‑35
В последние десятилетия отмечается значительный прогресс в лечении кровотечений из варикозно-расширенных вен пищевода, однако острый эпизод кровотечения остается тяжелым осложнением цирроза печени и часто выступает поворотным событием в развитии заболевания, приводя к летальному исходу. Летальность в подобных случаях достигает 20% [1, 2]. Одной из ключевых технологий в лечении и профилактике кровотечений портального генеза остается эндоскопическое лигирование варикозно-расширенных вен пищевода [3, 4]. Эндоскопическое лигирование считается довольно безопасным вмешательством с небольшим количеством осложнений [5]. Как правило, речь идет о преходящей дисфагии и небольших загрудинных болях в первые дни после лигирования [6]. Некоторые авторы сообщают о формировании рубцовой стриктуры пищевода в 1,9% случаев [7].Также отмечены единичные казуистические осложнения: дислокация дистального колпачка с эндоскопа в просвет пищевода [8], полная обтурация пищевода варикозным узлом, сформированным лигатурой [9]. Этапность патологических изменений в зоне лигирования хорошо изучена [10]. После странгуляции варикозного узла происходит тромбоз, ишемический некроз с последующим отслоением лигатуры. Небольшие поверхностные язвы заживают в течение 2—3 нед с развитием фиброза в слизистом и подслизистом слоях. В случае преждевременного соскальзывания резинового кольца с варикса до формирования тромбоза могут быть оголены дефекты с зияющими сосудами [11]. Именно в такой ситуации возникают эпизоды кровотечения из пищевода после эндоскопического лигирования [12]. В литературе немного публикаций, посвященных постлигатурным кровотечениям у больных с циррозом печени [13]. К факторам риска такого осложнения, не зависящим от техники операции, отнесены низкий протромбиновый индекс, рефлюкс-эзофагит, кровотечение из варикозно-расширенных вен в анамнезе, низкий уровень по шкале APRI [14]. В другом исследовании отмечено, что у пациентов с развившимся постлигатурным кровотечением был зафиксирован более низкий уровень гемоглобина, гематокрита, альбумина, усугубляющим фактором являлась также тяжесть заболевания печени по шкале Чайлд—Пью [15]. Однако резонно предположить, что преждевременное соскальзывание лигатуры может быть обусловлено и высоким напряжением в варикозном узле, отражающем степень портальной гипертензии. Известно, что вероятность кровотечения из поврежденного варикозного узла возрастает при увеличении давления в нем, которое пропорционально градиенту давления в печеночных венах [3]. Необходимо уточнить влияние величины давления в венах пищевода на исход эндоскопического лигирования.
Цель нашего исследования— определить ведущие прогностические факторы риска преждевременного соскальзывания лигатуры с развитием кровотечения у больных циррозом печени.
Материал и методы
Характеристика пациентов, участвовавших в исследовании, представлена в табл. 1.

Таблица 1. Характеристика пациентов, участвовавших в исследовании
103 пациентам с циррозом печени (54 мужчины, 49 женщин, средний возраст 6,6±13,54 года) выполнено 193 сеанса эндоскопического лигирования с профилактической целью в 2010—2015 гг., в том числе: 19 пациентам — однократно, 72 — дважды, 10 пациентам — трижды. У пациентов зафиксировано кровотечение различной интенсивности из области наложения лигатуры, которое подтверждено во время эзофагогастродуоденоскопии (ЭГДС), при этом другие (неварикозные) источники кровотечения были исключены. Геморрагии возникли в сроки от 1 до 8 сут после вмешательства, у 4 пациентов после первого лигирования, у 1 — после повторного. Все сеансы лигирования выполнены одним врачом с опытом выполнения данной манипуляции более 200 случаев. Процедура перевязки пищеводных вариксов была во всех случаях типична: под внутривенной седацией визуализировались варикозно-расширенные вены пищевода, определялась степень и распространенность варикоза по классификации Шерцингера (I степень — диаметр вен 2—3 мм, II степень — диаметр вен 3—5 мм, III степень — диаметр вен более 5 мм [16]) и классификации Sarin [17]. Измерение кровяного давления в вариксах выполняли методом эндосонографии аппаратом Вальдмана (патент № 2456913 от 27.10.10) (рис. 1). Данный способ измерения кровяного давления в венах пищевода сочетает в себе непосредственно эндоскопическое исследование и ультразвуковое сканирование. При ЭГДС измерялось расстояние от резцов до наиболее расширенных венозных узлов. В последующем на это же расстояние проводился зонд с резиновым баллоном на конце и ультразвуковым датчиком в нем. В баллон нагнеталась деаэрированная вода. Под действием нарастающего давления вены пищевода сдавливались, кровоток прекращался, что визуально определялось на экране монитора по ультразвуковой картине и данным допплерографии. В этот момент с помощью аппарата Вальдмана, соеди ненного через Т-образный переходник с баллоном, определялось давление, которое соответствовало венозному давлению в венах пищевода.

Рис. 1. Прибор для измерения давления в венах пищевода.
Эндоскопические исследования в сочетании с эндоскопической ультрасонографией и измерением давления в варикозно-расширенных венах пищевода было выполнено на эндоскопическом комплексе OlympusExera II серии 180 с использованием ультразвуковых мини-зондов с частотой сканирования 12 и 20 МГц. Далее выполняли аспирацию варикса и сбрасывание резинового кольца от кардии в проксимальном направлении по спирали с использованием лигирующего устройства EndoflexOVL с 6 или 7 лигатурами. За один сеанс накладывалось от 4 до 10 лигатур. Пациенты в течение 3 сут наблюдались в хирургическом стационаре, прием жидкой пищи начинали на следующие сутки после вмешательства. В случаях постлигатурного кровотечения двум пациентам был установлен зонд Блэкмора, единожды выполнялась интравазальная терапия 3% раствором этоксисклерола по методике foamform. Однократно была проведена операция Пациоры.
После определения основных, наиболее характерных, факторов определяли их частоту:
P 1 =S 1 P 2 =S 2
где P 1 и P 2 — частности (оценка вероятности) наличия фактора риска; S 1 и S 2 — число симптомов в каждой группе; n 1 и n 2 — число обследованных в каждой группе (группе осложнений и группе без осложнений).
Вычисление прогностического коэффициента каждого симптома проводили по формуле:
где ПК — прогностический коэффициент, Lg — логарифм отношения частностей, который для удобства расчетов увеличивали в 10 раз.
Порог принятия решения определяли исходя из уровня допустимых ошибок. Сбор диагностической информации продолжается до достижения какого-либо из установленных порогов (+13 или –13).
Полученные данные использованы для выявления больных с высоким риском развития постлигатурного кровотечения.
Результаты
Анализ случаев постлигатурного кровотечения представлен в табл. 2.

Таблица 2. Анализ случаев постлигатурного кровотечения
Частота кровотечений, возникших в результате преждевременного соскальзывания лигатуры (рис. 2), составила 2,59% (5 эпизодов на 193 эндоскопических лигирования). Эпизоды геморрагии возникли в сроки от 1 до 8 дней после манипуляции. Трем пациентам в условиях стационара ЭГДС выполнена немедленно при первых признаках кровотечения. В одном случае соскользнуло две лигатуры, в 2 — по одной. В 2 случаях кровотечение было настолько массивным, что потребовало установки зонда Блэкмора, причем у 1 из пациентов зонд Блэкмора был неэффективен, на фоне продолжающегося кровотечения пациенту выполнена операция Пациоры. Однако массивная кровопотеря спровоцировала развитие печеночной недостаточности с летальным исходом на 9-е сутки после лигирования. В 1 случае удалось выполнить эндоскопическую склеротерапию в области преждевременного соскальзывания лигатуры 3% раствором этоксисклерола 6 мл, однако в ближайшие дни появились признаки двусторонней полисегментарной пневмонии, наросла дыхательная недостаточность, потребовавшая интубации трахеи и ИВЛ, далее развился сепсис и пациент скончался на 12-е сутки после лигирования. Об эпизодах кровотечении еще у 2 пациентов известно из анамнеза. В обоих случаях пациенты были госпитализированы в хирургические стационары (через 7 и 8 дней после лигирования соответственно), эндоскопически выявлены язвенные дефекты с некротическим содержимым в дне и стигмами кровотечения. Медикаментозная терапия с использованием внутривенной инфузии раствора октреотида со скоростью 50 мкг/ч в течение 2 сут и антибактериальная терапия препаратами широкого спектра действия были достаточны для купирования кровотечения.

Рис. 2. Преждевременное соскальзывание лигатуры.
М. Г. Ипатова 1, 2 к.м.н., Ю. Г. Мухина 1 д.м.н. профессор, П. В. Шумилов 1 д.м.н., профессор
1 Российский национальный исследовательский медицинский университет им. Н. И. Пирогова
МЗ РФ, Москва
2 Детская Городская Клиническая Больница № 13 им. Н. Ф. Филатова, Москва
Ключевые слова: печень, синдром цитолиза, аланинаминотрансфераза, аспартатамино-трансфераза, гепатопротективные препараты
В статье изложены биохимические лабораторные показатели и их клиническое значение при заболеваниях печени, протекающих с синдромом цитолиза. Отдельное внимание уделено механизмам действия гепатопротективных препаратов, применяемых при цитолитическом синдроме.

Рис. 1. Роль печени в обмене веществ.
Сокращения: ЛПВП - липопротеиды высокой плотности; ЛПОНП - липопротеиды очень низкой плотности; РЭС ретикуло-эндотелиальная система; НАД - никотинамидадениндинуклеотид; ФАД - флавинадениндинуклеотид.
Печень представляет собой центральный орган химического гомеостаза организма, где создается единый обменный и энергетический пул для метаболизма почти всех классов веществ [1]. К основным функциям печени относятся: метаболическая, депонирующая, барьерная, экскреторная, гомеостатическая и детоксицирующая [2]. Печень может обезвреживать как чужеродные экзогенные вещества, обладающие токсическими свойствами, так и синтезированные эндогенно.
Таблица 2. Причины повышения уровня аминотрансфераз
Печеночные причины
Внепеченочные причины
•Вирусные гепатиты (В, С, ЦМВ и др.)
•Хронические инфекции и паразитарные
заболевания (эхинококкоз, токсоплазмоз и др.)
•Неалкогольный стеатогепатит
•Аутоиммунные заболевания печени
•Злоупотребление алкоголем
•Прием лекарственных препаратов
(статины, некоторые антибиотики, противогрибковые препараты, нестероидные
противовоспалительные препараты,
глюкокортикостероиды, другие)
•Метаболические заболевания печени
(галактоземия, фруктоземия, гликогенозы,
дефицит альфа1-антитрипсина,
аминоацидопатии, нарушение цикла мочевины, нарушение окисления жирных кислот, митохондриальная гепатопатия, некоторые лизосомные заболевания (болезнь
Гоше, болезнь Ниманна-Пика, дефицит кислой липазы и др.), муковисцидоз, синдром Швахмана-Даймонда, гемохроматоз, болезнь Вильсона и др.)
•врожденные и приобретенные дефекты
сосудов системы воротной вены (болезнь
Бадда-Киари и др.)
•Цирроз печени
•Опухоли печени
•Патология сердца (острый инфаркт
миокарда, миокардит)
•Повышенная физическая нагрузка
•Наследственные нарушения мышечного
метаболизма
•Приобретенные мышечные заболевания
•Травма и некроз мышц
•Целиакия
•Гипертиреоз
•Тяжелые ожоги
•Гемолиз эритроцитов
•Нарушение кислотно-щелочного равновесия
•Сепсис
Находясь между портальным и большим кругами кровообращения, печень выполняет функцию большого биофильтра. Через воротную вену в нее поступает более 70% крови, остальная кровь попадает через печеночную артерию. Большая часть веществ, всасывающихся в пищеварительном тракте (кроме липидов, транспорт которых в основном осуществляется через лимфатическую систему), поступает по воротной вене в печень [2]. Таким образом, печень функционирует как первичный регулятор содержания в крови веществ, поступающих в организм с пищей (рис 1).
Большое разнообразие функций гепатоцитов приводит к тому, что при патологических состояниях печени нарушаются биохимические константы, отражающие изменения многих видов обмена. Поэтому стандартный биохимический анализ крови включает определение различных параметров, отражающих состояние белкового, углеводного, липидного и минерального обмена, а также активность некоторых ключевых ферментов.
Концентрация ферментов в клетках значительно выше, чем в плазме крови; в норме только очень незначительная часть определяется в крови. Наиболее частыми причинами повышения уровня ферментов в сыворотке крови являются: прямое поражение клеточных мембран, в частности вирусами и химическими соединениями, гипоксия и ишемия тканей. Иногда активность ферментов увеличивается в результате их повышенного синтеза в тканях. Определение активности тех или других ферментов в сыворотке крови позволяет судить о характере и глубине поражения различных компонентов гепатоцитов [3, 4].
Ферменты в зависимости от их локализации можно разделить на несколько групп:
1) универсально распространенные ферменты, активность которых обнаруживается не только в печени, но и в других органах – амино-трансферазы, фруктозо-1-6-дифосфатальдолаза;
2) печеночноспецифические (органоспе-цифические) ферменты; их активность исключительно или наиболее высоко выявляется в печени. К ним относятся холинэстераза, орнитин-карбамилтрансфераза, сорбитдегидрогеназа и др.;
3) клеточноспецифические ферменты печени относят преимущественно к гепатоцитам,
купферовским клеткам или желчным канальцам (5-нуклеотидаза, аденозинтрифосфатаза);
4) органеллоспецифические ферменты, являются маркерами определенных органелл
гепатоцита: митохондриальные (глутаматде-гидрогеназа, сукцинатдегидрогеназа, цитохромоксидаза), лизосомальные (кислая фос фатаза, дезоксирибонуклеаза, рибонуклеаза), микросомальные (глюкозо-6-фосфатаза).
Специфичность ферментов и их диагностическое значение представлено в таблице 1 [5].
Отдельное место занимает макроэнзиме-мия – редкое и крайне сложное для дифференциальной диагностики состояние, при котором происходит комплексирование молекул того или иного энзима с иммуноглобулинами или небелковыми веществами. Описаны клинические наблюдения макро-КФК-емии, макро-ЛДГ-емии, макро-АСТ-емии, макро-ГГТ-емии, макроамилаземии. Макро-энзимемии сложны для диагностики и дифференциальной диагностики и ведут к проведению инвазивных методов обследования и необоснованному лечению.
В основе выявления макроэнзимемии лежит выявление отличий молекулы макрофермента от молекулы обычного энзима. Некоторые из этих методов являются прямыми, т. е. такими, которые позволяют непосредственно определить присутствие в крови ферментного комплекса, имеющего гораздо более высокий молекулярный вес, чем молекула нормального фермента. В основу прямого метода положено разделение белков сыворотки по молекулярному весу. Другие же методы являются непрямыми, так как выявление макроэнзима в крови проводится не путем выявления самого ферментного комплекса, а основываются на выявлении какого-либо из свойств макроэнзима. Прямые тесты имеют большее диагностическое значение и влекут за собой меньше технических и диагностических ошибок.
В некоторых ситуациях повышение ферментов является физиологическим: уровень щелочной фосфатазы повышен у подростков в период вытяжения (период ускорения роста), у здоровых женщин во время третьего триместра беременности (за счет плаценты). Однако очень высокую активность щелочной фосфатазы наблюдают у женщин с преэк-лампсией, что связно с нарушением кровообращения плаценты [7].
Большое значение в диагностике заболеваний печени имеют анамнестические данные и клиническая картина заболевания. Из анамнеза следует попытаться узнать о факторах риска заболеваний печени, обращая особое внимание на семейный анамнез, прием лекарств, витаминов, растительных добавок, наркотиков, алкоголя, трансфузии препаратов крови, патологические результаты печеночных проб в прошлом и симптоматику заболеваний печени. Клиническое обследование позволяет диагностировать до 50–60% патологических состояний. Более детальная дифференциальная диагностика основана на иммунохимических методах. Они позволяют детализировать характер вирусной, а также паразитарной инфекции, определить локализацию неопластического процесса, определить этиологию аутоиммунного заболевания, уточнить вид нарушения наследственных заболеваний обмена веществ.
При патологии печени в биохимическом анализе крови выделяют 4 синдрома:
• Синдром печеночно-клеточной недостаточности
• Мезенхиально-воспалительный синдром.
В данной статье мы подробно разберем по
казатели, характерные для синдрома цитолиза.
Синдром цитолиза – это синдром, обусловленный нарушением проницаемости клеточных мембран, распадом мембранных структур или некрозом гепатоцитов с выходом в плазму ферментов (АЛТ, АСТ, ЛДГ, альдолазы и др.).
АМИНОТРАНСФЕРАЗЫ: аспартатаминотрансфераза и аланинаминотрансфераза
Референтные значения: у новорожденных детей до 1 мес. – менее 80 Ед/л; от 2 мес. до 12 мес. – менее 70 Ед/л., с 1 года до 14 лет – менее 45 Ед/л, у женщин – менее 35 Ед/л, у мужчин – менее 50 Ед/л.
В клинической практике широко применяется одновременное определение уровня двух трансаминаз – аспартатаминотрансферазы (AСT) и аланинаминотрансферазы (АЛТ) в сыворотке крови.
Ферменты АЛТ и АСТ содержатся практически во всех клетках человеческого организма. Однако самый высокий уровень фермента АЛТ содержится в печени, поэтому уровень данного энзима служит специфическим маркером поражения печени. В свою очередь, АСТ помимо печени (в порядке снижения концентрации) содержится в сердечной и скелетных мышцах, почках, поджелудочной железе, легких, лейкоцитах и эритроцитах [6, 7, 8].
В печени АЛТ присутствует только в цитоплазме гепатоцитов, а АСТ – в цитоплазме и в митохондриях. Более 80% печеночной АСТ представлено именно митохондриальной фракцией [6, 7, 8].
В норме постоянство концентрации транс-аминаз в плазме крови отражает равновесие между их высвобождением вследствие физиологического апоптоза состарившихся гепатоци-тов и элиминацией. Соотношение синтеза АСТ/ АЛТ в печени равно 2,5/1. Однако при нормальном обновлении гепатоцитов уровни АСТ и АЛТ в плазме крови практически одинаковы (30–40 Ед/л) из-за более короткого периода полувыведения АСТ (18 ч против 36 ч у АЛТ).
При заболеваниях печени в первую очередь и наиболее значительно повышается активность АЛТ по сравнению с АСТ. Например, при остром гепатите, независимо от его этиологии, активность аминотрансфераз повышается у всех больных, однако преобладает уровень АЛТ, содержащейся в цитоплазме, вследствие ее быстрого выхода из клетки и поступления в кровяное русло. Таким образом, по уровню АЛТ судят о биохимической активности заболевания печени. Повышение показателя в 1,5–5 раз от верхней границы нормы свидетельствует о низкой активности процесса, в 6–10 раз – об умеренной и более 10 раз – о высокой биохимической активности. Повышение активности трансаминаз более 6 месяцев является биохимическим признаком хронического гепатита [6, 7].
Некоторые лекарственные препараты (например, вальпроевая кислота) метаболизируются в митохондриях гепатоцитов [9], поэтому ранним лабораторным маркером гепатотоксичности может быть лишь изолированное повышение АСТ.
Помимо патологии печени АСТ служит одним из ранних маркеров повреждения сердечной мышцы (повышается у 93–98% больных инфарктом миокарда до 2–20 норм); специфичность его не высока. Уровень ACT в сыворотке крови возрастает через 6–8 часов после начала болевого приступа, пик приходится на 18–24 часа, активность снижается до нормальных значений на 4–5 день. Нарастание активности фермента в динамике может свидетельствовать о расширении очага некроза, вовлечении в патологический процесс других органов и тканей, например, печени [7].
Интенсивные мышечные упражнения с чрезмерной нагрузкой также могут вызвать преходящее увеличение уровня ACT в сыворотке крови. Миопатии, дерматомиозиты и другие заболевания мышечной ткани вызывают повышение трансаминаз, преимущественно за счет АСТ.
Умеренное увеличение активности АСТ (в 2–5 раз от верхней границы нормы) отмечается при острых панкреатитах и гемолитических анемиях.
При латентных формах цирроза печени повышения активности ферментов, как правило, не наблюдают. При активных формах цирроза стойкий незначительный подъем аминотрансфераз выявляют в 74–77% случаев, и, как правило, преобладает активность АСТ над АЛТ в два и более раз.
Снижение активности АЛТ и АСТ имеет место при недостаточности пиридоксина (витамина В6), при почечной недостаточности, беременности.
Ниже приведены печеночные и внепеченочные причины повышения активности аминотрансфераз в сыворотке крови (табл. 2).
Помимо оценки уровня трансаминаз в клинической практике широко применяется коэффициент де Ритиса – отношение АСТ к АЛТ (АСТ/АЛТ). В норме значение этого кэффициента составляет 0,8–1,33. Следует отметить, что расчет коэффициента де Ритиса целесообразен только при выходе АСТ и/или АЛТ за пределы референтных значений.
У новорожденных детей соотношение АСТ/АЛТ обычно превышает 3,0, однако к пятому дню жизни снижается до 2,0 и ниже.
При поражениях печени с разрушением гепатоцитов преимущественно повышается АЛТ, коэффициент де Ритиса снижается до 0,2–0,5. При патологии сердца преобладает уровень АСТ, и коэффициент де Ритиса повышается. Однако для точной дифференциальной диагностики этот коэффициент непригоден, так как нередко при алкогольном поражении печени, неалкогольном стеатогепатите, циррозе печени также преобладает повышение АСТ и коэффициент де Ритиса составляет 2,0–4,0 и более. Значение данного коэффициента выше нормы часто наблюдается при обтурационных желтухах, холециститах, когда абсолютные значения АЛТ и АСТ невелики.
1. При остром вирусном и хроническом гепатитах, особенно на ранних стадиях, активность АЛТ выше, чем АСТ (коэффициент де Ритиса меньше 1,0). Тяжелое поражение паренхимы печени может изменить это соотношение.
2. При алкогольном гепатите и циррозе нередко активность АСТ оказывается выше, чем АЛТ (коэффициент де Ритиса больше 1,0).
3. При остром ИМ активность АСТ выше, чем АЛТ (коэффициент де Ритиса больше 1,5).
ЛАКТАТДЕГИДРОГЕНАЗА
Референтные значения ЛДГ для новорожденных – до 600 Ед/л, у детей с 1 года до 12 лет активность ЛДГ – 115 – 300 Ед/л, для детей старше 12 лет и у взрослых норма ЛДГ – до 230 Ед/л.
Лактатдегидрогеназа (ЛДГ) – гликолитический цинксодержащий фермент, обратимо катализирующий окисление L-лактата в пируват, широко распространен в организме человека. Наибольшая активность ЛДГ обнаружена в почках, сердечной мышце, скелетной мускулатуре и печени. ЛДГ содержится не только в сыворотке, но и в значительном количестве в эритроцитах, поэтому сыворотка для исследования должна быть без следов гемолиза [7].
При электрофорезе или хроматографии удается обнаружить 5 изоферментов ЛДГ, отличающихся по своим физико-химическим свойствам. Наибольшее значение имеют два изофермента – ЛДГ1 и ЛДГ5. Фракция ЛДГ1 более активно катализирует обратную реакцию превращения лактата в пируват. Она в большей степени локализуется в сердечной мышце и некоторых других тканях, в норме функционирующих в аэробных условиях. В связи с этим миокардиальные клетки, обладающие богатой митохондриальной системой, окисляют в цикле трикарбоновых кислот не только пируват, образующийся в результате протекающего в них самих процесса гликолиза, но и лактат, образующийся в других тканях. Фракция ЛДГ5 более эффективно катализирует прямую реакцию восстановления пирувата в лактат. Она локализуется преимущественно в печени, в скелетных мышцах. Последние нередко вынуждены функционировать в анаэробных условиях (при значительной физической нагрузке и быстро наступающем утомлении). Образующийся при этом лактат с кровотоком попадает в печень, в которой он используется для процесса глюконеогенеза (ресинтеза глюкозы), а также в сердце и другие ткани, где происходит его преобразование в пируват и вовлечение в цикл трикарбоновых кислот (цикл Кребса). Любое повреждение клеток тканей, содержащих большое количество ЛДГ (сердце, скелетные мышцы, печень, эритроциты), приводит к повышению активности ЛДГ и ее изо-ферментов в сыворотке крови. Наиболее частыми причинами повышения активности ЛДГ являются:
1. Поражение сердца (острый инфаркт миокарда, миокардит, застойная сердечная недостаточность); в этих случаях обычно преобладает повышение активности ЛДГ1 и/или ЛДГ2.
2. Поражение печени (острые и хронические гепатиты, цирроз печени, опухоли и метастазы печени), когда преимущественно увеличивается изофермент ЛДГ5, ЛДГ2, ЛДГ4.
3. Повреждение скелетных мышц, воспалительные и дегенеративные заболевания
скелетных мышц (преимущественно увеличение изофермента ЛДГ1, ЛДГ2, ЛДГ3).
4. Заболевания крови, сопровождающиеся распадом клеток крови: острый лейкоз, гемолитическая анемия, В12-дефицитная анемия, серповидноклеточная анемия, а также заболевания и патологические состояния, сопровождающиеся разрушением тромбоцитов (массивная гемотрансфузия, эмболия легочной артерии, шок и др.). В этих случаях может преобладать повышение активности ЛДГ2, ЛДГ3.
5. Острый панкреатит.
6. Заболевания легких (пневмония и др.)
7. Инфаркт почки.
8. Опухоли (повышенный уровень ЛДГ наблюдается в 27% случаев опухолей в I стадии и в 55% – метастатических семином).
Следует помнить, что многие заболевания сердца, скелетных мышц, печени и крови могут сопровождаться повышением активности в сыворотке крови общей ЛДГ без отчетливого преобладания какого-либо из ее изоферментов.
Таблица 3. Эффективность гепатопротекторов при синдроме цитолиза (по С. В. Морозову с соавт., 2011 г. и Н. Б. Губергриц, 2012 г.) [10]
Что такое цирроз печени? Причины возникновения, диагностику и методы лечения разберем в статье доктора Васильева Романа Владимировича, гастроэнтеролога со стажем в 15 лет.
Над статьей доктора Васильева Романа Владимировича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Цирроз печени (ЦП) — это хроническое дегенеративное заболевание печени, связанное с диффузным патологическим процессом, при котором нормальные клетки печени повреждаются, а затем замещаются рубцовой тканью, образуя избыточный фиброз и структурно-анатомические регенераторные узлы.
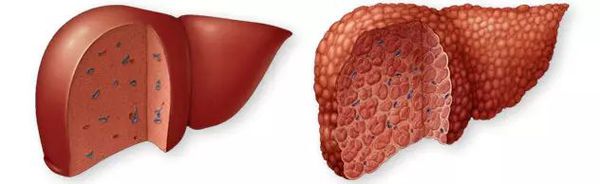
Этиология
По этиологическим характеристикам можно выделить:
- распространённые формы ЦП;
- редкие формы ЦП.
К распространённым относят вирусные (В, С, D), алкогольные и метаболические формы цирроза печени.
Редкими формами ЦП являются:
- аутоиммунные, лекарственные, токсические, первичные и вторичные билиарные циррозы;
- генетически обусловленные патологии — гемохроматоз (нарушение обмена железа), болезнь Вильсона — Коновалова, дефицит белка альфа-1-антитрипсина, гликогеноз IV типа (недостаток ферментов), галактоземия, наследственная тирозинемия и непереносимость фруктозы;
- нарушение венозного оттока из печени — венокклюзионные формы ЦП (болезнь Бадда — Киари);
- тяжёлая правожелудочковая сердечная недостаточность;
- флебопортальные циррозы (типа Банти).
Пути заражения
Заразиться циррозом печени нельзя. Однако, если он вызван вирусным гепатитом, то возбудитель может передаться через кровь, при половых контактах и от матери к ребёнку.
Основную роль в возникновении и развитии вирусного ЦП играют симптомные, малосимптомные и бессимптомные формы острого вирусного гепатита В, С, а также одновременное заболевание гепатитами В и D с последующим переходом в активный хронический вирусный гепатит. У большинства больных интервал между острым гепатитом С и клинически выраженными проявлениями ЦП превышает 30 лет. Только у мужчин, употребляющих более 50 г спирта в день, выраженные формы ЦП возникают через 13-15 лет.
Наиболее частыми причинами смерти больных ЦП является:
- большая печёночная недостаточность;
- кровотечение из варикозно расширенных вен пищевода;
- первичный рак печени;
- иммунопротективная недостаточность, влекущая за собой активизацию инфекционных (микробных) процессов, в первую очередь спонтанного бактериального перитонита и пневмонии, а также возникновение оксидативного стресса.
У больных в терминальной (заключительной) фазе заболеваний печени в основном наблюдаются декомпенсированные формы цирроза печени: асцит, варикозное расширение вен пищевода и желудка, энцефалопатия и желтуха.
Особенности цирроза печени у детей
Заболевание у детей встречается крайне редко и обычно связано:
- с аутоиммунным поражением печени;
- кардиогенными заболеваниями — лёгочной гипертензией и хронической сердечной недостаточностью;
- болезнью Бадда — Киари;
- врождёнными болезнями накопления — наследственным гемохроматозом, лизосомальными болезнями накопления, болезнью Вильсона — Коновалова;
- флебопортальным циррозом (типа Банти).
Прогноз у таких детей неблагоприятный, чаще всего они погибают, так как не успевают попасть к гепатологу и выяснить диагноз. Также они обычно страдают от множества сопутствующих болезней, в том числе от основного заболевания, ставшего причиной цирроза.
Проявления заболевания у детей и взрослых схожи. Единственный эффективный метод лечения цирроза у детей — это пересадка печени. Поэтому крайне важно вовремя диагностировать заболевание и встать в очередь на пересадку печени.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы цирроза печени
Цирроз печени в течение длительного времени может протекать латентно, т. е. бессимптомно.
Клиническая картина ЦП зависит от его формы и течения, активности основного заболевания, а также наличия или отсутствия печёночно-клеточной недостаточности, синдрома портальной гипертензии, холестаза и внепечёночных проявлений.
Основные общие симптомы, которые чаще всего встречаются при ЦП:
- повышенная утомляемость;
- похудение;
- нарушения сознания и поведения;
- ухудшение аппетита и чувство дискомфорта в животе;
- пожелтение кожи, белковых оболочек глаз и слизистой;
- осветление или обесцвечивание кала;
- потемнение мочи;
- болевые ощущения в животе;
- отёки;
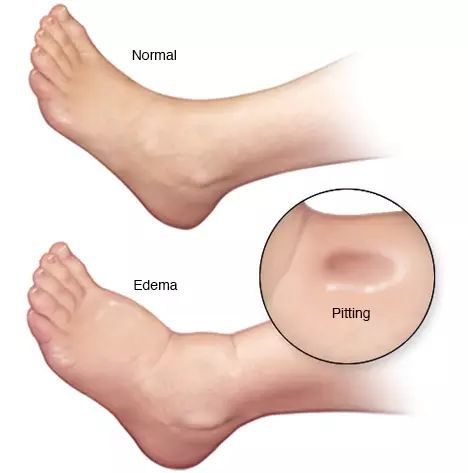
- асцит (скопление жидкости в брюшной полости);
- кровотечения из носа, желудочно-кишечного тракта, дёсен или геморроидальных узлов, а также подкожные кровоизлияния;
- часто возникающие бактериальные инфекции (например, органов дыхания);
- снижение полового влечения;
- кожный зуд.
Симптомы распространённых форм ЦП
При высокоактивном ЦП, кроме общей утомляемости, осветления стула и потемнения мочи, может возникать тупая боль в правом подреберье и вздутие живота.
Во время осмотра часто выявляют:
- субиктеричность (желтушность) склер;
- расширение вен брюшной стенки, напоминающее голову медузы;
- венозный шум при выслушивании в эпигастральной области живота (шум Крювелье — Баумгартена);
- серо-коричневатый цвет шеи;
- гинекомастию (увеличение грудных желёз);
- гипогонадизм (у мужчин);
- контрактуру Дюпюитрена (укорочение сухожилий ладоней).
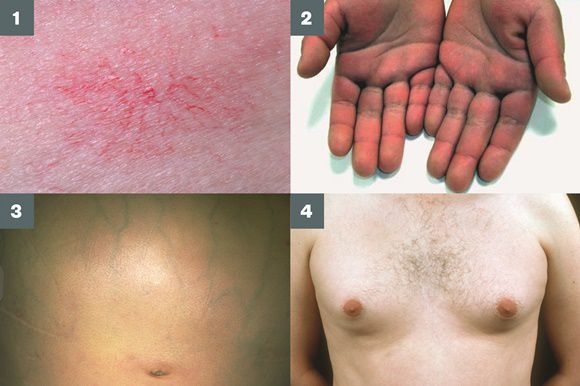
Три последних признака цирроза печени зачастую наблюдаются при алкогольных ЦП.
В области грудной клетки в 50-80% случаев наблюдаются телеангиэктазии кожи (расширения мелких сосудов), чаще при алкогольных ЦП. Пальпаторно печень отчётлива уплотнена, имеет неровный нижний край. Размеры печени различны — от значительного увеличения до уменьшения.
Часто при пальпации выявляется умеренно увеличенная селезёнка, причём её край может выступать из-под рёберной дуги на 1-3 см.
При развитии ЦП появляются симптомы белково-энергетической недостаточности, асцит, отёки, а также печёночный запах при тяжёлой печёночной недостаточности.
Симптомы при малоактивных и начальных стадиях ЦП
Данные формы ЦП зачастую протекают бессимптомно и выявляются в ходе периодических медицинских осмотров, диспансеризации, а также как случайная находка при обследовании пациента со смежной патологией или внепечёночными проявлениями.
При малоактивном ЦП, как правило, не возникают жалобы, связанные с печенью. Во время активного расспроса можно выявить весеннее снижение работоспособности, частые болезни, после которых возможны кровоточивость дёсен и потемнение мочи. Такие пациенты хуже, чем раньше, переносят длительные физические и нервно-психические нагрузки.
Желтухи и выраженного увеличения билирубина, за исключением периода интеркурентного острого гепатита, нет. Неяркая телеангиоэктазия кожи (сосудистые звёздочки) в области грудной клетки наблюдаются у 40-60% людей с ЦП.
Телеангиоэктазии кожи, плотная печень с фестончатым краем и умеренно увеличенная селезёнка — ценная клинико-диагностическая триада, которая с вероятностью 80-90% свидетельствует о ЦП или далеко зашедшем активном хроническом гепатите.
Патогенез цирроза печени
В основе патофизиологии цирроза лежит повреждение и некроз паренхимы (основной ткани) печени с деструкцией и гибелью гепатоцитов (клеток печени), а также системное поражение интерстициальной ткани.
При всех формах ЦП нарушается иммунологическое равновесие организма, преобладающими становятся аутоиммунные процессы: иммунная система человека принимает собственные клетки печени за чужеродные и повреждает их. В конечном итоге, это приводит к разрушению гепатоцитов и структуры печени в целом. Однако при этом каждая форма ЦП имеет свои патогенетические особенности:
- при вирусных гепатитах повреждающим агентом является сама вирусная частица, которая, размножаясь в клетке, разрушает её, вызывая цитолиз;
- при алкогольном ЦП прямое токсическое воздействие на мембраны гепатоцитов оказывает ацетальдегид с развитием алкогольной жировой болезни печени и алкогольного стеатогепатита;
- при метаболическом ЦП ведущую роль в патогенезе играет ожирение и сахарный диабет через стадию неалкогольного стеатогепатита с инсулинорезистентностью и последующей запрограммированной гибелью клеток печени.
В основе патогенеза более редких причин цирроза печени лежат ещё более частные механизмы развития повреждения и разрушения гепатоцитов и структуры печени:
- нарушение обмена и накопления железа при гемохроматозе;
- накопление меди при болезни Вильсона — Коновалова;
- окклюзия в системе воротной вены при гепатопортальном склерозе.
Цирроз формируется на протяжении многих лет. С течением времени происходят изменения генетического аппарата клеток печени, в результате чего появляются новые патологические клетки. Этот процесс в печени является иммуновоспалительным, он поддерживается чужеродными агентами, в роли которых могут выступать разные субстраты:
- вирус гепатита В;
- алкогольный гиалин;
- денатурированные белки;
- некоторые лекарственные средства;
- медьбелковые и железобелковые комплексы (ферритин).
В итоге повреждения паренхимы печени развивается гепатоцеллюлярная (печёночно-клеточная) недостаточность за счёт диффузного фиброза и трансформации ткани печени в анормальные узлы-регенераты. [3] [4] [5]
Классификация и стадии развития цирроза печени
В 1974 году на съезде гепатологов в Акапулько (Мексика) была принята единая морфологическая классификация, которую позже уточнили и несколько доработали эксперты ВОЗ. В настоящее время она является общепринятой.
Читайте также:

