Живые сухие вирус вакцины
Обновлено: 19.04.2024
Вакцины (лат. vaccinus коровий) — препараты, получаемые из бактерий, вирусов и других микроорганизмов или продуктов их жизнедеятельности и применяемые для активной иммунизации людей и животных с целью специфической профилактики и лечения инфекционных болезней.
Содержание
История
Еще в древние времена было установлено, что перенесенная однажды заразная болезнь, напр, оспа, бубонная чума, предохраняет человека от повторного заболевания. В последующем эти наблюдения развились в учение о постинфекционном иммунитете (см.), т. е. о повышенной специфической устойчивости против возбудителя, наступающей после перенесения вызванной им инфекции.
Давно было замечено, что люди, перенесшие болезнь в легкой форме, становятся невосприимчивыми к ней. На основе этих наблюдений у многих народов применялось искусственное заражение здоровых людей инфекционным материалом в надежде на легкое течение болезни. Например, с этой целью китайцы вкладывали в нос здоровым людям высушенные и размельченные оспенные струпья от больных. В Индии размельченные оспенные струпья прикладывали к коже, предварительно натертой до ссадин. В Грузии с той же целью делали уколы кожи иглами, смоченными оспенным гноем. Искусственную прививку оспы (вариоляцию) стали применять и в Европе, в частности в России, в 18 в., когда эпидемии оспы приняли угрожающие размеры. Однако этот метод предохранительных прививок не оправдался: наряду с легкими формами заболевания у многих привитая оспа вызывала тяжелое заболевание, а сами привитые становились источниками заражения окружающих. Поэтому в начале 19 в. вариоляция в европейских странах была запрещена. Африканские народы продолжали применять ее и в середине 19 в.
В связи с распространением вариоляции искусственные прививки заразного материала предпринимались и при некоторых других инфекциях: кори, скарлатине, дифтерии, холере, ветряной оспе. В России в 18 в. Д. С. Самойлович предлагал прививать гной из чумных бубонов лицам, непосредственно соприкасающимся с больными. Указанные попытки предохранения людей от инфекционных болезней сохраняют теперь лишь исторический интерес.
Введение в организм человека или домашних животных современных В. имеет целью добиться выработки прививочного иммунитета, аналогичного постинфекционному иммунитету, но с исключением опасности развития инфекционной болезни в результате прививок (см. Вакцинация). Впервые такая Вакцина для иммунизации людей против оспы была получена английским врачом Э. Дженнером с использованием инфекционного материала от коров (см. Оспопрививание). Дата публикации труда Э. Дженнера (1798) считается началом развития вакцинопрофилактики, к-рая в течение первой половины 19 в. получила широкое распространение в большинстве стран мира.
На последующих этапах развития учения о вакцинах большое значение имели работы Η. Ф. Гамалеи (1888), Р. Пфейффера и В. Колле (1898), показавшие возможность создания иммунитета не только прививками ослабленных живых микробов, но и убитыми культурами возбудителей болезней. Η. Ф. Гамалеи показал также принципиальную возможность иммунизации химическими В., получаемыми извлечением из убитых микробов иммунизирующих фракций. Большое значение имело открытие Г. Рамоном в 1923 г. нового вида вакцинирующих препаратов — анатоксинов.
Виды вакцин
С целью повышения иммуногенности В., особенно химических и анатоксинов, их применяют в форме препаратов, адсорбированных на минеральных коллоидах, чаще всего на геле гидроокиси алюминия или фосфата алюминия. Применение адсорбированных В. удлиняет период воздействия антигенов (см.) на организм привитого; кроме того, адсорбенты проявляют неспецифическое стимулирующее действие на иммуногенез (см. Адъюванты). Адсорбирование некоторых химических В. (напр., брюшнотифозной) способствует снижению их высокой реактогенности.
Каждый из указанных выше видов В. имеет свои особенности, положительные и отрицательные свойства.
Живые вакцины
Для приготовления живых Вакцин применяют наследственно измененные штаммы (мутанты) патогенных микробов, лишенные способности вызывать специфическое заболевание у вакцинируемого, но сохранившие свойство размножаться в привитом организме, заселять в большей или меньшей степени лимфатический аппарат и внутренние органы, вызывая скрытый, без клинического заболевания, инфекционный процесс — вакцинную инфекцию. Привитой организм может реагировать на вакцинную инфекцию местным воспалительным процессом (преимущественно при накожном способе вакцинации против оспы, туляремии и других инфекций), а иногда и общей непродолжительной температурной реакцией. Некоторые реактивные явления при этом могут быть обнаружены при лабораторных исследованиях крови привитых. Вакцинная инфекция, даже если она протекает без видимых проявлений, влечет за собой общую перестройку реактивности организма, выражающуюся в выработке специфического иммунитета против заболевания, вызываемого патогенными формами того же вида микроба.
Выраженность и продолжительность поствакцинального иммунитета различны и зависят не только от качества живой вакцины, но и от иммунологических особенностей отдельных инфекционных болезней. Так, напр., оспа, туляремия, желтая лихорадка ведут к развитию практически пожизненной невосприимчивости у переболевших. В соответствии с этим высокими иммунизирующими свойствами обладают и живые В. против названных болезней. В отличие от этого, трудно рассчитывать на получение высокоиммуногенных В., напр, против гриппа или дизентерии, когда сами эти заболевания не создают достаточно длительного и напряженного постинфекционного иммунитета.
Среди других видов вакцинных препаратов живые В. способны создавать у привитых наиболее выраженный поствакцинальный иммунитет, приближающийся по напряженности к постинфекционному иммунитету, но продолжительность его все же меньше. Напр., высокоэффективные В. против оспы и туляремии способны обеспечить устойчивость привитого человека против заражения на протяжении 5—7 лет, но не пожизненно. После прививок против гриппа лучшими образцами живых В. выраженный иммунитет сохраняется в ближайшие 6—8 мес.; постинфекционный иммунитет против гриппа резко падает к полутора — двум годам после болезни.
Вакцинные штаммы для приготовления живых В. получают различными путями. Э. Дженнер отобрал для вакцинации против оспы людей субстрат, содержащий вирус коровьей оспы, обладающий полным антигенным сходством с вирусом оспы человека, но маловирулентный для людей. Подобным образом отобран бруцеллезный вакцинный штамм № 19, относящийся к слабопатогенному виду Br. abortus, вызывающий бессимптомную инфекцию у привитых с последующим развитием иммунитета ко всем видам бруцелл, в т. ч. и к наиболее опасному для человека виду Br. melitensis. Однако отбор гетерогенных штаммов относительно редко позволяет найти вакцинные штаммы нужного качества. Чаще приходится прибегать к экспериментальному изменению свойств патогенных микробов, добиваясь лишения их патогенности для человека или вакцинируемых домашних животных при сохранении иммуногенности, связанной с антигенной полноценностью вакцинного штамма и с его способностью размножаться в привитом организме и вызывать бессимптомную вакцинную инфекцию.
Методы направленного изменения биол, свойств микробов для получения вакцинных штаммов разнообразны, но общей чертой этих методов является более или менее длительное культивирование возбудителя вне организма животного, чувствительного к данной инфекции. Для ускорения процесса изменчивости экспериментаторы применяют те или иные воздействия на культуры микробов. Так, Л. Пастер и Л. С. Ценковский для получения сибиреязвенных вакцинных штаммов культивировали возбудителя в питательной среде при повышенной против оптимума температуре;
Спонтанной утрате патогенности микробных культур предшествует появление в их популяции отдельных мутантов с качеством вакцинных штаммов. Поэтому вполне оправдан и перспективен метод селекции вакцинных клонов из лабораторных культур возбудителей, популяции которых в целом еще сохраняют патогенность. Такая селекция позволила H. Н. Гинсбургу получить сибиреязвенный вакцинный штамм — мутант СТИ-1, пригодный для вакцинации не только животных, но и людей. Аналогичный вакцинный штамм № 3 был получен А. Л. Тамариным, а Р. А. Салтыков селекционировал из патогенной культуры возбудителя туляремии вакцинный штамм № 53.
Для получения вакцинных штаммов вирусов применяется длительное пассирование их в организме одного и того же вида животных, иногда не являющихся естественными хозяевами данного вируса. Так, антирабическая вакцина готовится из штамма фиксированного вируса (virus fixe) Л. Пастера, полученного из вируса уличного бешенства, многократно пассированного через мозг кролика (см. Антирабические прививки). В результате этого резко возросла вирулентность вируса для кролика и снизилась вирулентность для других животных, а также для человека. Таким же путем вирус желтой лихорадки был превращен в вакцинный штамм путем длительных внутримозговых пассажей на мышах (штаммы Дакар и 17Д).
Заражение животных в течение длительного периода оставалось единственным методом культивирования вирусов. Это имело место до разработки новых методов их культивирования. Одним из таких методов явился метод культивирования вирусов на куриных эмбрионах. Использование данного метода позволило адаптировать к куриным эмбрионам высокоаттенуированный штамм 17Д вируса желтой лихорадки и начать широкое изготовление В. против этого заболевания. Метод культивирования на куриных эмбрионах позволил также получать вакцинные штаммы вирусов гриппа, паротита и других вирусов, патогенных для человека и животных.
Еще более существенные достижения в деле получения вакцинных штаммов вирусов стали возможны после открытия Эндерса, Уэллера и Роббинса (J. Enders, Т. Weller, F. Robbins, 1949), предложивших выращивать вирус полиомиелита в тканевых культурах, и введения в вирусологию однослойных клеточных культур и метода бляшек [Дульбекко и Фогт (R. Dulbecco, М. Vogt, 1954)]. Эти открытия позволили осуществить селекцию вариантов вирусов и получать чистые клоны — потомства одной или немногих вирусных частиц, обладающих определенными, наследственно закрепленными биол, свойствами. Сейбину (A. Sabin, 1954), использовавшему указанные методы, удалось получить мутанты вируса полиомиелита, характеризующиеся пониженной вирулентностью, и вывести вакцинные штаммы, пригодные для массового производства живой полиомиелитной вакцины. В 1954 г. те же методы были использованы для культивирования вируса кори, для получения вакцинного штамма этого вируса и затем для производства живой коревой В.
Метод клеточных культур с успехом используется как для получения новых вакцинных штаммов различных вирусов, так и для усовершенствования существующих.
Еще одним методом получения вакцинных штаммов вирусов является метод, основанный на применении рекомбинации (генетического скрещивания).
Так, напр., оказалось возможным получить рекомбинант, используемый как вакцинный штамм вируса гриппа А при взаимодействии авирулентного мутанта вируса гриппа, содержащего гемагглютинин H2 и нейраминидазу N2, и вирулентного штамма Гонконг, содержащего гемагглютинин H3 и нейраминидазу N2. Полученный рекомбинант содержал гемагглютинин H3 вирулентного вируса Гонконг и сохранил авирулентность мутанта.
Живые бактерийные, вирусные и риккетсиозные В. в последние 20— 25 лет наиболее широко изучаются и внедрены в противоэпидемическую практику в Советском Союзе. Применяются в практике живые В. против туберкулеза, бруцеллеза, туляремии, сибирской язвы, чумы, оспы, полиомиелита, кори, желтой лихорадки, гриппа, клещевого энцефалита, Ку-лихорадки, сыпного тифа. Изучаются живые В. против дизентерии, эпидемического паротита, холеры, брюшного тифа и некоторых других инфекционных болезней.
Методы применения живых В. разнообразны: подкожный (большинство В.), накожный или внутрикожный (В. против оспы, туляремии, чумы, бруцеллеза, сибирской язвы, БЦЖ), интраназальный (вакцина против гриппа); ингаляционный (вакцина против чумы); оральный или энтеральный (вакцина против полиомиелита, в стадии разработки — против дизентерии, брюшного тифа, чумы, некоторых вирусных инфекций). Живые В. при первичной иммунизации вводят однократно, за исключением В. против полиомиелита, где повторная вакцинация связана с введением вакцинных штаммов разных типов. В последние годы все шире изучается метод массовой вакцинации с помощью безыгольных (струйных) инъекторов (см. Инъектор безыгольный).
Основной ценностью живых В. является их высокая иммуногенность. При ряде инфекций, в первую очередь особо опасных (оспа, желтая лихорадка, чума, туляремия), живые В. являются единственным эффективным видом В., т. к. убитыми микробными телами или химическими В. не удается воспроизвести достаточно напряженного иммунитета против этих заболеваний. Реактогенность живых В. в целом не превышает реактогенности других прививочных препаратов. За время многолетнего широкого применения живых В. в СССР не наблюдалось случаев реверсии вирулентных свойств апробированных вакцинных штаммов.
К числу положительных качеств живых В. относятся также однократность их применения и возможность использования разнообразных способов аппликации.
К недостаткам живых Вакцин следует отнести их относительно малую устойчивость при нарушении режима хранения. Эффективность живых В. определяется наличием в них живых вакцинных микробов, а естественное отмирание последних снижает активность В. Однако выпускаемые сухие живые В. при соблюдении температурного режима их хранения (не выше 8°) по срокам годности практически не уступают другим видам В. Недостатком некоторых живых В. (оспенная В., антирабическая) является возможность появления у отдельных привитых индивидуумов неврологических осложнений (см. Поствакцинальные осложнения). Эти поствакцинальные осложнения весьма редки, и их удается в значительной мере избежать при строгом соблюдении технологии приготовления и правил применения названных В.
Убитые вакцины
Убитые В. получают инактивацией патогенных бактерий и вирусов, применяя для этого различные воздействия на культуры физ. или хим. характера. Соответственно фактору, обеспечивающему инактивацию живых микробов, готовят гретые В., формалиновые, ацетоновые, спиртовые, феноловые. Изучаются также другие способы инактивации, напр, ультрафиолетовыми лучами, гамма-излучением, воздействием перекиси водорода и другими хим. агентами. Для получения убитых В. применяют высокопатогенные, полноценные в антигенном отношении штаммы соответствующих видов возбудителей.
По своей эффективности убитые В., как правило, уступают живым, однако некоторые из них имеют достаточно высокую иммуногенность, предохраняя привитых от заболевания или уменьшая тяжесть течения последнего.
Т. к. инактивация микробов упомянутыми выше воздействиями нередко сопровождается значительным снижением иммуногенности В. в связи с денатурацией антигенов, предпринимались многочисленные попытки применения щадящих способов инактивации с прогреванием микробных культур в присутствии сахарозы, молока, коллоидных сред. Однако полученные такими способами АД-вакцины, гала-вакцины и др., не показав существенных преимуществ, не вошли в практику.
В отличие от живых В., большинство которых применяется путем однократной прививки, убитые В. требуют двух или трех прививок. Так, напр., убитую брюшнотифозную В. вводят подкожно дважды с интервалом 25— 30 дней и третью, ревакцинирующую, инъекцию проводят через 6—9 мес. Вакцинацию против коклюша убитой В. проводят трехкратно, внутримышечно, с интервалом 30— 40 дней. Холерную В. вводят дважды.
В СССР применяют убитые В. против брюшного тифа и паратифа В, против холеры, коклюша, лептоспирозов и клещевого энцефалита. В зарубежной практике применяют также убитые В. против гриппа, полиомиелита.
Основным способом введения убитых В. являются подкожные или внутримышечные инъекции препарата. Изучаются методы энтеральной вакцинации против брюшного тифа и холеры.
Преимуществом убитых В. является относительная простота их приготовления, поскольку для этого не требуются специально и длительно изученные вакцинные штаммы, а также сравнительно большая стабильность при хранении. Существенным недостатком этих препаратов является слабая иммуногенность, необходимость повторных инъекций в курсе вакцинации, ограниченность способов аппликации В.
Химические вакцины
Из числа химических В. в СССР применяется брюшнотифозная В. в сочетании с хим. паратифозной В вакциной или со столбнячным анатоксином. Для вакцинации детских контингентов применяют другую хим. вакцину — Vi-антиген брюшнотифозных микробов (см. Vi-антиген).
В зарубежной практике имеет ограниченное применение для иммунизации некоторых профессиональных контингентов хим. сибиреязвенная В., представляющая собой протективный антиген сибиреязвенных бацилл, получаемый в специальных условиях культивирования и сорбированный на геле гидроокиси алюминия. Двукратное введение этой В. создает у привитых иммунитет длительностью 6—7 мес. Повторные ревакцинации приводят к выраженным аллергическим реакциям на прививки.
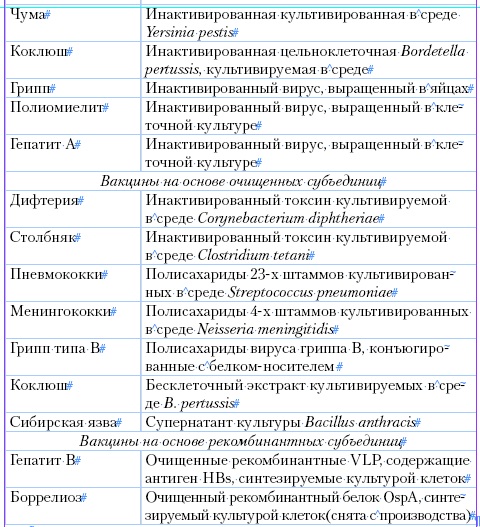
Применяют перечисленные В. для профилактики, т. е. для иммунизации здоровых людей с целью выработки ими иммунитета против того или иного заболевания (см. табл.). Некоторые В. применяют также при терапии хронических инфекционных болезней с целью стимуляции выработки организмом более выраженного специфического иммунитета (см. Вакцинотерапия). Напр., при лечении хрон, бруцеллеза применяют убитую В. (в отличие от живой профилактической В.). М. С. Маргулис, в. д. Соловьев и А. К. Шубладзе предложили лечебную В. против множественного (рассеянного) склероза. Промежуточное положение между профилактическими и лечебными В. занимает антирабическая В., которую применяют для предупреждения заболевания бешенством лиц, зараженных и находящихся в инкубационном периоде. С лечебной целью применяют также аутовакцину (см.), приготовляемую путем инактивации культур микробов, выделенных от больного.

Среди различных микробных препаратов, применяемых для профилактики, лечения и диагностики инфекционных заболеваний большое место занимают вакцины - биопрепараты, предназначенные для создания активного искусственного иммунитета.
В качестве антигенов вакцины могут содержать убитые или живые микробные тела, либо извлеченные из них химическим путем полные антигены -глюцидо-липоидные полипептидные комплексы. В зависимости от количества антигенов различают моно-, ди-, три-, тетра- и поливакцины.
Для изготовления вакцин применяются такие штаммы микробов, которые удовлетворяют требованиям специальных инструкций по отбору, проверке и хранению культур, применяемых для изготовления вакцин. Изучение и апробация штаммов на предмет соответствия их требованиям инструкций производится Государственным контрольным институтом медицинских биологических препаратов, там же они хранятся в музее живых культур как эталонные, от них отвивают дубликаты и рассылают в сопровождении специального паспорта в институты, изготавливающие вакцины, для использования в производстве. В паспортах, сопровождающих такие штаммы, указываются основные их свойства - морфологические, культуральные, биохимические, антигенные.
Штаммы, полученные из контрольного института, используются в производстве вакцин только после проверки на местах. В производственных институтах проводится большая работа по изучению условий стабилизации свойств штаммов, предназначенных для изготовления вакцин. В настоящее время стабильность свойств культур обеспечивается хранением их в высушенном состоянии в условиях вакуума в запаянных ампулах. Бактериальные культуры, кроме того, можно хранить в пробирках на плотной питательной среде, оптимальной для данного вида микроба. Пробирки в этом случае запаивают, либо заливают пробки расплавленным воском или парафином, чтобы предохранить культуру от высыхания при длительном хранении. Штаммы, хранящиеся в лаборатории, регистрируются в специальных журналах, где записывают паспортные данные, а также результаты текущих проверок, регламентируемых инструкциями.
Требования инструкций к производственным штаммам разных видов и различных групп микроорганизмов направлены к одной цели - обеспечению малой реактогенности, полной безвредности и высокой эпидемиологической эффективности приготовленных из них вакцин. Методы определения этих свойств производственных штаммов в зависимости от того, к какому виду микробов они применяются, имеют специфические особенности, которые отражены в специальной части. В принципе иммуногенность их определяется путем выявления устойчивости животных, иммунизированных опытными вакцинами, приготовленными из этих штаммов, к заражению заведомо смертельными дозами соответствующих культур.
Вирулентность штаммов изучается путем заражения чувствительных животных, чаще всего мышей, и характеризуется заведомо смертельными, минимальными смертельными и 50 %-ными смертельными дозами культур испытуемых штаммов.
Для выявления токсичности животным вводится убитая нагреванием культура производственных штаммов.
Конкретные показатели иммуногенности, вирулентности и токсичности для разных видов микробов определяются инструкциями. Штаммы, обладающие меньшей иммуногенностью и вирулентностью или большей токсичностью, чем это установлено инструкцией, для производства вакцин не применяются.
Таблица 1
Основные типы вакцин

Живые вирусные вакцины. Особенности живых вакцин.
Живые вирусные вакцины — это, как правило, искусственно ослабленные посредством культивирования или природные авирулентные либо слабовирулентные иммуногенные штаммы вируса, которые, размножаясь в естественно восприимчивом организме, не проявляют повышения вирулентности и потеряли способность к горизонтальной передаче.
Безопасные высокоиммуногенные живые вакцины являются лучшими из всех существующих вирусных вакцин. Применение многих из них дало блестящие результаты в борьбе с наиболее опасными вирусными болезнями человека и животных. В основе эффективности живых вакцин лежит имитация субклинической инфекции. Живые вакцины вызывают иммунный ответ на каждый протективный антиген вируса.
Основным преимуществом живых вакцин считается активизация всех звеньев иммунной системы, вызывающая сбалансированный иммунный ответ (системный и локальный, иммуноглобулиновый и клеточный). Это имеет особое значение при тех инфекциях, когда клеточный иммунитет играет важную роль, а также при инфекциях слизистых оболочек, где требуется как системный, так и локальный иммунитет. Местное применение живых вакцин обычно является более эффективным для стимулирования локального ответа у непраймированных хозяев, чем инактивированные вакцины, вводимые парентерально.
В идеале, вакцинация должна повторять иммунологические стимулы естественной инфекции, сводя до минимума нежелательные эффекты. Она должна вызывать напряженный продолжительный иммунитет при введении в небольшой дозе. Ее введение, как правило, не должно сопровождаться слабой, кратковременной общей и местной реакцией. Хотя после введения живой вакцины иногда допускается развитие у небольшой части реципиентов отдельных слабовыраженных клинических признаков, напоминающих легкое течение естественной болезни. Живые вакцины больше, чем другие, отвечают этим требованиям и, кроме того, отличаются низкой стоимостью и простотой применения разными способами.
Вакцинные вирусные штаммы должны обладать генетической и фенотипической стабильностью. Их приживляемость в привитом организме должна быть выраженной, а способность к размножению ограниченной. Вакцинные штаммы обладают значительно менее выраженной инвазивностью, чем их вирулентные предшественники. Это связано в значительной мере с их частично ограниченной репликацией в месте проникновения и в органах-мишенях естественного хозяина. Репликация вакцинных штаммов в организме легче ограничивается естественными неспецифическими защитными механизмами. Вакцинные штаммы размножаются в привитом организме до тех пор, пока его защитные механизмы не затормозят их развитие.
В течение этого времени образуется такое количество антигена, которое значительно превышает его при введении с инактивированной вакциной.
Для аттенуации вирусов обычно применяют пассажи вируса в неестественном хозяине или культуре клеток, пассажи при пониженной температуре и мутагенез с последующей селекцией мутантов с измененным фенотипом.
Большинство современных живых вакцин, используемых для профилактики инфекционных болезней человека и животных, получены пассажами вирулентного вируса в гетерологичном хозяине (животные, куриные эмбрионы, различные клеточные культуры). Аттенуированные в чужеродном организме вирусы приобретают множественные мутации в геноме, препятствующие реверсии вирулентных свойств.
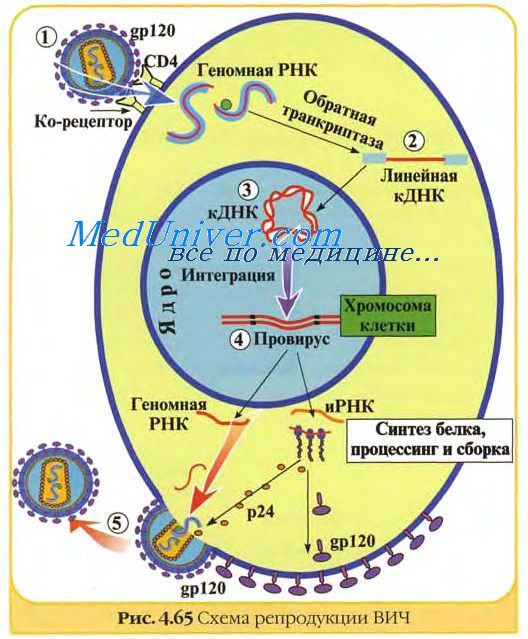
В настоящее время в практике широко применяют живые вакцины против многих вирусных заболеваний человека (полиомиелит, желтая лихорадка, грипп, корь, краснуха, паротит и др.) и животных (чума крупного рогатого скота, свиней, плотоядных, бешенство, герпес-, пикорна-, коронавирусные и другие болезни). Однако еще не удалось получить эффективных вакцин против ряда вирусных болезней человека (СПИД, парагрипп, респираторно-синциальная инфекция, денгевирусная инфекция и другие) и животных (африканская чума свиней, инфекционная анемия лошадей и другие).
Имеется много примеров тому, что традиционные методы аттенуации вирусов еще не исчерпали своих возможностей и продолжают играть существенную роль в разработке живых вакцин. Однако их значение постепенно уменьшается по мере увеличения масштабов использования новой технологии конструирования вакцинных штаммов. Несмотря на значительный прогресс в этой области, принципы получения живых вирусных вакцин, заложенные Л. Пастером, до сих пор не потеряли своей актуальности.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Вакцинопрофилактика. Вирусные вакцины.
Вакцинопрофилактика по праву считается одним из крупнейших достижений биологии. Характерная черта развития биологии на современном этапе — стремительное преодоление расстояния, отделяющего фундаментальные открытия от их практического применения. Этот процесс наиболее отчетливо проявляется в области разработки средств специфической профилактики вирусных заболеваний. В настоящее время трудно назвать область биологической науки, где бы столь быстро и эффективно использовались новейшие достижения.
Благодаря этому в последние годы достигнуты большие успехи в области вакцинопрофилактики многих опасных вирусных заболеваний. С помощью глобальной вакцино профилактики во всем мире искоренена натуральная оспа человека (1979 г.) существует эффективный контроль ряда опасных вирусных заболеваний людей (полиомиелит, корь, грипп, бешенство, гепатиты и др.) и животных (ящур, чума свиней, чума жвачных и плотоядных, болезнь Марека, ньюкаслская болезнь и др.).
Достаточно сказать, что на сегодняшний день практически нет эпидемий и эпизоотии вирусной этиологии. Создание высокоэффективных вакцин и широкомасштабных методов их производства позволили разработать национальные и международные программы контроля и искоренения ряда вирусных заболеваний человека и животных.
Профилактика многих вирусных болезней животных достигла исключительно широких масштабов и стала неотъемлемой частью технологии ведения животноводства, особенно на индустриальной основе. Например, инактивированную вакцину против ящура и живую вакцину против ньюкаслской болезни изготовляют в количестве, исчисляемом многими миллиардами доз. Предотвращенный экономический ущерб, благодаря применению вакцин, достигает огромных размеров. Только отмена прививок против оспы людей в связи с ликвидацией болезни позволило сэкономить многие миллиарды долларов США.
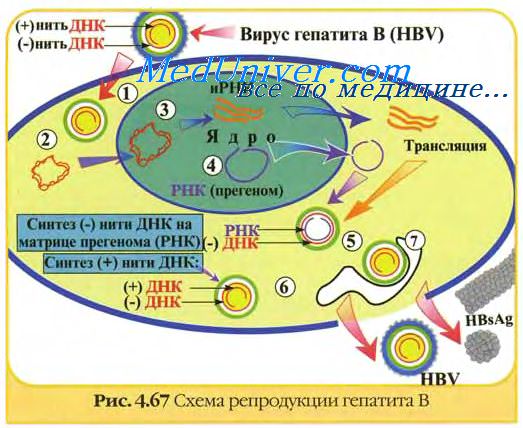
В настоящее время в медицинской и ветеринарной практике широко применяют живые и инактивированные вакцины, производство которых основывается на современных достижениях биологической науки и технологических разработках. Производство и методы контроля таких препаратов стали достаточно сложными и трудоемкими, значительно возросло их качество и безопасность применения. У живых вакцин основные трудности связаны с получением стабильного иммуногенного вакцинного штамма вируса и разработкой методов его контроля. При изготовлении инактивированных вакцин основной проблемой является получение большого количества безопасного вирусного антигена, по возможности в неденатурированном и концентрированном виде. Существует большое разнообразие в способах изготовления живых и инактивированных вакцин. Важное значение придается стандартности вирусных вакцин, в связи с чем постоянно совершенствуются методы контроля и ужесточаются требования к готовому препарату. В живой вакцине вирус сохраняет потенциальную способность изменяться в сторону снижения антигенности или повышения реактогенности или даже вирулентности.
В культуре клеток и куринных эмбрионах, используемых в качестве субстратов для размножения вакцинных вирусных штаммов, могут присутствовать другие, трудно обнаруживаемые вирусы, загрязняющие вакцину. В инакти-вированной вакцине вирус может быть обезврежен не полностью, а ее производство таит в себе опасность попадания возбудителя во внешнюю среду. Кроме вирусных частиц и продуктов вирусспецифического синтеза с инактивированной вакциной в организм поступает масса иммунологически активных балластных клеточных белков и чужеродных нуклеиновых кислот, что крайне нежелательно.
Успехи в области изучения функциональной роли вирусных структур открывают принципиально новые возможности для создания и усовершенствования вакцин. Установлено, что иммунный ответ при вирусных инфекциях направлен не на вирус как таковой, и даже не на вирусный белок, а лишь на небольшое количество антигенных детерминант, представляющих не всю белковую молекулу, а только отдельные участки. С учетом этого разрабатываются вакцины из вирусных компонентов, получаемых путем расщепления вирусных частиц или выделением из инфицированных вирусом клеток, либо генно-инженерными методами.
Достигнутый уровень разработки эффективных препаратов не снимет проблемы их совершенствования и создания вирусных вакцин нового поколения на основе достижений биотехнологии.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

