Aeromonas salmonicida инфекции у человека
Обновлено: 25.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Цитомегаловирус: причины появления, симптомы, диагностика и способы лечения.
Определение
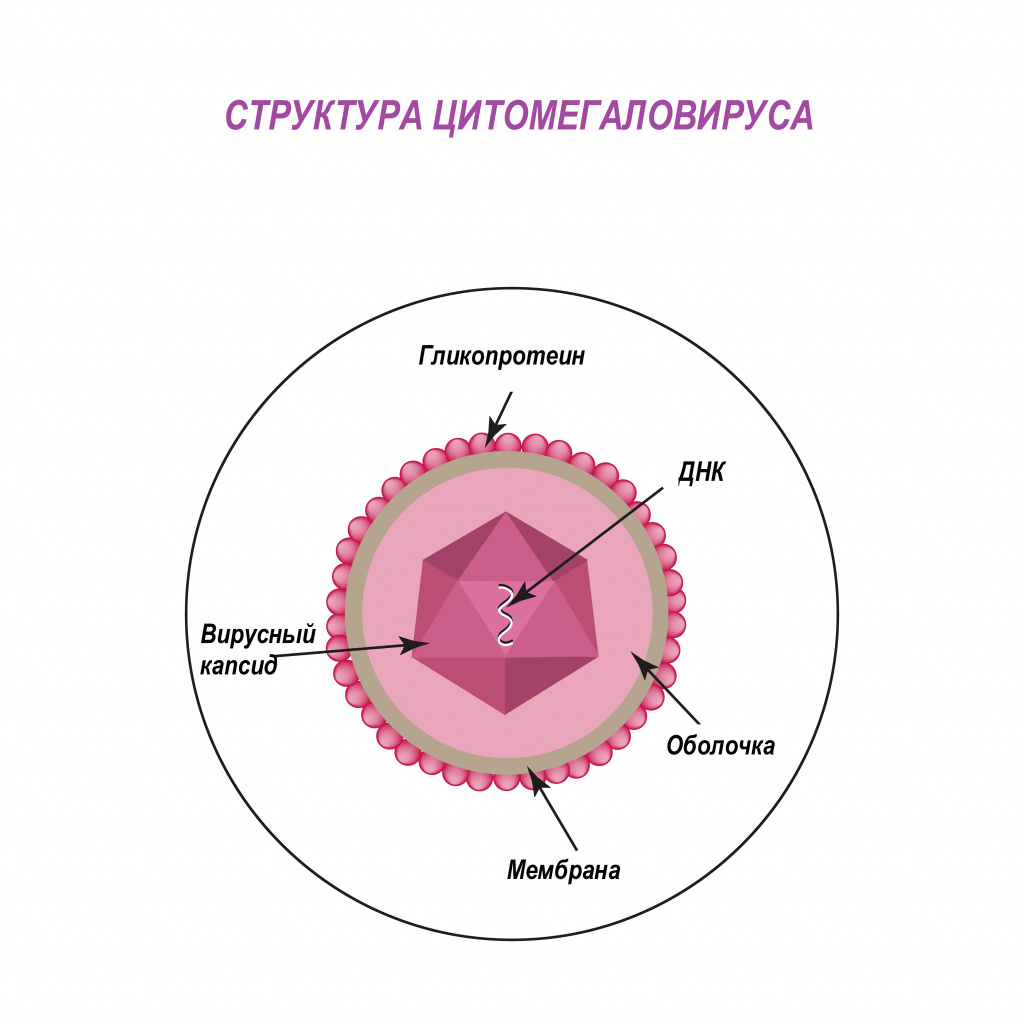
Цитомегаловирус (ЦМВ, или цитомегаловирусная болезнь) – хроническое инфекционное заболевание вирусной этиологии, характеризующееся многообразием клинических форм и проявлений - от бессимптомного течения до тяжелого поражения внутренних органов и центральной нервной системы. Возбудитель ЦМВ – представитель семейства герпесвирусов (вирус герпеса человека 5-го типа).
Попадая в клетки организма, цитомегаловирус способен оставаться в них пожизненно. У лиц с нормально функционирующей иммунной системой в подавляющем большинстве случаев инфекция протекает по типу вирусоносительства. При угнетении иммунитета вирус активизируется, вызывая клинические симптомы болезни.
По различным данным доля носителей цитомегаловируса в России составляет порядка 73-90% - то есть именно у такого количества людей выявляются антитела к ЦМВ.
Причины появления цитомегаловирусной болезни
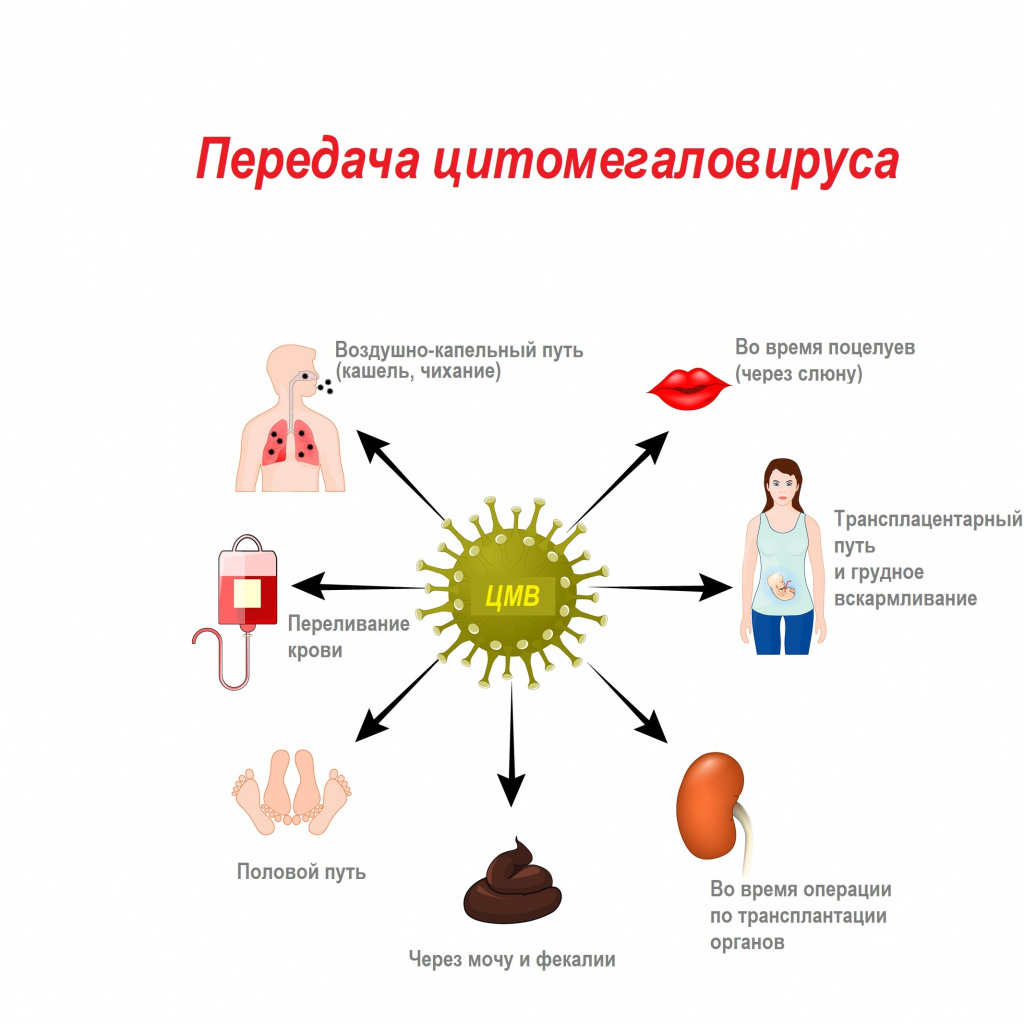
Цитомегаловирус передается через биологические жидкости: слюну, мочу, кровь, вагинальный секрет, слезы, сперму, фекалии, грудное молоко.
Из-за лабильности возбудителя и низкой концентрации вируса в выделениях для передачи инфекции необходим длительный, частый и тесный контакт с носителем.
Механизмы передачи вируса — воздушно-капельный (аэрозольный путь), контактный (контактно-бытовой и половой), гемоконтактный (парентеральный, а также при пересадке органов), вертикальный (от матери к плоду), фекально-оральный (алиментарный — через грудное молоко).
Заражение плода реализуется за счет трансплацентарной передачи от матери к плоду, которая возможна в течение всей беременности. Наибольшую опасность для плода представляет первичная инфекция на ранних сроках беременности, поскольку часто вызывает формирование врожденных пороков развития.
Особое свойство ЦМВ — способность вызывать депрессию практически всех звеньев иммунитета, резко угнетать продукцию интерферонов, в первую очередь ИНФ-α. При острой инфекции вирус поражает преимущественно эпителиальные клетки легких, печени, кишечника, почек, мочевого пузыря, молочных и слюнных желез, генитального тракта. Цитомегаловирус может инфицировать нервные клетки, клетки гладкой мускулатуры, костного мозга.
Классификация заболевания
По характеру инфицирования:
- врожденное (внутриутробное),
- постнатальное (приобретенное).
- латентная инфекция,
- персистирующая инфекция,
- активная (низкой, средней, высокой степени тяжести) инфекция.
- острая инфекция,
- реактивация вируса,
- реинфекция.
Инкубационный период цитомегаловирусной болезни составляет от 15 дней до трех месяцев (при манифестной, выраженной форме заболевания). Однако чаще первичное инфицирование протекает или бессимптомно, или по типу легкой формы ОРЗ – у пациента наблюдаются незначительная слабость, лихорадка (температура 37,1-38,0°С), дискомфорт в мышцах, першение в горле, иногда насморк, увеличение шейных лимфатических узлов, болезненность слюнных желез, головная боль, отсутствие аппетита.
У беременных острая первичная инфекция протекает, как правило, бессимптомно (25–50%) или с неспецифическими проявлениями (с лихорадкой, астенией и головной болью).
В редких случаях развиваются гепато- и спленомегалия, гепатит с минимальной степенью активности цитолитического синдрома, дерматиты, васкулиты, интерстициальный пневмонический процесс, тромбоцитоз или тромбоцитопения, лимфоцитоз.
У больных с иммунодефицитом цитомегаловирусная инфекция протекает тяжело - вирус быстро распространяется по организму и вызывает серьезные осложнения.
Диагностика цитомегаловируса
Диагностические мероприятия начинаются со сбора жалоб и анамнеза, в том числе акушерско-гинекологического анамнеза матери.
Затем врач проводит объективное обследование (физикальное, неврологическое и антропометрическое).
Лабораторные исследования - общие и специфические:
-
общий анализ крови;
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Синонимы: Анализ крови на антитела к цитомегаловирусу; АТ-ЦМВ-IgМ; цитомегаловирусная инфекция; ЦМВ-инфекция; специфические иммуноглобулины класса М к цитомегаловирусу. Cytomegalovirus; CMV Antibody; IgM; CMV infection; CMV-specific IgM. Краткое описание исследования Anti-CMV.
Синонимы: Анализ крови на антитела к цитомегаловирусу; АТ-ЦМВ-IgG; Цитомегаловирусная инфекция; ЦМВ-инфекция; Специфические иммуноглобулины класса G к цитомегаловирусу. Cytomegalovirus; CMV Antibody, IgG; CMV infection; CMV-specific IgG. Краткое описание исследования Anti-CMV-IgG .
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирусная инфекция входит в группу репродуктивно значимых инфекций, обозначаемых как TORCH-комплекс (название образовано начальными буквами в латинских наименованиях - Toxoplasma, Rubella, Cytomegalovirus, Herpes); первичное инфицирование данными возбудителями, либо обострение .
К каким врачам обращаться
С первичными жалобами пациенты обращаются к врачу-терапевту или врачу общей практики (семейному врачу), детей ведет врач-педиатр . Могут потребоваться консультации инфекциониста - для верификации диагноза, стоматолога - при поражениях слизистой оболочки рта, кардиолога - при наличии врожденного порока сердца, нейрохирурга - при пороках центральной нервной системы, невропатолога - для оценки неврологической патологии, гематолога - при выраженных гематологических изменениях и геморрагическом синдроме, окулиста - для исследования глазного дна, отоларинголога - для исследования слухового аппарата.
Лечение цитомегаловирусной болезни
Субклинические формы ЦМВ-инфекции и латентное носительство крайне распространены, поэтому в большинстве случаев не требуют специфической терапии даже при выявлении антител. Их лечение направлено на усиление защитных сил организма при помощи иммуномодуляторов и профилактику факторов риска, которые приводят к обострению заболевания.
Для терапии клинически активных форм инфекции применяют:
- комплекс патогенетической (противовирусной) терапии, который разрабатывается профильными специалистами и включает препараты прямого противовирусного действия для минимизации риска осложнений, сокращения времени течения заболевания, а также профилактики рецидивов;
- иммунотерапию – антицитомегаловирусный иммуноглобулин назначают преимущественно детям при манифестных формах заболевания и беременным;
- дезинтоксикационную терапию, которая направлена на купирование синдрома интоксикации;
- метаболическую терапию - для восстановления обмена веществ в организме;
- симптоматическую терапию - для купирования воспалительных и токсических проявлений заболевания.
Проблема клинически выраженной инфекции актуальна для лиц, имеющих иммуносупрессию иной природы, в частности, онкогематологических пациентов, больных лучевой болезнью, лиц, длительно принимающих кортикостероидную, туберкулостатическую терапию, а также перенесших ожоговую травму.
Острое течение ЦМВ может привести к развитию гепатита с повышением уровня аминотрансфераз и атипичным лимфоцитозом.
Ученые предполагают роль цитомегаловируса как одного из кофакторов в развитии системных васкулитов, хронических диссеминированных заболеваний легких (в частности, фиброзирующего альвеолита), криоглобулинемии, опухолевых процессов (аденокарциномы предстательной железы, аденокарциномы толстой кишки, рака шейки матки), атеросклероза, кардиомиопатии, детского церебрального паралича, эпилепсии, синдрома Гийена-Барре, синдрома хронической усталости, аутизма.
Первичное инфицирование цитомагаловирусом у беременных женщин существенно повышает риск преждевременных родов, самопроизвольного выкидыша, многоводия, замершей беременности, внутриутробного инфицирования и даже гибели плода. Врожденная ЦМВ-инфекция может стать триггерным фактором развития тяжелых генерализованных форм и инвалидизирующих исходов заболевания, таких как потеря слуха, зрения, умственная отсталость, микроцефалия, судорожный синдром и пр. Такие пожизненные проблемы со здоровьем развиваются примерно у каждого пятого ребенка с врожденной цитомегаловирусной инфекцией.
Профилактика цитомегаловирусной болезни
Женщинам, планирующим беременность, необходимо пройти обследование на наличие ЦМВ. При обнаружении вируса важно получить консультацию врача-иммунолога.
Профилактика или превентивное лечение (активный мониторинг пациентов по уровню вирусной нагрузки и назначение противовирусных препаратов пациентам с признаками инфекции) являются эффективными способами предотвращения развития цитомегаловирусной инфекции после трансплантации органов.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Что такое сальмонеллез? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Сальмонеллёз — это острое инфекционное заболевание желудочно-кишечного тракта с возможностью дальнейшей генерализации процесса (распространением заболевания по всему организму). Причина развития сальмонеллёза — различные серотипы бактерий рода Salmonella. К клиническим характеристикам сальмонеллёза относят синдром общей инфекционной интоксикации, синдром поражения желудочно-кишечного тракта (гастрит, энтерит), синдром обезвоживания, гепатолиенальный синдром (увелечение печени и/или селезёнки) и иногда синдром экзантемы (высыпания).
Возбудитель
семейство — кишечные бактерии (Enterobacteriaceae)
род — Сальмонелла (Salmonella)
Существует 7 подвидов (более 2500 сероваров). Наиболее актуальные серовары: typhimurium, enteritidis, panama, london.
Представлены следующей антигенной структурой:
- О-антиген (соматический, термостабильный);
- H-антиген (жгутиковый, термолабильный);
- К-антиген (поверхностный, капсульный);
- Vi-антиген (антиген вирулентности — степень способности штамма вызвать заболевание; является компонентом О антигена);
- М-антиген (слизистый).
К факторам патогенности (механизмам приспособления бактерий) относятся:
- холероподобный энтротоксин — интенсивная секреция жидкости в просвет кишки;
- эндотоксин (липополисахарид) — общее проявление интоксикации;
- инвазия — заражение.
Тинкториальные свойства: разлагают глюкозу и маннит, образовывая кислоту и газ, продуцируют сероводород. Грамм-отрицательные палочки подвижны, спор и капсул не образуют. Растут на обычных питательных средах, образуя прозрачные колонии, на мясо-пептонном агаре с образованием колоний голубоватого цвета, на среде Эндо образуют прозрачные розовые колонии, на среде Плоскирева — бесцветные мутные, на висмут-сульфитном агаре — чёрные с металлическим блеском.
Высокоустойчивы во внешней среде (без агрессивных воздействий), активно размножаются в мясе и молоке (до 20 суток), в воде сохраняют жизнесособность до 5 мес., в почве — до 9 мес., в комнатной пыли — до 6 мес., в колбасе — до 1 мес., в яйцах — до 3 мес., в фекалиях сохраняются до 4 лет. При 56 °C погибают через 3 минуты, при кипячении мгновенно. Сальмонеллы, которые находятся в куске мяса массой 400 гр и толщиной до 9 см, погибают при его варке за 3,5 часа. Соление и копчение оставляет сальмонелл в живых. Воздействие кислот и хлорсодержащих дезинфицирующих средств вызывает их гибель. В последнее десятилетие появились штаммы сальмонелл, устойчивые ко многим антимикробным препаратам. [2] [5]
Эпидемиология
Зооантропоноз, распространённый повсеместно.
Источники инфекции: домашние животные (сами не болеют), птицы, человек (больной и носитель).
Резервуары инфекции и причина эпидемических вспышек сальмонеллеза: грызуны, дикие птицы, тараканы, улитки, лягушки, змеи.
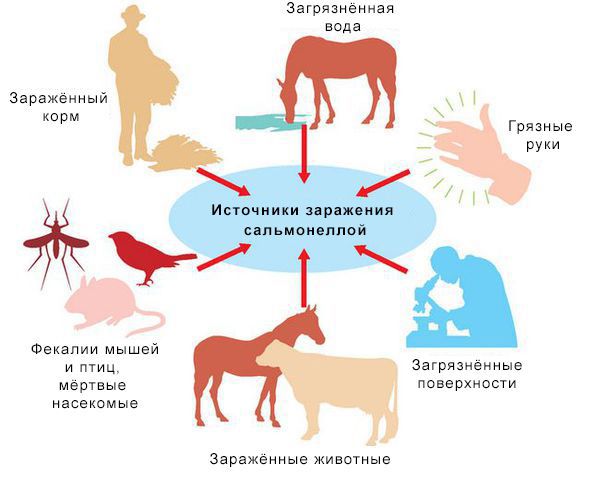
Механизм передачи: фекально-оральный (пути — алиментарный, т. е. через органы ЖКТ, водный, контактно-бытовой). В основном источниками заражения являются птицы, яйца и молочные продукты. Инфицирующая доза 10*5-10*8 микробных тел.
Факторы риска
- детский возраст до 5 лет;
- возраст до 12 месяцев, особенно высока вероятность заболеть без грудного вскармливания;
- иммунодефицит (в основном у младенцев и лиц старше 65 лет, а так же у пациентов с ВИЧ в стадии СПИДа, принимающих иммунодепрессивные препараты);
- регулярный приём препаратов, снижающих кислотность желудка;
- употребление сырого и недостаточно термически обработанного мяса, молочных продуктов и яиц;
- частый контакт с животными с несоблюдением правил гигиены;
- посещение стран с низким уровнем жизни.
В России в 2016 г. заболеваемость была – 26 на 100 тыс. населения, у детей в до 14 лет – 71 на 100 тыс. Для сравнения в США среднегодовая заболеваемость — 15 на 100 тыс. (1,35 миллиона заболеваний, 26 500 госпитализаций и 420 смертей ежегодно). Иммунитет строго типоспецифичен (возможно многократное инфицирование различными штаммами) и непродолжителен [2] [6] [9] [10] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы сальмонеллеза
Инкубационный период — от 6 часов (при алиментарном заражении) до 3 суток. При внутрибрюшном заражении (искусственно) — до 8 дней.
Начало заболевания острое (т. е. развитие основных синдромов происходит в первые сутки заболевания).
Aeromonas - это род грамотрицательных , факультативно-анаэробных палочковидных бактерий, которые морфологически напоминают представителей семейства Enterobacteriaceae . Большинство из 14 описанных видов были связаны с заболеваниями человека. Наиболее важными патогенами являются A. hydrophila , A. caviae и A. veronii biovar sobria . Эти организмы повсеместно распространены в пресной и солоноватой воде. [2]
Они группируются с гамма-подклассом протеобактерий. [3]
Два основных заболевания, связанных с Aeromonas, - это гастроэнтерит и раневые инфекции с бактериемией или без нее . Гастроэнтерит обычно возникает после употребления загрязненной воды или пищи, тогда как раневые инфекции возникают в результате контакта с зараженной водой. В наиболее тяжелой форме Aeromonas spp. может вызвать некротический фасциит , опасный для жизни, обычно требующий лечения антибиотиками и даже ампутации. [4]
Хотя некоторые потенциальные факторы вирулентности (например, эндотоксины , гемолизины , энтеротоксины , факторы приверженности) были идентифицированы, их точная роль неизвестна. Виды Aeromonas вызывают:
- оппортунистическое системное заболевание у пациентов с ослабленным иммунитетом
- диарейное заболевание у здоровых людей
- раневые инфекции
Содержание
Если автоматизированные машины не используют самую последнюю базу данных, Elizabethkingia meningoseptica может быть ошибочно принята за Aeromonas salmonicida .
Есть литература по этому вопросу, но во многих работах недостаточно изучена причинная роль штамма (ов) Aeromonas , выделенных из изученных случаев. Наличие штамма Aeromonas в образце фекалий не доказывает и даже не подразумевает, что штамм вызывал диарею. Заболевания желудочно-кишечного тракта у детей обычно являются острыми и тяжелыми заболеваниями, тогда как у взрослых заболевание чаще бывает хронической диареей. Тяжелый гастроэнтерит, вызванный Aeromonas, напоминает шигеллез с кровью и лейкоцитами в стуле. Острое диарейное заболевание купируется самостоятельно, больным показана только поддерживающая терапия.
Раневые инфекции - второй по распространенности тип инфекции человека, связанный с Aeromonas . [5] Они связаны с проникающими ранами или ссадинами, которые приводят к контакту раны с пресной водой или почвой. [5]
Aeromonas виды эндосимбионты из медицинской пиявки , вид пиявки , который FDA обсуждение и для использования в сосудистой хирургии , такие как пересадка кожи и закрылки . [6] [7] Aeromonas помогает пиявкам переваривать пищу из крови. [8] Использование H. medicinalis после операции привело к инфекциям Aeromonas , чаще всего A. veronii . [6] Это может проявляться как местный целлюлит , но может прогрессировать до подкожного абсцесса и сепсиса . [6]
Виды Aeromonas также были связаны с пневмонией после случаев почти утопления , особенно в пресной воде. [9] Чаще всего об этом сообщалось в отношении A. hydrophila , хотя возможности клинических лабораторий правильно идентифицировать виды Aeromonas были ограничены. [9] Пневмония Aeromonas из-за эпизодов почти утопления часто осложняется бактериемией и смертью. [9]
Название Aeromonas происходит от
греч. Aer, eros (ἀήρ, ἀέρος), воздух, газ; и -monas | monas (μονάς), единица, монада; газовая (-производящая) монада. [10]
Члены рода Aeromonas можно назвать аэромонадами (то есть упрощение названий ).
Aeromonas salmonicida - патогенная бактерия, которая серьезно поражает популяции лососевых и другие виды . Впервые он был обнаружен в инкубатории баварской форели Эммерихом и Вайбелем в 1894 году. [1] Способность Aeromonas salmonicida инфицировать множество хозяев, размножаться и адаптироваться делает его одной из основных вирулентных бактерий. A. salmonicida является этиологическим агентом фурункулеза , заболевания, вызывающего сепсис , кровотечения, поражения мышц, воспаление нижнего отдела кишечника, увеличение селезенки и смерть популяций пресноводных рыб. Встречается по всему миру, за исключением Южной Америки. [1] Основной путь заражения - плохое качество воды; однако это также может быть связано с факторами стресса, такими как перенаселенность, высокие температуры и травмы. Нерестовые и тлеющие рыбы являются основными жертвами фурункулеза из-за своего иммунодефицитного состояния.
СОДЕРЖАНИЕ
Aeromonas salmonicida - грамотрицательная, факультативно анаэробная неподвижная бактерия. Он имеет форму стержня, размером примерно 1,3–2,0 на 0,8–1,3 мкм и оптимально растет при температуре от 22 до 25 ° C. [1] Бактерия легко ферментирует и окисляет глюкозу и является положительной по отношению к каталазе и цитохромоксидазе. Его молекулярные свойства включают специальный поверхностный белковый массив, называемый А-слоем, который, как считается, отвечает за вирулентные свойства бактерии, и липополисахарид, основной антиген клеточной оболочки. [2] А-слой состоит из белка массой 50 кДа и обеспечивает защиту бактерии. Липополисахарид состоит из трех частей: липида A, основного олигосахарида и O -полисахарид (О-антиген). Внеклеточные продукты A. salmonicida состоят из 25 белков, ферментов, токсинов и многих других. [2] Кроме того, геном состоит из одной кольцевой хромосомы (4,702,402 п.н.) с двумя большими и тремя маленькими плазмидами. Хромосома дает 58,5% пар G + C, содержит 4086 кодирующих белков и всего 4388 генов. [3]
Изоляты A. salmonicida процветают при выращивании на кровяном агаре или тирозине. Большие колонии наблюдаются вместе с коричневым диффундирующим пигментом в течение двух-четырех дней. Большинство типичных штаммов морфологически и биохимически однородны, за некоторыми исключениями. Некоторые из этих исключений включают заметные различия в производстве пигментов, способность бактерий сбраживать выбранные сахара и результаты анализа Фогеса-Проскауэра.
A. salmonicida является факультативным анаэробом , что означает, что он способен производить АТФ путем аэробного дыхания, если присутствует кислород , но также способен переключаться на ферментацию, когда кислорода нет. Он не ферментирует сахарозу или лактозу , используя глюкозу. вместо этого на этом пути; ферментация глюкозы создает газ. Бактерия оптимально растет при температуре от 22 до 25 ° C. Максимальная температура, при которой он может расти, составляет 34,5 ° C. Примерно после 24-часового периода роста колонии бактерий достигают размера булавочной головки. Колонии также имеют коричневый пигментный цвет, который появляется после 48–72 часов роста. [4]
- Лосось
- Форель
- Карповые
- Щука
- Окунь
- Bullheads
- Палтус
- Палтус
A. salmonicida , переносимый по воздуху патоген, может перемещаться на 104 см от своего хозяина в атмосферу и обратно в воду [5], что затрудняет контроль. Бактерия может сохранять патогенность в пресноводных условиях в течение 6–9 месяцев [6] и в условиях соленой воды до 10 дней без хозяина. Несколько методов прямого подсчета и других методов обнаружения показали, что организм не теряет и не снижает концентрацию титра. [7]
Передача фурункулеза в основном происходит при контакте рыбы с рыбой через кожу или через рот. Было обнаружено, что радужная форель является переносчиком A. salmonicida в течение двух лет после первоначального заражения без повторного контакта. У рыб с химическим иммунодефицитом по сравнению с рыбами, подвергшимися температурному стрессу, смертность составила 73% против 33%, соответственно. [8] При естественных инфекциях форели уровень смертности составлял 5–6% в неделю с уровнем смертности 85% среди необработанных популяций. Некоторые выжившие после клинического фурункулеза инфицированной популяции форели стали носителями A. salmonicida . [9] При сравнении эпидемии фурункулеза с пониженным уровнем кислорода, когда концентрация кислорода снижалась до менее 5 мг / л, Концентрация A. salmonicida увеличилась. [10] При наблюдении за кетой при плотности 14,7 особи на квадратный метр 12,4% были инфицированы A. salmonicida , тогда как при плотности 4,9 особи на квадратный метр инфекция отсутствовала. [11] Кроме того, концентрации A. salmonicida были значительно повышены в воде с низким содержанием растворенного кислорода (6–7 мг / л) по сравнению с водой с более высоким содержанием растворенного кислорода (10 мг / л). Вода с высокой плотностью и низким содержанием кислорода привела к выживаемости, которая была примерно на 40% меньше, чем в воде с низкой плотностью и высоким содержанием кислорода.
Бактерия патогенна для рыб и вызывает заболевание, известное как фурункулез. [12] Симптомы, проявляемые рыбой, включают внешнее и внутреннее кровотечение , опухание вентиляционных отверстий и почек , фурункулы , язвы , разжижение и гастроэнтерит . Фурункулез широко известен как хвостовая гниль у рыб и часто встречается у золотых рыбок и кои . Зараженные рыбы с открытыми язвами способны передать болезнь другим рыбам. [4]
Это также одна из нескольких бактерий, которые могут вызывать болезнь лысых морских ежей . [13] Поскольку A. salmonicida не может расти при 37 ° C, он не является патогенным для человека. [14]
Фурункулез подразделяется на четыре категории в зависимости от степени тяжести: острый, подострый, хронический или латентный. Когда рыба заражена, она становится вялой и слабой до самой смерти. Другие наблюдаемые характеристики включают анорексию и летаргические движения, и они могут иметь темный пигмент. Также могут возникать глубокие или неглубокие язвы, экзофтальм , кровянистые пятна, вздутие живота и петехии у основания плавника. Внутри инфицированная рыба может страдать от гастроэнтерита , геморрагической сепсиса , отека почек и увеличения селезенки. Печень может казаться бледной, а селезенка может потемнеть. Полость брюшины также может быть кровоточащей и воспаленной.
Чтобы точно идентифицировать заболевание, необходимо изолировать бактерии. Изоляты извлекают из поражений мышц, почек, селезенки или печени, а затем выращивают на триптиказо-соевом агаре и среде для инфузии мозг-сердце, инкубированной при 20-25 ° C. Колонии A. salmonicida кажутся твердыми, рыхлыми, гладкими, мягкими и темными.
В то время как культуральные процедуры дают хорошие результаты, серологические процедуры дают более быстрые результаты при использовании агглютинации сыворотки, флуоресцентных антител или иммуноферментного анализа на инфицированной ткани или культивируемых бактериях. [15] Муни и др. [16] разработали ДНК-зонд с полимеразной цепной реакцией для обнаружения ДНК A. salmonicida ; результаты были успешными у 88% дикого атлантического лосося.
Bacillus hydrophilus fuscus Sanarelli 1871
Bacillus hydrophilus Chester 1901
Proteus hydrophilus (Chester 1901) Bergey et al. 1923
Bacterium hydrophilum (Chester 1901) Weldin and Levine 1923
Pseudomonas hydrophila (Chester 1901) Breed et al. 1948 г.

Aeromonas hydrophila является гетеротрофные , грамотрицательные , палочковидные бактерии основном в районах с теплым климатом. Эта бактерия обитает в пресной или солоноватой воде. Он может выжить в аэробной и анаэробной среде и может переваривать такие материалы, как желатин и гемоглобин . A. hydrophila была выделена от людей и животных в 1950-х годах. Это самый известный из видов Aeromonas . Он устойчив к большинству распространенных антибиотиков, холоду и положителен на оксидазу и индол. У Aeromonas hydrophila также есть симбиотический взаимосвязь с кишечной флорой некоторых пиявок, таких как Hirudo medicinalis . [1]
СОДЕРЖАНИЕ
Бактерии Aeromonas hydrophila представляют собой грамотрицательные прямые палочки с закругленными концами (форма от бацилл до кокциб) обычно составляет от 0,3 до 1,0 мкм в ширину и от 1,0 до 3,0 мкм в длину. Они могут расти при температуре до 4 ° C. Эти бактерии передвигаются по полярному жгутику .
Из-за своей структуры он очень токсичен для многих организмов. Попадая в тело жертвы, он с кровотоком попадает в первый доступный орган. Он производит аэролизин , цитотоксический энтеротоксин, который может вызывать повреждение тканей. A. hydrophila , A. caviae и A. sobria считаются условно-патогенными микроорганизмами, то есть они редко заражают здоровых людей. A. hydrophila широко считается основным патогеном рыб и земноводных [2], и его патогенность для человека была признана десятилетиями. [3] Геномные идеи аэромонад могут стать ступенькой к их пониманию [4]
Считалось, что патогенность видов Aeromonas опосредована рядом внеклеточных белков, таких как аэролизин, липаза, хитиназа, амилаза, желатиназа, гемолизины и энтеротоксины. Однако патогенетические механизмы неизвестны. Недавно предложенная система секреции типа III (T3SS) была связана с Aeromonas. патогенез. T3SS - это специализированный механизм секреции белка, который экспортирует факторы вирулентности непосредственно в клетки-хозяева. Эти факторы нарушают нормальные функции клетки-хозяина в пользу вторжения бактерий. В отличие от общего секреторного пути, T3SS запускается, когда патоген вступает в контакт с клетками-хозяевами. Токсин АДФ-рибозилирования является одной из эффекторных молекул, секретируемых несколькими патогенными бактериями, которые транслоцируются через T3SS и доставляются в цитоплазму хозяина, что приводит к прерыванию пути NF-κB, повреждению цитоскелета и апоптозу. Этот токсин был охарактеризован у A. hydrophila (диарейный изолят человека), A. salmonicida (патоген рыб) и A. jandaei. GV17, патогенный штамм, который может вызывать заболевания как у людей, так и у рыб.
Инфекции Aeromonas hydrophila чаще всего возникают при смене пола , стрессовых факторах , изменении температуры, в загрязненной окружающей среде и когда организм уже инфицирован вирусом или другой бактерией. Он также может попадать в организм через пищевые продукты, зараженные бактериями, такие как морепродукты, мясо и даже некоторые овощи, например, ростки. Также может передаваться пиявками. [5]
Aeromonas hydrophila не так патогенна для человека, как для рыб и земноводных. Одно из заболеваний, которое он может вызвать у людей, гастроэнтерит , чаще всего встречается у маленьких детей и людей с ослабленной иммунной системой или проблемами роста. Эта бактерия связана с двумя типами гастроэнтерита. Первый тип - это заболевание, похожее на холеру , которое вызывает диарею из рисовой воды. Другой тип - дизентерийный гастроэнтерит, при котором жидкий стул наполнен кровью и слизью. Дизентерийный гастроэнтерит является наиболее тяжелым из двух типов и может длиться несколько недель. A. hydrophila также связана с целлюлитом . Он также вызывает такие заболевания, как мионекроз. и экзема у людей с ослабленной или подавленной (с помощью лекарств) иммунной системой. [6] В очень редких случаях A. hydrophila может вызывать некротический фасциит . [7]
Aeromonas hydrophila можно устранить с помощью 1% раствора гипохлорита натрия или 2% раствора гипохлорита кальция .
Brage et al., 1990 рекомендуют введение фторхинолона в качестве профилактического лечения во время применения медицинской пиявки. [9]
Антибиотики, такие как хлорамфеникол , флорфеникол , тетрациклин , сульфонамид , производные нитрофурана и пиридинкарбоновые кислоты , используются для устранения и контроля инфекции A. hydrophila .
Террамицин добавляется в корм для рыб во время работы инкубатория в качестве еще одного химиотерапевтического агента для предотвращения A. hydrophila .
Читайте также:

