Антисептик для кишечная палочка
Обновлено: 05.05.2024
Проблема острых кишечных инфекций является одной из актуальнейших в отечественном здравоохранении. С одной стороны, уровень заболеваемости остается достаточно высоким, без тенденции к отчетливому снижению, с другой – отмечается появление сероваров, обусловливающих тяжелое течение болезни (S. flexneri 2a, энтерогеморрагическая эшерихия OI57 и др.). Кроме того, получают широкое распространение кишечные инфекции, которые прежде не диагностировались или встречались редко (ротавирусный гастроэнтерит, клебсиеллез и др.).
К сожалению, в лечении острых кишечных инфекций допускается много ошибок, порожденных недостаточной квалификацией специалистов; отжившими догматическими представлениями о сущности патологического процесса; погоней за рекламой суперсовременных лекарственных средств; непониманием сущности регидратационной терапии, прежде всего оральной.
Крайне важно, чтобы практические врачи осознали все опасности, возникающие при развитии кишечного дисбактериоза в случае бесцельного, а порой бесконтрольного применения антибиотиков, особенно при лечении сальмонеллеза и пищевых токсикоинфекций. В лечении острых кишечных инфекций появились новые подходы, основной акцент делается на патогенетическую терапию.
Одной из целей патогенетической терапии острых кишечных инфекций является купирование диарейного синдрома. Предложено множество антидиарейных препаратов, при использовании которых должны учитываться патогенетические особенности указанного синдрома.
Известно, что циклические нуклеотиды способствуют регуляции секреции воды и электролитов в кишечнике. По современным представлениям эндотоксины сальмонелл воздействуют на аденилатциклазу, находящуюся на наружной поверхности мембран энтероцитов. В результате активации аденилатциклазы усиливается образование циклического аденозинмонофосфата (цАМФ). Изменения мембранных белков и биполяризация клеток мембран способствуют повышению проницаемости последних для воды и электролитов, что ведет к диарее. Определенная роль в изменении проницаемости клеточных мембран принадлежит простагландинам, функционально связанным с циклическими нуклеотидами, что приводит к повышенному образованию цАМФ и развитию диареи. Таким образом, избыток гуморального регулятора обмена может стать фактором патогенеза болезни. В связи с этим было предложено использовать индометацин при диарейном синдроме в качестве ингибитора биосинтеза простагландинов.
Рекомендуется так же применение карболонга – порошка из активированных косточковых углей. Он обладает высокими сорбционными свойствами. Его назначают по 5–10 г на прием 3 раза в день.
Одним из эффективных сорбентов является полифепан. Препарат получают при переработке лигнина – продукта гидролиза углеводных компонентов древесины. Выпускается в виде гранул (содержит 40% полифепана) или пасты (50% полифепана). Назначают внутрь взрослым по 1 столовой ложке 3–4 раза в день; перед употреблением препарат тщательно размешивают в течение 2 мин в стакане воды.
Наиболее эффективным сорбентом является диосмектит. Кроме того, диосмектит обладает значительной обволакивающей способностью. Известна способность диосмектита защищать эпителий кишечных ворсинок от разрушения. Препарат выпускается в виде порошка в пакетах, содержащих 3 г лекарственного средства. Содержимое пакета растворяют в 100 мл воды и размешивают. Взрослому рекомендуют принимать 3–4 пакета (9–12 г) в день. Препарат не имеет противопоказаний к применению, его можно назначать беременным и кормящим матерям. При тяжелом течении сахарного диабета применение диосмектита опасно, так как в 1 пакетике содержится 0,75 г глюкозы.
К группе сорбентов относится аттапульгит. Препарат выпускается в таблетках. Начальная доза для взрослого – 2 таблетки, затем назначают по 2 таблетки после каждого акта дефекации. Максимальная суточная доза – 12 таблеток, максимальная продолжительность лечения 2 дня.
Другой группой антидиарейных препаратов являются лекарственные средства, оказывающие опиоидное действие. К ним относят лоперамид и тримебутан. Способность тормозить перистальтику кишечника является характерной особенностью опиатов. Действие лоперамида наступает быстро и продолжается 4–6 ч. Его назначают взрослым при острой диарее, вначале 2 капсулы, а затем по 1 капсуле после каждого акта дефекации, но не более 6 капсул в сутки. Не рекомендуется применение препарата вместе с атропинсодержащими средствами. Лоперамид противопоказан беременным и кормящим грудью женщинам, а также больным неспецифическим язвенным колитом. Группа атропинсодержаших антидиарейных препаратов представлена двумя лекарственными средствами – лиспафеном и реасеком.
Лиспафен уменьшает секрецию желез, понижает тонус гладкой мускулатуры и двигательную активность желудка и кишечника. Взрослым назначают по 2 таблетки 3 раза в день, максимальная суточная доза – 12 таблеток. Реасек назначают по 1 таблетке 2–3 раза в день. К указанной группе препаратов относится тримебутин малеат. В 1 таблетке содержится 100 мг препарата. Тримебутан оказывает положительное действие на регуляцию перистальтики кишечника. При гиперкинетическом состоянии он оказывает спазмолитическое, при гипокинетическом – стимулирующее действие. Воздействует на гладкую мускулатуру всего желудочно–кишечного тракта. Лечебный эффект основан на нормализации моторики кишки, применяется по 1–2 таблетки 3 раза в день. Противопоказан беременным и кормящим грудью женщинам.
В группу лекарственных средств, обладающих обволакивающим и вяжущим свойствами, входит порошок Кассирского и десмол. Антидиарейный порошок (состав: Bismuti subnitrici 0,5; Dermatoli 0,3; Calcii carbonici I 0; Ac. ascorbinici 0,3; Ac. nicotinici 0,01) назначают по 1 порошку 3–4 раза в день.
В отдельных случаях тяжелого течения диареи используются большие дозы висмута – по 2 г 3 раза в сутки. В последние годы для лечения острых диарейных заболеваний успешно применяют висмута субсалицилат, одна таблетка препарата содержит 262 мг активного вещества. Препарат принимают по 2 таблетки 3–4 раза в день. Он оказывает обволакивающее и противовоспалительное действие, повышает выработку слизи и улучшает ее защитные свойства. Наш опыт применения висмута субсалицилата подтверждает эффективность препарата.
Новым средством для лечения диареи, оказывающим патогенетическое воздействие на процессы всасывания и секрецию в кишечнике, является октреотид. Этот гормон увеличивает скорость всасывания воды и электролитов в тонкой кишке, снижает концентрацию вазоактивных пептидов в крови, уменьшает частоту актов дефекации и массу кала. Выпускается в виде свободного пептида – оректида в ампулах, содержащих 0,05, 0,1 и 0,5 мг. Вводится подкожно 1–2 раза в сутки; при необходимости дозу препарата увеличивают.
Проблема дисбактериоза и эубиотики
Острые кишечные инфекции сопровождаются развитием дисбактериоза, либо это состояние развивается после применения антибиотиков. Лечение больных, страдающих кишечным дисбактериозом, требует комплекса терапевтических мер и индивидуально подобранных препаратов с учетом заболевания, на фоне которого возник дисбактериоз. В комплекс терапии дисбактериоза кишечника необходимо включать средства для нормализации кишечной флоры и курс лечения антибактериальными препаратами при появлении патогенной флоры.
Схема лечения дисбактериоза с учетом стадии заболевания:
I стадия – назначение биопрепаратов и лекарств, нормализующих моторную функцию кишечника (спазмолитики, вяжущие, ферменты), а также витаминов и противоаллергических средств;
II стадия –тактика такая же, как в I стадии, но добавляется колибактерин. При отсутствии эффекта через 3–4 недели назначают невиграмон или нитроксалин;
Ill–IV стадии –назначение поливалентного бактериофага, после отмены которого используют ко–тримоксазол (часто в сочетании с метронидазолом); при отсутствии эффекта назначают антибиотики. Одновременно с антибиотиками применяют биопрепараты.
Нормализация кишечной флоры осуществляется эубиотиками. Различают четыре поколения эубиотиков, применяемых для лечения дисбактериоза: I – классические эубиотики (коли–бактерин, бифидумбактерин, лактобактерин); II – самоэлиминирующиеся эубиотики (бактисубтил, биоспорин, споробактерин); III – комбинированные эубиотики (Аципол и др.); IV поколение – иммобилизованные на сорбенте живые бактерии, представители нормальной микрофлоры – бифидумбактерин форте.
Эффективность эубиотиков определяется биологическими свойствами штаммов микроорганизмов: колонизирующей способностью, антимикробной активностью, особенностью воздействия на иммунную систему и другие защитные механизмы [5].
Аципол – эубиотик III поколения, представляющий собой биомассу, состоящую из смеси живых антагонистических активных штаммов ацидофильных лактобацилл и инактивированных прогреванием кефирных грибков. Препарат оказывает многофакторное лечебное действие, отличается высокой активностью в отношении патогенной и условно–патогенной флоры, корригирует нормальную микрофлору кишечника, повышает иммунологическую резистентность организма. Аципол принимают по 1 таблетке 3 раза в сутки вместе с пищей.
Эубиотики обычно назначают в сочетании с ферментами (абомин, ораза, фестал и др.) и антигистаминными препаратами (пипольфен, хлоропирамин, клемастин).
При стафилококковом дисбактериозе лечение обязательно должно включать применение стафилококкового бактериофага. В тяжелых случаях целесообразно назначать антибиотики (оксациллин, цефалоспорины I и II поколений, карбопенемы, ванкомицин, рифампицин) и фторхинолоны.
При протейном дисбактериозе используют поливалентный бактериофаг (протейный, стафилококковый, синегнойный), в тяжелых случаях – антибиотики (ампициллин, карбенициллин, цефалоспорины I и II поколений), в более легких – ко–тримоксазол–480 и полимиксин М.
При синегнойном дисбактериозе используют полимиксин В, тетрациклин, рифампицин, лонгацеф.
В случаях энтеробактериального или бактериоидного дисбактериоза целесообразно применение цефалексина или цефадина, при клостридиозе – метронидазола и ко–тримоксазол–480.
При дисбактериозе эшерихиозной этиологии рекомендуются препараты висмута, а при заболеваниях, обусловленных гемолитическими штаммами – лактобактерин. Антибактериальная терапия осуществляется невиграмоном, нитроксалином, ко–тримоксазолом–480, энтероседивом. Иногда дает эффект коли–бактериофаг.
Для борьбы с дисбактериозом кишечника рекомендуют применение нормазе. Этот препарат представляет собой раствор лактулозы (дисахарид) из молекул галактозы и фруктозы. Способность лактулозы стимулировать рост лактобацилл в толстой кишке, в то же время снижая концентрацию гнилостных бактерий, позволяет восстановить нормальный биоценоз в кишечнике. Продукты метаболизма нормазе стимулируют перистальтику. Суточная доза нормазе для взрослых – 75 мл. Длительность лечения 2–3 недели.
В целях восстановления и профилактики нарушений микроэкологии кишечника в последние годы был предложен пищевой биококтейль (NK). Этот препарат по существу является эубиотиком. При острой диарее его рекомендуют принимать по 2–3 столовые ложки каждые 3–4 ч в течение 1–2 дней, а затем по 1–2 столовые ложки 3 раза в день в течение 1–3 месяцев. При иммунодефицитах, нарушениях обмена и длительной антибиотикотерапии принимают по 1 столовой ложке 2–3 раза в день в течение 1–3 месяцев. Эубиотики обычно назначают в сочетании с ферментами (абомин, ораза, фестал, дигестал, мезим и др.) и антигистаминными препаратами.
В последние годы широкую популярность приобрели ферментные препараты креон и панцитрат–10000. Каждая капсула креона содержит 300 мг панкреатина в микросферах, устойчивых к желудочному соку, что соответствует 8000 ед. липазы, 9000 ед. амилазы и 4500 ед. протеазы. Вначале принимают по 1–2 капсулы во время еды, а затем дневную дозу увеличивают до 3–15 капсул. Активным веществом панцитрата–10000 является панкреатин. Одна капсула препарата содержит 10000 ед. липазы, 9000 ед. амилазы и 500 ед. протеазы. Обычная дозировка препарата – по 2–4 капсулы во время каждого приема пищи.
Этиотропное лечение острых кишечных инфекций
Кишечные антисептики
В настоящее время применяются три препарата этой группы: интестопан, интетрикс и энтероседив.
В последние годы для лечения диарейных заболеваний предложен эрцефурил (нифураксазид), являющийся производным нитрофурана. Этот препарат действует преимущественно в просвете кишечника, показан при лечении диареи бактериального происхождения. По данным исследователей, он активен в отношении кампилобактерий, эшерихий (энтеротоксигенных, энтеропатогенных и энтероинвазивных), сальмонелл, шигелл, холерного вибриона и иерсиний (J. enterocolitica).
Популярным препаратом этой группы является фуразолидон. Препарат эффективен в отношении грамположительных и грамотрицательных бактерий, лямблий и трихомонад. Из числа возбудителей острых кишечных инфекций наиболее чувствительны к нему бактерии дизентерии, брюшного тифа, паратифов А и В. Устойчивость к нему микроорганизмов развивается медленно. Фуразолидон был рекомендован к применению в качестве препарата выбора для лечения острой дизентерии, так как он оказывает минимальное побочное действие на организм, особенно на желудочно–кишечный тракт.
Эффективность лечения острых кишечных инфекций вышеуказанными группами лекарственных средств различна. Терапия кишечными антисептиками всегда носит вспомогательный характер.
Антибиотики и другие антибактериальные препараты
Для лечения острых кишечных инфекций используются различные антибактериальные средства: 1) b–лактамные антибиотики: пенициллины природные, пенициллины полусинтетические, ингибиторы b–лактамаз, цефалоспорины I – IV поколений, карбапенемы, монобактамы; 2) антибиотики других классов: аминогликозиды, тетрациклины, макролиды, рифампицины, линкозамины, хлорамфеникол, полимиксины, гликопептиды; 3) синтетические антибактериальные средства: сульфаниламиды, хинолоны, фторхинолоны, нитрофураны, производные хиноксалина, производные 8–оксихинолина.
Учитывая, что в большинстве случаев острые кишечные инфекции вызываются грамотрицательными микроорганизмами, целесообразно привести перечень антибактериальных средств, действующих на них бактерицидно или бактериостатически: аминопенициллины, цефалоспорины, монобактамы, карбапенемы, аминогликозиды, тетрациклины, хлорамфеникол, полимиксины, хинолоны, фторхинолоны, нитрофураны, комбинированные препараты сульфамидов с триметопримом.
При неосложненном течении острых кишечных инфекций нешигеллезной и нехолерной этиологии лечение должно быть только патогенетическим. В тяжелых случаях особенно при наличии тяжелых фоновых и сопутствующих заболеваний, целесообразно использование кишечных антисептиков. К сожалению, до сегодняшнего дня антибиотики широко применяются для лечения острых кишечных инфекций, что способствует развитию дисбактериоза и более медленной репарации слизистой оболочки кишечника. Нет единства взглядов и на лечение сальмонеллеза. Наша точка зрения, основанная на многолетнем опыте лечения острых кишечных инфекций, заключается в том, что должна проводиться только патогенетическая терапия. Это относится и к гастроинтестинальной форме сальмонеллеза. Единственным исключением является генерализованная форма сальмонеллеза, при которой показана антибиотикотерапия. Мы также резко отрицательно относимся к использованию антибиотиков для лечения носительства при острых кишечных инфекциях.
Таким образом, лечение острых кишечных инфекций направлено на поддержание деятельности ряда функциональных систем, в том числе систем, обеспечивающих уровень АД, массу циркулирующей крови, поддержание оптимальных величин дыхательных показателей, уровня осмотического давления и системы выделения. Используя современные подходы в лечении острых кишечных инфекций, можно избежать развития таких грозных осложнений, как инфекционно–токсический шок, гиповолемический шок, острая почечная недостаточность. Аккуратность и рациональность в применении антибактериальной терапии позволяет избавить наших пациентов от дисбактериоза, адекватно проведенная пероральная регидротация в короткие сроки справляется с основными симптомами острых кишечных инфекций.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Врага, как известно, надо знать в лицо. Просторы интернета принесли вот такое симпатичное фото нашего противника.
Данного возбудителя невозможно перепутать ни с чем, особенно, когда процесс зашел далеко. Практически все отделение будет в курсе наличия такого больного из-за непередаваемого аромата, разносящегося из его пораженных областей.
Pseudomonas aeruginosa бывает дикой, ее нам приносят пациенты из внешнего мира и нашей, госпитальной, которая живет внутри больничных отделений (чаще хирургических и реанимационных) и вызывает тот самый суеверный ужас практически у всех, обремененных медицинским образованием.
Синегнойная палочка является вольным жителем тех мест, где тепло и влажно. Она живет в прудах (дикая), в раковинах, в банках с фурацилином и другими дезенфектантами, диализных жидкостях и наркозных аппаратах в стационарах.
А потому, если в отделение что-то такое выросло, борьба с синегнойной инфекцией должна начинаться со смены сантехники (старой на новую) и линолеума вокруг раковины. С отказа от фурацилина, со сроком изготовления более суток и с просушивания трубок аппаратуры для вентиляции легких.
Больной у нас тоже теплый и, как и любой человек, на 70% состоит из воды. А еще у него множество вольных открытых пространства – мокнущие раневые поверхности, ожоговые раны, свищевые ходы, пролежни, цистостомы, трахеостомы, катетеры. То есть все те условия, которые палочка очень любит. А еще теплой и влажной поверхностью у нас является роговица глаза и если промедлить с лечением – этот самый глаз можно потерять за несколько часов.
- Гангренозную пневмонию
- Эмпиему
- Наружный отит
- Инфекции глаз (особенно после травм и хирургических вмешательств)
- Фурункулез (после горячих ванн)
- Септицемию
- Эндокардит
- Менингит
- Часто инфицирует ожоговые поверхности, свищевые ходы, изъязвленные пролежни.
Синегнойная инфекция развивается чаще всего на фоне иммуносупрессии или массированной антимикробной терапии, так как сам возбудитель природно устойчив абсолютному большинству антибактериальных препаратов, а массовая гибель конкурентов, дает ей селективное преимущество. Кстати, основными препаратами, селектирующими в отделениях Pseudomonas aeruginosa являются цефалоспорины третьего и четвертого поколений.
- на руках
- на общих полотенцах в ординаторских, процедурных и манипуляционных (многоразовых)
- на фонендоскопах
- на мобильных телефонах
- на авторучках, которые у нас торчат из карманов и т.д.
И достаточно в отделении появиться одному пациенту с этим возбудителем, а персоналу забыть о путях распространения – к вечеру все 100% пациентов будут обсеменены этим возбудителем. А дальше как повезет… пациентам…
Если инфицирование все-таки произошло, и у пациента возникла синегнойная инфекция, чем же мы будем ее лечить?
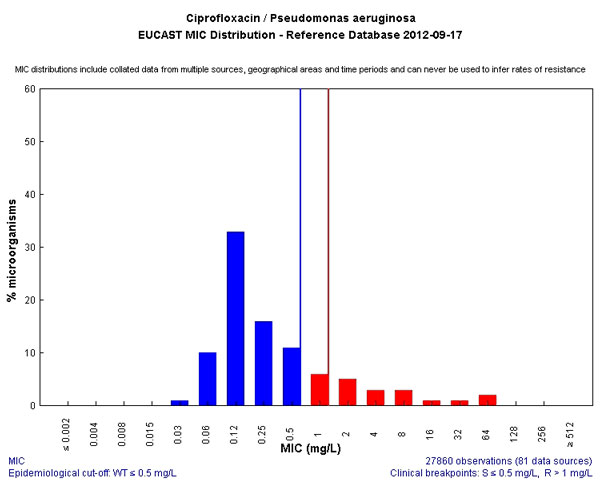
В этом списке нет цефоперазона и цефоперазона/сульбактама, о которых нам с института говорят, что они антисинегнойные. Дело в том, что единственным действительно антисинегнойным цефалоспорином является цефтазидим, а данные о якобы высокой чувствительности к цефоперазону и цефоперазону сульбактаму существуют только в России, так как нет ни одной рекомендации по использованию этих препаратов ни в США, ни на medscape.com, ни на EUCAST. Более того, эти источники не дают даже критериев определения чувствительности Pseudomonas aeruginosa к этим препаратам. И откуда взялись наши российские выводы о высокой чувствительности вообще не понятно. Более того, комбинация Цефоперазон/сульбактам существует только в 2-х странах – России и Турции. FDA в свое время очень быстро отменила его регистрацию.
Цефалоспорин третьего поколения. Препарат с явной и очень высокой антисинегнойной активностью. Первые несколько лет после появления он был самым мощным препаратом против грам(-) флоры. Однако в связи с увеличением количества как госпитальных, так и внебольничных беталактамаз расширенного спектра (БЛРС), его значение было пересмотрено и сейчас он используется в качестве индикатора для выявления БЛРС у грам(-) бактерий. Проще говоря, если кишечная палочка или клебсиелла устойчивы к цефтаздиму, то любой, сколь угодно большой диаметр зоны на чашке Петри вокруг диска с цефотаксимом или цефтриаксоном в расчет уже не принимаются.
Если антибиотикограммы еще нет, но есть пациент предлеченный цефтазидимом без эффекта, то не нужно выбирать ему препарат среди III генерации цефалоспоринов, по причине того, что использование их будет бесполезным, при этом, если пациента с грамотрицательной инфекцией лечили цефалоспоринами 2-3-й генерации, то вполне допустима терапия цефтазидимом, потому что, во-первых, он активен против синегнойки, а во вторых бета-лактамаза цефуроксимаза, рушит все цефалоспорины, но не цефтазидим.
Еще одной особенностью цефтазидима является его возможность создавать высокие концентрации в ликворе, проникая через гематоэнцефалический барьер, поэтому его используют для лечения менингитов, вызванных грамотрицательной микрофлорой, при условии чувствительности к нему возбудителей.
3. Карбопенемы обладают антисинегнойной активностью, но она слабее чем у цефтазидима и анисинегнойными они стали только из-за того, что существует Эртапенем, у которого нет никакой антисинегнойной активности. Да, применять можно, но только в комбинации с другими антисинегнойными препаратами.
4. Амикацин, как и все аминогликозиды, обладает более мощным бактерицидным действием, чем бета-лактамы и минимальным количеством аллергических реакций. Но он должен нами рассматриваться, как и другие антисинегнойные препараты, как препарат резерва и не использоваться широко в стационаре. Другие аминогликозиды прекрасно отработают Гр (-) флору и без него, нам важно сохранить чувствительность нашей, местной синегнойки к нему как можно дольше.
Дозируем амикацин, как вы помните, на килограмм массы тела и детям и взрослым и обязательно с учетом клиренса креатинина. (подробнее о дозировании смотрите обзорную статью по аминогликозидам, которая располагается по этой ссылке /vracham/Informatsiya-dlya-spetsialistov/Antibiotikoterapiya/Obzory-antibiotikov-razlichnyh-grupp/Obzory-antibiotikov-razlichnyh-grupp_411.html)
И, к сожалению, препарат, который нам скоро уничтожат коллеги из поликлинического звена, потому что назначают его направо и налево. Да и в стационарах коллеги грешат его необоснованным назначением, так как он относительно дешев и более чем доступен из-за огромного количества дженериков. Как результат, нам уже приходится использовать дозировки не 400 мг в сутки, а 800-1200 мг. И, слава богу, что механизм резистентности нам это еще позволяет. Является одним из самых безопасных антисинегнойных препаратов, а потому беречь его мы должны как самое дорогое.
Он может использоваться в стационаре в случаях не синегнойной инфекции только тогда, когда другим способом помочь пациенту невозможно.
Это препарат такого же глубокого резерва как амикацин. И может использоваться только под контролем клинического фармаколога в отличие от других фторхинолонов.
И один из самых страшных моих, и не только моих, кошмаров – это панрезистентная синегнойная палочка. Это та палочка которая устойчива абсолютно ко всем известным на данный момент антимикробным средствам и здесь мы совершенно бессильны. А потому наша основная цель состоит в том, чтобы не дать ей у нас в стационаре появиться. Для этого требуется соблюдать несложные правила асептики, а именно, мыть и обрабатывать руки после каждого пациента, менять перчатки, обрабатывать фонендоскопы и к пациентам с гнойным воспалением не заходить с мобильниками и чем либо еще, что мы можем схватить руками, сами того не замечая. Ну и никаких общих полотенец в ординаторских и сестренских.
Этой статьей мы начинаем рассмотрение представителей микробиологического мира, с которыми чаще всего встречаем в ежедневной клинической практике, и темой сегодняшнего разговора будет кишечная палочка, она же Escherichia coli (E.coli).
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С.,
врач – клинический фармаколог
Этой статьей мы начинаем рассмотрение представителей микробиологического мира, с которыми чаще всего встречаем в ежедневной клинической практике, и темой сегодняшнего разговора будет кишечная палочка, она же Escherichia coli (E.coli).
Микробиологические аспекты
E.coli относится к типичным представителям семейства Enterobacteriaceae, являясь грамотрицательной бактерией, факультативным анаэробом в составе нормальной кишечной микрофлоры человека. Но тут же становится патогеном, выбравшись из среды нормального обитания, хотя отдельные штаммы являются патогенными и для желудочно-кишечного тракта. То есть кишечная палочка относится к кишечным комменсалам, кишечным патогенам и внекишечным патогенам, каждый из которых мы кратко разберем.
К штаммам E.coli, действующим как кишечные патогены и встречающимся чаще других, относятся:
- Штамм серотипа O157:H7 (STEC O157) или так называемый энтерогеморрагический штамм E.coli, который является причиной 90% случаев геморрагических колитов и 10% случаев гемолитико-уремического синдрома. Встречается достаточно часто, а если вы работаете в стационарах плановой помощи, то это один из обязательных анализов для принятия решения о госпитализации, так что так или иначе он на слуху. Проблема инфицирования этим возбудителем связана с употреблением плохо термически обработанной пищи и передачи штамма контактным путем от человека к человеку, проще говоря, через руки.
- Второй крайне опасный высоко-патогенный штамм кишечной палочки – O104:H4, вызвавший в Германии 2011 году эпидемию с высоким уровнем смертности среди пациентов с пищевыми токсико-инфекциями вследствие развития гемолитико-уремического синдрома. Если помните, это была очень громкая история с перекрытиями границ для испанских огурцов, потом вообще для всей плодоовощной продукции из Европы в Россию, пока искали хотя бы источник, не говоря уж о виновнике тех событий. Окончательно виновными тогда были обозначены листья салата, в поливе которых использовалась вода с признаками фекального заражения, а затем речь пошла уже о пророщенных семенах, которые так же полили фекально-зараженной водичкой. Так вышли на конкретный штамм E.coli – O104:H4, который, подвергшись санации антибиотиком, выплескивает эндотоксин, вызывающий гемолиз и острую почечную недостаточность. В итоге – массовая летальность пациентов, получавших антибиотики.
Затем тот же штамм обнаружился при вспышке ПТИ в Финляндии, но к тому времени пациентов с диареями до появления микробиологических результатов перестали лечить бактерицидными антибиотиками и ситуация была купирована в зародыше.
И третий громкий (для нашей страны) случай – это массовое заболевание питерских школьников в Грузии, где так же был выявлен этот штамм (пресс-релиз Роспотребнадзора по данному случаю лежит здесь).
Когда кишечная палочка выступает внекишечным патогенном? Почти всегда, когда обнаруживается вне места своего нормального обитания.
- Заболевания мочевыводящий путей. Здесь E.coli является абсолютным лидером и играет ведущую роль в развитии:
- Острых циститов
- Пиелонефритов
- Абсцессов почек и
- Простатитов
Этот факт объясняется близким анатомическим расположением двух систем и огрехами в личной гигиене, что позволяет на этапе эмпирической терапии вышеперечисленных заболеваний сразу же назначать препараты, активные в отношении кишечной палочки.
- Заболевания желудочно-кишечного тракта:
- Диарея путешественников
- Интраабдоминальные абсцессы и перитониты, чаще всего носящие вторичный характер (прободение кишки в результате первичного заболевания, либо при дефектах оперативного вмешательства)
- Инфекции центральной нервной системы у очень ослабленных пациентов, результатом чего будет развитие менингитов. Встречается в основном у лиц старческого возраста и новорожденных. Кроме того, в случае внутрибольничного заражения менингит может развиться в результате плохой обработки рук медицинского персонала перед оперативным вмешательством или перевязками.
- Инфекции кровотока, а именно сепсис, как продолжение развития заболеваний мочевыводящих путей, ЖКТ и билиарного тракта вследствие метастазирования очага инфекции. Лечению поддается крайне тяжело, особенно если задействованы внутрибольничные штаммы, летальность чрезвычайно высокая.
- Инфекции кожи и мягких тканейкак следствие раневых инфекций после вмешательств на органах брюшной полости.
- Внутрибольничные пневмонии, вызванные устойчивыми штаммами кишечной палочки, целиком связаны с дефектами ухода за пациентом и фактором чистоты, точнее ее отсутствия, рук медицинского персонала или ухаживающих родственников. Факт внутрибольничного заражения доказывается элементарно, что будет наглядно продемонстрировано в следующем разделе.
- Послеродовые (и не только) эндометриты. Вынуждены упомянуть и эту патологию, так как инфицирование кишечной палочкой встречается все чаще и чаще, а большой настороженности нет. Как результат, можно очень сильно промахнуться с антибактериальной терапией и, как следствие, прийти к экстирпации органа в виду неэффективности антибиотикотерапии. Натолкнуть на мысль может более позднее, чем обычно, поступление и более агрессивное, чем обычно течение. Дополнительный осмотр прианальной области так же может натолкнуть на вероятность развития именно такого инфицирования.
(часть вторая) Практические вопросы диагностики и лечения.
Когда мы можем заподозрить, что перед нами пациент с инфекцией, вызванной кишечной палочкой?
- Пациенты с диареей, приехавшие из отпуска и все-таки смогшие прийти на прием (диарея путешественников или энтеротоксигенные штаммы E.coli).
- Пациенты со всеми заболеваниями мочевыделительной системы, в том числе беременные, но строго с наличием симптоматики (не надо лечить бессимптомную бактериурию, иначе вырастите резистентные штаммы и создадите проблему и себе, и женщине, и роддому в последующем).
- В стационарах – нозокомиальные пневмонии, послеоперационные менингиты, перитониты, сепсисы и т. д., носящие вторичный характер.
Подтвердить или полностью исключить кишечную палочку из возбудителей может только микробиологическое исследование. Конечно, в современных условиях микробиология уже становится практически эксклюзивом, но мы пришли учиться, а учится надо на правильных примерах, поэтому далее будет рассмотрен ряд антибиотикограмм, выполненных автоматизированными системами тестирования. Вдруг вам повезет, и в вашем лечебном учреждении все уже есть или в ближайшее время будет, а вы уже умеете с этим всем работать?
Если вы читаете данный цикл по порядку, то в базовом разделе по микробиологии был выложен ряд антибиотикограмм некоего микроорганизма в контексте нарастания антибиотикорезистентности, и это была наша сегодняшняя героиня – кишечная палочка.
- Начнем с дикого и крайне симпатичного штамма E.coli, который живет в кишечнике и обеспечивает синтез витамина К. С ним сталкиваются доктора амбулаторной службы у пациентов с инфекциями мочевыводящих путей или в случае госпитализации у пациентов, которые не получали антибиотики около года. И именно такую чувствительность мы имеем в виду, когда назначаем эмпирическую антибиотикотерапию
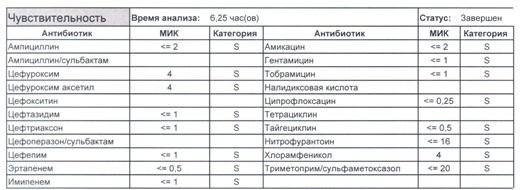
- Как видите, зверь чувствителен абсолютно ко всему, и это как раз тот случай, когда можно свободно пользоваться табличными материалами справочников или клинических рекомендаций, так как механизмы резистентности полностью отсутствуют.
- Если в ваши руки попал пациент, которого в течение последнего полугодия лечили антибиотиками пенициллинового ряда, то антибиотикограмма может выглядеть следующим образом.
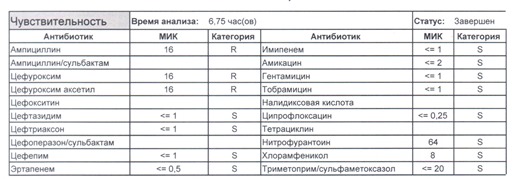
Если такая кишечная палочка окажется внекишечным патогенном, и перед вами будет беременная и ИМП (самый частый случай), то нам необходимо преодолеть резистентность к пенициллинам, то есть подавить деятельность пенициллиназ. Соответственно высокую эффективность продемонстрируют препараты с ингибиторами бета-лактамаз, чаще всего амоксициллина/клавуланат, как наиболее безопасный и эффективный. Единственное, пациентку необходимо предупредить, что в результате стимуляции рецепторов кишечника может развиться антибиотик-ассоциированная диарея.
- Отдельно хотелось бы обратить внимание на следующий штамм E.coli, как типичного обладателя бета-лактамаз расширенного спектра. И эти БЛРС чаще всего вырабатываются в результате неуемного использования цефалоспоринов третьего поколения и совершенно конкретного его представителя – цефтриаксона.
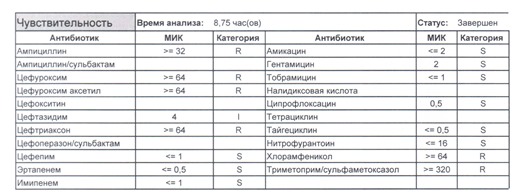
В каких ситуациях мы можем увидеть (или подумать) о таком звере:
- Пациент сам рассказывает, что получал цефтриаксон в промежутке полугодия
- Пациент был переведен из другого стационара (хотя там можно будет и следующую картинку обнаружить)
- Пациент ничего не получал, и вообще в больнице не лежал, но возбудитель попал с рук медицинского персонала, вызвав внутрибольничную инфекцию
- И самый простой случай – посев был взят в момент проведения терапии цефтриаксоном
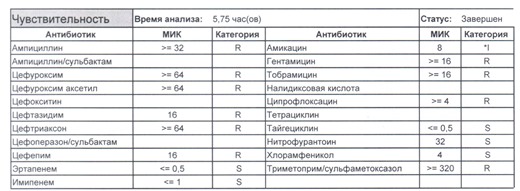
Подобный пациент не придет к вам своими ногами, его не увидит амбулаторная служба, это абсолютно стационарные больные, и если их привезут, то только из другого лечебного учреждения. Чаще всего это пациенты палат интенсивной терапии или реанимации, и такой возбудитель носит на 100% нозокомиальный характер.
Когда можем его обнаружить:
- вторичные перитониты,
- нозокомиальные пневмонии,
- пиелонефриты,
- послеоперационные менингиты,
- сепсис и т. п.
- Для эрадикации такого возбудителя нужен не просто отдельный обученный специалист и имеющая весь набор препаратов резерва аптека, но и напряженная работа эпидемиологической службы, так как подобный пациент должен быть изолирован в отдельную палату, а лучше изолятор (не подумайте, что бред – при правильной организации такие вещи вполне реальны) с проведением карантинных мероприятий, так как основная проблема появления подобного рода возбудителей в том, что они очень быстро разбегаются по всему корпусу (или стационару, если корпуса не изолированы) и обсеменяют все и вся, нанося вред другим ослабленным тяжелой болезнью пациентам и заселяя кишечники всего медицинского персонала.
- И еще одно крайне мерзкое свойство таких возбудителей – они умеют осуществлять горизонтальный перенос механизмов резистентности с другой флорой семейства Enterobacteriaceae, и даже если вы избавились от E.coli, неприятным сюрпризом может стать ее подруга клебсиелла, наносящая еще больший вред и по сути добивающая больного. Избавится полностью от этих возбудителей невозможно, для этого надо избавится от медицинского персонала как основных носителей, но контролировать можно – мероприятия подробно расписаны в действующих СанПиН 2.1.3.2630-10. Так что в случае выявления подобного возбудителя речь пойдет не только о лечении того пациента, у которого он обнаружен, но и проведения мероприятий по недопущению инфицирования всех остальных пациентов (а это, напомню, почти всегда ПИТ или ОРИТ), находящихся рядом.
- И в заключение необходимо упомянуть о панрезистентной E.coli, вооруженной полным спектром механизмов резистентности. В антибиотикограмме будут тотальные R, а МПК возбудителей пробьют все возможные потолки. К счастью для автора, она с таким зверем пока не сталкивалась, что связано с наличием работающей системы эпиднадзора, поэтому картинки не будет, хотя ее несложно представить. Такие пациенты, если кишечная палочка окажется патогеном, а не колонизатором (мало ли с чьих рук, например, в рану упала), к сожалению, почти не выживают, так как изначально являются крайне тяжелыми соматически, а кишечная палочка обычно подводит черту к их существования на бренной земле.
- Не допускать развития такой, не побоюсь этого слова, зверюги в ваших стационарах, а если появилась – гонять эпидемиологическую службу, чтобы избавляла руки и поверхности от такого рода заражения, что возможно только при условии наличия достаточного количества расходных материалов, перчаток и дезинфицирующих средств.
А теперь подведем небольшой итог нашего непростого разговора:
- Кишечная палочка – возбудитель очень серьезный и не следует его недооценивать. В ее типах также необходимо четко ориентироваться.
- В первую очередь о ней мы думаем при лечении инфекций мочевыводящих путей, особенно у беременных.
- Если перед нами пациент с признаками кишечной инфекции, то подход к терапии антибиотиками должен быть сугубо индивидуальным, и если состояние позволяет, то до получения микробиологии – вообще без антибиотиков. Если не позволяет – это должны быть бактериостатики.
- Мы никогда не лечим только анализ, и даже микробиологическое заключение, мы всегда лечим пациента со всем комплексом его симптомов и синдромов. Но микробиология помогает решить как дифференциально-диагностические задачи, что и позволяет отделить безусловный патоген от мирно живущего комменсала.
- Микробиологическая диагностика носит ключевое значение как для подтверждения самого возбудителя, так и для выбора необходимого антибиотика
- В случае выявления резистентных и панрезистентных возбудителей, помимо лечения самого пациента должна в полной мере задействоваться эпидемиологическая служба лечебного учреждения

Достаточно много лет нас убеждают, что мыло и зубная паста должны быть антибактериальными, руки отмываться антисептиками в режиме нон-стоп, про злосчастный ободок унитаза даже не говорим. Некоторые, поверив рекламе, в погоне за стерильностью, совсем запараноили и начали добывать специализированную больничную химию, которой для обеспечения санитарно-эпидемического режима отмываются операционные блоки и реанимации. Почему это все очень и очень плохо, мы сегодня и поговорим.
Начнем с небольшого микробиологического экскурса. Дело в том, что никто на Земле не стерилен, и человек не исключение. На нашей коже и слизистых, в желудочно-кишечном тракте живут миллиарды микробов. Например, в кишечнике (толстом и тонком) их живет около двух килограмм, и все они одинаково полезны: кто-то участвует в пристеночном пищеварении, кто-то работает как фабрика по производству витаминов, а кто-то совмещает обе эти функции, как кишечная палочка, которая как помогает переваривать пищу, так и снабжает организм витамином К. Напомню другую рекламу, кошмарящую нас по поводу страшного дисбактериоза кишечника и предлагающую волшебную таблетку с устойчивыми к антибиотикам бактериями – автор каждый раз почти в обморок падала от разверзающихся перспектив, если бы эти таблетки действительно имели заявленные свойства, а потом такой пациент оказывался бы на операционном столе, например, с аппендицитом, и лечить его было уже нечем, ибо внутренняя микрофлора оказалась бы не чувствительна ни к чему.
На коже есть еще и эпидермальные стафилококки – так вот, они даже в ране будут нормой. Есть состояния, когда они способны стать патогенами, но для этого вы должны оказаться в реанимации с подключичным катетером, да и то не факт, все будет зависеть от медицинского персонала и используемых ими расходных материалов.
И вот эту милую микрофлору (кишечную и кожную) реклама велит нам уничтожать – мылами, гелями, паровыми генераторами и еще кучей всего, что продавцам надо немедленно продать, и желательно подороже. Для этого показываются страшные мультики, пишутся не менее странные наукообразные статьи и, что самое отвратительное, во всем этом обязательно используются детские образы, ибо какой родитель в здравом уме и твердой памяти захочет навредить своему ребенку? И в результате вредит ему использованием антисептиков и дезинфектантов в промышленных масштабах.
Что такое антисептик? Антисептиками называют химические вещества, препятствующие развитию бактерий в организме. Антисептики используются в борьбе с патогенными микроорганизмами; при этом происходят нарушения метаболизма их энзимов, проницаемости клеточных мембран, коагуляция протоплазмы.
Еще немножко информации, чтобы договориться о терминологии: антисептики – это специальные медицинские средства, применяющиеся для антимикробной обработки поверхности человеческого тела или его полостей. Кроме того, есть еще группа веществ – дезинфектантов, которые применяются для обработки поверхностей и окружающих предметов, находящихся рядом с пациентом. Различия между этими двумя группами откровенно условные, а потому для простоты разговора будем их все называть антисептиками.
В переводе с бюрократического английского на обычный русский было доказано, что использование средств с триклозаном ничем не лучше и не эффективнее обычного гигиенического мытья рук с мылом. Кроме того, рутинное использование триклозана может как само по себе вредить здоровью, так еще и выращивать устойчивый к антибиотикам золотистый стафилококк. Тот самый, который в норме живет на неповрежденной коже, но стоит только ее повредить, как этот же зверек, упав в рану, вызывает там гнойное воспаление. А теперь представьте, что упавшая зверушка не дикая и симпатичная, то есть чувствительная к антибиотикам и антисептикам типа хлоргексидина, а натренированная триклозаном вооруженная и защищенная зверюга, которую обычным набором препаратов не прибьешь, а антибиотики резерва ой как не безразличны человеческому организму (ванкомицин, например, который используют в лечении устойчивого стафилококка, быстро и эффективно калечит почки вплоть до наступления почечной недостаточности). Вот и подумайте, стоит ли игра таких свеч.
Также было доказано, что включение триклозана в зубные пасты привело к селекции устойчивых к антибиотикам кишечных палочек в кишечнике. Помните страшный сон автора – устойчивые бактерии при банальном аппендиците? Тут они чуть было не стали явью.
В данный момент триклозан официально изъят из состава безрецептурных препаратов (мыла, пасты и т.д.) в США. Как у нас? Автор предлагает внимательно изучать упаковку, и при наличии в перечне ингредиентов триклозана или триклобана возвращать его на полку. Заодно возвращать туда же нечаянно брошенные в корзину антисептические гели для рук и спиртовые салфетки. Задайте себе вопрос – зачем все это вам? Вам негде руки помыть? Или вы в Индии, не приведи господи, оказались? Даже с использованием всех этих средств вы не избавитесь от пыли и грязи, а отсутствие достаточного времени действия препарата не избавит и от бактерий, которые реклама пообещала вам убить. А потом весь этот коктейль вы (и ваш ребенок) потянете в рот. Обычное же гигиеническое мытье рук с обычным же мылом очищает ваши руки от всего вышеперечисленного. Скажу больше, специальная методика мытья рук, которую используют хирурги перед операцией, используя такое же обычное жидкое мыло из диспенсера (правда, выдерживая его на руках 2,5-3 минуты) очищает руки на 99,9% от всего, что на этих руках было. Повторюсь, все это делает обычное мыло.
Когда можно и даже нужно использовать антисептики для немедицинских целей? Существуют только два повода (если вы не медицинский работник): вы оказались в безводной пустыне или в месте, где нет доступа к проточной воде (ну или в Индии), либо же вы ухаживаете за тяжелым лежачим пациентом, не могущем себя обслужить. Гигиена рук в данной ситуации равноценна спасению жизни, только необходимо правильно выполнять технику обработки и обязательно выдерживать время обработки.
И второй не менее важный вопрос – использование дезинфектантов в домашних условиях, причем любых, но особенно это касается тех, кто додумался мыть поверхности больничной химией, а таких людей оказалось довольно много. Что такое специальные моющие, а также больничные дезинфицирующие средства? Это самая что ни на есть боевая санитарная химия, устраивающая тотальный геноцид всего микробиологического мира на отдельно взятой территории. Ключевое слово – микробиологического! А потому места ее применения жестко закреплены: это лечебные учреждения и предприятия общепита. В быту это использовать нельзя, от слова совсем. И не только потому, что эти средства страшно вредны (хотя они действительно страшно вредны), а потому что дом – это, во-первых, не ламинарный бокс. Второе, для применения данных средств должна быть выдержана точная экспозиция. Если ее нет, вы своими руками растите мутантов (а вы в любом случае будете их растить), ибо живете не в ламинарном боксе, на стенах у вас обои, и максимум, что вы этой химией обольете, – это полы и отдельные поверхности – и не факт, что они от этого не облезут. Когда такие средства используются по назначению, то ими обрабатываются все поверхности до единой, а потому помещения покрыты материалами, которые подобную обработку выдерживают, не теряя ни своего вида, ни своих свойств.
Третье, даже использование бытовой химии и антисептиков ведет к проблемам с аллергическими заболеваниями у детей, животных, да и у взрослых тоже. Никто не станет отрицать, что вал аллергических состояний и заболеваний сейчас огромен. И связан он в том числе и с тем, что люди помешались на стерильности, отобрав у иммунной системы полигон для тренировки. Иммунная система – это одна из двух, которая своего хозяина может быстро и качественно убить иногда и потому, что ей банально заняться больше нечем. Так вот, аллергические реакции – это состояния, связанные с очень сильно разозленной иммунной системой, бросающейся на собственного хозяина. И хорошо, если это только крапивница, а если отек Квинке или, не приведи боже, анафилактический шок? И если медицинский персонал, что называется, знал, куда шел, то зачем же дома все эти проблемы собственноручно устраивать? Если ребенка будут условно бесплатно лечить, хотя стоимость препаратов такова, что хочется пойти и тихо побиться головой о стенку, то за аллергичную собачку или котика платить будете полновесным рублем из собственного кошелька.
В-четвертых, и самых главных, – неконтролируемое применение антисептиков и специальной моющей химии – это то же самое, что неконтролируемое использование антибиотиков, только еще хуже. Они ровно так же тренируют микрофлору, только более масштабно. Не дай бог чего случись, и попади вы в больницу, ваше устойчивое нательное зверье, тот же золотистый стафилококк, шлепнется в рану не из носа хирурга, а слетит с вашей же собственной кожи, так как его не прибило больничной химией, и результатом может стать раневая инфекция, которую не берет ничего, кроме вышеупомянутого ванкомицина, который ой как сильно не безразличен организму. И вообще, до него еще додуматься надо, так как врачи его опасаются (и правильно делают). Меж тем рану больничными антисептиками вам могут уже и не отмыть, и придется ходить не раз и не два на ревизию, после которых остаются совершенно безобразные шрамы (женщинам, любительницам бытовой стерильности, на заметку).
Возникает логичный вопрос – а что делать, и как обезопасить дом? Использовать обычную бытовую химию. 99% вопросов решается хозяйственным мылом, оно уже давно есть даже в жидком виде и стоит менее 100 руб. за литр. Не надо нести в дом ничего специального. Дома должны быть дикие "соседи", это и для иммунитета полезно, и случись чего, оно будет легко изничтожено без плясок с бубном.
Перед началом применения любого препарата посоветуйтесь со специалистом и ознакомьтесь с инструкцией по применению.
Для цитирования: Падейская Е.Н. НЕКОТОРЫЕ ВОПРОСЫ АНТИМИКРОБНОЙ ТЕРАПИИ КИШЕЧНЫХ ИНФЕКЦИЙ. РМЖ. 1997;24:5.
В статье представлены возбудители различных кишечных инфекций и рассмотрены вопросы этиотропной терапии этих заболеваний. Используемые для этой цели препараты делятся на две группы: средства, плохо всасывающиеся и оказывающие лишь местное действие,и системные препараты, способные, тем не менее, достигать высоких концентраций в содержимом кишечника.
В статье представлены возбудители различных кишечных инфекций и рассмотрены вопросы этиотропной терапии этих заболеваний. Используемые для этой цели препараты делятся на две группы: средства, плохо всасывающиеся и оказывающие лишь местное действие,и системные препараты, способные, тем не менее, достигать высоких концентраций в содержимом кишечника.
Особое внимание уделено препаратам группы фторхинолонов. Даны рекомендации по использованию антибактериальных средств с учетом этиологии заболеваний.
The paper presens pathogens of various intestinal infections and considers their etiotropic therapy. The agents used for this purpose are divided into two groups: those which are poorly absorbed and produce only local effects and those which have systemic effects and, nevertheless. can achieve high concentrations in the intestinal contents.
Particular attention is given to a group of fluoroquinolones. Recommendations are given on the use of antibiotics according to the etiology of the diseases.
Е.Н. Падейская, профессор, д.м.н., Москва
Prof Ye.N. Padeiskaya, Doctor of Medical Sciences, Moscow
Ш ироко распространенный термин “кишечные инфекции” относится к большой группе инфекционных заболеваний с преимущественным поражением желудочно-кишечного тракта (ЖКТ) и соответствующей симптоматикой (диарея, боли в области живота, в подложечной области, тошнота, иногда рвота, в тяжелых случаях – выраженная интоксикация, обезвоживание). Эти инфекции вызываются главным образом различными патогенными или условно-патогенными бактериями, вирулентные и токсигенные свойства которых определяют особенности патогенеза. Кроме того, поражение ЖКТ может быть вызвано некоторыми протозоа и вирусами (табл. 1) . Общим для этой группы инфекций является орально-фекальный путь заражения (через пищу, воду, контактно-бытовым путем – “болезни грязных рук”), входные ворота инфекции – ЖКТ, основные формы заболевания – гастроэнтерит, энтероколит, колит, гастроэнтероколит или гастрит. При тяжелых формах инфекции (в том числе на фоне иммунодефицитных состояний) могут иметь место токсинемия или бактериемия, реже – септицемия или септикопиемия. Учитывая особенности возбудителей инфекций, патогенез, характер течения и тяжесть процесса, определяющие тактику терапии, каждое заболевание в зависимости от этиологии следует рассматривать отдельно. К кишечным инфекциям, учитывая путь инфицирования и поражение тонкой кишки, обычно относят брюшной тиф и паратифы. При этих заболеваниях на фоне поражения кишечника и инвазии в кровь возбудителя развивается тяжелый генерализованный инфекционный процесс с бактериемией и интоксикацией. Высвобождающийся после гибели сальмонелл эндотоксин оказывает нейротропное действие, вызывает дистрофические изменения в миокарде, повреждает костный мозг. Генерализация процесса с поражением внутренних органов происходит при осложненных формах амебной дизентерии (амебный гепатит, абсцесс печени, поражение центральной нервной системы). Таким образом, понятие “кишечные инфекции” является в значительной степени условным.
Инфекционные диареи различного генеза широко распространены в разных регионах мира, могут протекать в тяжелой форме с выраженной токсинемией, в развивающихся странах остаются одной из основных причин заболеваемости и смертности [1 – 6].
Таблица 1. Возбудители и клинические формы кишечных инфекций
К кишечным инфекциям бактериальной этиологии относятся холера, эшерихиоз, шигеллез, кампилобактериоз, геликобактериоз, иерсиниоз, сальмонеллы, брюшной тиф и паратифы, а также острые диареи, часто недиагностированные по этиологическому фактору. Причиной последних могут быть как возбудители перечисленных выше инфекций, так и некоторые другие условно-патогенные аэробные бактерии. Характер течения заболевания зависит от свойств штаммов, в первую очередь от их токсигенных и инвазивных свойств. Одна из тяжелых свойств эшерихиоза – геморрагический колит с синдромом гемолитической уремии – вызывается токсигенным штаммом кишечной палочки 0156:Н7 [5].
Серьезную проблему для ВИЧ-инфицированных представляют диареи, вызванные Campylobacter spp.: описано до 10 различных представителей Campylobacter, которые могут быть причиной этих диарей [6].
Возбудителем инфекции у человека может быть Cyclospora cayetanensis – энтеропатогенный микроорганизм, вызывающий иногда очень длительную (до 70 дней) диарею [7].
Особое место занимают пищевые токсикоинфекции, патогенез которых определяют бактериальные экзотоксины с энтеротропными свойствами (энтеротоксины, цитотоксины). Они продуцируются различными аэробными и некоторыми анаэробными бактериями, причем и вне организма человека, в частности при размножении бактерий в пищевых продуктах, что и является причиной пищевой интоксикации. Клиника заболевания связана в первую очередь с поражением верхних отделов ЖКТ. Энтеротоксины мoгут продуцировать токсигенные штаммы P. vulgaris, P. mirabilis, Klebsiella spp., Enterobacter spp., Serratia spp., Citrobacter spp., Pseudomonas spp., Aeromonas spp., S. aureus, C. perfringens. Наиболее серьезную опасность представляют термостабильные энтеротоксины, в частности энтеротоксин стафилококка. Чаще энтеротоксины относятся к термолабильным токсинам [2].
К пищевым токсикоинфекциям, с учетом источника заражения и пути инфицирования, можно было бы отнести и заболевание, вызванное токсином Clostridium botulinum. Однако этот токсин характеризуется не энтеротропными, а нейроплегическими свойствами, и заболевание (ботулизм) по патогенезу и клинике принципиально отличается от инфекций с преимущественным поражением ЖКТ.
Таблица 2. Группы антимикробных препаратов, применяющихся для этиотропной терапии бактериальных кишечных инфекций
Лечение кишечных инфекций является комплексным и включает патогенетическую терапию (прежде всего – дезинтоксикацию, при обезвоживании – регидратацию), этиотропное лечение, направленное на инактивацию возбудителя инфекции, диетотерапию (сбалансированную и тщательно подобранную в зависимости от характера ферментативных нарушений при той или иной инфекции), коррекцию нарушений нормальной микрофлоры кишечника с помощью биопрепаратов для предупреждения развития дисбактериоза.
Задачей настоящей работы является рассмотрение разных аспектов этиотропной терапии. Вместе с тем следует подчеркнуть, что патогенетическая и диетотерапия в сочетании с коррекцией микрофлоры должны рассматриваться как важнейшие компоненты лечения кишечных инфекций, а при легких формах заболевания могут быть эффективны и без применения антимикробных препаратов. С другой стороны, этиотропные средства являются важнейшим копонентом терапии при среднетяжелых и тяжелых (особенно генерализованных) формах инфекции, кроме того, они используются для лечения и профилактики бактерионосительства.
Учитывая широкий профиль возбудителей (см. табл. 1) , трудности быстрой микробиологической диагностики острых диарей в большистве случаев на первом этапе проводят эмпирическую терапию. В связи с этим, важно, чтобы антимикробный препарат характеризовался широким антимикробным спектром, включающим, по возможности, всех потенциальных возбудителей этих инфекций. Необходимо также, чтобы препарат:
– достигал высокой концентрации в содержимом кишечного тракта после перорального применения;
– хорошо проникал в клетки фагоцитарной системы (микроорганизмы с внутриклеточной локализацией – одни из важнейших в этиологии рассматриваемых заболеваний);
– оказывал минимальное отрицательное влияние на нормальную микрофлору кишечника;
– не вызывал побочных реакций со стороны ЖКТ.
Кроме того, важно, чтобы у энтеропатогенных бактерий как можно реже развивалась выраженная резистентность к данному препарату.
При пищевых токсикоинфекциях основное значение имеет дезинтоксикационная патогенетическая терапия, и в большинстве случаев нет необходимости прибегать к применению этиотропных средств.
Проблема лекарственной резистентности существенно осложнила этиотропную терапию кишечных инфекций. Особенно демонстративным в этом отношении является пример дизентерии и брюшного тифа. Изучение чувствительности шигелл к антимикробным препаратам в 14 штатах США за период с 1985 – 1986 по 1995 г. показало повышение частоты выделения устойчивых к ампициллину штаммов с 32 до 67%, к ко-тримоксазолу – с 7 до 35% [8]. Значительно возросло число штаммов сальмонелл, в том числе S. typhi, устойчивых к хлорамфениколу, ко-тримоксазолу и ампициллину, причем уровень резистентности может быть очень высоким: минимальная ингибирующая концентрация (МИК) достигает 400 мг/л. Одновременно в ряде регионов отмечается и более тяжелое клиническое течение кишечных инфекций, в частности шигеллеза, что проявляется увеличением продолжительности и тяжести интоксикации и диареи в сочетании с более глубокими деструктивными изменениями в стенке толстой кишки [9].
Для этиотропной терапии кишечных инфекций с учетом лекарственной резистентности в настоящее время успешно используются препараты группы фторхинолонов, эффективность которых при этих заболеваниях очень высокая.
Уже внедренные в практику с 1962 г. нефторированные хинолоны (налидиксовая кислота и аналоги) оказались эффективными при пероральном приеме при дизентерии, вызванной штаммами, устойчивыми к сульфаниламидам и хлорамфениколу. Однако широкое использование этих препаратов способствовало формированию резистентности к ним энтеропатогенов и снижению эффективности. В связи с особенностями фармакокинетики нефторированные хинолоны оказались неэффективными при генерализации процесса, не могли применяться для лечения брюшного тифа и паратифов, несмотря на высокую активность in vitro.
Таблица 4. Эффективность перорального приема офлоксацина при брюшном тифе и сальмонеллезах 1)
За последние 15 лет накоплен большой клинический опыт, свидетельствующий о высокой эффективности фторхинолонов при кишечных инфекциях бактериальной этиологии [1, 4, 10 – 18].
Фторхинолоны высокоэффективны в отношении практически всех возбудителей бактериальных кишечных инфекций, включая штаммы с множественной устойчивостью к бета-лактамам (в частности к ампициллину), хлорамфениколу, препаратам группы ко-тримоксазола. Несмотря на высокую биодоступность, препараты при применении перорально обеспечивают достаточно высокие концентрации в содержимом кишечника, колеблющиеся в пределах 100 – 2500 мг/кг и выше, что на несколько порядков превышает МИК и минимальную бактериостатическую концетрацию фторхинолонов для энтеропатогенов. Препараты создают высокие концентрации в слизистой кишечника и в макрофагах; это особенно существенно, учитывая внутриклеточную локализацию сальмонелл, шигелл, иерсиний, стафилококков. Высокая бактерицидная активность фторхинолонов в сочетании с активностью в отношении полирезистентных штаммов энтеробактерий, высокими концентрациями препаратов в содержимом кишечника и клетках фагоцитарной системы обеспечивают клинический и бактериологический эффект и, как правило, предотвращают формирование бактерионосительства. При генерализованных инфекциях важное значение имеет длительная циркуляция фторхинолонов в организме, хорошее проникновение в органы и ткани и высокие тканевые и внутриклеточные концентрации. Последнее особенно важно при лечении брюшного тифа и паратифов, а также других форм генерализованных сальмонеллезов.
Таблица 5. Эффективность фторхинолонов при лечении больных холерой; курс лечения – 3 дня [12, 17,21, 22, в модификации]
Читайте также:

