Биохимические маркеры эндогенной интоксикаций
Обновлено: 25.04.2024
Островский О.В. 1 Химич И.В. 1 Хлыбов В.С. 1 Кирпичников М.В. 1 Афанасьева Н.В. 1 Мартин Е.А. 1 Осадчий Г.С. 1
Исследование проводилось вотделениях челюстно-лицевой хирургии областной клинической больница №1 г.Волгограда игородской клинической больницы №1 г. Волжского, впериод с2008 по 2011год. Нами было обследовано 59пациентов сфурункулом лица встадии абсцедирования ввозрасте 18–35лет, из которых 31получили антиоксидант мексидол. Группу сравнения составили 37 практически здоровых лиц ввозрасте 18–35лет. Группы формировались методом простой рандомизации. Вработе представлены данные овлиянии антиоксиданта на клинические показатели имаркеры эндогенной интоксикации убольных абсцедирующим фурункулом лица. Установлено, что при поступлении увсех больных отмечалось повышение изучаемых показателей (интегральные индексы интоксикации, молекулы средней массы, сорбционная способность эритроцитов, диенкетоны, диеновые конъюгаты), что свидетельствовало об исходном высоком уровне эндогенной интоксикации. Наиболее значимым биохимическим маркером эндогенной интоксикации явились диенкетоны, уровень которых оставался предельно высоким до конца стационарного лечения ина 8–10сутки показатель составил 0,128±0,016усл.ед. соответственно. Включение антиоксиданта вбазисную терапию фурункула лица встадии абсцедирования способствовало уменьшению эндогенной интоксикации, оптимизации инфекционно-воспалительного процесса, сокращало пребывание больных на стационарном лечении иисключало риск гнойно-воспалительных осложнений.

1.Арман Амджад Ша. А. Оптимизация диагностики илечения абсцедирующих фурункулов челюстно-лицевой области удетей: автореф. дис. . канд. мед. наук. - Воронеж, 2009. - 24 с.
3.Дурново Е.А. Роль свободнорадикального окисления впатогенезе воспалительных заболеваний челюстно-лицевой области // Материалы IX Международной конференции челюстно-лицевых хирургов истоматологов. - СПб., 2004. - С. 67-68.
5.Казарян А. С. Эффективность сочетанного применения антигипоксантов иантиоксидантов вкомплексном лечении больных одонтогенными флегмонами челюстно-лицевой области (экспериментально-клиническое исследование): автореф. дис. . канд. мед. наук. - Краснодар, 2009. - 22 с.
6.Климова И. С. Закономерности возникновения иразвития фурункула челюстно-лицевой области, патогенетическое обоснование путей коррекции: автореф. дис. . д-ра мед. наук. - Иркутск, 2009. - 24 с.
7.Клинико-лабораторная диагностика эндогенной интоксикации убольных вялотекущими ихроническими гнойно-воспалительными заболеваниями челюстно-лицевой области / Е.В. Фомичёв, О.В. Островский, М.В. Кирпичников, Е.Н. Ярыгина // Вестник ВолГМУ. - 2010. - №1(33). - С. 99-102.
8.Клиническое обоснование применения атиоксиданта мексидол вкомплексном лечении фурункула лица встадии абсцедирования / В.С. Хлыбов, И.В. Химич, М.В. Кирпичников, Н.В. Афанасьева, Е.С. Макаренко // Молодые ученые - здравоохранению: материалы 71-й межрегиональной научно-практ. конф. смеждунар. участием. - Ч.2. - Саратов, 2010. - С. 220-221.
9.Atanaskova N., Tomecki K.J. Innovative management of recurrent furunculosis. Dermatol Clin. - 2010. - Vol. 28, №479.
10.Biesalski H.K, Mc Gregor G.P. Antioxidant therapy in critical care - Is the microcirculation the primary target // Crit. Care Med. - 2007. - Vol. 35. - P. 577-583.
Типичным представителем неодонтогенной гнойно-воспалительной патологии по-прежнему остается фурункул лица (ФЛ). Актуальность фурункула лица обусловлена неуклонным ростом количества больных данным заболеванием, развитием угрожающих для жизни осложнений и утратой трудоспособности пациента на длительный срок. По статистическим данным ряда авторов, фурункулы лица в России составляют около 30 % от всех воспалительных заболеваний челюстно-лицевой области. В 5-27 % случаев они осложняются флегмоной, тромбофлебитом, сепсисом, что нередко приводит к летальному исходу [4, 6, 8].
По мнению Матюнина О.Ю. (2009), развитие и особенность клинического течения фурункула лица в современных условиях связана с увеличением количества антибиотикорезистентных штаммов, снижением общей иммунологической реактивности организма, усилением вирулентности условно-патогенной микрофлоры, патоморфозом видового и количественного состава раневой микрофлоры. Другие авторы особое значение придают нарушению углеводного обмена, изменению гормонального фона и различным стрессорным факторам [4, 8, 9].
Фурункул лица отличается своим клиническим течением от фурункулов прочих локализаций, что зависит от особенности кровоснабжения челюстно-лицевой области. На лице расположено обширное венозное русло глубоких и поверхностных вен, которые имеют множественные анастомозы сетевидного строения, которые наиболее выражены вблизи средней линии лица. Для v. facialis характерна большая наклонность к формированию тромбов и последующему гнойному их распаду с образованием метастазов. У большинства больных отмечается развитие воспаления по гиперергическому типу. Стадия очищения и заживление гнойно-некротической раны при этом занимает длительное время. Пациенты с фурункулом лица находятся на лечении в среднем около 15 суток, а при сопутствующей патологии (сахарный диабет, иммунодепрессивные состояния) до одного месяца [1, 6].
Оптимизация диагностики и лечения неодонтогенных гнойно-воспалительных заболеваний лица является одной из актуальных задач челюстно-лицевой хирургии. Данной проблеме посвящено немало исследовательских работ. В настоящее время с успехом используют такие методы, как УФО, лазерная терапия, плазмаферез, экзогенная NO-терапия, иммунотерапия [4, 6, 8].
В последние годы уделяется пристальное внимание вопросам диагностики и лечения синдрома эндогенной интоксикации (ЭИ). Как правило, ее клинико-лабораторные проявления развиваются на фоне истощения внутренних компенсаторных механизмов организма, уменьшения активности антиоксидантной системы (АОС), повышенной концентрации продуктов перекисного окисления липидов (ПОЛ) и других токсических веществ в крови. Окислительный стресс способствует ингибированию репаративных процессов и может служить основанием к неблагоприятному исходу заболевания [3, 7].
Научно-исследовательских работ по изу-
чению антиоксидантной системы и эндогенной интоксикации у больных с неодонтогенной гнойно-воспалительной патологией челюстно-лицевой области в литературе не найдено. Следовательно, антиоксидантная терапия у пациентов с фурункулом лица не применялась и является новым перспективным направлением.
Цель исследования. Обосновать целесообразность включения антиоксидантных препаратов в традиционную схему лечения фурункула лица по результатам мониторинга клинических и лабораторных маркеров эндогенной интоксикации.
Материалы и методы исследования
В период с 2008 по 2011 г. в отделениях челюстно-лицевой хирургии ОКБ №1 г. Волгограда и ГКБ №1 им. С.З. Фишера г. Волжского нами было проведено обследование и лечение 59 пациентов с фурункулом лица в стадии абсцедирования. Возраст пациентов составлял от 18 до 35 лет (28,25 ± 1,59 лет). Среди пациентов было 36 мужчин (62,1 %) и 23 женщины (40 %).
Для определения региональных показателей нормы нами было обследовано 37 практически здоровых лиц в возрасте от 18 до 35 лет (26,29 ± 1,83 лет). Из них мужчин было 36 (62,1 %), женщин - 23 (40 %). Исключались лица с существенными отклонениями в общеклинических и биохимических анализах крови.
Распределение пациентов по клиническим группам проводили по методу простой рандомизации. Сформированные группы были репрезентативны и сопоставимы между собой по возрастному составу и полу. Набор группы условно здоровых лиц проводили на всем протяжении исследовательской работы.
Клиническое обследование больных включало анализ жалоб и данных анамнеза заболевания, объективных показателей общего состояния пациента: частоты дыхания, пульса, величины артериального давления, температуры тела, симптомов интоксикации. Также проводили оценку местного статуса: выраженности инфильтрации и перифокального воспалительного отека мягких тканей, изменения цвета кожных покровов, увеличения и болезненности регионарных лимфатических узлов, выраженности болевого синдрома и функциональных нарушений, площади раневой поверхности в динамике.
Величину инфильтрата и отека мягких тканей оценивали по трехбалльной шкале. Измерения проводились по модифицированной нами методике Н.Н. Свечниковой (2004) и В.В. Шеленковой (2008), с помощью сантиметровой линейки. Диаметр инфильтрата и отека мягких тканей, равный до 2 см, расценивался как 1 балл, от 2 до 3 см - 2 балла, более 3 см - 3 балла. Сокращение площади раневого дефекта оценивалось по методике Ярмольчука-Автандилова (1990). В ходе измерений использовалось прозрачное, самоклеящееся, нерастягивающееся плёнчатое покрытие Hydrofilm. Контур раны переносился на миллиметровую бумагу, с последующим подсчётом количества квадратных миллиметров внутри контура. Динамика площади раневой поверхности и перифокальных явлений протоколировалась цифровой фотокамерой в режиме макросъемки.
Анализ качества жизни проводили путем анкетирования и исчисляли по десятибалльной системе, разработанной на кафедре хирургической стоматологии и челюстно-лицевой хирургии ВолгГМУ (Хлыбов В.С., Химич И.В., Гутман Л.И., 2008). Отрицательный ответ на вопрос фиксировался как один балл. Качество жизни в 10 баллов расценивалось как удовлетворительное.
Лабораторные исследования осуществляли в клинической лаборатории ВОКБ №1. На основании данных общего анализа крови и результатов клинического обследования производили расчет ряда интегральных показателей (индексов) интоксикации: лейкоцитарного индекса интоксикации (ЛИИ) по формуле Я.Я. Кальф-Калифа (1941), гематологического индекса интоксикации (ГИИ) по Г.Н. Карабанову (1993), гематологического показателя интоксикации (ГПИ) по В.С. Васильеву (1983), пульсо-лейкоцитарно-температурного индекса интоксикации (ПЛТИИ) по формуле С.Д. Химича (1992). Поправочные коэффициенты определяли по соответствующим специально разработанным таблицам [7].
Традиционное лабораторное обследование было дополнено разработанным нами комплексом биохимических тестов, которые проводили на кафедре теоретической биохимии с курсом клинической биохимии ВолгГМУ [7].
Для оценки выраженности токсемии определяли уровень молекул средней массы (МСМ) в плазме крови спектрофотометрическим методом по Н.И. Габриэлян (1981), содержание диеновых конъюгатов и диенкетонов модифицированным методом Z. Placer et al., (1976). Для оценки степени мембранных повреждений определяли величину сорбционной способности эритроцитов (ССЭ) по А.А. Тогайбаеву (1988).
Результаты исследований и их обсуждение
По результатам проведенного исследования фурункул лица составил 27,4 % случаев в общей структуре гнойно-воспалительных заболеваний челюстно-лицевой области. Преобладал в основном молодой возраст 28,25 ± 1,59 лет, мужской пол (62,1 %). Развитие заболевания более чем у половины больных (63 %) составило 2-3 суток. Пусковым фактором послужили: травмирование первичных элементов кожи (пустулы, угри) - 66,1 %, частые переохлаждения - 16,9 %, перенесенный стресс - 10,2 %, неудовлетворительная гигиена кожи лица - 6,8 %.
У 47 пациентов (79,7 %) в анамнезе были сопутствующие заболевания, среди которых наиболее часто встречались хронические воспалительные заболевания ЛОР-органов и бронхолегочной системы (21 пациентов, 35,6 %). В день госпитализации общее состояние 35 больных (59,3 %) было оценено как удовлетворительное, 24 пациентов (40,7 %) - средней степени тяжести. Общесоматические жалобы больных сводились к наличию слабости, озноба, ухудшению сна, потери аппетита, головным болям. Местный статус характеризовался выраженным перифокальным отеком и инфильтрацией мягких тканей (3 балла). При пальпации отмечался положительный симптом флюктуации.
Традиционная терапия не приводила к существенному улучшению общего состояния больных и быстрому купированию местного воспалительного процесса. В контрольной группе клинические признаки эндогенной интоксикации сохранялись на всем протяжении стационарного лечения.
На 3-4-е сутки после операции отмечалось нарастание перифокальных явлений по периметру очага воспаления во всех клинических случаях. Однако у 13 больных (41,9 %) основной группы наблюдалось уменьшение гноетечения и появление грануляций, в то время как у 18 пациентов (59,1 %) контрольной группы сохранялось обильное отделяемое из раны.
Таблица 1 Динамика некоторых клинических показателей больных контрольной и основной групп
Синдром эндогенной интоксикации. Клиника синдрома эндогенной интоксикации.
В настоящее время одной из наиболее сложных проблем интенсивной терапии является синдром эндогенной интоксикации (СЭИ), сопровождающий значительное количество патологических состояний (шок, перитонит, панкреатит и др.), которые по мере своего развития могут приводить к летальному исходу.
Прогрессирование эндотоксикоза обусловлено накоплением в крови различных по происхождению, химической структуре и биологическому воздействию веществ, именуемых эндотоксинами. Эндотоксины способствуют развитию острой почечно-печеночной недостаточности, сердечно-сосудистой недостаточности, острого респираторного дистресс-синдрома, приводя в конечном итоге к появлению крайне тяжелого состояния - синдрома мультиорганной дисфункции.
Эндогенная интоксикация - клинический синдром, возникающий при различных по этиологии патологических состояниях, обусловленных накоплением в тканях и биологических жидкостях организма продуктов нарушенного обмена веществ, метаболитов, деструктивных клеточных и тканевых структур, разрушенных белковых молекул, pi сопровождающийся функциональными и морфологическими поражениями органов и систем организма.
Выделяют три основных звена, которые определяют тяжесть состояния больных и выраженность клинической симптоматики: токсемия, нарушение микроциркуляции, угнетение функций собственных детоксицирующих и защитных систем организма.
Основным звеном патогенеза синдрома эндогенной интоксикации является токсемия. К сожалению, четкая дифференциация токсических веществ эндогенного происхождения практически невозможна. Однако в каждом конкретном случае можно выделить "первичные" и "вторичные" эндотоксины. Так, при ожогах, синдроме длительного раздавливания, облитерирующих сосудистых заболеваниях "первичными" являются продукты белковой деградации, "вторичными" - продукты естественного метаболизма, накопление которых в организме является следствием угнетения функций естественной детоксикации и экскреции.
Эндотоксемия, нарушая тонус периферических сосудов, реологию крови, кинетические и механические свойства форменных элементов крови, приводит к тканевой гипоксии, которая является одним из важных звеньев патогенеза СЭИ, течение которого усугубляется снижением функции органов естественной детоксикации и экскреции. Токсины блокируют места связывания молекул альбумина, что ведет к снижению эффективности проводимого медикаментозного лечения, поскольку этот белок является транспортным агентом для многих фармакологических препаратов.
Клиника синдрома эндогенной интоксикации.
Сопоставление экспериментальных и клинических исследований позволило выявить следующие стадии развития синдрома эндогенной интоксикации.
I стадия синдрома эндогенной интоксикации. Реактивно-токсическая возникает в ответ на формирование первичного деструктивного очага или травматического повреждения. Лабораторными признаками этой стадии являются повышение в крови уровней молекул средней массы (МСМ), продуктов перекисного окисления липидов (ДК и МДА), возрастание ЛИИ.
II стадия синдрома эндогенной интоксикации - стадия выраженной токсемии развивается после прорыва гастогематического барьера, когда в циркулирующую кровь попадают эндотоксины, образовавшиеся в первичном очаге интоксикации, с последующим распространением и накоплением в организме. В зависимости от состояния организма, его резистентности и исходного уровня детоксицирующих и иммунных систем выделяют компенсированную и декомпенсированную стадии выраженной токсемии.
III стадия синдрома эндогенной интоксикации - мультиорганной дисфункции (СМОД) наблюдается при дальнейшем прогрессировашш патологического процесса как следствие тяжелого повреждения эндотоксинами различных органов и систем с развитием их функциональной декомпенсацш!. Клинически эта стадия Проявляется нарушением сознания, гипоксией, выраженной сердечной Недостаточностью, олигурией, паралитической непроходимостью кишечника. В крови определяется высокая концентрация креатинина, мочевины, билирубина.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Маркеры эндогенной интоксикации. Диагностика эндогеннной интоксикации.
1. Лейкоцитоз (увеличение количества лейкоцитов в венозной крови (более 10-10 /л). При оценке степени выраженности интоксикации лейкоцитоз следует учитывать наряду с другими признаками, свидетельствующими о длительности заболевания, распространенности патоло-ТОческого процесса и его динамики.
2. Лейкоцитарный индекс интоксикации (Кальф-Калиф Я. Я., 1941). Нормальные значения ЛИИ колеблются от 0,3 до 1,5.

3. Ядерный индекс интоксикации (Даштаянц Г. А., 1978). При ЯИИ, равном 0,05-0,08, состояние больного оценивается как удовлетворительное, 0,3-1,0 - средней степени тяжести, более 1,0 -тяжелое.
У больных в стадии токсемии ЛИИ и ЯИИ может снижаться, что свидетельствует о декомпенсации систем кроветворения и детоксикации. В этих случаях значительная часть токсичных продуктов белковой природы и эндотоксинов фиксируется на микросгустках и агрегатах и, выключаясь из общего кровотока, снижает токсичность крови.
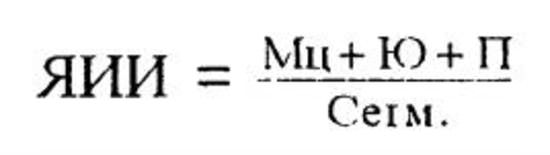
4. Индекс интоксикации (Гринев М. В., 1989). При ИИ, равном 35, прогноз заболевания неблагоприятный, при ИИ выше 45 в 100% случаев - летальный исход.
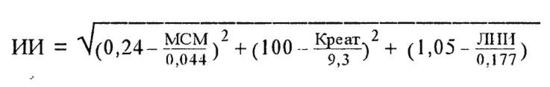
5. Концентрация общего белка в плазме крови.
- снижение уровня общего белка в плазме крови до 45 г/л указывает на тяжелую эндогенную интоксикацию и неблагоприятный исход болезни;
- уменьшение концентрации общего белка за счет альбуминовой фракции отражает использование альбумина как важнейшего фактора плазменной детоксикации, связывания и удаления токсинов;
- увеличение альфа-2-глобулинов в два раза огражает активность процесса с нарушением дезаминирования;
- увеличение гамма-глобулинов указывает на рост продукции грубодисперсных белков;
- снижение альбумино-глобулинового коэффициента (отношение количества альбуминов к количеству глобугашов) обусловливает при выраженной интоксикации переход альбуминов в ткани вследствие нарушенной проницаемости стенок сосудов, снижение интенсивности синтеза альбуминов в почечной ткани, ускорение их распада и превращения в другие белки, частично в глобулины, а также усиление синтеза альфа-2- и гамма-глобулинов. В норме атъбумино-глобулиновый коэффициент колеблется от 1,5 до 2,3.
6. Билирубин. Уровень билирубина более 30 ммоль/л вызывает выраженньш мембранотоксический эффект. Встраиваясь в мембраны и проникая в клетку, билирубин повреждает липиды митохондрий, вызывая их необратимое набухание, ингибирует утилизацию глюкозы, нарушает активность ферментов, ионную клеточную проницаемость. При эндогенной интоксикации билирубин плохо связывается с белками вследствие как гипоальбуминемии, так и вытеснения его из комплекса с альбумином лекарственными препаратами (гормонами, салуретиками).
7. Мочевина и креатинин. Увеличение уровня мочевины более 16 ммоль/л и креатинина более 0,2 ммоль/л указывает на наличие эндогенной интоксикации и сопровождается нарушением нейрогумо-рального контроля ЦНС.
8. Токсическая энзимопатия.
- увеличение уровней АЛТ, ACT, ЛДГ (изоферменты 1, 2, 5) указывает на нарушение проницаемости клеточных мембран;
- гипергликемия, увеличение концентрации лактата и пирувата отражает энергетическую несостоятельность клетки;
- увеличение концентрации молочной кислоты без повышения концентрации пировиноградной кислоты свидетельствует о повреждении ферментативных клеточных процессов;
- увеличение ДНКазы, РНКазы, кислой фосфатазы, катапрессина Д отражает степень деструкции клеток, лизиса внутриклеточных белков, а также энергодефицит клетки.
9. Молочная кислота. Увеличение концентрации молочной кислоты отражает уровень энергодефицита и гипоксии. Концентрация молочной кислоты более 4 ммоль/л расценивается как прогностически неблагоприятный признак.
10. Молекулы средней массы (МСМ) - являются олигопептидами с массой от 500 до 5000 Д, по своей природе относящимися к белковым токсинам с высоким содержанием дикарбоновых и низким - ароматических кислот.
МСМ обладают прямым мембранотоксическим действием и инициируют появление пептидов, близких по структуре к биорегуляторам. Среди них выделяют гепатоцеребральные, уремические, ишеми-ческие, ожоговые МСМ. На 80% МСМ состоят из белков и их метаболитов, в том числе продуктов гидролиза фибриногена и глобулинов, катаболизма глюкокортикоидов. В состав средних молекул входят биологически активные вещества (паратгормон, нейротоксин X, ингибиторы фагоцитоза, гемопоэза, хрупкости мембран эритроцитов, утилизации глюкозы и др.). Этим и определяется токсичность МСМ: нарушение эритропоэза, снижение розеткообразования, ингибирование дыхания митохондрий, нарушение синтеза ДНК в гепатопитах и лимфоцитах. Нейротоксические эффекты МСМ связаны с образованием ложных медиаторов: МСМ, взаимодействуя с инсулином, инактивируют гормон, ингибируя фосфорилирование, нарушают энергетический обмен в клетке.
Увеличение уровня МСМ - один из самых чувствительных признаков эндогенной интоксикации.
11. Коэффициент нейтрофилы/лимфоциты (отношение клеток неспецифической и специфической защиты). В норме коэффициент равен 2,0.
Увеличение коэффициента до 4,0 и более свидетельствует о нарастании тяжелой интоксикации.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Синдром эндогенной интоксикации сегодня широко распространен и сопровождает различные патологические состояния организма. Отсутствие единых методов оценки состояния больных эндотоксикозами требует поиска универсальных методов диагностики. В нашей работе мы выделили четыре наиболее информативных биохимических метода оценки формирования стадий эндогенной интоксикации. Первая стадия – компенсация, или скрытый эндотоксикоз: метаболиты поступают в кровь, идет активная детоксикация; вторая стадия характеризуется декомпенсацией защитных и регуляторных систем, когда накапливаются в высоких концентрациях специфические метаболиты и появляются продукты нарушенного функционирования; третья стадия – нарушенного метаболизма или мембранной несостоятельности. Происходит включение, далее напряжение с последующей декомпенсацией регуляторных и защитных систем, отмечается проникновение токсических продуктов в клетки с последующим нарушением их обмена, что превращает процесс из местного в системный, который препятствует выделению определенного токсического продукта; на четвертой стадии происходят стремительные изменения гомеостаза клетки, приводящие к формированию последней стадии дезинтеграции. Показательными биохимическими маркерами являются: ВНиСММ (вещества низкой и средней молекулярной массы) и олигопептиды в эритроцитах и плазме, альбумин (общая и эффективная концентрация), церулоплазмин, общий белок, АЛТ (аланинаминотрансфераза), АСТ (аспартатаминотрансфераза), ЛДГ (лактатдегидрогеназа), ЩФ (щелочная фосфатаза), мочевина, креатинин, амилаза, трипсин, миоглобин.

1. Марупов А.М. Эндотоксикоз при острых экзогенных отравлениях: дис. … док. мед. наук. Москва, 2004. 258 с.
2. Нескубина И.В. Роль производных оксида азота в формировании эндогенной интоксикации у онкологических больных с различной распространенностью злокачественного процесса и при некоторых методах аутобиохимиотерапии: дис. … канд. биол. Наук. Ростов-на-Дону, 2008. 148 с.
3. Дуденко Л.А. Пектинсодержащие препараты в послеоперационной инфузионной энтеральной зондовой коррекции нарушений гомеостаза при лечении абдоминального хирургического эндотоксикоза: автореф. дис. … канд. мед. наук. Москва, 2010. 22 с.
5. Меркушкина И.В. Коррекция метаболических нарушений головного мозга при эндотоксикозе: автореф. дис. … док. мед. наук. Саранск, 2009. 39 с.
6. Обухова Л.М. Роль протеинов в формировании структурного макропортрета плазмы крови при интоксикации организма: автореф. дис. … док. биол. наук. Нижний Новгород, 2010. 48 с.
7. Ведунова М.В. Состояние эндогенной интоксикации при метаболическом синдроме и его коррекции низкими дозами озона: автореф. дис. … канд. биол. наук. Нижний Новгород, 2008. 26 с.
8. Кравченя С.С. Оптимизация диагностики и медикаментозная коррекция иммунологических нарушений, ассоциированных с эндогенной интоксикацией, у больных псориазом: дис. … канд. мед. наук. Саратов, 2005. 228 с.
9. Начкина Э.И. Системные цитотоксические поражения при эндотоксикозе и их коррекция препаратами метаболического типа действия: автореф. дис. … док. мед. наук. Саранск, 2011. 42 с.
10. Шулаева Н.М. Оптимизация интенсивной терапии синдрома эндогенной интоксикации у больных с тяжелой термической травмой: автореф. дис. … канд. мед. наук. Саратов, 2011. 20 с.
11. Мурадов А.М., Туйчибоева М.Н., Шумилина О.В. ИК-спектрометрический метод диагностики эндотоксикозов при критических состояниях. Преимущества и перспективы // Вестник последипломного образования в сфере здравоохранения. 2015. № 1. С. 41–47.
12. Туйчибоева М.Н., Козлов А.В., Шукуров Т. Совершенствование диагностики токсичных компонентов крови при эндотоксикозах // Современная медицина: актуальные вопросы. 2014. № 5(31). С. 104-112.
13. Полякова Л.В. Патоморфология щитовидной железы при хроническом эндотоксикозе (экспериментальное исследование): автореф. дис. … канд. мед. наук. Волгоград, 2008. 22 с.
14. Лещанкина Н.Ю. Фосфолипидная дестабилизация цитомембран в прогрессировании кардиальных расстройств при эндотоксикозе: автореф. дис. … док. мед. наук. Москва, 2010. 43 с.
15. Пашина Е.В., Золотавина М.Л. Альбумин в оценке эндогенной интоксикации // Наука и современность. 2014. № 33. С. 23-28.
17. Ухмерова А.Л. Синдром эндогенной интоксикации при хронических гепатитах и циррозах печени. Патогенез, диагностика, лечение: автореф. дис. … док. мед. наук. Астрахань, 2010. 15 с.
18. Хохлова Н.И. Значение интегральных показателей эндогенной интоксикации и дисбиоза в многофакторной системе клинической диагностики вирусных гепатитов: дис. … док. мед. наук. Новосибирск, 2012. 257 с.
19. Ващенко В.И., Ващенко Т.Н. Биология и фармакология церулоплазмина: от эксперимента до лекарственной терапии // Обзоры по клинической фармакологии и лекарственной терапии. 2008. №1. С. 31-44.
20. Васильев В.В. Патологические механизмы прогрессирования эндогенной интоксикации в раннем послеоперационном периоде: автореф. дис. … канд. мед. наук. Москва, 2012. 20 с.
21. Безручко Н.В. Критерии биохимической оценки выраженности эндотоксикоза при неотложной абдоминальной патологии: дис. … док. биол. наук. Пенза, 2009. 252 с.
22. Делиханова М.Н. Прогностическое значение синдрома эндогенной интоксикации в дебюте острого лейкоза: автореф. дис. … канд. мед. наук. Тюмень, 2011. 23 с.
24. Сальникова Е.Н. Некоторые закономерности изменений функционального состояния клеток крови и липидного метаболизма при эндогенной интоксикации. дис. … канд. биол. наук. Ульяновск, 2006. 121 с.
25. Карандин В.И. Эфферентная терапия в лечении тяжелых хирургических эндотоксикозов: автореф. дис. … док. мед. наук. Москва, 2009. 49 с.
Многие авторы отмечают, что эндотоксикоз, несмотря на то, что на начало развития молекулярно-патологического процесса влияют множество факторов, в конечном счете приобретает универсальный характер формирования патологического процесса [1–4].
Эндогенная интоксикация может служить следствием нарушения процессов метаболизма или являться непосредственной причиной развития патологических реакций. Е.В. Корякина и С.В. Белова высказали мнение, что эндотоксикоз (2001) – это не что иное, как токсикация организма накопленными промежуточными и конечными продуктами обмена веществ, что в свою очередь приводит к запуску катаболических процессов при одновременном снижении процессов эндогенной детоксикации [5–7]. На развитие эндотоксикоза, по мнению С.С. Кравчени [8], может влиять множественный ряд факторов, таких как: высокая концентрация продуктов жизнедеятельности патогенной, а также условно-патогенной либо нормальной микрофлоры – вирусов, токсинов микробов и простейших; проникающие во внутреннюю среду метаболиты различных полостей организма; компоненты нормального обмена веществ в аномальных концентрациях; продукты извращенного метаболизма (например, транспортные макромолекулы белков сыворотки крови, которые имеют афизиологическую конформацию молекулы); продукты анаболизма, приводящие к развитию и поддержанию иммунного ответа организма; некорректное функционирование регуляторных систем организма, приводящее к чрезмерной выработке ферментов фибринолитической и калликреин-кининовой систем, иммуноглобулинов, иммунных комплексов, катализаторов воспаления, биогенных аминов, нейромедиаторов и продуктов, образующихся в результате перекисного окисления липидов; а также ткане- и органоспецифичные вещества с нарушенным распределением и в дальнейшем диссеминацией в виде ферментов: трансаминаз, амилазы, миоглобина, трипсина, лизосомальных ферментов.
Возможно возникновение токсемии и в результате возрастных дисфункций, при этом отмечается, что механизм формирования патологического процесса универсален, отличие составляет лишь этиология, что сказывается на скорости протекания процесса [1, 2].
Отсутствие единых методов оценки состояния больных эндотоксикозами, объемность, дороговизна существующих общепринятых методов диагностики требуют поиска новых универсальных методов диагностики эндогенной интоксикации, позволяющих диагностировать синдром эндогенной интоксикации на ранних этапах развития. Определение степени тяжести заболевания сегодня является важной диагностической задачей [11, 12].
Цель исследования: выделить основные стадии формирования эндогенной интоксикации с учетом изменения биохимических показателей сыворотки крови.
В формировании патологического процесса эндогенной интоксикации, идентифицируемой как первая стадия (стадия компенсации, или скрытый эндотоксикоз), отмечаются вброс отравляющих веществ и метаболитов в кровь, лимфу и интерстициальную жидкость извне и дальнейшее их распределение из очага развития патологии; все это приводит к активации процессов детоксикации, способных обезвредить токсичные вещества. В этом случае клиническая симптоматика не выявляется [8, 13]. Напротив, в случае развития скрытого эндотоксикоза происходящие изменения наблюдаются в крови на уровне структурных и межмолекулярных связей. Причем развитие защиты организма может осуществляться при помощи одного из двух механизмов. Первый механизм – за счет биотрансформации отравляющих веществ в менее токсичные. За реализацию данного механизма отвечает монооксигеназная система печени. Эндогенная интоксикация приводит к угнетению этой системы печени, что влечет генерализованное воздействие токсинов на организм с дальнейшим развитием полиорганной недостаточности. Система связывания и транспорта токсичных веществ выступает в роли второго механизма. Он работает за счет транспортных сывороточных белков (альбумина, церулоплазмина) и липопротеидных структур клетки, свойств адсорбции эритроцитов и элементов иммунной системы [14]. Белок альбумин, выполняющий транспортную функцию, обладает низкой аффинностью и большой емкостью для многих веществ. Пространственное расположение альбумина может видоизменяться и зависит от физико-химических свойств крови, влияющих на его способность к связыванию. Молекула альбумина способна принять на себя большое количество отравляющих веществ, не выведенных почками, печенью и другими органами, отвечающими за детоксикацию организма.
При высоком уровне токсичных веществ в крови конформационная подвижность альбумина падает, это ведет к уменьшению внутримолекулярных объемов центров связывания. При этом количество активных центров для взаимодействия с лигандами у сывороточного альбумина способно значительно увеличиваться, поскольку молекула обладает способностью к конформационным изменениям [2]. При этом не стоит забывать, что с активными центрами альбумина также связываются множество лекарственных препаратов, поэтому падение концентрации альбумина может иметь серьезные последствия при лекарственной терапии, способствуя еще большему увеличению токсичности. Недостаточная функция печени, повышенная потеря белка, низкая скорость синтеза или иные причины приводят к снижению концентрации альбумина, а затем – к повышению концентрации токсических и биологически активных веществ в крови и затруднению процессов детоксикации [2, 15–17].
Особое место в развитии эндогенной интоксикации занимают реакции перекисного окисления липидов, происходящие в организме непрерывно и интенсифицирующиеся при эндогенной интоксикации. В некоторых случаях эти реакции становятся пусковым механизмом эндотоксикоза. Продукты перекисного окисления липидов обладают токсическими свойствами. Свободные радикалы воздействуют на различные компоненты клеток, в том числе на липиды плазматических мембран, содержащие ненасыщенные жирные кислоты. Непрерывно с синтезом продуктов перекисного окисления липидов происходит их распад. Можно выделить первичные продукты перекисного окисления липидов (гидроперекиси, диеновые конъюгаты, эндоперекиси, эпоксиды и др.), вторичные – (алкенали, алканали, малоновый диальдегид, триеновые конъюгаты и др.) и конечные продукты этого процесса (газообразные продукты – пептан, этан, этилен, шиффовые основания).
Среди биохимических методов оценки эндогенной интоксикации получили широкое распространение МСМ, обладающие большой биологической активностью. Молекулы СМ относятся к классу среднемолекулярных продуктов протеолиза. По своей химической природе МСМ состоит из следующих компонентов: пептидов, остаточного азота, гликопептидов, полиаминов, аминосахаров, многоатомных спиртов, продуктов перекисного окисления липидов и др. В здоровых клетках организма постоянно образуется незначительное количество низко- и среднемолекулярных веществ. Их концентрация достоверно увеличивается в 1,5–2 раза при патологических состояниях по сравнению с нормальными значениями. Близкие по строению к регуляторным пептидам, они оказывают влияние на жизнедеятельность всех органов и систем органов. Молекулы СМ, блокируя фагоцитарную активность и кислородозависимые механизмы микробицидности и цитотоксичности лейкоцитов, пролиферацию фибробластов и иное, способны вызвать вторичный иммунодефицит, могут блокировать рецепторы любой клетки, нарушая тем самым ее метаболические процессы и функции. Также молекулы СМ отвечают за эффекты повреждения микроструктуры и свойств липидного бислоя биомембран, нарушения связи с клеточными рецепторами, изменения транспортных, биомеханических и функциональных характеристик плазматических и субклеточных мембран клеток. С учетом размеров и функций молекул их подразделяют на олигопептиды с молекулярной массой не более 10–15 кДа и ВНиСММ (в основном вещества небелкового происхождения). Среди олигопептидов выявлены регуляторные пептиды: нейрокины, нейротензины, соматомедин, самостатин, энкефалины, эндорфины, вазоактивный интерстициальный пептид и другие биологически активные вещества, концентрация которых в норме невелика. Центрами образования регуляторных пептидов являются клетки диффузной эндокринной системы и нейроны, обнаруживаемые в том или ином количестве практически во всех органах. В состав олигопептидов входят и нерегуляторные пептиды – поступившие извне токсины (имеющие бактериальную природу возникновения), а также токсины, являющиеся продуктами процессов аутолиза, неорганического протеолиза, ишемии, гипоксии органов и тканей, а также веществ, образуемых в ходе протеолитической деструкции тканевых и плазменных белков. Именно они являются ключевым звеном катаболического пула плазмы крови. Поэтому на данной стадии эндотоксикоза значительно повышается сначала содержание ВНиСММ на эритроцитах, а изменение концентрации олигопептидов в плазме крови незначительно [1, 2, 8, 22, 23].
Исследования содержания альбумина и МСМ позволяют определить изменения всех процессов гомеостаза, в частности уровень токсемии [2].
Вторая стадия характеризуется декомпенсацией защитных и регуляторных систем, накоплением специфических метаболитов в высоких концентрациях и появлением продуктов нарушенного функционирования. Органы дистанционно поражаются токсическими продуктами, поступающими из очага поражения [2]. Происходит дальнейшее накопление ВНиСММ на эритроцитах, а также олигопептидов – в плазме. По мнению А.М. Марупова [1], при этом формируется катаболический пул ВНиСММ плазмы крови, который распределяется в крови между белками-акцепторами за счет высокого содержания дикарбоновых аминокислот [1]. Особое место отводится процессу активации нейтрофилов, что приводит к синтезу медиаторов различных типов: цитокинов, обладающих тканедеструктивными свойствами, к синтезу составляющих системы комплемента и к образованию молекул адгезии (селектинов) [2, 8].
Третья стадия – стадия нарушенного метаболизма или мембранной несостоятельности – характеризуется включением, напряжением и последующей декомпенсацией систем, ответственных за регуляцию и защиту организма. Накопленные отравляющие вещества достаточно легко попадают в целые клетки, вызывая в них нарушения внутриклеточного обмена, системное нарушение микроциркуляции, цитолиз и разрушение биологических мембран. Все это является причиной синтеза аутоантигенов, свободных радикалов, комплексов фибриногена и гепарина с тромбогенными белками и сопровождается гидроперекисей. Результатом этого является нарушение распределения и диссеминации тканеспецифичных веществ [2, 8, 24].
Эти деструктивные процессы в тканях сопровождаются выраженной активацией и увеличением количества биологически активных веществ (гистамина, брадикинина и пр.), что приводит к нарушению мембран субклеточных образований, митохондрий, лизосом. Сывороточные белки распадаются под действием ферментов, продолжают образовываться и накапливаться продукты белкового обмена и высокотоксичные вещества – МСМ. Эндогенная интоксикация еще более нарастает при повышении проницаемости сосудов [8, 24].
Формирование этой стадии носит каскадный характер: происходят нарушение всех видов биологического окисления, активация реакций анаэробного гликолиза, разделение окислительно-восстановительных реакций, что в конечном итоге блокирует процессы тканевого обмена и дыхания. Прогрессирование ацидоза ведет к нарушению клеточных структур. В клетке накапливается внутриклеточный Ca 2+ , что вызывает нарушение функций митохондрий и в результате приводит к повреждению и последующей гибели клетки [24]. Количество ВНиСММ и олигопептидов превышает нормальный уровень в плазме в 3–4 раза, что свидетельствует об изменениях эритроцитарной мембраны. Развивается печеночно-почечная недостаточность (повышение концентрации мочевины, креатинина, внутриклеточных ферментов АЛТ, АСТ, ЛДГ, ЩФ и пр.) [1]. И тогда патологический процесс, протекающий в клетке, распространяется на ткани, а затем приобретает системный характер. Определить какой-либо один определенный продукт метаболизма невозможно, и развитие процесса интоксикации приобретает универсальный и сложный характер, теряя связь с первоначальным механизмом и причиной [2].
На финальной стадии происходят стремительные изменения в системе гомеостаза, приводящие к формированию последней стадии дезинтеграции. На этой стадии отмечается низкое содержание ВНиСММ (в основном в их состав входят катаболические вещества) как в плазме, так и на эритроцитах. В плазме крови, наоборот, определяется значительное повышение олигопептидов. Происходят депонирование токсинов и полная дезинтеграция систем детоксикации в клетке и организма в целом [1, 2, 9, 24, 25].
Выводы
Изменения биохимических показателей сыворотки крови происходят на всех стадиях эндогенной интоксикации, что позволяет использовать их при оценке тяжести течения эндотоксикоза и при определении степени формирования патологического процесса.
На первой стадии эндогенной интоксикации происходит увеличение количества МСМ на эритроцитах, увеличивается содержание церулоплазмина в крови, уменьшается содержание белков, особенно альбумина. Также возникают интенсификация перекисного окисления липидов, угнетение иммунитета и снижение антиоксидантной защиты.
На второй стадии в результате накопления метаболитов происходит декомпенсация защитных и регуляторных систем, появляются продукты нарушенного функционирования, продолжается накопление ВНиСММ на эритроцитах, появляются олигопептиды в плазме.
На третьей стадии при продолжающемся накоплении токсинов до высоких концентраций нарушается нормальная жизнедеятельность клетки, что сказывается на ее синтетической функции. Происходят изменения в эритроцитарной мембране. Процесс превращается из местного в системный, развивается печеночно-почечная недостаточность, невозможно выделить конкретный токсический продукт.
Финальная – четвертая – стадия характеризуется полной дезинтеграцией систем детоксикации и организма в целом. Низкое содержание ВНиСММ отмечается как в плазме, так и на эритроцитах. В плазме регистрируется высокая концентрация олигопептидов, что приводит к гибели клетки.
Читайте также:

