Можно ли вылечить инфекционный эндокардит
Обновлено: 26.04.2024
И нфекционный эндокардит (ИЭ) - заболевание инфекционной природы с первичной локализацией возбудителя на клапанах сердца, пристеночном эндокарде (реже - на эндотелии аорты и крупных артерий), протекающее с возможной генерализацией септического процесса и развитием иммунопатологических проявлений.
В доантибиотическую эру ведущие позиции в этиологии ИЭ занимали зеленящие стрептококки (Str. viridans), на долю которых приходилось до 90% случаев заболевания. С начала 1970-х гг., наряду с широким внедрением в клиническую практику антибиотиков, нарастанием числа инвазивных диагностических и лечебных манипуляций, интенсивным развитием кардиохирургии и, с другой стороны, распространением потребления наркотиков, существенно повысилась этиологическая роль стафилококков и грамотрицательных микроорганизмов. Длительное (в ряде случаев - необоснованное) лечение антибиотиками, глюкокортикостероидами и цитостатиками, более широкое применение парентерального питания привели в последние годы к нарастанию частоты грибкового ИЭ. Развитие и усовершенствование микробиологических и серологических методов исследования позволили выявить целый ряд редких возбудителей ИЭ (риккетсии, хламидии, легионеллы, бруцеллы).
Таким образом, современный ИЭ представляет собой полиэтиологичное заболевание, возникновение и развитие которого может быть обусловлено возбудителями, составляющими чрезвычайно обширный перечень, пополняемый практически ежегодно.
Особенности течения
Клиническая семиотика современного ИЭ достаточно подробно описана во многих руководствах и журнальных публикациях, доступных широкому кругу отечественных клиницистов. Поэтому в рамках данной статьи решено ограничиться особенностями клинической картины заболевания как в зависимости от возбудителя, так и у отдельных категорий пациентов.
Стрептококковый ИЭ, вызванный Str. viridans, развивается преимущественно у лиц, имеющих врожденную или приобретенную сердечную патологию, чаще протекает подостро с относительно меньшей выраженностью септических проявлений и большей частотой развития иммунокомплексных синдромов (нефрит, васкулит, артрит, миокардит), в связи с чем доля ошибок в диагностике данной формы заболевания превышает 50% случаев.
ИЭ, обусловленный b -гемолитическими стрептококками, напротив, встречается значительно реже, но отличается большей остротой и агрессивностью течения, частыми эмболическими осложнениями и высокой летальностью, достигающей 40% [1,2].
Энтерококковый ИЭ чаще развивается у лиц старших возрастных групп после медицинских манипуляций на урогенитальном (>70% случаев) и желудочно-кишечном тракте (20-27%). Предшествовавшая сердечная патология отмечается примерно у 50% больных. Данной форме в большей степени свойственно подострое течение с преимущественным вовлечением в процесс левых отделов сердца (в т.ч. - у наркоманов) и достаточно низкой (10%) частотой развития эмболий [3].
Стафилококковый ИЭ, вызванный St. aureus, поражает как интактные, так и измененные сердечные клапаны (в т.ч. клапанные протезы). Наиболее типично острое течение с выраженными явлениями интоксикации, быстрым разрушением клапанов, множественными абсцессами различной локализации (селезенка, почки, миокард), частым поражением ЦНС в виде гнойного менингита или геморрагического инсульта. ИЭ, обусловленный коагулазонегативными стафилококками (St. epidermidis), значительно чаще развивается на клапанных протезах и, несмотря на более свойственное ему подострое течение, по частоте осложнений существенно не отличается от S. aureus- ИЭ. В последние годы все большее внимание уделяется еще одному представителю коагулазонегативных стафилококков - St. lugdunensis. ИЭ, вызванный этим возбудителем, несмотря на высокую чувствительность последнего к большинству антибиотиков, отличается значительной частотой перивальвулярного и экстракардиального распространения инфекции [5].
Бруцеллезный ИЭ обычно развивается на измененных митральном и/или аортальном клапанах и/или клапанных протезах. В типичных случаях он протекает подостро, средняя длительность интервала от появления первых симптомов до момента установления диагноза составляет 2,6 мес. Нередко встречается суставной синдром. Характерны крупные клапанные вегетации и высокая частота развития тромбоэмболий (>65%) [10].
В течение последних 20 лет наблюдается некоторое уменьшение значимости таких факторов риска грибкового ИЭ, как наличие клапанных протезов, ревматических пороков сердца и длительное применение антибиотиков. Данное обстоятельство, по всей вероятности, может быть объяснено улучшением качества кардиохирургической техники, жестким подходом к выбору клапанных протезов и контролю качества их стерилизации, определенным снижением частоты встречаемости ревматических пороков сердца в развитых странах, более разумной политикой применения антибиотиков у стационарных больных. В то же время отмечается явное увеличение удельного веса такого фактора, как длительно стоящие катетеры центральных вен, по причине нарастающей распространенности парентерального питания. Все большую роль в развитии грибкового ИЭ играют иммуносупрессивные состояния, обусловленные как фоновым заболеванием (сахарный диабет, ВИЧ-инфекция, солидные опухоли, трансплантация органов), так и необходимостью применения глюкокортикостероидов и цитостатических препаратов (азатиоприн, циклофосфамид). Аортальный клапан сердца поражается в 44% случаев, митральный - в 26%, трикуспидальный - в 7%. Однако у реципиентов клапанных протезов соотношение частоты поражения аортального и митрального клапанов составляет 4,3:1 [12]. У 18% больных процесс развивается на пристеночном эндокарде (муральный эндокардит), что создает дополнительные трудности в диагностике. Характерны крупные вегетации, достигающие в диаметре 2 см и более. Перивальвулярное распространение инфекции с формированием абсцессов миокарда наблюдается более чем у 60% больных, особенно при аспергиллезном ИЭ [13]. Частота развития эмболий (преимущественно в сосуды головного мозга и почек) превышает 70%. По данным американских авторов, эмболические феномены различной локализации были первым клиническим проявлением грибкового ИЭ у 47% больных [12]. В подобных ситуациях требуется немедленное хирургическое вмешательство, при отсутствии которого летальный исход наступает в 100% случаев.
Как уже упоминалось, прослеживается четкая тенденция к нарастанию частоты ИЭ у лиц пожилого и старческого возраста. В данной возрастной группе преобладают такие предрасполагающие к развитию ИЭ факторы, как сахарный диабет, инфицированные кожные язвы, медицинские манипуляции на мочевыводящих путях и толстом кишечнике, длительно стоящие катетеры центральных вен, программный гемодиализ, дегенеративные изменения сердечных клапанов, клапанные протезы и др. В 23% случаев ИЭ у пожилых имеет нозокомиальный (госпитальный) генез. Значительно чаще фигурируют в качестве этиологических факторов энтерококки и Str. bovis [17,18]. Выделяют ряд клинических ситуаций, при которых у лиц пожилого возраста следует заподозрить наличие ИЭ:
– лихорадка с необъяснимой сердечной или почечной недостаточностью;
– лихорадка с цереброваскулярными расстройствами или болью в спине;
– анемия неясного генеза и потеря массы тела;
– вновь появившийся шум над областью сердца;
– госпитальная инфекция с лихорадкой у больных с внутривенными катетерами;
– спутанность сознания [19].
В то же время температура тела у этих больных может быть субфебрильной (и даже нормальной). Одним из косвенных симптомов, свидетельствующих о развивающемся ИЭ, является прогрессирующая застойная недостаточность кровообращения. Учитывая высокую частоту фоновой патологии сердечных клапанов, аускультативная диагностика ИЭ у пожилых больных нередко затруднена. По этой же причине крайне низка информативность трансторакальной ЭхоКГ (45% положительных результатов). В то же время применение чреспищеводного датчика позволяет повысить чувствительность метода до 90-93% [20].
Определенный диагноз ИЭ правомочен при наличии либо одного из двух патологических критериев, выявляемых при исследовании операционного или аутопсийного материала, либо определенной совокупности клинических критериев. Последние, в соответствии с их диагностической значимостью, подразделяются на большие и малые, аналогично критериям Джонса для диагноза острой ревматической лихорадки.
Диагноз возможного ИЭ ставится в тех случаях, когда у больного имеется минимальный набор критериев, позволяющий с определенной долей вероятности предполагать наличие данного заболевания и, следовательно, принять решение о целесообразности проведения антибактериальной (большей частью - эмпирической) терапии.
Данные критерии весьма совершенны в смысле специфичности (до 95%), более чувствительны по сравнению с ранее предлагавшимися схемами и общеприняты в настоящее время. Однако эта система критериев ставит во главу угла результаты параклинических исследований и тем самым отводит клиническую симптоматику на второй план. Данный момент представляется не совсем логичным с позиций врача-клинициста, который назначает те или иные дополнительные обследования, исходя из имеющейся клинической картины. Помимо этого, использование упомянутых критериев подразумевает достаточно высокую оснащенность амбулаторного и стационарного звеньев медицинской помощи, что в условиях российского здравоохранения, к большому сожалению, нередко оставляет желать лучшего.
С учетом вышеизложенного отечественными исследователями были разработаны критерии подострого ИЭ, как наиболее часто встречающейся формы, где выделены максимально информативные клинические и параклинические признаки заболевания (табл. 2) [23].
По мнению авторов, данные критерии сопоставимы с критериями Duke по чувствительности для клинической диагностики ИЭ, более радикальны в диагностике достоверного ИЭ, менее зависимы от технического уровня ультразвуковой и бактериологической диагностики, что весьма важно для раннего выявления ИЭ хотя бы в категории вероятного.
Хотелось бы отметить, что сложный и многогранный процесс диагностики ИЭ, как и любого другого заболевания, невозможно уложить в рамки какой-либо схемы. Любая система критериев требует достаточно высокой врачебной квалификации, правильной интерпретации клинической симптоматики и данных дополнительных исследований. Решающая же роль в диагностике принадлежит опыту и суждениям клинициста.
Дифференциальный диагноз
Чрезвычайное разнообразие форм и вариантов течения, нередкая стертость клинической и лабораторной симптоматики служат источником как гипо -, так и гипердиагностики ИЭ. Спектр нозологических форм, с которыми приходится дифференцировать ИЭ, особенно на ранних стадиях заболевания, весомо широк. Поэтому в рамках данной статьи решено ограничиться перечнем только тех заболеваний, при которых в наибольшей степени возникают дифференциально-диагностические проблемы (табл. 3).
1. При острой ревматической лихорадке (ОРЛ) в отличие от первичного ИЭ прослеживается хронологическая связь с А-стрептококковой инфекцией глотки (что подтверждается микробиологическими и серологическими исследованиями), полиартрит имеет симметричный и мигрирующий характер, отмечается преимущественное поражение митрального клапана сердца с более медленным формированием порока, высокая подвижность и быстрое обратное развитие клинических и лабораторных симптомов на фоне противовоспалительной терапии. Более сложен процесс дифференциальной диагностики повторной атаки ОРЛ и вторичного ИЭ на фоне приобретенного порока сердца. Наличие в ближайшем анамнезе медицинских манипуляций, сопровождающихся бактериемией (стоматологических, урогинекологических и др.), ознобы даже при субфебрильной температуре тела, быстрое формирование нового порока сердца (или усугубление уже имеющегося) с преобладанием клапанной регургитации и развитием застойной недостаточности кровообращения, появление петехий на коже и слизистых, увеличение селезенки, высокие лабораторные параметры воспалительной активности, отсутствие эффекта от противовоспалительной терапии - все это заставляет заподозрить наличие вторичного ИЭ еще до получения данных ЭхоКГ и исследования на гемокультуру.
2. Для установления диагноза системной красной волчанки большое значение имеют молодой возраст, женский пол, усиленное выпадение волос, эритема на щеках и над скуловыми дугами, фотосенсибилизация, язвы в полости рта или носа. Наиболее частым симптомом поражения сердца при этом заболевании является перикардит; клапанная патология - эндокардит Либмана-Сакса - развивается значительно позднее и относится к категории признаков высокой активности болезни. Возможно развитие вторичного ИЭ и на фоне эндокардита Либмана-Сакса, что, по данным отечественных авторов, встречается в 7,3% случаев [24]. Следует отметить, что антинуклеарный фактор и антитела к нативной ДНК могут выявляться и при ИЭ, однако повторное обнаружение данных показателей в высоких титрах более характерно для системной красной волчанки.
3. В процессе обследования больного нередко требуется проведение дифференциальной диагностики ИЭ с поражением сердца в рамках антифосфолипидного синдрома - своеобразного симптомокомплекса, характеризующегося наличием артериальных и/или венозных тромбозов любой локализации, различными формами акушерской патологии (в первую очередь - привычное невынашивание беременности), тромбоцитопенией, а также другими разнообразными неврологическими (хорея, судороги, ишемия мозга), кардиологическими (клапанные пороки, инфаркт миокарда), кожными (сетчатое ливедо, язвы голени), почечными (почечная недостаточность, нефрогенная артериальная гипертензия), гематологическими (гемолитическая анемия) расстройствами. У некоторых больных возможно быстрое развитие тяжелой клапанной патологии, обусловленной тромботическими вегетациями, неотличимыми от ИЭ [25]. В подобных ситуациях решающую дифференциально-диагностическую роль играет повторно выделенная гемокультура.
4. Определенные проблемы могут возникать при дифференциальной диагностике ИЭ и неспецифического аортоартериита (болезни Такаясу), протекающего с формированием аортальной недостаточности, преимущественно обусловленной дилатацией аорты. Последнему чаще свойственны преходящие парестезии, перемежающаяся хромота у молодых женщин, сосудистые шумы, асимметрия или отсутствие пульса (чаще - в зоне локтевой лучевой и сонной артерий), различия АД на конечностях. Важное значение для верификации диагноза аортоартериита имеют данные ультразвукового сканирования сосудов и контрастной ангиографии. В то же время описаны случаи развития вторичного ИЭ у больных неспецифическим аортоартериитом [26,27].
5. Выраженность и стойкость лихорадочного синдрома, особенно в дебюте первичного ИЭ, требует проведения дифференциальной диагностики с узелковым полиартериитом и лимфопролиферативными заболеваниями. При этих нозологических формах не отмечается формирования пороков сердца и позитивной гемокультуры, однако в ряде случаев может потребоваться морфологическое подтверждение (соответственно, признаки васкулита в биоптате кожно-мышечного лоскута и наличие клеток Березовского-Штернберга в биоптате лимфоузла).
6. Достаточно сложен дифференциальный диагноз ИЭ со злокачественными новообразованиями, особенно у лиц пожилого возраста. Высокая лихорадка часто отмечается при гипернефроме, опухолях толстого кишечника, поджелудочной железы и др. В то же время у пожилых людей нередко встречается грубый систолический шум митральной регургитации, как следствие хронической ишемической болезни сердца или протодиастолический шум аортальной регургитации атеросклеротического генеза. У таких больных при наличии опухоли наблюдается анемия, ускорение СОЭ. В подобных ситуациях, прежде чем остановиться на диагнозе ИЭ, необходимо настойчиво искать опухоль, применяя все современные диагностические методы. Следует иметь в виду, что у больных пожилого и старческого возраста возможно сочетание ИЭ и опухоли [28].
7. Значительные трудности представляет дифференциальная диагностика ИЭ и хронического пиелонефрита в стадии обострения, особенно у пожилых больных. Так, развитие пиелонефрита с характерной клинической картиной (лихорадка с ознобом, анемия, ускорение СОЭ, иногда - бактериемия) может наводить на мысль о наличии ИЭ с вовлечением в процесс почек. С другой стороны, у больных, длительно страдающих пиелонефритом, возможно развитие ИЭ, вызванного микрофлорой, наиболее часто встречающейся при инфекциях мочевыводящих путей (кишечная палочка, протей, энтерококки и др.) [29].
В заключение следует подчеркнуть, что ИЭ обязательно должен быть включен в алгоритм диагностического поиска у всех больных с лихорадкой неясного генеза.
Неврологические осложнения развиваются у15-40% пациентов с инфекционным эндокардитом и в большинстве случаев обусловлены тромбоэмболией церебральных сосудов. Риск эмболий зависит от размеров и подвижности вегетаций. Среди возбудителей эндокардита сразвитием данных осложнений чаще других ассоциирован Staphylococcus aureus. При возникновении неврологических осложнений инфекционного эндокардита принципиально важным является привлечение специалистов различного профиля с целью более точной диагностики, определения тактики лечения и улучшения прогноза пациентов.
Неврологические осложнения развиваются у 15-40% пациентов с инфекционным эндокардитом (ИЭ). Чаще всего они возникают до начала антимикробной терапии (АМТ) и в первые дни после ее назначения, когда отмечается гемодинамическая нестабильность вегетаций [1,2]. Спектр неврологических осложнений ИЭ включает в себя ишемический и геморрагический инсульт, транзиторные ишемические атаки, бессимптомную церебральную эмболию, микотические аневризмы, абсцесс мозга, менингит, токсическую энцефалопатию и эпилепсию [3,4]. Среди возбудителей ИЭ с развитием неврологических осложнений чаще других ассоциирован Staphylococcus aureus. Это связано с тем, что при стафилококковой этиологии заболевания наблюдаются острое течение инфекционного процесса и изменения в свертывающей системе крови, способствующие возникновению тромбоэмболий [5,6]. Ишемическое или геморрагическое повреждение центральной нервной системы приводит к более чем двукратному повышению внутрибольничной летальности пациентов с ИЭ [7,8].
| Локализация | Частота, % |
|---|---|
| Селезенка | 40,8 |
| Головной мозг | 35,2 |
| Конечности | 25,3 |
| Почки | 22,5 |
| Коронарные артерии | 15,5 |
| Легкие | 8,5 |
| Центральная артерия сетчатки | 2,8 |
Структура и характеристика неврологических осложнений ИЭ
Тромбоэмболические проявления – одни из самых частых системных осложнений ИЭ. Например, в многоцентровом исследовании МАЭСТРО частота их составила 38,2% и превышала таковую иммунопатологических проявлений заболевания (11,1%) (рис. 1) [2]. При стафилококковой этиологии ИЭ тромбоэмболические осложнения возникают чаще, чем при стрептококковой или энтерококковой (рис. 2) [9]. Результаты ряда современных исследований свидетельствуют о том, что при ИЭ чаще всего развиваются тромбоэмболии сосудов селезенки и головного мозга (табл. 1) [3,9].
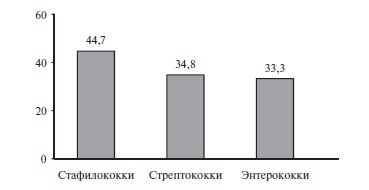
Рис. 1. Частота основных клинических проявлений ИЭ в%(исследование МАЭСТРО).
Ряд экспертов констатировали достоверно более высокую летальность в группе пациентов с тромбоэмболиями (39%, p<0,001) по сравнению с таковой у пациентов, у которых данные осложнения не отмечались (9%) [9].
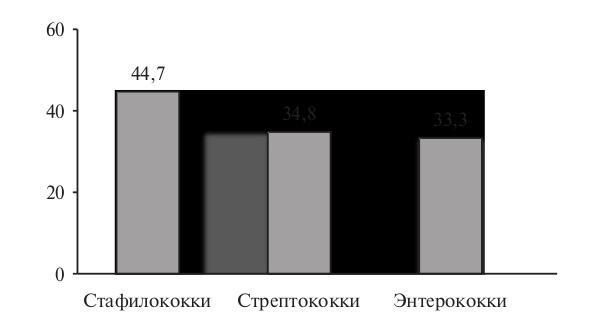
Рис. 2. Частота тромбоэмболических осложнений при ИЭ в зависимости от возбудителя (%).
ИЭ может осложниться внутримозговым или субарахноидальным кровоизлияниями, сопровождающимися высокой летальностью [3,11]. Первичное внутримозговое кровоизлияние у больных с ИЭ наблюдается в 2,4% случаев [9]. Основной причиной вторичных геморрагических осложнений ИЭ является геморрагическая трансформация ишемического инсульта как следствие септической эмболии церебральных сосудов. К более редким причинам внутримозговых кровоизлияний относятся гнойный артериит, некроз сосудистой стенки, не приводящий к образованию аневризмы, а также сопутствующее назначение антиагрегантов и антикоагулянтов [8].
Микотические аневризмы встречаются у 2-5% пациентов с ИЭ (рис. 3) и могут быть обусловлены как прямым воздействием инфекционного агента на стенку сосуда, так и септической эмболией vasa vasorum [8]. Mикотические аневризмы чаще развиваются в бифуркациях дистальных отделов средней мозговой артерии. Окклюзия сосудов септическими эмболами, сопровождающаяся вторичным артериитом и деструкцией стенки сосуда, как правило, наблюдается при ИЭ, вызванным S. aureus, в то время как поражение сосудистой стенки vasa vasorum ассоциировано с выделением Streptococcus viridans [12]. Микотические аневризмы могут быть бессимптомными, а клинические проявления их варьируются от легкой головной боли до менингеального синдрома, расстройств чувствительности, поражения черепно-мозговых нервов, эпилептических приступов, внезапно развившегося гемипареза и гемианопсии [13].
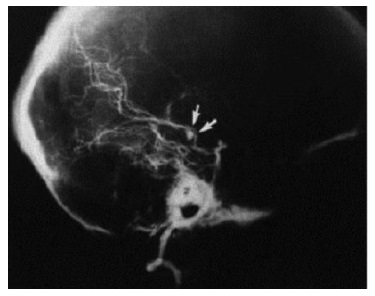
Рис. 3. Визуализация микотической аневризмы при ангиографии церебральных сосудов.
Менингит и менингоэнцефалит в последние десятилетия осложняют течение ИЭ примерно в 3% случаев. Они вызывают существенное ухудшение состояния больных и прогноза. Развитие воспаления мозговых оболочек связывают с воздействием высоко вирулентных возбудителей, присутствующих в составе тромботических масс, прежде всего S. aureus [9].
Абсцессы головного мозга при ИЭ встречаются редко. Они формируются в результате септических эмболий на фоне ограниченного инфекционного воспаления нервных волокон, которое может трансформиро ваться в микро- и/или макроабсцессы. Чаще развиваются микроабсцессы, которые могут проявляться головной болью, эпилептическими приступами и энцефалопатией [8].
Энцефалопатия является неспецифическим проявлением ИЭ и может быть объяснена наличием лихорадки, развитием острого нарушения мозгового кровообращения в лобных долях головного мозга, а также усугублением дисциркуляторной энцефалопатии у пожилых пациентов на фоне интоксикации. Развитие данного осложнения характеризуется изменением личности, возникновением галлюцинаций и параноидальных идей [9,10].
Ведение пациентов с неврологическими осложнениями инфекционного эндокардита
В рекомендациях Европейского общества кардиологов 2015 года подчеркивается важность лечения пациентов с ИЭ в специализированных центрах и привлечения мультидисциплинарной команды специалистов, которая способна определить тактику ведения пациентов (выбор комбинаций антимикробных препаратов и длительности АМТ, установление показаний для оперативного лечения), своевременно выявить осложнения заболевания и провести их коррекцию (табл. 2) [3,14].
| Показания | Время | Класс рекомендаций | Уровень доказательств |
|---|---|---|---|
| Примечание: *эхстренное хирургическое вмешательство – в течение 24 часов; **неотложное хирургическое вмешательство – в течение нескольких дней; ***отложить – через 1-2 недели АМТ | |||
| Сердечная недостаточность | |||
| Поражение аортального или митрального клапана с тяжелой острой регургитацией, обструкцией или фистулой, ведущее к рефрактерному отеку легких или кардиогенному шоку | Экстренно | I | B |
| Поражение аортального или митрального клапана с тяжелой острой регургитацией, обструкцией, вызывающее симптомы сердечной недостаточности или эхокардиографические признаки нарушенной гемодинамики | Неотложно | I | B |
| Неконтролируемая инфекция | |||
| Локально неконтролируемая инфекция (абсцесс, псевдоаневризма, фистула, растущая вегетация) | Неотложно | I | B |
| Инфекция, вызванная грибами или множественно-резистентными микроорганизмами | Неотложно/ отложить | I | C |
| Персистирующие положительные результаты бактериологического исследования крови несмотря на назначение адекватной АМТ | Неотложно | IIа | B |
| Поражение протезированных клапанов, вызванное стафилококками и не-HACEK грамотрицательными микроорганизмами | Неотложно/ отложить | IIа | C |
| Предотвращение тромбоэмболических осложнений | |||
| Поражение аортального или митрального клапана с персистирующими вегетациями размером более 10 мм после хотя бы одного эпизода эмболии несмотря на назначение адекватной АМТ | Неотложно | I | B |
| Поражение аортального или митрального клапана с вегетациями более 10 мм, ассоциированное с тяжелым стенозом или регургитацией и низким операционным риском | Неотложно | IIа | B |
| Поражение аортального или митрального клапана с изолированными очень большими вегетациями (более 30 мм) | Неотложно | IIа | B |
| Поражение аортального или митрального клапана с изолированными большими вегетациями (более 15 мм) и отсутствием других показаний для хирургического вмешательства | Неотложно | IIb | C |
Ключевую роль в прогнозировании тромбоэмболических осложнений играет эхокардиография, которая позволяет точно установить локализацию поражения, размеры микробных вегетаций, степень и динамику компенсации поврежденного клапана, что, в свою очередь, определяет дальнейшую тактику ведения пациентов с ИЭ. Факторы риска эмболий включают в себя размер и подвижность вегетаций, их локализацию на митральном клапане [15]. По данным современных исследований, высокий риск тромбоэмболических осложнений отмечается при наличии вегетаций диаметром более 10 мм, а самый высокий – при размере вегетаций 30 мм и более [16,17].
В многоцентровом исследовании МАЭСТРО чреспищеводная эхокардиография, позволяющей диагностировать ИЭ на начальных стадиях заболевания, использовалась в 15,8% случаев. Инфекционное поражение чаще всего локализовалось на митральном (43,6%) и аортальном (37,9%) клапанов. У 15,9% больных отмечалось сочетанное поражение клапанов, которое обусловливало повышенный риск развития тромбоэмболических осложнений [18].
В последние годы увеличилось количество публикаций, свидетельствующих о потенциальной роли в диагностике инфекционного поражения эндокарда компьютерной и магнитно-резонансной томографии. Однако на сегодняшний день эти методы исследования не вошли в рутинную практику, а их применение при ИЭ в основном ограничено диагностикой поражения головного мозга (табл. 3). Кроме того, использование контрастных веществ в ходе проведения данных визуализирующих методов исследования должно быть ограничено у пациентов с нефропатией и нестабильной гемодинамикой [3].
| Рекомендации | Класс рекомендаций | Уровень доказательств |
|---|---|---|
| Если после бессимптомной эмболии или транзиторной ишемической атаки кардиохирургическое вмешательство показано, оно должно быть выполнено без задержки | I | B |
| Нейрохирургическое вмешательство рекомендуется при очень больших, увеличивающихся или разрывающихся микотических аневризмах | I | C |
| После внутричерепного кровоизлияния хирургическое лечение должно быть отложено по крайней мере на 1 месяц | IIа | B |
| После развития ишемического инсульта вопрос о хирургическом лечении с целью коррекции сердечной недостаточности, устранения абсцесса или неконтролируемой инфекции должен быть немедленно рассмотрен при сохраняющихся показаниях к его проведению при отсутствии комы и исключении внутричерепного кровоизлияния с помощью КТ или МРТ | IIа | B |
| При сохранении подозрения на развитие микотических аневризм и отрицательных результатах неинвазивных визуализирующих методов рекомендуется проведение ангиографии | IIа | B |
В соответствии с рекомендациями Европейского общества кардиологов наибольшее значение для снижения риска тромбоэмболических осложнений имеет раннее назначение адекватной АМТ [3]. Вместе с тем, согласно результатам исследования МАЭСТРО, стартовая АМТ при ИЭ была эффективной лишь в 51,3% случаев [1]. Следует отметить, что с учетом низкой частоты выделения этиологически значимых возбудителей при ИЭ в Российской Федерации (по данным исследования МАЭСТРО – 35,5%) важное значение для обеспечения эффективности АМТ имеет выявление потенциальных факторов риска, таких как инъекционная наркомания, кардиохирургические вмешательства и инвазивные медицинские манипуляции, которые обусловливают ведущую роль S. aureus в этиологической структуре за бо левания [1,2].
Важно подчеркнуть, что применение антитромботических лекарственных средств в активную фазу инфекционного процесса в настоящее время не подкреплено данными крупных клинических исследований и оправдано лишь при поражении протезированных клапанов, частота вовлечения которых на сегодняшний день не превышает 15%. Кроме того, в случае поражения протезированных клапанов увеличивается вероятность выделения коагулазонегативных стафилококков, что также может способствовать нарушению реологических свойств крови [3].
Целесообразность выполнения раннего хирургического вмешательства для предотвращения тромбоэмболических осложнений у пациентов с ИЭ широко обсуждается в экспертном сообществе. В настоящее время рекомендуется индивидуально подходить к решению этого вопроса, принимая во внимание степень поражения клапанного аппарата сердца и динамику ответа на АМТ (табл. 2) [3,19].
Хирургическое лечение микотических аневризм, включающее клипирование или эндоваскулярную эмболизацию, представляет собой одну из наиболее сложных процедур даже в современных условиях. При отсутствии возможности хирургического вмешательства терапия должна включать в себя длительный курс назначения антимикробных препаратов, что в подавляющем большинстве случаев позволяет уменьшить размер микотических аневризм [18].
Заключение
Проблема неврологических осложнений ИЭ остается одной из наиболее серьезных в кардионеврологии. Для ее успешного решения необходимы усилия широкого круга специалистов – кардиологов, кардиохирургов, неврологов, нейрохирургов, врачей функциональной диагностики и других. Современная диагностика ИЭ основывается на предложенных в 1994 г. и впоследствии дополненных Duke критериев, согласно которым ключевая роль отводится бактериологическому исследованию крови и визуализирующим методам диагностики. Вместе с тем, в Российской Федерации отмечается чрезвычайно низкая частота выделения этиологически значимых возбудителей из крови, а также недостаточно широкое использование чреспищеводной эхокардиографии, позволяющей диагностировать поражение клапанов сердца на начальных стадиях заболевания. Ранняя диагностика ИЭ и назначение адекватной АМТ способствуют максимальному сокращению риска неврологических осложнений. В случае развития таких осложнений показания к хирургическому лечению сохраняются, но потенциальная польза его должна быть сопоставлена с операционным риском и послеоперационным прогнозом.
Среди неврологических осложнений ИЭ чаще всего встречается ишемическое поражение головного мозга вследствие тромбоэмболии церебральных сосудов. Наиболее высокий риск тромбоэмболических осложнений наблюдается в первые 2 недели заболевания и ассоциирован с размерами и подвижностью вегетаций, наличием в анамнезе эпизода тромбоэмболии, а также видом этиологически значимого микроорганизма. Знание вариантов поражения нервной системы при ИЭ, которое может маскировать основное заболевание, позволит в более ранние сроки поставить правильный диагноз и своевременно назначить лечение, способствующее снижению смертности и улучшению прогноза у данной категории пациентов.
Повышение эффективности ведения пациентов с ИЭ невозможно без знания особенностей диагностики и подходов к терапии, четких представлений об этиологической структуре, учета глобальных и локальных данных об антимикробной резистентности наиболее часто встречающихся возбудителей. В этой связи чрезвычайно важной представляется совместная работа клиникомикробиологических лабораторий, направленная на получение достоверных данных о возбудителях и их чувствительности к антимикробным препаратам, и врачей, осуществляющих лечение пациентов с ИЭ. Одним из методов получения подобной информации является участие научных работников и практикующих врачей в многоцентровых клинических исследованиях, проводимых по единому протоколу.
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубеж
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубежом. По данным различных авторов, сегодня выросла заболеваемость в пожилом и старческом возрасте, а также среди лиц в возрасте до 30 лет, использующих внутривенное введение наркотиков [1, 2].
Известно, что ИЭ представляет собой заболевание инфекционной природы с первичной локализацией возбудителя на клапанах сердца, пристеночном эндокарде, протекающее с проявлениями системной инфекции, сосудистыми осложнениями и иммунной реакцией [3, 4, 5].
В данной работе обобщен опыт диагностики и ведения больных ИЭ на базе общетерапевтического отделения Александровской больницы Санкт-Петербурга за период 1998–2003 гг. Диагностика заболевания осуществлялась в соответствии с критериями Duke [8]. Диагноз ИЭ оценивался как достоверный при наличии двух главных критериев, а именно:
- при выделении типичного для ИЭ возбудителя при посевах крови больного;
- при определении эхокардиографических признаков поражения эндокарда - подвижные вегетации на клапанах сердца, абсцессов в области протеза клапана; образования внутрисердечных фистул и др., в сочетании с тремя или/и пятью вспомогательными критериями, к которым относились сосудистые осложнения (эмболии крупных артерий, септические инфаркты легких, внутричерепные кровоизлияния и др.), иммунологические феномены (гломерулонефрит, узелки Ослера, геморрагический васкулит и др.), а также фебрильная лихорадка, гепато-спленомегалия и другие проявления системной инфекции.
Нами было проведено обследование 105 больных ИЭ, из них у 80 человек в возрасте от 18 до 30 лет (первая группа) основным фактором риска заболевания являлась инъекционная наркомания.
Во второй группе больных (25 чел.) основными предрасполагающими факторами развития ИЭ были врожденные и приобретенные пороки сердца, а также протезированные клапаны.
У лиц старшей возрастной группы дополнительным фактором риска являлись дегенеративно-дистрофические изменения клапанов сердца.
Взаимосвязь характера поражения клапанов сердца и факторов риска ИЭ представлена в таблице 1.
По данным эхокардиографического исследования, у 100% больных первой группы были выявлены подвижные вегетации на створках трикуспидального клапана (ТК), что сопровождалось формированием его недостаточности I—III степени.
Во второй группе больных ИЭ отмечалось поражение левых камер сердца с образованием вегетаций на створках аортального и митрального клапанов. Изолированное поражение митрального клапана наблюдалось у двух человек с ревматическим пороком сердца (митральный стеноз), у одной больной с врожденным дефектом межжелудочковой перегородки и в единственном случае обструктивной формы гипертрофической кардиомиопатии.
Среди лиц пожилого и старческого возраста у девяти человек (36%) определялось изолированное поражение аортального клапана в отсутствии признаков аортального стеноза. Наряду с этим, у пяти больных (20%) в возрасте от 72 до 87 лет ИЭ развился на фоне аортального порока атеросклеротического генеза, причем у всех пятерых было выявлено сочетанное поражение аортального и митрального клапанов. Дегенеративно-дистрофические изменения других клапанов сердца определялись у 100% больных старшей возрастной группы.
Образование вегетаций на створках аортального клапана наблюдалось у двух больных с третичной формой сифилиса на фоне имеющегося аортального порока, связанного со специфическим процессом в аорте.
В двух случаях мы наблюдали развитие эндокардита протезированных клапанов.
При сопоставлении результатов посевов крови в двух группах больных определялись существенные различия как в частоте выделения микробной флоры, так и в видовом составе возбудителей эндокардита. По нашим данным, возбудителем ИЭ у больных-наркоманов в 71,3% наблюдений (57 чел.) являлся золотистый стафилококк, тогда как во второй группе, наряду с кокковой флорой, чаще обнаруживались грамотрицательные микроорганизмы (28%). Отрицательные результаты посевов крови значительно реже наблюдались в первой, чем во второй, группе больных ИЭ: 18,7% и 56% — соответственно. Данные относительно этиологической структуры ИЭ в обследуемых группах больных представлены в таблице 2.
Клиническая характеристика и особенности течения ИЭ
Клиническое течение и характер осложнений инфекционного эндокардита во многом зависят от локализации клапанных вегетаций — в правых или левых камерах сердца, а также степени вирулентности возбудителя заболевания.
Течение ИЭ у больных-наркоманов отличалось особой тяжестью и полисиндромностью. Причиной госпитализации у большинства больных были острые осложнения основного заболевания. Значительная часть больных поступала в реанимационное отделение стационара с клиническими симптомами одно- или двухсторонней многофокусной пневмонии, причиной которой являлась септическая тромбоэмболия ветвей легочной артерии (72% больных). Течение пневмонии сопровождалось тяжелой дыхательной недостаточностью, нередко с развитием респираторного дистресс-синдрома (РДСВ) и очагами деструкции в легких (12%). Проявления вторичной нефропатии, которые обнаруживались у 100% больных в первой группе, иногда ошибочно трактовались как обострение хронического гломеруло- или пиелонефрита, мочекаменной болезни, что служило поводом для госпитализации этих больных в урологическое и нефрологическое отделения.
Во второй группе больных основной причиной госпитализации была длительная фебрильная лихорадка в сочетании с анемией и гепатолиенальным синдромом. Наряду с этим, у пяти человек (20%) поводом для госпитализации послужила прогрессирующая сердечная недостаточность.
Основные клинические синдромы, наблюдаемые у больных ИЭ первой и второй групп, представлены в таблице 3.
По нашим наблюдениям, характерной особенностью клинического течения ИЭ у больных-наркоманов являлась высокая частота септической ТЭЛА с формированием множественных очагов инфильтрации в легких. У многих больных легочные тромбоэмболии носили рецидивирующий характер (31,3% больных) и нередко осложнялись развитием деструктивных очагов в легких.
Образование вегетаций у 100% больных первой группы сопровождалось недостаточностью трехстворчатого клапана I—III степени с формированием потоков регургитации. Вместе с тем, у большинства пациентов не определялось тяжелых нарушений центральной гемодинамики, связанных с дисфункцией ТК. В данной группе больных характерной клинической особенностью был обратимый характер нарушений гемодинамики на фоне проводимой терапии. Острая сердечная недостаточность с дилятацией полостей сердца и снижением фракции выброса до 40% и ниже наблюдалась у 28 больных (35,3%) в связи с присоединением острого миокардита или на фоне сочетанного поражения клапанов сердца.
Вторичная нефропатия являлась одним из самых распространенных синдромов в первой группе больных ИЭ. Острая почечная недостаточность наблюдалась у 16 больных, причем у 10 из них она носила обратимый характер и была связана с острым ДВС-синдромом, а также с острой сердечной недостаточностью с отеками. Инфекционно-токсическая нефропатия регистрировалась в 73,8% наблюдений и сопровождалась мочевым синдромом — гематурией, протеинурией, лейкоцитурией — при достаточном уровне клубочковой фильтрации.
Характерной особенностью ИЭ во второй группе было подострое течение заболевания с длительным периодом лихорадки на догоспитальном этапе, причем в пожилом и старческом возрасте лихорадка носила субфебрильный характер с редкими подъемами температуры до фебрильных цифр.
Большинство больных подострым инфекционным эндокардитом (ПИЭ) поступали в стационар в стадии развернутой клинической картины заболевания с клиническими признаками тромбоэмболии сосудов большого круга кровообращения. В данной группе больных наиболее распространенными следует признать такие осложнения, как церебральные эмболии с развитием ишемических и геморрагических инсультов, эмболии почечных сосудов с болевым синдромом и гематурией, а также формирование острых очаговых изменений в миокарде, связанных с эмболией коронарных сосудов или прикрытием устьев коронарных артерий вегетациями [9].
Септические тромбоэмболии церебральных сосудов нередко сопровождались развитием гнойного менингоэнцефалита с летальным исходом. Вместе с тем, при посевах крови у 56% больных второй группы не получено роста микробной флоры. Обращает на себя внимание тот факт, что септицемия у больных с положительными результатами посевов крови в 28% наблюдений была обусловлена грамотрицательной микрофлорой. В этой категории больных источником бактериемии являлись очаги хронической инфекции в мочеполовой системе, а у двух больных (по данным аутопсии) был выявлен двухсторонний апостематозный нефрит.
У значительного числа больных ПИЭ (62%) определялись признаки острой недостаточности кровообращения с застойными хрипами в легких, легочной гипертензией, увеличением полостей сердца и периферическими отеками.
В этой группе больных чаще, чем в первой, наблюдалась преренальная азотемия и ОПН, связанные с развитием острой недостаточности кровообращения.
Острый диффузный миокардит, типичными проявлениями которого были различные нарушения ритма, диагностирован у 27% больных второй группы.
Анемия со снижением уровня гемоглобина до 80 г/л и менее выявлена у 100% больных второй группы. Значительное увеличение СОЭ (более 45 мм/ч) наблюдалось у 85,8% больных подострым ИЭ.
Кожные изменения в виде геморрагических высыпаний, пурпуры Шенлейн-Геноха, а также другие проявления иммунного воспаления в обеих группах больных встречались нечасто — 6,3 и 4% в первой и второй группах, соответственно.
Лечение больных ИЭ
Консервативная терапия больных ИЭ проводилось с использованием антибиотиков широкого спектра действия в сочетании со средствами дезинтоксикационной, антикоагулянтной и метаболической терапии. В составе антибактериальной терапии больные получали цефалоспорины III-IV поколений в комбинации с аминогликозидами и метронидазолом. Из группы цефалоспоринов назначались: цефтриаксон (лонгацеф) 2 г в сутки внутривенно (в/в), или цефотаксим (тальцеф) 2 г в сутки в/в, или цефепим (максипим) 2 г в сутки в/в в сочетании с аминогликозидами (амикацин в суточной дозе 1,5 г в/в) и метронидазолом по 1,5-2 г в сутки в/в. В случае, если такая терапия оказывалась неэффективной или существовали противопоказания к вышеперечисленным препаратам, применялись антибиотики группы линкозаминов: клиндамицин 1,2 г в сутки в/в или линкомицин 3 г в сутки в/в в сочетании со фторхинолонами (ципрофлоксацин 400 мг в сутки в/в). В условиях отделения реанимации в течение пяти–семи дней проводилась терапия имипинемом (тиенамом) в дозе 2—4 г в сутки в/в или рифампицином в суточной дозе 0,45—0,6 г в/в. Средняя продолжительность курса антибиотикотерапии в обследуемой группе больных составила 28 + 3,5 дней.
Дезинтоксикационная терапия включала в себя внутривенные инфузии реополиглюкина, гемодеза, поляризующих смесей в сочетании с петлевыми диуретиками. Объем вводимой жидкости составлял в среднем 2-2,5 л в сутки. В течение всего периода инфузионной терапии осуществлялся контроль за функциональным состоянием почек, электролитным составом крови, суточным диурезом. В условиях отделения реанимации у всех больных осуществлялся мониторинг ЦВД. Инфузионная терапия проводилась в течение всего острого периода заболевания до купирования проявлений интоксикационного синдрома. Средняя продолжительность курса составила 22 + 4,5 дня.
Развитие легочной эмболии, особенно в сочетании с признаками острого ДВС-синдрома в стадии гиперкоагуляции, служило основанием для назначения антикоагулянтной терапии. Начальная доза гепарина составляла 10 тыс. ЕД внутривенно, струйно, за-тем — по 1000 ЕД в час внутривенно, капельно с переходом на подкожное введение до 30 тыс. ЕД в сутки. Введение гепарина осуществлялось под контролем показателей коагулограммы и времени свертывания крови. Одновременно проводились внутривенные трансфузии свежезамороженной плазмы по 300 мл в сутки с добавлением 2500–5000 ЕД гепарина. Анемия тяжелой степени (Нb менее 80 г/л, Ht ≤25) корригировалась переливаниями эритроцитарной массы (пять–семь доз). При наличии гипопротеинемии использовалось введение растворов аминокислот, альбумина или нативной плазмы. Выявление клинических и рентгенологических признаков отека легких на фоне рецидивирующего течения септической ТЭЛА служило показанием для назначения кортикостероидов (преднизолон от 120 до 200 мг в сутки внутривенно капельно). Терапия антикоагулянтами прямого действия в сочетании с трансфузиями криоплазмы проводилась до стойкого улучшения показателей гемостаза. Критериями нормокоагуляции являлись уровень фибриногена в плазме 3-4 г/л, отсутствие тромбоцитопении, нормализация ВСК, АЧТВ, тромбинового времени, а также отрицательные паракоагуляционные тесты. По нашим данным, купирование проявлений острого ДВС-синдрома на стадии гиперкоагуляции у 75% больных отмечалось на седьмой–десятый день от начала комплексной терапии.
У части больных формировалась резистентность к проводимой антибактериальной терапии, которая характеризовалась нарастанием интоксикации, фебрильной лихорадкой, прогрессирующей анемией, а также высевами из крови возбудителя ИЭ – золотистого стафилококка — в 65% наблюдений. При рентгенологическом обследовании данной категории больных с большой частотой определялись очаги деструкции легочной ткани, а у трех больных гнойный выпот в плевральной полости.
Длительное применение антибиотиков широкого спектра действия у 70,3% больных (38 чел.) сопровождалось развитием побочных эффектов антибактериальной терапии. Кандидоз полости рта глотки, пищевода, а также кишечный дисбактериоз III-IV стадии был выявлен у 36 больных (66,7%). Применение антибиотиков с гепатотоксическими свойствами (цефалоспорины, линкозамины, метронидазол) у двух больных (3,7%) с хроническим гепатитом С и В приводило к прогрессированию печеночной недостаточности, которая сопровождалась высокой ферментемией (АЛТ 1500 ЕД, АСТ 1000 ЕД) и желтухой.
Развитие застойной сердечной недостаточности с появлением акроцианоза, влажных хрипов в базальных отделах легких, периферических отеков в сочетании с кардиомегалией и падением фракции выброса до 50—45% наблюдалось у пяти больных (9,3%) на фоне массивной инфузионной терапии.
Длительная антикоагулянтная терапия в 20,4% (11 чел.) наблюдений сопровождалась повышением толерантности плазмы к гепарину, что клинически выражалось в развитии периферических флеботромбозов, в то время как гепарининдуцированной тромбоцитопении в обследуемой группе больных мы не наблюдали.
Положительные результаты консервативной терапии были получены у 70,2% больных (56 чел.) с поражением ТК и лишь у 32% пациентов (6 чел.) из второй группы. Исходом ИЭ в обеих группах больных являлось формирование недостаточности клапанов сердца.
Госпитальная летальность при ИЭ у наркозависимых лиц составила 29,4% (24 чел.), тогда как у больных с поражением левых камер сердца (вторая группа) уровень смертности составил 68% (19 чел.).
По данным аутопсии, основными причинами смерти больных ИЭ были:
- септикопиемия с формированием гнойных очагов в печени, почках селезенке, головном мозге с развитием полиорганной недостаточности (46,2%);
- сердечная недостаточность на фоне полипозно-язвенного эндокардита с разрушением клапанов сердца, а также острый миокардит с дилятацией полостей сердца (39,4%);
- вторичная нефропатия с развитием почечной недостаточности, отеком легких, отеком головного мозга (14,4%).
Таким образом, характерные особенности ИЭ у лиц с наркотической зависимостью — это острое течение заболевания с поражением правых камер сердца и рецидивами септической ТЭЛА. Возбудителем ИЭ у инъекционных наркоманов в 71,3% является высоковирулентный золотистый стафилококк. Формирование недостаточности трехстворчатого клапана I—III степени стало самым распределенным осложнением ИЭ у наркоманов. При этом у большинства больных не наблюдается тяжелых нарушений центральной гемодинамики, приводящих к развитию острой недостаточности кровообращения.
Подострый ИЭ у больных с предрасполагающими заболеваниями сердца, а также у лиц пожилого и старческого возраста протекает с преимущественным поражением левых камер сердца, причем в старшей возрастной группе преобладает моноклапанное поражение. Наличие сопутствующей патологии у лиц старше 60 лет маскирует течение основного заболевания, чем и обусловлены поздняя диагностика и высокая смертность больных. Для затяжного течения ИЭ характерна низкая высеваемость возбудителя, по сравнению с острыми формами заболевания. Развитие тромбоэмболий сосудов большого круга кровообращения является характерной клинической особенностью подострого ИЭ.
Положительный эффект от проводимой консервативной терапии наблюдается у большинства больных ИЭ с поражением ТК, тогда как при подостром эндокардите левых камер сердца консервативная терапия является малоэффективной у большинства больных.
Госпитальная летальность в обеих группах больных обусловлена диссеминацией возбудителя с формированием гнойных очагов и полиорганной недостаточностью, а также развитием острой недостаточности кровообращения и вторичной нефропатии.
Литература
- Буткевич О. М., Виноградова Т. Л. Инфекционный эндокардит. - М., 1997.
- Симоненко В. Б., Колесников С. А. Инфекционный эндокардит: современное течение, диагностика, принципы лечения и профилактики. - Клин. мед., 1999. - 3. - С. 44-49.
- Тазина С. Я., Гуревич М. А. Современный инфекционный эндокардит. - Клин. мед.,1999. - 12. - С. 19-23.
- Bansal R. C. Infective endocarditis. Med Clin North America 1995; 79 (5): 1205-1239.
- Bayer A. S., Bolger A. F., Taubert K. A. et al. Diagnosis and management of infective endocarditis and its complications. Circulation 1998; 98: 2936-2948.
- McKinsey D. S., Ratts T. E., Bisno A. I. Underlying cardiac lesions in adults with infective endocarditis. The changing spectrum. Amer J Med 1987; 82: 681-688.
- Lamas C. C. Eykyn S. J. Suggested modifications to the Duke criteria for the clinical diagnosis of native valve and prosthetic valve endocarditis: analysis of 118 pathologically proven cases. Clin Infect Dis 1997; 25: 713-719.
- Durack D. T., Lukes A. S., Bright D. K. et al. New criteria for diagnosis of Infective Endocarditis Utilization of Specific Echocardiographic Finding. Amer J Med 1994; 96: 200-209.
- Тюрин В. П., Дубинина С. В. Инфекционный эндокардит у лиц пожилого и старческого возраста. - Клин. мед., 2000. - 4. - С. 53-56.
В. И. Уланова
В. И. Мазуров, доктор медицинских наук, профессор
Медицинская академия последипломного образования, Санкт-Петербург
Читайте также:

