Биомаркеры для диагностики сепсиса
Обновлено: 11.05.2024
Институт хирургии им. А.В. Вишневского Министерства здравоохранения и социального развития РФ, Москва
Отделение хирургии сосудов Института хирургии им. А.В. Вишневского, Москва
Динамика биомаркеров сепсиса как показатель эффективности интенсивной терапии
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2019;(2): 53‑57
Институт хирургии им. А.В. Вишневского Министерства здравоохранения и социального развития РФ, Москва
Институт хирургии им. А.В. Вишневского Министерства здравоохранения и социального развития РФ, Москва
Отделение хирургии сосудов Института хирургии им. А.В. Вишневского, Москва
Сепсис — наиболее частая причина смерти в отделениях реанимации и интенсивной терапии (ОРИТ), за исключением больных ИБС [1]. В мире ежегодно регистрируют более 18 млн случаев сепсиса. Развитие сепсиса происходит в 6—30% госпитализаций в ОРИТ [2], при этом от 30 до 50% из них заканчиваются летальным исходом [3, 4]. Последние 10 лет количество больных с сепсисом возрастает на 1,5—2% в год, а смертность продолжает увеличиваться, несмотря на более раннюю диагностику сепсиса [4].
Несмотря на то что в мире появляются новые клинические руководства и рекомендации [7], изменение концепции сепсиса не позволяет окончательно решить существующие трудности ранней постановки диагноза и оценки эффективности лечения. Продолжаются поиски лабораторных маркеров, которые могут быть связаны с развитием очага инфекции, уровнем воспалительной реакции и сепсисом [3, 8—19]. В настоящее время основными из этих маркеров являются прокальцитонин (PCT), пресепсин (P-SEP) и С-реактивный белок (CRP) [20—24].
Цель исследования — оценить в динамике уровень P-SEP, РСТ и CRP в двух группах (умершие и выжившие больные с сепсисом) при проведении интенсивной терапии.
Материал и методы
В исследование не включали больных, переведенных из реанимации или умерших в течение 3 сут с момента поступления; больных, которым проводили экстракорпоральные методы детоксикации в ОРИТ, так как это могло повлиять на значения уровня маркеров.
Больные с сепсисом были разделены на две группы, исходя из исходов лечения: 1-ю группу составили выжившие (n=21), 2-ю — умершие (n=20).
Всем больным проводили общепринятую интенсивную терапию сепсиса (адекватная инфузионная терапия, своевременная эмпирическая антибиотикотерапия с последующей деэскалационной терапией, контроль источника хирургической инфекции, целенаправленная инфузионно-трансфузионная терапия, седация и адекватное обезболивание, парентеральное и энтеральное питание).
Подтвержденными источниками инфекции у больных были обширные инфицированные раны мягких тканей, легкие (внутрибольничная пневмония), перитонит, панкреонекроз.
Статистическая обработка полученных данных проведена в программе Statistica 10.0.
Результаты
Результаты статистического анализа уровня биомаркеров представлены в табл. 1. Таблица. 1. Средние значения лабораторных биомаркеров Средний уровень (median) РСТ в 1-й группе (выжившие пациенты) был существенно ниже, чем во 2-й (умершие) — 1718,00 и 3266,50 пг/мл соответственно, при этом Me (25,75) в половине случаев составила 1021,00—3231,00 и 1618,50—7469,00 пг/мл. Минимальные и максимальные значения уровня P-SEP в 1-й группе составили 410,00 и 22542,00 пг/мл, во 2-й — 377,00 и 24860,00 пг/мл соответственно (рис. 1). Рис. 1. Уровень P-SEP в группах пациентов с благополучным (1) и неблагополучным (2) исходом заболевания, пг/мл. Аналогичные данные получены для двух других биомаркеров. Средний уровень (median) РСТ в группе выживших пациентов с сепсисом был также существенно ниже, чем в группе умерших (0,995 и 4,465 нг/мл), при этом в половине случаев Me (25,75) находилась в интервале 0,49—4,44 и 1,625—19,30 нг/мл. Минимальные и максимальные значения РСТ были следующими: в 1-й группе 0,05 и 84,0 нг/мл, во 2-й — 0,11 и 156,99 нг/мл (рис. 2). Рис. 2. Уровень PCT в группах пациентов с благополучным (1) и неблагополучным (2) исходом заболевания, нг/мл.
Для CRP показатели среднего уровня (median) в группе выживших пациентов оказались значительно ниже, чем в группе умерших (95,5 и 215,0 мг/л соответственно), Me (25,75) в половине случаев находится в пределах 64,00—155,00 и 155,00—264,00 мг/л). Минимальные и максимальные значения уровня CRP в 1-й группе больных с сепсисом составили 11,00 и 359,00 мг/л, во 2-й группе — 8,00 и 443,00 мг/л соответственно.

В табл. 2 приведены Таблица 2. Сравнение достоверности различия биомаркеров в исследуемых группах непараметрическим методом U-критерия Манна—Уитни уровни биомаркеров, согласно проведенному непараметрическому статистическому тесту Манна—Уитни (U-критерий). При сравнении значений лабораторных биомаркеров в группах пациентов выявлены достоверные различия (p-value для P-SEP PCT и CRP белка равны соответственно 0,000008, 0,000242 и 0,0000001).
Проблема диагностики и интенсивной терапии сепсиса остается актуальной в связи с неудовлетворительными результатами лечения. Летальность остается высокой — 30—50%. Продолжается поиск биологических маркеров, которые могут быть связаны с наличием инфекции в организме, уровнем воспалительной реакции и сепсисом. В настоящий момент основными из этих маркеров являются CRP, PCT и P-SEP.
P-SEP как биомаркер подходит не только для ранней диагностики сепсиса, но также для оценки его тяжести и прогноза. В исследовании ALBIOS [25] у 100 пациентов с тяжелым сепсисом и септическим шоком определяли концентрацию P-SEP и РСТ. Средняя (Q1—Q3) концентрация P-SEP в 1-й день мониторинга у умерших пациентов была достоверно существенно выше, чем у выживших. На 7-й день у выживших пациентов уровень P-SEP существенно снизился, а у впоследствии умерших пациентов он повышался. Однако различий в летальности в контрольной и основной группах не отмечено [25]. По нашим данным, определяемые в динамике уровни биомаркеров (CRP, РСТ, P-SEP) коррелируют с тяжестью течения хирургической инфекции. Динамика уровня биомаркеров характеризует эффективность хирургического лечения и проводимой интенсивной терапии, а также достоверно различается в зависимости от результатов лечения.
Таким образом, сепсис — гетерогенный процесс с выраженной индивидуальной вариабельностью, что усложняет его диагностику и лечение. Биологические маркеры и их комбинации помогают верифицировать диагноз и контролировать эффективность процесса лечения. Определение алгоритма практического применения маркеров сепсиса является перспективной клинической задачей.
Институт хирургии им. А.В. Вишневского Министерства здравоохранения и социального развития РФ, Москва
Отделение хирургии сосудов Института хирургии им. А.В. Вишневского, Москва
Динамика биомаркеров сепсиса как показатель эффективности интенсивной терапии
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2019;(2): 53‑57
Институт хирургии им. А.В. Вишневского Министерства здравоохранения и социального развития РФ, Москва
Институт хирургии им. А.В. Вишневского Министерства здравоохранения и социального развития РФ, Москва
Отделение хирургии сосудов Института хирургии им. А.В. Вишневского, Москва
Сепсис — наиболее частая причина смерти в отделениях реанимации и интенсивной терапии (ОРИТ), за исключением больных ИБС [1]. В мире ежегодно регистрируют более 18 млн случаев сепсиса. Развитие сепсиса происходит в 6—30% госпитализаций в ОРИТ [2], при этом от 30 до 50% из них заканчиваются летальным исходом [3, 4]. Последние 10 лет количество больных с сепсисом возрастает на 1,5—2% в год, а смертность продолжает увеличиваться, несмотря на более раннюю диагностику сепсиса [4].
Несмотря на то что в мире появляются новые клинические руководства и рекомендации [7], изменение концепции сепсиса не позволяет окончательно решить существующие трудности ранней постановки диагноза и оценки эффективности лечения. Продолжаются поиски лабораторных маркеров, которые могут быть связаны с развитием очага инфекции, уровнем воспалительной реакции и сепсисом [3, 8—19]. В настоящее время основными из этих маркеров являются прокальцитонин (PCT), пресепсин (P-SEP) и С-реактивный белок (CRP) [20—24].
Цель исследования — оценить в динамике уровень P-SEP, РСТ и CRP в двух группах (умершие и выжившие больные с сепсисом) при проведении интенсивной терапии.
Материал и методы
В исследование не включали больных, переведенных из реанимации или умерших в течение 3 сут с момента поступления; больных, которым проводили экстракорпоральные методы детоксикации в ОРИТ, так как это могло повлиять на значения уровня маркеров.
Больные с сепсисом были разделены на две группы, исходя из исходов лечения: 1-ю группу составили выжившие (n=21), 2-ю — умершие (n=20).
Всем больным проводили общепринятую интенсивную терапию сепсиса (адекватная инфузионная терапия, своевременная эмпирическая антибиотикотерапия с последующей деэскалационной терапией, контроль источника хирургической инфекции, целенаправленная инфузионно-трансфузионная терапия, седация и адекватное обезболивание, парентеральное и энтеральное питание).
Подтвержденными источниками инфекции у больных были обширные инфицированные раны мягких тканей, легкие (внутрибольничная пневмония), перитонит, панкреонекроз.
Статистическая обработка полученных данных проведена в программе Statistica 10.0.
Результаты
Результаты статистического анализа уровня биомаркеров представлены в табл. 1. Таблица. 1. Средние значения лабораторных биомаркеров Средний уровень (median) РСТ в 1-й группе (выжившие пациенты) был существенно ниже, чем во 2-й (умершие) — 1718,00 и 3266,50 пг/мл соответственно, при этом Me (25,75) в половине случаев составила 1021,00—3231,00 и 1618,50—7469,00 пг/мл. Минимальные и максимальные значения уровня P-SEP в 1-й группе составили 410,00 и 22542,00 пг/мл, во 2-й — 377,00 и 24860,00 пг/мл соответственно (рис. 1). Рис. 1. Уровень P-SEP в группах пациентов с благополучным (1) и неблагополучным (2) исходом заболевания, пг/мл. Аналогичные данные получены для двух других биомаркеров. Средний уровень (median) РСТ в группе выживших пациентов с сепсисом был также существенно ниже, чем в группе умерших (0,995 и 4,465 нг/мл), при этом в половине случаев Me (25,75) находилась в интервале 0,49—4,44 и 1,625—19,30 нг/мл. Минимальные и максимальные значения РСТ были следующими: в 1-й группе 0,05 и 84,0 нг/мл, во 2-й — 0,11 и 156,99 нг/мл (рис. 2). Рис. 2. Уровень PCT в группах пациентов с благополучным (1) и неблагополучным (2) исходом заболевания, нг/мл.
Для CRP показатели среднего уровня (median) в группе выживших пациентов оказались значительно ниже, чем в группе умерших (95,5 и 215,0 мг/л соответственно), Me (25,75) в половине случаев находится в пределах 64,00—155,00 и 155,00—264,00 мг/л). Минимальные и максимальные значения уровня CRP в 1-й группе больных с сепсисом составили 11,00 и 359,00 мг/л, во 2-й группе — 8,00 и 443,00 мг/л соответственно.

В табл. 2 приведены Таблица 2. Сравнение достоверности различия биомаркеров в исследуемых группах непараметрическим методом U-критерия Манна—Уитни уровни биомаркеров, согласно проведенному непараметрическому статистическому тесту Манна—Уитни (U-критерий). При сравнении значений лабораторных биомаркеров в группах пациентов выявлены достоверные различия (p-value для P-SEP PCT и CRP белка равны соответственно 0,000008, 0,000242 и 0,0000001).
Проблема диагностики и интенсивной терапии сепсиса остается актуальной в связи с неудовлетворительными результатами лечения. Летальность остается высокой — 30—50%. Продолжается поиск биологических маркеров, которые могут быть связаны с наличием инфекции в организме, уровнем воспалительной реакции и сепсисом. В настоящий момент основными из этих маркеров являются CRP, PCT и P-SEP.
P-SEP как биомаркер подходит не только для ранней диагностики сепсиса, но также для оценки его тяжести и прогноза. В исследовании ALBIOS [25] у 100 пациентов с тяжелым сепсисом и септическим шоком определяли концентрацию P-SEP и РСТ. Средняя (Q1—Q3) концентрация P-SEP в 1-й день мониторинга у умерших пациентов была достоверно существенно выше, чем у выживших. На 7-й день у выживших пациентов уровень P-SEP существенно снизился, а у впоследствии умерших пациентов он повышался. Однако различий в летальности в контрольной и основной группах не отмечено [25]. По нашим данным, определяемые в динамике уровни биомаркеров (CRP, РСТ, P-SEP) коррелируют с тяжестью течения хирургической инфекции. Динамика уровня биомаркеров характеризует эффективность хирургического лечения и проводимой интенсивной терапии, а также достоверно различается в зависимости от результатов лечения.
Таким образом, сепсис — гетерогенный процесс с выраженной индивидуальной вариабельностью, что усложняет его диагностику и лечение. Биологические маркеры и их комбинации помогают верифицировать диагноз и контролировать эффективность процесса лечения. Определение алгоритма практического применения маркеров сепсиса является перспективной клинической задачей.
Кафедра факультетской хирургии Российского университета дружбы народов, Москва
Кафедра факультетской хирургии Российского университета дружбы народов (зав. — д.м.н., проф. А.Е. Климов)
Кафедра факультетской хирургии Российского университета дружбы народов, Москва, Россия
Кафедра факультетской хирургии Российского университета дружбы народов, Москва
Биомаркеры и индикаторы воспаления в диагностике и прогнозе абдоминального сепсиса
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2018;(10): 92‑98
Кафедра факультетской хирургии Российского университета дружбы народов, Москва
На сегодняшний день необходимо признать, что основной проблемой в ургентной хирургии остается лечение больных с абдоминальным сепсисом в силу стабильно высокой летальности. Ранняя диагностика и целенаправленная терапия — это ключевые моменты для улучшения исхода сепсиса. В настоящее время исследователями всего мира предложено достаточно большое количество биологических маркеров для диагностики сепсиса и прогнозирования его исхода. В идеале биомаркеры можно использовать для определения риска, диагностики, мониторинга эффективности лечения и прогнозирования исхода. Биомаркер — это лабораторный показатель, который можно объективно измерить и охарактеризовать как индикатор нормальных и патологических биологических процессов. В статье сепсис рассматривается с позиций современной концепции патогенеза для понимания роли различных биомаркеров и индикаторов воспаления в его развитии. Проведен анализ литературных данных и представлены обобщающие сведения о возможности использования отдельных биологических маркеров и их комбинаций в раннем выявлении сепсиса, для мониторирования заболевания и прогнозирования его исхода.
Кафедра факультетской хирургии Российского университета дружбы народов, Москва
Кафедра факультетской хирургии Российского университета дружбы народов (зав. — д.м.н., проф. А.Е. Климов)
Кафедра факультетской хирургии Российского университета дружбы народов, Москва, Россия
Кафедра факультетской хирургии Российского университета дружбы народов, Москва
Сепсис является результатом сложной цепочки событий, состоящей из врожденных и адаптивных иммунных реакций, включая активацию системы комплемента, каскадов коагуляции и дисфункции сосудистой эндотелиальной системы. Кроме того, иммунные ответы основаны на индивидуальных особенностях пациента, включая возраст, основные заболевания, состояние питания и даже генетическую изменчивость [1—3]. По этой причине лечение, особенно иммунотерапия, должно быть индивидуализировано. Данный факт подчеркивает необходимость раннего и точного обнаружения сепсиса. Однако микробиологический диагноз не может быть установлен примерно у трети пациентов с клиническими проявлениями сепсиса [4]. Бактериологическое подтверждение инфекции при системной инфекции может отсутствовать, в то время как положительные бактериологические результаты могут быть вызваны случайной контаминацией [5—7].
Повреждения органов при сепсисе развиваются в результате неконтролируемого распространения из первичного очага инфекционного воспаления провоспалительных медиаторов эндогенного происхождения. В дальнейшем под их влиянием происходит активация клеточных медиаторов воспаления в других органах и тканях с вторичным выделением аналогичных эндогенных субстанций, повреждением эндотелия и снижением органной перфузии и доставки кислорода [5]. Таким образом, повышение уровней гуморальных и клеточных индикаторов воспаления свидетельствует о развитии воспаления в организме больного.
Идеальный биомаркер сепсиса и индикатор воспаления должны быть объективно измерены и достоверно отражать биологические и патогенные процессы, а также ответы на проводимое лечение [8]. К настоящему времени для оценки сепсиса изучено более 170 биомаркеров [9].
Развитие сепсиса меняет экспрессию и активность тысяч эндогенных медиаторов воспаления, коагуляции и промежуточного метаболизма [10, 11]. Тем не менее идеальные биомаркеры могут играть определенную роль в скрининге сепсиса, ранней диагностике, обосновании лечения, критической оценке течения заболевания и его прогнозе [11, 12].
Индикаторы и маркеры для раннего выявления сепсиса
Традиционная модель сепсиса — это иммунный ответ, активируемый, когда толл-подобные рецепторы (TLR) распознают консервативные структуры микроорганизмов и активируют клеточный иммунный ответ. Это распознавание стимулирует секрецию провоспалительных цитокинов, таких как TNF-α, IL-1β и IL-6. Поэтому различные воспалительные цитокины и липополиcахарид (LPS)-связывающий белок были изучены как биомаркеры сепсиса.
LPS-связывающий белок (LBP), главным образом синтезированный в печени, представляет собой полипептид, который связывает бактериальный LPS. Этот сложный комплекс имеет двойное действие, усиливающее и подавляющее сигнализацию LPS на низких и более высоких уровнях соответственно [18]. Уровень LBP в сыворотке увеличивается в несколько раз при сепсисе, что делает его полезным для диагностики [19, 20]. Он также может быть эффективным как прогностический маркер тяжести заболевания и прогноза заболевания [21]. Однако уровень LPS и LBP зависит от введения антибиотиков и, как правило, не коррелирует с клиническим течением сепсиса [22], поэтому имеет ограниченное применение в качестве биомаркера сепсиса [2].
Пресепсин (ПСП) — маркер, концентрация которого быстро растет при развитии сепсиса. ПСП представляет собой белок, который является фрагментом рецептора макрофагов CD14 (mCD14 и sCD14). Образование ПСП связано с инфекцией, бактериальным фагоцитозом и расщеплением mCD14 лизосомальными ферментами. При активации бактериального фагоцитоза sCD14 и mCD14 расщепляются лизосомальными протеиназами с образованием фрагмента — ПСП [23, 24].
В ответ на бактериальную инфекцию концентрация ПСП резко возрастает. Уровень ПСП в крови можно быстро выявить с помощью иммуноферментного анализа, что имеет огромное значение для ранней диагностики инфекционного процесса [25—27].
Содержание ПСП повышается при инфекции, он специфически продуцируется при сепсисе, связанном с грамотрицательными и грамположительными бактериями, грибками. В случае вирусных инфекций ПСП не продуцируется [28].
Повышение уровня ПСП отмечается через 1,5—2 ч после начала клинического проявления инфекции. В настоящее время установлено, что уровень ПСП менее 200 пг/мл указывает на отсутствие сепсиса, более 300 пг/мл — на то, что сепсис возможен, более 500 пг/мл — на умеренный риск тяжелого сепсиса, более 1000 пг/мл — на высокий риск развития тяжелого сепсиса и септического шока [28, 29]. Чувствительность данного маркера составляет 91,9%, что выше по сравнению с прокальцитонином (88,9%), IL-6 (88,9%) или гемокультурой (35,4%) [27, 29, 30].
Индикаторы и маркеры для мониторирования и прогнозирования исхода сепсиса
TNF-α и IL-1β высвобождаются в течение нескольких минут после воздействия LPS. Существуют два известных воспалительных медиатора: белок с высокой подвижностью группы 1 (HMGB1) и ингибитор миграции макрофагов (MIF), которые важны на поздней стадии тяжелых инфекций.
HMGB1 представляет собой цитоплазматический и ядерный белок, который не обнаруживается у здоровых людей. Его выделяют активированные моноциты или некротические ткани во время инфекции или травмы. Этот провоспалительный цитокин достигает обнаруживаемых уровней через 8—12 ч и плато через 18—32 ч. Концентрация плазменного HMGB1 увеличивается у пациентов с сепсисом и коррелирует со степенью органной недостаточности [31, 32]. Уровни HMGB1 более 4 нг/мл на 3-й день после развития сепсиса были связаны с 5,5-кратным повышенным риском смерти [33].
С-реактивный белок (CRP), не являясь специфическим маркером сепсиса, давно признан как врожденный опсонин, т. е. белок, способный распознавать микробы и способствовать их поглощению фагоцитами. Его содержание повышается при развитии инфекции и снижается по мере ее угасания. Эти характеристики позволяют относить CRP к классу острофазных реагентов. CRP — это классический биомаркер, который обычно используют в клинических условиях. CRP относят к неспецифическим маркерам воспаления, который также увеличивается после операции, ожога, инфаркта миокарда и ревматических заболеваний [36]. Чувствительность и специфичность CRP в качестве маркера для бактериальных инфекций составляют 68—92 и 40—67% соответственно [37, 38]. Его низкая специфичность и неспособность дифференцировать бактериальные инфекции от неинфекционных причин воспаления ограничивают диагностическую ценность CRP. Тем не менее CRP перспективен для оценки тяжести и прогноза сепсиса. Показано, что уровень CRP в плазме коррелирует с тяжестью инфекции [39]. Быстрое снижение уровня СRP коррелирует с хорошим защитным ответом на первоначальную антимикробную терапию у больных сепсисом [40]. CRP является полезным биомаркером для мониторинга реакции на лечение. Однако клиницисты не могут интерпретировать изменения уровней CRP без учета кинетики этого маркера [2].
Прокальцитонин (PCT) является предшественником гормона кальцитонина (CТ). Концентрация PCT в крови повышается при бактериальной инфекции. Этот факт способствовал тому, что PCT стали использовать в качестве маркера бактериальных инфекций. На современном этапе именно тест на PCT отвечает большинству требований к идеальному биомаркеру [2].
Бактериальные эндотоксины и провоспалительные цитокины являются сильными стимуляторами образования PCT. Предполагают, что PCT при сепсисе играет патогенную роль. Во время сепсиса наблюдается достоверное повышение уровня PCT в плазме, особенно в первые дни развития сепсиса. У пациентов, синдром системного воспалительного ответа которых обусловлен небактериальной инфекцией, как правило, уровень PCT находится в нижней области (менее 1 нг/мл). В ранней фазе после тяжелой сочетанной и множественной травмы или обширной операции, после тяжелых ожогов, а также у новорожденных уровень PCT может быть повышен независимо от инфекционного процесса. Возврат к нормальным значениям происходит обычно быстро, повторное повышение концентрации PCT в этих случаях можно расценивать как развитие нового септического эпизода. Вирусные инфекции, бактериальная интервенция, местные инфекции, аллергические состояния, аутоиммунные заболевания и отторжение трансплантата обычно не приводят к заметному повышению концентрации PCT (
При вирусных и грибковых инфекциях, а также при аллергических и аутоиммунных заболеваниях уровень PCT значимо не возрастает, что позволяет проводить дифференциальный диагноз [43, 44].
Полученные данные свидетельствуют о том, что чувствительность, специфичность, позитивная и негативная предиктивная ценность были наиболее высокими для РСТ, за ним следовал CRP, а на последнем месте по диагностической значимости находились показатели лейкоцитов крови. Обширные повреждения тканей из-за травмы или гипоксии в отсутствие признаков бактериальной инфекции могут вызвать транзиторное повышение уровня РСТ.
Таким образом, концентрация РСТ является хорошим показателем, дополняющим клинические и лабораторные исследования. В отличие от методов определения всех известных маркеров воспаления метод определения РСТ более чувствителен и высокоспецифичен для тяжелой бактериальной инфекции. К достоинству теста относится возможность его проведения в экстренных клинических ситуациях (у постели больного), при мониторировании больных в палатах интенсивной терапии и в качестве прогностического маркера при прогрессировании инфекционного процесса. Тест отличается высокой точностью измерения в диапазоне низких значений от 0,1 до 5 нг/мл, что особенно важно при очаговых инфекциях без признаков бактериемии [2]. Несмотря на то что точная функция РСТ в воспалительной реакции и цитокиновом каскаде остается неизвестной, использование теста в клинике уже сейчас оценивается чрезвычайно высоко [45].
Уровень лактата в сыворотке может отражать тканевую гипоперфузию и анаэробный метаболизм при сепсисе. Повышенный уровень лактата в основном обусловлен увеличением гликолиза и образованием лактата, а также сниженной оксигенацией тканей. Несколько исследований [46—48] показали, что повышение уровня лактата связано со смертностью у пациентов с сепсисом. В ретроспективном исследовании у больных, находящихся в критическом состоянии, при повышении уровня лактата в сыворотке более 2 ммоль/л наблюдали 2—10-кратное повышение летальности по сравнению с больными, у которых уровень лактата был ниже 2 ммоль/л [49]. Устойчивая гиперлактатемия увеличивает риск внутрибольничной смертности [50]. Существуют подтверждения полезности мониторинга серийного уровня лактата крови и его ценности как прогностического маркера внутрибольничной смертности [48]. Таким образом, скрининг и мониторинг лактата могут быть ценными инструментами для стратификации риска и прогнозирования исхода сепсиса.
Маркеры клеточной поверхности и растворимые рецепторы
CD64 представляет собой мембранный гликопротеин с повышенной экспрессией у пациентов с бактериальными инфекциями. Повышение уровня CD64 может отражать очень ранние стадии заражения, помочь в ранней диагностике и предсказать прогноз заболевания. Индекс CD64 чувствителен к грамположительной инфекции [55]. Индексы CD64, превышающие 2,2, являются специфическими (специфичность 89%), но менее чувствительны (чувствительность 63%) для прогнозирования бактериальных инфекций у больных, находящихся в критическом состоянии [56]. В некоторых работах показано [57], что CD64 может быть маркером бактериальной инфекции с чувствительностью и специфичностью 79 и 91% соответственно. Однако, поскольку опубликованные исследования имеют низкое методологическое качество, необходимы дальнейшие исследования для проверки этих результатов.
Рецептор активатора урокиназного плазминогена (uPAR) является рецептором поверхностной сигнализации, выраженным на большинстве лейкоцитов. Он участвует в многочисленных иммунологических функциях, включая клеточную адгезию, дифференцировку, пролиферацию и ангиогенез, а также миграцию [64]. Во время воспалительных процессов uPAR отщепляется от поверхности клетки протеазами и выделяется в виде растворимого uPAR (suPAR). Он измеряется в крови и биологических жидкостях организма, включая мочу, спинномозговую жидкость, бронхиальную промывочную жидкость и слюну. Уровни suPAR в плазме отражают иммунную активацию в ответ на бактериальную или вирусную инфекцию, рак, ожоги и ревматические заболевания. Уровни suPAR значительно выше у пациентов с сепсисом, чем у пациентов с банальным воспалением, и выше у пациентов с тяжелыми заболеваниями, чем у пациентов контрольной группы [65]. Однако suPAR имеет более низкое диагностическое значение для сепсиса, чем CRP или PCT [65, 66]. В нескольких исследованиях [66—68] предположено, что suPAR является информативным маркером тяжести сепсиса. Исследования Y. Backes и соавт. [66] показали, что suPAR превосходил другие биомаркеры, включая CRP, PCT и sTREM-1 для прогнозирования исхода заболевания. Вероятно, suPAR может иметь большую прогностическую ценность для прогнозирования смертности, а не для диагностики [2].
Комбинированные системы диагностики и мониторинга сепсиса
Таким образом, в настоящее время для раннего выявления сепсиса наиболее эффективно определение уровня пресепсина. Для мониторирования больных в палатах интенсивной терапии, для выбора антибактериальной терапии и в качестве прогностического маркера наряду с пресепсином, эффективно определение уровня прокальцитонина.
информацию о наличии сепсиса, о его тяжести и о текущем прогнозе его развития.
Идеальный маркер сепсиса должен также обеспечивать надежный мониторинг
эффективности терапии и оперативно менять ее тактику.
Традиционные маркеры сепсиса, такие как С-реактивный белок,
прокальцитонин, лактат, эндотоксин и др. не отвечают вышеперечисленным
требованиям. Однако недавние клинические исследования нового биомаркера,
названного пресепсином, показали, что он является многообещающим ранним и
прогностическим маркером сепсиса [6, 7].
Пресепсин (ПСП) – это белок (мол. масса 13 КДа) являющийся N-концевым
фрагментом рецептора макрофагов CD14. CD14 – это белок, существующий в двух
формах: 1) связанной с мембраной (mCD14) и присутствующей на поверхности
макрофагов, моноцитов и гранулоцитов и 2) в растворимой (sCD14, s – soluble,
растворимый), циркулирующей в кровотоке. mCD14 – рецептор, ответственный за
трансдукцию эндотоксинового сигнала внутрь клеток. Выход mCD14 в кровоток и
образование sCD14 связаны с инфекцией и с некоторыми другими патологическими
состояниями. При активации бактериального фагоцитоза sCD14 и mCD14
расщепляются лизосомальными протеиназами с образованием фрагмента, исходно
названного sCD14-subtype (sCD14-ST), а потом переименованного в пресепсин [6, 7].
Один из механизмов образования ПСП связан с бактериальным фагоцитозом и
расщеплением mCD14 лизосомальными ферментам (рис. 1) [8].
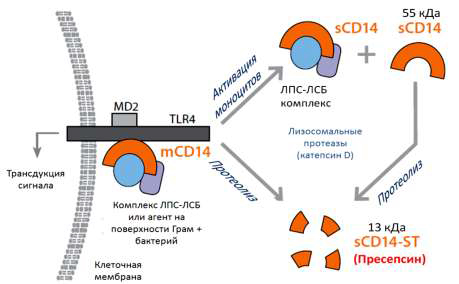
Рис. 1. Механизм образования ПСП.
mCD14 – СD14, связанный с мембраной, sCD14 – растворимый CD14, sCD14-ST – пресепсин, ЛПС –
липополисахарид, ЛСБ – липополисахарид связывающий белок, TLR4 – толл-подобный рецептор 4; MD2 – белок,
связанный с TLR4. Подробности в тексте.
Показано, что ПСП повышается в связи с инфекцией и специфически
продуцируется при сепсисе, связанном с грамотрицательными и
грамположительными бактериями, с грибками, при вирусных инфекция ПСП не
продуцируется [9, 10]. Недавно был разработан новый диагностический инструмент –
хемилюминесцентный иммуноферментный анализатор PATHFAST, который _______за 17
мин проводит полностью автоматические измерения важнейших биомаркеров
различных критических состояний и в особенности – пресепсина.
Эффективность ПСП для диагностики сепсиса. Измерения уровней ПСП при
разных патологических состояниях помощью экспресс-анализатора PATHFAST
показали, что этот маркер является высоко специфическим по отношении к сепсису
[7]. Анализ чувствительности и специфичности ПСП, проведенный в различных
исследованиях, продемонстрировал, что он обеспечивает: 1) раннюю диагностику
сепсиса непосредственно при поступлении пациента, 2) прогнозирование течения
заболевания и 3) оценку риска неблагоприятных исходов. Согласно результатам
клинических исследований уровни ПСП имеют сильную связь со степенью тяжести
сепсиса и 30-дневной смертностью.
В недавнем проспективном исследовании 859 пациентов с ССВО, поступивших
в отделения неотложной терапии (ОНТ) подтверждено, что ПСП – высоко
эффективный биомаркер, действительно пригодный для ранней диагностики сепсиса,
стратификации риска, мониторинга терапии и прогнозирования исходов у септических
пациентов [11]. Данное исследование показало, что одновременное измерение
уровней ПСП и оценка тяжести пациентов с помощью шкал MEDS и APACHE II
значительно улучшает точность прогнозирования развития тяжелого сепсиса.
Предварительные исследования показали также, что ПСП – весьма
перспективный маркер неонатального и педиатрического сепсиса [12].
К сожалению, несмотря на широкое применение современных антибиотиков и
высокотехнологичных методов реанимации, сепсис все еще является главной
причиной смертности пациентов в ОНТ и в ОРИТ, поэтому ранняя диагностика
сепсиса сразу при поступлении пациентов – ключевой момент для повышения
выживаемости таких больных. ПСП - многообещающий маркер для решения этой
Эффективность ПСП для прогнозирования сепсиса. При сепсисе
повышение ПСП сильно связано с повышением риска неблагоприятного исхода, а
снижение – с повышением шансов выживания. Более того, как показано в
специальном исследовании, именно ПСП, по сравнению с другими маркерами
сепсиса, наилучшим образом отражает динамику тяжести сепсиса (рис. 2) [13].
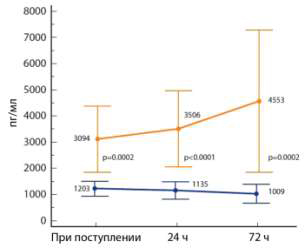
Рис. 2. Динамика ПСП у септических пациентов
с благоприятным исходом (внизу) и у не выживших (вверху).
Недавнее многоцентровое ретроспективное рандомизированное исследование,
в котором наблюдались пациенты, поступившие в ОИТ с сепсисом и септическим
шоком, показало, что уровни ПСП адекватно отражают изменение тяжести патологии
у впоследствии выживших и не выживших пациентов [14].
1.Согласно существующей практике, измерение широко используемых
маркеров сепсиса проводится в центральной лаборатории, что ведет к существенной
задержке получения срочной и жизненно важной диагностической информации.
2. Ни один из ныне широко используемых маркеров сепсиса не сочетает в себе
возможности для ранней диагностики сепсиса, стратификации рисков, с ним
связанных, прогнозирования и мониторинга течения сепсиса.
3. Пресепсин – новый, многообещающий маркер, который позволяет через 17
минут после взятия крови проводить:
а) раннюю и точную дифференциальную диагностику ССВО и сепсиса,
б) оценку тяжести сепсиса,
в) оперативный мониторинг эффективности его терапии,
г) прогнозирование его исхода, особенно эффективное при параллельной
оценке тяжести пациента согласно шкалам APACHEII, SOFA и MEDS.
4. Измерение уровней ПСП возможно оперативно проводить непосредственно
при поступлении пациента в ОНТ, ОИТ, ОРИТ и в операционном блоке (тестирование
Point-of-Care), что обеспечит своевременное принятие обоснованных клинических
Диагностические уровни пресепсина, пг/мл
Умеренный риск развития системой инфекции (тяжелого
сепсиса / септического шока).
Высокий риск 30-дневной смертности, сравнимый с таковым
1. Levy MM, Fink MP, Marshall JC, et al. 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions
Conference. Crit Care Med. 2003;31(4):1250-6.
2. Bone RC, Balk RA, Cerra FB, et al. Definitions for sepsis and organ failure and guidelines for the use of
innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of
Chest Physicians/Society of Critical Care Medicine. Chest. 1992;101(6):1644-55.
prospectively derived and validated clinical prediction rule. Crit Care Med. 2003;31(3):670-5.
4. Kumar A, Roberts D, Wood KE, et al. Duration of hypotension before initiation of effective antimicrobial
therapy is the critical determinant of survival in human septic shock. Crit Care Med. 2006;34(6):1589-96.
5. Dellinger RP, Levy MM, Rhodes A, et al. Surviving sepsis campaign: international guidelines for
management of severe sepsis and septic shock: 2012. Crit Care Med. 2013;41(2):580-637.
6. Shozushima T, Takahashi G, Matsumoto N, et al. Usefulness of presepsin (sCD14-ST) measurements as
a marker for the diagnosis and severity of sepsis that satisfied diagnostic criteria of systemic inflammatory
response syndrome. J Infect Chemother. 2011;17(6):764-9.
7. Spanuth E, Wilhelm J, Loppnow H, et al. Diagnostic and Prognostic Value of Presepsin (Soluble CD14
Subtype) in Emergency Patients with Early Sepsis Using the New Assay PATHFAST Pesepsin. IFCC World
Lab/EuroMedLab. 2011 May.
8. Naitoh K, Shirakawa K, Hirose J, et al. The new sepsis marker, sCD14-ST (PRESEPSIN), induction
mechanism in the rabbit sepsis models. SEPSIS 2010; poster:P-19.
9. Yaegashi Y, Shirakawa K, Sato N, et al. Evaluation of a newly identified soluble CD14 subtype as a marker
for sepsis. J Infect Chemother. 2005;11(5):234-8.
10. Kojika M, Takahashi G, Matsumoto N, et al. Serum levels of soluble CD14 subtype reflect the APACHE II
11. Liu B, Chen YX, Yin Q, et al. Diagnostic value and prognostic evaluation of Presepsin for sepsis in an
emergency department. Crit Care. 2013;17(5):R244.
12. Mussap M, Puxeddu E, Burrai P et al. Soluble CD14 subtype (sCD14-ST) presepsin in critically ill preterm
newborns: preliminary reference ranges. J Matern Fetal Neonatal Med. 2012;25(Suppl 5):51-3.
13. Endo S, Suzuki Y, Takahashi G, et al. Presepsin as a powerful monitoring tool for the prognosis and
treatment of sepsis: A multicenter prospective study. J Infect Chemother. 2013,
14. Masson S, Caironi P, Spanuth E, et al. Presepsin (soluble CD14 subtype) and procalcitonin levels for
Кафедра факультетской хирургии Российского университета дружбы народов, Москва
Кафедра факультетской хирургии Российского университета дружбы народов (зав. — д.м.н., проф. А.Е. Климов)
Кафедра факультетской хирургии Российского университета дружбы народов, Москва, Россия
Кафедра факультетской хирургии Российского университета дружбы народов, Москва
Биомаркеры и индикаторы воспаления в диагностике и прогнозе абдоминального сепсиса
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2018;(10): 92‑98
Кафедра факультетской хирургии Российского университета дружбы народов, Москва
На сегодняшний день необходимо признать, что основной проблемой в ургентной хирургии остается лечение больных с абдоминальным сепсисом в силу стабильно высокой летальности. Ранняя диагностика и целенаправленная терапия — это ключевые моменты для улучшения исхода сепсиса. В настоящее время исследователями всего мира предложено достаточно большое количество биологических маркеров для диагностики сепсиса и прогнозирования его исхода. В идеале биомаркеры можно использовать для определения риска, диагностики, мониторинга эффективности лечения и прогнозирования исхода. Биомаркер — это лабораторный показатель, который можно объективно измерить и охарактеризовать как индикатор нормальных и патологических биологических процессов. В статье сепсис рассматривается с позиций современной концепции патогенеза для понимания роли различных биомаркеров и индикаторов воспаления в его развитии. Проведен анализ литературных данных и представлены обобщающие сведения о возможности использования отдельных биологических маркеров и их комбинаций в раннем выявлении сепсиса, для мониторирования заболевания и прогнозирования его исхода.
Кафедра факультетской хирургии Российского университета дружбы народов, Москва
Кафедра факультетской хирургии Российского университета дружбы народов (зав. — д.м.н., проф. А.Е. Климов)
Кафедра факультетской хирургии Российского университета дружбы народов, Москва, Россия
Кафедра факультетской хирургии Российского университета дружбы народов, Москва
Сепсис является результатом сложной цепочки событий, состоящей из врожденных и адаптивных иммунных реакций, включая активацию системы комплемента, каскадов коагуляции и дисфункции сосудистой эндотелиальной системы. Кроме того, иммунные ответы основаны на индивидуальных особенностях пациента, включая возраст, основные заболевания, состояние питания и даже генетическую изменчивость [1—3]. По этой причине лечение, особенно иммунотерапия, должно быть индивидуализировано. Данный факт подчеркивает необходимость раннего и точного обнаружения сепсиса. Однако микробиологический диагноз не может быть установлен примерно у трети пациентов с клиническими проявлениями сепсиса [4]. Бактериологическое подтверждение инфекции при системной инфекции может отсутствовать, в то время как положительные бактериологические результаты могут быть вызваны случайной контаминацией [5—7].
Повреждения органов при сепсисе развиваются в результате неконтролируемого распространения из первичного очага инфекционного воспаления провоспалительных медиаторов эндогенного происхождения. В дальнейшем под их влиянием происходит активация клеточных медиаторов воспаления в других органах и тканях с вторичным выделением аналогичных эндогенных субстанций, повреждением эндотелия и снижением органной перфузии и доставки кислорода [5]. Таким образом, повышение уровней гуморальных и клеточных индикаторов воспаления свидетельствует о развитии воспаления в организме больного.
Идеальный биомаркер сепсиса и индикатор воспаления должны быть объективно измерены и достоверно отражать биологические и патогенные процессы, а также ответы на проводимое лечение [8]. К настоящему времени для оценки сепсиса изучено более 170 биомаркеров [9].
Развитие сепсиса меняет экспрессию и активность тысяч эндогенных медиаторов воспаления, коагуляции и промежуточного метаболизма [10, 11]. Тем не менее идеальные биомаркеры могут играть определенную роль в скрининге сепсиса, ранней диагностике, обосновании лечения, критической оценке течения заболевания и его прогнозе [11, 12].
Индикаторы и маркеры для раннего выявления сепсиса
Традиционная модель сепсиса — это иммунный ответ, активируемый, когда толл-подобные рецепторы (TLR) распознают консервативные структуры микроорганизмов и активируют клеточный иммунный ответ. Это распознавание стимулирует секрецию провоспалительных цитокинов, таких как TNF-α, IL-1β и IL-6. Поэтому различные воспалительные цитокины и липополиcахарид (LPS)-связывающий белок были изучены как биомаркеры сепсиса.
LPS-связывающий белок (LBP), главным образом синтезированный в печени, представляет собой полипептид, который связывает бактериальный LPS. Этот сложный комплекс имеет двойное действие, усиливающее и подавляющее сигнализацию LPS на низких и более высоких уровнях соответственно [18]. Уровень LBP в сыворотке увеличивается в несколько раз при сепсисе, что делает его полезным для диагностики [19, 20]. Он также может быть эффективным как прогностический маркер тяжести заболевания и прогноза заболевания [21]. Однако уровень LPS и LBP зависит от введения антибиотиков и, как правило, не коррелирует с клиническим течением сепсиса [22], поэтому имеет ограниченное применение в качестве биомаркера сепсиса [2].
Пресепсин (ПСП) — маркер, концентрация которого быстро растет при развитии сепсиса. ПСП представляет собой белок, который является фрагментом рецептора макрофагов CD14 (mCD14 и sCD14). Образование ПСП связано с инфекцией, бактериальным фагоцитозом и расщеплением mCD14 лизосомальными ферментами. При активации бактериального фагоцитоза sCD14 и mCD14 расщепляются лизосомальными протеиназами с образованием фрагмента — ПСП [23, 24].
В ответ на бактериальную инфекцию концентрация ПСП резко возрастает. Уровень ПСП в крови можно быстро выявить с помощью иммуноферментного анализа, что имеет огромное значение для ранней диагностики инфекционного процесса [25—27].
Содержание ПСП повышается при инфекции, он специфически продуцируется при сепсисе, связанном с грамотрицательными и грамположительными бактериями, грибками. В случае вирусных инфекций ПСП не продуцируется [28].
Повышение уровня ПСП отмечается через 1,5—2 ч после начала клинического проявления инфекции. В настоящее время установлено, что уровень ПСП менее 200 пг/мл указывает на отсутствие сепсиса, более 300 пг/мл — на то, что сепсис возможен, более 500 пг/мл — на умеренный риск тяжелого сепсиса, более 1000 пг/мл — на высокий риск развития тяжелого сепсиса и септического шока [28, 29]. Чувствительность данного маркера составляет 91,9%, что выше по сравнению с прокальцитонином (88,9%), IL-6 (88,9%) или гемокультурой (35,4%) [27, 29, 30].
Индикаторы и маркеры для мониторирования и прогнозирования исхода сепсиса
TNF-α и IL-1β высвобождаются в течение нескольких минут после воздействия LPS. Существуют два известных воспалительных медиатора: белок с высокой подвижностью группы 1 (HMGB1) и ингибитор миграции макрофагов (MIF), которые важны на поздней стадии тяжелых инфекций.
HMGB1 представляет собой цитоплазматический и ядерный белок, который не обнаруживается у здоровых людей. Его выделяют активированные моноциты или некротические ткани во время инфекции или травмы. Этот провоспалительный цитокин достигает обнаруживаемых уровней через 8—12 ч и плато через 18—32 ч. Концентрация плазменного HMGB1 увеличивается у пациентов с сепсисом и коррелирует со степенью органной недостаточности [31, 32]. Уровни HMGB1 более 4 нг/мл на 3-й день после развития сепсиса были связаны с 5,5-кратным повышенным риском смерти [33].
С-реактивный белок (CRP), не являясь специфическим маркером сепсиса, давно признан как врожденный опсонин, т. е. белок, способный распознавать микробы и способствовать их поглощению фагоцитами. Его содержание повышается при развитии инфекции и снижается по мере ее угасания. Эти характеристики позволяют относить CRP к классу острофазных реагентов. CRP — это классический биомаркер, который обычно используют в клинических условиях. CRP относят к неспецифическим маркерам воспаления, который также увеличивается после операции, ожога, инфаркта миокарда и ревматических заболеваний [36]. Чувствительность и специфичность CRP в качестве маркера для бактериальных инфекций составляют 68—92 и 40—67% соответственно [37, 38]. Его низкая специфичность и неспособность дифференцировать бактериальные инфекции от неинфекционных причин воспаления ограничивают диагностическую ценность CRP. Тем не менее CRP перспективен для оценки тяжести и прогноза сепсиса. Показано, что уровень CRP в плазме коррелирует с тяжестью инфекции [39]. Быстрое снижение уровня СRP коррелирует с хорошим защитным ответом на первоначальную антимикробную терапию у больных сепсисом [40]. CRP является полезным биомаркером для мониторинга реакции на лечение. Однако клиницисты не могут интерпретировать изменения уровней CRP без учета кинетики этого маркера [2].
Прокальцитонин (PCT) является предшественником гормона кальцитонина (CТ). Концентрация PCT в крови повышается при бактериальной инфекции. Этот факт способствовал тому, что PCT стали использовать в качестве маркера бактериальных инфекций. На современном этапе именно тест на PCT отвечает большинству требований к идеальному биомаркеру [2].
Бактериальные эндотоксины и провоспалительные цитокины являются сильными стимуляторами образования PCT. Предполагают, что PCT при сепсисе играет патогенную роль. Во время сепсиса наблюдается достоверное повышение уровня PCT в плазме, особенно в первые дни развития сепсиса. У пациентов, синдром системного воспалительного ответа которых обусловлен небактериальной инфекцией, как правило, уровень PCT находится в нижней области (менее 1 нг/мл). В ранней фазе после тяжелой сочетанной и множественной травмы или обширной операции, после тяжелых ожогов, а также у новорожденных уровень PCT может быть повышен независимо от инфекционного процесса. Возврат к нормальным значениям происходит обычно быстро, повторное повышение концентрации PCT в этих случаях можно расценивать как развитие нового септического эпизода. Вирусные инфекции, бактериальная интервенция, местные инфекции, аллергические состояния, аутоиммунные заболевания и отторжение трансплантата обычно не приводят к заметному повышению концентрации PCT (
При вирусных и грибковых инфекциях, а также при аллергических и аутоиммунных заболеваниях уровень PCT значимо не возрастает, что позволяет проводить дифференциальный диагноз [43, 44].
Полученные данные свидетельствуют о том, что чувствительность, специфичность, позитивная и негативная предиктивная ценность были наиболее высокими для РСТ, за ним следовал CRP, а на последнем месте по диагностической значимости находились показатели лейкоцитов крови. Обширные повреждения тканей из-за травмы или гипоксии в отсутствие признаков бактериальной инфекции могут вызвать транзиторное повышение уровня РСТ.
Таким образом, концентрация РСТ является хорошим показателем, дополняющим клинические и лабораторные исследования. В отличие от методов определения всех известных маркеров воспаления метод определения РСТ более чувствителен и высокоспецифичен для тяжелой бактериальной инфекции. К достоинству теста относится возможность его проведения в экстренных клинических ситуациях (у постели больного), при мониторировании больных в палатах интенсивной терапии и в качестве прогностического маркера при прогрессировании инфекционного процесса. Тест отличается высокой точностью измерения в диапазоне низких значений от 0,1 до 5 нг/мл, что особенно важно при очаговых инфекциях без признаков бактериемии [2]. Несмотря на то что точная функция РСТ в воспалительной реакции и цитокиновом каскаде остается неизвестной, использование теста в клинике уже сейчас оценивается чрезвычайно высоко [45].
Уровень лактата в сыворотке может отражать тканевую гипоперфузию и анаэробный метаболизм при сепсисе. Повышенный уровень лактата в основном обусловлен увеличением гликолиза и образованием лактата, а также сниженной оксигенацией тканей. Несколько исследований [46—48] показали, что повышение уровня лактата связано со смертностью у пациентов с сепсисом. В ретроспективном исследовании у больных, находящихся в критическом состоянии, при повышении уровня лактата в сыворотке более 2 ммоль/л наблюдали 2—10-кратное повышение летальности по сравнению с больными, у которых уровень лактата был ниже 2 ммоль/л [49]. Устойчивая гиперлактатемия увеличивает риск внутрибольничной смертности [50]. Существуют подтверждения полезности мониторинга серийного уровня лактата крови и его ценности как прогностического маркера внутрибольничной смертности [48]. Таким образом, скрининг и мониторинг лактата могут быть ценными инструментами для стратификации риска и прогнозирования исхода сепсиса.
Маркеры клеточной поверхности и растворимые рецепторы
CD64 представляет собой мембранный гликопротеин с повышенной экспрессией у пациентов с бактериальными инфекциями. Повышение уровня CD64 может отражать очень ранние стадии заражения, помочь в ранней диагностике и предсказать прогноз заболевания. Индекс CD64 чувствителен к грамположительной инфекции [55]. Индексы CD64, превышающие 2,2, являются специфическими (специфичность 89%), но менее чувствительны (чувствительность 63%) для прогнозирования бактериальных инфекций у больных, находящихся в критическом состоянии [56]. В некоторых работах показано [57], что CD64 может быть маркером бактериальной инфекции с чувствительностью и специфичностью 79 и 91% соответственно. Однако, поскольку опубликованные исследования имеют низкое методологическое качество, необходимы дальнейшие исследования для проверки этих результатов.
Рецептор активатора урокиназного плазминогена (uPAR) является рецептором поверхностной сигнализации, выраженным на большинстве лейкоцитов. Он участвует в многочисленных иммунологических функциях, включая клеточную адгезию, дифференцировку, пролиферацию и ангиогенез, а также миграцию [64]. Во время воспалительных процессов uPAR отщепляется от поверхности клетки протеазами и выделяется в виде растворимого uPAR (suPAR). Он измеряется в крови и биологических жидкостях организма, включая мочу, спинномозговую жидкость, бронхиальную промывочную жидкость и слюну. Уровни suPAR в плазме отражают иммунную активацию в ответ на бактериальную или вирусную инфекцию, рак, ожоги и ревматические заболевания. Уровни suPAR значительно выше у пациентов с сепсисом, чем у пациентов с банальным воспалением, и выше у пациентов с тяжелыми заболеваниями, чем у пациентов контрольной группы [65]. Однако suPAR имеет более низкое диагностическое значение для сепсиса, чем CRP или PCT [65, 66]. В нескольких исследованиях [66—68] предположено, что suPAR является информативным маркером тяжести сепсиса. Исследования Y. Backes и соавт. [66] показали, что suPAR превосходил другие биомаркеры, включая CRP, PCT и sTREM-1 для прогнозирования исхода заболевания. Вероятно, suPAR может иметь большую прогностическую ценность для прогнозирования смертности, а не для диагностики [2].
Комбинированные системы диагностики и мониторинга сепсиса
Таким образом, в настоящее время для раннего выявления сепсиса наиболее эффективно определение уровня пресепсина. Для мониторирования больных в палатах интенсивной терапии, для выбора антибактериальной терапии и в качестве прогностического маркера наряду с пресепсином, эффективно определение уровня прокальцитонина.
Читайте также:

