Бисептол при токсоплазмозе кошек
Обновлено: 25.04.2024
Каковы диагностические признаки острых и хронических синуситов? Показаны ли антибиотики, и если да, то в каком случае? Каких пациентов стоит направлять к специалистам? Oбзоры, касающиеся диагностики и лечения болезней придаточных
Каковы диагностические признаки острых и хронических синуситов?
Показаны ли антибиотики, и если да, то в каком случае?
Каких пациентов стоит направлять к специалистам?
Oбзоры, касающиеся диагностики и лечения болезней придаточных пазух носа (ППН), чаще всего вызывают множество новых вопросов, поскольку точный диагноз осложняется неспецифичностью неинвазивных методов обследования. Эмпирическое лечение, особенно с помощью антибиотиков, как правило, считается успешным, хотя во многих случаях наступает спонтанное выздоровление без какого-либо лечения.
Цель этого обзора — осветить современные представления о природе воспаления ППН и дать логические и фактические обоснования медикаментозного либо хирургического лечения.
Анатомия и физиология. Носовая полость и ППН наделены важными физиологическими функциями. Преимущественно через полость носа проходит вдыхаемый и выдыхаемый воздух, поэтому нос должен обладать защитными механизмами, способными оградить воздухоносные пути от вдыхаемых патогенов и инородных тел.
 |
| Рисунок 1. Слизь стекает назад в носоглотку вследствие движений ресничек |
Железы реснитчатого эпителия носа и ППН производят поверхностный слизистый слой. Он задерживает частички веществ, а реснички, находящиеся в постоянном движении, проталкивают их назад, в носоглотку (см. рис. 1).
И верхнечелюстная, и лобная пазухи вентилируются через каналы, в свою очередь проходящие через переднюю решетчатую область. Очень важно, чтобы эти пути оставались проходимыми, поскольку нормальный отток слизи нужен для поддержания воздухонаполнения пазух.
Важная роль передних клеток решетчатого лабиринта и среднего носового хода в физиологии ППН подтверждается тем, что эта область получила название “остеомеатальный комплекс” (рис. 2). Считается, что легкое ограниченное воспаление в этой области может привести к вторичному инфицированию верхнечелюстного и фронтального синуса. Это во многом справедливо, хотя патогенез синуситов более сложен.
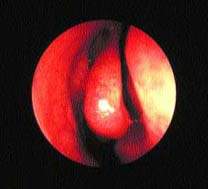 |
| Рисунок 2. Нормальный средний носовой ход — область “остиомеатального комплекса” |
Микробиология. Носовая полость и ППН заселены нормальной бактериальной флорой; в норме там обнаруживаются те же микроорганизмы, что и в инфицированных пазухах. Многие инфекционные процессы в пазухах имеют вирусную природу; бактерии присоединяются вторично.
При остром синусите чаще всего выделяют Streptococculs pneulmoniae, Heamophiluls influlenzae и Moraxella catarrhalis.
При хронических синуситах обычно присутствуют те же микроорганизмы, а также анаэробы, такие как штаммы Fulsobacteriulm, Staphylococculs aulreuls, изредка грамотрицательные бактерии, например штаммы Pseuldomonas. В последние годы участились случаи диагностики синуситов, вызванных грибами, как правило, у иммунодефицитных пациентов. Чаще всего обнаруживаются штаммы Aspergilluls, а выраженность клинических проявлений зависит от имунного статуса пациента.
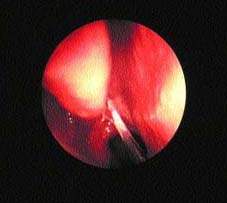
 |
| Рисунок 3. Гной в среднем носовом ходе при остром синусите |
Все больше диагностируется аллергических синуситов, часто ассоциированных с назальными полипами.
Клиника. С позиций оториноларингологической хирургии понятия об анатомии, физиологии и патологии ППН в корне изменились с появлением жесткой эндоскопии носовой полости и возможности компьютерного сканирования (КТ) синусов.
Однако ни один из этих диагностических методов не доступен для врача общей практики, которому нередко приходится ставить диагноз и лечить синусит на основании клинических симптомов.
Часто жалобы больных при остром и хроническом синуситах совпадают, поэтому своевременный подход предполагает, что при попытке различать эти состояния врач опирается скорее на патофизиологию, чем на соображения длительности заболевания.
 |
| Рисунок 4. Компьютерное сканирование синусов |
Синусит считается острым, когда инфекция разрешается под действием медикаментозной терапии, не оставляя значительных повреждений слизистых. Острые эпизоды могут быть рецидивирующими по своей природе; хронический синусит — постоянное заболевание, которое не поддается только медикаментозному лечению. При разграничении этих состояний проблема заключается в том, что для хирургического лечения всегда находятся показания, хотя в действительности многим пациентам достаточно длительной медикаментозной терапии. Кроме того, хирургическое вмешательство не дает стопроцентного успеха.
У многих пациентов с острым синуситом в анамнезе началу заболевания предшествует простуда. Симптомы, позволяющие предположить развитие острого синусита:
- гнойные выделения из носа;
- заложенность носа;
- боли и болезненность при обследовании;
- лихорадка и озноб.
В некоторых случаях имеются местные симптомы, позволяющие заподозрить вовлечение различных синусов. При диагностике наиболее достоверным симптомом является жалоба на гнойные выделения из носа или выявление их при обследовании (рис. 3).
Если пациент страдает головными или лицевыми болями при отсутствии гнойных выделений, скорее всего, это не синусит.
При невылеченном синусите инфекция иногда распространяется за пределы пазух, приводя к серьезным осложнениям. Чаще это случается при инфицировании лобной и решетчатой пазух; более всего осложнениям подвержены дети.
При распространении инфекции из фронтального синуса вперед мягкие ткани лба становятся отекшими и болезненными. Первоначально развивается целлюлит, затем субпериостальный абсцесс. Распространение через заднюю стенку фронтального синуса приводит к внутричерепным осложнениям, таким как менингит, субдуральная эмпиема или абсцесс передней доли.
При воспалении решетчатой пазухи инфекция распространяется через тонкую кость бумажной пластинки, приводя к поражению глазницы, сопровождающемуся целлюлитом и орбитальным абсцессом. Нелеченые инфекции глазницы почти всегда ведут к слепоте.
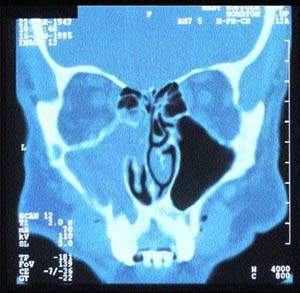 |
| Рисунок 5. Компьютерная томограмма синусов, демонстрирующая односторонний хронический синусит |
При подозрении на осложненный синусит, особенно при отеке мягких тканей глазницы у ребенка, необходима срочная консультация оториноларинголога и уточнение диагноза путем компьютерного сканирования.
Клиническая картина хронического синусита разнообразна. Как и при острой инфекции, заложенность носа и гнойное отделяемое являются постоянными симптомами.Температура не повышается либо повышается умеренно, а жалобы на общее недомогание, головную и лицевую боль типичны. Дополнительно многие пациенты жалуются на снижение обоняния, при этом они чувствуют отвратительный запах гноя в носу.
Простое клиническое обследование носовой полости с помощью отоскопа позволяет обнаруживать крупные полипы; маленькие полипы видны только при эндоскопии носа.
| Промывание верхнечелюстного синуса под местной анестезией теряет былую популярность, так как редко приносит длительное облегчение |
За прошедшее десятилетие участились случаи диагностики острых и хронических синуситов у детей, особенно в Северной Америке. Диагностика и лечение детских синуситов осложняется многими факторами.
Рецидивирующие симптомы поражения верхних дыхательных путей у детей проявляются достаточно часто и, как правило, свидетельствуют о наличии заболевания миндалин и аденоидов, а не первичного синусита. Компьютерное томографическое сканирование детей с симптомами поражения верхних дыхательных путей часто выявляет аномалии ППН, особенно верхнечелюстных.
Клинический опыт показывает, что симптомы синуситов у детей часто сами проходят с возрастом, при этом до сих пор не установлено, вырастают ли из “сопливых” детей “сопливые” взрослые.
Нет сомнения в том, что хронический синусит встречается и у детей, особенно если имеется нарушение функции реснитчатого эпителия. Однако большинство британских лор-хирургов считают, что, насколько это возможно, необходимо придерживаться консервативных методов лечения детей.
Обследование. В общей практике диагноз “синусит”, как правило, ставится на основании клинических данных.
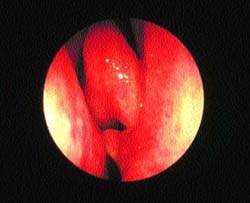 |
| Рисунок 6. “Шпора” перегородки носа, врезающаяся в среднюю носовую раковину, — возможная причина “контактных болей” |
Плоскостная рентгенография пазух чрезвычайно неспецифична и малоинформативна для выявления патологических изменений. Аномалии на таких рентгенограммах обнаруживаются у половины населения. Так, на рентгенограмме может быть выявлено утолщение слизистой верхнечелюстной пазухи, что не совпадает с результатами прямой эндоскопии. Несмотря на это, к плоскостным снимкам прибегают довольно часто, особенно при хронических симптомах.
В руководстве, изданном Королевской коллегией радиологов, говорится, что плоскостная рентгенография не является обязательным рутинным исследованием при заболеваниях ППН].
Наиболее специфичным методом оценки анатомии и патологии пазух носа является компьютерная томография, как правило, в проекции венечного шва (рис. 4).
Компьютерное сканирование пазух дает точную информацию об анатомии пациента и наличии патологических изменений (рис. 5). Однако это исследование следует проводить только после специализированного обследования, включающего и назальную эндоскопию.
Острый синусит. При остром синусите единого мнения о выборе антибиотика и продолжительности курса лечения не существует. С одной стороны, согласно рекомендации североамериканских ринологов, антибиотики следует принимать по крайней мере 14 дней или еще 7 дней после исчезновения симптомов. Согласно данным некоторых исследований, антибиотики не имеют преимуществ по сравнению с плацебо, когда речь идет о лечении синуситоподобных симптомов в общей практике .
Наличие столь противоположных точек зрения нередко только сбивает с толку врача общей практики, сталкивающегося с острым синуситом. Опасность назначения длительного курса антибиотиков заключается в развитии антибиотикорезистентности; кроме того, больные нередко отказываются от продолжительного лечения. Неадекватное лечение скрывает в себе риск остаточной инфекции, при этом всегда сохраняется, хоть и небольшая, вероятность развития осложнений.
 |
| Рисунок 7. Перед направлением к специалисту следует попробовать провести интраназальную стероидную терапию |
Многие пациенты, поступающие с симптомами синусита, выздоравливают спонтанно, без приема антибиотиков; задача врача — своевременно определить, есть ли возможность такого выздоровления.
Предполагается, что успешно решить этот вопрос может помочь КТ-сканирование. Пациенты с уровнем жидкости или при наличии тотального затемнения верхнечелюстных пазух нуждаются в антибиотиках, в то время как больные, у которых при сканировании не выявлено никаких отклонений или речь идет только об утолщении слизистой оболочки, скорее всего, могут выздороветь спонтанно.
Английские врачи общей практики не имеют непосредственного доступа к КТ, и вряд ли она будет им предоставлена для диагностики острого синусита, так как пациент при этом подвергается значительному облучению, а кроме того, исследование стоит достаточно дорого.
С чисто симптоматических позиций наличие гнойного отделяемого из носа и заложенность носа — более достоверные признаки инфицирования пазух, чем другие симптомы, такие как головные и лицевые боли. Для больных с первой группой симптомов оправданно назначение антибиотиков.
При выборе антибиотика необходимо учитывать возможность присутствия пенициллин-резистентных штаммов.
Препаратами первого ряда являются амоксиклав, эритромицин и цефалоспорины, например цефиксим. Те же антибиотики могут быть назначены при хронических инфекциях; в этом случае также полезны производные хинолона, такие как ципрофлоксацин.
Часто при остром синусите в качестве дополнительных средств используются противоотечные препараты, как местные, так и системные. Местные противоотечные, например ксилометазолин, уменьшают отек слизистой и улучшают проводимость воздуха, что теоретически ускоряет выздоровление.
Паровые ингаляции, часто с ароматическими добавками, например с ментолом, приносят облегчение пациенту, усиливая ощущение тока воздуха в носовой полости, но объективно не способствуют выздоровлению.
Хронический синусит. Наличие хронической инфекции ППН подразумевает или собственно заболевание слизистой, или анатомическое препятствие аэрации пазух. В любом случае хронический синусит не поддается только антибиотикотерапии.
Краеугольным камнем лечения в данном случае является стероидная терапия, как правило, с назальным путем введения. Смысл назначения стероидов в уменьшении воспалительного отека и улучшении вентиляции пазух.
Местные стероиды назначают в каплях или в форме спрея. Часто оказываются эффективны местные бетаметазоновые капли, которые нужно вводить, соблюдая правильное положение (голова наклонена вниз) (рис. 7), и применять не более шести недель во избежание возникновения системных побочных эффектов. Преимущество новых стероидных спреев (триамцинолон, будезонид) заключается в однократном примении в течение дня, что удобнее для пациента.
Пациентов следует направлять на консультацию к специалисту, если адекватное медикаментозное лечение оказалось неэффективным или при подозрении на более серьезные заболевания, такие как неоплазия или гранулематоз Вегенера. Часто курс интраназальных стероидов облегчает состояние пациентов с рецидивирующими острыми и хроническими синуситами. Такой курс следует провести перед направлением к оториноларингологу.
Имеется ряд симптомов, заставляющих заподозрить неоплазию и требующих раннего направления к специалисту: односторонние кровянистые выделения из носа, онемение лица, диплопия, глухота, обусловленная выпотом в среднем ухе, и определение интраназального объемного образования при обследовании.
Некоторым пациентам показано хирургическое лечение, причем в основном хирурги предпочитают эндоскопическую этмоидэктомию. Пункции верхнечелюстного синуса под местной анестезией теряют былую популярность, так как редко приносят длительное облегчение и чрезвычайно не нравятся пациентам.
Новые хирургические и анестезиологические методики позволяют в большинстве центров проводить операции на пазухах на базе дневного стационара и избегать рутинной послеоперационной тампонады носа.
Лечение лицевых болей. Значительную часть рабочего времени ринолога занимает диагностика пациентов с лицевыми и головными болями. С появлением синусовой хирургии в лечении заболеваний, сопровождающихся этими симптомами, удалось добиться впечатляющих результатов.
Часто симптомы, присущие синуситу, и жалобы, типичные для мигреней и кластерных головных болей, во многом совпадают.
Если у пациента с лицевыми болями отсутствует заложенность носа или гнойные выделения, а результаты эндоскопии и КТ-сканирования нормальные, то, скорее всего, проблема не в носе и придаточных пазухах, и синусовая хирургия здесь неэффективна, хотя не следует сбрасывать со счетов возможность воздействия плацебо.
Недавно возник интерес к так называемой контактной боли. Предполагается, что при этом состоянии носовая перегородка находится в патологическом контакте с боковой стенкой носа. Обычно это происходит, когда от перегородки отходит острая шпора, упирающаяся в среднюю носовую раковину (рис. 6). Как правило, пациенты жалуются на боль вокруг центральной части лица, отдающую в лоб и глазницы.

Основными хозяевами токсоплазмы являются кошачьи, они заражаются при поедании мяса птиц и грызунов. После попадания в организм кошек паразит запускает цикл размножения. Кошка выделяет инфекционные ооцисты с фекалиями в окружающую среду в течение 1-2 недель. Большинство кошек выделяют ооцисты лишь раз в жизни. При этом ооцисты устойчивы к воздействию неблагоприятных факторов окружающей среды и могут сохранять жизнеспособность до нескольких месяцев. При случайном проглатывании ооцист человеком паразиты проникают в эпителий кишечника и распространяются по всему телу, проникают в нервную и мышечную ткань, где могут оставаться в спящей форме в виде цист на протяжении всей жизни хозяина - это называется латентная инфекция. При снижении иммунитета организма оболочки цист могут разрушиться и паразиты будут размножаться, вызывая обострение инфекции.
Существует четыре основных способа заражения человека токсоплазмозом:
Попадание в организм инфекционных ооцист из окружающей среды (при смене кошачьего лотка, при работе с землей, песком - садоводство)
Проглатывание тканевых кист в мясе инфицированного животного (употребление в пищу плохо термически обработанного мяса)
Вертикальная передача от инфицированной матери ее плоду
Передача при трансплантации органа от инфицированного донора
У иммунокомпетентных пациентов в большинстве случаев не бывает клинических проявлений инфекции, тогда как у пациентов с ослабленным иммунитетом риск развития тяжелой инфекции с осложнениями гораздо выше. К тяжелым формам токсоплазмоза относятся энцефалит, пневмонит, миокардит, хориоретинит.
Опасен токсоплазмоз и для беременных, которые при первичном инфицировании могут инфицировать плод, тем самым подвергая новорожденного ребенка опасности развития тяжелого токсоплазмоза.
Токсоплазмоз у иммунокомпетентных людей.
В редких случаях у некоторых людей инфицирование токсоплазмой может проявляться как острая системная инфекция, которая обычно развивается через 5–23 дня после инфицирования. Симптомы неспецифичны - лихорадка, озноб и пот; головные боли, миалгии, фарингит, гепатоспленомегалия и / или диффузная не зудящая макулопапулезная сыпь, данные симптомы могут сохраняться в течение 2-3 дней.
Наиболее распространенным проявлением является двусторонняя, симметричная, безболезненная шейная лимфаденопатией. Приблизительно у 20-30 процентов развивается генерализованная лимфаденопатия. Лимфатические узлы обычно меньше 3 сантиметров в размере и неподвижны. В отличие от лихорадки, которая длится недолго, лимфаденопатия может сохраняться неделями.
Лабораторные данные неспецифичны - небольшой лимфоцитоз с атипичными клетками (менее 10%) или без них, в биохимическом анализе крови иногда повышение печеночных трансаминаз, С-реактивного белка.
Как правило, первичное инфицирование токсоплазмой такой категории пациентов не требует специфической терапии, симптомы проходят самостоятельно.
Токсоплазмоз при ВИЧ-инфекции.
Токсоплазмоз любой локализации является оппортунистическим заболеванием для пациентов с ВИЧ и указывает на прогрессирование основного заболевания.
К другим опасным формам реактивации токсоплазмоза относятся пневмонит, миокардит, хориоретинит в зависимости от того, где осели и сформировали цисты токсоплазмы во время первичного инфицирования.
Диагностика основана на интерпретации клинической картины: часто при выявлении неврологической симптоматики у пациента с продвинутой стадией ВИЧ-инфекции, врач может заподозрить токсоплазменный энцефалит. В таком случае назначается терапия Бисептолом в лечебных дозах, а подтверждение диагноза проводится уже на фоне терапии, так как очень важно не потерять время. Для подтверждения диагноза могут понадобиться МРТ головного мозга (с контрастом или без), люмбальная пункция с исследованием ликвора - общий анализ и биохимический, а также ПЦР ликвора, позволяющая выделить ДНК токсоплазмы. Иногда на помощь приходят серологические методы обследования - антитела к токсоплазме классов IgG, IgM.
Лечение при реактивации токсоплазмоза проводят также Бисептолом. На фоне терапии улучшение состояния пациента наступает обычно в течение 1-2 недель. Но стоит помнить, что при отрицательном обследовании на токсоплазмоз, отсутствии специфического очага поражения с перифокальным отеком в головном мозге, при отсутствии клинической динамики на фоне проводимого лечения - необходимо исключать другую причину поражения головного мозга. Чаще всего - это лимфома ЦНС.
При подозрении на хориоретинит, пневмонит, миокардит требуются дообследования у профильных специалистов (офтальмолог, кардиолог, пульмонолог), даже может потребоваться проведение биопсии тканей органов.
Токсоплазмоз у беременных.
Своевременное серологическое обследование до наступления беременности, а также установление диагноза токсоплазмоза у беременных женщин определяет тактику ведения беременности.
Для самой беременной первичная инфекция токсоплазмой не так опасна, как для плода. Плод инфицируется от матери, и инфекция может быть как бессимптомной, так и с умеренными/тяжелыми клиническими проявлениями. Три наиболее распространенных вида поражения - ретинохориоидит (15-26%), внутричерепные кальцификации (9-13%) и гидроцефалия (1-2,4%).
Частота инфицирования плода резко возрастает с увеличением гестационного возраста на момент инфицирования матери. Оценочная вероятность передачи в зависимости от срока беременности при документально подтвержденной сероконверсии составляет:
В 13 недель - 15%
На 26 неделе - 44%
На 36 неделе - 71%
Наиболее часто инфицирование плода происходит при первичной инфекции токсоплазмой. Согласно приказу МЗ РФ №572 обследование на антитела класса IgM, IgG к вирусу краснуху и к токсоплазме являются обязательными для всех беременных. При отсутствии антител класса G к токсоплазме беременная должна быть проинформирована о том, как предотвратить первичное инфицирование токсоплазмозом.
При выявлении антител к токсоплазме используют дополнительные методы диагностики для определения давности инфицирования - исследования в парных сыворотках и анализ крови на авидность (или сродство) антител класса IgG к антигену токсоплазмы. Обнаружение низкоавидных антител свидетельствует о недавнем инфицировании.
Не беременные женщины, у которых диагностирован острый токсоплазмоз, должны отложить планирование беременности на 6 месяцев.
Каждая беременная, у которой при скрининге выявлено отсутствие антител IgG к токсоплазме, должна очень тщательно профилактировать заражение во время беременности. Основные меры профилактики токсоплазмоза:
Употреблять в пищу хорошо термически обработанное мясо (при Т более 67С) либо предварительно замораживать его до Т -20С.
Мыть разделочные доски и другую кухонную утварь горячей водой с мылом после контакта с сырым мясом, тщательно мыть руки.
Не есть сырые яйца и не пить сырое молоко, мыть фрукты и овощи, не пить необработанную воду.
Надевать перчатки и мыть руки водой с мылом при контакте с почвой или песком, которые могут быть загрязнены кошачьими фекалиями.
Надевать перчатки и мыть руки водой с мылом при работе с кошачьим лотком, кормить питомцев сухим или консервированным мясом. Домашние кошки, которых кормят сухим или консервированным кормом для кошек, не представляют опасности.
Таким образом, тактика обследования и лечения пациента в любой ситуации (и для пациента с иммунодефицитом, и для беременной или планирующей беременность женщины) достаточно индивидуальная и определяется только лечащим врачом-инфекционистом, либо консилиумом врачей.
Стоит упомянуть, что некоторые пациенты, иммунокомпетентные и не беременные, в процессе обследования могут получить положительный результат анализа на антитела к токсоплазме, но в большинстве случаев это не требует никаких вмешательств - ни специфической терапии, ни тем более ликвидации домашней кошки :)
да, это действительно так - наибольшую опасность представляют уличные кошки и те, которых подкармливают необработанным мясом, тем более выделение ооцист в окружающую среду происходит как правило только один раз.
По любым результатам анализов Вас всегда могут проконсультировать и помочь определиться с тактикой дальнейших действий врачи Университетсткой клиники H-clinic.
Услуги, упомянутые в статье*:
041601 - Возбудитель токсоплазмоза (Тoxoplasma gondii), количественное определение антител класса IgG
041602 - Возбудитель токсоплазмоза (Тoxoplasma gondii), качественное определение антител класса IgМ
041603 - Определение индекса авидности IgG к токсоплазме (Toxoplasma gondii), полуколичественное определение
*Назначение и интерпретация результатов анализов должны проводиться только лечащим врачом
Автор: врач-инфекционист Университетской клиники H-Clinic Коновалова Анастасия Александровна.
Медицинский редактор: руководитель Университетской клиники, к.м.н., врач-инфекционист Коннов Данила Сергеевич.

Токсоплазмоз это паразитарное заболевание, вызываемое внутриклеточным паразитом Toxoplasma gondii. Этот возбудитель способен размножаться и существовать практически в любых клетках человеческого организма, но чаще всего встречается в клетках скелетной мускулатуры и головного мозга. Попадая в организм любого теплокровного животного (включая человека) T.gondii вызывает острое заболевание, распространяясь по организму проникает в различные ткани и органы. Далее вступает в действие иммунная система, которая ограничивает распространение паразита, но он сохраняет себя в организме животного или человека в виде цист, находящихся преимущественно в мышцах. В таком виде латентная инфекция может протекать очень длительно, что не несет угрозы для организма носителя с корректно работающей иммунной системой. Заразиться от животного, носителя латентного токсоплазмоза можно, употребив в пищу его мясо, не прошедшее достаточной термической обработки, которая нейтрализует цисты токсоплазм. Человек является своеобразным эпидемиологическим тупиком для токсоплазм, так как в обычной жизни он не является заразным для окружающих. Исключение составляет лишь острый токсоплазмоз у беременной женщины, который может привести к заражению плода, переливание крови и трансплантация органов.
Токсоплазмоз распространен широко, и в странах, где практикуется употребление в пищу сырого или недостаточно термически обработанного мяса, до 50% населения и более могут быть инфицированными токсоплазмами. Во Франции частота инфицированности составляет 54%. В США 15% женщин детородного возраста инфицированы этим паразитом. В некоторых общинах эскимосов заражено около 60% населения по причине частого употребления в пищу сырого мяса тюленей.
Таким образом, ведущей причиной заражения токсоплазмами в мире является употребление в пищу недостаточно термически обработанного мяса, содержащего цисты T.gondii.
Отдельно следует упомянуть опасность токсоплазмоза для беременной женщины и плода. Многочисленные данные говорят о том, что для плода опасно исключительно недавнее заражение беременной женщины, т.е., когда она переносит острый токсоплазмоз. А такая ситуация возможна только один раз в жизни - после первичного заражения.
В случае, когда подтверждается острый токсоплазмоз у беременной – это не является показанием к прерыванию беременности! Опытный инфекционист оценит степень риска для ребенка и даст соответствующие рекомендации по лечению. Токсоплазмы не сразу проникают в кровоток ребенка, им нужно достаточно много времени – 1-4 месяца для того, чтобы сначала попасть в плаценту, накопиться в ней в достаточном количестве и только после этого инфекция может проникнуть в организм ребенка. Таким образом, риски заражения ребенка в первом триместре минимальные – около 6%, далее этот показатель увеличивается, достигая 65% в 3 триместре. Своевременная диагностика и корректное лечение позволяет существенно снизить риски заражения плода.
В качестве терапии острого токсоплазмоза у беременной женщины используются 2 стратегии:
1. При высоком риске или при подтвержденном заражении ребенка назначаются препараты, максимально эффективные против размножающихся токсоплазм;
2. Если признаков поражения плода нет, то назначается лечение для профилактики заражения плода – препараты, способные накапливаться в плаценте и эффективно подавлять размножение в ней паразита.
У людей без иммунодефицита острый токсоплазмоз чаще всего (>90%) протекает бессимптомно и заканчивается формированием цист в тканях, тоесть клиническим выздоровлением. У остальных развиваются неспецифические признаки острой инфекции – субфебрильная температура, увеличение лимфатических узлов, слабость. Период от заражения до возможного появления симптомов составляет от 5 до 20 дней.
У людей с признаками иммунодефицита, например, у ВИЧ-позитивных, острая токсоплазменная инфекция и реактивация латентной инфекции (выход возбудителя из цист в мышечной ткани) могут вызвать тяжелое поражение головного мозга по типу специфического энцефалита, поражение глаз в виде хориоретинита и другие тяжелые заболевания. Также, реактивация латентного токсоплазмоза у ВИЧ-позитивной беременной женщины может привести к заражению ребенка, такая ситуация требует наблюдения и лечения профильными специалистами – инфекционистом и акушером-гинекологом.
1. Основным источником заражения токсоплазмами является недостаточно термически обработанное мясо, содержащее цисты паразита.
2. Кошки являются второстепенным источником инфекции.
3. Обследование на токсоплазменную инфекцию и трактовку полученных результатов должен осуществлять специалист в области инфекционных заболеваний.
4. В большинстве случаев острый токсоплазмоз протекает бессимптомно.
5. Опасность для плода представляет только недавнее заражение беременной женщины (менее 6 месяцев).
6. Острый токсоплазмоз у беременной женщины требует обязательного лечения.
7. У ВИЧ-позитивных пациентов с низкими показателями СД4-Т-лимфоцитов существует угроза реактивации латентной инфекции и тяжелого течения острого токсоплазмоза с развитием серьезных осложнений.
Для женщин, планирующих беременность рекомендовано обследование на наличие антител к T.gondii. Отрицательный результат обследования говорит о том, что данная женщина не болела токсоплазмозом ранее и у нее есть риски им заболеть в период беременности. Для снижения подобных рисков необходимо соблюдать определенные правила, которые четко сформулированы в 2013 году в клиническом практическом руководстве общества акушеров-гинекологов Канады :
1. Надевать перчатки и тщательно мыть руки и ногти при работе с материалом, потенциально загрязненным фекалиями кошки (песок, земля, садоводство).
2. Снижать риск инфицирования от домашних кошек: не держать кошек в помещении; кормить домашних кошек только термически обработанной консервированной едой или сухим кормом. Удалять мусор и фекалии кошки в перчатках каждые 24 ч. Кошачий лоток после его очистки и перед его наполнением обрабатывать кипятком в течение 5 мин.
3. Употреблять в пищу только хорошо термически обработанное мясо (> 67 °c).
4. Замораживать мясо до температуры -20 °С (данная температура убивает цисты T. gondii).
5. Очищать поверхность и посуду, которые контактировали с сырым мясом. Не употреблять сырые яйца или сырое молоко.
6. Мыть фрукты и овощи перед употреблением
7. Предотвращать перекрестное заражение: тщательно мыть руки и посуду после контакта с сырым мясом или овощами. Не пить воду, которая может быть загрязнена ооцистами. Помнить, что во время копчения или сушки мяса цисты T. gondii могут сохраняться;
8. Холодильных условиях хранения паразит не гибнет (T. gondii сохраняет жизнеспособность после 68 дней при температуре +4 °c);

Доступные варианты химиотерапии токсоплазмоза ограничены. Путь фолиевой кислоты, участвующий в синтезе ДНК с ферментами дигидрофолатредуктазы (DHFR) и дигидроптероатсинтетазы (DHPS), является основной мишенью терапии этого паразитарного заболевания. Пириметамин (PYR) и триметоприм (TMP), два основных современных препарата в лечении острого токсоплазмоза, оба действуют на паразитический DHFR, но не могут отличить его от фермента человека ( хозяина ) Взятые по отдельности, они недостаточно эффективны, поэтому их нужно сочетать в комбинированных схемах с сульфонамидами, которые блокируют DHPS. Эти схемы лечения имеют побочные эффекты из-за миелотоксичности (не говоря уже о более серьезных и острых , которые могут быть опасными для жизни) и требуют прекращения терапии или, что более часто, вызывают несоблюдение режима лечения. . Это серьезный недостаток данных препаратов , поскольку пациенты (врожденно инфицированные новорожденные, пациенты с ослабленным иммунитетом) обычно нуждаются в длительных курсах лечения. Более того, ни один современный препарат не может уничтожить T. gondii.цисты инфицированного хозяина, которые остаются неподвижными при условии, что иммунная система достаточно сильна, чтобы препятствовать их реактивации в тахизоиты.
Резистентность и побочные эффекты
Устойчивость T. gondii к лекарственным препаратам считается незначительной проблемой по сравнению с плохой комплаентностью и спектром побочных эффектов. Однако, сообщалось о неэффективности длительного лечения врожденного токсоплазмоза на основе PYR, возможно, из-за развития лекарственно-устойчивого штамма T. gondii. PYR и SDZ являются ингибиторами синтеза ДНК у тахизоитов T. gondii, но также могут подавлять синтез ДНК в тканях с высокой метаболической активностью, таких как костный мозг и эпителий. Этого можно избежать, добавив фолиновую кислоту (FA), и эти побочные эффекты будут обращены вспять после прекращения лечения.
Лечение врожденного токсоплазмоза
Существует два показания для введения специфического лечения против T. gondii : 1) пренатальное лечение, направленное на предотвращение передачи паразитов от матери к плоду (MFTP) и / или уменьшение повреждений плода, и 2) послеродовое лечение с целью облегчения клинических проявлений и / или предотвращения отдаленных последствий у инфицированного новорожденного.
Однако преимущества дородового лечения по-разному оцениваются в литературе из-за смешивающих факторов ( Robert-Gangneux, 2014 ), поскольку это может зависеть, среди прочего, от типа лечения, времени введения препаратов после заражения матери, дозы, режимы и продолжительность.терапии. Таким образом, необходимо знать точное время материнского заражения, что возможно только в странах с программами серологического скрининга беременных, то есть в ограниченном числе европейских стран. Соотношение польза / риск послеродового лечения также подвергалось сомнению, особенно у бессимптомных или субклинических инфицированных пациентов, для которых продолжительность лечения и долгосрочные преимущества все еще обсуждаются в литературе.
Женщинам, инфицированным во время беременности (или в период до зачатия), обычно предлагают спирамицин (SPI) - мощный антибиотик из группы макролидов, который концентрируется в плаценте, что делает его идеальным вариантом предварительного лечения для профилактики MFTP. Из-за низкой частоты побочных эффектов SPI - удобный вариант лечения в ожидании амниоцентеза. К сожалению, SPI неэффективен для лечения установленной внутриутробной инфекции, поскольку практически не проникает через плацентарный барьер.
ПЦР-анализ образцов AF, начиная с 16-й недели гестации (gw) и далее, позволяет переключить лечение на комбинации на основе PYR, в первую очередь на комбинацию PYR-сульфадиазин (PYR-SDZ), при получении положительного результата ПЦР. Однако комбинация PYR-SDZ является тератогенной, и поэтому ее следует избегать в течение первых 14 gw, хотя это пороговое значение варьируется в зависимости от страны к стране. В любом случае, пренатальная диагностика никогда не проводится раньше 14 gw, поэтому лечение SPI является правилом в течение первого триместра беременности.
Защитный эффект SPI известен давно. В классическом исследовании Desmonts и Couvreur ( Desmonts and Couvreur, 1974 ) сообщалось о снижении MFTP более чем на 50% (45% в группе без лечения по сравнению с 22% в группе лечения), но результаты были смещены из-за того, что не учитывался срок беременности. при сероконверсии. Однако несколько обсервационных исследований, опубликованных с 1999 г., ставят под сомнение способность пренатального лечения снижать тяжесть инфекции, признавая при этом его роль в снижении материнско-фетальной передачи.
Исследование EMSCOT 2005 года показало на 72% меньшую вероятность внутричерепных поражений у младенцев, рожденных от матерей, пролеченных в течение 4 недель после сероконверсии. Мета-анализ SYROCOT 2007 среди 1438 матерей, получавших лечение, показал, что начало пренатального лечения в течение трех недель после сероконверсии привело к снижению MFTP на 52% по сравнению с лечением, введенным через 8 или более недель, но не сообщил о явном влиянии пренатального лечения на частоту. клинических проявлений у инфицированных новорожденных.
Следует отметить, что введение ежемесячного систематического скрининга на токсоплазмоз у беременных во Франции привело к общему снижению частоты MFTP с 29% до 1992 г. до 24% после 1992 г., а немедленное введение лечения PYR-SDZ повлияло на сокращение клинических случаев токсоплазмоза новорожденных с 11% до 1995 г. до 4% после 1995 г. ( Wallon et al., 2013 ). Австрия, еще одна европейская страна с многолетней национальной программой скрининга токсоплазмоза у беременных, добилась впечатляющего снижения MFTP среди пренатально диагностированных и пролеченных женщин - 9% по сравнению с 51% ранее у нелеченных женщин, согласно данным Австрийского регистра токсоплазмоза. Эффективность PYR-SDZ по сравнению с SPI была выше, когда лечение было начато в течение 3 недель после сероконверсии.
Послеродовое лечение начинается после подтверждения диагноза врожденной инфекции и направлено на предотвращение или уменьшение клинических проявлений при рождении и облегчение возможных отдаленных последствий или клинических рецидивов, в основном, глазных.
Гематологические побочные эффекты
Фолиновая кислота
Фолиновая кислота , также известная как лейковорин , - это лекарство, используемое для уменьшения токсических эффектов метотрексата и пириметамина . Он также используется в сочетании с 5-фторурацилом для лечения колоректального рака , может использоваться для лечения дефицита фолиевой кислоты, который приводит к анемии , и отравления метанолом . Его принимают внутрь, путем инъекции в мышцу или в вену . Побочные эффекты могут включать проблемы со сном, аллергические реакции или жар . Использование во время беременности или кормления грудью обычно считается безопасным. При использовании при анемии рекомендуется сначала исключить злокачественную анемию как причину. Фолиновая кислота - это форма фолиевой кислоты , которая не требует активации дигидрофолатредуктазой, чтобы быть полезной для организма.
Новые варианты лечения токсоплазмоза
Потенциальная тяжесть нежелательных явлений комбинации PYR-SDZ привела к рассмотрению альтернативных вариантов лечения токсоплазмоща , таких как PYR-клиндамицин, PYR-азитромицин, атоваквон, котримоксазол (TMP-SMX). Однако срочно необходимы клинические оценочные исследования, желательно рандомизированные; единственное на сегодняшний день исследование показало значительный эффект TMP-SMX на снижение MFTP в сочетании с SPI, который был эквивалентен эффекту PYR-SDZ. Пириметамин недоступен и / или недоступен по цене во многих странах, что объясняет широкое использование TMP / SMX в качестве лечения первой линии в этих странах. PYR / SDZ и TMP / SMX обладают хорошей биодоступностью (70% и 90% соответственно), и все эти молекулы имеют период полураспада в плазме около 10 часов, что позволяет получить пиковую концентрацию через 2-6 часов, за исключением пириметамина, который имеет длительный период полураспада. период полувыведения (около 4 дней), лежащий в основе потребности в ударной дозе. Кроме того, снижение биодоступности пириметамина у истощенных пациентов ( de Kock et al., 2018), делает TMP / SMX лучшим выбором в развивающихся странах. Кроме того, TMP / SMX - это единственная схема внутривенного введения, когда пероральный путь нецелесообразен.
Системное лечение ( Butler et al., 2013 ; Ozgonul and Besirli, 2017 ), сочетающее противопаразитарные препараты и кортикостероиды ( Holland and Lewis, 2002 ), рекомендуется при токсоплазмозе глаз у пациентов с ослабленным иммунитетом. Однако сравнительные исследования этой популяции пациентов немногочисленны.
Помимо хорошо известных мишеней для лекарств от токсоплазмоза , недавно был описан интересный новый подход с использованием морфолино для идентификации и характеристики новых мишеней T. gondii, представляющих терапевтический интерес. Lykins et al. использовали модифицированные формы морфолино с ковалентно присоединенными химическими группами для облегчения проникновения в клетки (vivoPMO), чтобы снизить экспрессию специфических ферментов T. gondii.
Артемизинин, сильнодействующее противомалярийное средство, а также его многочисленные производные, производимые в течение многих лет, показали потенциал в лечении токсоплазмоза мышей. Особый интерес представляют артемизон и артемизид, которые продлевают выживаемость и снижают нагрузку на кисты мозга у мышей, инфицированных тахизоитами штамма токсоплазмы II типа . Они также продлили выживаемость на мышиной модели реактивированного токсоплазмоза, но все животные погибли после прекращения приема лекарств, что указывает на то, что производные артемизинина действуют на тахизоиты, но не на брадизоиты.
Скрининг библиотеки химических соединений, предоставленный Инициативой по открытию лекарств (Токийский университет, Япония), выявил два эффективных ингибитора in vitro, не вызывающих токсичности для клетки-хозяина, то есть таншинон IIA (соединение, которое может подавлять рост раковых клеток) и антигистаминный препарат - гидроксизин. Что еще более интересно, эти соединения продемонстрировали ингибирующее действие на рост промежуточно дифференцированных брадизоитов - свойства, отсутствующего в современных лекарствах.
Большинство соединений, ингибирующих рост паразитов, обладают противовоспалительными и противораковыми свойствами. Это неудивительно, поскольку уже было продемонстрировано, что некоторые лекарственные препараты, используемые при лечении рака и воспалительных процессов, проявляют сильное действие на рост T. gondii in vitro. Из них милтефозин показал многообещающие результаты в лечении многочисленных протозойных инфекций и в настоящее время широко используется для лечения висцерального лейшманиоза. Его способность успешно лечить энцефалит, вызванный свободноживущими амебами, подчеркивает его способность преодолевать гематоэнцефалический барьер. Он не показал эффективности в борьбе с острым токсоплазмозом, но, наоборот, введение этого препарата через 60 дней после заражения мышей штаммом ME49 привело к уменьшению количества и размера кист головного мозга. Другая противораковая молекула (тетраоксан) была протестирована на мышиной модели острого токсоплазмоза и значительно увеличила выживаемость инфицированных мышей по сравнению с контрольными мышами.
Иммунотерапевтические стратегии
Острая инфекция токсоплазмой остается в основном бессимптомной у иммунокомпетентных хозяев благодаря соответствующему иммунному контролю, приводящему к инцистации паразитов. Однако частичное нарушение реакции хозяина паразитом позволяет цистам сохраняться на протяжении всей жизни. Это сожительство паразита и хозяина опирается на строго регулируемый баланс для контроля репликации паразита. Возникновение любого иммунного дефекта, особенно влияющего на ответ Т-клеток, в основном вторичного по отношению к ВИЧ-инфекции или иммуносупрессивной терапии, приводит к реактивации паразитов, что приводит к тяжелому энцефалиту или диссеминированной инфекции. В настоящее время ни один из описанных выше методов лечения не может уничтожить паразита у инфицированных хозяев, что делает их уязвимыми для дальнейших рецидивов. В этом контексте в течение многих лет иммунотерапия рассматривалась как многообещающий и полезный подход к лечению токсоплазмоза, позволяющий хозяевам с ослабленным иммунитетом восстановить адекватный иммунный ответ.
Непрерывный прогресс в понимании иммунопатогенеза токсоплазмоза позволил по-новому взглянуть на то, как противодействовать иммунным нарушениям при токсоплазмозе . Помимо разработки вакцины, которая вызывает множество активных исследований ( Lim and Othman, 2014 ; Rezaei et al., 2018 ) и рассматривается в специальном выпуске ( Innes et al., 2019), необходимо последовательно обсудить альтернативные стратегии иммуномодуляции, включая перенос адаптивных клеток и пассивную иммунизацию. Иммунный ответ против T. gondii включает сложные механизмы как врожденного, так и адаптивного иммунитета. В то время как врожденные эффекторы играют важную роль во время острой инфекции ( Яровинский, 2014 ), долговременная защита обеспечивается адаптивным иммунным ответом. В частности, клеточные эффекторы, в основном Т-лимфоциты, продуцирующие IFNγ, необходимы для контроля размножения и распространения T. gondii и поддержания латентного периода. В частности, CD8 + Т-клетки и NK-клетки действуют посредством лизиса инфицированных клеток и, следовательно, делают паразита доступным для других иммунологических механизмов, включая иммуноглобулины, комплемент, макрофаги и дендритные клетки.
Провоспалительный ответ Th1 с участием цитокинов, таких как IL-12, IFNγ, TNFα, а также IL-7 и IL-15, является основой адекватного антипаразитарного ответа, сначала во время острой инфекции для уменьшения количества паразитов, а затем во время хроническая инфекция для оказания иммунного давления, достаточного для поддержания инцистации паразитов. И наоборот, иммунодепрессивные цитокины, такие как IL-10, способствуют внутримозговому сохранению паразитов, а нарушение местного иммунного ответа приводит к реактивации латентных цист T. gondii в головном мозге. Во-первых, для усиления врожденного иммунитета было показано, что введение IL-18 усиливает IL-12-опосредованную устойчивость к токсоплазме у мышей SCID с сильной иммуносупрессией, что приводит к уменьшению количества паразитов и увеличению времени до смерти. Несмотря на то, что эндогенный IL-18, по-видимому, принимает ограниченное участие в врожденной резистентности, защитная роль, обеспечиваемая добавлением экзогенного IL-18, коррелировала с увеличением количества NK-клеток и цитотоксической активностью, а также с повышенными уровнями INOS в ткани селезенки.
Другая стратегия может быть направлена на противодействие биологической активности вредных цитокинов, как было предложено Deckert-Schlüter et al. (1997) , которые оценили релевантность антител против IL-10 в модели хронического энцефалита на мышах. Интересно, что это привело к снижению внутримозговой паразитарной нагрузки, связанной с повышенной экспрессией IFNγ и TNFα, и более высоким интрацеребральным рекрутированием CD4 + и CD8 + Т-клеток. Однако мыши с дефицитом IL-10 быстро умерли от некротического гепатита в результате иммунопатологии, опосредованной CD4 + Т-клетками, с избыточной продукцией IFNγ, IL-12 и TNFα.
В новую эру клеточной терапии был предложен адаптивный перенос иммунных CD8 + клеток, особенно в контексте хронической инфекции токсоплазмы . Хотя было показано, что он временно ограничивает разрушение цист и обеспечивает временную защиту от реактивации паразитов (в течение четырех недель после лечения), он не позволяет в долгосрочной перспективе спасать истощенные Т-клетки, поскольку донорские клетки не могут стать долгосрочными в своей жизни. Таким образом, эту стратегию можно рассматривать только как профилактическую терапию реактивации у пациентов с ослабленным иммунитетом высокого риска.
Кроме того, что касается иммунотерапевтических вмешательств, несмотря на многие достижения в области вакцинации, эффективность иммунизационной терапии может снижаться у хозяев с ослабленным иммунитетом из-за снижения клеточного иммунитета. Таким образом, этот вопрос вызвал интерес к методам пассивной иммунизации, которые могли бы обеспечить, по крайней мере временно, адекватную защиту от реактивации. Действительно, использование специфических рекомбинантных антител против токсоплазмы представляет собой многообещающую стратегию для блокирования на ранней стадии прикрепления паразитов и инвазии клеток-хозяев или внутриклеточной репликации тахизоитов . Среди прочего, антитела против антигена SAG1, самого распространенного и иммуногенного антигена на поверхности паразита, вызвали много ожиданий. В частности, было показано, что фрагменты Fab-антител к SAG1 увеличивают на 50% выживаемость мышей после летального заражения путем прямой блокады клеточной инвазии, а не способствуют Fc-зависимому фагоцитозу, клеточной цитотоксичности или активации комплемента. Таким образом, замедляя инвазию паразитов, такие методы лечения могут рассматриваться как профилактические или адъювантные методы лечения в сочетании с лечебными антипаразитарными препаратами у хозяев с ослабленным иммунитетом.
Слабый терапевтический ответ на обычное лечение можно было бы компенсировать добавлением альтернативной терапии, включая добавление или ингибирование определенных интерлейкинов (анти-IL-10), непрямых иммуностимулирующих препаратов, клеточного переноса или переноса антител. Таким образом, усиление иммунного ответа хозяина может быть соблазнительным терапевтическим подходом 1) для предотвращения реактивации токсоплазмоза у пациентов с ослабленным иммунитетом, если он имеет меньше побочных эффектов, чем широко используемый лекарственный препарат котримоксазол, или 2) для помощи в лечении эпизодов тяжелой реактивации в сочетании с обычные препараты, но все еще необходимы активные исследования в этой области.
Пациенты с ослабленным иммунитетом
Токсоплазмоз - это тяжелая оппортунистическая инфекция у пациентов с ослабленным иммунитетом, чаще всего возникающая в результате реактивации спящих кист у пациентов с хронической инфекцией. Токсоплазматический энцефалит (ТE) является наиболее частым клиническим проявлением, которое часто наблюдается у ВИЧ-инфицированных пациентов, но спектр заболеваний изменился с увеличением числа пациентов с иммунодефицитом, не связанным с ВИЧ. Действительно, у пациентов, не инфицированных ВИЧ, исход хуже, и токсоплазмоз чаще распространяется, чем ограничивается ЦНС. Это особенно опасно для жизни пациентов с трансплантацией костного мозга или гемопоэтических стволовых клеток, поскольку смертность здесь составляет от 38% до 67%, несмотря на лечение.
PYR / SDZ, казалось, был наиболее эффективным лечением, но мощность исследования не может показать превосходного лечения ( Katlama et al., 1996 ) с меньшим количеством рецидивов во время поддерживающей терапии, чем PYR / CLD, но вызвала больше побочных эффектов, чем PYR / CLD или TMP / SMX. Предпочтительным режимом является PYR (ударная доза 200 мг в день 1, затем 75 мг / день, если пациент весит ≥60 кг, или 50 мг / день, если пациент весит
Читайте также:

