Болезнь вызванная вич с проявлениями других микозов
Обновлено: 11.05.2024
Инфекция, вызванная вирусом иммунодефицита человека (ВИЧ-инфекция) и синдром приобретенного иммунодефицита (СПИД) — хроническая инфекция, которая при отсутствии лечения приводит к снижению иммунитета к другим инфекциям.
Факторы риска — внутривенные инъекции, незащищенный секс с несколькими партнерами.
За последние 20 лет ВИЧ-инфекции стала самой опасной и самой интенсивно изучаемой болезнью в мире. Несмотря на разработку высокоэффективных лекарств, которые ограничивают проявление болезни, до сих пор не найдено вакцины против вируса, поэтому число людей, инфицированных ВИЧ, продолжает расти, особенно в развивающихся странах.
Есть мнение, что люди были заражены вирусом через слюну обезьян, которые кусали людей. Потом через контакты биологических жидкостей вирус начал распространяться от человека к человеку. ВИЧ инфицирует и постепенно разрушает клетки иммунной системы, ослабляя устойчивость организма к инфекциям и раку.
По всему миру считаются инфицированными более 30 миллиона человек, хотя 9 из 10 этих людей не подозревают об этом. В развитых странах начиная с 1995 года благодаря медикаментозному лечению резко упала смертность от СПИДа. В развивающихся странах проблема СПИД стоит более остро, потому что там живет большинство людей, инфицированных ВИЧ, и им недоступны лекарства от этой тяжелой болезни.
ВИЧ передается с биологическими жидкостями (кровью, спермой, влагалищными выделениями, слюной и грудным молоком). Человек становится более восприимчивым к ВИЧ-инфекции, и у него более вероятно заражение, если он уже страдает от другой болезни, передающейся половым путем.
В группу риска по заражению ВИЧ-инфекцией входят и те люди, которые вводят наркотики или лекарства внутривенно и пользуются для этого общими шприцами и иглами. Кроме того, в группу риска входят и медработники, потому что они контактируют с загрязненными иглами и биологическими жидкостями больных людей, но у них уровень риска намного ниже.
ВИЧ-инфекция может передаваться oт инфицированной женщины к плоду через плаценту или к новорожденному ребенку при рождении или с грудным молоком. Вирусом можно заразиться при трансплантации органов или переливании крови. Но во многих странах сейчас тщательно контролируют отсутствие ВИЧ во всех органах, крови и тканях, что способствует значительному снижению риска заражения. ВИЧ-инфекцией нельзя заразиться при повседневных контактах с людьми, таких как рукопожатие, а также воздушно-капельным путем, через кашель и чихание, поэтому инфицированные люди не представляют опасности для окружающих, которые рядом с ними живут или работают.
ВИЧ проникает в кровь и инфицирует клетки, имеющие на своей поверхности специальные структуры, называемые рецепторами CD4 — СD4-лимфоциты, которые отвечают за борьбу с инфекцией. Внутри этих клеток происходит быстрая репродукция вируса, что приводит к их полному разрушению.
У людей, инфицированных ВИЧ, в течение многих лет не проявляются никакие симптомы, или отмечается незначительное снижение иммунитета: они чаще или дольше, чем обычно, болеют легкими инфекциями. Началом болезни принято считать серьезное ухудшение иммунитета. После этого у больного развиваются тяжелые инфекции, которые вызывают микроорганизмы, абсолютно безвредные для здоровых людей; он также становится очень восприимчив к определенным видам рака.
Вначале иммунная система продолжает нормально работать, несмотря на инфекцию, именно поэтому симптомы могут не появляться годами. Но количество СD4-лимфоцитов неизбежно уменьшается (особенно при отсутствии лечения), вызывая повышенную восприимчивость к другим инфекциям и некоторым видам рака.
Первые признаки ВИЧ-инфекции обычно появляются в течение 6 недель после заражения. Иногда они похожи на грипп, но могут появляться и следующие симптомы:
- увеличение лимфатических узлов;
- повышение температуры;
- слабость;
- сыпь;
- боли в мышцах;
- боль в горле.
Эти симптомы обычно проходят через несколько недель, и большинство людей с ВИЧ-инфекцией чувствуют себя вполне здоровыми. Однако у остальных могут появиться следующие легкие нарушения:
- постоянное увеличение лимфатических узлов;
- болезнь десен;
- тяжелые и хронические инфекции вирусом простого герпеса, такие как герпетическая лихорадка;
- интенсивный рост кондилом;
- зуд и шелушение кожи;
- потеря в весе.
Время между заражением ВИЧ и началом СПИДа отличается у людей, оно может составлять от года до 14 лет. Часто люди долгие годы не подозревают, что они инфицированы ВИЧ, пока у них не разовьется одна или несколько тяжелых инфекций или рак; которые считаются болезнями, сопутствующими СПИДу.
Единственным осложнением ВИЧ-инфекции является развитие СПИДа. О человеке, инфицированном ВИЧ, говорят, что он заболел СПИДом, когда уровень его СD4-лимфоцитов падает ниже определенного предела, либо у него развиваются болезни, сопутствующие СПИДу. Этими болезнями являются оппортунистические инфекции (инфекции, возникающие только при сниженном иммунитете), некоторые виды рака и расстройства нервной системы, которые могут привести к слабоумию, спутанности сознания, изменениям поведения и потере памяти.
Возбудителями оппортунистических инфекций могут быть простейшие, грибки, вирусы, бактерии, и все они опасны для жизни больных СПИДом. Одним из самых распространенных заболеваний людей со СПИДом является тяжелая инфекция, вызванная паразитом Pneumocystis carnii, другой распространенной болезнью являются инфекция криптоспоридиоз, которая приводит к затяжным поносам и токсоплазмоз, сопровождающийся поражением головного мозга.
Candida albicans — это вид грибков, который способен вызывать только легкую поверхностную инфекцию у здоровых людей, приводит к тяжелому заболеванию больных СПИДом.
Криптококковые грибки вызывают лихорадку, головную боль и инфекции легких.
Люди со СПИДом страдают от тяжелых вирусных и бактериальных инфекций. К бактериальным инфекциям относятся туберкулез и листериоз, которые могут вызвать заражение крови. Вирусные инфекции вызывают в основном герпесвирусы. Вирус простого герпеса может поражать головной мозг, вызывая менингит и вирусный энцефалит. Цитомегаловирусная инфекция может привести к таким тяжелым заболеваниям, как пневмония, вирусный энцефалит и воспаление глаз, приводящее к слепоте. Однако больные СПИДом не больше здоровых людей подвержены таким распространенным инфекциям, как простуда.
Самым распространенным видом рака, поражающим больных СПИДом, является саркома Капоши. Это раковая опухоль кожи, которая образуется на внутренней поверхности полости рта и внутренних органах, таких как легкие. Другими видами рака, которые часто наблюдаются у больных СПИДом, являются лимфомы, такие как неходжкинская лимфома. Рак шейки матки также часто встречается у женщин, инфицированных ВИЧ.
При любых подозрениях на возможность заражения ВИЧ нужно сделать анализ крови на антитела к этому вирусу. Анализ крови выполняют также, если у человека появились симптомы, причиной которых может быть ВИЧ-инфекция..
Если анализ на ВИЧ дал отрицательные результаты, то необходимо сделать повторный анализ через 3 месяца, потому что для развития антител требуется время. Очень трудно диагностировать ВИЧ-инфекцию у ребенка, родившегося у инфицированной матери, потому что материнские антитела могут оставаться в его крови до 18 месяцев. СПИД диагностируют после развития обусловленных им болезней, таких как пневмоцистоз, либо когда анализ крови показывает падение количества CD4-лимфоцитов ниже определенного уровня.
Лекарства назначают, когда у больного находят ВИЧ-инфекцию, либо обнаруживают резкое падение уровня СD4-лимфоцитов. Достигнуты большие успехи в применении комбинированной терапии специальными противовирусными лекарствами, которые предотвращают репликацию ВИЧ. Это дает возможность остановить развитие ВИЧ-инфекции в СПИД, а у некоторых людей даже подавить вирусную инфекцию до неопределимого уровня.
После развития СПИДа начинается борьба с оппортунистическими инфекциями, если они есть, а также в некоторых случаях проводится профилактическое лечение против большинства распространенных инфекций. Эмоциональную поддержку и психологическую помощь можно получить у соответствующих специалистов, которые помогают людям с ВИЧ-инфекцией и СПИДом.
Профилактика
Заражение ВИЧ можно предотвратить, если каждый узнает о факторах риска с самого раннего возраста. Две основные меры предосторожности позволяют избежать заражения половым путем — это применение презерватива во время полового акта и половая жизнь с одним партнером. Также обоим партнерам рекомендуется сделать анализы на ВИЧ перед началом незащищенного секса. Особым группам населения нужны специальные меры предосторожности. Например, если больному назначены внутривенные инъекции, всегда следует использовать новую иглу и шприц.
Людям с положительными анализами на ВИЧ нужно соблюдать меры предосторожности, чтобы не заразить других через контакт с кровью или биологическими жидкостями. Они должны информировать медицинский персонал и стоматолога, что у них ВИЧ-инфекция. Если беременная женщина ВИЧ-инфицирована, ей могут назначить противовирусные лекарства, чтобы снизить риск передачи вируса плоду. Помимо этого, ей рекомендуют сделать кесарево сечение и не кормить ребенка грудью, чтобы еще больше снизить риск заражения ВИЧ.
Медицинские работники предпринимают все усилия, чтобы не допустить распространения ВИЧ. Все составляющие крови и тканей для трансплантации тщательно проверяют, а для работы примененяют стерильное оборудование. Проводятся обширные исследования, направленные как на разработку вакцины против ВИЧ, так и на создание мер профилактики развития СПИДа. Однако, несмотря на твердую уверенность ученых в успехе, они не смогут предотвратить миллионы смертей по всему миру прежде, чем будет найдено действенное лечение, доступное всем.
Возбудитель — Cryptococcus neoformans — повсеместно распространенный дрожжевой гриб. Он занимает второе место (после Candida albicans) среди возбудителей грибковых инфекций у ВИЧ-инфицированных. Криптококкоз наблюдается у 5—10% ВИЧ-инфицированных.
а. Менингит — самое частое проявление криптококковой инфекции у ВИЧ-инфицированных. Для криптококкового менингита характерны головная боль, лихорадка, нарушения сознания, реже — эпилептические припадки и кома. Криптококкоз также может протекать с поражением легких, сетчатки, кожи, костей, предстательной железы и других органов.
б. Диагностика. Диагноз криптококкового менингита ставят при выявлении возбудителя в СМЖ. Для этого проводят микроскопию с контрастированием тушью, посев и определяют криптококковый антиген. Последний выявляется примерно у 90% больных криптококковым менингитом. Число клеток в СМЖ обычно невелико. При внемозговой локализации инфекции возбудитель выявляется в крови, костном мозге и других тканях.
в. Лечение. Препарат выбора — амфотерицин B. В комбинации с ним часто назначают фторцитозин. Во избежание выраженного угнетения кроветворения фторцитозин применяют в дозе, не превышающей 150 мг/кг/сут внутрь. Амфотерицин B вводят в/в, постепенно повышая дозу до 0,6—0,8 мг/кг/сут. После 2—6-недельного курса лечения амфотерицином B назначают флуконазол внутрь в течение 6—10 нед. Эффективность данной схемы лечения достигает 60%. При легкой форме криптококкового менингита в отсутствие неблагоприятных прогностических признаков (нарушение сознания и кома на ранней стадии заболевания, очаговая неврологическая симптоматика, выявление возбудителя в крови, высокий титр криптококкового антигена в СМЖ) проводят монотерапию флуконазолом, 400 мг/сут внутрь или в/в. Некоторые авторы при криптококкозе у взрослых рекомендуют применять более высокие дозы флуконазола, 600—800 мг/сут внутрь или в/в. Во избежание рецидивов инфекции всем больным проводят поддерживающее лечение флуконазолом в дозе 200—400 мг/сут внутрь. Контролируемые испытания показали, что при применении флуконазола рецидивы криптококкоза возникают реже, чем при применении амфотерицина B. Кроме того, флуконазол лучше переносится.
Гистоплазмоз
Грибковая инфекция, вызванная Histoplasma capsulatum. Чаще всего гистоплазмоз возникает у ВИЧ-инфицированных, проживающих в местности с широким распространением этого гриба. В США — это северо-восточные и северо-западные штаты. При СПИДе гистоплазмоз может возникнуть даже после кратковременного пребывания в такой местности.
а. Клиническая картина. Клинические проявления обычно неспецифичны и включают головную боль, кашель, лихорадку, похудание, увеличение лимфоузлов и спланхномегалию.
б. Диагностика. Диагноз основан на выявлении возбудителя в посеве крови и биоптатов лимфоузлов и костного мозга. Разрабатываются методы выявления антигенов возбудителя. Они могут применяться для диагностики и оценки эффективности лечения гистоплазмоза.
в. Лечение. Препарат выбора — амфотерицин B. В легких случаях эффективен итраконазол.
Кокцидиоидоз
Обычно встречается у ВИЧ-инфицированных, проживающих в местности с широким распространением Coccidioides immitis, например на юго-западе США. Заболевание проявляется поражением легких и менингитом. При кокцидиоидозе назначают амфотерицин B и итраконазол в/в.
Аспергиллез
Обычно проявляется поражением легких. Характерны кашель, одышка, лихорадка, образование полостей и обширных затемнений в легких. Эффективны амфотерицин B и итраконазол.

Молодой человек жаловался на высыпания в области туловища и гриппоподобное состояние. Общую слабость, периодическое повышение температуры до 37,4 °C, боли в мышцах пациент связывал с возможным контактом с больными на работе. Кожные изменения расценил как "обычный" дерматит.
Анамнез
Жалобы на общую слабость, повышение температуры и мышечные боли пациента беспокоили на протяжении двух недель. На второй день болезни молодой человек обращался по этому поводу к терапевту по месту жительства. Было назначено лечение: "Ингавирин", "Лизобакт", "Мирамистин". Однако на фоне терапии состояние не улучшалось, жалобы сохранялись. На пятый день лечения пациент самостоятельно начал принимать антибиотик "Амоксиклав" 875 мг + 125 мг два раза в сутки. После семи дней приёма положительного эффекта не было, в связи с чем обратился к врачу обшей практики. Сыпь на боковой поверхности туловища отмечал на протяжении месяца, однако, связав эти изменения с "обычным" дерматитом, лечение не проводил.
Согласно анамнезу жизни, в детстве пациент часто болел простудными заболеваниями. Из детских инфекций перенёс ветряную оспу, скарлатину, краснуху. В 18 лет болел пневмонией. Травмы и операции отрицает. Курение, алкоголь, спиртные напитки отрицает. Наследственность пациента отягощена: по линии матери — гипертоническая болезнь, по линии отца — язвенная болезнь двенадцатиперстной кишки. Аллергические заболевания и реакции на переливания крови, приём медикаментов отрицает. Половой анамнез: отсутствует постоянный половой партнер, пациент практикует незащищённые половые контакты. Последний контакт был пять месяцев назад с малознакомой девушкой.
Обследование
При обследовании обнаружены следующие изменения: 1. Затылочные, задние шейные и заушные лимфатические узлы увеличены с двух сторон, слегка болезненные при пальпации, плотной консистенции, кожа над ними не изменена. 2. В лёгких выслушивается жёсткое дыхание с единичными сухими свистящими хрипами на выдохе, больше в межлопаточной области. 3. Кожный процесс представлен пятнами розовато-красного цвета. Пятна имеют кольцевидную (монетообразную) форму с приподнятыми шелушащимися краями, которые по мере периферического роста регрессируют в центре. Локализованы преимущественно на боковой поверхности туловища, в области подмышечных впадин.
На рентгенограмме органов грудной клетки патологии не обнаружено. При УЗИ лимфатических узлов выявлена двусторонняя лимфаденопатия (увеличение лимфоузлов) с максимальными размерами 0,9 см на 1,6 см. ЭКГ без патологии. Результаты лабораторного обследования: ⠀• в клиническом анализе крови изменений не обнаружено; ⠀• С-реактивный белок в пределах нормы; ⠀• биохимический и общий анализ крови без патологии; ⠀• тест на антитела к вирусам герпеса (Ig-M) 1-5 типов отрицательный; ⠀• анализ крови на токсоплазмоз отрицательный. При микроскопическом исследований соскоба кожи, взятого с поражённого участка, обнаружены споры грибов (без этиологической верификации). Анализ крови на ВИЧ — положительный (подтверждён последующим выполнением блоттинга в двух лабораториях), результаты на сифилис, гепатиты B и С отрицательные.

1. Корнилова З.Х., Луконина И.В., Алексеева Л.П. Туберкулез в сочетании с ВИЧ-инфекцией // Туб. 2010. №3. С.3-9.
2. Оттен Т.Ф. Микобактериоз у больных с ВИЧ-инфекцией / В кн.: Беляков Н.А., Рахманова А.Г.(ред.). Вирус иммунодефицита человека-медицина. Гл.10.2. СПб.: Балтийский медицинский образовательный центр, 2011. С.199-224.
4. Adjemian J., Prevots D. R., Gallagher J. et al. Lack of adherence to evidence based treatment guidelines for nontuberculous mycobacterial lung disease. Ann. Am. Thorac. Soc. 2014. V. 11, № 1. Р. 9-16.
5. Andréjak C., Nielsen R., Thomsen V. et al. Chronic respiratory disease, inhaled corticosteroids and risk of non-tuberculous mycobacteriosis. Thorax. 2013. V. 68, № 3. Р. 256-262.
6. Brode S.K., Daley C.L., Marras T.K. The epidemiologic relationship between tuberculosis and non-tuberculous mycobacterial disease: a systematic review. Int. J. Tuberc. lung Dis. 2014. V. 18, № 11. Р. 1370-1377.
7. Daley C. L., Griffith D. E. Pulmonary non-tuberculous mycobacterial infections. Int. J. Tuberc. Lung. Dis. 2010. V. 14, № 6. Р. 665-671.
8. Griffith D. E., Aksamit T., Brown-Elliott B. A. et al. An official ATS/ IDSA statement: Diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases. Am. J. Respir. Crit. Care Med. 2007. V. 175, № 4. Р. 367-416.
К клиническим и рентгенологическим критериям для постановки диагноза микобактериоза согласно рекомендациям относятся: имеющиеся респираторные симптомы; обнаружение при рентгенографическом исследовании в легких очаговых или полостных изменений или наличие при компьютерной томографии множественных бронхоэктазов с мелкими очагами, при этом должна быть проведена дифференциальная диагностика в целях исключения других заболеваний, имеющих сходную рентгенологическую картину.
К микробиологическим критериям микобактериоза относятся:
– наличие в двух и более независимо взятых образцах мокроты нетуберкулезных микобактерий;
– не менее одного положительного результата культурального исследования материала, полученного при проведении бронхоскопии (бронхоальвеолярный лаваж [БАЛ] или промывные воды бронхов);
– морфологические изменения в тканях и органах (наличие гранулематозного воспаления или обнаружение кислотоустойчивых бактерий) и наличие роста культуры НТМБ этой ткани или не менее из одного образца БАЛ / промывных вод бронхов или мокроты,
или все вышеперечисленные критерии. В настоящее время этот вопрос является дискуссионным и широко обсуждается.
Цель исследования – изучить особенности клинических проявлений и диагностики микобактериозов у лиц, живущих с ВИЧ-инфекцией.
Результаты исследования и их обсуждение
Клиническое наблюдение 1
Пациентка Ш. (35 лет). Туберкулезом раньше не болела. Наблюдалась в Центре по борьбе со СПИД в течение 10 лет (4В стадия), получала антиретровирусную терапию. В июле 2018 г. перенесла пневмоцистную пневмонию, лечилась в стационаре, выписана с улучшением. В начале ноября состояние вновь ухудшилось, госпитализирована в стационар Центра по борьбе со СПИД. При обследовании на рентгенограмме легких выявлена патология, в мокроте обнаружены кислотоустойчивые микобактерии (КУМ), в связи с чем переведена в противотуберкулезный диспансер (ПТД) для исключения туберкулеза.
При поступлении в ПТД 22.11.2018 жалобы на кашель со слизистой мокротой до 50 мл в сутки, одышку при незначительной физической нагрузке, слабость, повышение температуры тела до 37оС, похудение на 4 кг за последний месяц. Общее состояние средней тяжести, пониженного питания, кожные покровы бледные. Дыхание жесткое с бронхиальным оттенком, гудящие хрипы в нижних отделах легких. ЧДД 24 в минуту. АД 90/55 мм рт. ст. Печень выступает на 7 см из-под подреберья.
Общий анализ крови: гемоглобин – 75 г/л; эритроциты – 2,9х1012/л; цветной показатель – 0,75; лейкоциты – 15,4х109/л; эозинофилы – 1; палочкоядерные – 16; сегментоядерные – 74; лимфоциты – 3; моноциты – 6; СОЭ – 57 мм/ч.
Общий анализ мочи: удельный вес – 1024; белок – 0,3; эритроциты – 1–2; лейкоциты – 5–6; цилиндры – 3–4.
Количество СD4+ лимфоцитов – 42 клетки/мкл.
В мокроте методом люминесцентной микроскопии выявлены кислотоустойчивые микобактерии КУМ (+) от 21.11.2018, 23.11.2018, 27.11.2018.
В мокроте методом ПЦР РВ от 26.11.2010 ДНК МБТ не выявлены; ПЦР Дженэксперт от 23.11.2018 ДНК МБТ не выявлены.
В мокроте посевом (BACTEC) от 23.11.2018, 26.11.2018 НТМБ(+). Иммунохроматографический тест на микобактерии туберкулеза TBAgMRT64 Rapid – отрицательный. Реакция на Диаскинтест отрицательная.
УЗИ органов брюшной полости: УЗ-признаки гепатоспленомегалии, диффузных изменений печени и поджелудочной железы.
Фибробронхоскопия: слева бронхи без особенностей. В просвете среднедолевого бронха (СДБ) справа густая слизисто-гнойная мокрота. По задней стенке СДБ с переходом на латеральную изъязвление, дно которого покрыто густыми массами белого цвета. Вокруг слизистая отечна, гиперемирована. Множество бугорков. За счет этих изменений БС4 сужено почти наполовину. Выше слизистая незначительно отечна. Шпора СДБ острая.
Гистологическое исследование биопсийного материала: в биоптате мелкие кусочки некротического детрита и фрагменты неспецифической грануляционной ткани с диффузной лимфоцитарной и нейтрофильной инфильтрацией, обилие мелких кровеносных сосудов.
При окраске по Цилю–Нильсену КУМ не определяются.
Заключение: морфологическая картина неспецифического воспаления.
На обзорной рентгенограмме органов грудной клетки в прямой и правой боковой проекции определяются массивное неоднородное инфильтративное затенение в средней доле правого легкого с четкой границей по междолевой борозде, неоднородное инфильтративное затенение в проекции 9-го сегмента левого легкого. Корни расширены. Тень средостения смещена влево (рис. 1, 2).
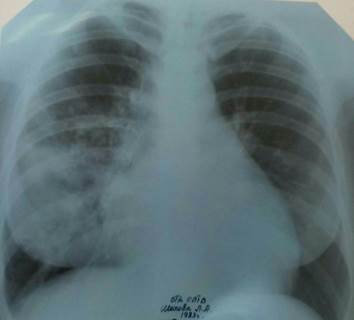
Рис. 1. Обзорная рентгенограмма органов грудной клетки в прямой проекции больной Ш.

Рис. 2. Обзорная рентгенограмма органов грудной клетки в правой боковой проекции больной Ш.
Мультиспиральная компьютерная томография органов грудной полости: в верхних и средних долях правого легкого массивная инфильтрация, участки консолидации в S8 нижней доли. Множественные полиморфные очаги по всем полям, больше справа. Часть из них с деструкцией. Лимфатические узлы гиперплазированы до 12–14 мм. Сердце обычных размеров, в перикарде жидкость, толщина слоя 12 мм. Дегенеративные изменения позвоночника. Костно-деструктивных изменений не выявлено.
Таким образом, у больной были типичные клинические проявления микобактериоза: кашель, одышка, лихорадка, потеря веса, анемия. Имелись рентгенологические изменения в легких в виде фокусов и очагов и поражение внутригрудных лимфатических узлов. Диагноз верифицирован бактериологическим методом исследования мокроты (рост НТМБ в двух анализах мокроты методом ВАСТЕК).
Клиническое наблюдение 2
Пациентка М., 32 года. Из анамнеза известно, что туберкулезом раньше не болела, наблюдается в Центре по борьбе со СПИД с 2008 г. (4В стадия), получает автиретровирусную терапию (АРВТ). В августе 2018 г. перенесла менингоэнцефалит. Состояние ухудшилось в октябре 2018 г., когда стали беспокоить кашель, общая слабость, плохой аппетит. Была госпитализирована в стационар. В легких при рентгенологическом исследовании выявлена патология. Больной была назначена антибактериальная терапия. При исследовании мокроты получили КУМ(+) методом люминесцентной микроскопии. Для исключения туберкулеза пациентка направлена в противотуберкулезный диспансер.
При поступлении в противотуберкулезный диспансер: состояние относительно удовлетворительное. Кожные покровы чистые, бледные. В легких дыхание аускультативно жесткое, хрипы не выслушиваются. ЧДД – 18 в минуту. Тоны сердца ритмичные ЧСС – 78 ударов в минуту, АД 100/65 мм рт. ст. Язык влажный, с белым налетом. Живот мягкий, безболезненный.
Общий анализ крови от 28.11.2018: гемоглобин – 130 г/л; эритроциты – 3,8х10/л; цветной показатель – 1,0; лейкоциты – 8,5х109/л; эозинофилы – 2%; палочкоядерные – 3%; сегментоядерные – 76%; лимфоциты – 8%; моноциты – 11%; СОЭ – 33 мм/ч.
Общий анализ мочи от 28.11.2018: уд. вес – 1020; белок – 0,19 г/л; лейкоциты – 1–3 в поле зрения.
Количество СD4+ лимфоцитов 101 клетка/мкл от 27.11.2018.
В мокроте КУМ (+) от 28.11.2018, 05.12.2018, 06.12.2018, 14.12.2018, 18.12.2018 методом люминесцентной микроскопии.
В мокроте методом ПЦР-РВ от 04.12.2018, 20.12.2018 ДНК МБТ не выявлены.
ПЦР Дженэксперт от 03.12.2018 ДНК МБТ не выявлены.
В мокроте посевом (BACTEC) от 05.12.2018, 06.12.2018 НТМБ(+). Иммунохроматографический тест на МБТ TBAgMRT64 Rapid – отрицательный.
Реакция на Диаскинтест – отрицательная.
Фибробронхоскопия № 1: слева устье нижнедолевого бронха сужено до почти щелевидного за счет бугристой опухоли с густым налетом некроза белого цвета.
Биопсия № 1: в собственном слое слизистой обилие мелких кровеносных сосудов и диффузная воспалительная инфильтрация лимфоидного и нейтрофильного характера, на фоне которого определяются мелкие нечеткие эпителиоидно-клеточные гранулемы. При окраске по Цилю–Нильсену КУМ не определяются.
Фибробронхоскопия № 2: устье верхнедолевого бронха справа полностью стенозировано бугристой опухолью с густым налетом фибрина белого цвета.
Биопсия № 2: в биоптате – мелкие фрагменты слизистой, местами покрытые многослойным плоским эпителием, местами – слоем некротического детрита. В слизистой – диффузная нейтрофильная и лимфоцитарная инфильтрация, на фоне которой местами определяются нечеткие мелкие эпителиоидно-клеточные гранулемы. В центре некоторых гранулем – скопление ядерного детрита. При окраске по Цилю–Нильсену КУМ не обнаружены.
МСКТ ОГК: в верхней доле S1, S2 справа и нижней доле S6 и базальной пирамиде левого легкого определяются очаговые изменения, деструкция четко не видна. Гиперплазированы бронхопульмональные лимфатические узлы. Средостение структурно не смещено.
В представленном случае клинические проявления микобактериоза (кашель, общая слабость, потеря веса) были мало выраженными. Это можно объяснить количеством СД4+ лимфоцитов (101 кл/мкл). Диагноз микобактериоза поставлен своевременно благодаря бактериоскопическому исследованию мокроты больной, консультации фтизиатра и комплексу обследований в противотуберкулезном диспансере.
1. В настоящее время наблюдается рост заболеваемости микобактериозами у лиц, живущих с ВИЧ-инфекцией. Для своевременного выявления микобактериозов у врачей различных специальностей должна быть настороженность.
2. Диагноз микобактериоза следует устанавливать на основании комплексного клинико-рентгенологического и микробиологического обследования. Главными критериями при постановке данного диагноза должны быть выделение культуры НТМБ и гистологическая верификация.
Оппортунистические инфекции – это большая группа инфекционных заболеваний, которые развиваются у пациентов с различными типами иммунодефицитов и нехарактерны для людей с нормальным иммунным статусом. Патологии поражают любую систему органов и вызывают соответствующую симптоматику. К общим клиническим проявлениям относят длительный субфебрилитет, лимфаденопатию, астенический синдром. Диагностика оппортунистических инфекций включает серологические, молекулярно-генетические, бактериологические и другие методы детекции патогенных возбудителей. Программы лечения сочетают длительную этиотропную терапию с методами иммунокоррекции.
МКБ-10


Общие сведения
Проблема оппортунистических инфекций (ОПИ) становится все более актуальной, что вызвано ростом числа ВИЧ-инфицированных людей, разработкой эффективных, однако агрессивных методов лечения онкопатологии. При этом многие люди являются бессимптомными носителями возбудителей ОПИ: 60% инфицированы цитомегаловирусом, 90% – герпесвирусами 1 и 2 типов, около 30% – токсоплазмой. Учитывая клинический полиморфизм и отсутствие специфических симптомов, диагностика и лечение оппортунистических болезней представляет серьезную мультидисциплинарную проблему.

Причины
Для манифестации оппортунистических инфекций необходимо заражение патогенным микроорганизмом: вирусом, бактерией, грибком или простейшим. Известно более 20 типичных возбудителей ОПИ, в современной инфектологии этот перечень постоянно дополняется. Болезнь возникает при активации латентного очага, реже выступает следствием текущего заражения. Первостепенную важность играет нарушение иммунного статуса вследствие следующих патологий:
- ВИЧ-инфекция. Самая частая причина, поскольку на определенном этапе снижения числа CD4-клеток ОПИ развиваются у каждого больного. Инфекционные болезни используются для диагностики заражения ВИЧ и определения стадии заболевания, поэтому в данном контексте они называются СПИД-ассоциируемыми или СПИД-индикаторными патологиями.
- Злокачественные новообразования. Патофизиология любого опухолевого процесса предполагает угнетение собственной иммунной системы пациента и снижение ее ответа на чужеродные агенты. При этом уменьшается число Т-клеток, угнетаются процессы фагоцитоза. Проблема наиболее выражена при гемобластозах – лейкозах и лимфомах.
- Хроническая соматическая патология. Угнетение активности клеточного и гуморального иммунитета происходит при эндокринных заболеваниях (сахарный диабет, гипотиреоз), почечной недостаточности, тяжелых воспалительных патологиях ЖКТ.
- Ятрогенные факторы. Применение цитостатиков и других видов иммуносупрессоров является важным предиктором развития оппортунистических инфекций. Подобная ситуация наблюдается в группе пациентов после лучевой терапии, трансплантации органов и костного мозга.
- Первичные иммунодефициты. В эту группу относят все виды иммунной недостаточности, которые имеют генетический характер или возникают внутриутробно под влиянием тератогенов. Они манифестируют в раннем детском возрасте, проявляются затяжными оппортунистическими болезнями, которые с трудом подаются терапии.
Патогенез
Хотя возбудители оппортунистических инфекций таксономически неоднородны, в развитии заболеваний большую роль имеют общие особенности их патогенности и вирулентности. К свойствам микроорганизмов, вызывающих ОПИ, относят возможность длительного и даже пожизненного персистирования в организме человека, внутриклеточное паразитирование, склонность к поражению клеток моноцитарно-макрофагальной системы.
Инфекции активизируются при иммунодефицитах любой этиологии и склонны к хроническому течению с периодическими обострениями, поражением жизненно важных органов. Для оппортунистических болезней характерна лимфогенная и гематогенная диссеминация микроорганизмов, образование эктопических очагов. Собственный иммунитет пациента не способен оказать должное сопротивление инфекционному агенту, лекарственные средства не всегда эффективны.
Сложность и опасность оппортунистических инфекций заключается еще и в том, что они способны подавлять естественный иммунитет. В последние годы говорят о возможности пожизненной иммуносупрессии при персистировании герпесвирусов. Таким образом, формируется порочный круг, когда иммунодефицит провоцирует активацию возбудителей ОПИ, которые усугубляют явления иммунной недостаточности и потенциируют дальнейшие полиорганные нарушения.

Классификация
Единой систематизации оппортунистических инфекций на сегодня не существует. Условно возбудителей объединяют в 3 группы: патогены, которые поражают лиц с нарушениями иммунитета и здоровых людей; микробы, встречающиеся только при иммунодефицитах; вакцинные штаммы микроорганизмов. Общепринятой является классификация ОПИ согласно типу возбудителя:
Симптомы оппортунистических инфекций
В инфектологии выделяют общую группу клинических признаков, которая встречается при любом варианте ОПИ. Наиболее типичным симптомом признан длительный субфебрилитет, которые возникает без видимой причины и беспокоит пациента больше 1 месяца. Нередко повышение температуры возникает после перенесенного ОРВИ или кишечной инфекции, которые выступают пусковым фактором активации оппортунистического заболевания.
Вторым настораживающим симптомом считается лимфаденопатия – увеличение лимфатических улов. Чаще всего в процесс вовлекается лимфоидная ткань шейно-подчелюстной, подмышечной и паховой зоны. Лимфоузлы достигают диаметра около 1 см, имеют плотноэластическую консистенцию, не спаяны с окружающими тканями и безболезненны при ощупывании.
Третью группу общей симптоматики оппортунистических инфекций составляет астенический синдром. Он включает слабость, повышенную утомляемость, снижение переносимости умственных и физических нагрузок. Зачастую пациенты жалуются на ночную потливость, головокружения и головные боли, нарушения сна. При длительном существовании таких признаков наблюдается когнитивная дисфункция, эмоциональная подавленность, стойкое снижение работоспособности.
Пациента с иммуносупрессией должен насторожить кашель и одышка – типичные признаки туберкулеза и пневмоцистной пневмонии (ПЦП), снижение остроты зрения – возможное проявление цитомегаловирусного ретинита, длительно сохраняющаяся диарея – признак криптоспоридиоза, микроспоридиоза. Жжение и сухость полости рта в комбинации с эрозиями и белыми налетами на слизистых указывают на орофарингеальный кандидоз.
Оппортунистические болезни не имеют четко выраженного тропизма. Один и тот же вид возбудителя может вызывать миокардит, плеврит, артрит, менингит и другие нозологические формы. Зачастую они имитируют симптомы хронических соматических заболеваний, с которыми пациенты длительно и безрезультатно посещают врачей разных специальностей. Исключение составляет пневмоцистоз, который в основном поражает легкие с развитием ПЦП.
Осложнения
Оппортунистические инфекции – тяжелые и потенциально смертельные заболевания. Среди пациентов с терминальными стадиями ВИЧ-инфекции ОПИ составляют 90% в структуре летальности, оставшиеся 10% приходятся на саркому Капоши, лимфомы и прочие неинфекционные последствия СПИДа. Смертность при церебральном токсоплазмозе составляет около 33%, при криптококковом менингите – 20-30%, при пневмоцистной пневмонии – 10-20%.
Особую тревогу вызывает сочетание нескольких видов оппортунистических заболеваний у одного пациента. Микробные ассоциации более характерны для позднего периода и хронического течения основной патологии, вызвавшей иммунодефицит. Сочетанное инфицирование типично для иммунокомпрометированных пациентов, пребывающих на стационарном лечении: у 40-50% больных в послеоперационном периоде, у 70-80% при перитонитах и плевритах.
Распространение оппортунистических инфекций негативно сказывается на репродуктивном здоровье населения. Они обуславливают многие случаи самопроизвольного прерывания беременности, эмбриопатий и фетопатий, задержки внутриутробного развития. Дети, рожденные от матерей с ОПИ, находятся в группе риска развития заболеваний новорожденных, перинатальных энцефалопатий.

Диагностика
Обследование пациентов проводится мультидисциплинарной командой врачей, в которую входят врач-инфекционист, иммунолог, онколог и другие узкопрофильные специалисты. Большое клиническое значение имеет выяснения времени и условий появления симптоматики, характера течения заболевания, наличия факторов риска иммунодефицитных состояний. Для подтверждения оппортунистических инфекций проводятся следующие методы диагностики:
Лечение оппортунистических инфекций
В процессе лечения практикующие инфекционисты сталкиваются с такими нюансами, как множественная лекарственная устойчивость патогенов, гетерогенность популяции возбудителей, низкая активность естественных иммунных факторов. Основу терапии составляет прием этиотропных противомикробных препаратов: антибиотиков, антимикотиков, противопротозойных и противовирусных. Лечение ОПИ имеет ряд особенностей:
- в основном назначаются комбинации из 2-3 препаратов для повышения их эффективности;
- продолжительность противомикробной терапии повышается в 1,5-2 раза и более в сравнении с лечением инфекционных болезней у иммунокомпетентных лиц;
- при подборе терапии ориентируются не только на клиническую картину болезни, но и на текущий иммунный статус пациента;
- при вирусных инфекциях обязательно назначаются этиотропные препараты, тогда как у людей без иммуносупрессии противовирусные средства используют только по показаниям.
Для успешного лечения ОПИ требуется максимально возможное восстановление иммунной функции. В группе пациентов с ВИЧ-инфекцией назначаются протоколы антиретровирусной терапии (ВААРТ), чтобы повысить число CD4-клеток и улучшить отдаленные прогнозы. При ведении онкологических больных используются персональные схемы иммуномодуляторов, экспериментальные направления иммунотерапии и регенеративной медицины с применением стволовых клеток.
Прогноз и профилактика
Течение любой инфекции на фоне иммуносупрессии является сложным и непредсказуемым, однако усовершенствованные протоколы лечения позволяют достичь стойкой ремиссии или даже полного излечения. К прогностически неблагоприятным факторам относят пожилой и старческий возраст, неправильно подобранную терапию, невозможность проведения иммунокоррекции основного заболевания.
При иммунодефицитах показана первичная медикаментозная профилактика оппортунистических инфекций. Применяют сульфаниламиды, макролиды‑азалиды, противогрибковые средства. При положительной пробе Манту или недавнем контакте с больным туберкулезом назначается химиопрофилактика сроком на 6 месяцев. Также пациентам рекомендовано строго соблюдать противоэпидемические меры, в периоде резкой иммуносупрессии необходимо пребывание в стерильных боксах.
3. Клинические особенности сочетанных оппортунистических инфекций (обзор)/ В.В. Шкарин, Н.В. Саперкин// Медицинский альманах. – 2017. – №4.
4. Оппортунистические инфекции: проблемы и перспективы/ Под общ. ред. проф. Ю.В. Редькина, О.А. Мирошника, В.В. Лобова. – 2002.
Читайте также:

