Чем лечить горло при инфекционном мононуклеозе
Обновлено: 25.04.2024
Инфекционный мононуклеоз — вирусное, широко распространенное заболевание, для которого характерна системность поражения с вовлечением в патологический процесс лимфоидных органов и тканей, сердечно-сосудистой, иммунной, систем, костного мозга, печени, селе
New approaches to the therapy of infectious mononucleosis Yu. G. Pritulina, V. V. Kunina, A. A. Monastyrsky, T. N. Malyutkina, V. V. Malinovskaya, A. N. Shuvalov
Infectious mononucleosis is a viral, widely-spread disease characterized by systemacy of the lesion, with involvement of lymphoid organs and tissues, cardiovascular and immune systems, marrow, liver, spleen and other organs in the pathological process. Comparative study of clinical and laboratory indices in the acute period of infectious mononucleosis was conducted, including treatment with human recombinant interferon alpha-2b, along with highly active antioxidants — C and E vitamins.
Герпесвирусные инфекции широко распространены среди детей и взрослых. По данным Всемирной организации здравоохранения (ВОЗ) до 90% взрослого и детского населения планеты инфицировано герпесвирусами, причем у 50% из них отмечают манифестное, рецидивирующее течение вызываемых ими заболеваний. Инфекционный мононуклеоз является наиболее характерным типичным клиническим проявлением герпесвирусных инфекций [1]. Инфекционный мононуклеоз (ИМ) — вирусное, широко распространенное заболевание, для которого характерна системность поражения с вовлечением в патологический процесс лимфоидных органов и тканей, сердечно-сосудистой, иммунной систем, костного мозга, печени, селезенки и других органов [2, 3]. В мире инфекционным мононуклеозом ежегодно заболевают от 16 до 800 лиц на 100 тыс. населения. В России ежегодно регистрируют 40–80 случаев ИМ на 100 тыс. населения [1, 2, 4]. Установлена роль вируса Эпштейна–Барр в развитии злокачественных новообразований, аутоиммунных, неврологических заболеваний и синдрома хронической усталости. Показано, что после перенесенной инфекции новое поколение В-клеток содержит несколько генокопий вируса Эпштейна–Барр в латентной форме, в результате чего вирус может длительно персистировать в организме, вызывая иммунодефицитное состояние и повышая риск развития онкогематологических заболеваний [5–7]. В последние годы доказана гепатотропность герпетических вирусов, которые могут вызывать различные поражения печени — от бессимптомного гепатита до гепатоцеллюлярной карциномы [2].
В связи с этим назначение интерферона α-2b человеческого рекомбинантного в комплексе с высокоактивными антиоксидантами витаминами Е и С (препарата Виферон®), обладающего иммуномодулирующими, противовирусными, антипролиферативными свойствами, подавляющего репликацию РНК- и ДНК-содержащих вирусов, могло бы способствовать более быстрому клиническому выздоровлению, оказать положительное влияние на лабораторные показатели и тем самым предотвратить хроническое течение.
Целью данного исследования явилось сравнительное изучение клинико-лабораторных показателей в острый период ИМ при лечении препаратом Виферон®.
В задачи иследования входило:
1) оценить эффективность использования симптоматической и патогенетической терапии у пациентов с ИМ;
2) оценить эффективность применения препарата Виферон® у пациентов с ИМ на фоне симптоматической и патогенетической терапии;
3) исследовать сравнительную эффективность лечения препаратом Виферон® с базисной стандартной терапией у пациентов с ИМ.
Материал и методы исследования
Проведено открытое проспективное рандомизированное контролируемое исследование в группах больных с острым ИМ. В исследование были включены 40 пациентов, больных острым ИМ средней степени тяжести, проходивших стационарное лечение в Воронежской областной клинической инфекционной больнице. Основная группа (1-я группа) — 20 пациентов, наряду с базисной терапией получала препарат рекомбинантного интерферона α-2b в комплексе с высокоактивными антиоксидантами витаминами Е и С Виферон®, и группа сравнения (2-я группа) — 20 пациентов, которым проводили только базисную стандартную терапию. Критерии включения пациентов были: лечение в стационаре, верифицированный диагноз ИМ, возраст старше 18 лет, поступавших в клинику на 1–5 день от начала заболевания и не получавших в домашних условиях препаратов интерферона и иммуномодуляторов, наличие информированного согласия на участие в исследовании.
Лечение пациентов в группах на всех этапах исследования осуществляли согласно стандартным режимам лечения (на основании основных положений Федеральных клинических рекомендаций по диагностике и лечению инфекционного мононуклеоза, 2013), включающего базисную стандартную терапию (дезинтоксикационная, десенсибилизирующая и антибактериальная терапия).
- 1-й группе пациентов наряду с базисной терапией назначали Виферон® по следующей схеме: по 1 суппозиторию (1 000 000 МЕ) 2 раза в сутки в течение 10 дней.
- 2-я группа пациентов получала только базисную стандартную терапию.
Набор больных в группы осуществляли методом пар, рандомизация проводилась с помощью генератора случайных чисел, больные в группах были сопоставимы по полу и возрасту.
Для обработки полученных данных использовали пакеты программ Microsoft Excel 2007 и Statistica 6.0. Проверку статистических гипотез проводили при критическом уровне значимости р = 0,05, т. е. различие считали статистически значимым при p < 0,05.
- 1-я группа — 20 человек, из которых 9 мужчин и 11 женщин в возрасте от 18 до 47 лет.
- 2-я группа — 20 человек, из которых 10 мужчин и 10 женщин в возрасте от 18 до 47 лет (рис. 1).
Всем больным проводилось клиническое и лабораторное обследование, включающее в себя (на 1-й и 3-й неделе):
1) общий анализ крови, общий анализ мочи, биохимический анализ крови;
2) антитела (АТ) к капсидному антигену (VCA) вируса Эпштейна–Барр класса M, G; АТ к раннему антигену (ЕА) класса G; АТ к ядерному антигену (ЕВNA) класса G;
3) полимеразная цепная реакция (ПЦР): ДНК вируса Эпштейна–Барр (ЕВV).
Результаты и обсуждение
Среди клинических проявлений ИМ у всех больных при поступлении наблюдались лихорадка, синдром интоксикации, полилимфаденопатия, синдром ангины с преобладанием лакунарной формы, гепатомегалия, заложенность носа, спленомегалия.
С первого дня поступления в стационар пациенты получали различные виды терапии. При изучении клинической эффективности разных способов лечения оказалось, что в 1-й группе больных температура нормализовалась на 6,3 ± 0,29 дня, во 2-й группе пациентов, не получавших Виферон®, — 10,5 ± 0,6 дня соответственно (p ≤ 0,05).
У пациентов, получавших Виферон®, отмечалась тенденция к более быстрому купированию синдрома интоксикации, чем во 2-й группе, что проявлялось улучшением самочувствия, аппетита, исчезновением бледности кожных покровов и уменьшением лимфаденопатии.
Сокращение размеров шейной группы лимфоузлов в 1-й группе отмечалось на 3,4 ± 0,17 дня, а во 2-й группе пациентов на 6,8 ± 0,12 дня соответственно (p ≤ 0,05). Применение антибиотикотерапии в сочетании с препаратом Виферон® привело к достоверному сокращению продолжительности гнойно-воспалительных процессов в ротоглотке на 3,7 ± 0,12 дня, заложенности носа на 4,6 ± 0,2 (p ≤ 0,05) дня, а в группе только с антибиотикотерапией на 5,2 ± 0,14 и 5,7 ± 0,28 (p ≤ 0,05) дня соответственно.
Уменьшение размеров печени до нормальных показателей отмечалось на 9,5 ± 0,37 дня в 1-й группе, тогда как во 2-й группе — на 11,53 ± 0,25 (p ≤ 0,05) дня (рис. 2). Нормализация размеров селезенки наступала к 5–7 дню лечения, что не было статистически значимым для сравниваемых групп.
При анализе биохимических показателей крови на фоне лечения препаратом Виферон® и в группе только с патогенетической терапией выраженных различий найдено не было. Что касается основных показателей общего анализа крови на фоне проводимой терапии, то статистически значимым оказалось более быстрое исчезновение числа атипичных мононуклеаров на фоне лечения препаратом Виферон® по сравнению с группой получавших только патогенетическую терапию (6,2 ± 0,29 и 8,6 ± 0,32 дня (p ≤ 0,05) соответственно). Нормализация СОЭ наступила раньше в 1-й группе по сравнению со 2-й группой сравнения (5,2 ± 0,27 и 9,4 ± 0,55 дня (p ≤ 0,05) соответственно) (рис. 3).
Выводы
- При проведении терапии с применением препарата Виферон® по 1 суппозиторию (1 000 000 МЕ) 2 раза в сутки в течение 10 дней отмечается более быстрое, по сравнению с группой, не применявшей Виферон®, исчезновение ряда клинических симптомов: отмечалась тенденция к более быстрому купированию синдрома интоксикации, нормализация температуры в 1-й группе произошла в среднем на 4 дня быстрее, чем в группе, не принимавшей Виферон®, уменьшение размеров шейной группы лимфоузлов — более чем на 3 дня раньше в 1-й группе по сравнению со 2-й, не получавшей Виферон®, уменьшение размеров печени до нормальных показателей на 2 дня раньше, чем во 2-й группе. Применение антибиотикотерапии в сочетании с препаратом Виферон® привело к достоверному сокращению продолжительности гнойно-воспалительных процессов в ротоглотке и заложенности носа, чем у пациентов, получавших только антибиотикотерапию. Нормализация некоторых лабораторных показателей, больных острым инфекционным мононуклеозом, принимавших в комплексной терапии Виферон®, по сравнению с больными, получавшими только стандартную терапию.
- Дальнейшее изучение этого препарата у данных пациентов требует оценки эффективности лекарственных форм препарата Виферон® в дозе 3 000 000 МЕ по 1 суппозиторию 2 раза в день.
Литература
Ю. Г. Притулина* , 1 , доктор медицинских наук, профессор
В. В. Кунина*, кандидат медицинских наук
А. А. Монастырский**
Т. Н. Малюткина**
В. В. Малиновская***, доктор биологических наук, профессор
А. Н. Шувалов***, кандидат медицинских наук
* ФГБОУ ВО ВГМУ им. Н. Н. Бурденко Минздрава России, Воронеж
** БУЗ ВО ВОКИБ, Воронеж
*** ФГБУ НИЦЭМ им. Н. Ф. Гамалеи Минздрава России, Москва
Новые подходы к терапии инфекционного мононуклеоза/ Ю. Г. Притулина, В. В. Кунина, А. А. Монастырский, Т. Н. Малюткина, В. В. Малиновская, А. Н. Шувалов
Для цитирования: Лечащий врач № 9/2019; Номера страниц в выпуске: 57-59
Теги: герпесвирусные инфекции, иммунодефицитные состояния, интерферон
Что такое острый тонзиллит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Меркушин Д. Е., онколога со стажем в 12 лет.
Над статьей доктора Меркушин Д. Е. работали литературный редактор Елена Бережная , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
Острый тонзиллит (Acute tonsillitis) — заболевание инфекционной природы с воздушно-капельным путем передачи, сопровождающееся выраженным синдромом общей интоксикации, местным проявлением которого служит воспаление одной или нескольких лимфатических фолликул глоточного кольца.
Острый тонзиллит вызывают бактериальные, вирусные и грибковые возбудители, а также бактериальные, вирусно-бактериальные, грибково-бактериальные ассоциации. Источником инфекции является больной или бактерионоситель.
Streptococcus pyogenes, Streptococcus группы A (GAS), является наиболее распространенной причиной бактериального фарингита у детей и взрослых. [1]
Прочие возбудители острого тонзиллита: [2]
- стафилококк (Arcanobacterium haemolyticum, Neisseria gonorrhoeae, Corynebacterium diphtheriae);
- анаэробы (синегнойная палочка);
- микоплазмы (m. Pneumoniae);
- хламидии;
- аденовирусы 1–9 типа;
- энтеровирус Коксаки;
- вирус простого герпеса;
- вирус гриппа;
- вирус Эпштейн-Барра и др.
Среди микозов наиболее часто развитие острого тонзиллита вызывают грибы рода Candida в симбиозе с патогенными и условно патогенными кокками.
Язвенно-некротическая тонзиллит вызывается спирохетой Плаута-Венсана в симбиозе с веретенообразной палочкой Венсана.
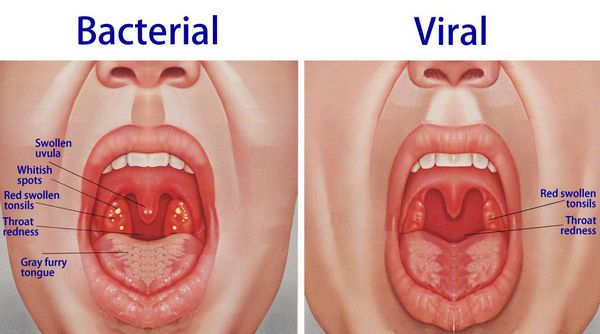
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы острого тонзиллита
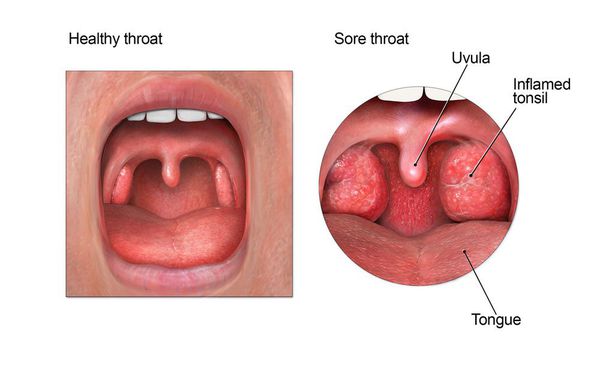
Осмотр глотки позволяет выявить характерные для заболевания изменения.
При катаральной форме заболевания миндалины увеличены, гиперемированы, наблюдается отек и гиперемия мягкого нёба и нёбных дужек. Налета на поверхности миндалин при этом не выявляется. При фолликулярном тонзиллите воспалительный процесс запускается в мелких лимфаденоидных фолликулах, происходит их нагноение, а потом вскрытие. Осмотр глотки в разгар заболевания выявляет на поверхности миндалин нечётко оформленные желтовато-белые точки.
Лакунарный тонзиллит характеризуется появлением в устьях лакун налётов или экссудата, выступающего на поверхность и покрывающего миндалину в виде островков, трудно удаляемого и оставляющего после себя кровоточащую изъязвленную поверхность.
Следствием фолликулярного и лакунарного тонзиллита может быть фибринозная форма заболевания, когда поверхность миндалин сплошь покрывается налетом.
Если возбудитель проникает в паратонзиллярную клетчатку и формируется инфекция мягких тканей, это может привести к флегмонозному тонзиллиту. Данная форма заболевания сопровождается нарастанием интоксикации, усилением боли в горле, появлением асимметричного отека и увеличением шеи, затруднением в наклоне и поворотах головы, появлением характерного неприятного запаха изо рта. По межфасциальным пространствам шеи гнойный процесс может опуститься до уровня клетчатки средостения и вызвать развитие медиастинита.
Для тонзиллита вирусного происхождения (вирус Коксаки типа А) характерны герпетические высыпания на миндалинах, мягком нёбе и нёбных дужках.
При аденовирусном тонзиллите воспалительный процесс в ротоглотке помимо миндалин распространяется на поверхность нёба, задней стенки глотки.
Такая форма острого тонзиллита, как ангина Симановского–Венсана чаще поражает одну миндалину в виде некротических изъязвлений, которые покрыты серым налетом. Признаки интоксикации при этом выражены слабо.
Для острого тонзиллита при системных заболеваниях кровеносной системы характерен некроз слизистой оболочки миндалин, распространение которого может привести к разрушению не только самой миндалины, но и мягкого нёба и стенок глотки с последующим рубцеванием дефекта. Тяжелое общее состояние больного обычно обусловлено течением основного заболевания. [3]
У маленьких детей (особенно у мальчиков) острый тонзиллит, вызванный стрептококками группы А, помимо прочего, может проявляться в виде желудочно-кишечных симптомов (боль в животе, тошнота и рвота). [8]
Патогенез острого тонзиллита
Врожденные и адаптивные иммунные ответы организма являются основополагающими для защиты от стрептококкового фарингита. Иммунные реакции организма также способствуют тяжелым постстрептококковым иммунным заболеваниям. Однако до недавнего времени о них было мало известно.
Клеточные медиаторы врожденного иммунитета, используемые при защите организма от стрептококка группы А, включают эпителиальные клетки, нейтрофилы, макрофаги и дендритные клетки (ДК), которые выделяют ряд растворимых воспалительных медиаторов, таких как антимикробные пептиды (AMP), эйкозаноиды, включая PGE2 и лейкотриен B4 (LTB4), хемокины и провоспалительные цитокины. Ответы Th1 и Th17 играют значительную роль в адаптивном иммунитете в тканях миндалин человека. [9]
Классификация и стадии развития острого тонзиллита
Выделяют три типа заболевания:
- первичные;
- вторичные;
- специфические тонзиллиты.
Возникновение вторичных связано с общими острыми инфекционными заболеваниями (скарлатина, дифтерия и т. д) и системными заболеваниями кровеносной системы (агранулоцитоз, лейкоз).
Специфические тонзиллиты возникают на фоне специфической инфекции (язвенно-пленчатый тонзиллит — ангина Симановского — Плаута — Венсана, вызываемая находящимися в симбиозе веретенообразной палочкой Плаута — Венсана и спирохетой Венсана, герпетический тонзиллит, вызываемый вирусом Коксаки А).
По форме выделяют:
- катаральный;
- фолликулярный;
- лакунарный;
- фибринозный;
- герпетический;
- флегмонозный (интратонзиллярный абсцесс);
- язвенно-некротический (гангренозный);
- смешанные формы тонзиллита.
Осложнения острого тонзиллита
Осложнения заболевания подразделяются на ранние и поздние.
Ранние осложнения возникают из-за распространения инфекции за пределы лимфоидной ткани и нарастания симптомов интоксикации (паратонзиллярный абсцесс, медиастинит, септические состояния, инфекционно-токсический шок, менингит и менингоэнцефалит).
В поздние сроки (через 2-4 недели) возможно развитие острой ревматической лихорадки и поражения почек в виде гломерулонефрита, реактивного артрита, провокация дебюта или обострение уже имеющихся системных аутоимунных заболеваний (красная волчанка, системный васкулит). [10]
Диагностика острого тонзиллита
Помимо общеклинического минимума, в который входят ОАК, ОАМ, ежегодное флюорографическое исследование, обязательным является:
- определение антистрептолизина-O в сыворотке крови;
- взятие мазка из зева и носовых ходов на корнебактерию дифтерии;
- взятие мазка на определение чувствительности микроорганизмов к антибиотикам.
Другие методы диагностики:
- в большинстве случаев показано проведение ЭКГ;
- в некоторых случаях обоснованным будет назначение серологического исследования на вирусы респираторных инфекций;
- молекулярно-биологическое исследование крови на вирус Эпштейна — Барр;
- микроскопическое исследование мазков с миндалин на гонококк;
- бактериологическое исследование слизи с миндалин и задней стенки глотки на анэробные микроорганизмы;
- микологическое исследование носоглоточных смывов на грибы рода кандида;
- определение С-реактивного белка.
Хотя фарингит группы A Streptococcus (GAS) является наиболее распространенной причиной бактериального фарингита у детей и подростков, многие вирусные и бактериальные инфекции имитируют симптомы фарингита. Экстренные клиницисты должны признать симптоматику фарингита GAS и использовать соответствующие средства диагностики и лечения для эффективного лечения антибиотиками.
У людей с острым фарингитом проводится дифференциальная диагностика между фарингитом, вызванным гемолитическим стрептококком А, инфекционным мононуклеозом и другими причинами вирусного фарингита. [11]
Лечение острого тонзиллита
При наличии показаний к госпитализации пациенту выдается направление на госпитализацию в круглосуточный стационар инфекционной больницы. При лечении в амбулаторных условиях на следующий день участковому терапевту в поликлинику по месту прикрепления пациента передается заявка на активное посещение на дому.
Необходима изоляция пациента, частое проветривание помещения, влажная уборка, производится ультрафиолетовое облучение воздуха в помещении с пациентом. Пациенту выдается отдельный набор посуды, недопустимо пользоваться общими полотенцами, зубными щетками.
В период повышения температуры пациенту показан полупостельный режим, по мере стихания синдрома интоксикации и лихорадки — палатный (до 7-го дня нормальной температуры тела). Пациенту показано обильное теплое питье не менее 1,5-2,0 л жидкости в сутки. При терапии в условиях стационара показано введение физиологического раствора с аскорбиновой кислотой для уменьшения симптомов интоксикации. При повышении t тела выше 38 градусов необходимо ее снижение приемом 500 мг парацетомола, 200-400 мг ибупрофена или 500 мг парацетомола в сочетании с 200 мг ибупрофена (препараты ибуклин, брустан). При неэффективности оказанных мер возможно внутримышечное введение литической смеси (анальгин 50% 1 мл + димедрол 1% 1 мл), преднизолона в дозе 30-60 мг (1-2 мл).
Пациенту назначается полоскание горла растворами антисептиков. На фармацевтическом рынке существуют распространенные, доступные по стоимости и в то же время эффективные антисептики с широким спектром активности и низкой резистентностью микроорганизмов к ним. К таким препаратам относят хлоргексидин, мирамистин, Йокс.
Антибактериальное (бактерицидное) действие раствора Йокс реализуется за счет йода в его составе. Раствор разводится из расчета 5 мл (1 чайная ложка) на 100 мл воды. Ополаскивать горло не менее 4 раз в сутки. Перед нанесением спрея прополоскать горло обычной водой для удаления слизи. Наносить спрей не менее 4 раз в сутки.
Обязательным является назначение этиотропного препарата для борьбы с возбудителем тонзиллита. В амбулаторно-поликлинических условиях наиболее удобным является пероральное назначение препаратов, в стационаре рационально парентеральное введение. [4]
При подтверждении роли корнебактерии дифтерии в развитии заболевания основное значение имеет введение лошадиной противодифтерийной сыворотки. Перед введением основной терапевтической дозы двукратно проводится биологическая проба. На первом этапе вводят 0,1 мл разведённой сыворотки из ампулы, маркированной красным цветом, внутрикожно в сгибательную поверхность предплечье руки. При правильном введении на коже образуется небольшой, плотный на ощупь узелок. В предплечье второй руки вводят в/к 0,1 мл физиологического раствора в качестве контроля. Время наблюдения за пациентом составляет 20 минут. Проба считается отрицательной, если диаметр папулы или гиперемии в месте введения не более 10 мм. На втором этапе 0,1 мл неразведенной сыворотки, маркированной синим цветом, вводят подкожно в наружную поверхность плеча. При отсутствии неблагоприятной реакции через 30 минут внутримышечно вводится основная доза препарата.
Разовая доза сыворотки составляет:
- при локализованных формах 10 000 – 20 000 МЕ;
- дифтерии гортани 40 000 – 50 000 МЕ;
- при субтоксической форме 40 000 – 50 000 МЕ;
- токсической 50 000 – 80 000 МЕ;
- геморрагической 100 000 – 120 000 МЕ.
При отсутствии терапевтического эффекта введение сыворотки можно повторить через 12-24 часа с использованием тех же доз. [5]
Из антибактериальных препаратов рекомендуется назначение макролидов — кларитромицина, мидекамицина или джозамицина:
- Кларитромицин рекомендован в дозировке 500 мг однократно в сутки внутрь длительностью не менее 7-10 дней.
- Мидекамицин в дозировке 400 мг 3 раза в сутки внутрь не менее 7-10 дней.
- Джозамицин применяется в дозировке 500-1000 мг двукратно в сутки внутрь. Длительность терапии не менее 7-10 дней.
Терапия гонококкового тонзиллита проводится в условиях кожно-венерологического диспансера. Назначается 0,5 мг цефтриаксона внутримышечно или 0,5 мг внутрь левофлоксацина однократно внутрь. В связи с высоким риском сопутствующей хламидийной инфекции совместно с цефалоспоринами назначают доксициклин, 600 мг. препарата назначается в 2 приема с интервалом 1 час (по 3 таблетки 100 мг 2 раза).
При общих вирусных инфекциях (инфекционный мононуклеоз, генерализованная герпетическая инфекция, тяжелое течение гриппа) развитие острого тонзиллита, как правило, связано с активацией условно патогенной флоры ротоглотки. Помимо противовирусной терапии назначаются антибиотики, как и в случае с обычным первичным бактериальным тонзиллитом.
Препаратами первой линии являются клавулированные пенициллины. Применение неклавулированного пенициллина для терапии инфекции верхних дыхательных путей не рекомендовано в связи с высокой резистентностью микрофлоры к данному антибактериальному препарату. [7]
Амоксициллина клавулонат принимается в дозировке 875+125 мг 3-4 раза в сутки внутрь не менее 7 дней.
Цефалоспорины 2-3 поколения и макролиды
Цефалоспорины II поколения:
Цефуроксим в таблетках по 250 мг назначается из расчета по 1 таблетке 2 раза в сутки внутрь;
Цефалоспорины III поколения:
- Цефиксим в таблетках по 400 мг назначается из расчета по 1 таблетке 1 раз в день внутрь;
- Цефотаксим во флаконах по 1 гр в/м на 2 мл 2% лидокаина, добавив для лучшего растворения 1 мл NaCI 0,9% 2 раза в сутки; возможно в/в капельное введение в течение по крайней мере 30 мин;
- Цефтриаксон флаконы по 1,0 гр в/м на 2 мл 2% лидокаина, добавив для лучшего растворения 1 мл NaCI 0,9% 2 раза в сутки; возможно в/в капельное введение в течение по крайней мере 30 мин.
В качестве препаратов резерва в большинстве случаев применяются фторхинолоны, карбапенемы и линкозамины. Антибиотики тетрациклинового ряда ушли из практики в связи с высокой устойчивостью флоры к ним и невозможностью применения у беременных и в педиатрической практике.
Для предупреждения развития кандидоза в индивидуальном порядке решается вопрос о назначении противогрибкового препарата.
Для терапии же грибкового тонзиллита назначение системных антимикотиков является обязательным. Она включает пероральное применение противогрибковых антибиотиков в течение 10–14 дней (леворин, нистатин, амфотерицин В, кетоконазол, флуконазол). Местно назначаются полоскания антисептиками и ингаляции с мирамистином.
При необходимости пациенту выдается листок нетрудоспособности или справка учащегося с освобождением от труда и посещения занятий соответственно. [6]
Ориентировочные сроки нетрудоспособности:
Средние сроки временной нетрудоспособности составляют 10-12 дней.
Критерии выздоровления:
- нормализация температуры тела в течение 5 суток;
- отсутствие боли в горле и болезненности при пальпации поднижнечелюстных лимфатических узлов;
- отсутствие патологических отклонений в общем анализе крови, общем анализе мочи и на пленке ЭКГ.
Возможно предоставление записки от лечащего врача работодателю в произвольной форме о переводе на облегченный труд и освобождении от ночных смен на 2 недели при возможности. Студентам и школьникам предоставляется освобождение от занятий физкультурой на 2 недели. [6]
Прогноз. Профилактика
При своевременно начатой терапии прогноз благоприятный. При применении современных методов диагностики и качественных антибактериальных препаратов ранние и поздние осложнения заболевания встречаются спорадически (при позднем обращении и самолечении пациента).
Рекомендуется избегать переохлаждений и контакта с больными ОРЗ, вакцинация против гриппа и пневмонии, общеукрепляющие мероприятия. В качестве средства профилактики обострений фарингита и рецидивирующего тонзиллита оказались эффективными препараты бактериального происхождения, в частности, комплексы антигенов — лизатов, наиболее частых возбудителей воспалительных заболеваний верхних дыхательных путей, полости рта и глотки.
К таким препаратам относится ИРС-19 по 1 дозе препарата в каждый носовой ход 2 раза в день в течение 2 недель в периоды межсезонья и перед ожидаемыми вспышками эпидемий ОРЗ.
Имудон по 6 таблеток в день. Таблетки рассасывают (не разжевывая) каждые два часа. Курс терапии составляет 20 дней.
За реконвалесцентами устанавливают патронажное медицинское наблюдение в течение месяца. На первой и третьей неделе проводится исследование анализов крови и мочи, при необходимости — ЭКГ-исследование.
Все пациенты с хроническим тонзиллитом, которые перенесли более двух ангин за последние три года, подлежат обязательному диспансерному наблюдению по группе Д3 (2 раза в год).

Инфекционный мононуклеоз — это острое инфекционное заболевание, протекающее с высокой температурой, воспалением миндалин, увеличением лимфатических узлов, печени, селезёнки, и специфическим изменением в картине крови (появление в анализе мононуклеаров). Вызвано заболевание вирусом Эпштейна-Барра, который относится к семейству герпесвирусов.
Источником инфекции становится больной человек или носитель инфекции. Обычно мононуклеоз лечит врач-инфекционист, но очень часто такие пациенты впервые появляются именно у врача оториноларинголога, с жалобами на температуру и боль в горле.
Инфекционный мононуклеоз встречается повсеместно. Им болеют лица всех возрастных групп, но чаще это лица от 14 до 18 лет, реже дети раннего возраста и взрослые старше 40 лет.
Симптомы мононуклеоза
Чаще всего заболевание начинается с повышения температуры и сильной боли в горле, могут появляться налеты на миндалинах, сыпь на слизистой глотки в виде пузырьков, десна могут кровоточить. Постепенно увеличиваются в основном шейные, а текже подмышечные и паховые лимфатические узлы. Увеличение и воспаление шейных лимфоузлов и ангина - это наиболее частые и типичные признаки инфекционного мононуклеоза. Лимфоузлы болезненны, температура тела может достигать 40° и держаться постоянно или иметь волнообразный характер.
С первых дней заболевания увеличиваются печень и селезенка, иногда отмечаются боли в животе. Реже у больных возникает желтушность кожи и склер, сыпь.
Часто, на фоне приема антибиотиков пенициллинового ряда, по какой-то причине назначенных врачом, у больных появляется аллергическая сыпь.
Заболевание продолжается от 2-х до 4-х недель, иногда дольше. Постепенно исчезают лихорадка и налеты на миндалинах, нормализуется картина крови, размеры лимфатических узлов, селезенки и печени. Температура может держаться до 2-х недель, в отдельных случаях до месяца.
Диагностика инфекционного мононуклеоза
Диагностируется инфекционный мононуклеоз на основании нескольких анализов:
- анализ крови для выявления антител к вирусу Эпштейн-Барра;
- УЗИ брюшной полости для оценки состояния печени и селезенки;
- общий и биохимический анализ крови.
Иногда проводится диагностика для определения ВИЧ-инфекции, которая может проявляется как мононуклеоз.
Лечение мононуклеоза
Больных с лёгким и среднетяжёлым течением болезни лечат на дому. При более тяжелом течении необходимо стационарное лечение. Необходимость постельного режима определяется выраженностью интоксикации.
Лечение мононуклеоза симптоматическое. Используются противовирусные, жаропонижающие, противовоспалительные препараты. На стадии выздоровления средства для повышения иммунитета. Местно применяют антисептические средства, обезболивающие спреи для обеззараживания и облегчения состояния пациента. Допускается использование растворов для полоскания зева. Если нет аллергии на продукты пчеловодства, применяют мед. Это средство укрепляет иммунитет, смягчает горло и борется с бактериями.
Инфекционный мононуклеоз часто осложняется бактериальной инфекцией - в таком случае назначаются антибактериальные препараты, избегая пенициллиновую группу антибиотиков.
Пациентам назначают специальную диету, которую необходимо соблюдать в течение полугода. Не разрешается ничего жирного, копченого, сладкого, горох, фасоль.
После выздоровления необходимо наблюдение инфекционистом на протяжении 6 месяцев. Перенесенное заболевание оставляет после себя стойкий иммунитет.
Одной из актуальных проблем современной медицины является высокая инфицированность населения одним из представителей оппортунистических возбудителей — вирусом Эпштейна–Барр (ВЭБ).
Одной из актуальных проблем современной медицины является высокая инфицированность населения одним из представителей оппортунистических возбудителей — вирусом Эпштейна–Барр (ВЭБ). Практикующие врачи в своей повседневной практике чаще сталкиваются с клинически манифестными формами первичной Эпштейна–Барр-вирусной инфекции (ЭБВИ) в виде острой, как правило, не верифицированной респираторной инфекцией (более 40% случаев) или инфекционным мононуклеозом (около 18% всех заболеваний) [1, 2]. В большинстве случаев эти заболевания протекают доброкачественно и заканчиваются выздоровлением, но с пожизненной персистенцией ВЭБ в организме переболевшего [1, 3–5].
Однако в 10–25% случаев первичное инфицирование ВЭБ, протекающее бессимптомно, и острая ЭБВИ могут иметь неблагоприятные последствия [6–9] с формированием лимфопролиферативных и онкологических заболеваний, синдрома хронической усталости, ВЭБ-ассоциированного гемофагоцитарного синдрома и др. [7, 9, 11–14].
До настоящего времени нет четких критериев, позволяющих прогнозировать исход первичного инфицирования ВЭБ. Перед врачом, к которому обращается пациент с острой ЭБВИ, всегда встает вопрос: что предпринять в каждом конкретном случае, чтобы максимально снизить риск развития хронической ЭБВИ и ВЭБ-ассоциированных патологических состояний Этот вопрос не праздный, и ответить на него действительно очень трудно, т. к. до сих пор нет четкой патогенетически обоснованной схемы лечения больных, а имеющиеся рекомендации часто противоречат друг другу.
По мнению многих исследователей, лечение ЭБВИ-мононуклеоза (ЭБВИМ) не требует назначения специфической терапии [15–17]. Лечение больных, как правило, проводится в амбулаторных условиях, изоляция пациента не требуется. Показаниями к госпитализации следует считать длительную лихорадку, выраженный синдром тонзиллита и/или синдром ангины, полилимфаденопатию, желтуху, анемию, обструкцию дыхательных путей, боли в животе и развитие осложнений (хирургических, неврологических, гематологических, со стороны сердечно-сосудистой и дыхательной системы, синдром Рейе).
При легком и среднетяжелом течении ЭБВ ИМ больным целесообразно рекомендовать палатный или общий режим с возвращением к обычной деятельности на адекватном для каждого конкретного больного физическом и энергетическом уровне. Проведенное многоцентровое исследование показало, что необоснованно рекомендуемый строгий постельный режим удлиняет период выздоровления и сопровождается длительным астеническим синдромом, требующим нередко медикаментозного лечения [18].
При легком течении ЭБВ ИМ лечение больных ограничивается поддерживающей терапией, включающей адекватную гидратацию, полоскание ротоглотки раствором антисептиков (с добавлением 2% раствора лидокаина (ксилокаина) при выраженном дискомфорте в глотке), нестероидные противовоспалительные препараты, такие как парацетамол (Ацетаминофен, Тайленол). По мнению ряда авторов назначение блокаторов Н2 рецепторов, витаминов, гепатопротекторов и местная обработка миндалин различными антисептиками являются малоэффективными и необоснованными способами лечения [19, 20]. Из экзотических методов лечения следует упомянуть рекомендуемое Ф. Г. Боковым и соавт. (2006) применение мегадоз бифидобактерий при лечении больных острым мононуклеозом [21].
Мнения о целесообразности назначения антибактериальных препаратов при лечении ЭБВИМ весьма противоречивы. По мнению Gershburg E. (2005) тонзиллит при ИМ часто асептический и назначение антибактериальной терапии не оправдано. Также нет смысла в применении антибактериальных средств при катаральной ангине [4]. Показанием для назначения антибактериальных препаратов является присоединение вторичной бактериальной инфекции (развитие у больного лакунарной или некротической ангины, таких осложнений, как пневмония, плеврит и др.), о чем свидетельствуют сохраняющиеся более трех суток выраженные воспалительные изменения показателей крови и фебрильная лихорадка. Выбор препарата зависит от чувствительности микрофлоры на миндалинах больного к антибиотикам и возможных побочных реакций со стороны органов и систем.
По данным H. Fota-Markowcka et al. (2002) у больных чаще выделяют гемофильную палочку, стафилококк и пиогенный стрептококк, реже — грибы рода Candida [22], поэтому следует признать обоснованным назначение этим больным препаратов из группы цефалоспоринов 2–3 поколения, линкосамидов, макролидов и противогрибковых средств (флуконазол) в терапевтических дозах на 5–7 дней (реже — 10 дней) [4]. Некоторые авторы при наличии некротической ангины и гнилостном запахе изо рта, вызванных, вероятно, ассоциированной анаэробной флорой, рекомендуют использовать метронидазол по 0,75 г/сут, разделенных на 3 приема, в течение 7–10 дней.
Противопоказаны препараты из группы аминопенициллинов (ампициллин, амоксициллин (Флемоксин Солютаб, Хиконцил), амоксициллин с клавуланатом (Амоксиклав, Моксиклав, Аугментин)) из-за возможности развития аллергической реакции в виде экзантемы. Появление сыпи на аминопенициллины не является IgE-зависимой реакцией, поэтому применение блокаторов Н1 гистаминовых рецепторов не имеет ни профилактического, ни лечебного эффекта [19].
По мнению ряда авторов до настоящего времени сохраняется эмпирический подход к назначению глюкокортикостероидов больным с ЭБВИ [23]. Глюкокортикостероиды (преднизолон, преднизон (Делтазон, Метикортен, Оразон, Ликвид Пред), Солу Кортеф (гидрокортизон), дексаметазон) рекомендуются больным с тяжелым течением ЭБВИМ, с обструкцией дыхательных путей, неврологическими и гематологическими осложнениями (тяжелая тромбоцитопения, гемолитическая анемия) [4, 24]. Суточная доза преднизолона составляет 60–80 мг в течение 3–5 дней (реже 7 дней) с последующей быстрой отменой препарата. Одинаковой точки зрения на назначение этим больным глюкокортикостероидов при развитии миокардита, перикардита и поражениях ЦНС нет.
При тяжелом течении ЭБВИМ показана внутривенная дезинтоксикационная терапия, при разрыве селезенки — хирургическое лечение.
Наиболее дискуссионным остается вопрос о назначении противовирусной терапии больным с ЭБВИ. В настоящее время известен большой перечень препаратов, являющихся ингибиторами ВЭБ репликации в культуре клеток [4, 25–27].
I. Подавляющие активность ДНК-полимеразы ВЭБ:
- ациклические аналоги нуклеозидов (ацикловир, ганцикловир, пенцикловир, валацикловир, валганцикловир, фамцикловир);
- ациклические аналоги нуклеотидов (цидофовир, адефовир);
- аналоги пирофосфатов (Фоскарнет (фоскавир), фосфоноацетиловая кислота);
- 4 оксо-дигидрохинолины (возможно).
II. Различные соединения, не ингибирующие вирусной ДНК-полимеразы (механизм изучается): марибавир, бета-L-5 урацил йододиоксолан, индолокарбазол.
Однако проведенный метаанализ пяти рандомизированных контролируемых испытаний с участием 339 больных ЭБВИМ, принимавших ацикловир (Зовиракс), показал неэффективность препарата [28, 29].
Одна из возможных причин кроется в цикле развития ВЭБ, в котором ДНК вируса имеет линейную либо циркулярную (эписома) структуру и размножается в ядре клетки хозяина. Активная репликация вируса происходит при продуктивной (литической) стадии инфекционного процесса (ДНК ВЭБ линейной формы). При острой ЭБВИ и активации хронической ЭБВИ происходит цитолитический цикл развития вируса, при котором он запускает экспрессию собственных ранних антигенов и активирует некоторые гены клеток макроорганизма, продукты которых участвуют в репликации ВЭБ. При латентной ЭБВИ ДНК вируса имеет вид эписомы (круговой суперспиральный геном), находящейся в ядре. Циркулярный геном ДНК ВЭБ характерен для CD21+ лимфоцитов, в которых даже при первичном инфицировании вирусом практически не наблюдается литической стадии инфекционного процесса, а ДНК воспроизводится в виде эписомы синхронно с клеточным делением инфицированных клеток. Гибель пораженных ВЭБ В лимфоцитов связана не с опосредованным вирусом цитолизом, а с действием цитотоксических лимфоцитов [4].
При назначении противовирусных препаратов при ЭБВИ врач должен помнить, что их клиническая эффективность зависит от правильной трактовки клинических проявлений болезни, стадии инфекционного процесса и цикла развития вируса на этой стадии. Однако не менее важным является и тот факт, что большинство симптомов ЭБВИ связаны не с прямым цитопатическим действием вируса в инфицированных тканях, а с опосредованным иммунопатологическим ответом ВЭБ-инфицированных В лимфоцитов, циркулирующих в крови и находящихся в клетках пораженных органов. Именно поэтому аналоги нуклеозидов (ацикловир, ганцикловир и др.) и ингибиторы полимеразы (Фоскарнет), подавляющие репликацию ВЭБ и уменьшающие содержание вируса в слюне (но не санирующие ее полностью [4], не оказывают клинического эффекта на тяжесть и продолжительность симптомов ЭБВИМ.
Показаниями для лечения ЭБВИМ противовирусными препаратами являются: тяжелое, осложненное течение болезни, необходимость профилактики ВЭБ-ассоциированной В-клеточной лимфопролиферации у иммунокомпрометированных пациентов, ВЭБ-ассоциированная лейкоплакия. Bannett N. J., Domachowske J. (2010) рекомендуют применять ацикловир (Зовиракс) внутрь в дозе 800 мг внутрь 5 раз в сутки в течение 10 дней (или 10 мг/кг каждые 8 часов в течение 7–10 дней). При поражениях нервной системы предпочтителен внутривенный способ введения препарата в дозе 30 мг/кг/сут 3 раза в сутки в течение 7–10 дней.
По мнению E. Gershburg, J. S. Pagano (2005), если под действием каких-либо факторов (например, иммуномодуляторов, при ВЭБ-ассоциированных злокачественных опухолях — применение лучевой терапии, гемцитабина, доксорубицина, аргинина бутирата и др.) удается перевести ДНК ВЭБ из эписомы в активную репликативную форму, т. е. активировать литический цикл вируса, то в этом случае можно ожидать клинический эффект от противовирусной терапии.
В комплексной терапии рекомендуется внутривенное введение иммуноглобулинов (Гаммар-П, Полигам, Сандоглобулин, Альфаглобин и др.) 400 мг/кг/сут, № 4–5.
В последние годы все чаще для лечения ЭБВИ стали применять рекомбинантные альфа-интерфероны (Интрон А, Роферон-А, Реаферон-ЕС) по 1 млн ME в/м в течение 5–7 дней или через день; при хронической активной ЭБВИ — 3 млн ME в/м 3 раза в неделю, курс 12–36 недель.
Медикаментозная коррекция астенического синдрома при хронической ЭБВИ включает назначение адаптогенов, высоких доз витаминов группы В, ноотропных препаратов, антидепрессантов, психостимуляторов, препаратов с прохолинергическим механизмом действия и корректоров клеточного метаболизма [30–32].
Залогом успешного лечения больного с ЭБВИ являются комплексная терапия и строго индивидуальная тактика ведения как в стационаре, так и во время диспансерного наблюдения.
Литература
И. В. Шестакова, доктор медицинских наук, доцент
Н. Д. Ющук, доктор медицинских наук, профессор, академик РАМН
МГМСУ, Москва
Читайте также:

