Что такое эндометрит и кишечная палочка
Обновлено: 25.04.2024
Для цитирования: Шульпекова Ю.О. Избыточный бактериальный рост в кишечнике: патогенетические особенности и лечебные подходы. РМЖ. 2003;5:281.
ММА имени И.М. Сеченова
Основная часть микроорганизмов поступает в просвет желудочно–кишечного тракта из ротоглотки и с пищей.
В составе нормальной микрофлоры желудочно–кишечного тракта выделено более 400 видов непатогенных аэробных и факультативно анаэробных бактерий.
Состав микрофлоры неодинаков на всем протяжении желудочно–кишечного тракта. В верхнем и среднем отделах тонкой кишки популяция микроорганизмов сравнительно небольшая (в начале тощей кишки их содержание не более 100 микроорганизмов на 1 мл содержимого) и включает преимущественно грамположительные факультативные аэробы, небольшое количество анаэробов, дрожжей и грибов.
По мере приближения к илеоцекальному клапану состав микролоры начинает все более походить на популяцию толстой кишки. В дистальном отделе подвздошной кишки содержание микробов составляет 10 5 –10 8 /г кишечного содержимого.
Наибольшее содержание микроорганизмов наблюдается в толстой кишке. Здесь их концентрация достигает 10 10 –10 11 и более на 1 г содержимого.
Микробная популяция играет важнейшую роль во внутрипросветном пищеварении, в частности, участвует в переваривании пищевых волокон (целлюлозы), ферментативном расщеплении белков, высокомолекулярных углеводов, жиров и в процессе метаболизма вырабатывает ряд полезных для организма веществ.
Главный представитель анаэробной кишечной микрофлоры – бифидобактерии – синтезируют аминокислоты, белки, витамины В1, В2, В6, В12, викасол, никотиновую и фолиевую кислоты. Выдвинуто предположение, что некоторые вещества, вырабатываемые бифидобактериями, обладают антиоксидантными свойствами и способствуют снижению риска заболеваемости раком толстой кишки.
Среди аэробных микроорганизмов важнейшая роль в метаболических процессах принадлежит кишечной палочке, обладающей большим спектром функциональных свойств. E.coli вырабатывает несколько витаминов (тиамин, рибофлавин, пиридоксин, витамины В12, К, никотиновую, фолиевую, пантотеновую кислоты), участвует в обмене холестерина, билирубина, холина, желчных и жирных кислот, и, опосредованно влияет на всасывание железа и кальция.
Образующиеся под влиянием микрофоры продукты метаболизма белка (индол, фенол, скатол) оказывают регулирующее воздействие на перистальтическую активность кишечника.
В последнее время интенсивно изучается роль кишечной микрофлоры в формировании иммунологической реактивности и иммунологической толерантности организма.
Представители нормальной кишечной микрофлоры вырабатывают вещества с антибактериальной активностью (такие как бактериокины и короткоцепочечные жирные кислоты, лактоферрин, лизоцим), которые предотвращают внедрение патогенных микроорганизмов и подавляют избыточное размножение условно–патогенной флоры. Кишечные палочки, энтерококки, бифидобактерии и лактобациллы обладают наиболее выраженными антагонистическими свойствами в отношении патогенных штаммов.
Продуктами метаболизма молочнокислых бактерий (бифидобактерий, лактобацилл) и бактероидов являются молочная, уксусная, янтарная, муравьиная кислоты. Это обеспечивает поддержание показателя рН внутрикишечного содержимого на уровне 4,0–3,8, благодаря чему тормозится рост и размножение патогенных и гнилостных микроорганизмов в ЖКТ.
Микрофлора желудочно–кишечного тракта активно участвует в химических превращениях многих веществ эндогенного и экзогенного происхождения, в частности, лекарств. В процессе кишечно–печеночной циркуляции вещества, поступающие из просвета кишечника в печень, подвергаются конъюгации с глюкуронатом, сульфатом и другими молекулярными остатками, и многие из них затем вновь выделяются с желчью. В просвете кишечника под действием ферментов кишечной микрофлоры они подвергаются деконъюгации и другим изменениям, после чего вновь всасываются и возвращаются в печень по воротной вене.
Количественный и качественный состав кишечной микрофлоры может изменяться под воздействием различных факторов эндогенного или экзогенного происхождения. Однако это изменение следует рассматривать как вторичное по отношению к первопричинному фактору.
Избыточный бактериальный рост в кишечнике (в англоязычной литературе – bacterial overgrowth) – обусловлен нарушением качественного и количественного состава микробного биоценоза кишечника, размножением условно–патогенных бактерий в количестве, не свойственном здоровому человеку. Нельзя забывать, что избыточный бактериальный рост в кишечнике и связанные с ним клинические проявления представляет собой не самостоятельную нозологическую форму, а синдром.
Фоном для развития синдрома избыточного бактериального роста служат различные состояния, сопровождающиеся нарушением переваривания пищи, пассажа внутрипросветного содержимого; изменением иммунологической реактивности организма, ятрогенные воздействия на микрофлору кишечника.
При различных состояниях, сопровождающихся нарушением переваривания и всасывания пищи (врожденный дефицит ферментов, панкреатит, глютеновая энтеропатия, энтериты), невсосавшиеся питательные вещества служат питательной средой для избыточного размножения бактерий.
При анацидных состояниях и иммунодефицитах утрачивается регулирующее влияние со стороны организма на поддержание состава кишечной микрофлоры.
Применение антибиотиков, кортикостероидов, цитостатиков, особенно у ослабленных и пожилых пациентов, сопровождаются вмешательством во взаимоотношения микрофлоры и макроорганизма.
Пожалуй, в качестве единственной самостоятельной нозологической формы избыточного бактериального роста в кишечнике выступает псевдомембранозный колит, который обусловлен избыточным размножением Clostridium difficile – облигатно–анаэробной грамположительной спорообразующей бактерии, обладающей природной устойчивостью к большинству широко применяемых антибиотиков. Популяция C.difficile в составе нормальной микрофлоры кишечника составляет примерно 0,01–0,001%; она существенно возрастает (до 15–40%) при приеме антибиотиков, угнетающих рост штаммов кишечной флоры, которые в норме подавляют жизнедеятельность C.difficile (в первую очередь, клиндамицина, ампициллина, цефалоспоринов).
Избыточное размножение бактерий в тонкой кишке является дополнительным фактором, поддерживающим воспаление слизистой оболочки, снижающим продукцию ферментов (в наибольшей степени – лактазы) и усугубляющим нарушение переваривания и всасывания. Эти изменения обусловливают развитие таких симптомов, как коликообразные боли в околопупочной области, метеоризм, диарея, похудание.
При преимущественном вовлечении в процесс толстой кишки пациенты предъявляют жалобы на неоформленный стул, метеоризм, ноющие боли в животе.
Диагностика синдрома избыточного бактериального роста подразумевает анализ картины основного заболевания, с выявлением возможной причины нарушения микробного биоценоза кишечника. Проводится дополнительное обследование, которое может включать эндоскопическое, рентгенологическое исследование кишечника для выявления нарушений анатомического строения, оценки перистальтики желудочно–кишечного тракта; биопсию тонкой кишки – для установления диагноза энтерита, энтеропатии, диагностики ферментопатий (к сожалению, возможности проведения этого исследования в нашей стране ограничены) и др. Мало доступными на сегодняшний день, но точными методами диагностики избыточного бактериального роста являются аспирация содержимого тонкой кишки с немедленным посевом аспирата на питательную среду, а также неинвазивный дыхательный водородный тест с лактулозой. Посев кала, ранее использовавшийся в нашей стране как метод оценки микробного биоценоза кишечника, признан неинформативным, поскольку даже при максимальном приближении к правилам проведения микробиологических исследований может дать представление лишь о микробном составе дистального отдела толстой кишки.
Перед тем как непосредственно приступить к лечению синдрома избыточного бактериального роста, необходимо определить причину развития нарушений микробного биоценоза и, по возможности, устранить влияние данного фактора. Например, назначить пациенту противовоспалительную, заместительную ферментную терапию, использовать возможности по нормализации перистальтической активности кишечника.
Изменение характера питания позволяет воздействовать на микрофлору физиологическим путем. Однако диетические предписания необходимо давать с учетом основного заболевания. В любом случае, при избыточном бактериальном росте в кишечнике показано ограничение потребления легкоусвояемых углеводов и исключение потребления молока (особенно пресного). При отсутствии противопоказаний целесообразно потребление овощей, фруктов и ягод, обладающих бактерицидным действием (редька, редис, лук, чеснок, хрен, морковь, малина, клубника, земляника, черника, абрикосы, яблоки, черноплодная рябина, сок граната, гвоздика, корица, лавровый лист).
Однако при тяжелых формах избыточного бактериального роста в кишечнике показана антибактериальная терапия (назначение метронидазола по 400 мг 3 раза в день в течение недели; при неэффективности метронидазола к лечению целесообразно добавить тетрациклин по 250 мг 4 раза в день в течение 2 недель). Антибиотики резерва – ципрофлоксацин (по 500 мг 2 раза в день) и ванкомицин (по 125 мг 4 раза в день). Лечение псевдомембранозного колита проводится по определенным схемам и не рассматривается в данной статье вследствие обособленности этого заболевания.
В ряде случаев для подавления условно-патогенных микроорганизмов используются бактериофаги (стафилококковый и коли–протейный) по 50 мл 2 раза в день за час до еды в течение 3–4 дней, проводится 2–3 курса с 3–дневным перерывом.
Не менее важным и, зачастую, основным направлением лечения является воссоздание условий, благоприятных для восстановления нормальной микрофлоры. Лекарственные препараты, обладающие подобными свойствами, носят название пробиотиков.
Некоторое время назад в качестве пробиотиков особенно широко использовались биологические препараты для перорального приема, содержащие в своем составе бифидобактерии, лактобациллы, кишечные палочки с полезными сойствами. Необходимо учитывать, что микробы, вводимые в составе лекарственных препаратов, сами по себе надолго не приживаются в кишечнике и элиминируются спустя 2–3 недели. Основой лечебного действия подобных препаратов является их способность временно поддерживать ферментативную активность и защитные свойства (колициногенность) собственной микрофлоры кишечника. Ниже охарактеризованы некоторые из наиболее известных препаратов.
Благоприятные условия для размножения бифидобактерий создает дисахарид лактулоза, обладающий также слабительными и аммонийсвязывающими свойствами. Он служит питательной средой для размножения молочнокислых бактерий и источником выработки ими молочной кислоты, снижающей рН кишечного содержимого. К существенным недостаткам лактулозы относятся нередко развивающиеся вздутие живота и диарея с потерей электролитов (поэтому назначение лактулозы предпочтительно пациентам, страдающим запором). Лактулоза противопоказана при галактоземии. Доза сиропа лактулозы для взрослых варьирует от 15 до 45 мл в сутки (в 2–3 приема).
Начальная доза для взрослых составляет по 40–60 капель 3 раза в день; для детей – по 20–40 капель 3 раза в день; для детей грудного возраста – по 15–30 капель 3 раза в день. По мере клинического улучшения доза может быть уменьшена наполовину.
1. Вудли М., Уэлан А., ред. Терапевтический справочник Вашингтонского университета. Пер. с англ. – М.: Практика, 1995г.
2. Гребенев А.Л., Мягкова Л.П. Болезни кишечника. – М.: Медицина, 1994 г.
3. Денисов И.Н., Кулаков В.И., Хаитов Р.М., гл. ред. Клинические рекомендации для практикующих врачей, основанные на доказательной медицине. – М.: ГЭОТАР–МЕД, 2001г.
5. Котельников Г.П., Яковлев О.Г., ред. Практическая гериатрия: Руководство для врачей. – Самара: Самарский Дом печати, 1995г.
6. Fauci A.S., Braunwald E., Isselbacher K.J. et al., ed. Harrison’s Principles of Internal Medicine. 14th edition – Copyright (c) 1998 by The McGraw–Hill Companies, Inc., USA.
7. Herfindal Е.Т., Gourley D.R., ed. Textbook for therapeutics: drug and disease managment – 6th ed. – Copyright (c) 1996 Williams & Wilkins, Baltimore, USA.
Кафедра акушерства и гинекологии Пермского государственного медицинского университетаим. акад. Е.А. Вагнера Минздрава России, Пермь, Россия
Особенности влагалищной и кишечной микрофлоры у больных с хроническим эндометритом в контексте исследования клеточного иммунитета
Журнал: Российский вестник акушера-гинеколога. 2019;19(1): 80‑85
Кафедра акушерства и гинекологии Пермского государственного медицинского университетаим. акад. Е.А. Вагнера Минздрава России, Пермь, Россия
Научных данных о роли микрофлоры в физиологических и патологических процессах в репродуктивных органах женщины пока недостаточно. Многие исследования сфокусированы на взаимосвязи иммунитета, микробиома, фертильности и онкологической патологии у женщин. Хронический эндометрит — серьезная патология, приводящая к нарушению нормального функционирования эндометрия. Рост числа больных с хронической воспалительной патологией в анамнезе может быть связан с изменением общего микробиоценоза, местного и общего иммунитета. Цель исследования — анализ влагалищной и кишечной микрофлоры у больных с хроническим эндометритом в контексте исследования клеточного иммунитета. Материал и методы. Выполнено исследование клеточного иммунитета методом иммуноцитохимии с определением в крови лимфоцитов CD3, CD4, CD8, CD19, CD95 с использованием микроскопических, бактериологических методов; проведено исследование микрофлоры кишечника и влагалища. Результаты. У больных с хроническим эндометритом прослеживается сочетание высокой частоты заболеваний органов репродуктивной системы и желудочно-кишечного тракта с недостаточностью клеточно-эффекторного звена иммунитета. На фоне изменения микрофлоры кишечника (снижения количества бифидобактерий и лактобактерий) наблюдается значительное преобладание других представителей кишечной микрофлоры в половых путях. Заключение. Полученные результаты свидетельствуют о том, что является перспективным применение альтернативных средств для профилактики тяжелых инфекционных процессов в урогенитальном тракте у больных с сочетанием нескольких хронических воспалительных заболеваний, в частности, препарата, обладающего способностью блокировать механизм адгезии патогенных и условно-патогенных бактерий и восстанавливать нормальную микрофлору урогенитального тракта.
Кафедра акушерства и гинекологии Пермского государственного медицинского университетаим. акад. Е.А. Вагнера Минздрава России, Пермь, Россия
Повышение эффективности лечебно-профилактических мероприятий у женщин, страдающих хроническим воспалительным заболеванием матки, остается одним из приоритетных направлений в гинекологии. Хронический эндометрит — серьезная патология, приводящая к изменению экспрессии рецепторного аппарата и нарушению нормального функционирования эндометрия.
Высокая распространенность хронической воспалительной патологии разных органов и систем негативно влияет на резистентность организма, его репродуктивные возможности. Большое значение в сохранении здоровья человека имеет общий микробиоценоз, местный и общий иммунитеты. В настоящее время, по данным ВОЗ, особенностью воспалительных заболеваний органов малого таза стало преобладание в их этиологии анаэробных и аэробных микроорганизмов до 25—60% случаев условно-патогенной микрофлоры [1, 2], что тоже подчеркивает изменение реактивности и резистентности организма человека в условиях индустриализации, широкого использования антибиотиков, гормональных препаратов, современного образа жизни и т. д. Идею о том, что почти все представители влагалищной и кишечной микрофлоры способны стать этиологическим агентом воспаления, в настоящее время поддерживают многие исследователи [3—8].
Человеческий микробиом представляет собой совокупность микроорганизмов (которые обитают в человеческом теле), вместе взятых с учетом их геномов; наше понимание роли микробиома в репродуктивных процессах у человека пока не является исчерпывающим, физиологическая роль микробиома в настоящее время обсуждается. Разные представители бактериальной микрофлоры в этиологическом аспекте несколько лет назад даже не рассматривались как причина развития многих заболеваний, например, не упоминалось о роли в развитии колоректального рака Fusobacteria и Porphyromonas, роли микробиоты в развитии злокачественных заболеваний эндометрия [9, 10]. Научных данных о роли микрофлоры в физиологических и патологических процессах в репродуктивных органах женщины пока недостаточно, многие исследования сфокусированы на взаимосвязи иммунитета, микробиома, фертильности и онкологической патологии.
У здорового человека микробный пейзаж кишечника представлен облигатной микрофлорой, факультативными (условные патогены и сапрофиты) и транзиторными микроорганизмами. Кишечная микрофлора представляет собой один из огромных резервуаров микроорганизмов, оказывающих непосредственное влияние на здоровье человека через участие в работе иммунной системы, участие в метаболизме гормонов, образовании биологически активных веществ [11], витаминов группы B, C, K, выведении токсинов и продуктов распада из организма и т. д. До 10% энергии в организме человека образуется с помощью непосредственного участия микрофлоры кишечника [12, 13].
Не оспаривается взаимосвязь разных представителей человеческого микробиома между собой. Колонизацию половых органов кишечной микрофлорой рассматривают как причину многих заболеваний в гинекологии, в том числе и хронических воспалительных заболеваний органов малого таза. Предполагается, что чаще всего инфицирование происходит по восходящему пути. Физический барьер в виде слизистой оболочки шейки матки, высокие концентрации антимикробных пептидов и воспалительных цитокинов в шеечной слизи, наличие иммуноглобулинов или ферментов в шейке матки, как предполагается, должны обеспечивать защиту от бактериального восхождения, однако это происходит не всегда [14—20]. Соответственно рост числа больных с хронической воспалительной патологией в анамнезе свидетельствует о необходимости минимизировать лекарственную агрессию антибиотиками, если имеется возможность широко использовать альтернативные технологии в профилактике и лечении пациентов.
О количественном и качественном характере микрофлоры можно судить, применяя метод культивирования бактерий и технологию секвенирования, т. е. изучения нуклеотидных последовательностей микроорганизмов, однако в научной и практической работе использование культуральных методов пока не теряет своей актуальности.
Цель исследования — анализ влагалищной и кишечной микрофлоры у больных с хроническим эндометритом (ХЭ) в контексте исследования клеточного иммунитета.
Материал и методы
Было выполнено проспективное клиническое исследование, одобренное локальным этическим комитетом Пермского государственного медицинского университета им. акад. Е.А. Вагнера Минздрава России (протокол № 6 от 26.05.16), все пациентки подписали информированное добровольное согласие на участие в исследовании. Критериями исключения пациенток из исследования были следующие: обострение хронической воспалительной патологии и прием лекарственных препаратов (антибиотиков, препаратов, влияющих на иммунную систему), отсутствие овуляции, наличие инфекции, передающейся половым путем, прием прогестогенов и комбинированных гормональных препаратов.
Для обследования были выбраны 86 женщин фертильного возраста, среди которых 33 практически здоровые женщины, обратившиеся с целью подбора контрацептивных средств, составили контрольную группу (1-я группа). У них хронический эндометрит был исключен путем исследования биоптата эндометрия (пайпель-биопсии). Основную (2-ю группу) составили 53 пациентки, имевшие морфологически подтвержденный хронический эндометрит. В дальнейшем выполнено комплексное общее клиническое обследование пациенток на основании Приказа № 572-н от 01.11.2 [21], были проанализированы результаты лабораторных и микробиологического исследований.
Анализ клеточного иммунитета проводился методом иммуноцитохимии, выполнено определение в крови CD3 + , CD4 + , CD8 + , CD19 + , CD95 + , оценены индексы, отражающие соотношение разных лимфоцитов — CD3 + /CD4 + , CD3 + /CD8 + , CD3 + /CD95 + . CD Количественные параметры по группам представлены в виде медианы (Ме) и перцентильного интервала — 25-й перцентиль—75-й перцентиль (25—75), для сравнения групп и исследования связей использовались непараметрические методы (тест Манна—Уитни для сравнения двух независимых выборок). Для анализа взаимосвязей между показателями распространенности признака в группе использовали критерий χ 2 , результаты рассчитывали в виде оценки доли признака с 95% доверительным интервалом. Анализ межгрупповых различий по распространенности признаков также выполнен с применением критерия χ 2 , отношения рисков (ОР) с доверительным интервалом (ДИ) 95%.
Результаты и обсуждение

Средний возраст обследуемых составил 30,90±7,09 года. Обращали на себя внимание отягощенный анамнез и высокая частота заболеваний органов малого таза у больных с ХЭ по сравнению с пациентками контрольной группы, что отражено на рис. 1. Рис. 1. Особенности акушерско-гинекологического анамнеза в обследуемых группах. Статистически значимо чаще хроническую воспалительную патологию придатков матки имели пациентки с хроническим эндометритом — χ 2 =6,85; p=0,009; ОР=1,97; 95% ДИ 1,56—2,49, хроническим цервицитом — χ 2 =9,54; p=0,002; ОР=2,1; 95% ДИ 1,62—2,72, нарушением фертильности — χ 2 =15,71; pp

В группе больных с хроническим эндометритом статистически значимо чаще (χ 2 =28,99; p=0,001; ОШ=57,26, 95% ДИ 7,24—452,7) встречались функциональные нарушения кишечника (χ 2 =32,34; p=0,001; ОШ=67,76, 95% ДИ 8,53— 38,2). Сравнительный анализ лидирующей хронической соматической патологии у пациенток двух групп представлен на рис. 2. Рис. 2. Статистически значимо отличающаяся хроническая соматическая патология воспалительного генеза у пациенток разных групп.
Анализ содержания лимфоцитов CD3 + продемонстрировал, что больные 2-й группы (с ХЭ) в 67,9% наблюдений достоверно чаще имели снижение количества лимфоцитов по сравнению с этим показателем у пациенток 1-й группы (χ 2 =5,69; p=0,017; ОР = 1,917; 95% ДИ 1,53—2). Медиана значений лимфоцитов CD3 + в группе больных с ХЭ равнялась 65% (54—70%), в контрольной группе — 71% (69—73%); рр<0,05), что можно расценить как один из признаков недостаточности клеточного иммунитета у пациенток с хроническим эндометритом.
При анализе содержания лимфоцитов с фенотипом CD3 + /CD4 + выявлено уменьшение количества Т-лимфоцитов-хелперов только в группе больных с ХЭ — у 41,5±13,6% (22), χ 2 =8,82; p=0,003; ОР=2,06; 95% ДИ 1,6—2,66. Анализ абсолютных значений показал, что медиана в данной группе составила 0,74·10 9 /л (0,56—1,35), в контрольной группе — 1,12·10 9 /л (0,8—1,54); p=0,008, что также указывает на изменение реактивности организма у женщин с ХЭ.
При анализе содержания лимфоцитов с фенотипом CD3 + /CD8 + обнаружено, что в 30,2±12,6% (16) наблюдений отмечено снижение их количества у больных основной группы, в контрольной группе ни одного случая снижения не установлено (χ 2 =5,15; p=0,023; ОР=1,89; 95% ДИ 1,52—2,36), при этом значение Me у больных с ХЭ равнялось 19,5·10 9 /л (12—29,5) против 25·10 9 /л (22—31) (p=0,004) у пациенток 1-й группы.
Анализ содержания в периферической крови у обследуемых лимфоцитов-хелперов и супрессоров показал, что индекс CD4 + /CD8 + статистически между группами не отличался (p=0,947), но при этом по критерию χ 2 выявлено достоверно большее число больных со снижением данного индекса — 28,3±12,4% (15) наблюдений во 2-й группе и ни одного случая в контрольной группе (χ 2 =4,63; p=0,031; ОР=1,868; 95% ДИ 1,5—2,32).
Анализ В-клеток лимфоцитов в обследуемых группах показал, что имелась статистическая разница в количестве лимфоцитов CD19 + у пациенток основной группы; низкое содержание лимфоцитов CD19 + зафиксировано у 32,08±12,9% пациенток с ХЭ и у 6,06±2,46% в контрольной группе (p<0,001), χ 2 =6,56; p=0,010; ОР=1,66; 95% ДИ 1,27—2,1.
Особенностью результатов микроскопического исследования мазков из влагалища было то, что у больных основной группы имела место статистически значимая лейкоцитарная реакция с большим количеством эпителиоцитов — в 45,24% (25) наблюдений, степень чистоты мазков из влагалища была оценена как III и IV (χ 2 =30,15; p<0,001), в контрольной группе ни одного такого наблюдения не установлено.

Микробиологическое (бактериологическое) исследование микрофлоры цервикального канала у обследуемых пациенток показало, что прослеживаются три типа результатов: 1) в бактериальных посевах пациенток обнаружен рост только Lactobaccilus; 2) в бактериальных посевах женщин имеется рост микрофлоры, отличающейся от Lactobaccillus; 3) у пациенток рост микрофлоры не получен (рис. 3). Рис. 3. Сравнение результатов микробиологического исследования микроорганизмов из цервикального канала в обследуемых группах.
У больных с ХЭ прослеживалась достоверная связь между высокой частотой заболеваний желудочно-кишечного тракта и недостаточностью клеточно-эффекторного звена иммунитета, в частности, имелась положительная ассоциативная связь снижения содержания CD3 + /CD4 + и CD3 + /CD8 + с функциональными нарушениями кишечника (r=0,001, χ 2 =9,24; p<0,002) и наличием хронического холецистита в анамнезе (r=0,003, χ 2 =6,98; p<0,008), снижение количества CD19 + коррелировало с ростом грибов рода Candida albicans в кишечнике (r=0,001, χ 2 =20,69; p<0,001).
На фоне изменения микрофлоры кишечника и при значительном преобладании представителей кишечной микрофлоры в половых путях у пациенток с хроническим эндометритом перспективным направлением является применение альтернативных средств для профилактики тяжелых инфекционных процессов в урогенитальном тракте. С целью уменьшения нагрузки от антибиотикотерапии мы обратили внимание на антиадгезивные средства, в частности, на возможность применения в комплексной терапии у данной категории больных полисахаридов Комплекс 2QR, обладающих способностью блокировать механизм адгезии патогенных и условно-патогенных бактерий и восстанавливать нормальную микрофлору урогенитального тракта.
Комплекс 2QR полисахаридов с отрицательным зарядом был получен более 19 лет назад из паренхимы листьев растения Aloe barbadensis [25, 26] и используется в европейских станах. Гель на основе 2QR-комплекса (Мульти-Гин АктиГель) может быть рекомендован больным с измененной микрофлорой, а избирательный механизм действия на патогенные микроорганизмы и отсутствие воздействия на лактобактерии [27] позволяют его использовать как для лечения, так и для восстановления естественного баланса и кислой среды во влагалище, возможно сочетание данного средства с антибиотиками, гормональными препаратами.
Пациенткам с хроническим эндометритом в состав комплексной терапии был рекомендован гель Мульти-Гин АктиГель с целью восстановления нормальной микрофлоры по 1 дозе 2 раза в день во влагалище в течение 5 дней, в дальнейшем 1 раз каждые 3 дня, сразу после менструации — до 3 введений. Пациентки отметили хорошую переносимость рекомендуемого средства, комфортность, отсутствие патологических выделений из половых путей в течение 5 мес. Контрольное микроскопическое исследование продемонстрировало нормализацию влагалищных мазков и уровня pH у 41,5% (22) из 45,24% женщин, отсутствие статистически значимой лейкоцитарной реакции и восстановление физиологической функции тканей влагалища — количество эпителиоцитов нормализовалось.
Выводы
1. Результаты проведенного исследования показали наличие высокой частоты патологии как репродуктивной, так и соматической системы у больных с хроническим эндометритом.
2. Проведенные бактериологические и микроскопические исследования свидетельствуют о преобладании условно-патогенной и факультативной микрофлоры во влагалище при наличии признаков недостаточности клеточно-эффекторного звена иммунитета, снижения фагоцитоза у больных с хроническим эндометритом, что приобретает особую важность при определении лечебно-профилактической тактики.
3. Полученные результаты свидетельствуют о необходимости минимизации лекарственной агрессии в частности, антибиотикотерапии при лечении больных с хроническим эндометритом.

- бактерии — наиболее частый виновник эндометрита. Выделяются специфичные и неспецифичные возбудители: к первым относятся хламидии, уреаплазмы, бледная трепонема сифилиса, микобактерии туберкулеза, ко вторым — синегнойная и кишечная палочка, стрептококки, стафилококки;
- грибки: чаще заболевание вызывают так называемые актиномицеты на фоне сниженного иммунитета;
- определенные виды вирусов;
- зачастую к развитию болезни приводит столкновение сразу нескольких возбудителей.

Возбудители проникают в матку двумя путями: восходящим и нисходящим. В первом случае бактерии попадают в полость из влагалища через шейку матки. Нисходящий путь бывает гематогенным или лимфогенным: иными словами, если в организме уже запущен какой-то воспалительный процесс, возбудитель попадает в матку через кровь или лимфу.
На развитие и течение воспаления влияет ряд провоцирующих факторов:
- Механическое повреждение (травмы) слизистой: аборты, выскабливание дна матки, кесарево сечение, вагинальные обследования с введением гинекологических инструментов.
- При менструации отторгается поверхностный слой эндометрия и формируется раневая (уязвимая) поверхность. К развитию эндометрита приводит и незащищенный секс во время месячных: заражение проходит по восходящему пути.
- Снижение местного или общего иммунитета на фоне врожденного или приобретенного иммунодефицита: прием иммунодепрессантов, ВИЧ, гиповитаминоз, нарушения питания. В этом случае возможно как восходящее, так и нисходящее заражение.
Другие, не менее опасные факторы — появление в полости матки остатков плаценты после кесарева сечения или родов, а также наличие там децидуальной (отпадающей) ткани, сгустков крови, плодного яйца. Поэтому аборт (особенно в нестерильных условиях) и выскабливание могут привести к воспалению.
Симптомы эндометрита матки
Лейкоциты — клетки иммунной системы — вырабатывают медиаторы воспаления простагландины. Этот процесс проявляется в ряде симптомов:
- у пациенток наблюдается отек, так как повышается проницаемость стенок сосудов, и потому плазма крови выходит в межклеточное вещество;
- боль появляется из-за того, что простагландины раздражают чувствительные нервные окончания и сдавливают их вследствие отека;
- застой крови усиливается в области воспаления из-за сужения (спазма) венозных сосудов и ухудшения оттока крови. Внешне реакция проявляется в виде покраснения воспаленного участка;
- в попытках защититься организм вырабатывает антитела и увеличивает активность лейкоцитов, из-за чего поднимается температура. Подъем только на 0,1° С может усилить активность нашего иммунитета в 10 раз.
При эндометрите проявляется острое либо хроническое воспаления: первое характеризуется яркой симптоматикой, второе нередко протекает бессимптомно. Острый воспалительный процесс чаще связан с воздействием сразу нескольких микроорганизмов. Реже слизистая оболочка поражается изолированно: обычно воспаляется мышечная оболочка матки наравне с развитием миоэндометрита.
При остром эндометрите симптомы проявляются на 3-4 день: повышается температура, наблюдается слабость, головная боль и боль внизу живота, гнойные и (или) кровянистые выделения. Острая стадия длится от 8 до 10 дней и полностью проходит при правильном и своевременном лечении. Если же этого не произошло, острая форма может перетечь в хроническую.
Хронический эндометрит легко не заметить: часто женщины узнают о заболевании только на приеме у гинеколога или при планировании беременности. Наиболее яркий симптом заболевания — нарушение менструального цикла. Температура у пациенток обычно нормальная, иногда бывают ноющие боли в пояснице и внизу живота. Поэтому окончательный диагноз ставится только на основе гистологического исследования эндометрия.
При обсуждении репродуктологии важнее говорить о хроническом эндометрите (ХЭ). Острая патология замечается почти сразу и потому оперативно устраняется. А вот хроническая фаза требует долгого лечения в течение нескольких месяцев, ведь при такой форме заболевания эндометрий сильно видоизменяется, не может трансформироваться и обновляться.
Чаще всего болезнь проявляется у женщин от 26 до 35 лет. Национальный центр контроля заболеваемости сообщает, что каждый год в США регистрируют около 1 млн воспалительных заболеваний органов малого таза. В России такие диагнозы ставятся от 28 до 34 % пациенток гинекологии. При хроническом эндометрите часто развивается бесплодие или привычное невынашивание беременности: до 65 % и до 70 % случаев соответственно. Плодное яйцо не может прикрепиться к измененному эндометрию, из-за чего беременность не наступает или протекает неудачно.
Клинические проявления хронического эндометрита таковы:
- аномальные маточные кровотечения и выделения из половых путей;
- синдром тазовых болей;
- диспареуния (болезненный половой акт);
- бесплодие и/или неудачные ЭКО, привычное невынашивание беременности;
- преждевременные роды.
Однако единого мнения насчет клинической картины хронического эндометрита не существует. Даже при явных симптомах невозможно понять, какова глубина функциональных и структурных изменений эндометрия.

Лечение эндометрита у женщин разного возраста
Симптомы и лечение эндометрита у женщин мало связаны с возрастом. После 40 лет острый эндометрит обычно проявляется более ярко: на это влияют изменения гормонального фона из-за предстоящего климакса. Переход острой формы в хроническую в этом возрасте происходит намного быстрее, однако формат лечения в 25 и 45 лет не различается.
Борьба с заболеванием — сложная, но важная задача, особенно у женщин, переживших выкидыш или неудачное ЭКО. Чтобы поставить точный диагноз и подобрать индивидуальное лечение, врачи МЦРМ собирают детальный анамнез. Необходимо выяснить информацию о менструальной функции, течении и исходе беременностей, абортах и выкидышах. Это позволит верно диагностировать патологию и подготовить эндометрий к беременности с помощью специально подобранных препаратов.
В комплексное лечение входят антибиотики широкого спектра с высокой способностью проникновения в клетку, а также (в зависимости от вида возбудителя) противогрибковые (антимикотики) и противовирусные препараты, местные комбинированные лекарства, системная энзимотерапия (применение ферментов) и физиотерапия в момент реабилитации. Для профилактики кандидоза на фоне антибиотиков назначаются противогрибковые препараты.
Следующий этап — гормональная терапия: комбинированные оральные контрацептивы. Во вторую фазу цикла при планировании беременности врач назначает прогестерон. Лечение начинается с первого дня менструации.
Перед назначением препаратов в нашей клинике проходит комплексная диагностика:
- ультразвуковое исследование органов малого таза;
- гистероскопия — осмотр внутренней оболочки матки (в сочетании с лапароскопией или изолированно);
- исследование эндометрия (получение материала во время гистероскопии, раздельного диагностического выскабливания или аспирационной биопсии);
- иммуногистохимическое и микробиологическое исследование эндометрия;
- ПЦР (фемофлор-скрининг): метод выявит патогенную микрофлору и причины развития воспалительного процесса.
После диагностики мы подбираем индивидуальное лечение. На первом этапе необходимо уничтожить инфекционного агента, на втором — восстановить функционал эндометрия: благодаря лечению устраняются повреждения, завершается регенерация, восстанавливается локальная гемодинамика (движение крови в сосудах) и активность рецепторов эндометрия.
В стенах клиники мы много лет разрабатывали схемы, которые помогают наиболее эффективно бороться с заболеванием. Прежде всего на весь период лечения (два-три менструальных цикла) прописываются следующие препараты:
- Монофазные комбинированные оральные контрацептивы (Ярина, Джес, Жанин, Фемоден и др.).
- Витаминотерапия: Фемибион, Ангиовит или Элевит (одна капсула в сутки).
- Иммунотерапия: Вобэнзим — три капсулы три раза в день за 30 минут до приема пищи.
Препараты в первый месяц лечения:
1. При обнаружении патогена по результатам фемофлор-скриннинга с первого дня менструального цикла назначается антибактериальная либо противовирусная терапия — в зависимости от вида возбудителя. Если в результате фемофлор-скрининга патоген не найден, антибиотики пить не нужно!
2. Также важна поддержка нормальной флоры желудочно-кишечного тракта и влагалища, поэтому:
- первый и последний дни приема антибиотиков назначается Дифлюкан: 150 мг перорально.
- Препараты, регулирующие равновесие кишечной микрофлоры, на выбор:
- Бифиформ — одна капсула 3 раза в день во время еды в течение трех недель,
- Аципол — две капсулы 3 раза в день на протяжении трех недель,
- Энтерол — по одной капсуле 2 раза в сутки 10 дней.
- Лактожиналь — по одной свече во влагалище на ночь в течение двух недель;
- Лактагель — по одному тюбику во влагалище на протяжении двух недель;
- Вагинорм-С — одна вагинальная капсула в течение 12 дней.
Препараты во второй месяц лечения:
1. Активная иммунотерапия: 10 дней после менструации принимается Генферон — 250 тыс. ед. два раза в сутки интравагинально.
2. Препараты, которые активируют обмен веществ в тканях, улучшают трофику (питание клеток) и стимулируют процесс регенерации: Актовегин — одно драже 3 раза в сутки перед приемом пищи на протяжении 30 дней.
3. Физиотерапевтические методы благоприятно влияют на пораженные ткани, помогают снять воспалительные процессы, улучшить состояние сосудов и эндометрия.
Хронический эндометрит и беременность
Как уже было сказано ранее, при хроническом эндометрите часто наблюдается бесплодие или привычное невынашивание беременности. Необходимо, чтобы слой эндометрия постоянно регенерировался: только тогда зародыш будет успешно имплантирован в матку. При хроническом эндометрите регенерация невозможна из-за воспалительного процесса, поэтому плодное яйцо не может закрепиться на эндометрии.
Даже если это происходит, беременность редко оказывается успешной: риск выкидыша сохранится на протяжении вынашивания. Такую беременность сопровождают нарушения и осложнения: в частности, возбудители заболевания могут поразить ткани плода, что приведет к его гибели.
Нарушение развития эмбриона — еще одно возможное последствие беременности при эндометрите. Поврежденному эндометрию не хватает поступления крови из-за застоя: ткань не получает кислород, витамины, питательные вещества и не передает их эмбриону. Из-за этого ребенок может родиться с патологиями. Кроме того в несколько раз повышается вероятность рождения раньше срока, может нарушиться формирование плаценты, так что при планировании беременности следует немедленно начать лечение этого заболевания.
В общей сложности выкидыши и бесплодие из-за хронического эндометрита связаны сразу с несколькими причинами:
- Нарушение морфологии эндометрия, из-за чего оплодотворенная яйцеклетка не закрепляется в матке и выходит вместе с выделениями — в таком случае женщина может даже не знать, что была беременна.
- Проблемы с синтезом прогестерона: этот гормон поддерживает состояние беременности, утолщая эндометрий и подготавливая слизистую матки. При хроническом эндометрите прогестерон вырабатывается слабо, а беременность прерывается на раннем сроке.
- Мужские сперматозоиды инактивируются уже при зачатии. При воспалении фагоцитарные клетки организма уничтожают чужеродные тела, за которые принимают и сперматозоиды.
Поэтому перед планированием беременности необходимо пройти полный курс лечения от эндометрита: в таком случае вероятность забеременеть может возрасти до 100 %. В случае с ЭКО основная проблема связана именно с закреплением половых клеток в матке, поэтому для эффективности стоит сделать несколько попыток подсадить оплодотворенную яйцеклетку. Помимо приема препаратов необходимо поберечь себя: постараться исключить стрессы, ограничить физическую нагрузку и не поднимать тяжести.
Что такое эндометрит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Делеске И. А., гинеколога со стажем в 9 лет.
Над статьей доктора Делеске И. А. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина
![Делеске Инна Александровна, гинеколог, гинеколог-эндокринолог - Волгоград]()
Определение болезни. Причины заболевания
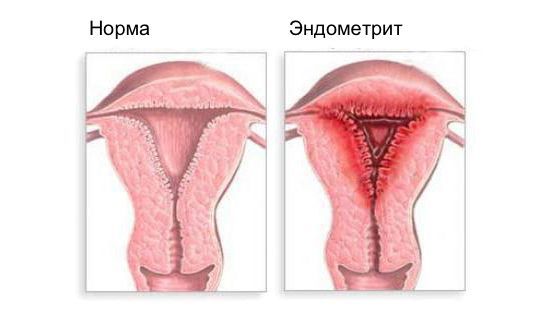
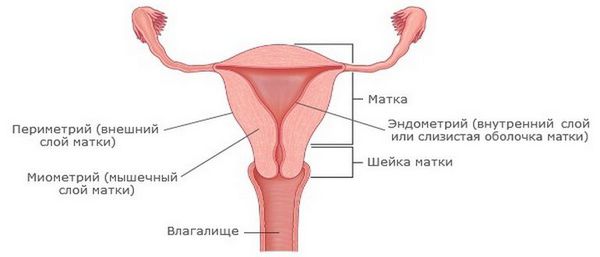
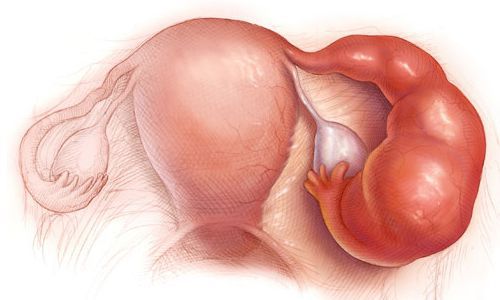
Эндометрит — это воспаление внутреннего слоя матки (эндометрия), которое приводит к изменению его функций. Возникает в результате заражения этой области микробами, вирусами и грибковыми инфекциями.
Эндометрит — одно из наиболее распространенных гинекологических заболеваний. По данным зарубежных источников, распространенность эндометрита составляет 20% в популяции, отечественные авторы указывают до 60-70%, чаще всего болеют женщины репродуктивного возраста [9] [11] . Стабильный рост заболеваемости отмечается последние 20-30 лет [1] [10] . Часто встречается в сочетании с ранним началом половой жизни, отсутствием контрацепции, абортами, наличием хронических воспалительных заболеваний нижнего отдела репродуктивного тракта. [7] [8] .
![Эндометрит и норма]()
Эндометрит часто является причиной бесплодия, привычного невынашивания (два и более выкидыша в анамнезе), нарушения менструального цикла, осложнений беременности, родов и послеродового периода, неудачных попыток ЭКО, гиперпластических заболеваний эндометрия и сексуальных проблем [1] .
Чем эндометрит отличается от эндометриоза
Эндометриоз — это разрастание эндометриоидной ткани. Эндометриоз может поражать полость матки, её оболочки, маточные трубы, яичники, брюшину и области вне половых органов. Эндометритом же называют воспаление внутреннего слоя матки.
Причины эндометрита
В женском репродуктивном тракте присутствуют различные микроорганизмы, среди которых преобладают Lactobacillus spp. Эндометрит чаще ассоциирован с чрезмерным размножением бактерий Enterobacter, Enterococcus, Streptococcus, Staphylococcus, Ureaplasma, Mycoplasma.
Эндометрит вызывают также вирусные инфекционные агенты: вирус герпеса, цитомегаловирус, вирус папилломы человека, энтеровирусы и аденовирусы.
Возможен эндометрит специфической этиологии: гонорейный, туберкулезный, актиномикотический (грибковая инфекция) и неспецифический. [8] [7] [10] .
Риск развития эндометрита увеличивают:
- манипуляции в полости матки — аборты, выскабливания, метросальпингография (контрастное рентгенологическое исследование полости матки и проходимости фаллопиевых труб), введение внутриматочного контрацептива, инсеминация (введение спермы), ЭКО;
- заболевания мочевыделительной системы;
- операции на органах малого таза;
- послеродовые гнойно-воспалительные осложнения;
- другие гинекологические заболевания (хронический сальпингоофорит, цервицит, гиперплазия эндометрия, полип эндометрия);
- частая смена половых партнеров;
- незащищенные половые связи;
- предшествующие прерывания беременности;
- кесарево сечение до 28 недель гестации;
- длительный безводный период в родах;
- ручное отделение плаценты;
- инвазивные исследования для пренатальной диагностики;
- длительное ношение внутриматочного контрацептива.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы эндометрита
Воспаление может протекать в острой и хронической форме. Чаще всего симптомы эндометрита появляются на четвёртый день после инфицирования. При острой форме эндометрита отмечаются общие симптомы воспаления, такие как слабость, быстрая утомляемость, повышение температуры тела, изменения в общем анализе крови (сдвиг лейкоцитарной формулы влево и повышение СОЭ).
К локальным симптомам острого эндометрита можно отнести:
- периодические умеренные или острые тянущие боли внизу живота, иногда отдающие вниз спины и в пах;
- жидкие гноевидные выделения из половых путей с неприятным запахом (возможно с примесью крови);
- диспареуния (боль при половом акте).
При отсутствии правильного и своевременного лечения эндометрита в течении 10 дней возможен переход в хронический воспалительный процесс. При этом держится повышенная температура, появляются новые симптомы:
- нарушение менструального цикла, мажущие кровянистые выделения в середине цикла;
- привычное невынашивание беременности;
- серозно-гнойные выделения из половых путей;
- ноющие боли внизу живота;
- боль во время секса [3][5][8] .
Течение острого послеродового эндометрита более тяжёлое, проявляется в следующих симптомах:
![Лохии]()
Эндометрит при беременности
Эндометрит препятствует имплантации плодного яйца, из-за чего оно может отторгнуться полностью или возникнет нарушение процессов имплантации. В дальнейшем это может привести к выкидышу или замершей беременности.
Если воспалительный процесс усиливается, может развиться хориоамнионит — воспаление плаценты, которое приводит к разрыву плодных оболочек, излитию околоплодных вод и преждевременным родам.
Чтобы избежать возможных осложнений, женщинам с хроническим эндометритом при планировании беременности необходимо пройти комплексное лечение.
Патогенез эндометрита
На начальном этапе воспаления инфекционный агент (бактерии, вирусы или грибки) внедряется в слизистую оболочку матки. Начинается выработка медиаторов воспаления, которая приводит к нарушению микроциркуляции крови в его очаге. Миграция лейкоцитов в зону повреждения, активация нейтрафилов и макрофагов ведёт к активной выработке цитокинов и перекиси водорода, запуску перекисного окисления липидов с повреждением мембран клеток. В это время на фоне повышенной выработки цитокинов и факторов роста происходит деградация матрикса клеток. Нарушение микроциркуляции крови приводит к развитию локальной ишемии и гипоксии ткани, которые затем активируют процессы склерозирования. При длительной стимуляции иммунной системы происходит её истощение и появление аутоиммунных реакций.
В 95% случаев эндометрит является первичным — патогенные микроорганизмы попадают в полость матки восходящим путём, при половом контакте или гинекологических манипуляциях . В 5% случае эндометрит носит вторичный характер: инфекция попадает в эндометрий гематогенным путем, либо же лимфогенным или нисходящим путём (с верхних отделов репродуктивного тракта).
При длительности воспалительного процесса более 2 месяцев можно расценивать его как хронический процесс. Развиваются изменения в структуре и функции ткани, происходит нарушение пролиферации (деления клеток) и физиологической циклической трансформации эндометрия. В связи с этим возможно нарушение нормальной имплантации эмбриона при беременности.
Существует аутоиммунная теория патогенезе хронического эндометрита. Она говорит о том, что при длительном воздействии инфекционного агента на иммунную систему происходит вторичное повреждение эндометрия. При этом нарушается процесс апоптоза (запрограммированной гибели клетки) [11] .
Классификация и стадии развития эндометрита
Эндометрит можно разделить на острую и хроническую форму.
Острый эндометрит возникает при абортах, диагностических манипуляциях, выскабливании, развивается быстро, воспаление сопровождается острыми или ноющими болями и повышением температуры. Наиболее частый путь инфекции при нём — восходящий. Распространение инфекции из влагалища в верхние отделы репродуктивного тракта происходит при несостоятельности барьера шейки матки. Воспаление может локализоваться в эндометрии, а также переходить на миометрий. При несвоевременном и неполноценном лечении возможно развитие пельвиоперитонита (воспаление оболочки брюшины в области малого таза).
Отдельно выделяется острый послеродовый эндометрит — начинается на 2-4 сутки после родов, ему может предшествовать хориоамнионит (инфицирование оболочек плода и жидкости).
![Строение матки]()
При хроническом эндометрите симптоматика сглажена. Характерны периодические обострения и рецидивы после переохлаждения и воспаления другой локализации урогенитального тракта.
По клиническим проявлениям эндометрит подразделяется на клиничеcки выраженную и субклиническую форму.
По характеру воспалительного процесса эндометрит можно разделить на:
- Катаральную форму (поражение поверхностных слоев слизистой оболочки матки и выделение слизистого экссудата).
- Катарально-гнойную форму.
- Гнойную форму.
- Некротическую форму.
- Гангренозную форму.
По морфологическим признакам:
- Атрофический эндометрит — наблюдается атрофия желез эндометрия, фиброз стромы, инфильтрация лимфоидными элементами;
- Кистозный эндометрит — сдавление протоков желез фиброзной тканью, образование кистозных элементов в эндометрии;
- Гипертрофический эндометрит — характеризуется гипертрофией желез эндометрия в результате хронического воспаления [5] .
Осложнения эндометрита
Осложнения у эндометрита могут быть достаточно серьёзными.
Метротромбофлебит (тромбоз тазовых вен) развивается через 2-3 недели от начала заболевания эндометритом. Пациентки отмечают общие симптомы воспаления, сохраняющуюся повышенную температуру тела, тянущие или острые боли внизу живота, выделения из половых путей [1] [2] .
Параметрит — воспаление околоматочной клетчатки. После внедрения инфекционного возбудителя в параметрий возможно образование диффузного воспалительного инфильтрата. При отсутствии лечения происходит нагноение и переход в хроническое течение. При переходе на всю клетчатку развивается пельвиоцеллюлит (воспаление клетчатчки малого таза) [2] [9] [10] .
![Параметрит]()
Пельвиоперитонит — воспаление выходит за пределы матки, в процесс вовлекаются листки брюшины. Пациентки отмечают резкое повышение температуры, симптомы интоксикации, тошноту, рвоту, интенсивные боли внизу живота (основная локализация ниже пупка), симптом раздражения брюшины ( резкое усиление боли в животе при быстром надавливании и снятии руки).
Сальпингоофорит — воспалительный процесс в маточных трубах и яичнике. Наиболее частые осложнения при несвоевременном лечении: пиовар (гнойное воспаление яичника) и туюоовар (формирование единого гнойного конгламерата из воспаленного яичника и маточной трубы). Все вышеперечисленные осложнения требуют оперативного лечения [2] [9] [10] .
![Сальпингоофорит]()
Другими осложнениями могут быть бесплодие, нарушение менструального цикла, выкидыши, внематочная беременность, спаечный процесс в малом тазу [1] [2] [3] .
В некоторых случаях возникает септический шок — угрожающее жизни осложнение, в условиях которого критически нарушается кровоснабжение тканей и клеточный метаболизм. Главные симптомы сепсиса — высокие показатели температуры тела, симптомы интоксикации, снижение давления и тахикардия, изменения в общих анализах крови, обильное потоотделение, спутанность сознания [8] [9] .
Диагностика эндометрита
Диагностика хронического эндометрита должна быть основана на комплексном подходе анализа жалоб пациентки, анамнеза, симптомов, результатов эхографических исследований, лабораторной диагностики, данных морфологического исследования эндометрия и иммунного статуса.
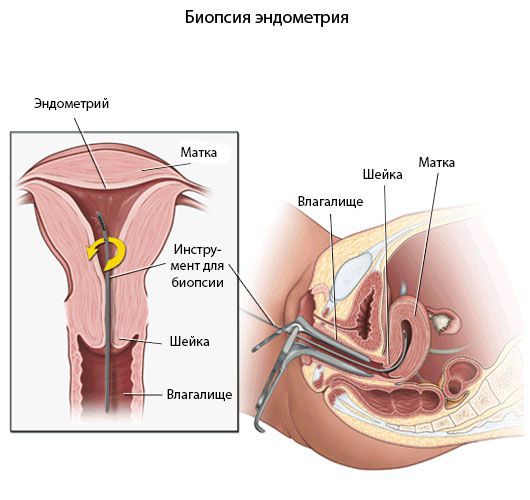
Пайпель-биопсия эндометрия
Хронический эндометрит диагностируют прежде всего с помощью морфологического исследования [8] .
Гистологический материал получают при выскабливании стенок полости матки под контролем гистероскопа или пайпель-биопсии. Пайпель-биопсия — это получение гистологического материала с помощью тонких канюль при аспирации (удалении) эндометрия. Данный метод имеет большую диагностическую ценность в амбулаторных условиях.
![Пайпель-биопсия]()
Критериями хронического эндометрита является наличие очаговых или диффузных лимфоидных инфильтратов, склероз стенок спиральных артерий, фиброз стромы и наличие плазматических клеток. При этом к абсолютным признакам хронического эндометрита относят плазматические клетки.
Микробиологическое исследование
Микробиологические посевы используются для выявления возбудителя воспалительного процесса.
Иммуногистохимическое исследование
Иммуногистохимическое исследование при эндометрите заключается в исследовании биоптата слизистой оболочки матки с целью определения мембранного белка, который является маркером плазматических клеток. Информативность гистологического исследования при этом возрастает до 85-90%, можно установить и иммунный характер повреждения эндометрия [5] [7] [8] .
УЗИ при эндометрите
При эхографии (УЗИ) хронический эндометрит определяют по:
- изменениям в структуре эндометрия;
- участкам повышенной эхогенности различной формы и величины в зоне М-Эхо;
- наличию сниженной эхогенности в эндометрии;
- наличию жидкости в полости матки;
- присутствию мелких кальцинатов 1-3 мм в эндометрии;
- участкам фиброза в эндометрии разной степени;
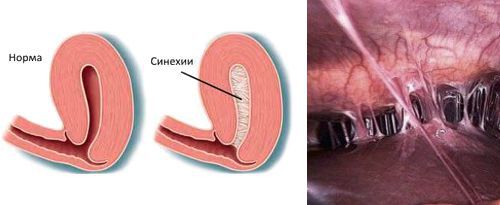
- наличию внутриматочных синехий.
![Внутриматочные синехии]()
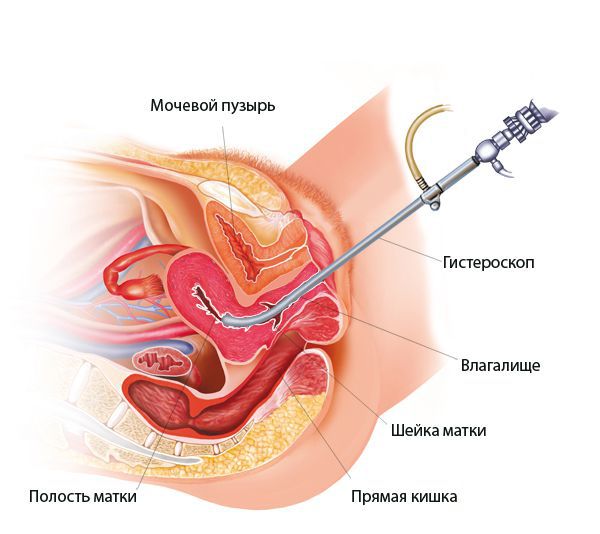
Гистероскопия при эндометрите
При гистероскопии определяются следующие признаки хронического эндометрита: гиперемия слизистой оболочки матки, неровномерная толщина эндометрия, полипообразные образования, кровоизлияния, очаговая гиперплазия эндометрия.
![Гистероскопия]()
Лечение эндометрита
Лечение эндометрита на первом этапе заключается в устранении бактериального или грибкового возбудителя, а для эндометрита вирусной этиологии — снижении вирусной нагрузки [7] . Для этого проводят комплексное лечение, включающее в себя антибактериальную терапию, анаэробные средства, противовоспалительные и противовирусные лекарственные средства [5] [6] [8] .
Второй этап заключается в восстановлении рецептивности эндометрия и его функциональности. Успешное восстановление рецепторного аппарата эндометрия должно происходить без снижения пролиферации (размножения, разрастания) клеток. Устраняются последствия ишемии, склеротические процессы, восстановливается отток крови. Длительность и объёмы терапии зависят от тяжести воспалительного процесса и сопутствующей гинекологической патологии. После проведения основных этапов лечения необходим курс реабилитации (физио-терапевтическое лечение) [7] [8] [10] .
Иммуностимулирующую терапию применяют при комплексном лечении хронического эндометрита, если выявлена вирусная инфекция: вирус папилломы человека, герпеса, Эпштейна — Барр, цитомегаловирус.
Гормональную терапию используют для подготовки эндометрия, чаще всего перед ЭКО. Для применения гормональных препаратов необходимо гистологическое подтверждение патологии эндометрия.
Контрольные критерии эффективности терапии хронического эндометрита:
- допплерометрическое исследование сосудов матки с ЦДК во 2 фазу менструального цикла;
- определение ангиогенных факторов;
- клиническое улучшение.
Рекомендации по диагностике и лечении эффективны лишь у половины больных, а частота рецидивов остается на уровне 25 % [13] .
Прогноз. Профилактика
При своевременном и полноценном лечении прогноз благоприятный. Пациентки отмечают улучшение состояния в течении двух суток. При запоздалом лечении эндометрита возможно развитие септического шока.
Читайте также: