Что такое гематогенный занос инфекции
Обновлено: 12.05.2024
Гематогенные формы менингита. Механизмы возникновения гематогенного менингита
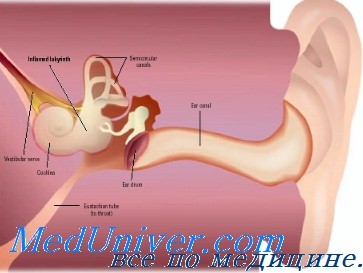
Гематогенная форма менингита обычно наблюдается тогда, когда инфекция переходит на мозговые оболочки по сосудам. Менингит возникает благодаря заносу бактерий и их токсинов в мозговые оболочки или вследствие поражения сосудов, соединяющих среднее ухо с твердой мозговой оболочкой.
Субстратом гематогенного пути являются мелкие костные вены сосцевидного отростка, а также капилляры (система гаверсовых сосудов) костной капсулы лабиринта, которые анастомозируют с сосудами среднего уха (Л. Н. Ямпольский).
Штейрер (Stcurer) большое значение в этом отношении также приписывает сосудистым связям, существующим между клетками сосцевидного отростка и твердой мозговой оболочкой, т. е. костным венам. Кроме того, инфекция из среднего уха может попасть в полость черепа по сосудистым тяжам, имеющимся на крыше барабанной полости.
Гематогенные формы менингита наблюдаются преимущественно при острых средних отитах. Они возникают в результате тромбоза вен, соединяющих среднее ухо с мозговыми оболочками. Менингит может также возникнуть при отогенном сепсисе или при другом гнойном процессе, который сопровождается генерализацией инфекции по организму. Известный интерес в этом отношении заслуживает описание случая менингита, опубликованное Маутнером (Mauthner). У больного, страдавшего острым средним гнойным отитом, почти в одно и то же время развились субдиафрагмальный абсцесс и гнойный менингит.
Автор считает, что менингит в данном случае развился метастатически. Подтверждением этому служит то, что в гнойных выделениях из среднего уха и абсцесса был обнаружен один и тот же вид стрептококка. Этот автор ссылается также на Руттина (Ruttin), приводящего историю болезни больного, у которого на почве острого среднего отита развился септический эндокардит и одновременно гнойный менингит. В литературе описано несколько случаев менингита с аналогичным патогенезом.
Гематогенная форма менингита отличается быстрым, нередко молниеносным развитием патологического процесса. Это объясняется тем, что инфекция быстро преодолевает защитные механизмы (слизистую оболочку, сосудистые стенки, твердую мозговую оболочку и т. п.) и попадает в полость черепа. Процесс сразу принимает диффузный характер. Гематогенные формы менингита наблюдаются, как уже сказано, при острых отитах, часто в их начальной стадии развития, т. е. в первые дни или даже часы. Иначе говоря, процесс развития менингита идет почти параллельно острому воспалительному процессу в ухе. Во время мастоидотомии кость в таких случаях оказывается макроскопически не измененной.
Нам кажется наиболее целесообразным деление отогенных менингитов на две формы: контактную и гематогенную. К первой относятся: а) случаи менингита, при которых патологический процесс переходит на мозговые оболочки непосредственно из кариозно измененной кости или из имеющегося уже в полости черепа гнойника (абсцесса мозга и т. д.); б) случаи, когда этот переход происходит по протяжению, например лабиринтогеyный менингит. Ко второй относится распространение инфекции по сосудам, соединяющим среднее ухо с мозговыми оболочками.
Говоря о гематогенном пути, мы, как уже сказано, различаем два вида заражения мозговых оболочек. Первый мы назвали бы сегментарно-васкулярным, исходя из тех соображений, что тут речь идет 6 поражении только сосудов уха, которые имеют связи с мозговыми оболочками. Инфекция в таких случаях не попадает в общее кровяное русло, т. е. она не генерализуется по организму, она только циркулирует от уха до мозговых оболочек. При метастатическом способе развитие менингита происходит вследствие генерализации инфекции по организму. Источником распространения инфекции может быть любой инфекционный процесс или гнойный очаг различной локализации (заболевания легких и бронхов и т. п.). Часто занос инфекции в полость черепа имеет место при сепсисе, в том числе сепсисе ушного происхождения.
При сегментарно-васкулярном способе реакции организма до поражения мозговых оболочек могут быть слабо выражены, так как процесс до определенной поры не выходит за пределы уха. При втором способе реакции организма резко выражены (высокая температура, ознобы) и они предшествуют воспалению мозговых оболочек. Метастазы при сепсисе возникают в различных органах и тканях малого и большого круга кровообращения. Метастазы в полости черепа выявляются в виде абсцессов мозга или менингита. Нередко метастазы возникают одновременно в различных местах, примером могут служить клинические наблюдения, приведенные нами выше.
На основании многочисленных клинических наблюдений, экспериментальных данных, а также гистологических исследований можно сказать, что отогенный менингит в большинстве случаев возникает в результате разрушения кости в области крыши барабанной полости и антрума. Этот путь наиболее частый. При нем патологический процесс из пораженной кости переходит на мозговые оболочки.
Для иллюстрации приведем данные наших наблюдений, касающихся 93 больных отогенным менингитом, находившихся на излечении в ЛОР-клинике Одесского медицинского института с 1947 до первой половины 1956 г.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Гематогенный остеомиелит – это гнойное воспаление кости, возникающее в результате заноса микробов с током крови из гнойничков на коже, гнойных ран и воспалительных очагов в различных органах. В первые сутки преобладают симптомы общей интоксикации: высокая температура, тошнота, рвота, ознобы, слабость и головная боль. Затем возникают интенсивные боли и значительный отек конечности. В последующем гной проникает в мягкие ткани, образуя флегмону, и может прорываться через кожу с формированием свищей. Диагноз выставляется на основании симптомов и данных лабораторных исследований. Рентгенография информативна только с третьей недели болезни. Лечение – антибиотикотерапия, дезинтоксикационная терапия, вскрытие и дренирование гнойников.
МКБ-10
Общие сведения
Гематогенный остеомиелит (от лат. haematogenus происходящий из крови, osteon кость + myelos костный мозг + itis воспаление) – гнойный процесс в костной ткани, возникший в результате заноса инфекции через кровь. Этот вид остеомиелита является тяжелым заболеванием, поражающим преимущественно детей и подростков в возрасте от 7 до 15 лет. Могут страдать и дети младшей возрастной группы. У мальчиков встречается втрое чаще, чем у девочек. Взрослые заболевают очень редко. Начинается остро, но в последующем иногда переходит в хроническую форму и может тянуться в течение многих лет – этим обусловлено наличие определенного количества взрослых пациентов, страдающих гематогенным остеомиелитом. Гнойное воспаление может развиться в любой кости, но чаще поражаются длинные трубчатые кости (плечевая, бедренная, большеберцовая). Лечение гематогенного остеомиелита осуществляют травматологи-ортопеды.

Причины
Чаще всего возбудителем болезни становится золотистый стафилококк. Реже гематогенный остеомиелит вызывается пневмококком, стрептококком и кишечной палочкой. Началу заболевания предшествует бактериемия (наличие микробов в крови), которая может возникать из-за наличия крупных гнойных процессов, так и вследствие небольших очагов инфекции (фурункулы, нагноившиеся ссадины, гнойники в миндалинах при ангине, гной при остром отите). При этом специалисты в области травматологии отмечают, что остеомиелит может развиваться как на фоне существующей инфекции, так и спустя много месяцев или даже лет.
Предрасположенность детей к гематогенному остеомиелиту объясняется особенностями строения костей в детском возрасте. У детей метафиз имеет очень широкую разветвленную сеть сосудов с замедленным кровотоком, что обусловлено необходимостью поставлять большое количество питательных веществ в зону роста кости. Сосуды метафиза не сообщаются с сосудами эпифизарного хряща, поэтому многие артериолы слепо заканчиваются на границе метафиза и эпифиза, что создает благоприятные условия для задержки патогенных микроорганизмов. Попадая в эту зону, микробы создают очаги дремлющей инфекции, которая может активизироваться при ослаблении организма или незначительной травме.
Патогенез
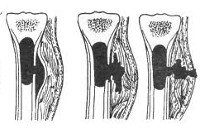
Вначале в толще костного мозга метафизарной зоны формируется небольшой гнойник. Поскольку устойчивость эпифизарного хряща к нагноению достаточно высока, гной распространяется в сторону диафиза, разрушая костный мозг и тем самым лишая кость питания изнутри. Через гаверсовы каналы гной проникает под надкостницу и отслаивает ее от кости, так кость лишается питания снаружи. Оставшаяся без питательных веществ кость разрушается, образуется участок остеонекроза.
Токсины из очага инфекции поступают в окружающие ткани и активно всасываются в кровь, что обуславливает развитие бурной интоксикации. А высокое давление гноя в полости, ограниченной костномозговым каналом, вызывает резкие, очень интенсивные боли. В последующем гной расплавляет надкостницу и проникает в мягкие ткани, вследствие чего формируется межмышечная флегмона. При прорыве флегмоны наружу образуется свищ на коже.
Симптомы гематогенного остеомиелита
Септико-пиемическая форма заболевания сопровождается выраженной интоксикацией и быстрым развитием местных изменений. Болезнь начинается с повышения температуры до 39-40 градусов. Состояние пациента тяжелое, характерны ознобы, повторная рвота и головные боли. Возможен бред и потеря сознания. Иногда выявляется гемолитическая желтуха. На вторые сутки появляются очень интенсивные, четко локализованные боли и быстро нарастающий отек мягких тканей. Конечность находится в вынужденном положении, движения невозможны из-за боли. Кожа над пораженной областью напряжена, отмечается местная гиперемия и гипертермия.
Гематогенный остеомиелит часто сочетается с артритом близлежащих суставов. По анализам выявляется метаболический ацидоз, гипонатриемия, гиперкальциемия и гиперкалиемия, а также циклические изменения свертывающей системы крови: вначале развивается гиперкоагуляция, в последующем – гипокоагуляция и фибринолиз. Нарушаются функции печени и почек. При развитии сепсиса формируются гнойные очаги в различных органах. Возможно множественное поражение костей, гнойный перикардит или гнойная деструктивная пневмония.
При местной форме гематогенного остеомиелита преобладает локальная симптоматика: боли, отек и гиперемия конечности. Общее состояние страдает меньше, чем при других формах, может незначительно ухудшаться, а иногда – даже оставаться удовлетворительным.
Токсическая (адинамическая) форма наблюдается достаточно редко. Характерно молниеносное развитие и очень тяжелое течение. В первые сутки возникает нарастающий токсикоз, сопровождающийся резким повышением температуры, появлением менингеальных симптомов, резким снижением артериального давления и развитием острой сердечно-сосудистой недостаточности. Наблюдаются судороги и потеря создания, сменяющиеся адинамией. Местная симптоматика на начальных стадиях слабо выражена, что существенно затрудняет постановку диагноза.
Диагностика
Диагноз гематогенный остеомиелит выставляется специалистом в сфере травматологии и ортопедии на основании клинической картины и данных лабораторных исследований, свидетельствующих об остром инфекционном процессе. При подозрении на нарушение работы внутренних органов и распространение инфекции назначаются консультации соответствующих специалистов: пульмонолога, гастроэнтеролога, нефролога. В зависимости от локализации выполняется рентгенография бедренной кости, рентгенография плечевой кости и т. д.
Рентгенологическое исследование повторяют в динамике, поскольку на начальных стадиях болезни изменения на рентгенограммах отсутствуют. Примерно спустя две недели от начала заболевания на снимках появляются признаки периостита, а несколько позже начинают выявляться признаки смазывания и разрежения губчатой кости в области метафиза. Через 2-4 месяца после появления первых симптомов на рентгенограммах обнаруживаются секвестры. Для уточнения расположения секвестров, свищевых ходов и полостей выполняется фистулография, радиотермия, МРТ кости и УЗИ пораженного сегмента.
Лечение гематогенного остеомиелита
Лечение проводится в условиях травматологического отделения. Для борьбы с инфекцией назначают внутримышечные и внутривенные инъекции полусинтетических пенициллинов, цефалоспоринов или линкомицина. В некоторых случаях раннее начало антибиотикотерапии позволяет остановить развитие воспалительного процесса и ликвидировать гнойный очаг до начала разрушения кости и образования секвестров. Одновременно проводится дезинтоксикационная терапия с использованием плазмы, кровезаменителей и кристаллоидных растворов. Назначаются препараты симптоматического действия.
Местное лечение включает в себя иммобилизацию пораженной конечности. При образовании гнойника в области метафиза или диафиза выполняют вскрытие, создавая фрезевые отверстия в кости, и осуществляют проточно-промывное дренирование. Межмышечные флегмоны широко вскрывают и дренируют. В полости гнойников, расположенных в кости и мягких тканях, вводят антибиотики. В послеоперационном периоде осуществляют антибиотикотерапию и дезинтоксикационную терапию. Иммобилизацию продолжают до полного купирования воспаления.
3. Современные представления о патологии и патанатомии гематогенного остеомиелита и их значение для клинической практики/ Григоровский В.В// Международный медицинский журнал - 2003 - №3
4. К вопросу о патогенезе острого и хронического остеомиелита у детей/ Горевой А.А.// Альманах клинической медицины - 2002 - №5
Геморрагические лихорадки – вирусные инфекции с природно-очаговым распространением, протекающие с геморрагическим и острым лихорадочным синдромом. Симптоматика геморрагических лихорадок включает выраженную интоксикацию, высокую температуру тела, геморрагическую сыпь, кровотечения различной локализации, полиорганные нарушения. Форма геморрагической лихорадки определяется с учетом клинико-эпидемиологических и лабораторных данных (ПЦР, ИФА, РИФ). При геморрагических лихорадках проводится дезинтоксикационная, противовирусная, гемостатическая терапия, введение специфических иммуноглобулинов, борьба с осложнениями.
Общие сведения
Геморрагические лихорадки – группа инфекционных заболеваний вирусной природы, вызывающих токсическое поражение сосудистых стенок, способствуя развитию геморрагического синдрома. Протекают на фоне общей интоксикации, провоцируют полиорганные патологии. Геморрагические лихорадки распространены в определенных регионах планеты, в ареалах обитания переносчиков заболевания. Вызывают геморрагические лихорадки вирусы следующих семейств: Togaviridae, Bunyaviridae, Arenaviridae и Filoviridae. Характерной особенностью, объединяющей эти вирусы, является сродство к клеткам эндотелия сосудов человека.
Резервуаром и источником этих вирусов является человек и животные (различные виды грызунов, обезьяны, белки, летучие мыши и др.), переносчиком – комары и клещи. Некоторые геморрагические лихорадки могут передаваться контактно-бытовым, пищевым, водным и другими путями. По способу заражения эти инфекции подразделяются на группы: клещевые инфекции (Омская, Крымская-Конго и лихорадка Кьясанурского леса), комариные (желтая, лихорадка денге, Чукунгунья, долины Рифт) и контагиозные (лихорадки Лаоса, Аргентинская, Боливийская, Эбола, Марбург и др.).
Восприимчивость к геморрагическим лихорадкам у человека довольно высока, заболевают преимущественно лица, чья профессиональная деятельность связана с дикой природой. Заболеваемость в городах чаще отмечается у граждан, не имеющих постоянного места жительства и сотрудников бытовых служб, контактирующих с грызунами.

Симптомы геморрагической лихорадки
Геморрагические лихорадки в большинстве случаев объединяет характерное течение с последовательной сменой периодов: инкубации (как правило, 1-3 недели), начальный (2-7 дней), разгара (1-2 недели) и реконвалесценции (несколько недель). Начальный период проявляется общеинтоксикационной симптоматикой, обычно весьма интенсивной. Лихорадка при тяжелом течении может достигать критических цифр, интоксикация – способствовать расстройству сознания, бреду, галлюцинациям.
Перед наступлением периода разгара нередко отмечается кратковременная нормализация температуры и улучшение общего состояния, после чего токсикоз нарастает, интенсивность общей клиники увеличивается, развиваются полиорганные патологии, нарушения гемодинамики. В период реконвалесценции происходит постепенный регресс клинических проявлений и восстановление функционального состояния органов и систем.
Геморрагический дальневосточный нефрозонефрит нередко называют геморрагической лихорадкой с почечным синдромом, поскольку для этого заболевания характерно преимущественное поражение сосудов почек. Инкубация геморрагического дальневосточного нефрозонефрита составляет 2 недели, но может сокращаться до 11 и удлиняться до 23 дней. Впервые дни заболевания возможны продромальные явления (слабость, недомогание). Затем развивается тяжелая интоксикация, температура тела поднимается до 39,5 и более градусов и сохраняется на протяжении 2-6 дней. Спустя 2-4 дня от начала лихорадки появляется геморрагическая симптоматика на фоне прогрессирующей интоксикации. Иногда могут отмечаться менингеальные симптомы (Кернига, Брудзинского, ригидность затылочных мышц). Ввиду токсического поражения головного мозга, сознание нередко спутано, появляются галлюцинации, бред.
Крымская геморрагическая лихорадка характеризуется острым началом: отмечается рвота, боль в животе натощак, озноб. Температура тела резко повышается. Внешний вид больных характерный для геморрагических лихорадок: гиперемированное отечное лицо и инъецированные конъюнктивы, веки, склеры. Геморрагическая симптоматика выражена: петехиальные высыпания, кровоточивость десен, кровотечения из носа, примесь крови в кале и рвотных массах, маточные кровотечения у женщин. Селезенка чаще остается нормального размера, у некоторых больных может отмечаться ее увеличение. Тяжелое течение заболевания проявляется интенсивной болью в животе, частой рвотой, меленой. Пульс лабильный, артериальное давление снижено, сердечные тоны – глухие.
Омская геморрагическая лихорадка протекает более легко и доброкачественно, геморрагический синдром выражен слабее (хотя летальность имеет место и при этой инфекции). В первые дни лихорадка достигает 39 с небольшим градусов, в половине случаев лихорадочный период протекает волнообразно, с периодами повышения и нормализации температуры тела. Продолжительность лихорадки – 3-10 дней.
Геморрагическая лихорадка денге характеризуется инкубационным периодом от 5 до 15 дней, доброкачественным течением, симптоматикой общей интоксикации, усиливающейся к 3-4 дню и пятнисто-папулезной сыпью геморрагического происхождения, проходящей через 2-3 дня после появления (обычно возникает в разгар заболевания) и не оставляющей после себя пигментаций или шелушения. Температурная кривая может быть двухволновой: лихорадка прерывается 2-3-дневным периодом нормальной температуры, после чего возникает вторая волна. Такая форма характерна для европейцев, у жителей Юго-Восточной Азии лихорадка Денге развивается по геморрагическому варианту и имеет более тяжелое течение.
Геморрагические лихорадки могут способствовать развитию тяжелых, угрожающих жизни состояний: инфекционно-токсического шока, острой почечной недостаточности, комы.
Диагностика геморрагических лихорадок
Диагностику геморрагических лихорадок производят на основании клинической картины и данных эпидемиологического анамнеза, подтверждая предварительный диагноз лабораторно. Специфическая диагностика производится с помощью серологических исследования (РСК, РНИФ и др.), иммуноферментного анализа (ИФА), выявления вирусных антигенов (ПЦР), вирусологического метода.
Геморрагические лихорадки обычно характеризуются тромбоцитопенией в общем анализе крови, выявлением эритроцитов в моче и кале. При выраженной геморрагии появляются симптомы анемии. Положительный анализ кала на скрытую кровь говорит о кровотечении по ходу желудочно-кишечного тракта.
Лихорадка с почечным синдромом также проявляется при лабораторной диагностике в виде лейкопении, анэозинофилии, увеличением количества палочкоядерных нейтрофилов. Значительны патологические изменения в общем анализе мочи – удельный вес снижен, отмечается белок, (нередко повышение достигает 20-40%), цилиндры. В крови повышен остаточный азот. Крымская лихорадка отличается лимфоцитозом на фоне общего нормоцитоза, сдвигом лейкоформулы влево и нормальной СОЭ.
Лечение геморрагической лихорадки
Больные с любой геморрагической лихорадкой подлежат госпитализации. Прописан постельный режим, полужидкая калорийная легкоусвояемая диета, максимально насыщенная витаминами (в особенности С и В) – овощные отвары, фруктовые и ягодные соки, настой шиповника, морсы). Кроме того, назначают витаминотерапию: витамины С, Р. Ежедневно в течение четырех дней принимается викасол (витамин К).
Внутривенно капельно назначают раствор глюкозы, в период лихорадки могут производиться переливания крови небольшими порциями, а также введение препаратов железа, препаратов на основе водного экстракта из печени крупного рогатого скота. В комплексную терапию включают противогистаминные средства. Выписка из стационара производится после полного клинического выздоровления. По выписке больные некоторое время наблюдаются амбулаторно.
Прогноз и профилактика геморрагической лихорадки
Прогноз зависит от тяжести течения заболевания. Геморрагические лихорадки могут варьироваться по течению в весьма широких пределах, в некоторых случаях вызывая развитие терминальных состояний и заканчиваясь летально, однако в большинстве случаев при своевременной медицинской помощи прогноз благоприятен – инфекция заканчивается выздоровлением.
Профилактика геморрагических лихорадок в первую очередь подразумевает меры, направленные на уничтожение переносчиков инфекции и предупреждение укусов. В ареале распространения инфекции производят тщательную очистку мест, подготовленных под поселение, от кровососущих насекомых (комары, клещи), в эпидемически опасных регионах рекомендовано в лесных массивах носить плотную одежду, сапоги, перчатки, специальные противокомариные комбинезоны и маски, использовать репелленты. Для омской геморрагической лихорадки существует методика специфической профилактики, плановая вакцинация населения с помощью убитой вакцины вируса.
8.3. ПУТИ РАСПРОСТРАНЕНИЯ ИНФЕКЦИИ
В зарубежной и отечественной литературе описано пять основных пу-тей проникновения возбудителей инфекции в организм плода (Анкирская А.С., 1985; Радзинский В. Е, 1992; Кира Е.Ф., 1996; Левицкая С. К., 1991):
1) восходящий (через шейку матки и оболочки плодного яйца);
2) трансплацентарный, или гематогенный (через плацентарный барьер к плоду);
3) нисходящий (из воспалительно измененных придатков матки, аппен-дикса);
4) интранатальный (при прохождении плода через инфицированные ро-довые пути матери);
Антенатально инфекционный агент попадает к плоду гематогенно (трансплацентарно) или через инфицированные околоплодные воды. Чаще при антенатальном заражении возбудители поступают в организм плода ге-матогенно. Вначале они с кровью матери поступают в плаценту, где возмож-но размножение возбудителя и последующее развитие воспалительного про-цесса (плацентита). Преодолев маточно-плацентарный барьер, возбудитель проникает к плоду и может привести к развитию генерализованной инфекции с поражением печени, легких, почек, головного мозга и других органов (Ан-кирская А.С., 1989; Айламазян Э.К., 1995; Есаулова Н.Е., 1996; Сидельникова В.М., 1996; Сидорова И.С., 1999; Михайлов А.В., Лаврова Д.Б., Коляченко Е.С., 2003). Следует отметить, что распространение возбудителей может происходить и по вартонову студню пуповины, чему способствует внесосу-дистый ток жидкости от плаценты к плоду (Mindel A., 1995).
Околоплодные воды могут быть инфицированы восходящим (из влага-лища) и нисходящим (из маточных труб) путём, а также самим плодом, ин-фицированным гематогенно и выделяющим возбудителя с калом и мочой с последующим инфицированием околоплодных вод. При синдроме инфици-рования амниона может произойти преждевременный разрыв околоплодных оболочек с последующим развитием эндометрита, инфекционных осложне-ний новорожденного (Анкирская А.С., 1985). Учитывая ведущую роль трансплацентарного (гематогенного) инфицирования при антенатальной ВУИ, важно отметить, что состояние барьерной функции плаценты в значи-тельной мере определяет возможность развития инфекции и количество по-павшего к плоду инфекционного агента. Известно, что фетоплацентарная не-достаточность резко увеличивает риск развития генерализованной ВУИ при наличии хронического очага или остром заболевании у беременной.
Гематогенный путь передачи инфекции характерен для цитомегалови-русной, энтеровирусной инфекции, вируса простого герпеса, ветряной оспы, а также наблюдается при листериозе, микоплазмозе, некоторой бактериаль-ной инфекции и приводит к тяжёлым диссеминированным поражениям фе-топлацентарной системы, жизненно важных органов плода (мозга, печени, лёгких) (Девис П. А., 1987; Лозовская Л. С., 1995; Самохин П. А., 1987; Си-макова М. Г., 1995).
Восходящий путь инфицирования характерен для условно - патогенной микрофлоры, грибковой инфекции, а также наблюдается при хламидиозе, микоплазмозе, листериозе, других инфекциях. При восходящем пути инфи-цирования микроорганизмы проникают через плодные оболочки в около-плодные воды, где происходит размножение возбудителя. При этом плод оказывается в инфицированной среде. Заражение внутренних полостей плода происходит при заглатывании и аспирации инфицированных вод (Гуртовой Б. Л., Анкирская А. С., 1994; Цинзерлинг А. В., 1986).
Нисходящий путь инфицирования менее характерен для ВУИ, хотя его риск высок при персистенции возбудителей в эндометрии и маточных трубах (хламидии, микоплазмы, уреаплазмы) (Радзинский В. Е., 1996; Тареева Т. Г., 1994).
Интранатальный путь инфицирования (заражение плода во время родов путём аспирации или заглатывания содержимого родовых путей матери) наиболее характерен для бактериальной инфекции (стрептококк группы В, E.сoli, стафиллококк, Proteus, клебсиелла, анаэробная флора), но возможен и для вирусной (ВПГ, ЦМВ) инфекции, грибов рода Кандида. Причем передача инфекции возможна как при наличии симптомов поражения в области шейки матки и вульвы, так и при бессимптомном выделении возбудителя (Адаске-вич В. П., 1996; Барашнев Ю. И., 1994; Кудашев Н. И., 1991; Carmack M. A., 1993).
Таким образом, при наличии у беременной урогенитальной инфекции внутриутробное инфицирование плода и новорожденного может произойти любым из вышеперечисленных путей.
Что такое пиелонефрит острый? Причины возникновения, диагностику и методы лечения разберем в статье доктора Закуцкий А. Н., уролога со стажем в 16 лет.
Над статьей доктора Закуцкий А. Н. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
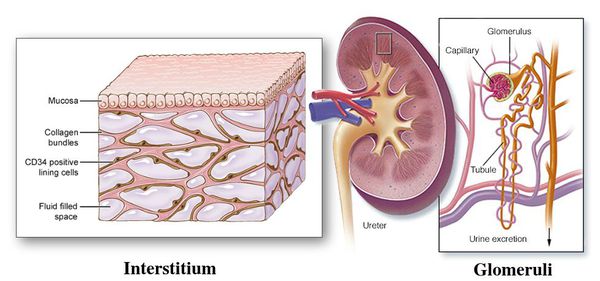
Причина пиелонефрита — бактериальная инфекция. Среди возбудителей заболевания лидирует кишечная палочка (Escherichia coli). Реже встречаются другие микробы, такие как протей, энтерококк, синегнойная палочка и стафилококк. [4]
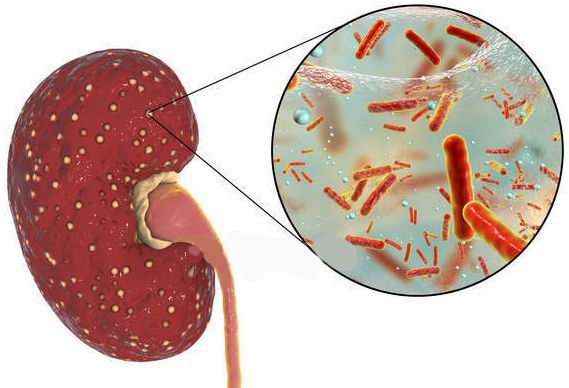
Острый пиелонефрит может возникнуть в любом возрасте и у любого пола. Чаще всего заболевание возникает у женщин активного репродуктивного возраста, что объясняется особенностями строения женской мочеполовой системы. Однако нередко пиелонефрит выявляют у детей и половозрелых мужчин, поэтому возраст и пол заболевавшего не могут быть использованы в качестве дифференциального признака данного заболевания.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы острого пиелонефрита
Для острого пиелонефрита типично сочетание высокой температуры с болями в области воспалённой почки. Если почка располагается на своём месте, то боль беспокоит в проекции рёберно-позвоночного угла. При опущении почки боль возникает по фланкам живота. Пиелонефрит может затрагивать как одну почку, так и обе почки, соответственно боль может беспокоить как с одной стороны, так и с обеих сторон одновременно.
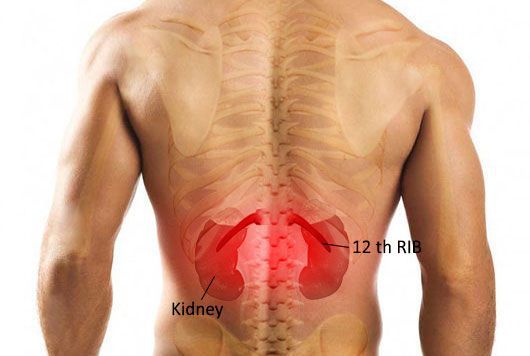
Выраженность боли может быть различной — от умеренной до интенсивной. Как правило, боль носит постоянный характер и не зависит от положения тела или движений. Иными словами, невозможно найти такое положение в кровати, когда боль будет беспокоить меньше или пройдет совсем. Также верно и то, что движения туловищем в виде сгибания, разгибания или поворотов не приводят к обострению болей.
В отдельных случаях боль носит приступообразный характер. Это характерно для пиелонефритов, которые возникают на фоне закупорки мочевых путей камнем. Если при классической почечной колике боль между приступами отступает совсем, то при сопутствующем пиелонефрите болевой синдром сохраняется и между приступами.
Развитие острого пиелонефрита может сопровождаться изменения со стороны мочеиспускания, хотя это не является обязательным условием. Можно отметить появление мути в моче и неприятного запаха. Кроме того, воспалённая моча потенциально способна спровоцировать учащённое мочеиспускание. В целом мочевые симптомы выходят на первый план только в том случае, если острый пиелонефрит осложняет уже имеющееся воспаление мочевого пузыря. [1] [4]
Патогенез острого пиелонефрита
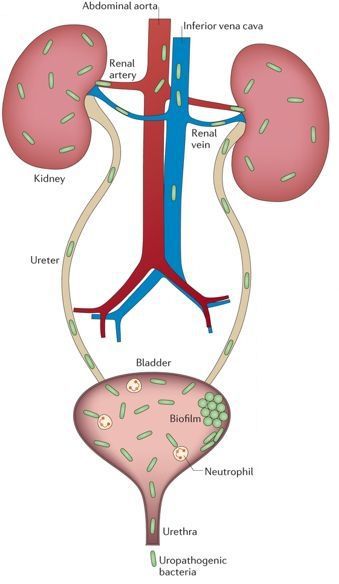
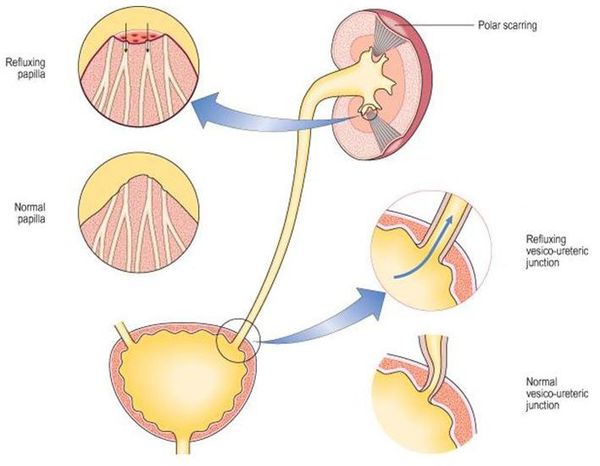
Уриногенный путь передачи особенно характерен для детей из-за широкого распространения пузырно-мочеточникового рефлюкса. Так называют заброс мочи из мочевого пузыря обратно в почку. Несмотря на широкое распространение рефлюкса именно в детском возрасте, многие взрослые страдают аналогичным заболеванием. Особенно часто рефлюкс, то есть обратный заброс мочи, наблюдается при переполнении мочевого пузыря. Поэтому очень важно своевременно опорожнять мочевой пузырь. [8]
Классификация и стадии развития острого пиелонефрита
Традиционно острый пиелонефрит подразделяют на серозный и гнойный, хотя гнойный пиелонефрит является скорее осложнением острого пиелонефрита.
Существует несколько форм гнойного пиелонефрита:
- апостематозный пиелонефрит;
- абсцесс почки;
- карбункул почки;
- некротический папиллит;
- эмфизематозный пиелонефрит.
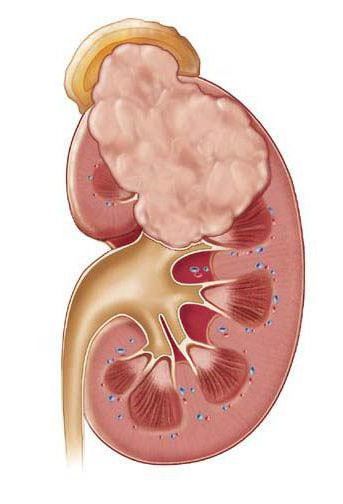
Если гнойников много, и они небольшие по размеру, то говорят об апостематозном пиелонефрите. В том случае, если гнойник большой и одиночный, то мы имеем дело с абсцессом почки.
Почечный абсцесс нужно дифференцировать с карбункулом почки. Карбункул — это часть почечной паренхимы, погибшая вследствие закупорки крупного почечного сосуда микробным эмболом. Рано или поздно погибшие от эмболии ткани подвергаются гнойному расплавлению, что приводит к абсцедированию карбункула.
Особой формой острого пиелонефрита является некротический папиллит — это грозное и смертельно опасное заболевание. К счастью, эта болезнь встречается настолько редко, что даже опытные урологи со стажем работы в несколько десятков лет могут вспомнить лишь несколько случаев данной формы острого пиелонефрита. При некротической папиллите происходит некроз, то есть омертвление и гибель почечного сосочка. Это сопровождается почечной недостаточностью и появлением крови в моче. Причина некротического папиллита сходна с причиной карбункула: закупорка почечного сосуда микробным эмболом. Только при папиллите страдает сосуд, питающий почечный сосочек. [4]
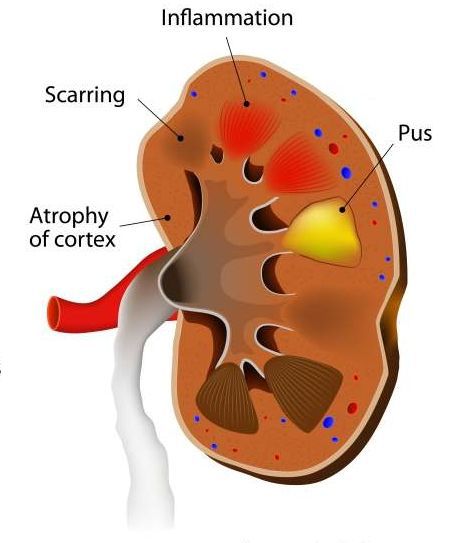
Осложнения острого пиелонефрита
Местные осложнения острого пиелонефрита включают апостематоз, абсцесс почки, эмфизематозный пиелонефрит, а также тромбоз почечных сосудов либо в виде карбункула почки, либо в виде некротизирующего папиллита. [10]
Эмфизематозный пиелонефрит является исключительно редким заболеванием и отличается от прочих гнойных осложнений пиелонефрита появлением пузырьков газа. Воздушные скопления могут быть в почечной паренхиме, полостной системе почек или даже в паранефральной клетчатке. К счастью, эмфизематозный пиелонефрит встречаются существенно реже других гнойных осложнений почки. [7]
Среди системных осложнений нужно отметить острую почечную недостаточность и синдром системной воспалительной реакции (сепсис). Именно поэтому часть пациентов нуждается в госпитализации в урологические стационары. В условиях стационара проводится регулярный контроль анализов и УЗИ для своевременного выявления осложнений острого пиелонефрита. [4]
Некоторые осложнения пиелонефрита в большей степени ассоциированы с хронической формой этого заболевания, но так как острый пиелонефрит может перейти в хронический, то нельзя не упомянуть о таком важном осложнении как мочекаменная болезнь. В некоторых ситуациях воспаление почечной паренхимы вызывают уреаза-продуцирующие микробы. Уреаза — это фермент, который позволяет бактериям расщеплять мочевину из мочи. После срабатывания фермента мочевина расщепляется до углекислоты и аммиака. Именно эти два компонента запускают сложный биохимический каскад, который приводит к образованию инфекционных камней: струвита и гидроксиапатита. К счастью, самый частый возбудитель пиелонефрита — кишечная палочка — не умеет производить уреазу, этой способностью обладают другие более редкие возбудители пиелонефрита — протей, клебсиелла и синегнойная палочка.
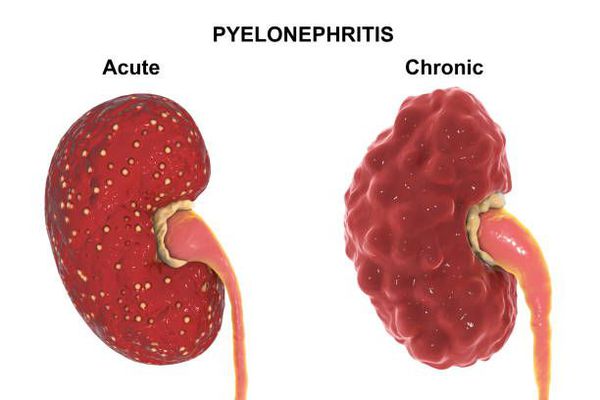
Диагностика острого пиелонефрита
Минимальный объём обследований:
- общий анализ мочи;
- посев мочи на флору с определением чувствительности к антибиотикам;
- клинический анализ крови;
- анализ крови на креатинин;
- УЗИ почек и мочевого пузыря.
Общий анализ мочи
Типичным для пиелонефрита является повышение уровня лейкоцитов и обнаружение бактерий. Могут быть и другие неспецифичные для данного заболевания изменения, включая повышенный уровень белка или положительный тест на нитриты. Обнаружение большого количества эритроцитов требует проведения дифференциальной диагностики с мочекаменной болезнью и гломерулонефритом.
Посев мочи на флору и чувствительность к антибиотикам
Этот анализ имеет смысл сдавать до назначения антибиотиков. Посев мочи позволяет выявить возбудитель пиелонефрита и определить наиболее эффективные антибактериальные препараты.
Клинический анализ крови
Неспецифическим признаком пиелонефрита является повышенный уровень лейкоцитов со сдвигом лейкоцитарной формулы влево. Как правило, больной с острым пиелонефритом повторяет клинический анализ крови два или три раза во время лечения. Данный анализ позволяет оценить эффективность антибактериальной терапии и своевременно сигнализировать о развитии гнойных осложнений в воспаленной почке.
Анализ крови на креатинин
Этот анализ является обязательным для всех пациентов с пиелонефритом прежде всего потому, что в ряде случаев острый пиелонефрит может осложниться развитием острой почечной недостаточности. Кроме того, анализ крови на креатинин необходим для решения вопроса о рентгенологическом исследовании почек с применением контраста.
УЗИ почек и мочевого пузыря
Ультразвуковое исследование позволяет исключить обструктивный пиелонефрит, связанный с нарушением оттока мочи из почки. Кроме того, УЗИ почек необходимо для своевременного выявления апостематоза, абсцесса и карбункула в паренхиме почки. Все вышеперечисленные термины используются для описания осложнений острого пиелонефрита.
Важнейшим преимуществом ультразвукового исследования является возможность повторения этого исследования в динамике без нанесения какого-либо вреда или даже дискомфорта организму. Важно помнить, что нормальные результаты УЗИ не исключают наличие острого пиелонефрита.
Рентгеновское обследование почек: внутривенная урография или компьютерная томография почек с внутривенным контрастированием.
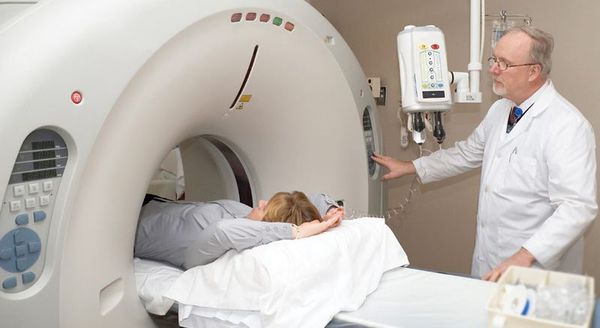
Рентгеновское обследование почек является самым точным и достоверным методом диагностики. Традиционный рентген в виде внутривенной урографии подразумевает обязательное внутривенное введение йодсодержащего контраста. Это не всегда возможно из-за сопутствующих причин: аллергия на йод, приём гормонов щитовидной железы и повышенный уровень креатинина в крови. По сути, в настоящее время внутривенная урография необходима только для установления степени нефроптоза при опущении почек.
Значительно более широко применяется КТ почек (компьютерная томография). КТ относится к рентгеновским методам исследования, однако его информативность значительно выше, чем у обычного рентгена. Вопрос о введении йодсодержащего внутривенного контраста решается лечащим урологом индивидуально с каждым пациентом. [2] [4]
Лечение острого пиелонефрита
Стационарное лечение обычно требуется для беременных, детей, пожилых людей, пациентов с ослабленным иммунитетом, плохо контролируемым диабетом, после трансплантации почек и, конечно же, всех людей с обструкцией мочевых путей. Также желательно госпитализировать людей с острым пиелонефритом единственной существующей или единственно функционирующей почки. Здоровые, молодые, небеременные женщины, которые болеют неосложнённым пиелонефритом, могут лечиться амбулаторно.
Обычно острый пиелонефрит требует исключительно медикаментозного лечения. Показания к хирургическому лечению возникают крайне редко.
Первоначальный выбор антибиотика при остром пиелонефрите является эмпирическим. Через 4-7 дней антибактериальная терапия может быть скорректирована по результатам посева мочи. Эмпирический выбор антибиотика остаётся на усмотрение лечащего врача.
В национальных рекомендациях в качестве средства выбора при остром пиелонефрите указаны фторхинолоны второго и третьего поколения. [4] Тоже самое сказано и в рекомендациях Европейской ассоциации урологов. Между тем, ещё в 2016 году FDA (Управление по контролю качества пищевых продуктов и лекарственных препаратов) рекомендовала отказаться от использования данных антибиотиков из-за большого количества осложнений в отношении связок, суставов и периферических нервов. [6] Поэтому в качестве первой линии терапии рекомендуют использовать цефалоспорины третьего поколения.
Часто можно встретить комбинацию из двух антибиотиков для лечения острого пиелонефрита. Как правило, комбинируют цефалоспорины с фторхинолонами или аминогликозидами. Аминогликозиды в виде амикацина обладают явным нефротоксическим действием, поэтому их использование для эмпирической терапии оправдано только в тяжёлых случаях. В целом выбор антибиотика — на усмотрение лечащего врача. [9]
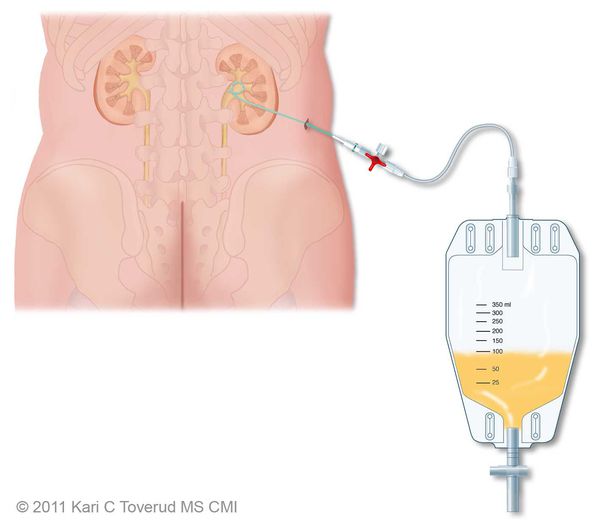
Показания к оперативному лечению возникают при гнойной форме воспаления и остром вторичном пиелонефрите. При вторичном пиелонефрите главная цель хирургического вмешательства состоит в дренировании мочи. Это можно сделать как путём установки почечного стента, так и благодаря чрезкожной пункционной нефростомии.
Гнойная форма острого пиелонефрита требует ревизии и декапсуляции почки, вскрытия гнойных очагов или даже нефрэктомии при гнойном разрушении большей части почки. [4]
Прогноз. Профилактика
Прогноз при пиелонефрите благоприятный. Большинство острых пиелонефритов успешно лечатся амбулаторно, и лишь небольшая доля случаев требует госпитализации. Тем не менее сохраняется определённый процент летальный исходов. Причиной неблагоприятного течения заболевания являются возраст старше 65 лет, присоединение острой почечной недостаточности, несвоевременно выявленные гнойные осложнения, требующие хирургического вмешательства, и тяжёлые сопутствующие заболевания наподобие декомпенсированного сахарного диабета. [5]
Составление плана индивидуальной профилактики начинается с изучения истории конкретного заболевания. В частности, необходимо ответить на вопрос, каким образом бактерии попали в почку: с кровью или с мочой? При гематогенном пути заражения необходимо санировать имеющиеся в организме очаги хронической инфекции, исключить переохлаждение и проводить профилактику сезонных простудных заболеваний. При уриногенном пути заражения необходимо заняться профилактикой воспалительных заболеваний мочевого пузыря.
В случае вторичной формы острого пиелонефрита целесообразно восстановить нормальный отток мочи из поражённой почки.
Вне зависимости от пути попадания микробов в почку всем пациентам рекомендуется потреблять достаточное количество жидкости и разнообразные урологические сборы растительного происхождения. [4]
Читайте также:

