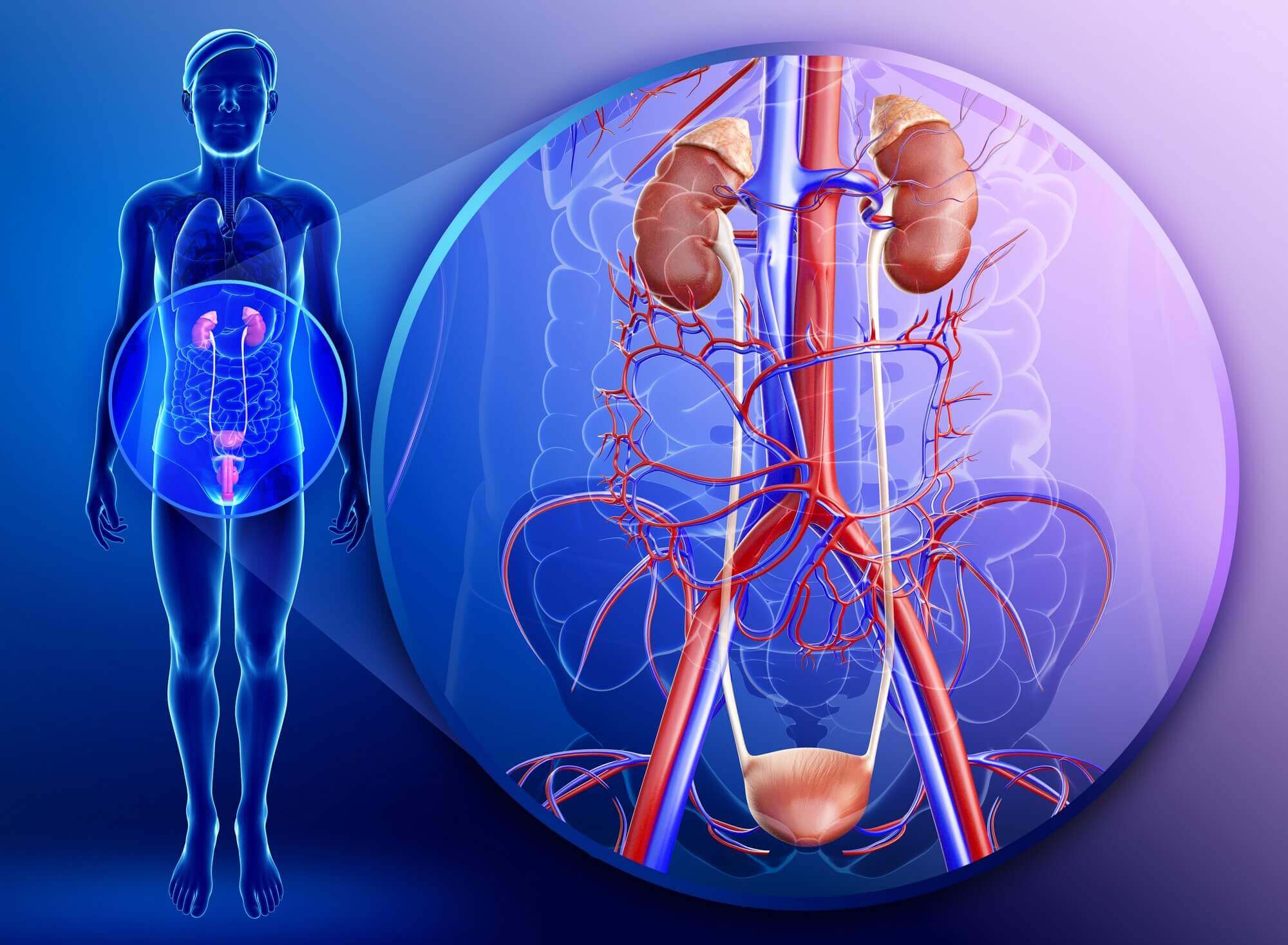
Что такое грибковая инфекция почки
Обновлено: 05.05.2024
В настоящее время в урологической практике наблюдается увеличение количества больных грибковыми инфекциями. Наиболее распространенными возбудителями грибковых инфекций мочевых путей являются представители рода Сапdida. Основными предрасполагающими факторами развития кандидурии являются: наличие дренажей в мочевых путях, предшествующая антибактериальная терапия, перенесенные инструментальные вмешательства, сахарный диабет и иммунодефицитные состояния. Определение локализации грибковой инфекции мочевых путей и степени ее распространения является наиболее ответственным и трудным этапом диагностики. Наиболее предпочтительным препаратом для лечения кандидоза нижних мочевых путей является флуконазол.
За последние десятилетия все большее значение приобретают нозокомиальные инфекции, обусловленные возбудителями с низким потенциалом патогенности. Это связано с ростом числа больных с множественными факторами риска развития заболеваний данной группы. В большинстве случаев инфекции, вызванные редкими или условно-патогенными возбудителями, выявляют у пациентов с иммунодефицитными состояниями после трансплантации органов и у онкологических больных. Грибковые микроорганизмы являются наиболее частыми этиологическими возбудителями таких инфекций [1].
Рост числа больных грибковыми инфекциями отмечается и в урологической практике. По данным широкомасштабного исследования, проведенного в США Richards M.J. и соавт. с 1992 по 1998 г., среди больных блоков интенсивной терапии хирургических отделений инфекции мочевыводящих путей (ИМП) в 95–97 % случаев возникали при наличии постоянного уретрального катетера, при этом у 31 % больных выявляли грибковые патогены.
Грибковые ИМП наиболее часто вызываются представителями рода Candida, а также могут быть обусловлены Cryptococcus neoformans, Aspergillus и возбудителями эндемичных микозов [2]. Источник фунгурии может находиться на любом уровне урогенитального тракта (табл. 1).
Наиболее частой локализацией грибкового процесса являются нижние мочевые пути. Возникновение грибковой инфекции почек и половых органов сопровождается значительным ухудшением состояния больного и требует применения более длительного и интенсивного курса противогрибковой терапии.
Важно отметить, что фунгурия не всегда сопровождается клиническими проявлениями [2]. Поэтому определение локализации грибковой ИМП, несмотря на современное развитие диагностических технологий, остается очень трудной задачей.
Диагностика кандидурии и кандидоза нижних мочевых путей
Наиболее распространенными возбудителями грибковых ИМП являются представители рода Сапdida. В настоящее время грибы рода Candida выявляют в 80–94 % случаев фунгурии [3]. Частота нозокомиальных инфекций, вызванных различными видами Сапdida, за прошедшие 10 лет увеличилась в два-три раза [2]. Самым распространенным видом при грибковых ИМП является Candida albicans (более 50 % случаев). Другие разновидности грибов Candida встречаются реже. Так, С. glabrata обнаруживают в 16–35 % случаев, а С. tropicalis, С. krusei, и С. parapsilosis в 8–28 % (табл. 2) [2–6].
Особенно характерно выявление редких разновидностей Candida для стационарных больных сахарным диабетом при наличии уретрального катетера. В настоящее время кандидурией считают обнаружение грибковых патогенов в титре более 10 3 КОЕ/мл в двух образцах мочи, полученных с интервалом не менее 24 часов [2, 4, 6]. Необходимо отметить, что при грибковых ИМП кандидурия нередко сочетается с бактериурией. Кроме того, известны случаи выявления в моче сразу двух видов Candida [2, 3, 6]. В нормальных условиях грибы Candida можно обнаружить на поверхности половых органов и коже промежности. Поэтому в большинстве случаев кандидурия не сопровождается какими-либо симптомами и связана с восходящей колонизацией мочевых путей по дренажу (уретральным катетерам, цистостомическим дренажам и др.) или у женщин из контаминированной вульвовагинальной области [2–4, 6–8]. Кандидурия редко возникает в отсутствие предрасполагающих факторов или у здоровых мужчин. Так, у больных сахарным диабетом наблюдается высокая частота развития грибковых инфекций нижних мочевых путей [2, 4, 6]. В основном это связано со снижением фагоцитарной и фунгицидной способности нейтрофилов при дефиците инсулина [2, 6]. У женщин с сахарным диабетом кандидурия возникает чаще, чем у мужчин. Это вызвано тем, что женщины, страдающие сахарным диабетом, имеют более выраженную колонизацию влагалища и периуретральной области грибами Candida [2, 6, 8]. Кандидурия может развиваться у госпитализированных больных уже в течение первых двух недель стационарного лечения [2, 3, 5].
Кроме сахарного диабета к основным предрасполагающим факторам развития кандидурии относят [2–7]:
- постоянные мочевые катетеры
- инструментальные вмешательства
- анатомические и функциональные аномалии мочевыводящих путей
- применение антибиотиков, кортикостероидов, иммуносупрессоров или цитостатиков
- грибковую инфекцию другой локализации
- гемобластозы с нейтропенией
- пожилой возраст
По данным ряда исследований, возникновению кандидурии в большинстве случаев предшествует антибактериальная терапия [2, 4, 6, 7]. Несмотря на то что возникновение кандидурии возможно при использовании любого антибактериального препарата, терапия препаратами широкого спектра действия ассоциируется с наиболее высоким риском возникновения данного осложнения, особенно при длительном курсе лечения. Антибактериальная терапия подавляет эндогенную бактериальную флору в желудочно-кишечном тракте и приводит к усилению процесса грибковой колонизации эпителиальных поверхностей, особенно при наличии уретрального катетера. Именно поэтому грибы рода Candida – частая причина восходящей инфекции у катетеризированных больных и пациентов с обструкцией мочевыводящих путей [2, 5, 6].
У госпитализированных больных в 10 % случаев кандидурия является первым клиническим проявлением диссеминированного кандидоза и кандидемии [2, 4].
Большинство случаев кандидоза почек обусловлено гематогенной диссеминацией возбудителя в их паренхиму из других очагов инфекции, при этом диссеминированный кандидоз является крайне тяжелым заболеванием, летальность при котором составляет более 50 % [3, 9]. Таким образом, у больных с высоким риском развития кандидоза, в т. ч. с поражением почек, необходимо проводить полное клиническое обследование для выявления источника кандидурии [2–4, 6, 9]. Для дифференциальной диагностики кандидоза верхних и нижних мочевых путей Fong I.W. и соавт. (1995) провели исследование эффективности однократной инстилляции раствора амфотерицина В в мочевой пузырь с последующим культуральным исследованием мочи. Сохранение кандидурии в данном случае свидетельствовало о кандидозе верхних мочевых путей или почек. Несмотря на высокую чувствительность и специфичность этого метода, достоверное определение почечной кандидурии оказалось возможным только в 44 % случаев.
У больных с несколькими факторами риска развития кандидурии могут развиваться клинические симптомы ИМП. При этом кандидурия расценивается как проявление кандидоза мочевых путей [3]. Кандидоз нижних мочевых путей является наиболее частым вариантом грибковой ИМП. Иммуносупрессия и нейтропения являются одними из основных факторов риска развития кандидоза нижних мочевых путей [6, 9, 10]. Особую роль в защите организма от кандидозной инфекции играет система клеточного иммунитета, принимающая активное участие в ограничении распространения и уничтожении клеток Candida spp. Нарушение функции иммунной системы может способствовать развитию тяжелых форм кандидоза [10].
Инфицирование грибами рода Candida при кандидозе нижних мочевых путей чаще всего происходит восходящим путем у катетеризированных больных и пациентов с нарушением уродинамики, особенно при наличии сахарного диабета [2–4, 6].
Клинические проявления, вызванные инфекцией Candida, зависят от ее локализации. У больных с кандидозным уретритом симптомы заболевания не отличаются от таковых при бактериальной инфекции. Пациенты с кандидозным циститом могут иметь учащенное или затрудненное мочеиспускание, императивные позывы к мочеиспусканию, гематурию и пиурию. Цистоскопическая картина кандидозного цистита может соответствовать как очаговому, так и распространенному поражению в виде мягких, белесоватых, приподнятых над поверхностью участков на фоне воспалительно-измененной слизистой оболочки [2, 6]. Таким образом, в большинстве случаев при выявлении кандидурии необходима комплексная диагностика, направленная на исключение кандидоза мочевых путей [2, 3].
К основным методам диагностики кандидоза мочевыводящих путей относятся [3]:
- микроскопия и посев мочи
- компьютерная томография или ультразвуковое исследование почек (по показаниям)
- цистоскопия (по показаниям)
- определение вида возбудителя и его чувствительности к антимикотикам показано при рецидивирующем течении и/или резистентности к стандартной терапии антимикотиками
- микологическое обследование (повторные посевы крови и других биосубстратов) и серологическая диагностика (определение специфических антител, антигена в сыворотке крови) показаны при высоком риске развития острого диссеминированного кандидоза (наличие факторов риска, клинических признаков)
Лечение кандидурии и кандидоза нижних мочевых путей
Назначение противогрибковых препаратов при выявлении кандидурии показано не во всех случаях. Так, при бессимптомной кандидурии у катетеризированных больных нет необходимости в лечении антимикотиками. Проведение противогрибковой терапии обязательно у пациентов с бессимптомной кандидурией, входящих в группу риска развития диссеминированного кандидоза: после трансплантации почек и хирургических вмешательств на органах брюшной полости, у перенесших распространенные глубокие ожоги или тяжелые травмы, до и после урологических операций, при наличии сопутствующей нейтропении, у новорожденных с низкой массой тела [2–7, 9]. Кроме того, постоянная бессимптомная кандидурия у больных с нейтропенией в отсутствие лихорадки требует дальнейшего обследования и исключения клинически бессимптомного гематогенного почечного кандидоза [2–4, 6, 7, 9].
По данным исследования, проведенного Sobel J.D. и соавт. (2000), при лечении бессимптомной кандидурии у пациентов без факторов риска диссеминированного кандидоза терапия флуконазолом быстро приводила к положительному результату, однако при продолжающемся дренировании мочевых путей достаточно часто возникали рецидивы и наблюдалась селекция резистентных штаммов Candida spp. При этом отдаленные микробиологические результаты у леченых и нелеченых больных были сопоставимы. По результатам проведенных исследований, прекращение антибактериальной терапии и замена дренажа приводили к исчезновению бессимптомной кандидурии в 20 %, а при удалении катетера – в 40 % случаев [2, 3, 6, 7].
Известно, что С. albicans и большинство других представителей Candida обладают хорошей чувствительностью к флуконазолу. C. krusei зачастую резистентна к данному препарату, а в отношении C. glabrata может определяться дозозависимый эффект при его применении. C. glabrata и C. krusei также характеризуются сниженной чувствительностью к амфотерицину В (табл. 3) [2–4, 6–8].
Внутрипузырное введение раствора амфотерицина B долгое время было стандартом терапии при кандидурии. Однако результаты исследований Gubbins P.O. и соавт. (1999) показали, что внутрипузырное введение амфотерицина B и пероральная терапия флуконазолом в равной степени эффективны для купирования кандидурии. Стерилизация мочи при внутрипузырном введении амфотерицина B развивается быстрее, но эффект от системной терапии флуконазолом сохраняется дольше, кроме того, пероральная терапия более удобна и экономически приемлема. По данным Jacobs L.G. и соавт. (1996), у пожилых пациентов уровень смертности, связанной со всеми причинами, после проведенного курса лечения кандидурии был выше среди больных, получавших лечение в виде инстилляций в мочевой пузырь амфотерицина В, чем среди тех, кому проводили пероральную терапию флуконазолом (41 и 22 % соответственно). Таким образом, проведение местной терапии было связано с более низкими показателями выживаемости. Внутрипузырное введение раствора амфотерицина B (50–200 г/мл) показано лишь в редких случаях или в качестве диагностического, локализационного теста.
В случае диагностики кандидоза нижних мочевых путей в настоящее время рекомендуется применение таких препаратов, как флуконазол, амфотерицин B или флуцитозин [2, 4, 6–9]. Наиболее предпочтительным из них является флуконазол. Данный антимикотик в отличие от других представителей группы азолов растворим в воде и на 80 % выводится с мочой в неизмененном виде, создавая в ней эффективную концентрацию, а также обладает широким спектром действия и эффективен в отношении наиболее частых возбудителей кандидоза (C. albicans, C. parapsilosis, C. tropicalis и др.). Препарат характеризуется высокой биодоступностью при приеме внутрь (> 90 %) и длительным периодом полувыведения (около 30 часов). Применение флуконазола возможно у больных с нарушением функции почек, однако в таких случаях необходима соответствующая коррекция дозы препарата. Курс противогрибковой терапии при лечении кандидурии и кандидоза мочевых путей должен продолжаться 7–14 дней, при этом флуконазол назначается в дозе 3 мг/кг/сут (200 мг/сут) [2–9]. Следует отметить, что в настоящее время в практическое здравоохранение России внедрен и с успехом применяется генерический препарат флуконазола фирмы “Д-р Редди'с Лабораторис Лтд.” – Микофлюкан, отличающийся выгодным соотношением стоимости и эффективности при необходимом качестве.
В отсутствие эффекта от применения флуконазола при лечении кандидоза нижних мочевых путей оправданно использование амфотерицина В. Однако, несмотря на высокую активность данного препарата в отношении большинства представителей рода Candida, его концентрация в моче невысока. Кроме того, концентрация данного препарата в моче снижается при нарушении функции почек. Поэтому применение амфотерицина В показано только при тяжелых инфекциях, вызванных резистентными к флуконазолу возбудителями, например C. krusei, у больных без почечной недостаточности. Амфотерицин B в дозе от 0,3 до 1,0 мг/кг/сут применяют в течение 1–7 дней в виде внутривенных инфузий [2–6, 7, 9]. Липосомальные формы амфотерицина В используются при тяжелых инфекциях, обусловленных резистентными к флуконазолу возбудителями, и наличии противопоказаний к применению обычного амфотерицина В (почечная недостаточность, инфузионные реакции и др.) [2, 3, 6].
При кандидозе нижних мочевых путей также эффективно пероральное применение флуцитозина в дозе 25 мг/кг 4 раза в сутки, особенно если кандидоз вызван видами кандид, отличными от C. albicans. Однако его назначение может привести к формированию резистентности патогенных штаммов Candida. Кроме того, применение данного препарата противопоказано у больных со сниженной функцией почек [6, 7, 9].
Редкие грибковые инфекции мочевых путей
Обнаружение криптококков, аспергилл, а также возбудителей эндемичных микозов в моче происходит крайне редко. Наличие данных инфекций определяет неблагоприятный прогноз заболевания и сопровождается высокой летальностью.
Криптококковая и аспергиллезная инфекции мочевых путей могут возникать не только у пациентов с синдромом приобретенного иммунодефицита (СПИД), но и при других нарушениях иммунитета [11]. При этом возникают условия для гематогенной диссеминации возбудителя из первичных очагов поражения в другие органы и ткани, включая мочевые пути, почки и половые органы.
При системном криптококкозе криптококкурия может и быть ранним признаком менингита, и сопутствовать развернутой форме этого заболевания (30–40 %). Появление криптококков в моче может и не сопровождаться проявлениями системного поражения. Однако в этом случае необходимо проведение комплексного клинического обследования, направленного на поиск признаков системного и менингеального инфекционного процесса. Криптококкурия может протекать как в стертой форме, так и с более характерными клиническими симптомами пиелонефрита или простатита. Причем при криптококковом простатите симптомы заболевания отмечаются в основном при формировании абсцесса. Криптококковая ИМП неопределенной локализации или со стертой клинической картиной может быть проявлением диссеминированной формы заболевания. По данным аутопсии, в 26–57 % случаев диссеминированная криптококковая инфекция была связана с поражением почек [2].
Лечение симптоматической или бессимптомной криптококкурии требует системного подхода и применения противогрибковых препаратов в виде внутривенного амфотерицина В в дозе 0,7 мг/кг/сут или флуконазола в дозе 5–10 мг/кг/сут, при этом длительность терапии должна составлять 3–6 месяцев. Больным ВИЧ-инфекцией с поражением мочевых путей флуконазол назначают в дозе 200–400 мг/сут. При этом всем ВИЧ-инфицированным пациентам рекомендуется пожизненная антифунгальная терапия [2].
Для грибов Aspergillus spp. гематогенное распространение инфекционного процесса особенно характерно у больных сахарным диабетом и лейкозами, при этом возможно поражение паренхимы почек и почечной лоханки, а также уретры и мочевого пузыря [11]. Некроз почечных сосочков при аспергиллезном пиелонефрите, а также вовлечение в инфекционный процесс простаты могут привести к формированию “грибкового шара” – аспергиллемы. При этом показано хирургическое лечение, направленное на удаление абсцессов и аспергиллем, в сочетании с системной противогрибковой терапией [11]. Наиболее предпочтителен в данной ситуации амфотерицин В в дозе 1,0–1,5 мг/кг/сут, кроме того, могут использоваться липосомальные формы амфотерицина В в дозе 3–5 мг/кг/сут с повышением дозы до 6 мг/кг/сут. Длительность курса терапии окончательно не определена и зависит от времени исчезновения признаков инфекции Aspergillus spp. [8, 9, 11].
Наиболее частыми возбудителями грибковых инфекций нижних мочевых путей являются грибы рода Candida. При выявлении кандидурии необходима комплексная диагностика, направленная на исключение кандидоза мочевых путей. При подтверждении кандидозной инфекции нижних мочевых путей наиболее эффективным и безопасным препаратом в лечении данной категории больных продолжает оставаться флуконазол. Однако наличие некоторых, резистентных к флуконазолу, видов Candida определяет необходимость усовершенствования режимов его рационального применения.
Какие грибки могут вызвать инфекционные заболевания
Грибковые инфекции (микоз) мочевыводящих путей могут быть вызваны двумя типами грибков:
- Неинвазивными. Это те грибки, которые могут присутствовать в организме как часть нормальной микрофлоры и не вызывать инфекцию. Чаще всего это грибок Кандида (Candida). Даже если он обнаружен в моче, это не говорит о развитии инфекции, которая требует лечения. Симптомов в таком случае тоже не наблюдается. Грибок начинает активно размножаться только при условии, что в организме есть другие неполадки.
- Инвазивными. Их отличие от кандид заключается в том, что они не заселяют мочевыводящие пути. Это значит, что присутствие таких грибков в указанных органах само по себе уже говорит о развитии инфекции: диссеминированной (очагами) или системной (затрагивает все органы). Ее могут вызывать криптококки, аспергиллы, гистоплазмы, кокциодиоиды.
Каковы причины грибковых инфекций мочевых путей
Микоз мочевыводящих путей, вызванный как неивазивными, так и инвазивными грибками, развивается на фоне других проблем с этими органами. Причиной могут стать болезни мочевого тракта, ослабление иммунитета и прием антибактериальных препаратов. Нередко инфекцию вызывают одновременно бактерии и грибки. В список провоцирующих факторов входят:
- Нарушения в работе мочевыводящих путей: мочекаменная болезнь, заболевания предстательной железы, стороннее вмешательство вроде катетера в мочевом пузыре или мочеточнике, дренаж нефростомии.
- Ослабление иммунитета: недостаточное питание, хронические (с микозом часто сталкиваются люди с сахарным диабетом) и онкологические заболевания.
- Прием антибиотиков. Они могут вызывать микоз, поскольку уничтожают не только вредную, но и полезную микрофлору, которая у здорового человека обеспечивает защиту от заражения.
Грибок может попасть в кровь, и тогда возможно развитие разных микозов, включая кандидоз почек. При такой инфекции поражается паренхима — основная функционирующая ткань органов. На фоне этого в почках могут возникнуть многочисленные мелкие абсцессы.
Микоз мочевых путей — более редкое заболевание, чем бактериальная инфекция. Почти у всех пациентов он связан с перечисленными факторами риска. Особенно высокая вероятность столкнуться с микозом у тех, кто недавно перенес трансплантацию почки. Это связано с тем, что пациенту назначают антибиотики и иммуносупрессоры (угнетают иммунитет), а также введение мочевого катетера. Т. е. причина в том, что присутствуют сразу несколько факторов риска. Заражение через кровоток встречается в редких случаях.
Как проявляется микоз
О микозе идет речь, только когда грибки не просто присутствуют в общем анализе или посеве мочи, а вызывают воспаление. В таком случае появляются симптомы бактериальной инфекции, среди которых:
- боль внизу живота; ;
- боль и жжение в процессе мочеотделения;
- сильные позывы к мочеиспусканию.

Симптомы грибковой инфекции мочевыводящих путей у женщин и мужчин проявляются почти одинаково — в виде уретрита. Его характерный признак — выделение: у мужчин из мочеиспускательного канала, а у женщин дополнительно из влагалища. Если поражены почки, то появляется боль в пояснице, может быть лихорадка.
Как лечат микоз и к какому врачу обратиться
Лечение грибковой инфекции мочевыводящих путей осуществляется с помощью специальных антигрибковых препаратов. Их назначают только на основании анализа, который точно определяет, какой возбудитель вызвал воспаление. Но в ряде случаев не требуется принимать препараты. У некоторых пациентов просто удаляют катетер, и инфекция, если она протекает в легкой степени, проходит.
При появлении симптомов микоза необходимо обратиться к урологу. На сайте клиники урологии им. Р. М. Фронштейна ПМГМУ им. И.М. Сеченова можно записаться на прием к специалисту в удобное время. Диагностика и лечение проводятся по программе ОМС, поэтому от вас не потребуется оплата за консультацию и обследования. Если остались вопросы, позвоните нам по контактному номеру или напишите в онлайн-чате. Записаться на прием можно на сайте или связавшись с нами по телефону.
Акопян Гагик Нерсесович - врач уролог, онколог, д.м.н., врач высшей категории, профессор кафедры урологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова

Возбудители и причины, вызывающие микоз мочевых путей
Чаще всего микоз мочевого тракта вызывается кандидой. Грибы Candida могут также колонизировать мочевые пути, что означает, что они присутствуют, но не вызывают инфекцию. В таких случаях грибки обнаруживаются в моче, но признаков инфекции мочевыводящих путей нет, поэтому нет необходимости назначения противогрибковых препаратов.
Другие виды грибков, которые могут вызвать инфекцию мочевых путей: криптококк, аспергилл, гистоплазма, Blastomyces и кокцидиоиды. Эти грибы не колонизируют мочевые пути, и их присутствие в моче всегда означает инфекцию, которая требует лечения.
Микоз мочевого пузыря возникает исключительно при наличии патологии мочевого тракта, иммунодефицита или после лечения антибиотиками. Инфекция мочевыводящих путей может быть вызвана бактериями и грибами одновременно.
Важные факторы, способствующие развитию грибковой инфекции в мочеполовых путях:
- Нарушения со стороны мочевыводящих путей, способствующие появлению инфекции. Включают вмешательство катетером в мочевыводящие пути (катетер мочевого пузыря, дренаж нефростомии, мочеточниковый катетер), свищ мочевых путей, мочекаменную болезнь, заболевания простаты.
- Иммунодефицит. Может быть результатом хронических заболеваний (особенно часто встречаются грибковые инфекции у пациентов с диабетом), рака, иммунодепрессивного лечения, недоедания.
- Влияние антибактериальных препаратов. Грибковые инфекции обычно наблюдаются во время или после лечения антибиотиками, так как они уничтожают и полезную микрофлору, защищающую слизистые от инфицирования.
Результатом этой инфекции могут быть многочисленные мелкие абсцессы почек. Такая грибковая инфекция может возникнуть у людей с ослабленным иммунитетом и тяжелыми заболеваниями.
Насколько распространен микоз мочевого пузыря?
Грибковая инфекция мочевых путей встречается гораздо реже, чем бактериальная инфекция. Мочевой микоз редко встречается у людей без факторов риска, перечисленных выше.
Особенно уязвимы для инфекции мочевыводящих путей пациенты, перенесшие пересадку почки, поскольку в их случае активны сразу несколько неблагоприятных факторов: использование мочевых катетеров, иммунодепрессивное лечение и лечение антибиотиками.
Грибковое заражение почек путём кровотока встречается очень редко.
Симптомы грибковой инфекции мочевыводящих путей
В большинстве случаев, когда анализы (общий анализ мочи или посев мочи) показывают наличие грибов Candida в моче, признаков инфекции мочевыводящих путей нет. Это означает колонизацию мочевыводящих путей (мочеиспускательного канала, мочевого пузыря) грибами Candida, которые, однако, не вызывают воспаление.
Мы говорим о микозе мочевыводящих путей, только когда грибы вызывают воспаление. Это проявляется симптомами бактериальной инфекции мочевыводящих путей.
Грибковый цистит проявляется как дизурические расстройства:
- более частое мочеиспускание;
- срочность мочеиспускания;
- боль или жжение во время мочеиспускания;
- боль в нижней ч асти живота.

- У мужчины может быть грибковый уретрит, который проявляется как боль, жжение или зуд мочеиспускательного канала. Могут присутствовать выделения.
- У женщины симптомы уретрита обычно связаны с наличием грибкового вульвовагинита и соответствующих симптомов: выделения из влагалища, зуд, жжение, воспаление.
Грибковая инфекция почек, начавшаяся из-за проникновения инфекции через кровь, обычно развивается у пациентов в тяжелом клиническом состоянии из-за других заболеваний. Это может проявляться как лихорадка и снижение функции почек, выражающееся повышением уровня креатинина в крови.
Что делать в случае появления симптомов грибка мочевыводящих путей?
Появление симптомов инфекции мочевыводящих путей всегда является показанием к срочному назначению лечения.
Если образец мочи показывает наличие грибов Candida и нет симптомов, указывающих на инфекцию мочевыводящих путей или новое острое заболевание, также следует обратиться к врачу для оценки состояния.
Как врач определяет диагноз?
Микоз почек диагностируется, когда в крови присутствуют грибы (положительная культура крови) и имеются признаки повреждения почек (например, ухудшение функции почек).
Наличие благоприятных обстоятельств, таких как катетер мочевого пузыря или другой урологический катетер, лечение антибиотиками, диабет или иммунодефицит, подтверждает диагноз грибковой инфекции мочевыводящих путей.
Методы лечения микозной инфекции мочевыводящих путей
Лечение микоза включает в себя удаление факторов, способствующих развитию микоза, и использование противогрибковых средств.
Во многих случаях легкой инфекции мочевого пузыря грибами Candida у человека с катетером в мочевом пузыре достаточно удалить катетер.
Грибковая инфекция мочевыводящих путей лечится флуконазолом в течение примерно 2 недель, другие противогрибковые препараты используются редко.
Микоз почек называется системным микозом. Это угрожающая жизни и всегда требующая лечения патология. При этом заболевании противогрибковые препараты используются внутривенно в больших дозах. Лечение занимает до нескольких недель.

Внутривенное введение противогрибкового препарата
Можно ли полностью вылечить микоз мочевого пузыря?
Колонизация или легкая грибковая инфекция мочевых путей, связанная с мочевым катетером, обычно полностью исчезает после удаления катетера.
Также при более тяжелых грибковых инфекциях мочевыводящих путей полное выздоровление достигается после применения противогрибкового препарата и устранения таких факторов, как катетеры, камни, препятствия для оттока мочи и т. д.
Микоз почки означает тяжелую инфекцию, обычно у пациента с другими серьезными медицинскими проблемами, которые могут привести к различным осложнениям и даже смерти.
Нужно ли обследоваться после прекращения лечения микоза мочевого пузыря
После излечения инфекции мочевыводящих путей нет необходимости в периодических контрольных посевах мочи на наличие грибков, если инфекция мочевых путей была связана с временной катетеризацией мочевого пузыря, лечением антибиотиками или урологической хирургией.
У людей, у которых в анамнезе была колонизация или грибковая инфекция мочевыводящих путей, следует проводить посев мочи до запланированных урологических вмешательств в мочевыводящих путях (например, цистоскопия, резекция простаты), поскольку наличие бессимптомного кандидоза в этих ситуациях является показанием к применению противогрибкового препарата. Нужно обязательно устранить грибковую колонизацию перед операцией.
Как избежать заражения мочевыводящих путей?
Большинство грибковых инфекций связаны с введением и поддержанием катетеров и дренажей в мочевыводящих путях. Избегание ненужной катетеризации мочевого пузыря и недержание мочевого катетера дольше, чем это необходимо — наиболее эффективный способ предотвращения грибковой инфекции мочевыводящих путей.
Инфекции мочевыводящих путей — частое заболевание в повседневной урологической практике. Значительный прогресс в лечении инфекций мочевыводящих путей наблюдается за последние двадцать лет. В статье затрагиваются такие важные проблемы, как этиология, патогенез и лечение инфекций мочевыводящих путей у взрослых.
Инфекции мочевыводящих путей (ИМП) представляют собой серьезную проблему из-за их распространенности и связанной с ними заболеваемости. По статистике на них приходится примерно 20% всех внебольничных и примерно 50% нозокомиальных инфекций. Достижения последних десятилетий способствовали лучшему пониманию патогенеза инфекций мочевыводящих путей и выяснили важную роль как бактериальных, так и зависимых от пациентов факторов в развитии или предотвращении инфекции.
Динамичное развитие антибактериальной терапии значительно облегчило правильное лечение ИМП, но неправильное и широкое злоупотребление антибактериальными препаратами привело к увеличению лекарственной устойчивости микроорганизмов.
Эпидемиология ИМП
Инфекции мочевыводящих путей — одно из самых распространенных инфекционных заболеваний человека.
Частота возникновения ИМП зависит от пола и возраста обследуемых, а также от конкретных характеристик исследуемой популяции.
Риск ИМП возрастает, когда существует препятствие для оттока мочи или когда обстоятельства способствуют колонизации и росту бактерий. К физиологическим факторам, предрасполагающим к ИМП, относятся беременность, пожилой возраст и такие заболевания, как диабет и мочекаменная болезнь.
Этиология и патогенез ИМП
Наиболее частыми факторами, вызывающими ИМП, являются бактерии, реже вирусы, грибки или паразиты. Распространенность определенных типов бактерий, выделенных из мочи пациентов, во многом зависит от изучаемой популяции. Совершенно иначе обстоит дело у пациентов, находящихся на амбулаторном лечении, чем в больницах.
В физиологических условиях мочевыводящие пути стерильны, за исключением конца уретры. Первый эпизод ИМП в амбулаторных условиях в 80% случаев вызывается Escherichia coli, в 10-15% — Staphylococcus saprophyticus (кроме группы молодых сексуально активных женщин, в которой он составляет около 30%), другими грамотрицательными бактериями (Proteus mirabilis, Klebsiella spp.) или грамположительными (стафилококки, стрептококки, энтерококки). 70% рецидивов внебольничных инфекций вызваны к ишечной палочкой . Также наиболее частые нозокомиальные инфекции вызываются кишечной палочкой (около 50%), Enterobacter spp., Pseudomonas spp., Serratia marcescens, а также стафилококками, энтерококками и грибками.

Кишечная палочка
У 95% пациентов ИМП является результатом заражения одним штаммом бактерий. Заражение несколькими штаммами наблюдается у 5% пациентов, преимущественно у катетеризованных больных, с ослабленным иммунитетом, нейрогенными нарушениями мочевого пузыря или дефектами мочевыделительной системы.
Инфекция мочевыделительной системы может происходить восходящим путем (урогенные инфекции), кровотоком (гематогенные инфекции — очень редко вызваны, главным образом, золотистым стафилококком), лимфатическим путем или непрерывно (при наличии урогенитального или урогенитального свища).
ИМП почти всегда вызывается попаданием бактерий через уретру. В физиологических условиях бактерии часто попадают в мочевыводящие пути, однако из-за защитных механизмов организма развитие ИМП происходит редко.
Наиболее важные естественные механизмы защиты от ИМП:
- длина уретры у мужчин;
- перистальтика мочеточника, нормальная функция пузырно-мочеточниковых клапанов;
- подкисление и концентрация мочи;
- правильная бактериальная флора влагалища и области вокруг уретры;
- антибактериальные свойства секрета простаты;
- механизмы предотвращения бактериальной адгезии в мочевыводящих путях: механическое воздействие струи мочи, мукополисахариды стенки мочевого пузыря, антитела IgG и IgA.
Инфекции мочевыводящих путей редко возникают у здоровых людей с нормальной анатомической структурой и физиологической функцией мочевыводящих путей. В случае затрудненного оттока мочи или ослабления организма из-за системных заболеваний (диабет, подагра , опухолевый процесс) мы часто сталкиваемся с воспалительными изменениями мочевыделительной системы.

Подагра
К наиболее частым факторам, способствующим развитию инфекции мочевыводящих путей, относятся:
- 1-я беременность,
- старый возраст,
- препятствие оттоку мочи — мочекаменная болезнь, аденома простаты,
- атрогенные факторы — инструментарий мочевыводящих путей (цистоскопия, катетеризация мочевого пузыря, восходящая пиелография),
- врожденные пороки мочевыводящих путей — двойная чашечно-тазовая система, ретроградный пузырно-мочеточниковый отток,
- диабет, подагра,
- неврогенный мочевой пузырь,
- конечная стадия почечной недостаточности (диализ),
- половые отношения,
- длительная иммобилизация в постели.
Моча в мочевыводящих путях здорового человека стерильна. Наличие в нем бактерий свидетельствует об инфицировании.
Основным симптомом, позволяющим диагностировать ИМП, является так называемая значительная бактериурия, когда количество бактерий в 1 мл свежей, собранной в асептических условиях мочи превышает 100000.
Возникновение значительной бактериурии по полу и возрасту представлено ниже:
Среди половых заболеваний грибковые инфекции становятся все более распространенными. В настоящее время считаются основным этиологическим фактором таких патологий Candida albicans и другие виды рода Candida, реже встречаются плесневые грибы и Geotrichum.
Важную роль в распространении генитального микоза играют факторы окружающей среды:
- индустриализация;
- урбанизация;
- пренебрежение гигиеной;
- синтетическое белье;
- близкие контакты в бассейне, на пляжах и т.д.;
- сексуальные контакты с многочисленными партнерами.
Также влияние оказывают различные внешние факторы — антибиотики, стероиды, цитостатики и иммунодепрессанты, и внутренние — нарушение иммунных механизмов, генетическая предрасположенность, злокачественные опухоли, диабет, атопический диатез.
Развитие полового микоза зависит от количества клеток атакующего гриба и его вирулентности, то есть способности размножаться и прилипать к эпителию и продуцируемым протеолитическим ферментам, фосфолипазе и токсическим метаболитам. Также важна способность преодолевать сапрофитную бактериальную флору благодаря грибковым β-лактамным антибиотикам, которые являются производными фуцидиновой кислоты и стрептомицина.
Грибковые инфекции у женщин: грибковый вульвовагинит
В настоящее время считается что грибковый вульвовагинит является причиной воспаления этого органа в 40%. Патология относится к наиболее часто диагностируемым микозам от возраста новорожденного до поздней старости. Инфекция может затрагивать только влагалище, но в большинстве случаев протекает вместе с вульвитом.
У новорожденных болезнь начинается с перинатальной инфекции, поражающей половые органы и рот. В дальнейшие периоды развития ребенка, вплоть до полового созревания, болезнь имеет характер острого воспаления, реже хронического, а у девочек после 10–12 лет напоминает микоз у женщин. У детей наиболее распространенным возбудителем является Candida albicans.
У женщин грибковый вульвовагинит имеет следующие формы, связанные с различными патогенами. К ним относятся:
- пенициллез;
- аспергиллез;
- кандидоз;
- геотрихоз.
Пенициллез, аспергиллез и геотрихоз имеют меньшее клиническое значение, и поэтому их описание было опущено. Тем более что в клиническом течении этих инфекций имеется много схожих симптомов, и различить патологии можно только с помощью детального микологического исследования.
Поэтому в статье более подробно обсуждаются инфекции вульвы и влагалища, вызванные дрожжеподобными грибами (вульвовагинит Candida mycetica). С медицинской точки зрения, в настоящее время считаются патогенными по крайней мере 12 видов грибов Candida.

Вульвовагинит
Среди дрожжеподобных грибов, обнаруженных во влагалище, наиболее распространенным патогеном является C. albicans (около 70%). Другие виды также являются потенциальной причиной вульвовагинита: C. glabrata, C. krusei, C. kefyr (C. pseudotropicalis), C. parapsilosis, C. tropicalis, C. stelatoidea, C. guilliermondi, C. zeylanoides, C. famata, C. incospicua, C. lusitaniae, C. macedoninsis, C. rugosa, C. viswanathii.
Вульвовагинальный кандидоз часто встречается у беременных. Болезнь диагностируется примерно у 10% женщин в первом триместре и 23-55% во время третьего триместра беременности. Вульвовагинальные грибковые инфекции чаще встречаются (до 90%) у беременных женщин, которые были носителями C. albicans.
Также увеличивает риск развития вульвовагинального кандидоза диабет. Рецидивирующая генитальная молочница часто может быть первым важным симптомом этого заболевания. Вагинальные заболевания распространены у девочек с диабетом, и 2/3 из них имеют одинаковую бактериальную флору в области вульвы и заднего прохода.
У многих женщин генитальная молочница развивается при приеме антибиотиков, особенно обладающих широким спектром активности.
Развитию кандидоза способствует использование иммунодепрессантов, в основном, у людей с неэффективной иммунной системой. Прежде всего опасно нарушение клеточного иммунитета, которое касается как CD4, CD8, так и медиаторов их активности, то есть лимфокинов и интерлейкинов.
Большинство ученых в настоящее время указывают на повышенный риск развития вульвовагинального кандидоза у женщин, использующих гормональную контрацепцию.
Начало вульвовагинального кандидоза обычно бывает внезапным. Первые симптомы обычно появляются перед менструацией. Их интенсивность может варьироваться — от легкой до очень тяжелой формы. При острой инфекции возникают зуд, жжение и болезненность вульвы, особенно во время и после полового акта, а также жжение вокруг заднего прохода и болезненное мочеиспускание.
- отек и покраснение стенок влагалища с эпителиальными трещинами;
- пятна или папулы на поверхности слизистой оболочки вульвы, влагалища и влагалищного отдела шейки матки;
- диффузные или единичные эрозии в своде влагалища;
- папулезные гнойничковые воспаления ануса,
- изменение цвета кожи на половых губах, внутренних поверхностях бедер и промежности;
- густые белые или кремовые выделения, иногда прозрачные, водянистые выделения.
При хронических инфекциях вульвы и влагалища дрожжевые выделения из влагалища разной степени выраженности возникают периодически. Иногда возникает зуд и жжение вульвы или влагалища, особенно до или после менструации. Физикальное обследование указывает на наличие обильного, плотного, белого, гнойного или сыроподобного отделяемого.
Примерно у 30% женщин вульвовагинальный кандидоз может протекать бессимптомно, иногда единственным симптомом является слабый зуд, ощущаемый некоторыми пациентками перед менструацией.
Заболевание может быть спорадической инфекцией, оно также может быть рецидивирующим.
Осложнения кандидоза вульвы и влагалища:
- воспаление влагалищной части матки (cervitis Candida mycetica);
- проктит (proctitis Кандида mycetica);
- опрелости в промежности (опрелости Кандида mycetica perinei);
- кандидоз мочевыделительной системы;
- изменения и гиперплазия вульвы и шейки матки, напоминающие бородавки.
Дифференциальный диагноз в первую очередь касается бактериального воспаления — трихомониаза, гонореи и хламидийной инфекции, а также постменопаузального вагинита и выделений из влагалища, вызванных инородными телами, химическими раздражителями.
Диагноз кандидоз половых органов устанавливается на основании анализов (преимущественно микологических) и после исключения других причин вульвовагинита. Диагноз, основанный только на клинических признаках заболевания, неверен.
Микологическая диагностика состоит из изучения выделений в 10%-ном растворе гидроксида калия (KOH), окрашивания мазка с использованием метода Грама и PAS и на культуре (агаровая среда Сабуро, агаровая среда Никерсона-Манковского, рисовый агар, солод, кофейный агар, рисовый агар с добавлением твина 80), а также выполнение теста на миколин.
Лечение состоит из применения противогрибковых средств. Терапия может быть местной, общей или комбинированной — общей и местной.
Актуальные методы лечения включают применение противогрибковых препаратов в различных формах: таблетки, диски, тампоны, гель и кремы. Хорошие результаты дает натамицин (пимафуцин) 1 раз в сутки влагалищная свеч а и 100 мг в течение 3 или 6 дней. Более эффективны производные азола 1-го и 3-го поколения.

Противогрибковые свечи
Первое поколение включает в себя:
- клотримазол (1%, 2%, 5% вагинальный крем, вагинальные таблетки 100 мг, 200 мг, 300 мг, 500 мг);
- миконазол (вагинальный гель, шарики 100 мг, 200 мг, 400 мг и 1,2 нитрата миконазола);
- эконазол (1% крем, вагинальные шарики 50 мг и 150 мг);
- изоконазол (300 мг свечи);
- бутоконазол (2% вагинальный крем).
Представители третьего поколения:
- итраконазол (влагалищные шарики 80 мг);
- тирозол 3 (шарики по 80 мг),
- тирозол (0,4% и 0,8% влагалищный крем).
Продолжительность лечения производными азола варьируется от двухнедельного лечения до одного приема.
Общее лечение включает использование азольных производных второго и третьего поколений. Производным второго поколения является кетоконазол, вводимый в дозе 400 мг в течение 7-14 дней.
Производные третьего поколения — итраконазол и флуконазол. Итраконазол, доступный в настоящее время под названием Орунгал, рекомендуется в дозе 200 мг в течение 3 дней или 100 мг в течение 4-8 дней. Прием Орунгала 200 мг один раз в месяц в течение полугода защищает от рецидивов. Флуконазол (Дифлюкан) назначается в разовой дозе 150 мг.
Итраконазол и флуконазол не следует применять беременным и кормящим женщинам.
При комбинированном общем и местном лечении пероральные противогрибковые препараты вводят локально и одновременно принимают внутрь.
В случае рецидивирующей вульвовагиновой молочницы необходимо устранить предрасполагающие факторы. Некоторые специалисты рекомендуют одновременное лечение половых партнеров и пероральное применение антимикотиков у пациентов для предотвращения желудочно-кишечной реинфекции у пациентов.
Грибковые половые инфекции у мужчин: дрожжевая инфекция головки и крайней плоти (баланит, микотический баланопостит)
Генитальный микоз у мужчин обычно проявляется в виде воспаления головки (баланит) или воспаления головки и крайней плоти (баланопостит). Реже поражаются мочеиспускательный канал и верхние отделы мочевыводящих путей, предстательная железа, семенные пузырьки и придатки яичка.
Возбудителем заболевания чаще всего является дрожжеподобный гриб C. albicans , иногда C. tropicalis или другие виды рода Candida.

Дрожжеподобный гриб C. albicans
Грибы поражают в основном людей, страдающих ожирением, пожилых мужчин и людей с диабетом и фимозом. Предрасполагающими факторами являются:
- влажная среда внутри мешка крайней плоти;
- отсутствие личной гигиены;
- недостаточное высыхание головки и крайней плоти после мытья;
- дрожжевой вульвовагинит у половых партнеров.
Морфотическая картина изменений очень разнообразна, поэтому часто используется классификация, учитывающая множественность и различную степень изменений, а также различную интенсивность воспалительного процесса.
I Простая, неосложненная форма
- эритематозно-эрозивная разновидность (varietas erythematous — erosiva);
- эритематозно-эрозивная разновидность с белым налетом (varietas pseudo membranacea);
- гирлянда (varietas gyrata);
- герпетиформный вид (varietas herpetiformis).
- Подострая (subacuta): папулопустулярная (папулопустулезная).
- Хроническая: эритематозная эксфолиативный вид (erythematosquamosa).
II Сложная форма с одновременным поражением мочеиспускательного канала, верхних отделов мочевыводящих путей, предстательной железы, семенных пузырьков, придатка яичка, кожи половых органов и перигенитальной области.
Дрожжевые инфекции мужских мочеполовых органов обычно возникают в области головки и крайней плоти, гораздо реже при уретрите. Молочница уретры имеет признаки хронического или подострого вида. Симптомы заболевания включают в себя наличие в целом скудных, менее обильных, слизистых, белых и иногда желтых выделений, а также покраснение и отек наружной уретры.
Дифференциальный диагноз должен учитывать:
- неспецифическое воспаление головки;
- воспаление эпителиальных клеток;
- кольцевое эрозивное воспаление;
- псориаз;
- эритроплазию.
Диагноз может быть установлен только на основании микологического и микроскопического исследования.
Лечение должно основываться прежде всего на тщательных гигиенических процедурах с очисткой и сушкой области крайней плоти. Рекомендуются кремы , содержащие нистатин (100 000 МЕ в 1 г среды), амфотерицин В (фунгизон), натамицин (пимафуцин).

Лечение грибковых половых инфекций у мужчин
В рефрактерных случаях или при сложных формах с осложнениями следует начинать комбинированную терапию, как при дрожжевой инфекции вульвы и влагалища, с предпочтением в общей терапии производных азола третьего поколения и при длительном применении. Эффективен Итраконазол в дозе 100 мг в сутки в течение 4-6 дней до 12 недель.
При кандидозе уретры назначается местное лечение амфотерицином В в виде 1-процентной инстилляции в количестве 4-6 процедур.
Любые генитальные поражения воспалительного, острого или хронического характера всегда должны диагностироваться на наличие грибковой инфекции. Желательно, чтобы для установления правильного диагноза было проведено микологическое обследование. Обнаружение патогенного гриба позволит использовать правильную терапию и эффективное лечение заболевания.
Большое значение имеет определение предрасполагающих факторов и их устранение, особенно в случаях повторного течения. Также важны профилактические действия.
Читайте также:

