Что такое персистирующий инфекционный процесс
Обновлено: 26.04.2024
Рецидивирующая инфекция мочевых путей — одно из ключевых звеньев рецидива инфекционного воспалительного процесса в стенке мочевого пузыря. Оценена эффективность противорецидивного лечения с применением рекомбинантного интерферона альфа 2b.
Recurrent infections of urinary tract — one of key elements for recurrence of the infectious-inflammatory process in wall of the bladder. Effectiveness of therapy using recombinant interferon ?2b was studied.
Рецидивирующая инфекция мочевых путей у женщин представляет собой важную социально-экономическую проблему [1–3].
Персистенция микроорганизмов — одно из ключевых звеньев рецидива инфекционно-воспалительного процесса в стенке мочевого пузыря. Данное обстоятельство обусловлено ростом резистентности микроорганизмов к традиционно используемым антибактериальным препаратам. Даже после полной эрадикации микроорганизмов из просвета мочевых путей инфекция способна сохраняться и персистировать в стенке мочевого пузыря (МП), в последующем вызывая рецидив инфекции нижних мочевых путей (ИНМП) [2]. В большинстве случаев рецидивирующая ИНМП обусловлена бактериальной микст-инфекцией. Длительный инфекционно-воспалительный процесс стенки мочевого пузыря может приводить к развитию гипоксии и ишемии уротелия с последующим нарушением проницаемости гликозаминогликанового (ГАГ) слоя слизистой МП. Этот слой представляет собой уникальный, тонкий, главный защитный слой, препятствующий проникновению патогенных бактерий в стенку МП, за счет значительной фагоцитарной активности, а также способности к синтезу и секреции специфических мукополисахаридов, образующих защитный слой [4] (рис. 1).
.jpg)
Кроме того, многие патогены, ответственные за развитие острого инфекционно-воспалительного процесса в мочевых путях, имеют происхождение из эндогенных очагов, в частности, из микрофлоры кишечника, влагалища и др., и, гематогенным путем проникая в мочевой пузырь, при определенных условиях способны вновь вызывать рецидив воспаления. Нарушенная проницаемость ГАГ-слоя слизистой МП, с нарушением различных звеньев местной иммунологической защиты: синтез лактоферрина, лизоцима, и т. п., является оптимальным условием для этого. В сложившейся ситуации проводимая антибактериальная терапия не всегда эффективна, а иногда необоснованность и нерациональность данной терапии являются дополнительными факторами, приводящими к хронизации инфекционно-воспалительного процесса и дисфункции иммунорегуляторных механизмов [5, 6]. Поэтому лечение персистирующей инфекции мочевых путей (ПИМП) у женщин является сложной задачей. В связи с чем в последние годы стали актуальны альтернативные методы лечения, среди которых наиболее признаются иммунотропные препараты [1, 7, 8].
Среди иммунокорригирующих препаратов для лечения и профилактики ПИМП часто обсуждаемыми направлениями стали использование интерферонотерапии для повышения специфической и неспецифической иммунной защиты макроорганизма, а также использование иммунотерапии [1, 7, 8].
К преимуществам использования интерферона в лечении ПИМП относится избирательное воздействие на несостоятельные функции иммунной системы, не влияющее на нормальные ее показатели. Включение интерферона в комплексное лечение инфекций мочевой системы обусловлено тем, что персистирующая бактериальная инфекция повреждает клетки уроэпителия и препятствует синтезу собственных интерферонов [1]. Из трех идентифицированных видов интерферона человека — интерферон альфа, бета и гамма — в терапии латентных форм ИНМП используются препараты интерферона альфа [8]. Среди них наиболее известен препарат Виферон®, комплексный препарат, содержащий интерферон альфа 2b, токоферола ацетат и аскорбиновую кислоту. Он оказывает противовирусное, иммуномодулирующее, антипролиферативное и антибактериальное действие.
Токоферол и аскорбиновая кислота, являясь компонентами антиоксидантной системы, оказывают мембран-стабилизирующее действие, способствуют регенерации тканей, улучшают тканевое дыхание, тем самым снижая процессы воспаления в стенке мочевого пузыря при нарушенной проницаемости его мукополисахаридной субстанции. Данные обстоятельства позволяют использовать Виферон® как при нарушении проницаемости ГАГ-слоя слизистой мочевого пузыря, когда необходима антиоксидантная и регенеративная активность для снижения инфекционно-воспалительного процесса в стенке МП, так и при нарушении иммунорегуляторных механизмов защиты, нарушенных вследствие воздействия различных этиологических факторов ПИНМП [1].
Материалы и методы исследования
В исследование включены 43 женщины с ПИНМП, средний возраст составлял 39,5 ± 1,2 года. Средняя длительность заболевания 6,5 года. Критерии включения: наличие симптомов ИНМП, тяжелое рецидивирующее течение, отсутствие анатомических и функциональных нарушений мочевых путей, этиологическая причастность Е. coli > 10 4 КОЕ/мл, отсутствие вирусных патогенов в этиологической структуре, чувствительность микроорганизма к фосфомицину при бактериологическом исследовании мочи. Обследование пациенток основывалось на данных клинико-лабораторных исследований: общеклинических и культуральных исследований мочи, молекулярно-биологического исследования (ПЦР — полимеразная цепная реакция), мазков из уретры, цистоскопии с биопсией с молекулярно-биологическим и морфологическим исследованием биоптатов по показаниям, консультации гинеколога и ультразвукового исследования с целью исключения анатомо-функциональных нарушений мочевых путей и репродуктивных органов. Культуральное исследование мочи и определение степени бактериурии проводили по общепринятым методикам, используя аэробную и анаэробную техники культивирования. Идентификацию выделенных штаммов микроорганизмов осуществляли по морфологическим, тинкториальным, культуральным, биохимическим свойствам. Чувствительность выделенных микроорганизмов определяли к 36 антибактериальным препаратам. Для анализа интенсивности и выраженности боли мы использовали визуальную аналоговую шкалу (ВАШ), предлагали оценить пациенткам интенсивность болей по 5-балльной системе: 4 — очень интенсивные боли, 3 — интенсивные, 2 — умеренные, 1 — слабо выраженные, 0 — отсутствие болей.
В зависимости от проводимой терапии пациентки разделены на две группы: пациентки 1-й группы (n = 20) получали только антибактериальную терапию в объеме: Фосфомицина триметамол 3 г, через каждые 10 дней, в течение трех месяцев (5), а 2-й группы (n = 23) — терапию Фосфомицином трометамолом в той же дозировке в сочетании с препаратом Виферон® (суппозитории ректальные). Виферон® (рекомбинантный интерферон альфа 2b в сочетании с антиоксидантами) назначали по 1 000 000 МЕ per rectum 2 раза в сутки, с интервалом 12 часов в течение 20 дней.
Группы пациенток были сопоставимы по возрасту, длительности заболевания, этиологической структуре (табл. 1).
Результаты
При оценке исходных данных между группами не было выявлено статистически значимых различий ни по одному из исходных симптомов. У всех обследованных женщин в обеих группах регистрировали болевой синдром и учащенное мочеиспускание (табл. 2).
Средний уровень инфицированности мочи при культуральном исследовании в обеих группах составил Lg 5,0 КОЕ/мл.
По степени интенсивности и выраженности болевого синдрома обе группы обследованных пациенток были равноценны. У большей части пациенток сумма баллов по шкале ВАШ обеих групп составляла 3 балла (рис. 2).
Учитывая наличие рецидивирующего процесса и неэффективность проводимой прежде антибактериальной и противовоспалительной терапии, 15 пациенткам (7 из 1-й группы и 8 из 2-й группы) с целью исключения вирусного или иного патологического процесса мочевого пузыря выполняли цистоскопию с биопсией мочевого пузыря. Визуально эндоскопическая картина характеризовалась поверхностными сосудистыми изменениями стенки МП, характер изменений зависел от степени разворачивающейся воспалительной реакции. Биопсийный материал исследовался молекулярно-биологически и морфологически (при выявлении вирусных агентов пациентки были исключены из исследования на этапе критериев включения). При гистоморфологическом анализе — выраженная воспалительная реакция: отек и полнокровие уротелия, что в последующем приводит к нарушению проницаемости. Кроме того, местами отмечается десквамация и реактивные изменения уротелия и нарушение проницаемости ГАГ-слоя (рис. 3).
.jpg)
Нарушение проницаемости ГАГ-слоя, в частности нарушение плотных контактов зонтичных клеток, которые составляют верхние слои уротелия, сообща выполняя работу по поддержанию герметичности поверхности эпителия, привело к нарушению функционирования одного из главных защитных механизмов слизистой оболочки МП. Кроме того, в стенке мочевого пузыря при морфологическом исследовании большинства пациенток отмечалась выраженная лимфогистиоцитарная инфильтрация, характер которой зависел от факторов патогенности инициирующего воспаление в стенке МП микроорганизма (рис. 4).
Эффективность терапии оценивали через 1 и 12 месяцев после ее завершения. Через 1 месяц положительная динамика с нормализацией клинических и лабораторных показателей отмечена у всех пациенток в обеих группах. Однако при клинико-лабораторной оценке через 12 месяцев боль при мочеиспускании сохранялась в 1-й группе у 25% пациенток, а боль в надлонной области у 10% пациенток. Во 2-й группе болевой синдром при мочеиспускании не отмечен ни у одной пациентки, боль в надлонной области в 4,3% случаев. Учащенное мочеиспускание выявлено в 1-й и во 2-й группах в 30% и 8,6% случаев соответственно (рис. 5).
Лейкоцитурию регистрировали у пациенток 1-й группы в 40% случаев, а во 2-й группе — в 8,6% наблюдений (рис. 6).
Через 12 месяцев при контрольном культуральном исследовании мочи E. coli в 1-й группе обнаруживали у 8 пациенток, а во 2-й группе только у 3 пациенток, средний уровень обсемененности мочи в 1-й группе составил 10 3 КОЕ/мл, а во 2-й группе 10 2 КОЕ/мл.
Персистирующая ИНМП является распространенным и трудноизлечимым заболеванием у женщин вследствие многогранности патогенеза заболевания. Поиск путей лечения требует понимания всех механизмов патогенеза ИМП, роли макроорганизма и бактериальных факторов. Только понимая этапы персистенции микроорганизмов, мы можем улучшить эффективность лечения и профилактики ПИНМП. Целью данного исследования было определить эффективность комбинированной терапии, сочетающей антибактериальный препарат и препарат интерферона, в лечении хронических и персистирующих ИНМП, которые плохо поддаются монотерапии антибактериальными препаратами.
Когорта пациенток, которую оценивали в этом исследовании, была сложной, т. к. они многократно применяли антибактериальную терапию и имели тяжелую супрессию иммунологических механизмов защиты уроэпителия слизистой мочевого пузыря. Кроме того, женщины неоднократно регистрировали ИНМП, доказанные культуральным исследованием с определением чувствительности к антибиотикам.
В ходе проведенного нами морфологического исследования была подтверждена важность концепции, свидетельствующей о вовлеченности нарушения целостности ГАГ-слоя в патогенезе инфекционно-воспалительного процесса в стенке МП. При нарушении проницаемости ГАГ-слоя МП теряет главный барьер против любого бактериального фактора, независимо от того, относится данный микроорганизм к нормальной микрофлоре урогенитального тракта или признается патогеном мочевых путей. При этом происходит взаимодействие рецепторов МП с рецепторами микроорганизма, позволяющее длительно персистировать бактериям в стенке мочевого пузыря даже при полной эрадикации микроорганизмов из мочи, что приводит к рецидиву заболевания. Так, через 12 месяцев после завершения терапии клинико-лабораторная эффективность во 2-й группе (с иммуномодулятором) составляет 91,4%, а в 1-й группе — 60% пациентов. Включение иммуномодулятора в комплексную терапию персистирующей инфекции мочевых путей способствовало сокращению частоты рецидивов в 1,5 раза и уменьшению числа пациенток с рецидивами в 4 раза. После полной эрадикации микроорганизмов из мочи через 1 месяц после окончания антибактериальной терапии в случае нарушения иммунных защитных механизмов происходит повторная активация инфекционно-воспалительного процесса мочевых путей персистирующими уропатогенами из стенки мочевого пузыря. Поэтому назначение только антибактериальных препаратов, а особенно тех, которые плохо проникают в ткани мочевого пузыря, не решает задачу лечения ПИНМП. Назначение иммуномодулирующей терапии оказалось эффективным в сочетании с антибактериальной терапией.
Выводы
Патогенез ПИНМП многогранен, характеризуется нарушением различных механизмов иммунологической защиты МП.
Виферон® (рекомбинантный интерферон альфа 2b в сочетании с антиоксидантами) в составе комплексной терапии ПИНМП, в сочетании с антибактериальной терапией позволяет нормализовать клинические и лабораторные признаки инфекционно-воспалительного процесса мочевого пузыря, а также снизить частоту рецидива ИНМП.
Виферон® может рассматриваться в качества лекарственного средства противорецидивного лечения ПИНМП.
Литература
- Ибишев Х. С. Целесообразность интерферонотерапии при рецидивирующей инфекции нижних мочевых путей // Лечащий Врач. 2013, № 12. С 88–91.
- Набока Ю. Л., Коган М. И., Васильева Л. И., Гудима И. А., Мирошниченко Е. А, Ибишев Х. С. Бактериальная микст-инфекция у женщин с хроническим рецидивирующим циститом // Журнал микробиологии, эпидемиологии и иммунобиологии. 2011; 1: 8–12.
- Набока Ю. Л., Гудима И. А., Мирошничнко Е. А., Коган М. И., Ибишев Х. С., Васильева Л. И. Этиологическая структура и антибиотикочувствительность уропатогенов при хронической рецидивирующей инфекции нижних мочевых путей // Урология. 2011. № 6. С. 12–16.
- Кульчавеня Е. В., Краснов В. А. Болезни мочевого пузыря. Новосибирск: Наука, 2012. 187 с.
- Лоран О. Б., Петров С. Б., Переверзев Т. С., Синякова Л. А., Винаров А. З., Косова И. В. Эффективность применения фосфомицина триметамола в лечении больных хроническим рецидивирующим циститом // Эффективная фармакотерапия в урологии. 2008. № 4. С. 2.
- Синякова Л. А., Косова И. В. Профилактика рецидивов инфекции мочевыводящих путей // Урология. 2009. № 2. С. 22–25.
- Кульчевеня Е. В., Бреусов А. А. Целесообразность индивидуального подхода к иммунопрофилактики рецидивов инфекций урогенитального тракта // Урология. 2013. № 6. С. 24–26.
- Шевяков М. А. Иммунотерапия инфекционно-воспалительных заболеваний мочевыводящих путей и ее эффективность // Урология. 2013. № 2. С. 98–102.
- Антимикробная терапия и профилактика инфекции почек, мочевыводящих путей и мужских половых органов. Российские национальные рекомендации. М., 2014. 64 с.
Х. С. Ибишев*, доктор медицинских наук, профессор
В. В. Малиновская**, доктор биологических наук, профессор
В. В. Парфенов**, кандидат медицинских наук
* ГБОУ ВПО РостГМУ МЗ РФ, Ростов-на-Дону
** ФГБУ НИИ ЭиМ им. Н. Ф. Гамалеи МЗ РФ, Москва
Персистирующая инфекция детей. Возбудители инфекций у детей
Своеобразной формой является персистирующая инфекция, характеризующаяся длительным пребыванием возбудителей (бактерий, вирусов, риккетский, микоплазм) в пораженном макроорганизме. Механизм развития персистирования инфекционного процесса еще не изучен. Однако получены убедительные данные о роли L-форм бактерий в этом процессе. В 1935 г. Е. Klieneberger открыла L-формы бактерий (названные так в честь Листсровского института, где работал автор). L-формы — результат изменчивости микробов, глубоких изменений их морфологических, биологических, вирулентных свойств, это варианты микробов, лишенных клеточной стенки. Выявлены L-формы стрептококков, стафилококков, некоторых сальмонелл, дифтерийной палочки и многих других. Роль их в патологии изучалась многими исследователями. Известно, что под влиянием лечения антибиотиками любые бактерии образуют резистентные L-формы.
При экзогенной инфекции возбудитель поступает в организм из внешней среды (от больного, носителя, животного, из воды, почвы и др.). Возникновение эндогенной, или аутоинфекции, происходит в результате нарушения защитных механизмов и снижения общей сопротивляемости организма.
С первого дня после рождения ребенок вступает в симбиоз с кишечной палочкой, стафилококком, молочнокислыми бактериями, вирусами, многие из которых обладают условной патогенностью, но при ослаблении организма ребенка приобретают патогенные свойства, вызывая аутоинфекцию. Последняя лежит в основе фурункулеза, ангины, аппендицита, холецистита, стоматита и др.

Инфекционные болезни могут быть вызваны двумя и более видами микроорганизмов. Такой вид инфекции называется смешанной, или сочетанной. Заражение может произойти одновременно двумя возбудителями, либо происходит присоединение к первоначальной, уже развившейся болезни. Возбудитель дополнительной инфекции может проникать в организм экзогенно или участвовать по механизму аутоинфекции. При присоединении одной инфекции к другой может произойти усиление заболевания (содружественное участие) либо снижение интенсивности и степени проявления (явление антагонизма). Очень часты, особенно в детском возрасте, смешанные вирусно-бактериальные инфекции, возможны также самые разнообразные ассоциации возбудителей.
Возбудителями инфекционных болезней являются бактерии, спирохеты, вирусы, риккетсии, микоплазмы, грибы. Болезни, вызываемые простейшими, гельминтами, насекомыми и клещами, относятся к инвазионным или паразитарным.
В процессе приспособления к условиям существования ряд микробов приобрел способность поражать только организм человека (антропонозы) пли определенные виды животных (зоонозы), от которых при ряде болезней может заразиться и человек (антропозоонозы).
Способность микроорганизмов размножаться в тканях организма и вызывать патологические изменения в них называется патогенностью. Последняя подвержена большим колебаниям в различных условиях. Степень патогенности микроба называется вирулентностью. Патогенность микроорганизмов связана с их инвазивностью, т. е. способностью проникать в естественных условиях заражения через кожные покровы и слизистые оболочки, а также внутрь органов и тканей, размножаться в них и противостоять защитным силам организма. Возбудители инфекционных заболеваний попадают в организм преимущественно через органы и ткани, граничащие с окружающей средой. Они обладают рядом механизмов, обеспечивающих преодоление естественных барьеров макроорганизма. К последним относятся: подвижность, агрессины, капсулярные факторы, выработка различных ферментов — гиалуронидазы, нейраминидазы, дезоксирибонуклеазы, муциназы, фибринолизина, коллагеназы и др.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
На уровне макроорганизма основные формы вирусных поражений принципиально не отличаются от таковых, наблюдаемых при инфицировании вирусами отдельных клеток.
Продуктивная вирусная инфекция с образованием дочерних популяций и характерными клиническими проявлениями возможна лишь при наличии в заражённом организме чувствительных клеток, в которых осуществляется репродуктивный цикл возбудителя. Например, возбудитель полиомиелита может реплицировать только в клетках ЖКТ и ЦНС приматов и человека.
Абортивная инфекция развивается при проникновении возбудителя в нечувствительные клетки (например, при попадании вируса лейкоза коров в организм человека) либо в клетки, не способные обеспечить полный репродуктивный цикл (например, находящиеся в стадии клеточного цикла G0). Способность клеток к поддержанию вирусспецифических репродуктивных процессов также подавляет ИФН, противовирусный эффект которого направлен против самых различных вирусов.

Персистирующая вирусная инфекция возникает при таком взаимодействии между вирусом и заражённой клеткой, когда в последней продолжается выполнение собственных клеточных функций. Если заражённые клетки делятся, образуется инфицированный клон. Таким образом, увеличение числа заражённых клеток способствует увеличению общей популяции возбудителя в организме. Тем не менее персистирующие вирусные инфекции обычно нарушают функции клеток, что в конце концов приводит к клиническим проявлениям. У человека развитие персисти-рующих инфекций в определённой степени зависит от возраста. Например, внутриутробное заражение вирусом коревой краснухи или цитомегаловирусом (ЦМВ) приводит к ограниченному по времени персистированию возбудителя. Появление симптоматики связано с возможностью плода развивать иммунные реакции на инфекционный агент.
Латентная (скрытая) вирусная инфекция. В то время как персистирующие инфекции сопровождаются постоянным высвобождением дочерних вирусных популяций, при латентных поражениях они образуются спорадически. Репродуктивный цикл подобных возбудителей резко замедляется на поздних стадиях и активируется под влиянием различных факторов. Латентные инфекции характерны для большинства герпесвирусов, вызывающих рецидивирующие и обычно не прогрессирующие заболевания.

Дремлющая (криптогенная) вирусная инфекция — форма проявления вирусной инфекции при которой возбудитель в неактивном состоянии находится в отдельных очагах (например, в нервных ганглиях). Клинически инфекция проявляется лишь при резком ослаблении защитных сил организма. Например, вирус герпеса 3 типа, вызывающий при первичном заражении ветряную оспу, пожизненно сохраняется в организме. Рецидив заболевания в форме опоясывающего лишая возможен лишь при нарушениях иммунного статуса (наиболее часто в пожилом возрасте).
Медленные вирусная инфекции характеризуются длительным инкубационным периодом (месяцы и годы), в течение которого возбудитель размножается, вызывая всё более явные повреждения тканей. Первоначально возбудитель размножается в ограниченной группе клеток, но постепенно инфицирует всё большее их число. Заболевания заканчиваются развитием тяжёлых поражений и смертью больного. К медленным вирусным инфекциям относят подострый склерозирующий панэнцефалит, ВИЧ-инфекцию и др.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Персистентные инфекции в легких. Латентная инфекция в легких.
В последнее десятилетие в центре внимания исследователей различного профиля находятся сложные формы воспаления, явно отступающие от общепринятых канонов острых защитных реакций и характеризуемые своеобразными дисбалансами иммуноглобулинов и цитокинов. Эти формы воспаления характерны, прежде всего, для вирусной персистенции. Персистенция (постоянство, упорство) - понятие достаточно широкое и неоднозначное, которое, по современным представлениям, включает в себя несколько подвариантов: персистентная, латентная, хроническая и медленная инфекции, а также бессимптомное вирусоносительство.
Персистентными называют инфекции, при которых вирус либо его антигены в течение продолжительного времени обнаруживаются в организме человека. Указанное пребывание сопровождается определенными специфическими иммунологическими сдвигами. Клинические проявления заболевания могут быть выраженными, слабыми либо маскироваться симптомами общего хронического заболевания (кашель, слабость, субфебрилитет, одышка и т.д.), что нередко наблюдается у больных с хронической обструктивной болезнью легких и бронхиолите с облитерацией при нерсистенции респираторно-синцитиального вируса.
Латентная инфекция - это практически пожизненная инфекция, при которой вирус (чаще герпес) находится в наиболее тесном взаимодействии с геномом клетки и пребывает преимущественно то в дефектной (ДНК-транскрипт), то в полной инфекционной форме, что соответствует ремиссии и обострению. Активация латентной инфекции происходит, как правило, под влиянии других инфекций (чаще грипп), переохлаждения, перегрева, солнечной радиации, психических травм и т.д.
Наиболее типичным примером хронической инфекции является инфекция, вызываемая аденовирусами. Для нее характерна частая смена клинических ремиссий и обострений, но относительно благоприятный прогноз при своевременном и правильном лечении.
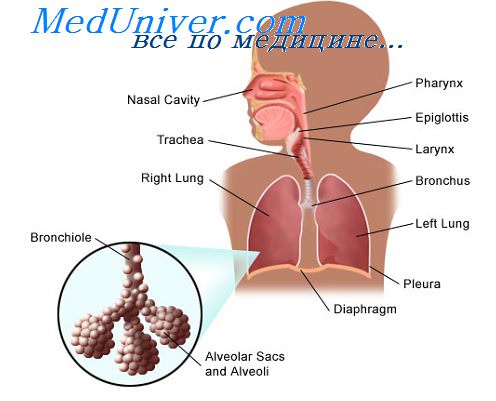
Медленная инфекция - имеет неизбежно летальный исход, характеризуется многомесячным или даже многолетним инкубационным периодом с последующим медленным, но неуклонным развитием симптомов заболевания (вирусы СПИД и спонгиозных энцефалитов).
Классификация вирусной персистенции весьма условна. При наличии отличительных свойств многие ее формы имеют общие черты: при всех вариантах весьма распространено формирование дефектных форм вируса, их тесное взаимодействие с геномом клетки-хозяина, чередование фаз обострения и клинической ремиссии. Вероятны переходы одной разновидности персистенция в другую, например персистентной инфекции в латентную или хроническую.
Как показали исследования, проведенные в Государственном научном центре пульмонологии (МЗ РФ), персистенция достаточно широко распространена не только при хронической, но и острой бронхолегочной патологии. При тяжелых полисегментарных пневмониях и острых абсцессах нередко отмечается замедленная элиминация респираторных вирусов и их компонентов из организма больного, что подтверждается и более длительными сроками образования специфических противовирусных иммуноглобулинов класса М и G. Персистенция сопровождается низкими показателями клеточного иммунитета (прежде всего Т-активные клетки), натуральной киллерной активности, всех видов интерферона. Иммуносупрессия, обусловленная вирусами, способствует более выраженной активации бактериальной флоры как аэробного, так и анаэробного плана.
При затяжных и рецидивирующих бронхитах, особенно с явлениями бронхоспазма, вирусы и вирусные компоненты удается обнаружить до 1,5-2 месяцев от начала заболевания. Их элиминация прямо коррелирует с исчезновением признаков воспаления бронхов.
При хронической обструктивной болезни легких и бронхиолите с явлениями облитерации у детей респираторно-синцитиальный вирус чрезвычайно часто выявляется как в период обострения, так и относительной клинической ремиссии.
У больных с ЛОР-патологией: аденоидитами, хроническими тонзиллитами и отитами основным персистирующим агентом является аденовирус. При одновременном наличии аденоидитов и шейных лимфоденитов чаще всего наблюдается ассоциация хронических аденовирусных и микоплазменных инфекций.
Особенности воспалительных реакций организма при вирусной персистенции чрезвычайно разнообразны, весьма вариабельны и зависят от громадного количества факторов, определяемых как макро-, так и микроорганизмами.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
На основании собственных многолетних данных произведен ретроспективный анализ особенностей динамики активной репликации персистирующих инфекций у детей. В статье описано, как изменяются показатели активной репликации геномов облигатных внутриклеточных пар
Based on our own multi-year data, a retrospective analysis of the dynamics of active replication of persistent infections in children was made. The article describes how the indicators of active replication genomes of obligate intracellular parasites and herpesviruses vary with age and seasonal changes.
Персистирующие инфекции могут являться причиной целого ряда заболеваний. Некоторые из них характеризуются тяжелым клиническим течением, особенно в раннем возрасте. В России, к сожалению, сохраняется высокий уровень детской инфекционной заболеваемости [1]. Известно, что в основном передача инфекции осуществляется в первые годы жизни человека, иногда — внутриутробно. Так, заражение герпес-вирусами человека 1–2, а также 4–6 типов в большинстве случаев реализуется в возрасте до двух лет. Источником инфекции чаще всего является ближайшее окружение ребенка, которое в первые два года его жизни представлено членами семьи и/или обслуживающим персоналом (няни, воспитатели и пр.). За последние пять лет увеличилось число детей в возрасте до одного года, умерших от генерализованных вирусных инфекций [2]. При этом, по данным литературы, у детей маркеры активной персистирующей инфекции выявляют чаще, чем у взрослых [3]. Одним из факторов, обусловливающих высокий уровень репликации инфекционных агентов, является незрелость иммунной системы в раннем возрасте [4]. Несмотря на обилие научных работ, посвященных проблеме персистирующих инфекций, вопрос особенностей динамики их активности остается открытым.
Объект и материалы исследования
Предметом анализа явились данные, полученные при обследовании детей и подростков, находившихся на стационарном лечении в клинике Московского НИИ педиатрии и детской хирургии (в последние годы — Обособленное структурное подразделение Научно-исследовательский клинический институт педиатрии им. акад. Ю. Е. Вельтищева ФГБОУ ВО РНИМУ им. Н. И. Пирогова) Минздрава РФ, и их родителей.
Проанализированы результаты обследования 1079 пациентов, из которых 1064 (98,6%) составили дети и подростки в возрасте от 2 месяцев до 17 лет и 15 (1,4%) взрослых в возрасте от 23 до 52 лет.
У каждого пациента одновременно исследовали от одного до трех образцов различных биологических материалов, всего 2051 образец. Из них осадков мочи — 877 (42,8%); буккальных соскобов — 104 (5,1%); объединенного материала, включающего осадок мочи и буккальный соскоб, — 901 (43,9%); крови — 169 (8,2%) (табл. 1).
Методы исследования
Оценивали активность репликации следующих микроорганизмов: Chlamydia trachomatis, Mycoplasma hominis, Ureaplasma urealyticum, цитомегаловирус, вирус Эпштейна–Барр, вирус простого герпеса 1–2 типов.
Среди пациентов девочки и женщины составили 56,7% от числа обследованных, мальчики и мужчины — 43,3%.
Возрастная характеристика пациентов отражена в табл. 2: возраст большинства пациентов составил от двух до 16 лет.
При определении периодов активной репликации персистирующих инфекций в зависимости от возраста фрагмент исследования включал данные, полученные при обследовании 876 пациентов.
Основным критерием отбора явилось одновременное исследование в материале не менее 3 инфекций (герпес-вирусов 4–6 типов и/или облигатных внутриклеточных паразитов). У каждого больного, соответственно, исследовали 3 или 6 инфекций. Такой подход позволил снизить избирательность выборки по той или иной инфекции.
Результаты исследования и их обсуждение
Выявлены следующие закономерности (рис. 1):
Отчетливая закономерность показана для цитомегаловируса: частота выявления ДНК в образцах стабильно снижается до 0 у обследованных взрослых, что можно рассматривать как доказательство зависимости активной репликации цитомегаловируса именно от зрелости иммунной системы (рис. 2).
Аналогичные, хотя и не столь четко выраженные изменения частоты активной репликации в зависимости от возраста можно проследить и для вирусов Эпштейна–Барр и вируса простого герпеса 1–2 типов.
Для ответа на вопрос, существуют ли сезонные изменения активности персистирующих инфекций, мы проанализировали частоту положительных проб в течение двух полных лет; был обследован 871 пациент.
Диаграмма отражает закономерности изменения количества положительных проб Chlamydia trachomatis, Mycoplasma hominis и Ureaplasma urealyticum в течение года (рис. 3).
Вопреки ожиданиям, наибольшая активность Chlamydia trachomatis приходится на период с апреля по июнь. Отмечаются существенные колебания показателя в первом полугодии с максимумом в июне и минимумом в марте и стабильно низкие показатели во втором полугодии.
Частота выявления ДНК Ureaplasma urealyticum крайне нестабильна с декабря по июнь, а в июле резко уменьшается и сохраняется на относительно низком уровне до ноября. В декабре значение показателя возрастает, достигая максимума. Таким образом, общим для исследованных внутриклеточных паразитов является нестабильность и более высокие значения показателя в первом полугодии (для Ureaplasma urealyticum — с декабря по июнь) и, напротив, относительно низкое и стабильное число положительных проб во втором полугодии. Не исключено, что снижение и стабилизация показателя в период с июля по декабрь вызвана улучшением метаболизма, а значит, и адаптивного иммунитета во второй половине лета и осенью.
Для персистирующих герпес-вирусов какой-либо четкой сезонной закономерности не выявлено, однако частота выявления ДНК вируса простого герпеса 1–2 типов стабильно повышается, в мае достигая максимума, а затем снижается к концу года до минимального значения (рис. 4).
Выводы
Проведенное нами исследование позволило сделать следующие выводы:
При исследовании сезонной активности всех облигатных внутриклеточных паразитов выявлена ее существенная вариативность в первом полугодии с максимумом в июне и относительное снижение и стабилизация во втором полугодии.
Литература
- Мазанкова Л. Н., Захарова И. Н. // Рос. вест. перинат. и педиатрии. 2010. № 5. С. 8–11.
- Лобзин Ю. В. Проблемы детских инфекций на современном этапе // Инфекционные болезни. 2009. № 2. С. 7–12.
- Учайкин В. Ф., Нисевич Н. И., Шамшева О. В. Инфекционные болезни и вакцинопрофилактика у детей. М.: ГЭОТАР-медиа. 2006. 688 с.
- Щеплягина Л. А., Круглова И. В. Возрастные особенности иммунитета у детей // РМЖ. № 23, 2009, с. 1564.
Е. И. Шабельникова 1 , кандидат медицинских наук
В. С. Сухоруков, доктор медицинских наук, профессор
Е. А. Ружицкая, кандидат медицинских наук
А. В. Семенов, кандидат медицинских наук
М. В. Кушнарева, доктор медицинских наук, профессор
ФГБОУ ВО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
Читайте также:

