Что такое сап инфекция
Обновлено: 25.04.2024
4362 11 Октября
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Сап: причины появления, симптомы, диагностика и способы лечения.
Определение
Странами, где можно встретить сап лошадей (эндемичными странами), официально считаются Иран и Бразилия. Кроме того, случаи заболевания животных регистрировались в Центральной и Южной Америке, на Ближнем и Среднем Востоке, в Азии, в том числе, в Монголии, Турции и Китае. В Российской Федерации вспышки сапа лошадей были отмечены в Читинской области в 2007 и 2013 годах.

Возбудитель заболевания относится к потенциальным агентам биотерроризма группы B за рубежом и к микроорганизмам II группы патогенности в России.
Причины появления сап
Источник инфекции для человека – животные (обычно лошади). Заражение происходит через выделения больного животного – носовой секрет, отделяемое кожных язв, реже - через содержимое кишечника, мочу, молоко. Основной путь инфицирования – контактный (80% случаев), человек заражается через кожу рук и ног, лица, шеи, реже – через слизистые оболочки верхних дыхательных путей и конъюнктиву глаз.
Сап – преимущественно профессиональная болезнь, которой болеют ветеринары, работники боен, зоотехники, наездники, кузнецы, конюхи. Заболеть сапом можно при работе с больным животным, при утилизации трупа, через инфицированные предметы. Описаны случаи заражения медицинских и ветеринарных работников в лабораториях (как правило, вследствие проникновения возбудителя через дыхательные пути).
Заражение человека от животных возможно в течение всего периода клинических проявлений болезни животного. Возможность передачи от человека к человеку вызывает сомнения.
Классификация заболевания
Сап имеет острое и хроническое течение. Хронический сап может принимать кожную, легочную или носовую форму.
Симптомы сап
В месте проникновения инфекции возникает воспалительный процесс с образованием очагов воспаления (гранулем), в которых содержится большое количество возбудителя. Оттуда с током крови и лимфы бактерии разносятся в другие органы и ткани с образованием новых очагов.
При остром течении заболевание приобретает форму септикопиемии - особой формы сепсиса, при которой в организме образуются гнойные метастатические очаги во внутренних органах и мышцах, суставах и костях. На коже и слизистых оболочках формируется гнойная сыпь. Распространяясь по бронхам и с током крови, возбудитель может попадать в легкие, где образуются мелкие узелки, сливающиеся в небольшие абсцессы. Возможно развитие мелкоочаговой или долевой пневмонии. Абсцессы также могут обнаруживаться в печени, почках, селезенке, миокарде, костном мозге, яичках.
Инкубационный период продолжается 1-5 дней, иногда до 3 недель. Заболевание протекает с выраженной интоксикацией, ознобом, слабостью, головной болью, болью в мышцах и суставах.
Температура повышается до 38,5-40оС, причем температурная кривая отличается значительным суточным размахом.
В месте проникновения инфекции возникает очаг рожистоподобной инфильтрации с узелком (папулой) красно-багрового цвета и зоной воспаления окружающей кожи. Далее папула превращается в образование с кровянистым содержимым, через 1-2 дня вскрывается и преобразуется в язву. Воспаляются регионарные лимфоузлы.
На 5-7-й день болезни температура может снизиться, но потом снова повышается до высоких значений, что говорит о генерализации инфекции. На коже, особенно на лице, слизистых оболочках, конъюнктиве глаз формируются множественные язвы. Из носа появляются слизисто-гнойные выделения. Распространение инфекции по организму с образованием множественных абсцессов приводит к боли в пораженных мышцах, особенно в икроножных.
При поражении легких пациент ощущает боль в груди, наблюдается кашель с отделением слизисто-кровянистой или гнойной мокроты. Возникают симптомы дыхательной недостаточности – одышка, цианоз (посинение кожных покровов). При прогрессировании заболевания в ряде случаев начинаются септические поносы, гнойные артриты, абсцессы в мышцах могут вскрываться с развитием свищей. В тяжелых случаях развивается сердечная недостаточность.
Хронический сап протекает медленно, с периодами обострений и ремиссий. Продолжительность болезни составляет от нескольких месяцев до трех лет. Заболевание может иметь кожную (самая частая), легочную или носовую форму. Кожный сап сопровождается формированием изъязвленных гнойничков, которые сливаются и, заживая, образовывают рубцы. Поражаются рядом расположенные лимфатические сосуды и лимфоузлы. Для легочной формы характерны повышенная температура тела, пневмония с вовлечением плевры и развитие абсцессов. При носовой форме основной патологический процесс протекает на слизистой оболочке носовых ходов, там образуются гнойники, которые изъязвляются, а потом распространяются на слизистые оболочки зева, гортани, трахеи.
Летальность при сап очень высокая: для острой формы без должного специфического лечения она достигает 95% (при антибиотикотерапии – 50%), для хронической формы - не менее 50%.
Диагностика сап
Диагноз ставится в результате клинического осмотра, на основании эпидемиологического анамнеза, установления факта контакта больного с резервуарами инфекции, а также после серологических, аллергологических, паталогоанатомических, биологических методов диагностики. Для постановки диагноза существенное значение имеет обнаружение в крови заболевшего специфических антител к Burkholderia mallei. В качестве альтернативного метода диагностики используют полимеразную цепную реакцию (ПЦР), позволяющую выявить ДНК бактерии и оценить их количество. Проводят также культуральные методы диагностики – бактерии, полученные из отделяемого язв, содержимого абсцессов, из мокроты, крови, высаживают на питательные среды, где наблюдают за их ростом и определяют чувствительность к антибиотикам. Проводится также проба с аллергеном – подкожно или на скарифицированную кожу вводят токсин Burkholderia mallei – малеин, диагноз подтверждается при развитии у больного через 24-48 часов аллергической реакции.
К каким врачам обращаться
Сап – это очень опасное заболевание с высокой летальностью. Заподозрить его может врач-терапевт , но требуется консультация инфекциониста, в ряде случаев кардиолога , а при лечении абсцессов – хирурга.
Лечение сап
Заболевание трудно поддается лечению. При любой его форме необходима госпитализация. Для лечения применяют антибактериальные препараты (сульфаниламиды), проводится вливание кристаллоидных и коллоидных растворов. В качестве симптоматической терапии назначают болеутоляющие, сердечно-сосудистые препараты. Абсцессы требуют хирургического вмешательства.
Течение сап может осложниться развитием пневмонии, острой сердечной недостаточности и септического шока.
Профилактика сап
В ветеринарно-санитарном отношении важное значение имеет постоянный ветеринарный надзор, обучение персонала животноводческих хозяйств правилам личной профилактики и гигиены.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Сап – тяжелое бактериальное заболевание септико-пиемического характера, вызываемое сапной палочкой – Burkholderia mallei. При сапе отмечается перемежающаяся лихорадка, лимфаденит, абсцессы мышц, абсцедирующая пневмония, гнойные артриты, остеомиелит, множественные гнойно-геморрагические пустулы на коже и слизистых оболочках, превращающиеся в сапные язвы. Диагноз сапа подтверждается микроскопическими, бактериологическими, серологическими исследованиями, постановкой биологической и кожно-аллергической проб. В лечении сапа применяются противомикробные и общеукрепляющие средства, хирургическое дренирование абсцессов.
МКБ-10
Общие сведения
Сап – опасная бактериальная инфекция, передающаяся человеку от непарнокопытных животных (главным образом, лошадей), сопровождающаяся гнойным поражением лимфатических узлов, кожи, мышц, легких и других внутренних органов. Ранее сап был распространен повсеместно, в настоящее время ареал инфекции сузился; отдельные случаи заболевания регистрируются только в некоторых странах Азии, Африки и Южной Америки. Заражение человека сапом встречается редко и в большинстве случаев связано с профессиональной деятельностью лиц, занятых коневодством (зоотехников, ветеринарных врачей, конюхов, наездников, кузнецов).

Причины сапа
Возбудителем сапа является неподвижная грамотрицательная палочка Burkholderia mallei, имеющая прямую или слегка изогнутую форму и характерное зернистое строение. Бактерия не имеет спор и жгутиков, выделяет эндотоксин маллеин. Палочка сапа развивается в интервале температур от 20 до 45˚C (оптимум - 37˚C), в почве и воде сохраняется до 1,5 мес., в выделениях из дыхательных путей и кожных элементов больных, в трупах животных – до нескольких недель. Возбудитель сапа чувствителен к нагреванию, действию ультрафиолета, средств дезинфекции.
Резервуаром и источником возбудителя сапа в природе являются больные непарнокопытные животные семейства лошадиных (лошади, ослы, лошаки, мулы, реже зебры), а также верблюды. Ослы болеют сапом в острой форме, лошади, обычно, в хронической. Сапом также могут заражаться хищники (львы, тигры, леопарды, рыси), поедающие мясо больных животных. Восприимчивость к инфекции у людей невысока. Заражение человека сапом происходит при непосредственном контакте с больными животными, утилизации сапных трупов, через вторично инфицированные окружающие предметы (сбрую, фураж, солому). Проникновение возбудителя сапа возможно аэрогенным путем (в лабораторных условиях), а также алиментарным путем. Передача сапа от человека к человеку маловероятна.
Симптомы сапа
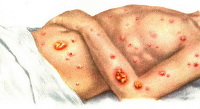
В месте внедрения палочки сапа на коже появляется папула багрово-красного цвета, которая быстро нагнаивается и вскрывается, обнажая серовато-грязную язву с сальным дном и отечными неровными краями. Кожа вокруг припухает, покрывается гнойничками, корками и омертвевшими тканями. Отмечается регионарный лимфаденит и лимфангит. На 5-7 день после кратковременного снижения температуры происходит генерализация инфекция по типу септикопиемии с повторной лихорадкой и резким ухудшением общего состояния больных. Гранулематозно-гнойный процесс с образованием мелких множественных абсцессов и очагов некроза распространяется на кожные покровы и внутренние органы, чаще легкие, а также мышцы, хрящи и кости.
На коже появляются полиморфные воспалительные высыпания (пятна, папулы, геморрагические везикулы, пустулы), окруженные инфильтратами, болезненными и горячими на ощупь, вскоре распадающимися и изъязвляющимися. Глубокие сапные язвы располагаются, в основном, на открытых участках тела (лице и конечностях) и содержат густой, тягучий гной зеленоватого цвета, иногда с примесью крови. При интраназальном проникновении возбудителя изъязвляющиеся гранулемы наиболее выражены на слизистой оболочке носа и сопровождаются обильными, слизисто-гнойными, зловонными выделениями грязно-красного цвета, которые засыхают корками вокруг ноздрей.
Поражение легких при сапе характеризуется образованием сапных узелков, абсцессов, развитием мелкоочаговой, абсцедирующей или сливной пневмонии с упорным глубоким кашлем, выделением слизисто-кровянисто-гнойной мокроты, болями в грудной клетке, одышкой. Могут возникать гнойные артриты (эмпиема суставов), остеомиелиты, септические поносы. Глубокие болезненные абсцессы в мышцах (особенно, икроножных) самопроизвольно вскрываются с образованием характерных свищей. Резко увеличивается селезенка. Острая форма сапа продолжается от 7 до 14 дней, быстро приводя смертельному исходу.
Хроническая форма сапа характеризуется медленным развитием и длительным (от нескольких месяцев до нескольких лет) течением с обострениями и ремиссиями. Отмечается интоксикация, перемежающаяся лихорадка, обширные, долго незаживающие язвы и множественные абсцессы холодного типа в подкожной клетчатке и мышцах (чаще конечностей), мигрирующая сливная пневмония с вовлечением плевры. Осложнениями сапа являются глубокие флегмоны, плевропневмония, бронхоэктазы, пневмосклероз, общий амилоидоз, гнойный менингит, кахексия.
Диагностика и лечение сапа
Диагноз сапа подтверждается специфическими клиническими признаками, обнаружением сапной палочки при микроскопии мазков, выделением и идентификацией культуры возбудителя при бакпосеве на питательные среды, положительными результатами серологических реакций (РСК, РА, РПГА), кожной аллергической и биологической проб. Клиническим материалом для исследований является гнойное отделяемое кожных язв, выделения из носа, мокрота, кровь, содержимое абсцессов, полученное при пункции лимфоузлов и подкожных гнойников, кусочки трупных тканей. С помощью бактериального посева материала на микрофлору при острой форме сапа определяется характерный рост культуры B.mallei в виде слизистого янтарно-коричневого налета, постепенно мутнеющего и приобретающего красноватый оттенок.
Биологическая проба, проведенная на самцах морских свинок, выявляет высокую патогенность палочки сапа для лабораторных животных и позволяет исследовать образцы различных органов и тканей. Со 2-3 недели заболевания проявляется положительная кожная аллергопроба с маллеином. Основным серологическим методом диагностики острого сапа является РСК, проведенная в динамике и определяющая нарастание титра специфических антител. Рентгенография грудной клетки при легочной форме сапа выявляет признаки мелкоочаговой или сливной пневмонии с затемнением доли легкого, а также очаговые тени и полости при абсцедировании легких. Сап необходимо дифференцировать от сепсиса, чумы, сибирской язвы, натуральной оспы, рожистого воспаления, сифилиса, абсцесса или туберкулеза легких, легочных микозов, мелиоидоза.
При сапе обязательна изоляция больного в инфекционный стационар. В качестве этиотропного лечения назначаются противомикробные препараты – сульфаниламиды (обычно, сульфатиазол) отдельно или в комбинации со стрептомицином, бензилпенициллином, аминогликозидами. Показаны витаминотерапия, переливание кровезаменителей, оксигенотерапия. Выполняется хирургическое дренирование образовавшихся абсцессов. Положительного эффекта в лечении сапа можно достичь с помощью подкожного или внутрикожного введения нарастающих доз глицериновой вытяжки из сапных бацилл. При септической форме сапа необходимы мероприятия интенсивной терапии, направленные на поддержание функции жизненно важных органов. Лечение легких случаев сапа продолжается не менее 30 дней, тяжелых - более длительно.
Прогноз и профилактика сапа
Прогноз сапа достаточно серьезный. Летальность при нелеченной острой форме приближается к 100%, при хронической наступает в половине и более случаев. Своевременно начатое лечение позволяет надеяться на более благоприятные перспективы. С целью профилактики сапа организуется ветеринарный контроль, раннее выявление и забой больных животных, соблюдение правил личной защиты при уходе за животными с подозрением на сап (ношение защитных комбинезонов, перчаток, масок, очков), дезинфекция мест содержания этих животных. Для лиц, бывших в контакте с больными, устанавливается 21-дневный карантин. Инфицированным, но еще не заболевшим сапом пациентам, производится экстренная профилактика сульфатиазолом.
Оппортунистические инфекции – это большая группа инфекционных заболеваний, которые развиваются у пациентов с различными типами иммунодефицитов и нехарактерны для людей с нормальным иммунным статусом. Патологии поражают любую систему органов и вызывают соответствующую симптоматику. К общим клиническим проявлениям относят длительный субфебрилитет, лимфаденопатию, астенический синдром. Диагностика оппортунистических инфекций включает серологические, молекулярно-генетические, бактериологические и другие методы детекции патогенных возбудителей. Программы лечения сочетают длительную этиотропную терапию с методами иммунокоррекции.
МКБ-10


Общие сведения
Проблема оппортунистических инфекций (ОПИ) становится все более актуальной, что вызвано ростом числа ВИЧ-инфицированных людей, разработкой эффективных, однако агрессивных методов лечения онкопатологии. При этом многие люди являются бессимптомными носителями возбудителей ОПИ: 60% инфицированы цитомегаловирусом, 90% – герпесвирусами 1 и 2 типов, около 30% – токсоплазмой. Учитывая клинический полиморфизм и отсутствие специфических симптомов, диагностика и лечение оппортунистических болезней представляет серьезную мультидисциплинарную проблему.

Причины
Для манифестации оппортунистических инфекций необходимо заражение патогенным микроорганизмом: вирусом, бактерией, грибком или простейшим. Известно более 20 типичных возбудителей ОПИ, в современной инфектологии этот перечень постоянно дополняется. Болезнь возникает при активации латентного очага, реже выступает следствием текущего заражения. Первостепенную важность играет нарушение иммунного статуса вследствие следующих патологий:
- ВИЧ-инфекция. Самая частая причина, поскольку на определенном этапе снижения числа CD4-клеток ОПИ развиваются у каждого больного. Инфекционные болезни используются для диагностики заражения ВИЧ и определения стадии заболевания, поэтому в данном контексте они называются СПИД-ассоциируемыми или СПИД-индикаторными патологиями.
- Злокачественные новообразования. Патофизиология любого опухолевого процесса предполагает угнетение собственной иммунной системы пациента и снижение ее ответа на чужеродные агенты. При этом уменьшается число Т-клеток, угнетаются процессы фагоцитоза. Проблема наиболее выражена при гемобластозах – лейкозах и лимфомах.
- Хроническая соматическая патология. Угнетение активности клеточного и гуморального иммунитета происходит при эндокринных заболеваниях (сахарный диабет, гипотиреоз), почечной недостаточности, тяжелых воспалительных патологиях ЖКТ.
- Ятрогенные факторы. Применение цитостатиков и других видов иммуносупрессоров является важным предиктором развития оппортунистических инфекций. Подобная ситуация наблюдается в группе пациентов после лучевой терапии, трансплантации органов и костного мозга.
- Первичные иммунодефициты. В эту группу относят все виды иммунной недостаточности, которые имеют генетический характер или возникают внутриутробно под влиянием тератогенов. Они манифестируют в раннем детском возрасте, проявляются затяжными оппортунистическими болезнями, которые с трудом подаются терапии.
Патогенез
Хотя возбудители оппортунистических инфекций таксономически неоднородны, в развитии заболеваний большую роль имеют общие особенности их патогенности и вирулентности. К свойствам микроорганизмов, вызывающих ОПИ, относят возможность длительного и даже пожизненного персистирования в организме человека, внутриклеточное паразитирование, склонность к поражению клеток моноцитарно-макрофагальной системы.
Инфекции активизируются при иммунодефицитах любой этиологии и склонны к хроническому течению с периодическими обострениями, поражением жизненно важных органов. Для оппортунистических болезней характерна лимфогенная и гематогенная диссеминация микроорганизмов, образование эктопических очагов. Собственный иммунитет пациента не способен оказать должное сопротивление инфекционному агенту, лекарственные средства не всегда эффективны.
Сложность и опасность оппортунистических инфекций заключается еще и в том, что они способны подавлять естественный иммунитет. В последние годы говорят о возможности пожизненной иммуносупрессии при персистировании герпесвирусов. Таким образом, формируется порочный круг, когда иммунодефицит провоцирует активацию возбудителей ОПИ, которые усугубляют явления иммунной недостаточности и потенциируют дальнейшие полиорганные нарушения.

Классификация
Единой систематизации оппортунистических инфекций на сегодня не существует. Условно возбудителей объединяют в 3 группы: патогены, которые поражают лиц с нарушениями иммунитета и здоровых людей; микробы, встречающиеся только при иммунодефицитах; вакцинные штаммы микроорганизмов. Общепринятой является классификация ОПИ согласно типу возбудителя:
Симптомы оппортунистических инфекций
В инфектологии выделяют общую группу клинических признаков, которая встречается при любом варианте ОПИ. Наиболее типичным симптомом признан длительный субфебрилитет, которые возникает без видимой причины и беспокоит пациента больше 1 месяца. Нередко повышение температуры возникает после перенесенного ОРВИ или кишечной инфекции, которые выступают пусковым фактором активации оппортунистического заболевания.
Вторым настораживающим симптомом считается лимфаденопатия – увеличение лимфатических улов. Чаще всего в процесс вовлекается лимфоидная ткань шейно-подчелюстной, подмышечной и паховой зоны. Лимфоузлы достигают диаметра около 1 см, имеют плотноэластическую консистенцию, не спаяны с окружающими тканями и безболезненны при ощупывании.
Третью группу общей симптоматики оппортунистических инфекций составляет астенический синдром. Он включает слабость, повышенную утомляемость, снижение переносимости умственных и физических нагрузок. Зачастую пациенты жалуются на ночную потливость, головокружения и головные боли, нарушения сна. При длительном существовании таких признаков наблюдается когнитивная дисфункция, эмоциональная подавленность, стойкое снижение работоспособности.
Пациента с иммуносупрессией должен насторожить кашель и одышка – типичные признаки туберкулеза и пневмоцистной пневмонии (ПЦП), снижение остроты зрения – возможное проявление цитомегаловирусного ретинита, длительно сохраняющаяся диарея – признак криптоспоридиоза, микроспоридиоза. Жжение и сухость полости рта в комбинации с эрозиями и белыми налетами на слизистых указывают на орофарингеальный кандидоз.
Оппортунистические болезни не имеют четко выраженного тропизма. Один и тот же вид возбудителя может вызывать миокардит, плеврит, артрит, менингит и другие нозологические формы. Зачастую они имитируют симптомы хронических соматических заболеваний, с которыми пациенты длительно и безрезультатно посещают врачей разных специальностей. Исключение составляет пневмоцистоз, который в основном поражает легкие с развитием ПЦП.
Осложнения
Оппортунистические инфекции – тяжелые и потенциально смертельные заболевания. Среди пациентов с терминальными стадиями ВИЧ-инфекции ОПИ составляют 90% в структуре летальности, оставшиеся 10% приходятся на саркому Капоши, лимфомы и прочие неинфекционные последствия СПИДа. Смертность при церебральном токсоплазмозе составляет около 33%, при криптококковом менингите – 20-30%, при пневмоцистной пневмонии – 10-20%.
Особую тревогу вызывает сочетание нескольких видов оппортунистических заболеваний у одного пациента. Микробные ассоциации более характерны для позднего периода и хронического течения основной патологии, вызвавшей иммунодефицит. Сочетанное инфицирование типично для иммунокомпрометированных пациентов, пребывающих на стационарном лечении: у 40-50% больных в послеоперационном периоде, у 70-80% при перитонитах и плевритах.
Распространение оппортунистических инфекций негативно сказывается на репродуктивном здоровье населения. Они обуславливают многие случаи самопроизвольного прерывания беременности, эмбриопатий и фетопатий, задержки внутриутробного развития. Дети, рожденные от матерей с ОПИ, находятся в группе риска развития заболеваний новорожденных, перинатальных энцефалопатий.

Диагностика
Обследование пациентов проводится мультидисциплинарной командой врачей, в которую входят врач-инфекционист, иммунолог, онколог и другие узкопрофильные специалисты. Большое клиническое значение имеет выяснения времени и условий появления симптоматики, характера течения заболевания, наличия факторов риска иммунодефицитных состояний. Для подтверждения оппортунистических инфекций проводятся следующие методы диагностики:
Лечение оппортунистических инфекций
В процессе лечения практикующие инфекционисты сталкиваются с такими нюансами, как множественная лекарственная устойчивость патогенов, гетерогенность популяции возбудителей, низкая активность естественных иммунных факторов. Основу терапии составляет прием этиотропных противомикробных препаратов: антибиотиков, антимикотиков, противопротозойных и противовирусных. Лечение ОПИ имеет ряд особенностей:
- в основном назначаются комбинации из 2-3 препаратов для повышения их эффективности;
- продолжительность противомикробной терапии повышается в 1,5-2 раза и более в сравнении с лечением инфекционных болезней у иммунокомпетентных лиц;
- при подборе терапии ориентируются не только на клиническую картину болезни, но и на текущий иммунный статус пациента;
- при вирусных инфекциях обязательно назначаются этиотропные препараты, тогда как у людей без иммуносупрессии противовирусные средства используют только по показаниям.
Для успешного лечения ОПИ требуется максимально возможное восстановление иммунной функции. В группе пациентов с ВИЧ-инфекцией назначаются протоколы антиретровирусной терапии (ВААРТ), чтобы повысить число CD4-клеток и улучшить отдаленные прогнозы. При ведении онкологических больных используются персональные схемы иммуномодуляторов, экспериментальные направления иммунотерапии и регенеративной медицины с применением стволовых клеток.
Прогноз и профилактика
Течение любой инфекции на фоне иммуносупрессии является сложным и непредсказуемым, однако усовершенствованные протоколы лечения позволяют достичь стойкой ремиссии или даже полного излечения. К прогностически неблагоприятным факторам относят пожилой и старческий возраст, неправильно подобранную терапию, невозможность проведения иммунокоррекции основного заболевания.
При иммунодефицитах показана первичная медикаментозная профилактика оппортунистических инфекций. Применяют сульфаниламиды, макролиды‑азалиды, противогрибковые средства. При положительной пробе Манту или недавнем контакте с больным туберкулезом назначается химиопрофилактика сроком на 6 месяцев. Также пациентам рекомендовано строго соблюдать противоэпидемические меры, в периоде резкой иммуносупрессии необходимо пребывание в стерильных боксах.
3. Клинические особенности сочетанных оппортунистических инфекций (обзор)/ В.В. Шкарин, Н.В. Саперкин// Медицинский альманах. – 2017. – №4.
4. Оппортунистические инфекции: проблемы и перспективы/ Под общ. ред. проф. Ю.В. Редькина, О.А. Мирошника, В.В. Лобова. – 2002.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Ротавирусная инфекция: причины появления, симптомы, диагностика и способы лечения.
Определение
Ротавирусная инфекция (ротавирус) – это острое инфекционное заболевание, вызываемое ротавирусом и характеризующееся поражением желудочно-кишечного тракта по типу гастроэнтерита с развитием синдрома дегидратации (обезвоживания).
Причины появления ротавирусной инфекции
Возбудителем заболевания выступает вирус семейства Reoviridae, рода Rotavirus. Ротавирусы устойчивы к воздействию факторов окружающей среды, в питьевой воде, открытых водоемах и сточных водах они сохраняют жизнеспособность до нескольких месяцев, на овощах и фруктах – до 30 дней.
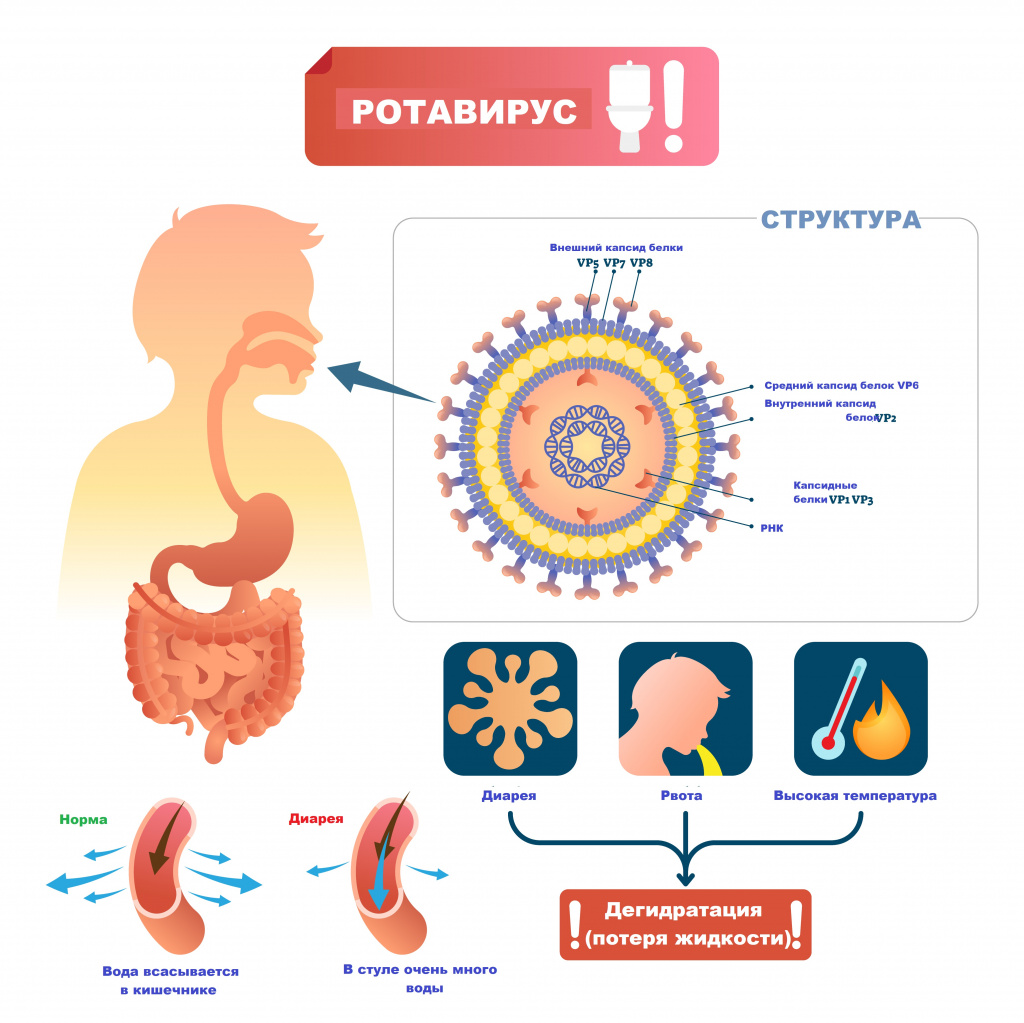
Основной источник и резервуар ротавирусной инфекции – больной человек в конце инкубационного периода и в первые дни болезни, выделяющий с фекалиями вирус, а также вирусоносители. Механизм передачи возбудителя – фекально-оральный.
- контактно-бытовой (через грязные руки и предметы обихода);
- водный (при употреблении воды, в которой присутствуют вирусы);
- пищевой (чаще всего при употреблении молока, молочных продуктов);
- реже – воздушно-капельный путь.
Ротавирусным гастроэнтеритом болеют люди любого возраста, но максимальная заболеваемость отмечается у детей первых двух лет жизни, людей пожилого возраста и лиц с нарушением функционирования иммунной системы.
Наблюдается зимне-весенняя сезонность, спорадические случаи заболевания регистрируются в течение всего года.
Ротавирусы проникают внутрь эпителия слизистой оболочки двенадцатиперстной кишки и верхних отделов тощей кишки. Размножение и накопление вируса приводит к гибели зрелых эпителиоцитов кишки и их отторжению. В результате нарушается абсорбция углеводов и простых сахаров, и они накапливаются в избыточном количестве. В просвете кишечника повышается осмотическое давление, нарушается всасывание воды и электролитов. Возникает водянистая диарея. Образование большого количество органических кислот, водорода, углекислого газа в процессе ферментации нерасщепленных дисахаридов кишечной микрофлорой ведет к повышению газообразования в кишечнике.
У детей с иммунными нарушениями ротавирус может стать причиной развития гепатита, нефрита, пневмонии, экзантемы, энцефалита с высоким риском летального исхода.
Классификация заболевания
Формы ротавирусной инфекции:
- типичная (гастрит, гастроэнтерит, энтерит);
- атипичная (стертая, бессимптомная);
- вирусоносительство.
- легкое;
- среднетяжелое;
- тяжелое.
- гладкое;
- негладкое (с обострениями и рецидивами).
- острое (до 1 месяца);
- затяжное (до 3 месяцев);
- хроническое (более 3 месяцев).
Инкубационный период ротавирусной инфекции составляет от 14 часов до 7 дней (в среднем 1-4 дня). Заболевание чаще всего начинается остро с повышения температуры тела от субфебрильных до фебрильных значений, появляются симптомы интоксикации (вялость, слабость, снижение аппетита), диарея и повторная рвота.
Кишечная дисфункция характеризуется жидким, водянистым, пенистым стулом желтого цвета без патологических примесей. При обильном жидком стуле развивается обезвоживание.
В тяжелых случаях возможно уменьшение количества мочи вплоть до полного ее отсутствия, снижение артериального давления.
В течение 3–6 дней могут присутствовать умеренные или сильные схваткообразные или постоянные боли в верхней половине живота. У детей младшего возраста в начале заболевания могут наблюдаться катаральные явления, которые предшествуют дисфункции кишечника: покашливание, насморк или заложенность носа, редко – конъюнктивит, катаральный отит. У детей раннего возраста на фоне высокой температуры могут развиться генерализованные судороги, сопровождающиеся потерей сознания.
Для легких форм ротавирусной инфекции характерны следующие симптомы:
- температура тела 37,1-38,0°C;
- умеренная интоксикация в течение 1–2 дней;
- нечастая рвота;
- стул жидкой кашицей до 5-10 раз в сутки.
- температура тела 38,0-39,0°C;
- выраженная интоксикация;
- повторная рвота в течение 1,5-2 дней;
- обильный водянистый стул от 10 до 20 раз в сутки;
- обезвоживание I–II степени.
- бурным началом;
- значительными потерями жидкости (обезвоживание II–III степени),
- многократной рвотой;
- водянистым стулом более 20 раз в сутки;
- снижением артериального давления.
Типичный ротавирусный гастроэнтерит характеризуется доброкачественным циклическим течением, наличием специфических признаков заболевания, а также обнаружением возбудителя в фекалиях.
К атипичным формам ротавирусного гастроэнтерита относятся:
- стертая и субклиническая формы со слабо выраженными и быстро проходящими симптомами;
- бессимптомная форма с отсутствием клинических признаков болезни, но с нарастанием титров специфических антител в крови;
- носительство ротавирусов после перенесенного острого ротавирусного гастроэнтерита, у здоровых лиц в очагах с инфекционной диареей;
- хроническая форма, сохраняющаяся более 3 месяцев.
Сочетание поражения желудочно-кишечного тракта и симптомов интоксикации, развитие обезвоживания, наличие ротавирусной инфекцией у лиц, контактирующих с больным, имеют большое значение в диагностике заболевания.
Окончательный диагноз ротавирусной инфекции ставится только на основании лабораторного подтверждения. Используют:
- методы, основанные на обнаружении ротавируса и его антигенов в фекалиях (электронная и иммуноэлектронная микроскопия, РЛА, ИФА);
- методы обнаружения вирусной РНК в копрофильтратах (метод молекулярных зондов – ПЦР и гибридизации, электрофорез РНК в полиакриламидном геле или агарозе);
- методы обнаружения специфических антител к ротавирусам в сыворотке крови (ИФА, РСК, РТГА, РНГА).
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Сепсис: причины появления, симптомы, диагностика и способы лечения.
Определение
Сепсис – это патологический процесс, в основе которого лежит реакция организма в виде генерализованного воспаления на инфекцию различной природы. При сепсисе бактерии преодолевают иммунную защиту человека и распространяются из очага воспаления по всему организму. Местное воспаление, сепсис, тяжелый сепсис и септический шок – это различные формы выраженности воспалительной реакции организма на инфекционный процесс.

Истинная частота возникновения случаев сепсиса остается неизвестной, однако по оценкам исследователей, во всем мире сепсис является лидирующей причиной летальности у пациентов в критическом состоянии. Согласно результатам большого европейского исследования SOAP, включившего 3147 пациентов из 198 европейских медицинских центров, сепсис развился в 37,4% случаев, а госпитальная летальность от него колебалась от 14% случаев в Швейцарии до 41% в Португалии, в среднем составив 24,1%. Данные другого крупного исследования PROGRES (12 881 больной тяжелым сепсисом в 37 странах) показали, что госпитальная летальность в среднем составила 49,6%.
Причины возникновения сепсиса
Возбудителями сепсиса могут быть бактерии, вирусы или грибы. Но чаще сепсис имеет бактериальную природу - его причиной становятся стафилококки, стрептококки, пневмококки, менингококки, сальмонеллы, синегнойная палочка и др.
В большинстве случаев патологический процесс вызывают условно-патогенные микроорганизмы, которые присутствуют на коже, слизистых оболочках дыхательного и пищеварительного трактов, мочевыводящих путей и половых органов. Иногда при сепсисе выделяют сразу 2-3 микроорганизма.
Причиной сепсиса могут стать гнойно-воспалительные заболевания кожи (абсцессы, фурункулы, флегмоны), обширные травмы, ожоги, инфекционно-воспалительные заболевания мочевыводящей системы (пиелонефрит), живота (например, гнойно-некротический деструктивный панкреатит), тяжелая ангина, гнойный отит, пневмония, инфицирование во время родов или абортов и др.

Возможность возникновения сепсиса зависит не только от свойств возбудителя, но и от состояния иммунной системы человека - нарушения в ее работе предрасполагают к распространению инфекции. Причинами таких нарушений могут быть врожденные дефекты иммунитета, хронические инфекционные болезни (ВИЧ, гнойные процессы), эндокринные заболевания (сахарный диабет), онкологические болезни, хронические интоксикации (алкоголизм, наркомания), проникающая радиация, прием иммуносупрессоров (кортикостероидов, цитостатиков) и др.
В ответ на внедрение возбудителя вырабатываются цитокины – особые белковые молекулы, которые выполняют защитные функции сначала на местном уровне, а затем, попадая в системный кровоток, продолжают работать уже на уровне всего организма. Цитокины бывают провоспалительными и противовоспалительными. В самом начале инфекционного процесса их количество находится в равновесии. Если регулирующие системы организма не способны поддерживать это равновесие, то цитокины накапливаются в кровотоке в сверхвысоких объемах, начинают доминировать их деструктивные, разрушающие эффекты, в результате повреждается сосудистая стенка, запускается синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) и полиорганная дисфункция. Вследствие полиорганной дисфункции печени, почек, кишечника появляются новые повреждающие факторы (лактат, мочевина, билирубин и др.), которые усиливают деструктивные процессы. При ДВС-синдроме в сосудах микроциркуляторного русла образуются множественные тромбы в сочетании с несвёртываемостью крови, приводящей к множественным кровоизлияниям.
Классификация заболевания
В зависимости от локализации входных ворот и первичного очага сепсис подразделяют на:
- перкутанный (чрескожный) – развивается при попадании возбудителя в организм через поврежденный кожный покров (ранки, царапины, фурункулы и др.);
- акушерско-гинекологический – развивается после родов и абортов;
- оральный (одонтогенный и тонзиллогенный) – развивается в результате первичной инфекции в полости рта;
- оториногенный – развивается в результате распространения инфекции из полости уха и/или носа;
- пневмогенный – при наличии инфекционного очага в нижних дыхательных путях;
- хирургический;
- урологический;
- пупочный – развивается у новорожденных вследствие проникновения инфекционных агентов в кровь через пупочную ранку;
- криптогенный (идиопатический, эссенциальный, генуинный) – сепсис неизвестного происхождения: первичный очаг гнойного воспаления неизвестен.
- молниеносный сепсис,
- острый сепсис,
- подострый сепсис,
- хронический сепсис (хрониосепсис).
По клиническим признакам:
1. Синдром системного воспалительного ответа (ССВО) – системная реакция организма на воздействие различных сильных раздражителей (инфекции, травмы, операции и др.) характеризуется двумя или более признаками:
- температура тела ≥ 38°С или ≤ 36°С;
- частота сердечных сокращений (ЧСС) ≥ 90 ударов в минуту;
- частота дыхания (ЧД) > 20 в минуту или гипервентиляция (РаСО2 ≤ 32 мм рт. ст.);
- лейкоциты крови > 12х109 /л или < 4х109 /л, или незрелых форм >10%.
По виду и характеру возбудителя:
- аэробный сепсис,
- анаэробный сепсис,
- смешанный сепсис,
- грибковый сепсис,
- вирусный сепсис.
Клинические проявления сепсиса могут варьировать от незначительных до критических. При молниеносном течении патологическое состояние развивается бурно - за несколько часов или суток. При остром сепсисе симптомы развиваются за несколько дней. Для хрониосепсиса характерно вялое течение и наличие малозаметных изменений, формирующихся месяцами. Рецидивирующий сепсис протекает с эпизодами обострений и затуханий.
Инкубационный период после выявления ворот инфекции или первичного очага составляет от 1 до 3-5 суток. Начало сепсиса, как правило, острое, хотя иногда может быть подострым или постепенным. Интоксикация проявляется резкой слабостью, адинамией, анорексией, нарушением сна, головной болью, расстройством сознания, менингеальным синдромом (поражением оболочек головного и спинного мозга), тахикардией, артериальной гипотензией. Температура тела держится высокой, со скачками утром и вечером. Признаки интоксикации особенно выражены на высоте лихорадки. На коже у трети больных появляется геморрагическая сыпь.
Со стороны дыхательной системы наблюдаются одышка и хрипы в легких. При нарушении функции почек снижается количество выделяемой мочи (олигурия) вплоть до полного прекращения мочеиспускания (анурия), в моче появляются следы крови, гноя. Наблюдается ухудшение функции печени с развитием желтухи и явлениями гепатита, увеличивается селезенка. Повреждение органов ЖКТ проявляется нарушением пищеварения, отсутствием аппетита, язык сухой, обложенный, нередко наблюдаются упорные септические поносы, тошнота и рвота. Метастазирование возбудителя из первичного очага с образованием вторичных очагов инфекции может приводить к инфаркту легкого, гангрене легкого, гнойному плевриту, эндокардиту (поражению внутренней оболочки сердца), воспалению сердечной мышцы (миокардиту), воспалению околосердечной сумки (перикардиту), гнойному циститу, абсцессам мозга и воспалению оболочек мозга (гнойному менингиту), гнойным артритам, флегмонам и абсцессам в мышцах.
Недостаточность функции одного органа длительностью более суток сопровождается летальностью до 35%, при недостаточности двух органов – 55%, при недостаточности функции трех и более органов летальность к четвертому дню возрастает до 85%.
Производят посевы крови, мочи, ликвора, мокроты, гнойного экссудата из элементов сыпи, абсцессов, пунктатов плевры, суставов и других септических очагов. Посевы делают многократно, чтобы определить чувствительность к максимальному количеству антибиотиков. Используется также обнаружение антигенов в крови методом ИФА и определение генома возбудителя методом ПЦР.
Одним из наиболее специфичных и чувствительных маркеров бактериальной инфекции служит прокальцитониновый тест. Прокальцитонин – один из основных маркёров системного воспаления, вызванного бактериями.
Синонимы: Анализ крови на прокальцитонин; ПКТ. Procalcitonin; PCT. Краткая характеристика определяемого вещества Прокальцитонин Прокальцитонин является прогормоном кальцитонина, состоящим из 116 аминокислот с молекулярной массой 14,5 кDa. Биосинтез прокальцитонина в физиологических условиях прои.
Читайте также:

