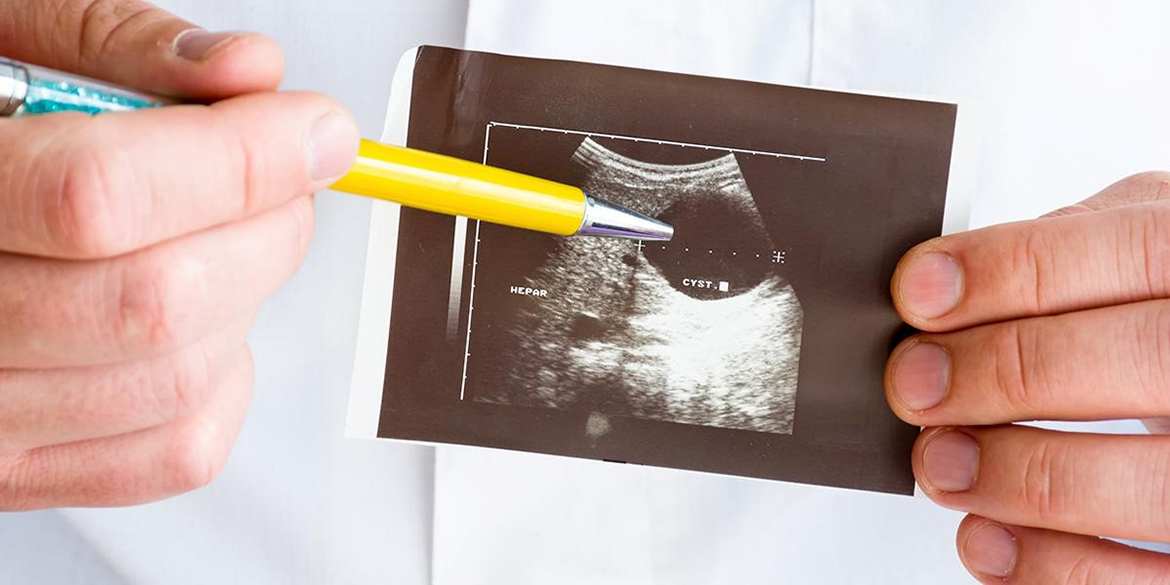
Что такое секундарная инфекция
Обновлено: 26.04.2024
Основные понятия
Заражение — это состояние заражения макроорганизма микроорганизмом, результат антагонистических взаимоотношений между ними, возникающих в окружающей среде.
Инфекционный процесс — это процесс взаимодействия микроорганизма и макроорганизма со всеми изменениями, происходящими в последнем (в результате прямого или косвенного действия микроорганизма и его токсических и других продуктов).
Суперинфекция — из-за повторного заражения тем же патогеном у нелеченного пациента.
Повторное заражение — из-за болезни по той же причине вскоре после выздоровления.
Смешанная инфекция — заболевание вызывается 2 и более возбудителями.
Вторичная инфекция — при одной инфекции добавляется вторая инфекция, вызванная другим микроорганизмом.
Миксинфекция — заболевание как инфекционное, так и неинфекционное.
Эндогенная инфекция — заболевание вызывается микроорганизмами, которые встречаются в макроорганизмах (из нормальной, условно-патогенной флоры).
Внутрибольничная инфекция — заражение произошло во время оказания медицинской помощи больным.
Типы инфекций
Воздушные инфекции — ветряная оспа, корь, эпидемический паротит, грипп, скарлатина, дифтерия, коклюш, менингококковая инфекция, туберкулез, краснуха, оспа у обезьян, легионеллез.
Кишечные инфекции — полиомиелит, вирусный гепатит А, ротавирусный гастроэнтерит, холера, брюшной тиф, шигеллез, сальмонеллез, бруцеллез, орнитоз, лептоспироз, кампилобактериоз, иерсиниоз, ботулизм.
Трансмиссивные инфекции — сыпной тиф, болезнь Брилля-Цинсера, возвратный сыпной тиф, волёская лихорадка, малярия, висцеральный лейшманиоз, вирусный энцефалит, вирусная геморрагическая лихорадка, вирусные лихорадки, болезнь Лайма, чума, туляремия, лихорадка Ку, марсельская лихорадка, американский кожный лейшманиоз.
Инфекции оболочки — трахома, инфекционные дерматозы, бильхарциози, анкилостомидози, бешенство, сибирская язва, сап, стопа, содоку, болезнь кошачьих царапин, мелиоидоз, столбняк, газовая гангрена, бластомикоз, аспергиллез, кокцидиоидомикоз.
Инфекции, передающиеся половым путем — сифилис, гонококк, венерическая лимфогранулема, трихомониаз, инфекции HHV1 и HHV2, урогенитальный хламидиоз, урогенитальный микоплазмоз, чесотка.
Инфекции с множественными механизмами передачи — вирусные гепатиты B, C, D, G, ВИЧ- инфекция, листериоз, токсоплазмоз.
Инфекции с недостаточно ясным механизмом передачи — медленные инфекции, болезнь Крейтцфельда-Якоба — человеческий вариант, болезнь Кавасаки, болезнь Крейтцфельда-Якоба — животный вариант.
Септикопиемия – форма проявления инфекции, при которой в пораженном организме наблюдается сочетание явлений септицемии и пиемии.
Токсемия - отравление организма токсинами, которые выделяют патогенные микроорганизмы. При некоторых инфекциях микроорганизмы могут размножаться только в местах их внедрения или в отдельных органах, а выделяемые токсины распространяться в организме током крови или лимфы.
ФОРМЫ ИНФИЦИРОВАНИЯ РЫБ. Инфекции различаются в зависимости от формы заражения рыб возбудителями инфекционных болезней.
Экзогенная, или гетерогенная, инфекция возникает в результате внедрения возбудителя инфекции в организм животного из окружающей среды.
Эндогенная инфекция,или аутоинфекция, возникает в том случае, если возбудитель находится в организме в качестве сапрофита или слабовирулентного штамма. При ослаблении защитных сил организма в результате воздействия неблагоприятных условий внешней среды, такие микроорганизмы проявляют, а затем усиливают свою вирулентность, что приводит к возникновению патологических процессов.
Спонтанная, или естественная, инфекция передается естественным путем, свойственными ей способами передачи возбудителя болезни. Например, если рыбы-микробоносители проникают по водным путям в другой, новый для них водоем и инфицируют там здоровых рыб.
Искусственная инфекция создается преднамеренно путем искусственного введения возбудителя в организм животного.
Реинфекция – повторное заболевание одной и той же болезнью, возникающее после первичного заболевания и полного освобождения организма от инфекционного начала при повторном поступлении в организм возбудителя инфекции. Для возникновения реинфекции необходимо, чтобы организм после перенесенного заболевания остался восприимчивым к болезни.
Суперинфекция – это такое повторное заболевание рыб одной и той же болезнью, которое наступает еще до ликвидации первичного заболевания в результате вторичного проникновения в организм того же возбудителя при пониженной сопротивляемости организма.
ВИДЫ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ РЫБ. Инфекционные болезни у рыб проявляются в различных видах.
Простая инфекция вызывается только одним возбудителем. Смешанная инфекция возникает при одновременном заболевании двумя или несколькими болезнями.
Вторичная (или секундарная) инфекция возникает при наличии первичной (основной) болезни. Возбудителями вторичной инфекции у рыб являются микроорганизмы, обитающие на коже и слизистых оболочках пищеварительного тракта. Эти микроорганизмы развиваются в ослабленном первичной инфекцией организме. Например, сапролегниоз рыб.
СТАДИИ РАЗВИТИЯ ИНФЕКЦИОННОЙ БОЛЕНИ. В развитии инфекционной болезни различаются четыре основных периода: инкубационный, продромальный, полного развития и угасания.

Протозойные заболевания или протозоозы - это заболевания, вызванные простейшими микроорганизмами. Такие инфекции могут быть системными (поражать весь организм) и кишечными (поражают желудочно-кишечный тракт).
К системным протозоозам относятся малярия, бабезиоз, лейшманиоз, токсоплазмоз, трипаносомоз.
В этой статье мы поговорим о простейших, которые поражают желудочно-кишечный тракт и вызывают кишечные инфекции.
Кишечные простейшие передаются фекально-оральным путем. Встречаются простейшие, а соответственно и инфекции, вызванные ими, по всеми миру, но наиболее широко распространены в областях с плохими санитарно-гигиеническими условиями и контролем за состоянием воды. Токсоплазмоз, кстати, тоже передается орально-фекальным путем, но при этом не поражает ЖКТ (подробнее по ссылке). Некоторые простейшие могут распространяться половым путем, например при орально-анальных контактах. Несколько разновидностей простейших вызывают тяжелые инфекции у пациентов с ВИЧ-инфекцией в продвинутой стадии.
Наиболее важными кишечными протозойными патогенами являются лямблии и амебы, криптоспоридии, бластоцисты и др.
Многие патогенные и непатогенные микроорганизмы могут находиться в кишечнике в одно и то же время. При этом инфекции, вызванные кишечными простейшими, в большинстве случаев характеризуются либо бессимптомным течением, либо стертой клинической симптоматикой. Настороженность по поводу паразитарных заболеваний имеет место при хронических диареях, кожных высыпаниях неясной этиологии, в некоторых случаях при длительно сохраняющейся эозинофилии в крови.
Постановка диагноза основывается на сборе эпидемиологического анамнеза, на выявлении симптомов и физикального обследования, а также на результатах лабораторного исследования кала на простейшие, а при наличии возможностей - на антигены возбудителей (криптопроридии, амебы, лямблии) или выявление генетического материала простейших с помощью молекулярно-генетических методов.
Микроскопический анализ кала является скрининговым методом диагностики, но может потребовать повторных исследований, методов концентрации и специальных окрашиваний. Наиболее информативным в этом плане может быть анализ трехдневного кала с применением специальных методов обогащения, с интервалом в две недели при первом отрицательном результате. Два последовательных отрицательных результата исследования кала на я/гельминтов и простейшие с интервалом в 14 дней позволяют исключить паразитарную (и глистную) инвазию, и дообследоваться в другом направлении.
Entamoeba histolytica/E. dispar .
Кишечный амебиаз распространен повсеместно, преимущественно в Центральной Америке, западной Южной Америке, Западной и Южной Африке и на индийском субконтиненте. В развитых странах большинство случаев происходит среди недавних иммигрантов и туристов, вернувшихся из эндемичных областей. Амебиаз является третьей по распространенности причиной смерти от паразитозов после малярии и шистосомоза.
Разновидностей амеб множество, но наиболее часто выявляются E.histolytica и E. dispar. Принято считать, что E.dispar непатогенна, но при ее выявлении в совокупности с клинической картиной заболевания, необходимость лечения рассматривается индивидуально.
Человек инфицируется при заглатывании цист с пищей или водой, или при оральных сексуальных контактах. После попадания в организм человека из цисты выходит трофозоит, который по мере продвижения по кишечнику может либо проникать в ткани кишечника, либо выводиться с калом (как в виде цист, так и в виде трофозоитов). Для заражения опасны только цисты.
В 90% случаев течение болезни бессимптомное. Если все же есть клиническая картина, то она может варьировать от легкой диареи до тяжелой дизентерии (боль в животе, диарея с кровью и слизью, снижение веса, повышение Т тела) и даже вызывать опасные осложнения: перфорацию кишечника, кишечные кровотечения и др. К факторам риска тяжелого течения относятся молодой возраст, беременность, лечение кортикостероидами, злокачественные новообразования, недоедание и алкоголизм, а также ВИЧ-инфекция.
Амебная инфекция может стать хронической и проявляться в виде диареи с болью в животе, слизью, метеоризмом, потерей веса. Могут обнаруживаться безболезненные, пальпируемые скопления - амебомы - по ходу толстого кишечника.
При внекишечном амебиазе наиболее часто поражается печень (абсцесс печени). Симптомы включают боль или дискомфорт в области печени, иррадиирующие в правое плечо, неустойчивую лихорадку, потливость, озноб, тошноту, рвоту, слабость и потерю веса. Абсцесс может перфорировать в поддиафрагмальное пространство, правую плевральную полость, правое легкое, перикард.
Основным методом диагностики, помимо общеклинических исследований (при которых можно обнаружить лейкоцитоз, эозинофилию, повышение СОЭ, повышение уровня трансаминаз печени и др.) является микроскопия кала. При этом 3х-кратное исследование повышает чувствительность до 95%. Чувствительностью до 100% обладают иммунохроматографические методы, основанные на выявлении антигена амеб в кале, кроме того они позволяют дифференцировать E.dispar и E.Histolytica. Так же могут использоваться молекулярно-генетические методы - ПЦР, и серологические методы - определение наличия антител к амебам, но серологические данные нельзя интерпретировать отдельно от других.
Из инструментального обследования информативным может быть колоноскопия, при которой выявляются характерные изъязвления стенки кишечника, а дальше проводится биопсия и гистологическое исследование материала, где могут быть выявлены трофозоиты амеб.
При подозрении на внекишечный амебиаз используют Р-графию органов грудной клетки, УЗИ органов брюшной полости, КТ с контрастированием или МРТ.
Лечение проводится только после лабораторного подтверждения диагноза. И оно включает в себя несколько схем последовательно применяемых противомикробных препаратов (действующих как на ткани кишечника, так и в просвете кишечника), в зависимости от тяжести заболевания, формы (кишечная или внекишечная), индивидуальной непереносимости препаратов и другого-другого-другого.
Лямблиоз не менее широко распространен - лямблии наиболее часто обнаруживаются при исследовании кала. Пути передачи те же, инфицирование происходит при проглатывании цист. После попадания в организм из цист выходит трофозоит, который паразитирует в тканях тонкой кишки, дозревает, а затем выводится в окружающую среду с калом в виде цист.
Характер клинических проявлений у человека, вероятно, зависит от ряда факторов, включая вирулентность изолята, паразитарную нагрузку и иммунный ответ хозяина. Половина переносит без симптомов, 15 процентов выделяют цисты без симптомов (бессимптомная инфекция встречается как у детей, так и у взрослых, а бессимптомное выделение кист может длиться шесть месяцев и более), 35-45% отмечают клинические симптомы острой или хронической инфекции.
Острый лямблиоз: диарея, недомогание, стеаторея, спазмы в животе и вздутие, метеоризм, тошнота, снижение веса, рвота, лихорадка, запор, крапивница. Симптомы обычно развиваются после инкубационного периода от 7 до 14 дней. Возникновение острых желудочно-кишечных симптомов в течение одной недели после контакта вряд ли может быть связано с инфекцией Giardia . Симптомы могут длиться от двух до четырех недель.
Симптомы хронического лямблиоза могут включать: жидкий стул, но обычно не диарея, стеаторея, потеря веса (от 10 до 20 процентов веса тела), мальабсорбция, задержка роста, недомогание, усталость, депрессия, спазмы в животе, метеоризм, отрыжка. Проявления могут усиливаться и уменьшаться в течение многих месяцев.
Нарушение всасывания может быть причиной значительной потери веса, которая может возникнуть при лямблиозе. Даже в случаях бессимптомной инфекции может возникнуть нарушение всасывания жиров, сахаров, углеводов и витаминов. Это может привести к гипоальбуминемии и дефициту витаминов A, B12 и фолиевой кислоты. Приобретенная непереносимость лактозы встречается примерно у 40 процентов пациентов - клинически это проявляется обострением кишечных симптомов после употребления молочных продуктов. Восстановление может занять много недель даже после избавления от паразита.
Осложнения: мальабсорбция, потеря веса, у путешественников длительная диарея, у детей может привести к задержке роста. Редко - сыпь, крапивница, афтозные язвы и реактивный артрит или синовит, холецистит, холангит или гранулематозный гепатит. При этом лямблиоз не ассоциирован со смертностью даже у иммунокомпрометированных лиц.
Диагностика основана на обнаружении простейших (трофозоитов или цист) при микроскопии кала, на выявлении антигена лямблий в кале иммунохроматографическими методами, обнаружении генетического материала методом ПЦР. При подозрении на лямблиоз и получении 5 негативных результата исследования кала необходимо рассмотреть возможность исследования дуоденального содержимого. Стоит помнить, что на обнаружение паразита могут влиять прием антибактериальных, антацидных препаратов, а также обследования с использованием контрастных веществ.
Лечение проводится только при лабораторном подтверждении диагноза и при наличии клинических проявлений заболевания, лечение бессимптомных носителей осуществляется в случае, если они контактируют с беременными, с больными муковисцидозом, если это дети, посещающие ДДО или работники пищевой промышленности.
Спорообразующие простейшие (Cryptosporidium parvum, Isospora belli, Cyclospora cayetanensis, Mycrosporidia)
Жизненный цикл для всех спорообразующих простейших одинаков и начинается после проглатывания спор, из которых в тонком кишечнике высвобождаются спорозоиты и начинают активно размножаться в энтероцитах, а затем способствуют развитию новых спор, выделяющихся с калом после гибели энтероцитов. При паразитировании данных микроорганизмов значительно страдает архитектоника ворсинок, что нарушает всасывание.
Из всех спорообразующих наиболее изучены криптоспоридии - о них и пойдет речь.
Путь передачи - фекально-оральный, инфицирование при проглатывании цист с водой, пищей, от человека к человеку, от животных к человеку. Факторами риска тяжелого течения могут быть ВИЧ-инфекция, трансплантация органов, дефицит IgA, гипогаммаглобулинемия и прием иммунодепрессантов.
В 30% случаев встречается бессимптомное течение. У пациентов, у которых развиваются симптомы, инкубационный период обычно составляет от 7 до 10 дней (от 2 до 28 дней). Диарея, связанная с криптоспоридиозом, может быть острой или хронической, кратковременной, прерывистой или непрерывной, скудной или обильной, с водянистым стулом до 25 л/день. Часто пациенты отмечают недомогание, тошноту и анорексию, спастические боли в животе и субфебрильную температуру. У иммунокомпетентных людей болезнь обычно проходит без лечения в течение 10–14 дней, хотя может сохраняться дольше или рецидивировать после первоначального улучшения. У людей с ослабленным иммунитетом криптоспоридиоз может стать хроническим изнурительным заболеванием с постоянной диареей и значительным истощением. Наиболее подвержены риску люди, живущие с ВИЧ, не принимающие антиретровирусную терапию и имеющие низкий уровень СД4+ менее 100-50кл/мкл.
Диагностика основана на выявлении микроорганизмов при микроскопии кала, выявлении их генетического материала методом ПЦР, обнаружение антигенов криптоспоридий в фекалиях, гистологическом исследовании биоптатов слизистой оболочки кишечника.
Если пациент с иммунодефицитом, то лечение может вызвать некоторые трудности - чаще это длительная, комбинированная терапия, которая может не дать желаемых результатов. При наличии ВИЧ-инфекции у пациента следует незамедлительно начать антиретровирусную терапию, в некоторых случаев этого бывает достаточно, но все же иногда необходимо добавить и противопаразитарные препараты.
У иммунокомпетентных лиц лечение криптоспоридиоза не требуется, если только клинические проявления не длятся более двух недель.
Распространен повсеместно. Фекально-оральный путь передачи. У людей паразитирует в толстом кишечнике, чаще встречается у пациентов с ВИЧ-инфекцией. Патогенез развития заболевания изучен не до конца. Вопрос о том, действительно ли этот паразит является патогеном для человека, остается спорным. Выделение этого паразита с диареей у пациентов с трансплантацией почек и другими иммунодефицитами коррелирует, но практически не связано со смертностью. У людей с ВИЧ-инфекцией и бластоцистозом симптомы исчезают самопроизвольно или подтверждается другая их этиология.
Клинические проявления при бластоцистозе могут включать: диарею, тошноту, анорексию, спазмы в животе, вздутие живота, метеоризм, крапивницу и усталость. Обычно описывается водянистая диарея (может быть острой или хронической). Лихорадка обычно отсутствует.
Диагностика - микроскопия и ПЦР-исследование кала, а также культуральные методы.
Пациенты с обнаруженными бластоцистами в кале и без клинических проявлений не нуждаются в лечении. Если все же есть клинические проявления, то необходимо исключить другую их этиологию, и только в случае исключения другой этиологии рассматривается вопрос о лечение.
Балантидиаз человека наиболее распространен в тропических и субтропических регионах и развивающихся странах. Путь передачи фекально-оральный, при заглатывании цист при употреблении зараженной пищи или воды. Источником инфекции являются свиньи. Эксцистация происходит в тонкой кишке, паразит колонизирует подвздошную и толстую кишки, могут проникать в ткани, цисты формируются в просвете кишечника и выделяются с калом.
Большинство случаев протекает бессимптомно. Риск развития симптомов увеличивается при сопутствующей инфекционной патологии. Симптомы могут включать тошноту, рвоту, потерю веса, боль в животе и заметную диарею с примесью крови. Фульминантное течение заболевания с перфорацией кишечника возникает редко.
Диагноз инфекции B. coli устанавливается путем обнаружения трофозоитов или цист при исследовании кала или соскобах слизистой оболочки, полученных при колоноскопии или ректороманоскопии.
Оптимальный подход к лечению балантидиаза неясен. В целом, лечение целесообразно при симптоматическом течении инфекции. Если симптомы не исчезают после проведенной терапии, необходимо повторить исследование кала для исключения другой этиологии.
Ранее считалась комменсалом. Путь передачи фекально-оральный, инфекция ассоциирована с энтеробиозом.
Инфекция может быть симптоматической или бессимптомной. Общие симптомы включают боль в животе, острую и рецидивирующую диарею, тошноту, рвоту, метеоризм. D. fragilis может проявляться периферической эозинофилией и/или эозинофильным колитом. Диарея обычно длится 1-2 недели, тогда как боль в животе может сохраняться в течение 1-2 месяцев. Из-за очень высокой связи с острицами у некоторых пациентов также может проявляться анальный зуд, инфекции нижних мочевыводящих путей.
Диагноз ставится путем обнаружения трофозоитов при микроскопии образцов стула или с помощью молекулярно-генетических методов.
У бессимптомного человека обычно не требует лечения, но инфекции, вызванные D. fragilis, следует лечить, если организм обнаруживается как единственный патоген в образцах стула пациентов с абдоминальной болью или диареей более 1 недели.
Несколько непатогенных простейших обитают в кишечном тракте и могут быть идентифицированы в образцах стула, отправленных в клиническую лабораторию для исследования яиц и паразитов. Поскольку диагностическая лаборатория может сообщить об этих непатогенных паразитах, важно уметь различать организмы, требующие лечения, и организмы, которые этого не требуют.
Непатогенные простейшие можно разделить на две группы: амебы и жгутиковые.
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубеж
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубежом. По данным различных авторов, сегодня выросла заболеваемость в пожилом и старческом возрасте, а также среди лиц в возрасте до 30 лет, использующих внутривенное введение наркотиков [1, 2].
Известно, что ИЭ представляет собой заболевание инфекционной природы с первичной локализацией возбудителя на клапанах сердца, пристеночном эндокарде, протекающее с проявлениями системной инфекции, сосудистыми осложнениями и иммунной реакцией [3, 4, 5].
В данной работе обобщен опыт диагностики и ведения больных ИЭ на базе общетерапевтического отделения Александровской больницы Санкт-Петербурга за период 1998–2003 гг. Диагностика заболевания осуществлялась в соответствии с критериями Duke [8]. Диагноз ИЭ оценивался как достоверный при наличии двух главных критериев, а именно:
- при выделении типичного для ИЭ возбудителя при посевах крови больного;
- при определении эхокардиографических признаков поражения эндокарда - подвижные вегетации на клапанах сердца, абсцессов в области протеза клапана; образования внутрисердечных фистул и др., в сочетании с тремя или/и пятью вспомогательными критериями, к которым относились сосудистые осложнения (эмболии крупных артерий, септические инфаркты легких, внутричерепные кровоизлияния и др.), иммунологические феномены (гломерулонефрит, узелки Ослера, геморрагический васкулит и др.), а также фебрильная лихорадка, гепато-спленомегалия и другие проявления системной инфекции.
Нами было проведено обследование 105 больных ИЭ, из них у 80 человек в возрасте от 18 до 30 лет (первая группа) основным фактором риска заболевания являлась инъекционная наркомания.
Во второй группе больных (25 чел.) основными предрасполагающими факторами развития ИЭ были врожденные и приобретенные пороки сердца, а также протезированные клапаны.
У лиц старшей возрастной группы дополнительным фактором риска являлись дегенеративно-дистрофические изменения клапанов сердца.
Взаимосвязь характера поражения клапанов сердца и факторов риска ИЭ представлена в таблице 1.
По данным эхокардиографического исследования, у 100% больных первой группы были выявлены подвижные вегетации на створках трикуспидального клапана (ТК), что сопровождалось формированием его недостаточности I—III степени.
Во второй группе больных ИЭ отмечалось поражение левых камер сердца с образованием вегетаций на створках аортального и митрального клапанов. Изолированное поражение митрального клапана наблюдалось у двух человек с ревматическим пороком сердца (митральный стеноз), у одной больной с врожденным дефектом межжелудочковой перегородки и в единственном случае обструктивной формы гипертрофической кардиомиопатии.
Среди лиц пожилого и старческого возраста у девяти человек (36%) определялось изолированное поражение аортального клапана в отсутствии признаков аортального стеноза. Наряду с этим, у пяти больных (20%) в возрасте от 72 до 87 лет ИЭ развился на фоне аортального порока атеросклеротического генеза, причем у всех пятерых было выявлено сочетанное поражение аортального и митрального клапанов. Дегенеративно-дистрофические изменения других клапанов сердца определялись у 100% больных старшей возрастной группы.
Образование вегетаций на створках аортального клапана наблюдалось у двух больных с третичной формой сифилиса на фоне имеющегося аортального порока, связанного со специфическим процессом в аорте.
В двух случаях мы наблюдали развитие эндокардита протезированных клапанов.
При сопоставлении результатов посевов крови в двух группах больных определялись существенные различия как в частоте выделения микробной флоры, так и в видовом составе возбудителей эндокардита. По нашим данным, возбудителем ИЭ у больных-наркоманов в 71,3% наблюдений (57 чел.) являлся золотистый стафилококк, тогда как во второй группе, наряду с кокковой флорой, чаще обнаруживались грамотрицательные микроорганизмы (28%). Отрицательные результаты посевов крови значительно реже наблюдались в первой, чем во второй, группе больных ИЭ: 18,7% и 56% — соответственно. Данные относительно этиологической структуры ИЭ в обследуемых группах больных представлены в таблице 2.
Клиническая характеристика и особенности течения ИЭ
Клиническое течение и характер осложнений инфекционного эндокардита во многом зависят от локализации клапанных вегетаций — в правых или левых камерах сердца, а также степени вирулентности возбудителя заболевания.
Течение ИЭ у больных-наркоманов отличалось особой тяжестью и полисиндромностью. Причиной госпитализации у большинства больных были острые осложнения основного заболевания. Значительная часть больных поступала в реанимационное отделение стационара с клиническими симптомами одно- или двухсторонней многофокусной пневмонии, причиной которой являлась септическая тромбоэмболия ветвей легочной артерии (72% больных). Течение пневмонии сопровождалось тяжелой дыхательной недостаточностью, нередко с развитием респираторного дистресс-синдрома (РДСВ) и очагами деструкции в легких (12%). Проявления вторичной нефропатии, которые обнаруживались у 100% больных в первой группе, иногда ошибочно трактовались как обострение хронического гломеруло- или пиелонефрита, мочекаменной болезни, что служило поводом для госпитализации этих больных в урологическое и нефрологическое отделения.
Во второй группе больных основной причиной госпитализации была длительная фебрильная лихорадка в сочетании с анемией и гепатолиенальным синдромом. Наряду с этим, у пяти человек (20%) поводом для госпитализации послужила прогрессирующая сердечная недостаточность.
Основные клинические синдромы, наблюдаемые у больных ИЭ первой и второй групп, представлены в таблице 3.
По нашим наблюдениям, характерной особенностью клинического течения ИЭ у больных-наркоманов являлась высокая частота септической ТЭЛА с формированием множественных очагов инфильтрации в легких. У многих больных легочные тромбоэмболии носили рецидивирующий характер (31,3% больных) и нередко осложнялись развитием деструктивных очагов в легких.
Образование вегетаций у 100% больных первой группы сопровождалось недостаточностью трехстворчатого клапана I—III степени с формированием потоков регургитации. Вместе с тем, у большинства пациентов не определялось тяжелых нарушений центральной гемодинамики, связанных с дисфункцией ТК. В данной группе больных характерной клинической особенностью был обратимый характер нарушений гемодинамики на фоне проводимой терапии. Острая сердечная недостаточность с дилятацией полостей сердца и снижением фракции выброса до 40% и ниже наблюдалась у 28 больных (35,3%) в связи с присоединением острого миокардита или на фоне сочетанного поражения клапанов сердца.
Вторичная нефропатия являлась одним из самых распространенных синдромов в первой группе больных ИЭ. Острая почечная недостаточность наблюдалась у 16 больных, причем у 10 из них она носила обратимый характер и была связана с острым ДВС-синдромом, а также с острой сердечной недостаточностью с отеками. Инфекционно-токсическая нефропатия регистрировалась в 73,8% наблюдений и сопровождалась мочевым синдромом — гематурией, протеинурией, лейкоцитурией — при достаточном уровне клубочковой фильтрации.
Характерной особенностью ИЭ во второй группе было подострое течение заболевания с длительным периодом лихорадки на догоспитальном этапе, причем в пожилом и старческом возрасте лихорадка носила субфебрильный характер с редкими подъемами температуры до фебрильных цифр.
Большинство больных подострым инфекционным эндокардитом (ПИЭ) поступали в стационар в стадии развернутой клинической картины заболевания с клиническими признаками тромбоэмболии сосудов большого круга кровообращения. В данной группе больных наиболее распространенными следует признать такие осложнения, как церебральные эмболии с развитием ишемических и геморрагических инсультов, эмболии почечных сосудов с болевым синдромом и гематурией, а также формирование острых очаговых изменений в миокарде, связанных с эмболией коронарных сосудов или прикрытием устьев коронарных артерий вегетациями [9].
Септические тромбоэмболии церебральных сосудов нередко сопровождались развитием гнойного менингоэнцефалита с летальным исходом. Вместе с тем, при посевах крови у 56% больных второй группы не получено роста микробной флоры. Обращает на себя внимание тот факт, что септицемия у больных с положительными результатами посевов крови в 28% наблюдений была обусловлена грамотрицательной микрофлорой. В этой категории больных источником бактериемии являлись очаги хронической инфекции в мочеполовой системе, а у двух больных (по данным аутопсии) был выявлен двухсторонний апостематозный нефрит.
У значительного числа больных ПИЭ (62%) определялись признаки острой недостаточности кровообращения с застойными хрипами в легких, легочной гипертензией, увеличением полостей сердца и периферическими отеками.
В этой группе больных чаще, чем в первой, наблюдалась преренальная азотемия и ОПН, связанные с развитием острой недостаточности кровообращения.
Острый диффузный миокардит, типичными проявлениями которого были различные нарушения ритма, диагностирован у 27% больных второй группы.
Анемия со снижением уровня гемоглобина до 80 г/л и менее выявлена у 100% больных второй группы. Значительное увеличение СОЭ (более 45 мм/ч) наблюдалось у 85,8% больных подострым ИЭ.
Кожные изменения в виде геморрагических высыпаний, пурпуры Шенлейн-Геноха, а также другие проявления иммунного воспаления в обеих группах больных встречались нечасто — 6,3 и 4% в первой и второй группах, соответственно.
Лечение больных ИЭ
Консервативная терапия больных ИЭ проводилось с использованием антибиотиков широкого спектра действия в сочетании со средствами дезинтоксикационной, антикоагулянтной и метаболической терапии. В составе антибактериальной терапии больные получали цефалоспорины III-IV поколений в комбинации с аминогликозидами и метронидазолом. Из группы цефалоспоринов назначались: цефтриаксон (лонгацеф) 2 г в сутки внутривенно (в/в), или цефотаксим (тальцеф) 2 г в сутки в/в, или цефепим (максипим) 2 г в сутки в/в в сочетании с аминогликозидами (амикацин в суточной дозе 1,5 г в/в) и метронидазолом по 1,5-2 г в сутки в/в. В случае, если такая терапия оказывалась неэффективной или существовали противопоказания к вышеперечисленным препаратам, применялись антибиотики группы линкозаминов: клиндамицин 1,2 г в сутки в/в или линкомицин 3 г в сутки в/в в сочетании со фторхинолонами (ципрофлоксацин 400 мг в сутки в/в). В условиях отделения реанимации в течение пяти–семи дней проводилась терапия имипинемом (тиенамом) в дозе 2—4 г в сутки в/в или рифампицином в суточной дозе 0,45—0,6 г в/в. Средняя продолжительность курса антибиотикотерапии в обследуемой группе больных составила 28 + 3,5 дней.
Дезинтоксикационная терапия включала в себя внутривенные инфузии реополиглюкина, гемодеза, поляризующих смесей в сочетании с петлевыми диуретиками. Объем вводимой жидкости составлял в среднем 2-2,5 л в сутки. В течение всего периода инфузионной терапии осуществлялся контроль за функциональным состоянием почек, электролитным составом крови, суточным диурезом. В условиях отделения реанимации у всех больных осуществлялся мониторинг ЦВД. Инфузионная терапия проводилась в течение всего острого периода заболевания до купирования проявлений интоксикационного синдрома. Средняя продолжительность курса составила 22 + 4,5 дня.
Развитие легочной эмболии, особенно в сочетании с признаками острого ДВС-синдрома в стадии гиперкоагуляции, служило основанием для назначения антикоагулянтной терапии. Начальная доза гепарина составляла 10 тыс. ЕД внутривенно, струйно, за-тем — по 1000 ЕД в час внутривенно, капельно с переходом на подкожное введение до 30 тыс. ЕД в сутки. Введение гепарина осуществлялось под контролем показателей коагулограммы и времени свертывания крови. Одновременно проводились внутривенные трансфузии свежезамороженной плазмы по 300 мл в сутки с добавлением 2500–5000 ЕД гепарина. Анемия тяжелой степени (Нb менее 80 г/л, Ht ≤25) корригировалась переливаниями эритроцитарной массы (пять–семь доз). При наличии гипопротеинемии использовалось введение растворов аминокислот, альбумина или нативной плазмы. Выявление клинических и рентгенологических признаков отека легких на фоне рецидивирующего течения септической ТЭЛА служило показанием для назначения кортикостероидов (преднизолон от 120 до 200 мг в сутки внутривенно капельно). Терапия антикоагулянтами прямого действия в сочетании с трансфузиями криоплазмы проводилась до стойкого улучшения показателей гемостаза. Критериями нормокоагуляции являлись уровень фибриногена в плазме 3-4 г/л, отсутствие тромбоцитопении, нормализация ВСК, АЧТВ, тромбинового времени, а также отрицательные паракоагуляционные тесты. По нашим данным, купирование проявлений острого ДВС-синдрома на стадии гиперкоагуляции у 75% больных отмечалось на седьмой–десятый день от начала комплексной терапии.
У части больных формировалась резистентность к проводимой антибактериальной терапии, которая характеризовалась нарастанием интоксикации, фебрильной лихорадкой, прогрессирующей анемией, а также высевами из крови возбудителя ИЭ – золотистого стафилококка — в 65% наблюдений. При рентгенологическом обследовании данной категории больных с большой частотой определялись очаги деструкции легочной ткани, а у трех больных гнойный выпот в плевральной полости.
Длительное применение антибиотиков широкого спектра действия у 70,3% больных (38 чел.) сопровождалось развитием побочных эффектов антибактериальной терапии. Кандидоз полости рта глотки, пищевода, а также кишечный дисбактериоз III-IV стадии был выявлен у 36 больных (66,7%). Применение антибиотиков с гепатотоксическими свойствами (цефалоспорины, линкозамины, метронидазол) у двух больных (3,7%) с хроническим гепатитом С и В приводило к прогрессированию печеночной недостаточности, которая сопровождалась высокой ферментемией (АЛТ 1500 ЕД, АСТ 1000 ЕД) и желтухой.
Развитие застойной сердечной недостаточности с появлением акроцианоза, влажных хрипов в базальных отделах легких, периферических отеков в сочетании с кардиомегалией и падением фракции выброса до 50—45% наблюдалось у пяти больных (9,3%) на фоне массивной инфузионной терапии.
Длительная антикоагулянтная терапия в 20,4% (11 чел.) наблюдений сопровождалась повышением толерантности плазмы к гепарину, что клинически выражалось в развитии периферических флеботромбозов, в то время как гепарининдуцированной тромбоцитопении в обследуемой группе больных мы не наблюдали.
Положительные результаты консервативной терапии были получены у 70,2% больных (56 чел.) с поражением ТК и лишь у 32% пациентов (6 чел.) из второй группы. Исходом ИЭ в обеих группах больных являлось формирование недостаточности клапанов сердца.
Госпитальная летальность при ИЭ у наркозависимых лиц составила 29,4% (24 чел.), тогда как у больных с поражением левых камер сердца (вторая группа) уровень смертности составил 68% (19 чел.).
По данным аутопсии, основными причинами смерти больных ИЭ были:
- септикопиемия с формированием гнойных очагов в печени, почках селезенке, головном мозге с развитием полиорганной недостаточности (46,2%);
- сердечная недостаточность на фоне полипозно-язвенного эндокардита с разрушением клапанов сердца, а также острый миокардит с дилятацией полостей сердца (39,4%);
- вторичная нефропатия с развитием почечной недостаточности, отеком легких, отеком головного мозга (14,4%).
Таким образом, характерные особенности ИЭ у лиц с наркотической зависимостью — это острое течение заболевания с поражением правых камер сердца и рецидивами септической ТЭЛА. Возбудителем ИЭ у инъекционных наркоманов в 71,3% является высоковирулентный золотистый стафилококк. Формирование недостаточности трехстворчатого клапана I—III степени стало самым распределенным осложнением ИЭ у наркоманов. При этом у большинства больных не наблюдается тяжелых нарушений центральной гемодинамики, приводящих к развитию острой недостаточности кровообращения.
Подострый ИЭ у больных с предрасполагающими заболеваниями сердца, а также у лиц пожилого и старческого возраста протекает с преимущественным поражением левых камер сердца, причем в старшей возрастной группе преобладает моноклапанное поражение. Наличие сопутствующей патологии у лиц старше 60 лет маскирует течение основного заболевания, чем и обусловлены поздняя диагностика и высокая смертность больных. Для затяжного течения ИЭ характерна низкая высеваемость возбудителя, по сравнению с острыми формами заболевания. Развитие тромбоэмболий сосудов большого круга кровообращения является характерной клинической особенностью подострого ИЭ.
Положительный эффект от проводимой консервативной терапии наблюдается у большинства больных ИЭ с поражением ТК, тогда как при подостром эндокардите левых камер сердца консервативная терапия является малоэффективной у большинства больных.
Госпитальная летальность в обеих группах больных обусловлена диссеминацией возбудителя с формированием гнойных очагов и полиорганной недостаточностью, а также развитием острой недостаточности кровообращения и вторичной нефропатии.
Литература
- Буткевич О. М., Виноградова Т. Л. Инфекционный эндокардит. - М., 1997.
- Симоненко В. Б., Колесников С. А. Инфекционный эндокардит: современное течение, диагностика, принципы лечения и профилактики. - Клин. мед., 1999. - 3. - С. 44-49.
- Тазина С. Я., Гуревич М. А. Современный инфекционный эндокардит. - Клин. мед.,1999. - 12. - С. 19-23.
- Bansal R. C. Infective endocarditis. Med Clin North America 1995; 79 (5): 1205-1239.
- Bayer A. S., Bolger A. F., Taubert K. A. et al. Diagnosis and management of infective endocarditis and its complications. Circulation 1998; 98: 2936-2948.
- McKinsey D. S., Ratts T. E., Bisno A. I. Underlying cardiac lesions in adults with infective endocarditis. The changing spectrum. Amer J Med 1987; 82: 681-688.
- Lamas C. C. Eykyn S. J. Suggested modifications to the Duke criteria for the clinical diagnosis of native valve and prosthetic valve endocarditis: analysis of 118 pathologically proven cases. Clin Infect Dis 1997; 25: 713-719.
- Durack D. T., Lukes A. S., Bright D. K. et al. New criteria for diagnosis of Infective Endocarditis Utilization of Specific Echocardiographic Finding. Amer J Med 1994; 96: 200-209.
- Тюрин В. П., Дубинина С. В. Инфекционный эндокардит у лиц пожилого и старческого возраста. - Клин. мед., 2000. - 4. - С. 53-56.
В. И. Уланова
В. И. Мазуров, доктор медицинских наук, профессор
Медицинская академия последипломного образования, Санкт-Петербург
Диагностику и лечение рака осложняет не только отсутствие симптомов на ранних стадиях. Даже при наличии данных лучевой диагностики, точно указывающих на очаговое поражение органа (например, очаговые образования в печени), не всегда удается сразу поставить диагноз.
О том, что такое онконастороженность при обследовании поражений печени, и насколько она важна для выявления ранних стадий рака читайте в материале официального сайта Онкологической клиники МИБС.
Что такое “онкологическая настороженность”?
При постановке диагноза по симптомам и данным неинвазивной инструментальной и лабораторной диагностики врач любой специальности обязан рассматривать все возможные причины таких изменений. В том числе, и наличие онкологического заболевания. Это и есть онкологическая настороженность (онконастороженность).
Например, выявленное очаговое поражение печени следует всегда рассматривать как вероятное проявление онкологического процесса. Ведь успех лечения в онкологии напрямую зависит от стадии, на которой диагностирована болезнь.
Онконастороженность при очаговом поражении печени
Задача дифференциальной диагностики состоит в том, чтобы максимально точно соотнести проявления заболевания с симптоматикой, характерной для конкретного его вида, и одновременно зафиксировать признаки, исключающие другие варианты диагноза
Задача диагностического этапа в данном случае состоит в максимально быстром и точном установлении природы выявленных изменений. А значит, подобное заключение является поводом для обязательной и незамедлительной консультации онколога с целью оценки природы новообразования, определения необходимости в дополнительном обследовании и/или биопсии узла.
К сожалению, далеко не все врачи, к которым пациенты обращаются с жалобами на нарушения работы печени, направляют на прием к онкологу после выявления очагового поражения, не говоря уже о случайном выявлении очагового поражения при бессимптомном течении. В таком случае, при отсутствии онконастороженности у врача, задача в кратчайшие сроки получить полноценное обследование ложится на плечи самого пациента. Стоит помнить, что эффективность (а также травматичность, длительность и стоимость) лечения рака печени, в случае если последующее обследование подтвердит такой диагноз, зависит от срока начала лечения. А промедление - не избавит от диагноза, и лишь усугубит ситуацию.
Очаговое поражение - не всегда рак печени
Сложность заключается в том, что узловые образования в печени могут быть следствием разнообразных новообразований доброкачественной и злокачественной природы, цирроза печени или паразитарной инвазии. Только консультация специалиста и правильно составленный план дополнительного обследования позволяет в кратчайшие сроки уточнить диагноз и разработать индивидуальную программу лечения и наблюдения.
Бояться визита к онкологу не следует: чаще всего выявленный в печени очаг - это гемангиома печени либо простая киста. Характерный вид таких узлов при УЗИ или компьютерной томографии позволяет при отсутствии симптомов рекомендовать динамическое наблюдение с выполнением контрольных обследований в сроки 3-6 месяцев. Динамика новообразований в данном случае является одним из диагностических критериев – стабильный размер и форма выявленного узла будет подтверждением, что выявленные изменения доброкачественной природы.
Паразитарные кисты печени чаще всего имеют характерный вид, что позволяет предположить диагноз паразитарного поражения печени и назначить обследование для подтверждения такого заключения. Исследование уровня антипаразитарных антител в крови и дополнительные методы визуализации (КТ или МРТ) вместе со сведениями анамнеза болезни и жизни позволят установить клинический диагноз и назначить пациенту правильное лечение.
Особенности диагностики рака печени
Важным фактором, который позволяет диагностировать рак печени на ранних стадиях, является внимательность пациента к тем “сигналам”, которые посылает организм. В первую очередь, это касается незамедлительного обращения к врачу при обнаружении нетипичной работы систем и органов.
Наиболее простые из обследований – лабораторные общий и биохимический анализы крови, исследование уровня онкомаркеров в крови. Эти анализы пациенты часто назначают себе сами. Но следует отметить, что правильную интерпретацию полученных данных может дать только квалифицированный врач-онколог. Связано это с тем, что большинство изменений будет носить неспецифический характер либо результаты лабораторного обследования окажутся нормальными. Но, как правило, этап лабораторных исследований пациент, у которого имеются симптомы нарушения работы печени, проходит до выявления очаговых поражений методами лучевой диагностики.
Рак печени, как и любое злокачественное новообразование, после достижения определенного размера опухоли требует притока крови для продолжения своего роста. Образование новых сосудов, питающих растущую опухоль (опухолевый ангиогенез) - один из наиболее характерных признаков, которые указывают на наличие рака. Поэтому обязательно проводится оценка характера кровообращения в узловом образовании печени, наличия или отсутствия жидкостного компонента, взаимоотношения очага со структурами ворот печени, характера роста.
При недостаточности данных для подтверждения рака врач-онколог может избрать тактику непродолжительного динамического наблюдения: при наличии злокачественной опухоли печени (первичный рак печени или метастаз в печень) форма и/или размер очага будет меняться, что проявится в данных КТ, МРТ или УЗИ и лишь тогда будет сигналом к началу более инвазивной диагностики.
При подтверждении злокачественного процесса следует выяснить, имеет ли место первичный рак печени, или у пациента выявлена первичная опухоль другой локализации, метастазировавшая в печень
Первичные опухоли печени встречаются редко. Предположить первичный рак печени врач сможет в том случае, если комплексное обследование не выявило опухолевой патологии в легких, желудке, кишечнике, молочной железе. Нормальное состояние других органов и повышение уровня онкомаркеров, характерных для рака печени позволяют предположить гепатоцеллюлярный рак или холангиокарциному. В такой ситуации трепан-биопсия очага в печени с гистологическим исследованием полученного материала является необходимыми для заключительного диагноза. Выполненная в условиях местного или общего обезболивания трепан-биопсия, позволяет получить образец тканей опухоли. Дальнейшее морфологическое и иммуногистохимическое исследование образца позволит подтвердить первичную гепатоцеллюлярную карциному.
Обычно трепан-биопсия печени легко выполнима. Если же имеются противопоказания для выполнения такого метода, на помощь приходит лапароскопия. Выполненная в условиях общего обезболивания лапароскопическая биопсия печени позволяет не только получить материал для морфологического исследования, но и оценить состояние других органов брюшной полости.
Большинство злокачественных опухолей печени - вторичные. Они представляют собой узлы размножения и роста опухолевых клеток, распространившихся из первичного очага, то есть метастазы рака другой локализации. Вторичные очаги в печени редко нуждаются в верификации: наличие первичной опухоли и характерные для нее путь и скорость метастазирования позволяют констатировать распространение опухоли в печень и использовать полученные данные для коррекции плана лечения первичного рака, включив в него лечение метастазов в печень.
Само по себе метастатическое поражение печени не является признаком неизлечимости заболевания. Размер, расположение, количество вторичных очагов, а также локализация и морфологический вариант первичного очага – вот исходные условия, которые определяют эффективность лечения в целом и позволяют составить прогноз.
Читайте также: