Что такое уремическая интоксикация
Обновлено: 01.05.2024
Сфинктерный проктит – одно из сравнительно распространенных проктологических заболеваний, суть которого заключается в воспалении прямой кишки на конечном, ближайшем к анальному отверстию участке (последние 2-4 сантиметра перед анусом).
Сфинктерный проктит, как и другие колопроктологические заболевания, обычно очень дискомфортен для пациента, – испытывающего сильные боли, утрачивающего работоспособность и качество жизни. Поэтому важно вовремя, при первых же симптомах (см. ниже) обратиться к врачу соответствующего профиля, не дожидаясь развития еще более серьезных осложнений.
Причины
Сфинктерный проктит – воспаление инфекционной этиологии. Причиной является либо активизация условно-патогенного микробиома прямой кишки, либо внешняя инвазия – инфекция, занесенная из соседних зараженных зон (прежде всего, урогенитальных) или переданная половым путем (кратчайший путь – анальный секс). Изолированный сфинктерный проктит встречается редко, это скорее исключение; гораздо чаще такое воспаление развивается на фоне хронических или острых заболеваний более общего характера: геморроя, криптита, анальных трещин, парапроктита, а также онкологических и гастроэнтерологических заболеваний, протекающих с кишечным воспалением. В зависимости от выявленного патогена, различают неспецифический и специфический анит (в последнем случае типичным возбудителем является гонококк).
Наиболее значимыми факторами риска выступают ослабление иммунной защиты, несоблюдение гигиенических норм, неразборчивые половые связи и сексуальное экспериментаторство, употребление алкоголя и раздражающей кишечник пищи, наличие в организме хронических инфекционно-воспалительных очагов. В ряде случаев, особенно в детском возрасте, сфинктерный проктит развивается на фоне гельминтоза.
Симптоматика
Классическая клиника сфинктерного проктита включает болевой синдром (спазм пораженной мышечной ткани может быть очень болезненным), мацерацию перианальных зон (мокнутие кожи вокруг заднепроходного отверстия из-за постоянно выделяющегося содержимого анального канала, дурно пахнущего и кишащего патогеном), гиперемию, отечность, ложные позывы на дефекацию. Нередко выявляется выраженная симптоматика общей инфекционной интоксикации: недомогание, слабость, субфебрилитет, головная боль, диссомния и т.п. Из-за боли резко снижается мобильность и активность, больные вынуждены искать лежачего положения.
Диагностика
Учитывая выраженный болевой синдром, любые диагностические процедуры при подозрении на анусит должны производиться с максимальной осторожностью, желательно под местной анестезией. Осуществляют пальцевое ректальное исследование, стандартные для проктологии аноскопию и/или ректороманоскопию; при наличии обоснованных диагностических сомнений производят колоноскопию (в ходе которой отбирается биоптат для гистологического анализа), МРТ и другие исследования по показаниям. Назначают стандартные и специальные лабораторные анализы.
Лечение
Стратегическими направлениями терапии сфинктерного проктита являются а) эрадикация (полная ликвидация, устранение) инфекции, б) противовоспалительные меры и в) купирование болевого синдрома. Соответственно, назначают антибиотики и/или антигельминтные препараты, нестероидные противовоспалительные средства, анальгетики (в наиболее тяжелых случаях прибегают к новокаиновым блокадам).
Применяются различные лекарственные формы – инъекции, суппозитории, гели, мази, микроклизмы и др. Большое терапевтическое значение имеет диета, максимально возможное исключение всех этиопатогенетических факторов и факторов риска (см. выше), нормализация стула по частоте и консистенции. Режим постельный. Необходимо интенсифицировать гигиенические процедуры, избегать ношения белья из синтетических тканей. В любом случае, обязательными являются санация инфекционных очагов и/или терапия основного заболевания, обострение которого послужило причиной или фоном для развития сфинктерного проктита.
Токсическая нефропатия — это повреждение гломерулярного аппарата и почечных канальцев, вызванное действием экзо- и эндотоксинов, гемодинамическими и метаболическими нарушениями при отравлениях. Проявляется болями в пояснице, астеническим синдромом, отечностью, олигоанурией, которая впоследствии сменяется полиурией, полиорганными нарушениями. Диагностируется при помощи общего, биохимического анализов крови и мочи, проб Реберга, Зимницкого, УЗИ и томографии почек, УЗДГ почечных сосудов, химико-токсикологических исследований. Лечение включает проведение дезинтоксикационной терапии, инфузионной коррекции нарушений метаболизма, ЗПТ.
МКБ-10
Общие сведения
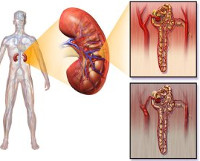
Токсическая нефропатия — собирательное понятие, объединяющее ряд нефрологических заболеваний со сходным этиопатогенезом и клинической картиной. Распространенность патологии достигает 0,04%, что составляет до 20% всех регистрируемых случаев ОПН. Рост заболеваемости связан со все более широким применением химических веществ на различных производствах и в быту: по наблюдениям, ежегодно до 10 млн. человек постоянно контактирует с нефротоксичными химикатами. Кроме того, обратной стороной успехов фармацевтической отрасли стало появление новых лекарственных средств, оказывающих влияние на почки. Актуальность своевременного выявления токсической формы нефропатий обусловлена высоким уровнем смертности и тяжелыми исходами при необратимой деструкции ткани почек.

Причины
Поражение почечной паренхимы обусловлено воздействием химических веществ, оказывающих прямой или опосредованный нефротоксический эффект. В большинстве случаев ренальную дисфункцию, а в тяжелых случаях и деструкцию тканей, вызывают экзогенные производственные и бытовые яды, хотя у некоторых пациентов заболевание вызвано эндогенной интоксикацией. Специалисты в сфере урологии и нефрологии выделяют следующих группы причин, которые приводят к развитию нефропатии:
- Прием веществ с нефротоксическим эффектом. При попадании в почки ядов этой группы возникают острая гломерулопатия или тубулярный некроз, вызванный реабсорбцией большого количества токсических веществ. Непосредственным повреждающим эффектом на почечную ткань обладают соли тяжелых металлов (кадмия, свинца, ртути, золота, мышьяка, йода, висмута, хрома и др.), этиленгликоль, щавелевая и борная кислоты, бензин, фенол, толуол, орелланиновые грибные токсины, яды некоторых животных.
- Опосредованное токсическое повреждение почек. Отравления веществами с гемолитическим эффектом (уксусной кислотой, мышьяковистым водородом, медным купоросом, змеиным ядом и др.) осложняются закупоркой нефронов гемоглобином. Аналогичное повреждение вызывают массивное размозжение тканей и синдром длительного сдавления, при которых наблюдается миоглобинурия. При токсическом поражении печени ренальная паренхима вторично повреждается ксенобиотиками и эндогенными токсинами.
- Общие клинические проявления отравления. Ряд химических веществ не оказывают прямого нефротоксического эффекта, однако системные проявления, возникающие при их приеме, приводят к тяжелой ренальной дисфункции. Чаще всего токсические формы нефропатии развиваются на фоне отравлений с клиникой шока, некомпенсированного ацидоза, выраженных метаболических расстройств. Такая же ситуация возникает под влиянием эндо- и экзотоксинов патогенной и условно-патогенной микрофлоры.
Постоянное расширение ассортимента медикаментозных препаратов, в первую очередь антибактериальных и противоопухолевых средств, привело к увеличению количества случаев токсической лекарственной нефропатии. По результатам исследований, более чем у 30% пациентов неолигурическая почечная недостаточность связана с приемом фармацевтических препаратов.
Нефротоксичные медикаменты могут прямо повреждать почечные канальцы (аминогликозиды, амфотерицины, иммуноглобулины, НПВС и др.), вызывать их закупорку (сульфаниламиды, циклоспорины, производные пуриновых нуклеозидов), системно нарушать ренальную гемодинамику (β-адреноблокаторы, некоторые диуретики) или оказывать сочетанное действие. Развитие токсической ятрогенной нефропатии также возможно при проведении лучевой терапии.
Патогенез
Механизм развития токсической нефропатии определяется причинами, спровоцировавшими почечную дисфункцию. Патогенез расстройств, вызванных нефротоксинами прямого действия, основан на нарушении биохимических процессов в нефронах, эпителиоцитах проксимальных и дистальных канальцев. После фильтрации клубочками токсическое вещество попадает в канальцевую систему, где вследствие реабсорбции воды его уровень возрастает почти в 100 раз. Возникающий градиент концентрации способствует поступлению и накоплению ксенобиотика в канальцевом эпителии до определенного критического уровня.
В зависимости от типа экзотоксина в эпителиоцитах происходят процессы деструкции клеточных и митохондриальных мембран, лизосом, компонентов цитоплазмы, гладкого эндоплазматического ретикулума, рибосом и т. п. с развитием в наиболее тяжелых случаях острого тубулярного некроза. Некоторые нефротоксины за счет инициации гипериммунных процессов разрушают гломерулярный аппарат коркового слоя. Осаждение в клубочковых структурах иммунных комплексов или образование в мембранах комплексных антигенов с последующей атакой антител провоцируют начало острого гломерулонефрита или интерстициального нефрита без повреждения канальцевых эпителиоцитов. Важным фактором прямой нефротоксичности является способность некоторых веществ стимулировать образование свободных радикалов.
Патогенез опосредованного повреждения почек при закупорке канальцев основан на развитии в их клетках некротических процессов, нарушении реабсорбционной способности. Внутриренальный застой мочи сопровождается ретроградным током гломерулярного фильтрата и последующим повреждением нефронов. При нефропатиях, возникших на фоне общих отравлений, основой патоморфологических изменений обычно становится ишемия клеток и нарушение биохимических процессов за счет кислотно-щелочного и водно-электролитного дисбаланса. На начальном этапе возникает дисфункция эпителиоцитов, которая впоследствии может осложниться токсической дегенерацией и некрозом канальцевого эпителия, деструкцией гломерулярных базальных мембран, интерстициальным отеком.
Классификация
Систематизация форм токсической нефропатии проводится с учетом особенностей этиопатогенеза заболевания и тяжести симптоматики. Такой подход позволяет выработать оптимальную тактику ведения пациента, а в ряде случаев предупредить развитие необратимой деструкции тканей. С учетом этиологического фактора и механизма повреждения почек различают следующие формы заболевания:
- Токсическая специфическая нефропатия. Развивается под влиянием экзогенных и эндогенных веществ с прямыми и опосредованным нефротоксическим эффектом. Отличается быстрым развитием тканевой деструкции, которая у части пациентов является необратимой. Чаще требует раннего начала заместительной почечной терапии.
- Токсическая неспецифическая нефропатия. Осложняет течение отравлений и заболеваний с выраженным интоксикационным синдромом, при которых ведущими становятся гемодинамические и метаболические расстройства. На начальных этапах нарушения носят функциональный характер и лишь позднее начинается разрушение тканей.
При легком течении нефропатия выявляется лабораторно: в клиническом анализе мочи определяется повышенное содержание белка, лейкоцитов, эритроцитов, появляются цилиндры. Средняя степень характеризуется уменьшением количества мочи и нарушением фильтрационной функции с увеличением уровня мочевины, креатинина, калия в сыворотке крови. Для тяжелого течения характерна клиника ОПН, вплоть до наступления уремической комы.
Симптомы токсической нефропатии
Возникают тошнота, рвота, понос. Кожные покровы и видимые слизистые становятся сухими, желтушными. Нарастание почечной недостаточности сопровождается практически полным прекращением мочевыделения, усилением отечности, ее нисходящим распространением на другие отделы тела, появлением петехиальной сыпи. При тяжелых поражениях развивается мозговая симптоматика — вялость, заторможенность, оглушенность, слуховые, зрительные, тактильные галлюцинации, судорожный синдром. Признаки выраженной ренальной дисфункции обычно сохраняются в течение 7-14 суток.
На следующем этапе развития заболевания, длящемся от 10-15 до 30 дней, олигоанурия сменяется постепенным усилением диуреза. Больной выделяет за сутки от 1,8 до 5-8 л и более мочи. Сохраняются слабость, утомляемость, мучительная жажда, уменьшается масса тела. Длительность периода реконвалесценции при интоксикационной нефропатии зависит от объема и характера поражения. Обычно для восстановления функциональной состоятельности органа требуется от 6 месяцев до 2 лет.
Осложнения
В 20-70% случаев токсическая нефропатия завершается летальным исходом из-за массивной необратимой деструкции ренальной паренхимы. Снижение фильтрационной функции у пациентов с ОПН приводит к гиперкалиемии с замедлением сердечного ритма, фибрилляцией и асистолией желудочков. Нарушение работы сердца в сочетании с гипопротеинемией повышает риск развития отека легких.
Длительная уремия сопровождается усиленным выделением азотистых метаболитов через кожу, серозные и слизистые оболочки с развитием уремического перикардита, плеврита, гастрита, энтероколита, ларинготрахеита, токсическим поражением печени, костного мозга. При нарушении секреции компонентов ренин-ангиотензиновой системы возможно развитие артериальной гипертензии. Отдаленными последствиями токсического поражения почек являются хронический тубулоинтерстициальный нефрит, хроническая почечная недостаточность, новообразования органов мочевыделительного тракта.
Диагностика
Постановка диагноза токсической нефропатии обычно не представляет сложности в тех случаях, когда заболевание возникло после отравления химическим веществом. Диагностический поиск направлен на оценку характера, объема возможного повреждения тканей, определение выраженности ренальной дисфункции. Пациентам с нефропатией рекомендованы следующие лабораторно-инструментальные методы исследований:
- Общий анализ мочи. Определяются протеинурия, лейкоцитурия, микрогематурия, цилиндрурия. Относительная плотность мочи в олигоанурической фазе превышает 1030 г/л, в полиурической составляет ниже 1003 г/л. Дополнительное проведение пробы Зимницкого при полиурии выявляет снижение концентрационной функции.
- Биохимический анализ крови. До восстановления объема диуреза повышаются сывороточные уровни креатинина, мочевой кислоты, азота мочевины, калия, кальция, неорганического фосфора. Нарушение фильтрационной способности гломерул также подтверждается результатами нефрологического комплекса и пробы Реберга.
- УЗИ почек. При эхографии нефропатия токсического типа проявляется увеличением размеров почечной паренхимы за счет интерстициального и лимфостатического отека. Участки некроза имеют вид гипоэхогенных полостей или гиперэхогенных включений. УЗДГ ренальных сосудов выявляет гемодинамические нарушения.
- Томография почек. Компьютерная томография почек позволяет получить послойное изображение ренальных тканей и обнаружить даже небольшие участки деструкции. В целях безопасности при токсических поражениях исследование рекомендуется проводить без контраста или заменить его МРТ, хотя в таком случае информативность несколько снижается.
Для подтверждения токсического характера нефрологической патологии по возможности проводятся химико-токсикологические исследования, позволяющие установить химическое вещество, которое вызвало расстройство. Контрастные методы исследований (экскреторная урография, ангиография почек) применяют с осторожностью в связи с риском усугубления клинической ситуации контраст-индуцированными деструктивными процессами. Для контроля за состоянием других органов и систем проводятся биохимические пробы печени, коагулограмма, ЭКГ. Изменения общего анализа крови неспецифичны: могут выявляться анемия, умеренный лейкоцитоз, повышение СОЭ, тромбоцитопения.
Нефропатию токсического происхождения дифференцируют со вторичными нефропатиями другого генеза (контраст-индуцированной, диабетической, дисметаболической и др.), острым гломерулонефритом, ишемическим некрозом почек, травматическими повреждениями почечной паренхимы, атероэмболической болезнью. По назначению уролога-нефролога пациента консультируют токсиколог, анестезиолог-реаниматолог, невролог, терапевт, кардиолог, пульмонолог, гепатолог.
Лечение токсической нефропатии
Больных, почки которых повреждены в результате отравления экзо- или эндотоксинами, госпитализируют в палату интенсивной терапии. Основными терапевтическими задачами являются скорейшая элиминация химического вещества, коррекция метаболических расстройств, предупреждение возможных осложнений. С учетом этапа заболевания пациентам показаны:
- Дезинтоксикационная терапия. Проводится в первые часы и сутки после отравления. Для ускоренного выведения токсина проводят промывание желудка, форсированный диурез с назначением осмотических мочегонных и салуретиков, используют адсорбенты, слабительные средства, специфические антидоты. В сложных случаях эффективны плазмаферез, гемосорбция, гемофильтрация, ультрафильтрация, гемодиализ, перитонеальный диализ. Некоторым пациентам назначают переливание крови и ее компонентов.
- Инфузионная коррекция метаболических нарушений. Начинается сразу после госпитализации и продолжается в олигоанурическом периоде ОПН. Для восстановления электролитного баланса и кислотно-щелочного равновесия применяют антагонисты калия (обычно — препараты кальция), инфузию глюкозы с инсулином, ощелачивающие полиионные растворы. Возможен дальнейший прием энтеросорбентов, связывающих токсические метаболиты. При значительной ренальной дисфункции оправдано проведение ЗПТ.
При утяжелении состояния больного проводится комплексная противошоковая терапия, купируются неотложные состояния (уремическая кома, отек легких, судорожный синдром, гипертонический криз). В полиурической фазе продолжается массивная (до 5-6 л/сут) инфузионная терапия для поддержания ОЦК и физиологической концентрации метаболитов. На этапе восстановления проводится общеукрепляющее лечение и определяется тактика дальнейшего ведения пациента с учетом степени сохранности почечных функций.
Прогноз и профилактика
Токсическая нефропатия — тяжелое, прогностически неблагоприятное расстройство с высокими показателями летальности. Своевременное установление токсина, правильная оценка морфологической сохранности и функциональной состоятельности почечной паренхимы, проведение адекватной интенсивной терапии повышают шансы благоприятного исхода нефропатии. Профилактика заболевания направлена на предупреждение попадания в организм токсических веществ: ограничение времени контакта с нефротоксичными ядами, использование средств индивидуальной защиты (респираторов, защитной одежды), отказ от употребления в пищу незнакомых грибов.
Работникам предприятий с вредными условиями производства рекомендовано прохождение профилактических медосмотров для раннего выявления почечной дисфункции. Для снижения количества случаев гемодинамического и метаболического поражения почечных клеток при системных нарушениях пациентам с отравлениями рекомендован регулярный контроль функциональной состоятельности почек и адекватное купирование острого состояния. С учетом роста распространенности лекарственных нефропатий при назначении нефротоксичных лекарственных средств необходимо тщательное обследование пациента для выявления предпосылок к токсическому повреждению ренальной паренхимы.
2. Патогенез токсических нефропатий/ Гоженко А.И. // Актуальные проблемы транспортной медицины. — 2006 — № 2.
3. Клинико-морфологические изменения при токсической нефропатии, вызванной отравлением некоторыми спиртсодержащими жидкостями: Автореферат диссертации/ Морозов В.И. – 1996.
4. Механизмы хронической токсической нефропатии у рабочих химической промышленности: Автореферат диссертации/ Письменский А.В. – 2006.
Гемолитико-уремический синдром - острое патологическое состояние, характеризующееся одновременным развитием микроангиопатической гемолитической анемии, тромбоцитопении и азотемии. Гемолитико-уремический синдром может проявляться кровавой диареей, абдоминальными болями, бледностью и иктеричностью кожи и склер, пастозностью лица, петехиями на коже, анурией, поражением ЦНС, печени, поджелудочной железы и сердца. Диагноз гемолитико-уремического синдрома основан на характерных клинических признаках, результатах общего и биохимического анализа крови и мочи, коагулограммы, бакпосева кала. Лечение гемолитико-уремического синдрома включает патогенетическую, симптоматическую и заместительную терапию.
МКБ-10
Общие сведения
Гемолитико-уремический синдром (болезнь Гассера) – тяжелое полиэтиологическое расстройство, проявляющееся сочетанием неиммунной гемолитической анемии, тромбоцитопении и острой почечной недостаточности. Гемолитико-уремический синдром наблюдается преимущественно у детей грудного и младшего возраста (с 6 мес. до 4 лет), но также встречается у детей старшего возраста и редко у взрослых. Ежегодно в расчете на 100 тыс. детского населения регистрируются 2-3 случая гемолитико-уремического синдрома у детей до 5 лет и 1 случай у детей до 18 лет. Поскольку гемолитико-уремический синдром - одна из частых причин острой почечной недостаточности у детей, то от своевременности его диагностики и лечения зависит исход заболевания.

Причины
У детей частыми причинами гемолитико-уремического синдрома являются острая кишечная инфекция (90%) и инфекции верхних дыхательных путей (10 %).
Основное значение в развитии Д+ гемолитико-уремического синдрома имеет энтерогеморрагическая Е. coli, продуцирующая специфический шига-подобный веротоксин, способный избирательно повреждать эндотелиальные клетки сосудов почек и головного мозга. Наибольшее сродство веротоксина с эндотелием капилляров почек наблюдается у детей первых 3 лет жизни. Веротоксин вызывает эндотелиальный апоптоз и лейкоцитозависимое воспаление, а также запускает цепь патологических реакций, приводящих к гемолизу эритроцитов, агрегации и деструкции тромбоцитов, локальной активации процесса коагуляции и внутрисосудистого отложения фибрина, развитию ДВС-синдрома.
Такими же свойствами обладает шигатоксин S. dysenteriae I типа. Развивающиеся микроциркуляторные нарушения (микроангиопатическая гемолитическая анемия, тромбоцитопения и микротромбозы) приводят к ишемическим изменениям в органах мишенях. При гемолитико-уремическом синдроме на фоне ОКИ наиболее часто поражаются капилляры клубочков почек, что может приводить к снижению скорости гломерулярной фильтрации, ишемии или некрозу клубочков, вторичной дисфункции или некрозу почечных канальцев, при массивном поражении – к ОПН.
Заражение энтерогеморрагической Е. coli может произойти при контакте с животными (кошками, крупным рогатым скотом) или инфицированным человеком; употреблении недостаточно термически обработанных мясных изделий, непастеризованных молочных продуктов, фруктовых соков, загрязненной воды. Для гемолитико-уремического синдрома характерна сезонность: на фоне ОКИ - преимущественно теплое время года (июнь-сентябрь), на фоне вирусных инфекций - зимне-весенний период.
Д- гемолитико-уремический синдром может быть постинфекционным, лекарственным, поствакцинальным, наследственным, связанным с системными заболеваниями соединительной ткани, идиопатическим. В 40% случаев развитие Д- гемолитико-уремического синдрома обусловлено респираторной инфекцией, возбудителем которой является S. pneumoniae, разрушающий мембраны эритроцитов, тромбоцитов и эндотелиоцитов с помощью фермента нейраминидазы. Вирусы ветряной оспы, ВИЧ, гриппа, Эпштейна-Барра, Коксаки также могут быть причиной гемолитико-уремического синдрома.
Установлена связь между развитием гемолитико-уремического синдрома у взрослых и употреблением некоторых медикаментов (циклоспорина А, митомицина С, эстроген - содержащих контрацептивов, противоопухолевых препаратов), трансплантацией костного мозга, злокачественными новообразованиями, системной красной волчанкой и антифосфолипидным синдромом, беременностью. Выявлены семейные случаи гемолитико-уремического синдрома с аутосомным типом наследования обусловленные дефектом системы комплемента, нарушением обмена простациклина, недостаточностью антитромботических факторов и др.
В основе гемолитико-уремического синдрома может лежать активация тромбоцитов иммунными комплексами (например, комплексом антиген – антитело после прививок живыми вакцинами против полиомиелита, против ветряной оспы, против кори, АКДС).
Классификация
В зависимости от этиологии и клинических особенностей разделяют гемолитико-уремический синдром диареяассоциированный - Д+ (типичный) и не ассоциированный с диареей - Д- (спорадический или атипичный). Д+ гемолитико-уремический синдром чаще встречается у детей раннего и младшего возраста, является эндемическим (распространен в Поволжье, Московском регионе); недиарейный – более свойственен детям старшего возраста и взрослым.
По тяжести течения выделяют легкую и тяжелую формы гемолитико-уремического синдрома.
- Легкая форма гемолитико-уремического синдрома подразделяется на тип А (анемия, тромбоцитопения и азотемия) и тип Б (триада симптомов в сочетании с судорожным синдромом или артериальной гипертензией);
- Тяжелая форма – на тип А (триада симптомов в сочетании с анурией длительностью более суток) и тип Б (триада симптомов в сочетании с анурией, артериальной гипертензией и судорожным синдромом).
Симптомы гемолитико-уремического синдрома
В клинической картине гемолитико-уремического синдрома различают продромальный период, разгар заболевания и восстановительный период. Продолжительность продромального периода составляет от 2 до 7 суток. Для него характерно появление признаков поражения ЖКТ или дыхательных путей.
Гемолитико-уремический синдром на фоне ОКИ, вызванной энтеропатогенной Е. coli, имеет ярко выраженную симптоматику. Развиваются симптомы гастроэнтерита или колита (часто кровавая диарея), тошнота, рвота, абдоминальные боли, лихорадка. Постепенно общее состояния ребенка ухудшается, повышенная возбудимость сменяется вялостью.
В период разгара гемолитико-уремического синдрома превалируют проявления гемолитической анемии, тромбоцитопении и ОПН: бледность и иктеричность кожного покрова, склер и слизистых оболочек; пастозность век, голеней; кожный геморрагический синдром в виде петехий или экхимозов, иногда - носовые кровотечения, в тяжелых случаях - снижение диуреза (олигурия или анурия). Тяжесть и продолжительность дизурии зависит от степени и глубины повреждения почек.
Гемолитико-уремический синдром может проявляться полиорганной патологией: поражением ЦНС, печени, поджелудочной железы, сердца, артериальной гипертензией. В 50% случаев гемолитико-уремического синдрома наблюдаются неврологические нарушения: подергивания мышц, гиперрефлексия, децеребрационная ригидность, гемипарезы, судороги, ступор, кома (особенно выраженные у детей первых лет жизни). Выявляются гепатоспленомегалия, кардиомиопатия, тахикардия, аритмия.
Продолжительность гемолитико-уремического синдрома обычно составляет 1-2 недели, затем наступает стабилизация и в 70% случаев - постепенное восстановление нарушенных функций: улучшение выделения мочи, повышение уровня тромбоцитов, нормализация уровня гемоглобина. При тяжелом течении наступает либо летальный исход вследствие экстраренальных поражений, либо формирование ХПН.
Диагностика
Диагноз гемолитико-уремического синдрома основан на выявлении характерных клинических признаков, осложняющих течение ОКИ или ОРВИ: гемолитической анемии, тромбоцитопении, ДВС-синдрома, азотемии.
При гемолитико-уремическом синдроме в крови обнаруживаются анемия, анизоцитоз и полихроматофилия эритроцитов (наличие фрагментированных форм), присутствие свободного гемоглобина, снижение количества тромбоцитов, лейкоцитоз, умеренная непрямая гипербилирубинемия, возрастание уровня мочевины и креатинина, гипонатриемия, гиперкалиемия, ацидоз (в олигоанурической стадии ОПН), гипоальбуминемия.
Моча приобретает коричневато-ржавый цвет, в ней могут появиться фибриновые комки, отмечается гематурия, протеинурия, гемоглобинурия. У детей с ОКИ выполняют бактериологическое исследование кала на выявление штаммов энтеропатогенной Е. coli. При тяжелых неврологических нарушениях возможно проведение КТ головного мозга и люмбальной пункции для исключения кровотечения и менингита.
Дифференциальная диагностика гемолитико-уремического синдрома проводится с неотложными хирургическими состояниями (аппендицитом, кишечной непроходимостью, окклюзией мезентериальных сосудов, перфорацией кишечника, дивертикулом подвздошной кишки), ишемическим колитом, септицемией с ДВС-синдромом, вирусным или бактериальным гастроэнтеритом, тяжелой степенью дегидратации при кишечных токсикозах, тромботической тромбоцитопенией.
Лечение гемолитико-уремического синдрома
Лечение гемолитико-уремического синдрома определяется периодом развития заболевания и тяжестью поражения почечной ткани. Чем раньше ребенок с гемолитико-уремическим синдромом поступает в стационар, тем выше вероятность его успешного и полного излечения. Патогенетическая терапия включает нормализацию агрегатного состояния крови с использованием антиагрегантов, гепаринотерапии; улучшение микроциркуляции (трентал, эуфиллин); коррекцию антиоксидантного статуса (витамины А и Е).
При бактериальной этиологии гемолитико-уремического синдрома назначаются антибиотики широкого спектра действия; при инфекции, вызванной энтеропатогенной Е. coli, прием антибиотиков и препаратов, замедляющих моторику кишечника, не рекомендуется. При олигоанурии показана коррекция водно-электролитных расстройств, подавление реакций метаболического распада и инфекционного процесса. Для коррекции тяжелой анемии используется инфузия эритроцитарной массы.
В половине случаев типичного гемолитико-уремического синдрома необходимо раннее проведение заместительной терапии: обменного плазмафереза, перитонеального диализа или гемодиализа. Гемодиализ проводится ежедневно в течение всего олигоуремического периода. В случае развития терминальной стадии ХПН показана трансплантация почки.
Прогноз
Гемолитико-уремический синдром имеет серьезный прогноз, летальность у маленьких детей во время острой фазы заболевания составляет 3-5%, у 12% развивается терминальная ХПН, у 25% происходит снижение клубочковой фильтрации. Плохой прогноз имеют атипичные наследственные, аутоиммунные и связанные с беременностью формы гемолитико-уремического синдрома.
Классическая форма гемолитико-уремического синдрома у детей раннего возраста с преимущественным поражением почечных клубочков протекает более благоприятно. В случае Д+ гемолитико-уремического синдрома наблюдается лучший исход по сравнению с недиарейным синдромом, сопровождающимся частыми рецидивами и высокой летальностью.
Уремия — это тяжелое клиническое проявление прогрессирующей почечной недостаточности, вызванное аутоинтоксикацией азотистыми и другими токсическими метаболитами. Проявляется нарастающей астенией, бледностью и субиктеричностью кожи, мучительным зудом, петехиальной сыпью, артериальной гипертензией, запахом аммиака изо рта, диспепсическими расстройствами, нарушением дыхания. Диагностируется с помощью биохимического исследования крови, пробы Реберга, УЗИ почек, экскреторной урографии, нефросцинтиграфии. Лечение предполагает комплексную терапию основного заболевания, коррекцию метаболических расстройств и отдельных симптомов, проведение ЗПТ, трансплантацию почки.
МКБ-10

Общие сведения
Традиционно уремический синдром рассматривается как самостоятельное патологическое состояние в связи с полисистемностью поражений, тяжестью симптоматики, неблагоприятным витальным прогнозом, которые выходят за рамки прямых признаков ренальной патологии. Как и почечная недостаточность, мочекровие может быть острым и хроническим.

Причины уремии
Аутоинтоксикация при мочекровии связана с прогрессированием острой или хронической почечной недостаточности. Соответственно причинами возникновения уремического синдрома являются те же ренальные и экстраренальные факторы, которые нарушили функционирование почек. Специалисты в сфере урологии и нефрологии выделяют следующие группы причин, вызывающих состояние уремии:
- Заболевания почек. Уменьшение количества активных нефронов со снижением почечной функциональности становится следствием гнойной, аутоиммунной, ишемической деструкции почечных тканей. Развитие уремии возможно при пиелонефрите, гломерулонефрите, наследственном нефрите, волчаночной нефропатии, пионефрозе, отторжении почечного трансплантата, тромбозе вен почек.
- Онкопатология. Азотная интоксикация наблюдается при разрушении раковым процессом ренальной паренхимы, повреждении гемато-уремического барьера у больных с аденокарциномой почки и другими злокачественными неоплазиями органа. Уремия также возникает вследствие почечной дисфункции при паранеопластической нефропатии, осложнившей экстраренальные опухоли.
- Обструкция мочевыводящих путей. Нарушение оттока мочи приводит к повышению давления в канальцах и гломерулах. Попаданию токсинов в кровь способствует разрушение клубочковых мембран. Обструкционный механизм уремии отмечается при мочекаменной болезни, мочеточниково-влагалищных свищах, сморщенном мочевом пузыре, аденоме простаты и др.
- Повреждение почек при отравлениях и интоксикациях. Почечная недостаточность с уремическим синдромом является этапом развития или исходом ряда токсических нефропатий. Уремия вследствие острой и хронической деструкции почек диагностируется при балканской эндемической нефропатии, лекарственном поражении почек, контраст-индуцированных дисфункциях.
- Экстраренальные причины. Недостаточностью почек осложняются острые состояния (кардиогенный шок, ДВС-синдром, кровотечения). Поражение почек выявляется при сахарном диабете, гипертонической болезни, туберкулезе, гестозах, других соматических, эндокринных, инфекционных болезнях. Дисметаболические нефропатии с исходом в уремию возникают при нарушениях обмена веществ.
Патогенез
Механизм развития уремического синдрома при ОПН, ХПН основан на комплексном повреждающем воздействии метаболитов, выведение которых нарушается при ренальной дисфункции. Ключевую роль в патогенезе уремии играет накопление продуктов белкового обмена, в первую очередь — мочевины, которая подвергается трансформации в кишечнике, выводится через кожу, слизистые оболочки, органы дыхания, раздражая их ткани. Токсическое воздействие на клетки разных органов и систем оказывают аммиак, метаболиты ароматических кислот (фенолы, индолы, скатолы), среднемолекулярные пептиды, ацетон, протеазы, ряд других соединений.
Повреждение клеточных мембран и нарушение работы ферментных систем при уремии усугубляет интоксикационный синдром и провоцирует полиорганную недостаточность. Низкая экскреция веществ с кислой реакцией, ингибирование процессов аммонио- и ацидогенеза, нарушение канальцевой реабсорбции завершается развитием ацидоза, электролитного дисбаланса, возникновением тяжелых мозговых, сердечно-сосудистых, дыхательных, гормональных расстройств.
Симптомы уремии
Клиническая картина уремического синдрома обычно формируется постепенно. Первыми признаками уремии являются изменения общего состояния: слабость, быстрая утомляемость, нарушения когнитивных функций, ухудшение аппетита, сонливость в дневное время с последующей ночной бессонницей, выраженная жажда, снижение температуры тела до 35,0-35,5° C. Кожа становится сухой, бледной с желтоватым оттенком, при длительной почечной недостаточности — серой. Появляется сильный зуд, петехиальная сыпь, расчесы.
Язык покрыт сероватым налетом, изо рта пациента слышен запах аммиака. У многих больных отмечается повышение артериального давления. На поздней стадии уремии происходит выделение токсических метаболитов через слизистые ЖКТ и дыхательной системы, что проявляется симптомами гастроэнтерита (тошнота, рвота, диарея), болью в горле, сухим кашлем. В тяжелых случаях наблюдается шумное глубокое дыхание, свидетельствующее о поражении дыхательного центра.
Осложнения
Длительное декомпенсированное течение уремии приводит к развитию острой энцефалопатии, при которой наблюдается спутанность сознания, наличие бреда и галлюцинаций, миоклонии, судороги. На фоне ионного дисбаланса выявляется аритмия, сердечная недостаточность. Угнетение иммунитета повышает риск возникновения и тяжесть течения инфекционных процессов. Для уремии характерно формирование плеврита и перикардита вследствие выделения кристаллов мочевины через серозные оболочки.
Расстройство может осложняться желудочно-кишечными, легочными, носовыми, маточными кровотечениями, причиной которых являются изъязвления слизистых, снижение количества тромбоцитов и белков свертывающей системы крови. При значительном снижении уровня кальция уремия усугубляется остеопорозом, остеомаляцией, гиперплазией паращитовидных желез. Наиболее опасное осложнение заболевания – уремическая кома, которая развивается при высокой концентрации аммиака в крови, выраженном метаболическом ацидозе и зачастую завершается летальным исходом.
Диагностика
Постановка диагноза уремии не представляет затруднений при наличии характерных клинических признаков и изменений биохимического состава крови. Подозревать нарушение фильтрационной и выделительной функции нефронов следует у пациентов, которые имеют заболевания мочевой системы в анамнезе. Для диагностики применяют ряд лабораторных и инструментальных методов исследования:
- Биохимический анализ крови. У всех больных отмечается многократное повышение уровня мочевины. Увеличивается концентрация креатинина, его количество кор релирует с тяжестью состояния. Для уремии типично уменьшение уровня альбуминов, диспротеинемия, изменение показателей электролитного обмена — снижение содержания натрия и кальция, повышение концентрации калия.
- Проба Реберга. Фильтрационная способность почек определяется с помощью формульного метода на основании данных об уровне креатинина в моче и плазме. При скорости клубочковой фильтрации от 60 мл/мин до 15 мл/мин у пациента диагностируют компенсированную стадию уремии. Показатель ниже 15,0 мл/мин считается прогностически неблагоприятным и свидетельствует о декомпенсации состояния.
- УЗИ почек. Ультразвуковое исследование позволяет быстро оценить состояние коркового и мозгового вещества органа, выявить абсцесс почки, почечнокаменную болезнь, злокачественные новообразования, склеротические изменения, которые могут служить непосредственной причиной уремии. Сонографию обычно дополняют проведением УЗДГ почечных сосудов для оценки ренального кровотока.
- Рентгенография. Рентгенологически можно визуализировать форму и контуры чашечно-лоханочной системы, мочеточников, мочевого пузыря, динамику заполнения мочевыводящих путей контрастом. Из-за нагрузки на почки при введении контрастного вещества у пациентов с выраженной уремией урографию применяют ограниченно. Экскреторную урографию сочетают с проведением нефросцинтиграфии.
Изменения в клиническом анализе крови при уремии неспецифичны, обычно наблюдается нормохромная анемия, повышение СОЭ, возможна тромбоцитопения, относительная лимфопения. В общем анализе мочи отмечается гипоизостенурия, цилиндрурия, эритроцитурия, при декомпенсированных состояниях рН мочи снижается до 4,5-5. В качестве дополнительных методов обследования мочевыделительной системы могут применяться КТ, МРТ.
Дифференциальная диагностика уремии проводится с гипохлоремической азотемией, гепаторенальным и панкреоренальным синдромами, печеночной энцефалопатией, эклампсией, атипичным гемолитико-анемическим синдромом, в терминальных стадиях — с диабетической комой и другими коматозными состояниями. Кроме врача-нефролога и уролога пациента могут консультировать гематолог, токсиколог, ревматолог, онколог, инфекционист, эндокринолог, анестезиолог-реаниматолог.
Лечение уремии
Выбор врачебной тактики определяется формой и причинами развития почечной недостаточности, особенностями клинической картины, тяжестью состояния пациента. Основными терапевтическими задачами являются максимальное сохранение функциональной способности почек, предупреждение и уменьшение интоксикационных нарушений, коррекция возникших расстройств.
Медикаментозные и хирургические методы ведения больных с уремией дополняют изменением диеты со снижением калорийности, ограничением белковых продуктов, соли, введением в рацион свежих овощей и фруктов, оказывающих ощелачивающий эффект. Для устранения проявлений мочекровия кроме терапии основного заболевания, на фоне которого развилась почечная недостаточность, могут быть использованы:
- Инфузионная терапия. Введение коллоидных, кристаллоидных растворов направлено на коррекцию водно-электролитного и кислотно-щелочного дисбаланса, уменьшение интоксикации. Грамотная дезинтоксикационная и регидратационная терапия позволяет уменьшить проявления полиорганной недостаточности, нормализовать работу сердца и головного мозга. Инфузии специальных составов при необходимости применяют для парентерального питания больных.
- Лекарственная коррекция отдельных симптомов. Чаще всего пациентам с уремией назначают противоанемическую терапию (эритропоэтины, препараты железа, фолиевой кислоты, витамин B12, переливание цельной крови, эритроцитарной массы), гипотензивные средства. При мучительном зуде для усиления дезинтоксикационного эффекта инфузий рекомендованы энтеросорбенты, осмотические слабительные. Для лечения сердечной недостаточности используют гликозиды.
- Заместительная почечная терапия. При недостаточной эффективности фармакотерапии, выраженной ОПН и прогрессирующей ХПН со значительными полиорганными нарушениями, угрозе развития уремической комы показана аппаратная детоксикация. В зависимости от возможностей лечебного учреждения и состояния пациента для удаления токсичных метаболитов разово или периодически проводят перитонеальный диализ, гемодиализ, гемофильтрацию, гемодиафильтрацию.
Хирургическое лечение уремии эффективно при острых интоксикационных состояниях, вызванных обструкцией мочевыводящих путей. Для обеспечения естественного пассажа мочи при обтурации камнем мочеточника выполняют уретеролитотомию, уретеролитоэкстракцию, контактную и дистанционную уретеролитотрипсию. При невозможности восстановления ренальной паренхимы у пациентов, страдающих хроническими нефрологическими заболеваниями, единственным радикальным методом лечения является трансплантация почки.
Прогноз и профилактика
Исход заболевания зависит от степени нарушения функции почек и наличия сопутствующих патологий. Прогноз при острой уремии относительно благоприятный, если скорость клубочковой фильтрации превышает 30 мл/мин. Благодаря использованию ЗПТ у 65-95% таких пациентов удается достичь положительного терапевтического результата. В хронических случаях больным требуется пожизненное проведение диализа либо трансплантация почки. Специфической профилактики не существует. Для предупреждения развития уремии необходима своевременная диагностика и комплексная терапия состояний, которые могут вызвать необратимое ухудшение выделительной функции почек.
1. Морфологические изменения в органах при уремии по секционным данным за 3 года/ Арапов И. А., Кошкин Н. Е., Гусарев С. А.// Молодой ученый. — 2016. — №15.2.
4. Дислипидемии у больных с терминальной уремией на постоянном амбулаторном перитонеальном диализе/ Грабская Е.С. – 2002.
Такая ситуация может развиться при остром инфекционном процессе или нарушениях обмена веществ, однако уремия относится к иному, т.н. ретенционному виду самоотравлений. Это значит, что в крови накапливаются токсические вещества, в норме полностью из него выводимые экскреторной (выделительной) системой.
В отсутствие внешнего гемодиализа или пересадки почки уремия приводит к разрушению клеточных мембран, необратимому поражению тканей, тяжелой полиорганной недостаточности и неизбежному летальному исходу, время наступления которого зависит от причин и темпов прогрессирования эндогенной интоксикации.
Причины
К потенциальным этиологическим, причинным факторам относятся любые заболевания, состояния, патологические процессы, при которых поражается почечная паренхима, блокируется или затрудняется пассаж мочи. Число таких состояний очень велико:
- наследственный и приобретенные нефриты (пиелонефрит, гломерулонефрит, токсический нефрит), аутоиммунные нефропатии, гнойно-некротические пионефрозы;
- нарушения почечной гемодинамики (венозный тромбоз, инфаркт почки);
- сокращение просвета (обструкция) мочевыводящих путей при доброкачественной гиперплазии предстательной железы (аденома простаты), мочекаменной болезни, экстраренальных (внепочечных) опухолях, стриктурах уретры и т.д.;
- рак почки; , инфекционно-токсический и другие виды шока, эндокринно-метаболические расстройства, гипертония, токсикозы беременности и пр.
В целом, этиопатогенетическим фактором уремии можно считать прогрессирующую почечную недостаточность, острую либо хроническую.
Симптоматика
Уремия может результировать смертью за несколько дней (острая уремия) или, – в случаях хронического течения и сравнительно плавного прогрессирования, – за несколько лет; однако при отсутствии надлежащего терапевтического ответа и сопровождения исход одинаков в любом случае.
Диагностика
Диагноз устанавливают анамнестически и клинически, по характерному сочетанию симптомов (несмотря на выраженный полиморфизм уремического синдрома), особенностям динамики состояния, данным инструментального обследования. Однако решающей информативностью обладают биохимические исследования крови, которые в некоторых случаях приходится проводить многократно, с измерением ряда показателей.
Лечение
Читайте также:

