Цитокины при кишечных инфекциях
Обновлено: 25.04.2024
Суппозитории белого, белого с желтоватым оттенком или светло-бежевого цвета, с характерным запахом, цилиндрической формы с заостренным концом, на продольном срезе однородны.
На срезе допускается наличие воздушного стержня или воронкообразного углубления. Допускается неоднородность окраски в виде мраморности.
Фармакологическое действие
Фармакологическое действие - антихламидийное, антибактериальное, противовирусное, противовоспалительное, иммуномодулирующее.
Фармакодинамика
Фармакологическое действие: иммуномодулирующее, противовирусное, антихламидийное.
Фармакологические свойства
Суппозитории Кипферон ® представляют собой комплексную лекарственную форму, содержащую человеческий рекомбинантный интерферон-α2 и КИП.
Интерферон-α2 является активатором врожденного и приобретенного иммунитета, обладает выраженной противовирусной активностью, усиливает защиту от вирусных, хламидийных, микоплазменных и бактериальных инфекций, оказывает иммуномодулирующий эффект в развитии иммунологических реакций, способствует росту и сохранению нормофлоры кишечника и влагалища. Биологическая активность интерферона-α2 реализуется посредством взаимодействия с рецепторным аппаратом иммунокомпетентных и других клеток, приводящего к усилению экспрессии молекул HLA I и HLA II на поверхности всех типов клеток и регуляции кооперации клеток, повышению активности естественных киллеров, а также приданию интактным клеткам устойчивости против их цитолитического действия, пролиферации CD8 Т-клеток. Повышает выработку гамма-интерферона естественными киллерами.
КИП содержит специфические и неспецифические Ig классов G, М, А. Сочетание антивирусных, антихламидийных, антибактериальных и антитоксических антител, принадлежащих к различным классам Ig , обеспечивает агглютинацию, нейтрализацию и преципитацию этиотропных патогенных агентов. В месте аппликации обеспечивает стабилизацию интерферона от секретов слизистых оболочек, нормализует местный иммунитет за счет поступления IgA и IgM с суппозиториями (заместительный эффект), повышает активность местно образуемых цитокинов.
Показания
Препарат применяется в комплексной терапии заболеваний, сопровождающихся вторичными иммунодефицитными состояниями:
острые респираторные заболевания, воспалительные заболевания ротоглотки бактериальной и вирусной этиологии у детей и взрослых;
острые вирусные (ротавирусные) и бактериальные (сальмонеллез, дизентерия, коли-инфекция) кишечные инфекции, в т.ч. с проявлениями дисбактериоза кишечника различной выраженности у детей;
урогенитальный хламидиоз у женщин (включая беременных во II–III триместрах беременности), в т.ч. с проявлениями дисбактериоза влагалища, вульвовагинита, цервицита матки, эрозии шейки матки.
Противопоказания
индивидуальная непереносимость отдельных компонентов;
беременность, I триместр;
Побочные действия
Взаимодействие
Отрицательного воздействия на другие лекарственные препараты не отмечено.
Способ применения и дозы
Ректально и вагинально.
Препарат используется в комплексе с общепринятыми средствами патогенетической терапии инфекционных заболеваний, а также антибиотиками по показаниям. Способ и режим дозирования, а также применение в комплексном лечении определяется врачом в зависимости от диагноза, остроты и тяжести заболевания.
Острые респираторные заболевания, воспалительные заболевания ротоглотки бактериальной и вирусной этиологии: суппозитории вводятся ректально (преимущественно после акта дефекации) детям до 1 года по 1 суппозиторию в день, детям до 12 лет — по 1 суппозиторию 2 раза в день, взрослым и детям старше 12 лет — по 1 суппозиторию трижды в день. Наиболее эффективно и целесообразно назначение препарата Кипферон ® в остром периоде заболевания (желательно в первые 3 дня). Длительность курса лечения определяется этиологией, формой тяжести заболевания, наличием сопутствующих осложнений, патологических состояний и составляет 5–7 дней.
Острые вирусные (ротавирусные) и бактериальные (сальмонеллез, дизентерия, коли-инфекция) кишечные инфекции, в т.ч. с проявлениями дисбактериоза кишечника различной выраженности у детей: суппозитории вводятся ректально (преимущественно после акта дефекации) детям до 1 года по 1 суппозиторию в день, детям до 12 лет — по 1 суппозиторию 2 раза в день, взрослым и детям старше 12 лет — по 1 суппозиторию трижды в день. Наиболее эффективно и целесообразно назначение препарата в остром периоде заболевания (желательно в первые 3 дня). Длительность курса лечения определяется этиологией, формой тяжести заболевания, наличием сопутствующих осложнений, патологических состояний и составляет 5–7 дней.
Урогенитальный хламидиоз у женщин (в т.ч. у беременных во II–III триместрах беременности), в т.ч. с проявлениями дисбактериоза влагалища, вульвовагинита, цервицита матки, эрозии шейки матки: суппозитории вводят глубоко интравагинально (до контакта с задним сводом влагалища и шейкой матки) по 1–2 суппозитория, в зависимости от выраженности заболевания, 2 раза в день. Курс лечения составляет в среднем 10 дней; при наличии эрозии шейки матки применение препарата продолжают до ее эпителизации. По показаниям курс лечения может быть повторен через один месяц. Лечение следует начинать в первые дни после окончания менструации. Перед введением рекомендуется удалить слизь со слизистых оболочек влагалища и шейки матки.
Передозировка
Случаи передозировки препарата неизвестны.
Особые указания
Влияние на способность управлять транспортными средствами. При применении в рекомендованных дозах препарат не оказывает влияния на поведение или функциональные показатели организма, а так же не влияет на способность управлять транспортными средствами, механизмами.
Форма выпуска
Суппозитории вагинальные и ректальные. По 5 суппозиториев в контурной ячейковой упаковке. 1 или 2 контурные ячейковые упаковки вместе с инструкцией по применению в пачку из картона.
Производитель
Для цитирования: Бельмер С.В., Симбирцев А.С., Головенко О.В. и др. Значение цитокинов в патогенезе воспалительных заболеваний толстой кишки у детей. РМЖ. 2003;3:116.
Российский государственный медицинский университет
ГНЦ колопроктологии, Москва
НИИ особо чистых биопрепаратов, Санкт-Петербург
Х ронические воспалительные заболевания желудочно–кишечного тракта в настоящее время занимают одно из ведущих мест в патологии органов пищеварения у детей. Особое значение придается воспалительным заболеваниям толстой кишки (ВЗТК), частота возникновения которых во всем мире неуклонно возрастает. Длительное течение с частыми, а в ряде случаев фатальными рецидивами, развитие местных и системных осложнений – все это побуждает к тщательному изучению патогенеза заболевания в поисках новых подходов к лечению ВЗТК.
В последние десятилетия заболеваемость неспецифическим язвенным колитом (НЯК) составила 5–10 случаев в год на 100 тыс. населения, при болезни Крона (БК) – 1–6 случаев в год на 100 тыс. населения [4]. Показатели распространенности в России, в Московской области соответствуют среднеевропейским данным, но значительно ниже, чем в Скандинавских странах, Америке, Израиле и Англии. Для НЯК распространенность 19,3 на 100 тыс., заболеваемость 1,2 на 100 тыс. человек в год. Для БК распространенность 3,0 на 100 тыс., заболеваемость 0,2 на 100 тыс. человек в год [4]. То, что наибольшая частота отмечена в высокоразвитых станах, обусловлено не только социальными и экономическими факторами, но также генетическими и иммунологическими особенностями больных, определяющими предрасположенность к ВЗТК.
Эти факторы являются основополагающими в иммунопатогенетической теории происхождения ВЗТК. Вирусная и/или бактериальная теории обьясняют лишь острое начало болезни, а хронизация процесса обусловлена как генетической предрасположенностью, так и особенностями иммунного ответа, которые также генетически детерминированы.
Необходимо отметить, что ВЗТК в настоящее время относят к болезням с генетически гетерогенной комплексной предрасположенностью [2]. Выявлено более 15 предположительных генов–кандидатов из 2–х групп (иммуноспецифические и иммунорегуляторные), обусловливающих наследственную предрасположенность. С наибольшей вероятностью предрасположенность детерминируется несколькими генами, определяющими характер иммунологических и воспалительных реакций (табл. 1).
На основании результатов многочисленных исследований можно сделать вывод о том, что самой вероятной локализацией генов, связанных с развитием ВЗТК, являются хромосомы 3, 7, 12 и 16 [7].
В настоящее время большое внимание уделяется изучению особенностей функции Т– и В– лимфоцитов, а также цитокинам – медиаторам воспаления. Активно изучается роль интерлейкинов (IL), интерферонов (IFN), фактора некроза опухолей- a (TNF- a ), макрофагов и аутоантител к белкам слизистой оболочки толстой кишки и к аутомикрофлоре. Выявлены особенности их нарушений при БК и НЯК, но по–прежнему остается неясно, возникают ли эти изменения первично или вторично. Для понимания многих сторон патогенеза были бы очень важны исследования, выполненные в доклиническую стадию ВЗТК, а также у родственников первой степени родства.
Среди медиаторов воспаления особая роль принадлежит цитокинам, которые представляют собой группу полипептидных молекул с массой от 5 до 50 кДа, участвующих в формировании и регуляции защитных реакций организма. На уровне организма цитокины осуществляют связь между иммунной, нервной, эндокринной, кроветворной и другими системами и служат для их вовлечения в организацию и регуляцию защитных реакций [5]. Классификация цитокинов приведена в таблице 2.
Большинство цитокинов не синтезируется клетками вне воспалительной реакции и иммунного ответа. Экспрессия генов цитокинов начинается в ответ на проникновение в организм патогенов, антигенное раздражение или повреждение тканей. Одним из наиболее сильных индукторов синтеза цитокинов служат компоненты клеточных стенок бактерий: ЛПС, пептидогликаны и мурамилдипептиды. Продуцентами провоспалительных цитокинов являются в основном моноциты, макрофаги, Т–клетки и др. В зависимости от воздействия на воспалительный процесс цитокины подразделяют на две группы: провоспалительные (IL–1, IL–6, IL–8, TNF- a , IFN– g ) и противовоспалительные (IL–4, IL–10, TGF– b ) [3].
Интерлейкин–1 (IL–1) – иммунорегуляторный медиатор, выделяемый при воспалительных реакциях, тканевых поражения и инфекциях (провоспалительный цитокин). IL–1 играет важную роль в активации Т–клеток при их взаимодействии с антигеном. Известны 2 типа IL–1: IL–1 a , и IL–1 b , продукты двух различных генных локусов, расположенных на хромосоме 2 человека. IL–1 a остается внутри клетки или может находиться в мембранной форме, в незначительном количестве появляется во внеклеточном пространстве. Роль мембранной формы IL–1 a – передача активирующих сигналов от макрофага Т–лимфоцитам и другим клеткам при межклеточном контакте. IL–1 a – основной медиатор короткодистантного действия. IL–1 b в отличие от IL–1 a активно секретируется клетками, действуя как системно, так и локально. На сегодняшний день известно, что IL–1 является одним из основных медиаторов воспалительных реакций, стимулирует пролиферацию Т–клеток, увеличивает на Т–клетках экспрессию рецептора IL–2 и выработку ими IL–2. IL–2 вместе с антигеном индуцирует активацию и адгезию нейтрофилов, стимулирует образование других цитокинов (IL–2, IL–3, IL–6 и др.) активированными Т–клетками и фибробластами, стимулирует пролиферацию фибробластов и эндотелиальных клеток. Системно IL–1 действует синергически с TNF- a и IL–6. При повышении концетрации в крови IL–1 воздействует на клетки гипоталамуса и вызывает повышение температуры тела, лихорадку, сонливость, снижение аппетита, а также стимулирует клетки печени к продукции белков острой фазы (СRP, амилоида А, a –2 макроглобулина и фибриногена).
IL–4 (хромосома 5). Ингибирует активацию макрофагов и блокирует многие эффекты, стимулированные IFN– g , такие как продукция IL–1, окиси азота и простагландинов, играет важную роль в противовоспалительных реакциях, оказывает иммуносупрессивное действие. IL–6 (хромосома 7), один из основных провоспалительных цитокинов, является главным индуктором конечного этапа дифференцировки В–клеток и макрофагов, мощным стимулятором продукции белков острой фазы клетками печени. Одна из основных функций IL–6 – стимуляция продукции антител in vivo и in vitro. IL–8 (хромосома 4). Относится к хемокинам – медиаторам, вызывающим направленную миграцию (хемотаксис) лейкоцитов в очаг воспаления. Основная функция IL–10 – угнетение выработки цитокинов Т–хелперами первого типа (TNF– b , IFN– g ) и активированными макрофагами (TNF- a , IL–1, IL–12).
Изменения цитокинов при ВЗТК могут изучаться различными способами – с определением их уровня в крови или in situ.
Уровень IL–1 повышается при всех воспалительных заболеваниях кишечника. Различия между НЯК и БК заключаются в повышении экспрессии IL–2. Если при НЯК обнаруживается сниженный или нормальный уровень IL–2, то при БК выявляется его повышенный уровень. Содержание IL–4 увеличивается при НЯК, тогда как при БК оно остается нормальным или даже снижается. Уровень IL–6, опосредующего острофазовые реакции, также повышается при всех формах воспаления [1].
Полученные данные, касающиеся профиля цитокинов, позволили высказать предположение о том, что две основные формы хронических ВЗТК характеризуются различной активацией и экспрессией цитокинов.
Результаты исследований свидетельствуют о том, что наблюдаемый у больных НЯК профиль цитокинов в большей мере соответствует профилю Тh2, тогда как для больных с БК более характерным следует считать профиль Тh1 [6]. Привлекательность этой гипотезы о роли Тh1 и Тh2 – профилей состоит еще и в том, что применение цитокинов может изменить иммунный ответ в ту или иную сторону и привести к ремиссии с восстановлением баланса цитокинов. Это может подтверждаться, в частности, применением IL–10 [8].
Дальнейшие исследования должны показать, является ли цитокиновый ответ вторичным феноменом в ответ на раздражение или же, наоборот, экспрессия соответствующих цитокинов определяет реактивность организма с развитием последующих клинических проявлений.
Изучение уровня цитокинов при ВЗТК у детей до настоящего времени не проводилось. Настоящая работа является первой частью научного исследования, посвященного изучению цитокинового статуса при ВЗТК у детей.
Целью настоящей работы стало изучение гуморальной активности макрофагов с определением уровней (IL–1 a , IL–8) в крови у детей с НЯК и БК, а также их динамика на фоне проводимой терапии.
С 2000 по 2002 год в отделении гастроэнтерологии Российской детской клинической больницы было обследовано 34 ребенка с НЯК и 19 детей с БК в возрасте от 4 до 16 лет. Диагноз верифицировали анамнестически, эндоскопически и морфологически.
Результаты, полученные в ходе исследования, выявили значительное повышение уровней IL–1 a , IL–8 в период обострения, выраженное в большей степени у детей с НЯК, чем у детей с БК. Вне обострения уровни провоспалительных цитокинов снижаются, однако не достигают нормы (рис. 1 и 2).
Рис.1 Показатели IL-1 a , IL-8 в период обострения у детей с НЯК и БК
Рис. 2. Показатели IL-1 a , IL-8 вне обострения у детей с НЯК и БК
При НЯК уровни IL–1 a , IL–8 были повышены в периоде обострения у 76,2% и у 90% детей, а в период ремиссии – у 69,2% и 92,3% соответственно. При БК уровни IL–1 a , IL–8 повышены в периоде обострения у 73,3% и у 86,6% детей, а в период ремиссии – у 50% и у 75% соответственно.
В зависимости от тяжести заболевания дети получали терапию аминосалицилатами или глюкокортикоидами. Характер терапии значительно влиял на динамику уровня цитокинов. На фоне терапии аминосалицилатами уровни провоспалительных цитокинов в группе детей с НЯК и БК значительно превышали таковые в контрольной группе. При этом более высокие показатели наблюдались в группе детей с НЯК. При НЯК на фоне терапии аминосалицилатами IL–1 a , IL–8 повышены у 82,4% и у 100% детей соответственно, в то время как при терапии глюкокортикоидами – у 60% детей для обоих цитокинов. При БК IL–1 a , IL–8 повышены на фоне терапии аминосалицилатами у всех детей, а при терапии глюкокортикоидами у 55,5% и у 77,7% детей соответственно.
Таким образом, результаты настоящего исследования указывают на значительное вовлечение в патогенетический процесс макрофагального звена иммунной системы у большинства детей с НЯК и БК. Полученные в настоящем исследовании данные принципиально не отличаются от данных, полученных при обследовании взрослых пациентов. Различия уровней IL–1 a и IL–8 у пациентов с НЯК и БК носят количественный, но не качественный характер, что позволяет предположить неспецифический характер данных изменений, обусловленный течением хронического воспалительного процесса. Следовательно, данные показатели не имеют диагностического значения. Результаты динамического изучения уроней IL–1 a и IL–8 обосновывают более высокую эффективность терапии глюкокортикоидными препаратами по сравнению с терапией аминосалицилами. Представленные данные являются результатом первого этапа исследования цитокинового статуса детей с ВЗТК. Требуется дальнейшее изучение проблемы с учетом показателей других провоспалительных и противовоспалительных цитокинов.
1. Никулина И.В. Клинико–эпидемиологическая характеристика воспалительных заболеваний кишечника в Московской области // Автореф. дисс. к.м.н., М., 1997, с.17
2. Бочков Н.П. Генетические основы болезней кишечника.// Российский журнал гастроэнтерологии, гепатологии, колопроктологии.– 1999.– N6.
4. Симбирцев А.С. Цитокины–новая система регуляции защитных реакций организма //Цитокины и воспаление.– 2002.– Том 1.– N1.–С.9–16.
5. Ковальчук Л.В., Ганковская Л.В., Рубакова Э.И. Система цитокинов. М., 2000.
6. Адлер Г. Болезнь Крона и язвенный колит. М., 2001.
7. Romagnani S. Th1 and Th2 subsets of CD4+ T–limphocytes //Sci.Am.Sci.Med.– 1994.– Vol.1.– p.68–77.
8. Schreiber S., Heining T. Immunoregulatory role of interleukin–10 in patients with inflammatory bowel disease.// Gastoenterology.– 1995.– Vol.108– p.1434–1444.
Ключевые слова: микробиота, микробиом, пробиотики, дети, мукозальный иммунитет, бифидобактерии.
T.E. Taranushenko
Prof. V.F. Voino-Yasenetsky Krasnoyarsk State Medical University, Krasnoyarsk,
Russian Federation
NIH Human Microbiome Project determined particular attention of the worldwide medical community to the study of the human microbiome and the assessment of the impact of symbiont microorganisms in the development of various (not only gastrointestinal) disorders. Potential interactions between the bowel and lungs (bowel-lung axis) via microbiota that allow for the possible involvement of microorganisms in the development of respiratory diseases are actively debated. This paper reviews studies on the pattern of interactions between bowel and lungs in infectious diseases associated with mucosal inflammation. The association between gut microbiota and the protective barrier of the respiratory tract based on known mechanisms and novel data derived from recent studies on SARS-CoV-2 is discussed. The relevance of beneficial bacteria (symbionts) in local and systemic immune responses, their disease-modifying and, eventually, therapeutic strategy-modifying properties, the ability to be a resource of preventive medicine and an orchestrating tool for infections are addressed. Practitioners’ difficulties with probiotics in preventive and treatment schedules for various conditions are highlighted. Finally, the use of probiotics in children with respiratory infections and COVID-19 is uncovered.
Keywords: microbiota, microbiome, probiotics, children, mucosal immunity, Bifidobacterium.
Введение
Взаимосвязь желудочно-кишечного тракта (ЖКТ) и респираторной системы на основе представлений об оси, связывающей кишечник и легкие, активно обсуждается в высокорейтинговых научных изданиях.
Согласно сформулированной научной концепции микробиом кишечника оказывает значимое влияние на поддержание нормального биоценоза дыхательных путей и функциональное состояние легких [1–3].
Вместе с тем различные внешние факторы (нерациональное питание, болезни, лекарственные препараты и др.) могут изменять качественный и количественный состав симбиотов и этим провоцировать ряд патологических состояний, сопровождающихся снижением барьерных функций кишечника, ограничением адгезивной способности нормальной микрофлоры по отношению к эпителию кишечника с образованием защитного пристеночного слоя, снижением синтеза антимикробных веществ (органических кислот, перекиси водорода и других биологически активных субстанций), ослаблением конкуренции с патогенными микроорганизмами за источники питания, избыточным присутствием факультативных и транзиторных бактерий с высоким инфекционным потенциалом и риском инвазии и транслокации патогенов, в том числе в системный кровоток [5, 6].
Научные поиски и дискуссии о взаимодействии макроорганизма с патогенами и симбиотами человека имеют большое значение не только для понимания причинно-следственных связей, но и для расширения представлений о важности микробиоты кишечника в поддержании здоровья, предупреждении развития болезней и создании терапевтических подходов в клинической практике.
Связь между слизистой оболочкой легких и кишечника прослежена в последних научных работах, посвященных COVID-19 [8–10]. При известной тропности вируса SARS-CoV-2 к эпителию слизистой дыхательных путей многочисленные сведения указывают на ЖКТ как на не менее важную мишень для вируса. При этом кишечный дисбиоз и сопутствующие повреждения барьера с транслокацией бактерий, лейкоцитов и медиаторов воспаления способствуют ухудшению респираторного статуса больных COVID-19. В связи с этими новыми данными предлагаются дополнительные терапевтические вмешательства с применением пре- и пробиотиков, которые нацелены на восстановление состояния эубиоза путем модуляции кишечной микробиоты. Предложенный подход направлен на улучшение течения инфекции и предотвращение наихудших исходов COVID-19.
Установлено, что предупредительные сигналы от комменсалов кишечника воздействуют на слизистую оболочку легких и усиливают противовирусное состояние эпителиальных и/или иммунокомпетентных клеток, а также контролируют репликацию вируса на ранних этапах инфекции. Повышение врожденного иммунитета при этом способствует повышению эффективности клеточного и гуморального адаптивного ответа в последующем течении COVID-19. Серьезного внимания заслуживают данные о причастности дисбиоза кишечника к повышенной смертности от респираторных инфекций, вероятно, вследствие дисрегуляции иммунного ответа, с повышенной секрецией интерферона γ, интерлейкина (ИЛ) 6, CCL2 и снижением регуляторных Т-клеток в легких и ЖКТ [9–11].
Механизмы взаимосвязи кишечника и респираторного тракта
Значение кишечной микробиоты и ее взаимосвязь с состоянием слизистой оболочки респираторного тракта рассматриваются с позиции четырех наиболее изученных механизмов, которые в настоящее время дополняются новыми данными, полученными в последних исследованиях SARS-CoV-2 [11–17]:
активация клеток, несущих sPRR, с усилением их защитного потенциала (продукция противомикробных пептидов и комплемента, фагоцитоз, продукция активных форм кислорода);
стимуляция антиген-специфических клеток адаптивного иммунитета к переходу в активированное состояние с улучшением эффекторной функции (зрелые В-лимфоциты увеличивают продукцию иммуноглобулинов (sIgA), повышением чувствительности к антигенной стимуляции и нарастанием киллерной функции Т-эффекторов;
инициация прайминга наивных лимфоцитов и их подготовка к началу адаптивного иммунного ответа.
Пробиотики
Фундаментальные и клинические исследования уже внесли существенный вклад в понимание значимости полезных бактерий в реакциях местного и системного иммунного ответа, их способности модифицировать болезнь и модулировать лекарственную терапию, а также быть ресурсом профилактической медицины и выступать в качестве инструмента по управлению как инфекционными, так и неинфекционными заболеваниями. В настоящее время эти задачи реализуются с учетом потенциальных возможностей пробиотиков.
Пробиотики — это живые микроорганизмы, оказывающие положительные эффекты на состояние здоровья человека в контролируемых клинических исследованиях (WGO Global Guideline Probiotics and prebiotics, 2017).
Изучение влияния пробиотиков на патологические состояния, ассоциированные с дисфункцией иммунной системы (аллергические, аутоиммунные и иммунокомплексные заболевания), с инфекциями и критическими неотложными ситуациями (искусственная вентиляция легких, хирургические вмешательства и др.), остаются актуальными и вместе с тем дискуссионными в связи с разноречивыми данными по этой проблеме.
Современные представления о возможностях лечебно-профилактического использования пробиотиков
(и пробиотических продуктов) у детей с респираторными инфекциями также неоднозначны [18–25].
Респираторные инфекции, COVID-19 и пробиотики
Респираторные инфекции являются наиболее распространенными заболеваниями детского возраста, в структуре которых ведущее место занимают острые респираторные заболевания (ОРЗ) в виде различных нозологических форм (назофарингит, фарингит, ларингит, трахеит, острая инфекция верхних дыхательных путей неуточненная). Около 90% всей инфекционной патологии детского возраста и более 80% всех вызовов врачей на дом обусловлены ОРЗ. Наиболее высокий уровень заболеваемости респираторными инфекциями отмечается у детей раннего возраста и дошкольников, посещающих организованные коллективы [26–28].
Важно, чтобы рекомендации по применению пробиотиков в клинических условиях были ассоциированы с определенными специфическими штаммами и с заявленными эффектами при конкретной нозологии. Вместе с тем отдельные штаммы демонстрируют универсальную способность реализовывать иммунологические, антимикробные и другие эффекты, а известные механизмы пробиотической активности являются общими для различных штаммов, видов и даже типов (например, способность к увеличению продукции КЦЖК или к снижению pH в просвете толстой кишки с улучшением процессов пищеварения).
Современные подходы к назначению пробиотиков обсуждаются в ключе профилактического и лечебного назначения наиболее актуальных штаммов с позиции доказательной медицины при конкретной педиатрической ситуации. Однако при всем понимании важности терапевтических стратегий следует признать трудности, с которыми сталкиваются практикующие врачи, принявшие решение включить пробиотик в схему лечения и профилактики при различных патологических состояниях.
Современная и объективная информация о возможности применения пробиотиков у детей при респираторных инфекциях и COVID-19 представлена в обзоре L. Depoorter et al. [21]. По заключению авторов, L. rhamnosus GG снижает риск как респираторных, так и желудочно-кишечных инфекций у младенцев.
В формировании защитных механизмов при респираторной инфекциии особое значение придается PRR (рецепторам распознавания образов), которым отводится роль сенсорных игроков (сигнальных молекул) врожденного иммунного ответа с последующим усилением экспрессии этих рецепторов в легочной ткани при воспалении. В аналогичном направлении работают макрофаги, моноциты, нейтрофилы, отвечающие за повышение уровней DAMP (ассоциированные с опасностями молекулярные паттерны) и PAMP. Предложено несколько моделей распознавания патогенов и защиты хозяина от инфекций.
Одна из моделей предполагает участие PRR в распознавании DAMP как сигналов опасности, исходящих от поврежденных или некротизированных клеток хозяина, которые также усиливают провоспалительный ответ и в конечном счете стимулируют PRR (преимущественно TLR) и реализуют иные (вне прямой связи с патогеном) защитные механизмы [31, 32].
Модель, ориентированная преимущественно на патоген, предусматривает ведущий вклад в противоинфекционную защиту PAMP. При вирусных инфекциях основными PAMP выступают нуклеиновые кислоты или гликопротеины вириона, которые должны распознаться PRR и после этого инициировать экспрессию цитокинов, хемокинов и других костимулирующих провоспалительных молекул, чтобы устранить патогенный вирус, активировать антигенпредставляющие клетки и запустить специфический адаптивный иммунитет. Регулирующий эффект пробиотиков в отношении экспрессии TLR отмечен в нескольких исследованиях по изучению протективного эффекта пробиотиков через снижение экспрессии TLR4. В этом контексте проведено большое рандомизированное контролируемое исследование (PROSPECT Investigators и Canadian Critical Care Trials Group) по изучению роли пробиотиков у тяжелобольных пациентов отделений интенсивной терапии с вентилятор-ассоциированной пневмонией (ВАП). Исследование показало положительное воздействие пробиотиков: частота ВАП, продолжительность ИВЛ и продолжительность пребывания в отделении интенсивной терапии, внутрибольничная летальность в группе, получавшей пробиотики, были значительно ниже, чем в контрольной группе [33].
Известные факты о высокой контагиозности, опасности и тяжести инфекции SARS-CoV-2, а также способности вируса вызывать респираторные и желудочно-кишечные симптомокомплексы привлекают внимание и интерес к данному пандемичному штамму, в том числе с позиции пробиотических стратегий. Так, установленной особенностью SARS-CoV-2 является наличие на оболочке вируса белка Е, который взаимодействует с ERGIC (промежуточный компартмент эндоплазматического ретикулума — Гольджи). ERGIC является посредником между эндоплазматическим ретикулумом и аппаратом Гольджи на секреторном пути высвобождения вновь созданных вирионов из инфицированной клетки и в нем же локализуется значительная часть белка E, участвующего в сборке вириона. Партнеры по взаимодействию вируса с белком E обозначены как ингибиторы митоген-активируемой протеинкиназы p38 (MAPK), что рассматривается как потенциальный инструмент управления воспалением [34]. При этом установлено, что полифосфат, который является компонентом Lactobacillus, способен усиливать барьерную функцию эпителия и поддерживать гомеостаз кишечника благодаря интегрину-p38 MAPK, способному активировать иммунопатологические процессы с участием провоспалительных медиаторов [35].
Другой пробиотик также продемонстрировал положительный эффект в отношении симптомов заболеваний верхних дыхательных путей и ЖКТ [36]. В шведском исследовании с использованием L. reuteri ATCC 55730 была показана значимая положительная динамика респираторных и желудочно-кишечных симптомов в сравнении с плацебо [37].
Установлено влияние микробиоты кишечника на повышение активности альвеолярных макрофагов и действие микробиоты кишечника как защитного медиатора при пневмонии [38].
Полученные данные свидетельствуют о важности дальнейшего изучения механизмов эффективности пробиотиков при респираторных заболеваниях, которые могут способствовать их использованию в профилактической медицине и клинической практике. Авторы большей части исследований подчеркивают необходимость дополнительных данных о роли пробиотиков как терапевтических средств при респираторных заболеваниях.
Пищевые продукты, обогащенные пробиотиками
Продукты с пробиотиками составляют важную часть детского рационального питания, особую значимость приобретают пробиотики в составе пищевых продуктов для детей грудного и раннего возраста с факторами риска развития кишечного дисбиоза: рождение путем кесарева сечения, преждевременное рождение, искусственное вскармливание, раннее отлучение от груди, нерациональное питание, перенесенные кишечные инфекции, соматические заболевания (особенно с вовлечением ЖКТ и эндокринной системы), прием антибиотиков, слабительных средств, сорбентов, кортикостероидов, цитостатиков и т. д. При указанных состояниях нарушается заселение кишечника самыми важными представителями кишечного микробиома — бифидобактериями (Bifidobacterium), что приводит к микробному дисбалансу [39].
Бифидобактерии составляют 80–90% кишечной микробиты детей, находящихся на грудном вскармливании. Бифидобактерии в кишечнике проявляют антагонистическую активность по отношению к возбудителям инфекционных заболеваний, способствуют перевариванию углеводов, участвуют в синтезе аминокислот, белков и витаминов, в ассоциации со слизистой оболочкой кишечника обеспечивают физиологическую защиту кишечного барьера, подавляют рост патогенных микроорганизмов и усиливают процессы всасывания микроэлементов и витаминов [40, 41].
Наиболее изученный представитель рода бифидобактерий — Bifidobacterium animalis subsp. lactis ВВ-12, которая показала устойчивость к действию соляной кислоты и желчи с сохранением функциональной активности у 60–80% пробиотической культуры как у детей, так и у взрослых
Безопасность ВВ-12 подтверждается длительной историей использования в питании человека без каких-либо нежелательных реакций, а также данными многочисленных клинических исследований, без указаний на негативные эффекты. BB-12 включена в список GRAS FDA (Generally recognized as safe Food and Drug Administration) как компонент детских молочных смесей в США, Европе, Азии [41, 42].
Детские молочные смеси, обогащенные ВВ-12, показали профилактический эффект в отношении острой диареи у младенцев со снижением частоты инфекционной и антибиотикассоциированной диареи.
Особо следует отметить влияние ВВ-12 на функцию иммунной системы с увеличением продукции антител, клеточной активности иммунокомпетентных клеток, модулированием взаимодействия между эпителиальными и иммунными клетками, а также цитокиновым сигналингом ИЛ-2, ИЛ-10, интерферона γ [43–45].
Доказанная эффективность данного пробиотического штамма бифидобактерий определяет расширение ассортимента продуктов детского питания, обогащенных B. animalis subsp. lactis ВВ-12.
Заключение
Микробиом — это сложная биологическая система, состоящая из множества сообществ и представителей микробного мира, оказывающая большое влияние на здоровье человека и выполняющая важную роль в создании защитного барьера от инфекционных заболеваний. Бережное отношение к симбиотам и возможность коррекции дисбиотических нарушений — актуальное научное направление медицины, в рамках которого разрабатываются рекомендации по сохранению естественного биоценоза и восстановлению баланса микробиома, в том числе с помощью безопасных пробиотических препаратов.
Благодарность
Acknowledgment
The authors and Editorial Board are grateful to "PROGRESS" JSC for providing full-text foreign articles required to write the review.
Сведения об авторе:
Таранушенко Татьяна Евгеньевна — д.м.н., профессор, заслуженный врач РФ, заведующая кафедрой педиатрии Института последипломного образования ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России; 660074, Россия, г. Красноярск, ул. Партизана Железняка, д. 3Д; ORCID iD 0000-0003-2500-8001.
Прозрачность финансовой деятельности: автор не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 23.09.2021.
Поступила после рецензирования 18.10.2021.
Принята в печать 12.11.2021.
About the author:
Tatyana E. Taranushenko — Dr. Sc. (Med.), Professor, Honorary Doctor of the Russian Federation, Head of the Department of Pediatrics of the Institute of Postgraduate Education, Prof. V.F. Voino-Yasenetsky Krasnoyarsk State Medical University; 1, Partizan Zheleznyak str., Krasnoyarsk, 660022, Russian Federation; ORCID iD 0000-0003-2500-8001.
There is no conflict of interests.
Received 23.09.2021.
Revised 18.10.2021.
Accepted 12.11.2021.
Проведен анализ течения острых кишечных инфекций (ОКИ) бактериальной этиологии у детей раннего возраста, при этом оценивалась тяжесть течения инфекции, сроки поступления больных в стационар, выраженность диспептического, интоксикационного и воспалительного синдромов, исследовалось состояние прооксидантной системы крови и уровни цитокинов (ИЛ-6 и ИЛ-10). В ходе исследования выявлено, что у большинства больных инфекция протекала в среднетяжелой форме, с выраженными проявлениями интоксикации и диспепсии. У всех пациентов на фоне ОКИ отмечалось достоверное по сравнению с контрольной группой повышение уровня ТБК-активных продуктов, щелочной фосфатазы, ИЛ-6 и ИЛ-10. Каких-либо достоверных отличий изучаемых показателей в зависимости от этиологического фактора выявить не удалось, однако максимальная активация прооксидантной системы, а также наибольшее содержание ИЛ-6 и ИЛ-10 обнаружено у больных с ОКИ, вызванными условно-патогенной флорой.

1. Голубев А.О., Милютина Л.Н. Современные данные об особенностях иммунного ответа при сальмонеллезах // Инфекционные болезни. – 2010. – Т. 8. – № 2. – С.62-67.
2. Зайцева Л.Ю., Калуцкий П.В. Клинико-иммунологические особенности течения острых кишечных инфекций у детей раннего возраста, проживающих на территории Курской магнитной аномалии // Вестник Уральской медицинской академической науки. – 2006. – № 3. – 1. – С. 66.
3. Калуцкий П.В., Медведева О.А., Зайцева Л.Ю. Анализ заболеваемости острыми кишечными инфекциями различных возрастных групп регионов с повышенным и фоновым уровнями напряженности геомагнитного поля // Бюллетень Оренбургского научного центра УРО РАН, 2012. – № 3. – С.9.
4. Касымов И.А., Шарапова Г.М. Клинико-иммунологические аспекты сальмонеллеза Typhimurium детей // Инфекционные болезни. – 2011. – Т.9. – № 1. – С.42-46.
5. Мартынова Н.Н. Динамика содержания цитокинов и газового состава крови больных сальмонеллезом и острым шигеллезом // Терапевтический архив, 2006. – Т. 78. – № 11. – С.24-26.
6. Смирнов И.Е. Цитокиновый профиль при бактериальной и вирусной инфекции у детей // Российский педиатрический журнал. – 2014. – Т.17. – № 4. – С.14-19.
7. Щербак В.А., Витковский Ю.А. Значение цитокинов в патогенезе хронического гастродуоденита, ассоциированного с H. PYLORY, у детей // Педиатрия. Журнал им. Г.Н. Сперанского, 2005. – Т. 84. – № 5. – С.11-13.
Заболеваемость острыми кишечными инфекциями (ОКИ) у детей по-прежнему остается на высоком уровне. В последние годы в структуре ОКИ преобладают вирусные диареи. Около 80 % всех кишечных инфекций вызвано вирусами, однако, не следует недооценивать роль бактериальных патогенов в развитии диарейных заболеваний инфекционной природы. Среди бактериальных ОКИ основная роль принадлежит сальмонеллам и шигеллам, а в последние годы значительно возросла роль условно-патогенной флоры как этиологического фактора ОКИ.
Несмотря на значительные успехи в диагностике, лечении и профилактике ОКИ, они продолжают играть часто определяющую роль в развитии хронической патологии желудочно-кишечного тракта (ЖКТ). Являясь триггерным фактором нарушения микроэкологии кишечника, ОКИ способны вызывать отдаленные последствия с возникновением предпосылок к формированию мультисистемной патологии, особенно в детском возрасте [2]. Поражая ЖКТ, патогенные микроорганизмы индуцируют местные и системные воспалительные реакции, значительно изменяя состав кишечной микрофлоры [3].
Так, например, изменения уровней цитокинов в крови детей с острыми инфекциями являются показателем активации иммунокомпетентных клеток в ответ на бактериальное воспаление и позволяют более точно диагностировать вирусные и бактериальные инфекции [6]. По имеющимся литературным данным при сальмонеллезе наблюдается повышение содержания ИЛ-6 и ИЛ-10 в сыворотке крови. Установлено, что высокий уровень ИЛ-6 сопровождает осложненные формы инфекции, а низкий уровень ИЛ-10 – обострение заболевания [4]. Содержание ИЛ-10 зависит от этиологии и тяжести течения инфекционного процесса при сальмонеллезной инфекции [5].
Если ранее при сальмонеллезах изучался преимущественно гуморальный иммунный ответ, то в последние годы появились данные о генетической предрасположенности к заболеванию сальмонеллезами, а именно – наличие антигена HLA-B27 может сделать людей более восприимчивыми к сальмонеллезной инфекции. Появились работы о механизмах взаимодействия сальмонелл с фагоцитами; о роли цитокинов, о значении местного иммунитета при этой инфекции [1]. Существуют данные о тесной корреляционной связи между содержанием цитокинов и уровнем антител к Н. pylori [7].
С целью определения прогноза и исходов заболевания определенный интерес представляет изучение цитокинового статуса и состояния прооксидантной системы крови у детей на фоне ОКИ бактериальной этиологии.
Продукты перекисного окисления липидов определяли спектрофотометрическим методом в реакции с тиобарбитуровой кислотой с использованием унифицированного набора реактивов для определения ТБК-активных продуктов при длине волны 535 и 570 нм в кювете с толщиной слоя 1 см [UchiyamaM., MiharaM. 1978; MiharaM., 1980].
Расчет содержания ТБК-активных продуктов проводили по формуле:
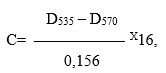
где: С – содержание ТБК-активных продуктов в опытной пробе (мкмоль/л);
D535 – оптическая плотность опытной пробы при 535 нм;
D570 – оптическая плотность опытной пробы при 570 нм;
0,156 – коэффициент молярной экстинции комплекса малоновый альдегид – ТБК (л/мкмоль/см);
16 – коэффициент разведения сыворотки.
Результаты и обсуждение
Клинически у всех детей на фоне ОКИ наблюдались проявления интоксикации, желудочно-кишечной диспепсии, диарейный синдром. Большинство детей перенесли среднетяжелую инфекцию (табл. 1).
При острых вирусных и бактериальных кишечных инфекциях у детей формируется Th-2 иммунный ответ, приводящий к развитию тяжелых и осложненных форм заболевания, поддерживаемый дисбиотическими нарушениями в кишечнике за счет необоснованно длительного применения антибактериальных препаратов. Показана безопасность и эффективность включения в комплексное лечение кишечных инфекций раннего индуктора интерферона 1 и 2-го типа — циклоферона, который способствует формированию Th-1 иммунного ответа, снижению повторного бактериовыделения возбудителя на фоне нормализации клинических синдромов заболевания. Установлено восстановление уровня микрофлоры кишечника, уменьшение условно-патогенной флоры при лечении дисбиоза.

Кишечные инфекции - группа заболеваний вирусной, бактериальной природы, для которых характерен фекально-оральный механизм передачи, с синдромом общей интоксикации, диарейным синдромом, склонностью к развитию дегидратации различной степени выраженности. Заболеваемость кишечными инфекциями неустановленной этиологии в Российской Федерации стабильно превышает показатель 100 на 100 тысяч населения [13].
Вирусные кишечные инфекции в большинстве случаев имеют не только фекально-оральный, но и воздушно-капельный путь передачи. Кишечные инфекции бактериальной природы с фекально-оральным механизмом передачи наблюдаются у детей первых 5 лет жизни. В последние годы отмечается тенденция к росту острых кишечных инфекций (ОКИ) у детей. В возрастном аспекте большинство (70%) составляют дети до 5-ти лет. Среди ОКИ расшифрованной этиологии 55,8% составляют ОКИ условно патогенной флоры, наметился рост (35%) ротавирусной инфекции, увеличивается заболеваемость в крупных городах с многочисленными контактами детей, проявляясь симптомокомплексом гастроэнтерита на фоне условно-патогенной флоры (18%). Сочетание ротавирусной инфекции (1,4%) с ОКИ шигеллезной этиологии составляет от 0,5 до 6,5%, по тяжести заболевания преобладают среднетяжелые формы кишечной инфекции, тяжелые формы чаще встречаются при сочетании ротавирусной инфекции с сальмонеллезом [11,28]. Основной причиной ОКИ у детей раннего возраста являются вирусы из разных таксонов (рота 35%,-норо- 16.7%,-астровирусы - 6.2%)[ 32].
Бесконтрольное и необоснованно длительное применение антибиотиков способствует продолжительной дисфункции кишечника, развитию антибиотик-ассоциированных диарей и глубоких дисбиотических нарушений [29]. Заболевания пищеварительного тракта характеризуются развитием дефицита факторов местного иммунитета, снижением противо- и провоспалительных цитокинов, уровня лизосомальнокатионного белка, обеспечивая тяжесть и активность воспалительного процесса [24]. Этиотропная терапия вирусных кишечных инфекций у детей остается малоразработанной. При внедрении патогена в организме происходит снижение иммунорезистентности, нарушаются процессы переваривания и всасывания, возникает транзиторный иммунодефицит с развитием интерферонодефицита, обусловливая затяжное и хроническое течение кишечных инфекций [1,19].
При негладком течении кишечной инфекции дисбаланс про- и противовоспалительных цитокинов характеризуется преобладанием Th-2 иммунного ответа, сохраняясь на протяжении всего заболевания. Среди бактериальных кишечных инфекций особое внимание привлекают шигеллы, обладающие высокими инвазивными и патогенными характеристиками. Сегодня доминируют штаммы Флекснер 2а и 3а, поэтому клиника заболевания характеризуется преобладанием среднетяжелых и тяжелых форм инфекции, наблюдается выраженный интоксикационный синдром с длительным бактериовыделением, явлениями гемо- и энтероколита, при бактериологическом исследовании выявляется Sh.zonnae 2g. Сальмонеллезы являются ведущими в этиологической структуре острых кишечных инфекций бактериальной этиологии, при затянувшейся санации от возбудителя нарушаются все звенья иммунной защиты [16,22], указывая на целесообразность широкого использования иммунокорригирующих препаратов [17,18,31]. Клиническая картина эшерихиозов разнообразна и зависит от состояния иммунной системы больного, его возраста, биологических характеристик возбудителя. Принадлежность возбудителя к той или иной О-серогруппе и наличие определенных факторов патогенности определяет характер патоморфологических изменений, течение инфекционного процесса и исход заболевания. Возможность развития тяжелых форм эшерихиозов обусловливает необходимость назначения адекватной патогенетически обусловленной и этиотропной терапии [ 36,37].
Выявленная роль интерферонов [14] в патогенезе заболеваний желудочно-кишечного тракта, особенно при рецидивирующих формах, позволяет в лечении отводить место иммунотерапии, определяя стратегию и тактику заболевания.
Для коррекции иммунных нарушений при кишечных инфекциях нами выбран циклоферон (метилглюкамина акридонацетат) - ранний индуктор интерферона 1 и 2-го типов. Основным его достоинством является полифункциональность - сочетание широкого спектра фармакологических эффектов, что позволяет рассматривать этот препарат в качестве иммунотропного средства лечения и профилактики различных заболеваний, включая и кишечные инфекции, что указано и в инструкции по его медицинскому применению. Продукция интерферонов под влиянием циклоферона обусловлена наличием чувствительных клеточных систем, способных синтезировать эндогенный интерферон в ответ на введение препарата. При действии циклоферона индуцируются сигналы, активирующие цитокиновую сеть организма. Характер иммунного ответа зависит от СД4+Th1 -и 2-типов, различающихся по продукции цитокинов при развитии иммунного ответа по клеточному и гуморальному типу. Препарат активирует Th1 иммунный ответ, продуцируя интерферон-гамма, интерлейкин 2, а ФНО-альфа, стимулирует Т-лимфоцитоы и макрофаги, развивая иммунный ответ по клеточному типу, обеспечивая решающую роль в противовирусной защите [24].
Циклоферон является одним из перспективных препаратов для лечения бактериальных инфекций. Вопрос влияния циклоферона на биологические свойства внутриклеточных бактериальных патогенов не изучен. В связи с этим, под руководством академика РАМН О.В.Бухарина (2005) проведено исследование антимикробной активности препарата и его влияния на персистенцию внутриклеточных бактерий. Показано подавление факторов персистенции (антилизоцимная и антикомплементарная активность) грамотрицательных (шигел,сальмонелл, бруцел, франциселл) бактерий, затрудняя их паразитирование внутри клеток, повышая эффективность лекарственных воздействий. Ингибирование циклофероном персистентного потенциала внутриклеточных патогенов способствует их элиминации при острых и хронических инфекционных процессах [ 3].
С целью предотвращения негладкого течения шигеллеза циклоферон включен в терапию. Клинический эффект циклоферона заключается в гладком течении заболевания, отсутствии повторного выделения возбудителя. У 12,8% больных, получавших антибактериальную терапию, продолжалось повторное выделение возбудителя. После того, как эти дети пролечены циклофероном, наблюдалась 100%-ная санация организма от возбудителя [ 10]. У больных с дизентерией и сальмонеллезом, получавших циклоферон в комплексной терапии, микробиологическая санация наступала у 90,3% больных, а у 89% пациентов нормализовался стул [15]. Среднетяжелая и тяжелая форма заболевания при гастроэнтероколитической форме заболевания выявляется в 25,8% случаев, в 74,2% - при гастроэнтеритическом варианте заболевания. У 13,1% больных после перенесенного заболевания остаются остаточные явления в виде затянувшейся репарации слизистой оболочки, характеризующейся усиленной макрофагальной инфильтрацией, что проявлялось неустойчивостью стула, склонностью к запорам на фоне длительного астенического синдрома, что расценивается как предпосылка к развитию хронического воспаления в слизистой оболочке толстой кишки. Протеолитические энзимы сальмонелл способствуют сохранению возбудителя в макрофагах, подавляя их функции через протеолитическую модификацию клеточных рецепторов [ 5,33].
И.А. Старикова (2004), оценивая эффективность циклоферона при кишечных (шигиллез, сальмонеллез) инфекциях, показала наступление санации кишечника у 95 из 100 больных, уменьшение кишечного токсикоза, общетоксического и колитического синдромов, что способствовало сокращению сроков пребывания детей в стационаре [27].
Под руководством В.В.Ботвиньевой (2010) [8] установлена этиология ОКИ, расшифрованная у 49,% детей, среди 104 детей, в возрасте от года до 14 лет. Шигиллез выявлен в 14,4% случаев, сальмонеллез наблюдался у 10,6% детей, эшерихиоз в 3,9% случаев, кишечная инфекция, вызванная условно патогенной флорой, документирована у 9,6% больных, а ротавирусная инфекция - в 10,6% случаев. У 74% больных первым проявлением заболевания были симптомы интоксикации, в 17,3% случаев -дисфункция кишечника, в 8,7% - повышение температуры. Диарейный синдром проявлялся в 35-64,4% случаев учащением стула до 5-6 раз, максимальная его частота составила 15 раз. Патологические примеси в виде слизи установлены в 81%, зелени - в 40,4%, прожилок крови - в 9,6% случаев. На боли в животе, метеоризм, тенезмы жаловались, соответственно, 75,9;50,0 и 19,2% наблюдаемых детей. Явления эксикоза с токсикозом I степени установлены у 47,1%, I-II степени - у 18,3% детей, а нейротоксикоз наблюдался в 6,7% случаев. В патологический процесс вовлекались все отделы желудочно-кишечного тракта, развитие гастроэнтероколита отмечено у 45,2% детей, гастроэнтерита - у 40,4%, а энтероколит и энтерит установлен, соответственно, в 7,7 и 6,7% случаев. Выявлена недостаточность фагоцитарного звена иммунитета при повышенной поглотительной активности нейтрофилов. Дисгаммаглобулинемия проявлялась гиперпродукцией иммуноглобулинов класса Е на фоне значительной активации провоспалительных цитокинов ИЛ-8 и ФНО-альфа, подтверждая значимую роль межклеточных медиаторов в развитии воспалительного процесса в желудочно-кишечном тракте при острых кишечных инфекциях [20,34].
Включение циклоферона в стандартную терапию кишечных инфекций способствовало исчезновению у 70,6% больных инфекционного токсикоза (против 38,2% - в группе сравнения), диарейного синдрома - у 35,3% против 14,7%, Клиническое выздоровление установлено на 5 день лечения у 94,1% больных, против 61,8% детей в группе сравнения. Значительно реже наблюдали сохранение признаков воспалительного процесса и показателей нарушения ферментативной и всасывательной функции желудочно-кишечного тракта. Применение пробиотика пробифор как стартового средства и препарата циклоферон с целью интенсификации общепринятой антибактериальной терапии сопоставимы, но терапевтический эффект пробифора наблюдали на 1-2 день, циклоферона - на 3-4 день. Циклоферон минимизировал интоксикационный синдром, а на фоне лечения пробифором достигался выраженный и быстрый регресс местных проявлений кишечной инфекции у детей. Следовательно, целесообразно комбинировать эти два препарата с различным механизмом действия с целью интенсификации терапии.
Оптимизация антибактериальной терапии циклофероном способствовала стимуляции фагоцитоза, активации гуморального звена иммунитета, нормализации уровня ИЛ-8, снижению концентрации ФНО-альфа. С учетом наличия прямой корреляционной связи между ИЛ-8 и ФНО-альфа в начальном периоде заболевания нами определена и прямая корреляционная связь между ИЛ-8 и ФНО-альфа у детей, получавших пробиотик и циклоферон, указывая на патогенетически обоснованное их применение, направленное на повышение механизмов иммунологической защиты и уничтожение возбудителя. Применяя циклоферон у больных с иерсиниозной инфекцией, отмечено снижение числа рецидивов заболевания (9% против 16%) [10,30].
Иммунный дисбаланс, приводящий к развитию тяжелых и осложненных форм заболевания, поддерживается дисбиотическими нарушениями слизистых оболочек дыхательных путей и кишечника. Так, у часто болеющих детей супрессия синтеза sIgA и дисбиотические нарушения в кишечнике обусловливают длительную персистенцию условно-патогенных микроорганизмов, что приводит к усилению клинических симптомов дисбиоза. В детском возрасте дисбактериозы формируются под действием респираторных инфекций, а самые тяжелые формы нарушения микробиоценоза происходят под воздействием активной терапии антибиотиками и химиопрепаратами. Развитию кишечного дисбактериоза способствует и прямое токсическое действие антибиотиков на эпителий и ретикулоэндотелиальную строму слизистой оболочки кишечника. У 88,1% часто болеющих детей выявлены нарушения микрофлоры толстой кишки, а у 92% часто болеющих детей с функциональными нарушениями желудочно-кишечного тракта выявляется дисбиоз с изменениями в системе иммунитета (повышение уровня CD3+,CD8+, снижение JgA). Одновременное поражение дыхательных путей и кишечника у детей остается недостаточно изученным в отношении как этиологии, особенностей клинического течения, механизмов патогенеза, так и и принципов лечения. Чаще всего ОРВИ с гастроинтестинальным синдромом регистрируется у детей 1-го года жизни (33,7%), реже у детей от 1 до 2- лет (30,4%), в возрасте 3-7 лет (27,2%), у школьников (21,2%). Респираторная вирусная этиология выявлена [12] у 79% пациентов, бактериальная инфекция участвовала в поражении дыхательных путей в 5,4% случаев, всегда сочетаясь с вирусной этиологией. Ротавирусная инфекция выявлена в 39,1% случаев, с помощью электронной микроскопии выявлены коронавирусы, детекция которых не проводится в обычной клинической практике [25,26].
Целесообразность применения циклоферона в комплексной коррекции дисбиоза кишечника выявлена и у детей раннего возраста (уровень микрофлоры кишечника восстановился до нормы у 95% пациентов, а число условно-патогенной микрофлоры сократилось в 12 раз). С целью коррекции дисбиоза желудочно-кишечного тракта изучали микрофлору кишечника у 96 часто болеющих детей в возрасте от 4 до 6 лет. В анамнезе у 44,8% матерей наблюдаемых детей были хронические заболевания, и у трети из них (29,8%) отмечались их обострения во время беременности. У 78% детей отмечались функциональные нарушения желудочно-кишечного тракта, на периодическое недомогание жаловались 13,5% детей, у 46,8% наблюдался сниженный аппетит, у 11,4% отмечалась изжога, тошнота, у 53,1% - боли в животе, у 46,8% - запоры, у 11,4% - неустойчивый стул. У 8,3% пальпировались спазмированные участки толстой кишки, у 11,4% - умеренное вздутие живота, урчание. У 18,0% детей отмечалась прозрачная слизь на поверхности фекалий с непереваренными частицами пищи. У 73,5% детей наблюдались осложнения в виде бронхита, пневмонии, ларинготрахеита, отита, лимфаденита, синусита. Прием антибактериальных средств потребовался 91,2% больным. Бактериологическое исследование выявило нарушение видового и количественного состава микрофлоры кишечника у 88,1% часто болеющих дошкольников. Патогенные микроорганизмы не определялись, выявлено снижение уровня Lactobacillus (р<0,001) и повышение E. coli со сниженными ферментативными свойствами (р<0,01) по сравнению со здоровыми детьми, а среди условно-патогенной микрофлоры наблюдали увеличение содержания Proteus ( р<0,01). Эшерихии с низкой ферментативной активностью определялись у 50 (52,1%) часто болеющих дошкольников.
На фоне снижения штаммов облигатных представителей микрофлоры у 48 детей (50,0%) диагностирована контаминация толстой кишки условно-патогенной флорой. Грибы рода Candida - 38,7%, Proteus - 20,4%, S. aureus - 3,2% [ 25].
Нами предпринята попытка изучить влияние циклоферона на элиминацию аллохтонной флоры из состава кишечного микробиоценоза при кампилобактериозе, поскольку доказано (in vitro) воздействие препарата на экспрессию факторов персистенции грамотрицательных патогенных, условно-патогенных энтеробактерий и грамположительных кокков [4].
In vivo эффект доказан положительным результатом лечения сальмонеллеза и иерсиниоза [30]. Дети с установленным диагнозом дисбактериоза кишечника жаловались на периодическое недомогание (27,5%), у 50,0% из них отмечался сниженный аппетит, у 72,7% периодически возникали боли в животе, у 40,9% детей наблюдались запоры, на неустойчивый характер стула указывали 54,6% детей. Обложенность языка наблюдалась у 36,4% дошкольников. У 8,3% пальпировались спазмированные участки толстой кишки, у 11,4% - умеренное вздутие живота, урчание. У 18,5% отмечалась прозрачная слизь на поверхности фекалий [23,26].
В остром периоде кампилобактериоза оценена эффективность циклоферона, в виде ректальных суппозиториев 1 . Курс терапии циклофероном составил 5-7 дней, препарат назначался в первые сутки госпитализации с момента установления диагноза кампилобактериоза методом ПЦР.
Рис.1. Динамика абсолютных значений субпопуляций лимфоцитов на фоне различных схем терапии кампилобактериоза
Изменения субпопуляций лимфоцитов (показатели 1-4-го и 12-18 дней болезни) выявили, что при включении циклоферона происходит нарастание абсолютного содержания лимфоцитов, несущих рецепторы CD3+ и CD4+ фенотипа Т-клеток. Так, изначально средний уровень Т-лимфоцитов периферической крови составил 1173х109 клеток у детей, пролеченных циклофероном, и 1262х109 клеток у получавших базисную терапию, а уровень CD4+ клеток, соответственно, составил 551х109 и 558х109 клеток. Сравнение с показателями в реконвалесцентном периоде выявило нарастание уровня Т-лимфоцитов до 1724х109 и 1645х109 клеток и CD4+ лимфоцитов до 1027х109 и 920х109 клеток ( р<0,05) для каждого показателя в обеих группах. При этом показатели реконвалесцентного периода уровней Т-лимфоцитов и клеток, несущих CD4+ рецепторы, не различались (р>0,05). Однако уровень антителпродуцирующих клеток и лимфоцитов, несущих рецепторы активации, в двух сравниваемых группах были неоднозначными (рис. 1).
Значимости влияния на продукцию циркулирующих иммунных комплексов использованной терапии отмечено не было, однако тенденция к нарастанию ЦИК у больных, получавших циклоферон, была более заметной (+0,02 ед.опт.плотн.), чем при базисной терапии (+0,006 ед.опт.плотн.).
Влияние циклоферона на гуморальное звено иммунного ответа изучено (табл.1) определением титров специфических антител в парных сыворотках и синтеза общего иммуноглобулина класса А в копрофильтратах с помощью реакции иммунофлюоресценции. Исходно среднегеометрическая концентрация циркулирующих противокампилобактерных антител не отличалась у детей двух наблюдаемых групп, динамика прироста антител имела сходные тенденции, а титр сывороточных антител (к началу третьей недели) не имел различий (5,01±0,34 и 5,36±0,41 1/Log2, р>0,05). У детей, получавших циклоферон, уровень общего IgA кишечного секрета составил 4,21±0,39 1/Log2 при исходном значении 1,97±0,15 1/Log2, то есть более чем в 2 раза (р<0,05), тогда как у детей, получавших базисную терапию прирост общего IgA в копрофильтратах произошел только в 1,3 раза (2,04±0,11 и 2,78±0,31 1/Log2 соответственно), разница в содержании иммуноглобулинов класса А в копрофильтатах у пациентов в периоде реконвалесценции составила 33,97%.
Таблица 1
Уровень антигенспецифических сывороточных антител и общих IgА в копрофильтратах на фоне комплексной терапии (1/Log2)
Читайте также:

