Цитомегаловирус и токсоплазма хламидия
Обновлено: 26.04.2024
Материал составлен на основе фундаментальных трудов западных ученых.
Токсоплазма, краснуха, цитомегаловирус и беременность
При беременности назначают анализы на антитела к инфекциям - токсоплазме, цитомегаловирусу и краснухе. Определяется два вида антител – IgG и IgM, по которым судят о встрече с инфекционным агентом, а также о времени этой встречи. Самое страшное – заражение во время беременности (краснуха, токсоплазма, ЦМВ) или активация инфекции (ЦМВ).
Специфические антитела класса IgM, в частности, антитела к краснухе, относятся к факторам, циркулирующим в крови экстремально низких концентрациях. Поэтому анализы не в цифрах (количественно), а в виде положительности (=реактивности) или отрицательности (=отсутствии реактивности). Отрицательный и положительный результаты отделяет друг от друга так называемый порог отсечки (cutoff). Цифры показателя выше данного порога считаются положительными, а ниже порога — отрицательными. Зона значений порог ± 10%) является „зоной неопределенности”.
Быстрые уточняющие методы диагностики
Используются два способа: подтверждающие анализы методом иммуноблот и анализ на авидность антител IgG.
Если Вы сдаете эти анализы, исчезает необходимость ЖДАТЬ 2 недели плюс дни готовности анализа. Вы получаете сведения о своем состоянии ВОВРЕМЯ.
Подтверждающие анализы на токсоплазму, краснуху, ЦМВ методом иммуноблот:
- Высокочувствительный и специфичный тест!
- Чувствительность 97 %
- Специфичность 99 %
Используется для подтверждения результатов скрининговых исследований, таких как ИФА (ELISA) или иммунофлуоресцентный анализ (IFA).
Будьте уверены в анализе!
Зачем это нужно:
- точное и своевременное выявление позволит правильно определить тактику ведения беременности
- нет необходимости терять время на ожидание следующего анализа
Тактика врача определяется в каждом конкретном случае по-разному (подготовка к беременности, начало беременности, период новорожденности и т.д.)
Авидность антител IgG
Определить время, когда произошло инфицирование можно и по авидности антител IgG. Этот анализ менее точен по срокам, чем подтверждающий анализ методом иммуноблот.
Низкоавидные антитела встречаются при острой, недавно развившейся инфекции
Высокоавидные антитела – если встреча с инфекцией состоялась давно.
Определение авидности антител помогает врачу оценить ситуацию по инфекции и решить вопрос о дальнейших действиях.
Кому нужно полное обследование на инфекции?
- женщинам во время подготовки к беременности
- беременным
- новорожденным для диагностики врожденного инфицирования
Дополнительная справка: если анализы сданы во время беременности
- IgM методом иммуноблот
- IgM методом иммуноблот
Основные сведения о цитомегаловирусе (ЦМВ)
ЦМВ человека относится к вирусам, вызывающим схожие заболевания у различных животных. Все эти заболевания связаны с появлением характерных увеличенных клеток - отсюда и название цитомегаловирус (цито - клетка, мегало - большая). Вирус может размножаться в различных клетках организма человека, но предпочтительно этими клетками являются фибробласты (клетки соединительной ткани).
В добавок к тому, что ЦМВ вызывает тяжелые врожденные дефекты, он может привести к целому ряду заболеваний у детей и взрослых.
Существует три основных клинических вида цитомегаловируса:
- Генитальная ЦМВ инфекция может привести к гепатоспленомегалии (увеличению печени и селезенки), ретиниту (воспаление сетчатки), появлению сыпи и поражению центральной нервной системы.
- У около 10 процентов детей и взрослых первичная цитомегаловирусная инфекция вызывает мононуклеозный синдром с лихорадкой, общим недомоганием, атипичным лимфоцитозом и фарингитом.
- Пациенты с трансплантантатами и ВИЧ-инфицированные люди могут заболеть угрожающим жизни заболеванием, которое охватывает легкие, желудочно-кишечный тракт, сетчатку, печень и центральную нервную систему.
Существует предположение, что вирус обладает онкогенным эффектом и в редких случаях может трансформировать фибробласты.
Подробнее о цитомегаловирусе (ЦМВ)
Эпидемиология цитомегаловирусной инфекции (ЦМВ)
Цитомегаловирус распространен по всему миру, но проживание в плохих социальных условиях и не соблюдение правил личной гигиены сильно способствует передаче микроба. Часто встречаются инфекции у новорожденных и маленьких детей. Вирус можно обнаружить в молоке, слюне, фекалиях и моче. Была прослежена передача вируса от маленького ребенка к его беременной матери, и затем к развивающемуся плоду. К счастью, вирус плохо передается при случайных контактах, так как для его передачи необходимо время. ЦМВ часто передается половым путем, его выделяют из семени или цервикальной слизи. Однажды заразившись, человек, возможно, будет носителем данного вируса в течение всей жизни.
Заболевания, вызываемые ЦМВ, и их клинические проявления
Генитальная цитомегаловирусная инфекция (ЦМВ)
Инфекции у плода варьируются от легких форм до тяжелых и диссеминированных. Петехии (точечные кровоизлияния), гепатоспленомегалия и желтуха - наиболее часто встречаемые проявления. Микроцефалия с (или без) церебральной кальцификации, внутриматочная задержка роста и преждевременное развитие встречаются (что это такое. ) в 30-50 процентах случаев. Лабораторные аномалии включают повышение уровня аланинаминотрансферазы, тромбоцитопению (уменьшенное число тромбоцитов), гипербилирубинемию (повышение уровня билирубина в крови), гемолиз (разрушение клеток крови) и увеличение уровня белка спинномозговой жидкости. Прогнозы для новорожденных с тяжелыми формами заболевания весьма печальны: процент смертности очень велик, а те, кому удается преодолеть болезнь, в будущем встречаются с трудностями в интеллектуальном развитии и развитии слуха.
Зачастую генитальный цитомегаловирус никак не проявляется у новорожденных, а потому не лечится своевременно, что приводит к отклонениям у таких детей в различных системах, которые проявляются в течение первых лет их жизни.
Перинатальная ЦМВ инфекция
Новорожденные могут заразиться ЦМВ при прохождении родового канала или при последующем контакте с материнским молоком или другими выделениями. Огромное количество случаев инфицирования новорожденных протекает асимптоматически. Однако длительная интерстициальная пневмония связана с цитомегаловирусом. Иногда она сопровождается присоединением других инфекций, таких как Chlamidia trachomatis или Ureaplasma urealyticum. Медленное набирание веса, аденопатия, сыпь, гепатит, анемия и атипичный лимфоцитоз также могут сопутствовать заболеванию.
Мононуклеозный синдром
Этот синдром возникает у 10 процентов первично зараженных людей, у оставшихся первичная инфекция протекает бессимптомно. Для пациентов с этим синдромом характерно наличие лихорадки, общего недомогания, атипичного лимфоцитоза и, в редких случаях, цервикальной аденопатии или гепатита.
Большинство пациентов выздоравливают без последствий, хотя послевирусная астения может продолжаться в течение нескольких месяцев.
ЦМВ и трансплантация органов
Считается, что ЦМВ является одним из основных патогенов, осложняющих трансплантацию органов. У пациентов, которым пересаживают почку, сердце, легкие и трансплантаты печени, ЦМВ вызывает множество синдромов, включающих лихорадку и лейкопению, гепатит, пневмонит, эзофагит, гастрит, колит и ретинит. Период максимального риска находится между первым и четвертым месяцами после трансплантации.
ЦМВ у людей с поражениями иммунной системы.
Цитомегаловирус признан важным паразитом у ВИЧ-инфицированных людей, у которых он вызывает ретинит или диссиминированные (охватывающие весь организм) заболевания. Хотя случаи серьезных ЦМВ заболеваний снизились, установление высокоактивного режима приема антиретровирусных препаратов иногда вызывает острые вспышки ЦМВ-ого ретинита в течение первых нескольких недель терапии.
Диагностика цитомегаловируса
Диагностику ЦМВ инфекции невозможно убедительно провести только по клиническим проявлениям. Необходимо выделение вируса или определение цитомегаловирусных антигенов или ДНК из клинических образцов. Кроме того, важно проследить рост уровня антител в крови. Вирус легко определяется в культуре фибробластов. Если содержание вируса велико, что зачастую имеет место при генитальной ЦМВ инфекции, характерные изменения в клетках будут видны в течение нескольких дней. Но если содержание вируса мало, как при цитомегаловирусном мононуклеозе, такая диагностика может занять несколько недель. Многие лаборатории применяют метод, включающий в себя центрифугирование и определение антител к раннему ЦМВ- антигену. Такое исследование может дать результат раньше, чем метод культур.
Что такое токсоплазмоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, паразитолога со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
![Александров Павел Андреевич, инфекционист, гепатолог, паразитолог, детский инфекционист - Санкт-Петербург]()
Определение болезни. Причины заболевания
Токсоплазмоз — это острое и хроническое паразитарное заболевание человека в виде манифестных форм или носительства, вызываемое простейшими внутриклеточными паразитами — токсоплазмами, которые попадая в организм человека могут при условиях иммунодефицита поражать нервную ткань, среды глаза, сердечно-сосудистую и ретикулоэндотелиальную системы, вызывая поражение организма той или иной степени тяжести. Болезнь относится к группе TORCH-комплекса, т. е. вызывает врождённую патологию.
![Внутриутробное инфицирование токсоплазмами]()
Этиология
Таксономия:
Вид — Toxoplasma gondii
Токсоплазмы обитают в мире в трёх формах:
- трофозоиты (тахизоиты);
- цисты (брадизоиты);
- ооцисты.
![Формы существования токсоплазмы]()
Трофозоиты достигают 4-7 мкм в длину и 2-4 мкм в ширину. Их тело по форме напоминает полумесяц с заострённым передним и закруглённым задним концами, состоит из пелликулы (покровной ткани) и различных органелл. Такие паразиты обитают во всех клетках млекопитающих кроме эритроцитов, размножаются путём деления. Могут создавать движение, активно проникая в клетки хозяина через клеточную мембрану или посредством фагоцитоза (захвата и переваривания клетки). Обнаруживаются в тканях в острой стадии инфекции. Их скопление внутри одной клетки называют псевдоцистой. Трофозоиты неустойчивы вне клетки и во внешней среде, быстро погибают при высушивании, прогревании и применении дезинфицирующих средств. Хорошо окрашиваются по Романовскому. Чувствительны к различным химиопрепаратам (сульфаниламидам, некоторым макролидам и другим).
Цисты размерами до 100 мкм отличаются плотной оболочкой, через которую не могут проникнуть антитела или лекарственные препараты. Внутри оболочки сосредоточено 3000-5000 паразитов, со временем они увеличиваются. Цисты формируются в организме хозяина (в основном в скелетных мышцах, миокарде и ЦНС) и живут там десятки лет. Чрезвычайно устойчивы к воздействиям внешних факторов. При адекватной иммунной системе могут пожизненно находиться в состоянии функционального покоя и не приносить никакого вреда организму человека.
Ооцисты играют основную роль в передаче инфекции. Они представляют собой овальные образования 10-12 мкм в диаметре. Их развитие и формирование длится 3-24 дня и проходит в слизистой оболочке тонкой кишки кошек. Затем в течение 7-20 дней паразиты выделяются с испражнениями, после этого срока новые фекалии кошки уже не заразны. За сутки с испражнениях животного выделяется до 10 миллионов ооцист. Спустя 2-3 дня при температуре 24 °C происходит споруляция ооцист — образование спор. При благоприятных условиях микроорганизмы сохраняются во внешней среде до года и дольше.
Существует множество штаммов токсоплазм, одни из которых отличаются высокой вирулентностью, а другие относительно маловирулентны. [1] [2] [7] [9]
Эпидемиология
Учитывая большое количество латентных форм, заболевание не поддаётся общему исчислению — им может быть заражено не менее 1,5 миллиардов человек. Только ежегодно регистрируется около 200 тысяч случаев внутриутробного инфицирования.
Распространение возбудителя повсеместное — токсоплазма обнаружена на всех материках. После заражения паразиты способны пожизненно сохранятся в организме большинства животных и птиц. Количество случаев приобретённого токсоплазмоза в разных странах колеблется: от 85 % во Франции и Мадагаскаре до 15 % в США и Англии.
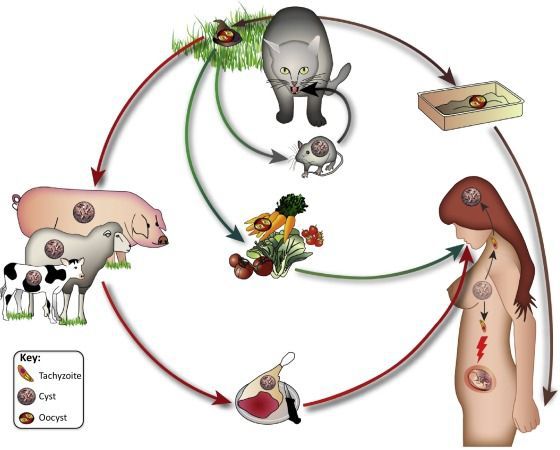
- Фекально-оральный:
- водный и пищевой путь — при недостаточной термической обработке, чаще при употреблении сырого мяса и фарша;
- контактно-бытовой путь — при несоблюдении санитарных норм в повседневной жизни, например, при общении с кошками.
- Вертикальный путь (от матери к плоду) — преимущественно при первичном заражении матери во время беременности, часто у ВИЧ-инфицированных в стадии СПИДа.
- Артифициальный путь — при пересадке органов, в которых расположены цисты, пациенту с плохим иммунитету.
- Аэрогенный путь — при попадании инфицированной ооцистами пыли в рот человека.
- Контактный путь — при повреждении целостности кожных покровов. Встречается крайне редко, в основном у работников лабораторий и скотобоен, отмечен лишь в некоторых источниках, явного практического значения не имеет.
![Пути передачи токсоплазмоза]()
От человека к человеку заболевание не предаётся (кроме случаев каннибализма). Нельзя заразиться посредством укуса насекомых и при половом контакте.
Инфицирование токсоплазмой вызывает устойчивый пожизненный иммунитет к повторному заражению, однако известны случаи рецидива первичной инфекции при заражении другим высоковирулентным штаммом (у беременных, заразившихся при употреблении сырого мяса с другого континента). [1] [3] [5] [8] [9]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы токсоплазмоза
Инкубационный период при манифестных формах (явных проявлениях болезни) длится от двух недель до двух месяцев.
Специфичных симптомов, характерных именно для токсоплазмоза, не существует.
В большинстве случаев приобретённого токсоплазмоза заболевание протекает бессимптомно или со стёртой клиникой, напоминающей нетяжёлое ОРЗ: кратковременная лихорадка, слабость, недомогание, повышение температуры до 38,0 °C, увеличение периферических лимфоузлов, небольшое увеличение печени и селезёнки.
Доказано, что токсоплазма может оказывать влияние на психику человека. Это выражается в учащении рискованных действий, снижении концентрации внимания, повышенной нервозности, у лиц с тяжёлым острым или длительным хроническим активным течением повышен риск развития шизофрении.
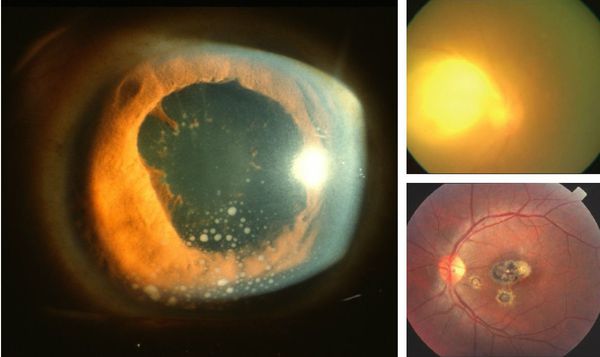
Иногда заболевание проявляется изолированной глазной формой — длительно текущие увеиты, иридоциклиты и хориоретиниты. Как правило, эти нарушения являются поздними проявлениями нераспознанного ранее врождённого процесса.
![Глазной токсоплазмоз]()
У людей с выраженным иммунодефицитом (ВИЧ, пересадка органов с последующей цитостатической терапией) возможно развитие генерализованного процесса с поражением нескольких органов (головного мозга, сердца, печени, почек, лёгких), нередко очень тяжёлого течения, проявляющегося в виде синдрома полиорганной недостаточности.
Токсоплазмоз у беременных может протекать в различных клинических вариантах и представляет опасность не столько для самой беременной (исключая тяжело протекающие патологии у беременных со СПИДом), сколько для плода.
При первичном заражении беременной токсоплазмозом имеет значение срок гестации:
- При инфицировании в первом триместре передача возбудителя плоду происходит лишь в 4 % случаев (к 13 неделе — в 6 %), но заканчивается, как правило, гибелью плода и выкидышем на ранних сроках. Если первичная инфекция у матери в первом триместре доказано, но выкидыш до 13 недели беременности не произошёл, то крайне высока вероятность, что внутриутробной передачи не было и ребёнок будет здоров.
- При инфицировании во втором триместре (особенно на 24-26 неделях) риск внутриутробной передачи резко возрастает и достигает 30-40 %, причём сопровождается развитием тяжёлых проявлений заболевания — одновременное увеличение селезёнки и печени, воспаление сосудистой оболочки и сетчатки глаза, поражения ЦНС в виде гидроцефалии, кальцификация, сыпь, миокардит, пневмония и другие.
- При заражении матери в третьем триместре передача инфекции ребёнку происходит с частотой до 90 %, однако проявления заболевания являются латентными или субклиническими и могут появиться спустя годы после рождения (отставание в развитии, нарушения зрения). [1][2][4][9]
Патогенез токсоплазмоза
![Проникновение трофозоита в клетку]()
По мере развития и размножения токсоплазм поражённые клетки разрушаются, происходит заражение новых здоровых клеток, и при попадании возбудителя в кровоток паразиты разносятся по всему организму. Образуются некрозы с формированием фиброзной ткани и кальцификацией (отложение солей кальция в организме).
Под воздействием иммунитета безоболочечные трофозоиты превращаются в брадизоиты (оболочечные скопления токсоплазм), т.е. в тканевые цисты, которые сохраняются десятками лет в неактивном состоянии и при значительном снижении иммунитета способны к обратной трансформации с развитием обострения.
При первичной инфекции у беременных возбудитель проникает в ткани плода и вызывает воспалительный процесс, причём в разные периоды развития наблюдается различный характер воспаления: у эмбриона происходит лишь альтерация (дистрофия и некроз ткани без фиброза), в раннем фетальном периоде дополняется повышенным образованием соединительной ткани (фиброзом), а в позднем фетальном периоде присоединяется сосудистый компонент. Отсюда вытекают различные по характеру и тяжести поражения плода, которые зависят от сроков инфицирования матери. [1] [2]
Классификация и стадии развития токсоплазмоза
По течению процесса токсоплазмоз бывает:
- острым — до одного месяца;
- подострым - 1-3 месяц;
- хроническим — более трёх месяцев.
По клиническим признакам выделяют пять форм заболевания:
- Врождённый острый токсоплазмоз:
- манифестная форма (с указанием ведущих проявлений);
- субклиническая форма (с указанием способа верификации диагноза).
- Врождённый хронический токсоплазмоз:
- обострение / ремиссия;
- с резидуальными (остаточными) явлениями / без резидуальных явлений.
- Врождённый латентный токсоплазмоз.
- Приобретённый острый токсоплазмоз.
- Приобретённый хронический токсоплазмоз.
По степени тяжести заболевание бывает:
- лёгким;
- среднетяжёлым;
- тяжёлым (врождённая инфекция, токсоплазмоз при СПИДе).
По наличию осложнений выделяют:
- осложнённый токсоплазмоз;
- неосложнённый токсоплазмоз.
В Международной классификации болезней 10 пересмотра выделены шесть типов заболевания:
- B58.0 Токсоплазмозная окулопатия;
- B58.1 Токсоплазмозный гепатит (K77.0*);
- B58.2 Токсоплазмозный менингоэнцефалит (G05.2*);
- B58.3 Легочный токсоплазмоз (J17.3*);
- B58.8 Токсоплазмоз с поражением других органов;
- B58.9 Токсоплазмоз неуточнённый. [1][2][3]
Осложнения токсоплазмоза
При врождённой форме может возникнуть гидроцефалия, микроцефалия, задержка психомоторного развития и слепота. Эти осложнения сопровождаются увеличением или уменьшением размеров черепа, различными неврологическими расстройствами — косоглазием, судорогами, трудностью с сидением и держанием головы, рвотой и другими.
При глазной форме заболевания развивается слепота, снижение остроты зрения и воспалительные явления всех сред глаза. Причём возможно как рождение с грубыми дефектами зрения, так и появление воспалительных явлений и нарушения зрения спустя много лет после рождения.
Токсоплазмоз у иммунокомпрометированных людей осложняется шизофренией, токсоплазменный энцефалитом и полиорганной недостаточностью — тяжёлой патологией различных органов при выраженном иммунодефиците. При этом свойственна картина тяжёлого энцефалита. Прогноз, как правило, неблагоприятный. [1] [5] [8] [9]
Диагностика токсоплазмоза
Лабораторная диагностика:
- Клинический анализ крови: снижение уровня тромбоцитов, увеличение количества лимфоцитов и эозинофилов.
- Биохимический анализ крови: возможно повышение уровня трансаминаз и билирубина.
- Иммуноферментный анализ (ИФА):
- Выявление специфических антител класса M — острая инфекция или её реактивация. Имеет ряд недостатков — низкая специфичность, длительная циркуляция в организме, иногда до года после острого процесса. В сложных случаях уточнение следует производить при помощи метода "двойной сэндвич" или "иммунозахват" IgM ELISA.
- Выявление специфических антител класса G (клеток памяти) — носительство, инфицированность — появляются в среднем со второй недели заболевания и достигают пика на 1-2 месяце, сохраняются пожизненно, за исключением СПИД-ассоциированных заболеваний.
- Авидность IgG — уточнение давности заболевания. Недостатком является отсутствие стандартизации результатов, что зачастую приводит к различным ошибкам интерпретации. Наибольшее значение имеет высокая авидность, остальные результаты низкой и слабой авидности могут быть ошибочными и не должны трактоваться как недавно перенесённое заболевание при отсутствии других подтверждающих этот факт тестов.
- ПЦР-диагностика: выявление ДНК токсоплазмы в крови, других жидкостях и тканях человеческого организма. Особенно информативна в диагностике генерализованного, глазного и врождённого токсоплазмоза, в т. ч. в антенатальном периоде путём проведения амнио (не ранее 16 недель) и кордоцентеза (с 18 недели беременности).
- УЗИ-диагностика: внутриутробное выявление гидро- и микроцефалии, кальцификатов, гепатоспленомегалии и выраженной задержки развития. [1][2][4][5][6]
Дифференциальная диагностика
Токсоплазмоз — это инфекция с необычайно разнообразными проявлениями, поэтому ввиду неспецифичности проявлений основное место в дифференциальной диагностике отводиться лабораторному обследованию, а именно специфическим серологическим тестам.
Необходимо исключить следующие заболевания:
-
(ВЭБ-инфекцию) — боли в горле, преимущественное увеличение затылочных и заднешейных лимфоузлов, характерные изменения гемограммы (появление большого количества атипичных мононуклеаров и отсутствие столь выраженных изменений при врождённом течении), положительные IgM и ПЦР крови; — лимфоцитарный характер гемограммы, частое поражение слюнных желёз, положительные IgM, ПЦР крови;
- туберкулёз — длительное постепенное начало, лёгкий субфебрилитет (до 38,0 °C), ночная потливость, нездоровый румянец на щеках, кашель, специфические изменения в лёгких, положительные пробы на туберкулёз, выявление бациллы Коха в мокроте;
- лимфопролиферативные заболевания (лимфома Ходжкина, неходжкинские лимфомы) — специфические изменения при биопсии поражённой ткани (лимфоузлов);
- ВИЧ-инфекция — наличие факта возможного заражения, увеличение всех групп лимфоузлов, положительная серология;
- саркоидоз — специфические изменения в лёгких, положительные результаты гистологического исследования. [1][2][5]
Лечение токсоплазмоза
Большинство случаев приобретённого токсоплазмоза протекают в лёгкой или бессимптомной форме, они не регистрируются и, по-видимому, не нуждаются в каком-либо лечении.
Необходимость проведения специфической этиотропной терапии возникает лишь у некоторых групп пациентов:
- беременные с доказанным первичным инфицированием (в ряде случаев при реактивации хронической инфекции);
- дети с врождённой формой токсоплазмоза (при наличии явных клинических и лабораторных проявлений заболевания, субклинических и инаппарантных формах) — сроки и объём терапии зависят от конкретных данных;
- иммунокомпрометированные люди, у которых токсоплазмоз (острый или в фазе реактивации хронического процесса) протекает с выраженными клинико-лабораторными проявлениями. Основное направление воздействия в этом случае должно быть на устранение причины иммунодефицита, повышение уровня СД4 клеток.
Проведение лечения может осуществляться как в стационаре, так и амбулаторно в зависимости от выраженности процесса, реакции пациента на вводимые препараты, необходимости тех или иных вариантов патогенетического и симптоматического обеспечения. [1] [4] [7]
Прогноз. Профилактика
При приобретённом токсоплазмозе у иммунокомпетентных лиц прогноз благоприятный, у иммунокомпрометированных лиц (СПИД) прогноз серьёзен, нередки летальные исходы.
При врождённом токсоплазмозе исход заболевания зависит от сроков инфицирования плода:
- при инфицировании в первом триместре, как правило, происходит выкидыш;
- в более поздние сроки последствия варьируются от тяжёлых до резидуальных форм.
Основным методом профилактики приобретённого и врождённого токсоплазмоза является соблюдение санитарно-гигиенических правил, особенно беременными, не имеющими антител класса G к токсоплазмам:
- ограничение контакта с кошками;
- запрет на употребление сырого мяса, фарша и морепродуктов;
- тщательная промывка зелени, фруктов и овощей;
- мытьё рук перед едой;
- работа на приусадебном участке только в перчатках.
Для беременных особенно важен скрининг антител к токсоплазме, позволяющий выявить активно протекающее заболевание или риск его возникновения, а также вовремя провести медикаментозную профилактику острого токсоплазмоза беременной и снизить риск врождённой инфекции на 60 %. При отсутствии антител класса G в первом триместре необходимо отслеживать антитела IgM и IgG не только в тертьем, но и во втором триместре беременности.
В очаге токсоплазмоза противоэпидемические мероприятия не проводятся, вакцина на разработана. [2] [3]
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Цитомегаловирус: причины появления, симптомы, диагностика и способы лечения.
Определение
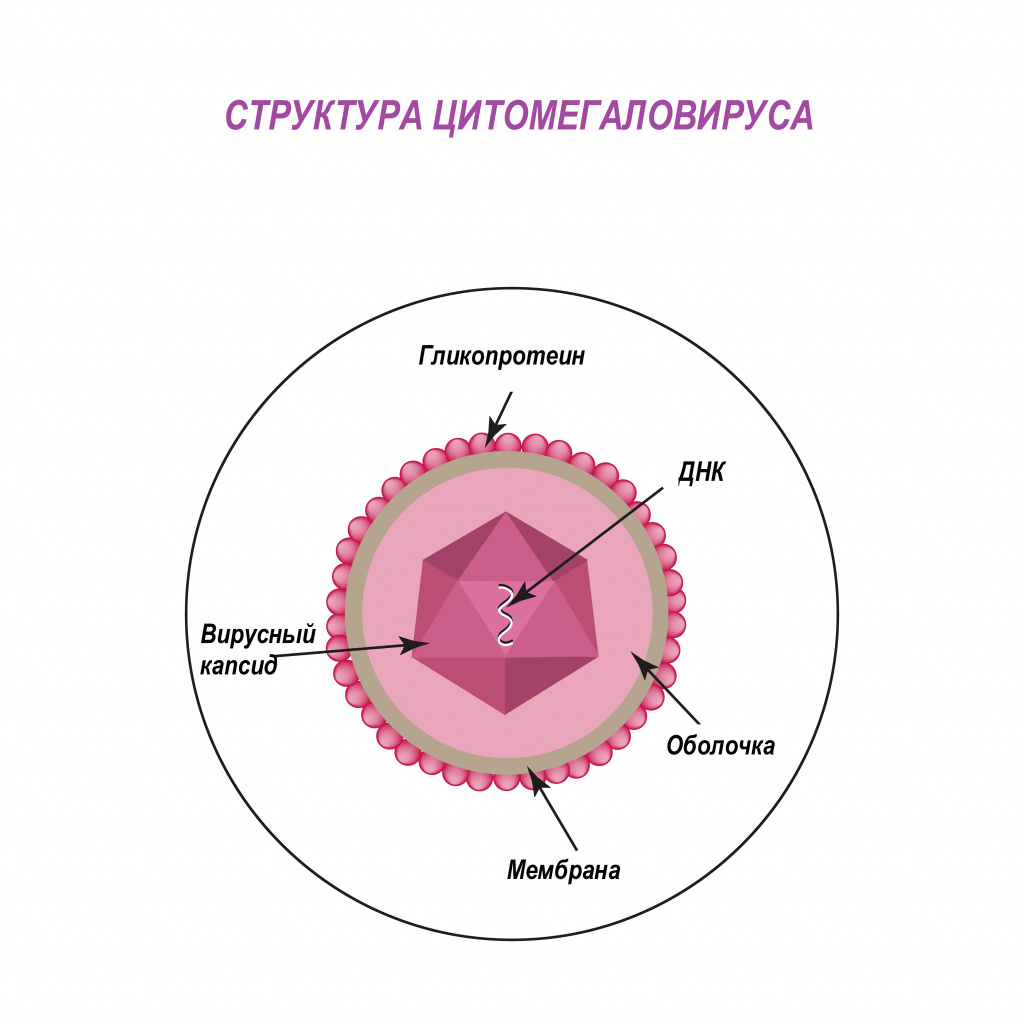
Цитомегаловирус (ЦМВ, или цитомегаловирусная болезнь) – хроническое инфекционное заболевание вирусной этиологии, характеризующееся многообразием клинических форм и проявлений - от бессимптомного течения до тяжелого поражения внутренних органов и центральной нервной системы. Возбудитель ЦМВ – представитель семейства герпесвирусов (вирус герпеса человека 5-го типа).
Попадая в клетки организма, цитомегаловирус способен оставаться в них пожизненно. У лиц с нормально функционирующей иммунной системой в подавляющем большинстве случаев инфекция протекает по типу вирусоносительства. При угнетении иммунитета вирус активизируется, вызывая клинические симптомы болезни.
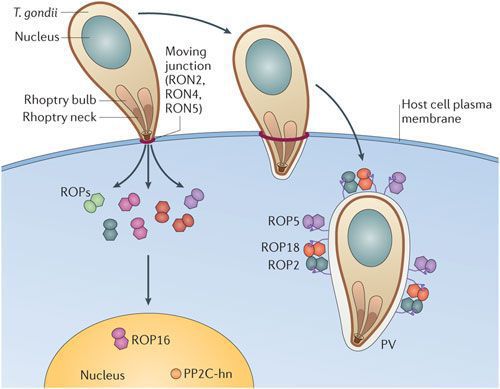
По различным данным доля носителей цитомегаловируса в России составляет порядка 73-90% - то есть именно у такого количества людей выявляются антитела к ЦМВ.
Причины появления цитомегаловирусной болезни
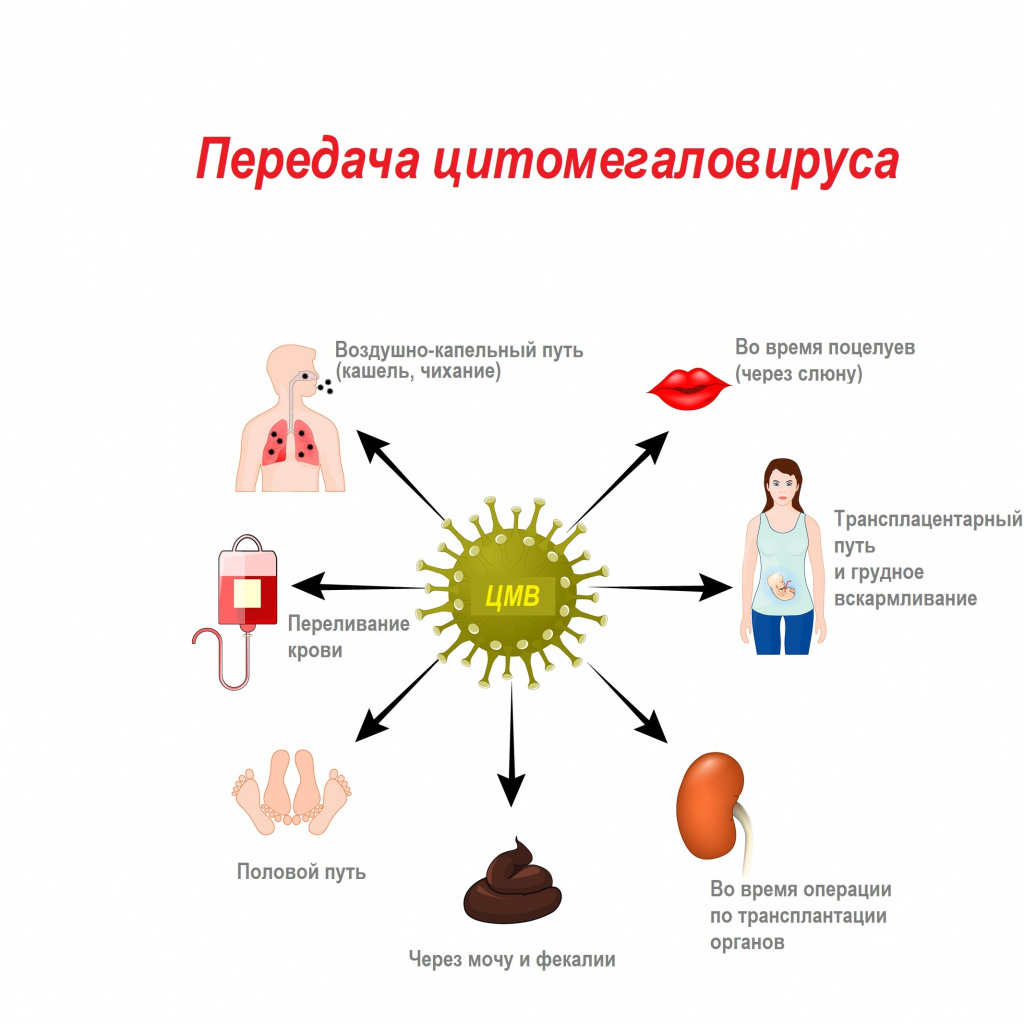
Цитомегаловирус передается через биологические жидкости: слюну, мочу, кровь, вагинальный секрет, слезы, сперму, фекалии, грудное молоко.
Из-за лабильности возбудителя и низкой концентрации вируса в выделениях для передачи инфекции необходим длительный, частый и тесный контакт с носителем.
Механизмы передачи вируса — воздушно-капельный (аэрозольный путь), контактный (контактно-бытовой и половой), гемоконтактный (парентеральный, а также при пересадке органов), вертикальный (от матери к плоду), фекально-оральный (алиментарный — через грудное молоко).
Заражение плода реализуется за счет трансплацентарной передачи от матери к плоду, которая возможна в течение всей беременности. Наибольшую опасность для плода представляет первичная инфекция на ранних сроках беременности, поскольку часто вызывает формирование врожденных пороков развития.
Особое свойство ЦМВ — способность вызывать депрессию практически всех звеньев иммунитета, резко угнетать продукцию интерферонов, в первую очередь ИНФ-α. При острой инфекции вирус поражает преимущественно эпителиальные клетки легких, печени, кишечника, почек, мочевого пузыря, молочных и слюнных желез, генитального тракта. Цитомегаловирус может инфицировать нервные клетки, клетки гладкой мускулатуры, костного мозга.
Классификация заболевания
По характеру инфицирования:
- врожденное (внутриутробное),
- постнатальное (приобретенное).
- латентная инфекция,
- персистирующая инфекция,
- активная (низкой, средней, высокой степени тяжести) инфекция.
- острая инфекция,
- реактивация вируса,
- реинфекция.
Инкубационный период цитомегаловирусной болезни составляет от 15 дней до трех месяцев (при манифестной, выраженной форме заболевания). Однако чаще первичное инфицирование протекает или бессимптомно, или по типу легкой формы ОРЗ – у пациента наблюдаются незначительная слабость, лихорадка (температура 37,1-38,0°С), дискомфорт в мышцах, першение в горле, иногда насморк, увеличение шейных лимфатических узлов, болезненность слюнных желез, головная боль, отсутствие аппетита.
У беременных острая первичная инфекция протекает, как правило, бессимптомно (25–50%) или с неспецифическими проявлениями (с лихорадкой, астенией и головной болью).
В редких случаях развиваются гепато- и спленомегалия, гепатит с минимальной степенью активности цитолитического синдрома, дерматиты, васкулиты, интерстициальный пневмонический процесс, тромбоцитоз или тромбоцитопения, лимфоцитоз.
У больных с иммунодефицитом цитомегаловирусная инфекция протекает тяжело - вирус быстро распространяется по организму и вызывает серьезные осложнения.
Диагностика цитомегаловируса
Диагностические мероприятия начинаются со сбора жалоб и анамнеза, в том числе акушерско-гинекологического анамнеза матери.
Затем врач проводит объективное обследование (физикальное, неврологическое и антропометрическое).
Лабораторные исследования - общие и специфические:
-
общий анализ крови;
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Синонимы: Анализ крови на антитела к цитомегаловирусу; АТ-ЦМВ-IgМ; цитомегаловирусная инфекция; ЦМВ-инфекция; специфические иммуноглобулины класса М к цитомегаловирусу. Cytomegalovirus; CMV Antibody; IgM; CMV infection; CMV-specific IgM. Краткое описание исследования Anti-CMV.
Синонимы: Анализ крови на антитела к цитомегаловирусу; АТ-ЦМВ-IgG; Цитомегаловирусная инфекция; ЦМВ-инфекция; Специфические иммуноглобулины класса G к цитомегаловирусу. Cytomegalovirus; CMV Antibody, IgG; CMV infection; CMV-specific IgG. Краткое описание исследования Anti-CMV-IgG .
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирусная инфекция входит в группу репродуктивно значимых инфекций, обозначаемых как TORCH-комплекс (название образовано начальными буквами в латинских наименованиях - Toxoplasma, Rubella, Cytomegalovirus, Herpes); первичное инфицирование данными возбудителями, либо обострение .
К каким врачам обращаться
С первичными жалобами пациенты обращаются к врачу-терапевту или врачу общей практики (семейному врачу), детей ведет врач-педиатр . Могут потребоваться консультации инфекциониста - для верификации диагноза, стоматолога - при поражениях слизистой оболочки рта, кардиолога - при наличии врожденного порока сердца, нейрохирурга - при пороках центральной нервной системы, невропатолога - для оценки неврологической патологии, гематолога - при выраженных гематологических изменениях и геморрагическом синдроме, окулиста - для исследования глазного дна, отоларинголога - для исследования слухового аппарата.
Лечение цитомегаловирусной болезни
Субклинические формы ЦМВ-инфекции и латентное носительство крайне распространены, поэтому в большинстве случаев не требуют специфической терапии даже при выявлении антител. Их лечение направлено на усиление защитных сил организма при помощи иммуномодуляторов и профилактику факторов риска, которые приводят к обострению заболевания.
Для терапии клинически активных форм инфекции применяют:
- комплекс патогенетической (противовирусной) терапии, который разрабатывается профильными специалистами и включает препараты прямого противовирусного действия для минимизации риска осложнений, сокращения времени течения заболевания, а также профилактики рецидивов;
- иммунотерапию – антицитомегаловирусный иммуноглобулин назначают преимущественно детям при манифестных формах заболевания и беременным;
- дезинтоксикационную терапию, которая направлена на купирование синдрома интоксикации;
- метаболическую терапию - для восстановления обмена веществ в организме;
- симптоматическую терапию - для купирования воспалительных и токсических проявлений заболевания.
Проблема клинически выраженной инфекции актуальна для лиц, имеющих иммуносупрессию иной природы, в частности, онкогематологических пациентов, больных лучевой болезнью, лиц, длительно принимающих кортикостероидную, туберкулостатическую терапию, а также перенесших ожоговую травму.
Острое течение ЦМВ может привести к развитию гепатита с повышением уровня аминотрансфераз и атипичным лимфоцитозом.
Ученые предполагают роль цитомегаловируса как одного из кофакторов в развитии системных васкулитов, хронических диссеминированных заболеваний легких (в частности, фиброзирующего альвеолита), криоглобулинемии, опухолевых процессов (аденокарциномы предстательной железы, аденокарциномы толстой кишки, рака шейки матки), атеросклероза, кардиомиопатии, детского церебрального паралича, эпилепсии, синдрома Гийена-Барре, синдрома хронической усталости, аутизма.
Первичное инфицирование цитомагаловирусом у беременных женщин существенно повышает риск преждевременных родов, самопроизвольного выкидыша, многоводия, замершей беременности, внутриутробного инфицирования и даже гибели плода. Врожденная ЦМВ-инфекция может стать триггерным фактором развития тяжелых генерализованных форм и инвалидизирующих исходов заболевания, таких как потеря слуха, зрения, умственная отсталость, микроцефалия, судорожный синдром и пр. Такие пожизненные проблемы со здоровьем развиваются примерно у каждого пятого ребенка с врожденной цитомегаловирусной инфекцией.
Профилактика цитомегаловирусной болезни
Женщинам, планирующим беременность, необходимо пройти обследование на наличие ЦМВ. При обнаружении вируса важно получить консультацию врача-иммунолога.
Профилактика или превентивное лечение (активный мониторинг пациентов по уровню вирусной нагрузки и назначение противовирусных препаратов пациентам с признаками инфекции) являются эффективными способами предотвращения развития цитомегаловирусной инфекции после трансплантации органов.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Определение авидности anti-Toxo-IgG антител и определение авидности anti-CMV-IgG антител даёт дополнительную информацию, полезную в диагностическом и прогностическом плане при подозрении на токсоплазмоз и цитомегаловирусную инфекции, в особенности во время беременности или планировании беременности.
В лаборатории ИНВИТРО определение авидности антител класса IgG проводится в составе серологических тестов для диагностики токсоплазмоза и цитомегаловирусной инфекции
Антитела класса G к Токсоплазме гондии (Т. gondii). Антитела класса G вырабатываются на антиген токсоплазмы при острой, подострой, хронической и латентной формах токсоплазмоза по истечении 3 - 4 недель с момента инфицирования. Антитела класса G обычно сохраняются пожизненно. Они выпо.
Антитела класса М к Toxoplasma gondii. Анти-Toxo-IgM появляются в течение 2 недель после инфицирования и могут сохраняться до года и более. Их присутствие не является, таким образом, строгим показателем острой инфекции. Но обнаружение у ранее серонегативных (то есть не имевших ант.
Синонимы: Анализ крови на антитела к цитомегаловирусу; АТ-ЦМВ-IgМ; цитомегаловирусная инфекция; ЦМВ-инфекция; специфические иммуноглобулины класса М к цитомегаловирусу. Cytomegalovirus; CMV Antibody; IgM; CMV infection; CMV-specific IgM. Краткое описание исследования Anti-CMV.
в качестве дополнительных подтверждающих тестов, которые выполняются бесплатно для пациента при выявлении комбинации результатов:
- anti-Toxo-IgG > 6 Ед/мл (больше порогового значения), anti-Toxo-IgM положительно или сомнительно;
- anti-CMV-IgG > 0,7 Ед/мл, anti-CMV-IgM положительно или сомнительно.
Подтверждение или исключение факта недавнего первичного инфицирования Toxoplasma gondii и Сytomegalovirus особенно важно при обследовании беременных женщин, поскольку риск патологии развития плода существенно увеличен при остром первичном инфицировании во время беременности, по сравнению с хронической инфекцией и реактивацией латентной инфекции. Поэтому постоянно идёт поиск новых диагностических подходов, позволяющих максимально достоверно оценить стадию и форму инфекционного процесса. Использование авидности IgG-антител в качестве индикатора срока первичного инфицирования, впервые предложенное финскими исследователями (Hedman K. M. с соавт.,1989), в настоящее время в ряде стран введено в практику серологических исследований на TORCH-инфекции. Так, во Франции, где, как и в России, проблема токсоплазмоза по-прежнему актуальна, этот тест входит в обязательный алгоритм обследования при подозрении на токсоплазмоз у беременных женщин.
Выявление в сыворотке присутствия одновременно IgG- и IgM-антител к инфекционному агенту можно трактовать как свидетельство недавнего первичного инфицирования, поскольку, как известно, срок исчезновения IgM-антител обычно составляет около 3 месяцев от начала инфекционного процесса. Но период циркуляции IgM антител может значительно варьировать в зависимости от инфекционного возбудителя и индивидуальных особенностей иммунного ответа организма. При инфицировании Toxoplasma gondii и Сytomegalovirus, следовые количества IgM-антител к этим инфекционным агентам в некоторых случаях выявляются в течение 1 - 2 и более лет.
Таким образом, их присутствие в крови беременной женщины не всегда является подтверждением первичного инфицирования в период беременности. Кроме того, специфичность даже лучших коммерческих тест-систем для обнаружения IgM-антител не абсолютна. В некоторых ситуациях, как следствие очень высокой чувствительности тестов, возможны неспецифические ложноположительные результаты. Выявление в крови высокоавидных IgG антител в этой ситуации позволяет исключить недавнее первичное инфицирование. Низкоавидные IgG-антитела, в среднем, выявляются в течение 3 - 5 месяцев от начала инфекции (это может в определённой степени зависеть от метода определения), но иногда вырабатываются и в течение более длительного срока. Само по себе выявление низкоавидных IgG-антител не является безусловным подтверждением факта свежего инфицирования, но служит дополнительным подтверждающим свидетельством в ряду остальных серологических тестов. При реактивации инфекции выявляются специфические IgG высокой авидности.
Показания к назначению теста. В комплексе серологических тестов для диагностики токсоплазмоза и цитомегаловирусной инфекции - при выявлении положительных результатов определения IgG и IgM-антител (в целях исключения или подтверждения вероятности недавнего первичного инфицирования).
Подготовка к исследованию: не требуется.
Метод исследования. В основе этих тестов лежит метод дифференциации высоко- и низкоавидных антител с помощью обработки комплексов антиген-антитело раствором мочевины, вызывающим денатурацию белка. После такой обработки связь низкоавидных антител с антигеном нарушается. Авидность IgG-антител в пробе оценивается с помощью расчётного показателя индекса авидности, который представляет собой отношение результата иммуноферментного определения концентрации IgG-антител в пробе, подвергнутой обработке мочевиной, к результату измерения концентрации IgG-антител в пробе, не обработанной диссоциирующим агентом.
Единицы измерения: результаты приводятся в виде индекса авидности.
Интерпретация результатов теста. Внимание! Фирма-производитель наборов предупреждает, что любой результат теста, особенно при обследовании беременных женщин, должен быть подтверждён при повторном тестировании.
При диагностике токсоплазмоза:
- индекс авидности anti-Toxo-IgG антител меньше 0,3 означает присутствие низкоавидных anti-Toxo-IgG антител, в этом случае нельзя исключить первичное инфицирование Toxoplasma gondii в течение последних 4 месяцев;
- индекс авидности anti-Toxo-IgG антител больше или равный 0,35 означает присутствие высокоавидных anti-Toxo-IgG антител — результат позволяет исключить первичное инфицирование Toxoplasma gondii в последние 4 месяца;
- значения индекса авидности anti-Toxo-IgG антител от 0,3 до 0,35 соответствуют пограничной авидности anti-Toxo-IgG антител в пробе.
- индекс авидности anti-CMV-IgG антител меньше 0,3 означает присутствие низкоавидных anti-CMV-IgG антител, в этом случае нельзя исключить первичное инфицирование Сytomegalovirus в течение последних 3 месяцев.
- индекс авидности anti-CMV-IgG антител больше или равный 0,3 означает присутствие высокоавидных anti-CMV-IgG антител — результат позволяет исключить первичное инфицирование Сytomegalovirus в течение последних 3 месяцев.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Проведен анализ комплексной лабораторной диагностики у больных с сочетанной токсоплазмозно-хламидийной инфекцией при различных режимах лечения. Верификацию диагноза осуществляли на основании клинико-анамнестических данных, с учетом эпидемиологического анамнеза и подтверждали результатами иммуноферментного анализа – определение титров антител (IgG) в парных сыворотках с нарастанием в динамике и методом ПЦР (полимеразной цепной реакции). Для лабораторной диагностики сочетанной токсоплазмозно-хламидийной инфекции рекомендуется комплексный подход, заключающийся в применении нескольких лабораторно-диагностических методов: ИФА и ПЦР.

1. Анчупане И.С., Андерсоне Д.П., Милтиньш А.П. Патогенетическое обоснование корригирующей терапии больных хламидийно-трихомонадной инфекцией // Всесоюзный IX съезд дерматовенерологов. – М., 1991. – С. 6–7.
2. Бурова А.А., Абдуллаева С.А., Торганова Е.Н. Основные свойства возбудителя хламидиоза и его роль в развитии инфекций урогенитального тракта // Журнал микробиологии эпидемиологии и иммунобиологии. – М., 1999. – № 4. – С. 107–110.
5. Капранова Е.И., Белоусова Н.А., Мельникова Е.В. и др. Клиническое течение и диагностика внутриутробных инфекций у новорожденных // Эпидемиология и инфекционные болезни. – 1997. – № 1. – С. 27–30.
6. Кисина В.И., Забиров К.И. Урогенитальные инфекции у женщин (клиника, диагностика, лечение). – М., 2005.
7. Козлова В.И., Пухнер А.Ф. Вирусные, хламидийные и микоплазменные заболевания гениталий: Руководство для врачей. – М.: Филин, 1997. – 536 с.
8. Коробейникова Э.А. К вопросу о частоте и клинических особенностях урогенитального хламидиоза // Труды ИГМИ. – 1995. – № 33. – С. 166–168.
9. Орджоникидзе Н.В., Ушницкая Е.К. Диагностика внутриутробной инфекции // Акушерство и гинекология. – 2008. – № 5. – С. 12–14.
10. Щербо С.Н., Макаров В.Б., Дубинина И.Г. Диагностика хламидийной и гонококковой инфекции методом полимеразной цепной реакции // Клиническая лабораторная диагностика. – 1997. – № 7. – С. 6–9.
В последние годы в связи с увеличением инфекционных заболеваний урогенитального тракта большое внимание уделяется так называемому TORCH-комплексу (Toxoplasma gondii, Rubella, Cytomegalovirus, Herpes simplex virus и другие инфекции, среди них возбудители сифилиса, хламидиоза, гепатитов А и В, листериоза), характеризующемуся склонностью к субклиническому течению инфекции у взрослых, возможностью активации латентно текущей инфекции, трудностью клинической диагностики и необходимостью использования специальных лабораторных методов, выраженным тропизмом возбудителя к определенным органам и системам [3, 5, 6, 8, 9 ].
Развитию микстинфектологии способствует совершенствование методов диагностики, терапии и профилактики урогенитальных инфекций, значительное внимание уделяется разработке новых методов взятия материала от больных [1, 4]. До настоящего времени вопрос о влиянии микст-инфекции на течение заболевания, ее реинфекцию и персистенцию остается мало изученным [10]. Кроме того, все еще нет четкого алгоритма эффективной диагностики сочетанных инфекций, поскольку микробные ассоциации не только влияют на результаты лабораторных исследований, но и микст-инфекция приводит к несвоевременной диагностике [2, 7].
Цель исследования: оценка комплексной лабораторной диагностики у больных с сочетанной токсоплазмозно-хламидийной инфекцией.
Материалы и методы исследования
Всего под наблюдением находилось 78 больных в возрасте от 18 до 40 лет с сочетанной токсоплазмозно-хламидийной инфекцией, находившихся на стационарном лечении в Областной инфекционной больнице г. Караганды и амбулаторном наблюдении в поликлинике Карагандинского государственного медицинского университета. В исследование включены больные только женского пола с диагнозом сочетанная токсоплазмозно-хламидийная инфекция (хронический приобретенный токсоплазмоз и урогенитальный хламидиоз, вызванный Chlamydia trachomatis). Сочетанная инфекция отличалась полиморфизмом клинической симптоматики, формированием хронических форм заболевания, особенно у женщин репродуктивного возраста. Наряду с этим у женщин был отягощен акушерско-гинекологический анамнез (хронические воспалительные заболевания матки и придатков, невынашивание беременности, мертворождения, вторичное бесплодие).
Верификацию диагноза осуществляли на основании клинико-анамнестических данных, с учетом эпидемиологического анамнеза и подтверждали результатами иммуноферментного анализа – определение титров антител (IgG) в парных сыворотках с нарастанием в динамике и методом ПЦР (полимеразной цепной реакции). Материалом для ИФА исследования послужила кровь, для ПЦР – кровь и урогенитальные соскобы.
Результаты исследования и их обсуждение
Из-за отсутствия патогномоничных симптомов при микст-инфекции токсоплазмоза и хламидиоза решающую роль приобретали методы лабораторной диагностики: определение специфических антител (ИФА) и выявление самого возбудителя (ПЦР). Выделение возбудителя одним методом может давать ложноположительные и ложноотрицательные результаты, так как у каждого метода диагностики есть свои преимущества и недостатки. В связи с этим при обследовании больных мы применяли два метода лабораторной диагностики: ИФА и ПЦР.
В ходе исследования больные с сочетанной токсоплазмозно-хламидийной инфекцией были разделены на три группы в зависимости от проведенной терапии: I группа (исследуемая) – 26 больных получили комбинированный препарат (сульфадоксин+триметамин) + мидекамицин + иммуномодулятор циклоферон + хилак-форте; II группа (исследуемая) – 27 больных получили спирамицин + офлоксацин + циклоферон + хилак-форте; III группа (контрольная) – 25 больных получили традиционное лечение: спирамицин + доксициклин + циклоферон + хилак-форте.
В связи с этим эффективность проводимой терапии больных с сочетанной токсоплазмозно-хламидийной инфекции оценивалась по результатам клинического (регресс клинической симптоматики) и лабораторного обследования (по снижению титров специфических антител в ИФА, результатов ПЦР через 1 и 2 месяца после проведенного курса комплексного лечения).
С помощью метода ИФА мы установили, что 78 обследованных больных являлись серопозитивными, тогда как серонегативных лиц выявлено не было. По уровню показателя ИФА в I исследуемой группе обнаружены IgG к токсоплазмам и хламидиям у 26, во II исследуемой группе у 27 и в III контрольной группе у 25 больных. Во всех трех группах у этих же больных IgM отсутствовали. Вместе с тем не было больных с одновременным наличием маркеров активной формы IgM и обнаружением IgG.
При сочетанной токсоплазмозно-хламидийной инфекции ИФА на токсоплазмоз оценка показателя IgG к токсоплазмам была весьма вариабельной в зависимости от степени активации инфекции. Так, в I группе положительный показатель IgG был выявлен у 26 женщин, во II группе у 27 и в III группе у 25. Для дифференциальной диагностики и констатации активного инфекционного процесса у больных с высокими титрами IgG использовалось определение индекса авидности IgG (ИА). В связи с этим для исключения острой инфекции у больных с наиболее высокими титрами IgG и ярко выраженными клиническими проявлениями нами был определен индекс авидности. Так, в I исследуемой группе у 6 (23,1 %) пациенток, во II исследуемой группе у 4 (14,8 %) и в III контрольной группе у 5 (20 %) показатель ИА превышал 30 %, что свидетельствовало о нереальности инфицированности токсоплазмами в течение последних шести месяцев. В то же время во всех трех группах не было ни одного случая, при котором IgG – ИА оказался ниже 30,0 %, что исключало возможность инфицирования в течение последних шести месяцев.
При сочетанной токсоплазмозно-хламидийной инфекции ИФА на хламидиоз у этих же больных показал более высокие титры на антитела к хламидиям. Так, в I исследуемой группе слабо положительные титры выявлены у 4 (15,4 %) больных, положительные у 13 (50 %), резко положительные у 9 (34,6 %), во II исследуемой группе у 3 (11,1 %), 16 (59,3 %) и 8 (29,6 %), в III контрольной группе отмечен подъем показателя IgG соответственно у 5 (20 %), 12 (48 %) и 8 (32 %)ца 2)ийной инфекции до лечения.
Оценка эффективности лечения отслеживалась по снижению титров противотоксоплазмозных антител IgG и по снижению антихламидийных антител IgG через 1 месяц (табл.1).
После проведенного лечения во всех трех группах отмечалась положительная динамика, так в I группе больных отсутствие противотоксоплазмозных антител наблюдалось у 6 (23,1 %) человек, снижение титров IgG у 20 (76,9 %). Во II группе титры IgG стали отрицательными у 5 (18,5 %), снижение титров IgG у 22 (81,5 %), в III группе титры IgG не обнаруживались у 3 (12 %), снижение титров IgG у 22 (88 %). После проведенной терапии в I группе больных отсутствие антихламидийных антител наблюдалось у 14 (53,8 %) человек, снижение титров IgG у 12 (46,2 %); во II группе отрицательные результаты стали у 12 (44,4 %), снижение титров IgG у 15 (55,6 %); в III группе соответственно у 7 (28 %) и 18 (72 %). Следует отметить, что в трех группах отмечалось снижение титров IgG в 1,5-2 раза.
Результаты ИФА у больных с сочетанной токсоплазмозно-хламидийной инфекцией после лечения
Читайте также: