Есть ли ядро в клетках туберкулезной палочки
Обновлено: 12.05.2024
Специальный корреспондент журнала "Наука и жизнь" Е. ЗВЯГИНА.
Специалистам Института биохимии им. А. Н. Баха в сотрудничестве с британскими учеными удалось выйти на принципиально новый уровень в изучении туберкулеза. Выявлен так называемый фактор роста, стимулирующий размножение туберкулезных бактерий. Открытие позволяет рассчитывать на появление принципиально новых методов диагностики и лечения этой болезни, ставшей реальной угрозой человечеству на рубеже второго и третьего тысячелетий.
Размножающиеся клетки. На микрофотографии видно, как в клетке разделилось ядро, а в средней части клетки появилась перегородка.
Туберкулезную микобактерию - микроорганизм, вызывающий туберкулез, когда-то можно было убить одним антибиотиком.
ХХ век, век НТР - на его долю пришлось наибольшее количество открытий в науке и технике - неожиданно поставил человечество на грань вымирания.
По данным Всемирной организации здравоохранения, в 1998 году от туберкулеза умерли 3 млн. человек (включая 100 тыс. детей). Если ситуация не изменится, то к 2020 году более 1 млрд. человек будут инфицированы, 200 млн. заболеют и 70 млн. человек умрут от туберкулеза.
Россия входит в число 15 самых отсталых стран с наивысшим уровнем заболевания туберкулезом. В нашей стране он в 10 раз выше, чем в странах Запада.
По сведениям Минздрава, в настоящее время в России более двух с половиной миллионов человек больны туберкулезом. Количество вновь заболевших выросло с 7,7 случая на 100 тысяч человек в 1990 году до 17,7 в 1998 году. Только за десять месяцев прошлого года число больных увеличилось на 8,5%. Смертность от этой болезни достигла предельно высокого уровня (50% всех летальных исходов, вызываемых инфекционными заболеваниями). В тюрьмах и колониях туберкулезом болеют в 50 раз чаще, чем в целом по стране.
Положение усугубляется тем, что возбудитель туберкулеза - так называемая "палочка Коха" - приспосабливается к созданным для его подавления антибиотикам. Современные лекарства оказывают все меньшее сопротивление новым, мутировавшим формам бактерий.
Единственный надежный способ противостоять туберкулезу - обнаружить его на начальной стадии. Однако проблема ранней диагностики весьма сложна, поскольку бактерии туберкулеза способны долгое время находиться в "спящей" (латентной) форме, а такие бактерии практически невозможно обнаружить традиционными методами.
Сегодня ученые полагают, что каждый третий человек - носитель инфекции. Болезнетворные бактерии многие годы способны находиться в организме, никак себя не проявляя. Однако стоит иммунитету по каким-то причинам ослабеть, как они могут "проснуться", и болезнь начнет стремительно прогрессировать. Именно поэтому таким принципиально важным шагом в борьбе с туберкулезом стал открытый недавно метод выявления "спящих" бактерий.
Подобно всем живым организмам, бактерии проходят три стадии: рождение, жизнь, смерть. Смерть бактерии может наступить от так называемого голодания: например, попадая в почву или в океан, она получает крайне мало питательных веществ (или совсем их не получает) - и умирает. Правда, существует небольшой класс бактерий, умеющих и в таких условиях выживать длительное время, - спорообразующие бактерии. Спора - совершенно "замершая" клетка, ее состояние аналогично смерти. Такие клетки не проявляют никакой активности до тех пор, пока не попадут в благоприятные условия: тогда они "оживают", начинают размножаться и образуют колонии. Но большинство бактерий, в том числе болезнетворных, могут переживать голодание лишь несколько недель, максимум месяцев. По крайней мере, так считалось до последнего времени.
Проблема приспособления бактериальных клеток к экстремальным ситуациям давно стала предметом исследований группы ученых из Института биохимии имени Баха; ее возглавляет доктор биологических наук профессор Арсений Сумбатович Капрельянц.
Что случается с бактериями, не умеющими образовывать споры, когда они попадают в неблагоприятную среду? Умирают они или все же каким-то образом приспосабливаются? Все ли клетки в колонии ведут себя одинаково? Микробиологи обычно исследуют не индивидуальные клетки, а популяции, сообщества бактерий. Микробиолог подсчитывает количество клеток в популяции, затем, поместив их в питательную среду, ждет, пока бактерии образуют колонии. Количество образовавшихся колоний эквивалентно числу жизнеспособных клеток в исходной популяции. Остальные клетки (не развившие колонию) считаются погибшими.
Ученые из Института биохимии стали изучать индивидуальные клетки в популяции Micrococcus luteus - одной из разновидностей неболезнетворных бактерий, на примере которой удобно рассматривать биохимические процессы. Наблюдая поведение бактерий, они обнаружили, что при определенных условиях голодания клетки способны переходить в покоящееся, или дормантное, состояние. Они не размножаются, но и не умирают. Этот феномен во многом напомнил исследователям образование спор, хотя разница оказалась все же существенной. Споры обладают наивысшей степенью устойчивости к воздействию внешних факторов. Они практически нечувствительны к ультрафиолету и нагреванию. Бактерии в дормантном состоянии обнаружили меньшую защищенность от окружающей среды, но сам факт возможности "летаргического сна" для неспорообразующих клеток стал сенсацией. Эффект "спящих клеток" получил широкий резонанс. Проблемой заинтересовались многие ученые у нас в стране и за рубежом.
В британских и американских газетах появились публикации об опасности "спящих" бактерий, поскольку они могут долгое время находиться в организме человека или в окружающей среде (в почве или воде), никак себя не проявляя. Современными методами обнаружить такие бактерии практически невозможно. К примеру, вода, прошедшая все необходимые тесты, может содержать болезнетворные бактерии в латентном состоянии, которые, попав в благоприятные условия, станут активно размножаться.
Тема явно заявляла о своей серьезности и глубине. Лаборатория А. С. Капрельянца стала работать в сотрудничестве с учеными из университета Уэльса (Великобритания). Обычно в Москве проводились длительные физиологические эксперименты. В Англии выполнялись исследования, требующие современного оборудования. В сложившемся коллективе каждый исследователь был достаточно самостоятелен, имел свои собственные научные интересы. Сферой интересов Майкла Янга была генетика. Дуглас Келл в большей степени интересовался биотехнологией. Именно он приобрел прибор, позволяющий отсматривать отдельно каждую клетку в популяции, - проточный цитометр. А. С. Капрельянц и Г. В. Мукамолова занимались физиологической стороной исследований, проблемами жизнедеятельности бактерий. Вероятно, именно разноплановость экспериментов стала предпосылкой успешной работы. Область, открывшаяся перед учеными, была своеобразным "белым пятном" в науке, и какое-либо единственное выбранное направление могло сузить исследования, а в худшем случае завести в тупик.
"Заснувшие" бактерии не росли ни при каких условиях. Около двух лет ушло на то, чтобы найти способ активизировать их и таким образом доказать, что дормантное состояние обратимо, а следователь но - не равнозначно смерти. "Не знаю, на чем строилась наша уверенность, что их можно "разбудить", - говорит А. С. Капрельянц. - Вероятно, это интуиция, основанная на некотором опыте. Например, под микроскопом они были совсем как живые, только не размножались. Помог, как это часто бывает, случай. Забытая колба или что-то в этом роде, сейчас уже не вспомнить".
Неожиданно выяснилось, что добавление небольшого количества живых, активных клеток приводит к тому, что "спящие" клетки начинают оживать и размножаться. Они оживали и при добавлении жидкости, в которой росли живые клетки. Отсюда следовал логический вывод: живые бактерии производят нечто, что заставляет "проснуться" клетки, находящиеся в дормантном состоянии.
После серии исследований определили, что сигнальное вещество, синтезируемое живыми клетками и влияющее на "спящие", имеет белковую природу. Новый белок получил название Rpf (Resuscitation promoting factor), что в переводе на русский означает "фактор, ускоряющий оживление" или просто - фактор роста. Было обнаружено: Rpf стимулирует рост и живых, не "спящих" бактерий, что позволило говорить о нем как о первом бактериальном факторе роста. Через некоторое время ученым удалось выяснить аминокислотную последовательность и определить ген, кодирующий этот белок.
Лечение туберкулеза: новые возможности?
К настоящему времени уже расшифрован геном некоторых бактерий (порядка пятнадцати) и созданы компьютерные базы данных, которые могут использоваться для сравнения белков, ими синтезируемых. Получив ген, кодирующий Rpf, ученые решили выяснить, есть ли сходные белки у других бактерий. Аналогия фактору роста была найдена у Mycobacterium leprae (возбудителя проказы), Mycobacterium tuberculosis ("палочки Коха"). Гены, кодирующие сходные белки, были обнаружены и у ряда других микобактерий и стрептомицетов.
Эксперименты, проведенные с целью подтвердить или опровергнуть результаты компьютерного анализа, дали обнадеживающие результаты. Прежде всего, выяснилось, что Rpf действительно стимулирует рост микобактерий. Кроме того, оказалось, что антитела, образуемые против фактора роста, практически останавливают рост бактерий туберкулеза. Как известно, принцип прививки основан на том, что небольшое количество вакцины, введенное в организм, провоцирует выработку антител. Именно они создают защиту против болезни и не дают ей развиться, если человек заразился.
Таким образом, проблема перешла в область практики. Перспективы медицины, вызванные открытием первого бактериального фактора роста, трудно переоценить. Вот только два главных направления - выработка более совершенной системы диагностики и возможность создания принципиально нового класса лекарств и вакцин.
С помощью Rpf можно будет, во-первых, значительно сократить время, нужное для диагностики (особенно если в образцах, взятых для анализа, присутствует только небольшое количество возбудителя туберкулеза - а это бывает часто). Туберкулезная палочка - медленно растущая культура, поэтому для ее выявления требуется несколько недель. Правда, есть косвенные методы диагностики, основанные на признаках активности бактерий. Такие методы позволяют распознать болезнь значительно быстрее, но точность результатов при этом не гарантирована. Применяя фактор роста (например, просто добавляя его к тканям, взятым для анализа), можно будет сократить сроки обнаружения туберкулеза до минимума, и таким образом выиграть время для борьбы с прогрессирующей болезнью. Кроме того, бактерии, находящиеся в дормантном состоянии, до сих пор вообще не поддавались диагностике. Теперь их можно будет "разбудить" - и таким образом обнаружить.
Еще более заманчиво создать новый класс антибиотиков. Современные лекарства в основном воздействуют на рост и деление бактерий, скрытая же форма болезни до сих пор была практически неизлечима. Эффект новых антибиотиков, если их удастся синтезировать, будет основан на подавлении фактора роста. Принцип действия - совершенно новый, таким образом, на какой-то период мы, возможно, получим преимущество в борьбе с туберкулезом. Безусловно, бактерии со временем выработают устойчивость и к этим лекарствам. И тем не менее положительную роль здесь может сыграть белковая природа фактора роста, допускающая довольно большой простор для варьирования . Например, если клетки туберкулеза заменят какую-то одну аминокислоту, можно будет модифицировать и антибиотик, не меняя принципа его действия.
Еще одна цель дальнейших исследований - создание вакцин на основе ДНК. При обычной прививке человеку однократно вводят какое-то количество белка. Сейчас уже возможно внедрить в организм не белок, а фрагмент ДНК. Ген включается в подкожные клетки и начинает вырабатывать нужное вещество. Таким образом, в организме человека постоянно поддерживается необходимый для подавления инфекции уровень антител. Этот тип вакцин значительно эффективнее традиционных.
Перспектива разработки такой вакцины против туберкулеза ставит перед наукой новую задачу - создать так называемую нуль-мутантную бактерию, в которой был бы инактивирован, то есть "обезврежен", ген, отвечающий за синтез Rpf. Задача усложняется тем, что Micrococcus luteus еще недостаточно генетически изучен, поэтому сделать нуль-мутантную бактерию на его основе непросто. Что касается туберкулеза, то, во-первых, эта культура крайне неудобна в практике из-за медленных темпов роста, во-вторых, туберкулез имеет пять генов, отвечающих за производство разных Rpf-подобных белков (следовательно, надо инактивировать пять генов). Если нуль-мутантная бактерия все же будет создана, она может стать идеальной основой вакцины: создавая иммунитет в организме, она будет абсолютно безопасна, поскольку неспособна к самостоятельному размножению. И еще. Если удастся получить такую бактерию и показать, что ей нужен фактор роста извне, чтобы размножаться, это будет бесспорным доказательством того, что это вещество необходимо для роста популяции бактерий. Пока такого доказательства нет.
Конечно, о практических "выгодах" открытия фактора роста можно говорить, лишь имея в виду длительную перспективу. По расчетам компании Glaxo Welcome, для введения в медицинскую практику нового типа вакцин потребуется минимум 10-15 лет. Что же касается фундаментальных исследований, то их цель на настоящем этапе - выяснить механизмы действия фактора роста. Непонятным еще остается и наличие в туберкулезных бактериях пяти генов, отвечающих за синтез Rpf. Каковы функции каждого? Вопросы ждут своего решения.
Как можно увидеть на примере исследований "спящих" бактерий, в науке трудно предсказать, какие проблемы могут открыться перед учеными в следующий момент. Начиная изучение бактерий Micrococcus luteus, никто из исследователей не предполагал, что полученные результаты будут связаны с туберкулезом. Ставя перед собой конкретную цель, ученый лишь задает себе первоначальное направление. В изучении природы человек меньше всего похож на последовательного и аккуратного экспериментатора. Материал часто "ведет" исследователя за собой, ставя перед ним все новые и новые проблемы.
Читайте в любое время
Когда несколько лет назад А. С. Капрельянц (стоит справа) и Дуглас Келл подписывали договор о сотрудничестве, никто еще не мог предположить, что совместная работа русских и британских ученых приведет к открытию бактериального фактора роста и станет новым шагом в постижении природы туберкулеза.
Туберкулезную микобактерию - микроорганизм, вызывающий туберкулез, когда-то можно было убить одним антибиотиком. Потом появились штаммы, требующие применения двух антибиотиков, позже - трех, а недавно возникли штаммы, резистентные к этому комплексному средству из трех антибиотиков.

Обзор
Автор
Редакторы

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.
Тем не менее диагностика — это еще не диагноз, и результат любого теста не является истиной в последней инстанции. Диагноз же по-прежнему ставят, исходя из нескольких составляющих:
- клинической картины;
- наличия контакта с туберкулезным больным;
- рентгенографии легких, флюорографии или компьютерной томографии;
- результатов диагностических тестов.
Однако большинство этих методов диагностируют туберкулез постфактум — только скрининговые тесты помогают выделить лиц с высоким риском развития заболевания или с только зарождающимся процессом. И уже более 100 лет основным методом массовой диагностики туберкулеза является туберкулиновая проба Манту 2 ТЕ (содержащая 2 туберкулиновые единицы). Тест спорный, со множеством ложноположительных результатов, но именно его используют во всем мире и отказываться пока не собираются.
Проба Манту
В мире используют 3 вида туберкулина (рис. 1): датский препарат PPD (purified protein derivative) RT 23, американский PPD-S и российский — PPD-L. Различаются они видами микобактерий, из которых были получены: при производстве датского и американского препаратов используют только M. tuberculosis, а при производстве российского — смесь из M. tuberculosis и M. bovis (микобактерии, вызывающей туберкулез у крупного рогатого скота; на основе этого штамма была разработана вакцина БЦЖ). Различие в составах туберкулина обусловливает разные границы положительного результата: 15 мм для детей, привитых БЦЖ, и не более 10 мм для непривитых детей до 5 лет у датского препарата, не более 10 мм у американского и 5 мм у российского [4].

Рисунок 1. Препараты туберкулина
Диагностику с помощью пробы Манту проводят следующим образом: небольшое количество туберкулина вводят под кожу чуть выше запястья и через 72 часа оценивают реакцию, которую считают положительной, если в месте введения появляется припухлость (папула) более 5 мм в диаметре. В зависимости от ее размера, различают степень реакции от отрицательной (0–1 мм) до резковыраженной, или гиперергической (17 мм и более у детей и подростков, 21 мм и более у взрослых) [5]. И тут начинаются трудности, потому что у привитых БЦЖ реакция Манту положительна [6]! Мало того, чем больше поствакцинальный рубец, тем выше чувствительность к туберкулину [7]. Поэтому у привитых БЦЖ оценивают не только диаметр папулы, но и размер поствакцинального рубчика (табл. 1).
| Срок, прошедший с момента вакцинации БЦЖ | Размер рубчика после БЦЖ | Привитый иммунитет (мм) | Неясная причина | Подозрение на инфицирование |
|---|---|---|---|---|
| 1 год | 6–10 мм | 5–15 мм | 16 мм | Более 17 мм |
| 2–5 мм | 5–11 мм | 12–15 мм | Более 16 мм | |
| 0 мм | 2–4 мм | 5–11 мм | Более 12 мм | |
| 2 года | Вне зависимости от размера | Уменьшение размера папулы или прежний ее размер | Увеличение размера на 2–5 мм от предыдущего положительного результата | Реакция изменяется на положительную или папула увеличивается более чем на 5 мм |
| 3–5 лет | Вне зависимости от размера | 5–8 мм либо уменьшение размера папулы | Увеличение размера на 2–5 мм за последний год или отсутствие тенденции к уменьшению | Изменение на положительную (5 мм) реакцию или увеличение папулы на 6 мм; 12 мм при впервые поставленной пробе; изменение предыдущего размера на 2–4 мм или размер в 12 мм |
| 6–7 лет | Вне зависимости от размера | 0–4 мм | 5 мм | 6 мм и более |
| 7–9 лет | Если в 7 лет ребенку была сделана ревакцинация БЦЖ, реакция Манту вновь становится положительной и нормы повторяются | 0–4 мм | 5 мм | 6 мм и более |
| Взрослые | Отрицательная реакция, покраснение любого диаметра; папула до 4 мм | Более 5 мм |
Безусловно, метод оценки результата довольно субъективный. Но главное, папулу надо еще правильно измерить, зафиксировав только размер выпуклой части и игнорируя покраснение вокруг нее (рис. 2).

Рисунок 2. Правильная и неправильная оценки диаметра папулы
Еще одна трудность с диагностическими возможностями пробы Манту связана с тем, что они зависят от нижней границы положительного результата: чем ниже граница, тем больше будет наблюдаться ложноположительных реакций. К примеру, в России пороговым значением является папула в 5 мм. Это приводит к гипердиагностике — большому количеству зафиксированных реакций, но в итоге к низкому проценту реально выявленных случаев инфицирования [4].
В общем, не удивительно, что в последнее время информативность туберкулиновой пробы постоянно ставится под сомнение. Мало того, она может вызывать не связанные с туберкулезом аллергические реакции, поэтому все больше здоровых, но склонных к аллергии детей вынуждены идти в тубдиспансер в надежде выяснить причину положительной реакции. И наконец, на результат пробы может влиять множество факторов: недавно перенесенные инфекции, хронические заболевания, прием медикаментов, изменение гормонального фона или иммунитет к нетуберкулезным микобактериям [7].
Если говорить о достоинствах пробы Манту, то кроме низкой себестоимости, ими будут возможность выявления туберкулеза на ранних стадиях развития (за исключением лиц с иммуносупрессией и маленьких детей до двух лет [7]) и более высокая диагностическая ценность у непривитых БЦЖ по сравнению с привитыми (от 50% и ниже против 65,4% [6], [9]).
Мифы о пробе Манту

Рисунок 3. Антигены ESAT-6 и CFP-10
Что нужно знать о кожных пробах?
Анализы крови на туберкулез: плюсы и минусы
- в ранние сроки инфицирования;
- при иммунодефицитных состояниях;
- при неправильном заборе крови или ее транспортировке;
- из-за ошибок во время расшифровки результатов.
Добавлю, что тесты IGRA требуют наличия качественного оборудования, специальных реактивов и квалифицированного персонала, поэтому себестоимость у них довольно высока.
Кроме того, по сравнению с кожными тестами существенным недостатком этих анализов является определение in vitro только образования гамма-интерферона или активности Т-клеток. Поэтому в странах с высокой заболеваемостью (а Россия, несомненно, в их числе с показателем более 50 больных на 100 000 населения [13]) у IGRA-анализов нет никаких дополнительных преимуществ [12]. Тем более что их способность диагностировать туберкулезный процесс колеблется в районе 42–90% для разных возрастных групп, к тому же они не маркируют латентное носительство [12]. Другими словами, для жителей нашей страны анализы крови на туберкулез в общем-то напрасная трата денег, хотя в странах с низкой заболеваемостью (США, Канада, Западная Европа) они более информативны и рекомендованы к замене туберкулиновых проб для привитых БЦЖ [14].
В мире живет более полумиллиарда латентных носителей M. tuberculosis. Причем, далеко не каждый из них в итоге заболевает, потому что размножение микобактерии сдерживает иммунная система. Например, из 100 инфицированных палочкой Коха детей, лишь у одного развивается активная форма туберкулеза, поэтому диагностические тесты направлены не только на выявление латентных носителей, но и на оценку риска развития заболевания [15].
Анализы крови vs кожные тесты: сравнение эффективности
При оценке эффективности тестов для диагностики туберкулеза чаще всего учитывают два параметра: чувствительность (sensitivity) и специфичность (specificity). Под чувствительностью понимают способность метода выявлять лиц с заболеванием или носителей с высоким риском развития туберкулеза. Под специфичностью — способность теста правильно идентифицировать людей, у которых нет туберкулеза (то есть этот параметр характеризует риск появления ошибочных ложноположительных результатов) [12].
Какой тест все-таки выбрать?
Как говорится, при всем богатстве выбора альтернатив немного. К сожалению, при выборе теста многие руководствуются не его диагностическими характеристиками, а безвредностью для здоровья, потому что фенол в составе кожных проб пугает многих. И существует даже движение против пробы Манту, группа поддержки которого периодически предлагает заменить ее анализами крови IGRA. Но, как было отмечено выше, у подобных страхов нет никаких оснований. В придачу, являясь продуктом жизнедеятельности организма, фенол не накапливается, а выводится вместе с мочой. Поэтому главными критериями все-таки являются чувствительность и специфичность тестов.
Морфология туберкулёза человека. Палочка Коха. Тинкториальные свойства туберкулеза. Культуральные свойства возбудителя туберкулеза.
М. tuberculosis (палочка Коха) — тонкая, прямая или слегка изогнутая палочка, размером 1-10*0,2-0,6 мкм, со слегка закруглёнными концами (рис. 22-1). В молодых культурах палочки более длинные, а в старых склонны к ветвлению.
Бактерии туберкулёза способны образовывать L-формы, сохраняющие способность к инфицированию, а также фильтрующиеся формы, патогенетическая роль которых остаётся плохо изученной. Капсул не имеют, но образуют микрокапсулу.
Методом Циля-Нильсена окрашиваются в ярко-красный цвет. Содержат кислотонеустойчивые гранулы (зёрна Муха), располагающиеся в цитоплазме.
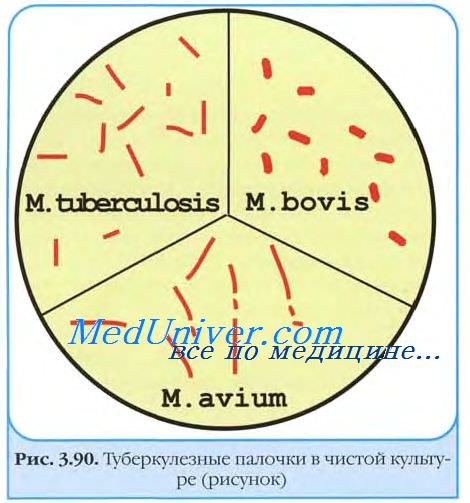
Культуральные свойства возбудителя туберкулеза
Туберкулёзные палочки могут расти как в аэробных, так и факультативно анаэробных условиях. Повышенное содержание СО2 (5-10%) способствует более быстрому росту. Оптимальная температура 37-38 °С; рН 7,0-7,2. Нуждаются в присутствии белков, глицерина, факторов роста (биотин, никотиновая кислота, рибофлавин и др.), ионов (Mg2+ K+, Na+ Fe2+) и др.
Для выращивания бактерий туберкулеза наиболее часто применяются глицериновые, картофельные с жёлчью, яичные, полусинтетические и синтетические среды. Наиболее оптимальна среда Лёвенштайна-Йёнсена.
На средах туберкулёзные палочки обычно образуют R-колонии; под влиянием антибактериальных препаратов бактерии могут диссоциировать с образованием мягких и влажных S-колоний.
В жидких средах палочки туберкулеза образуют сухую морщинистую пленку (на 7-10-е сутки), поднимающуюся на края пробирки; среда остаётся прозрачной. В жидких средах выявляют корд-фактор — важный дифференциальный признак вирулентности. Наличие корд-фактора обусловливает сближение бактериальных клеток в микроколониях и их рост в виде серпантинообразных кос.
На плотных средах рост палочек туберкулеза отмечают на 14-40-е сутки в виде сухого морщинистого налёта желто-, вато-кремового цвета. Зрелые колонии напоминают цветную капусту, крошковатые, плохо смачиваются водой и имеют приятный запах. Культуры плохо снимаются со среды, а при прокаливании трещат. Отличительная особенность М. tuberculosis— способность к синтезу значительного количества никотиновой кислоты (ниацина); ниациновый тест — важный метод дифференцировки микобактерий.
Свойства туберкулезной палочки и передача возбудителя. Инфекционность туберкулеза.
В какой мере эти особенности возбудителя отражаются на частоте заражения и заболевания туберкулезом, а также на характере его течения? Отдельные авторы утверждают, что снижение инфицированности и заболеваемости туберкулезом и особенности его течения в последнее время отчасти обусловлены понижением вирулентности и малой патогенностью изониазидоустоичивых и каталазоотрицательных микобактерии, которыми заражаются теперь некоторые взрослые и дети при контакте с больными, лечившимися без достаточного эффекта препаратами ГИНК. Эта гипотеза основывается, с одной стороны, на результатах экспериментальных исследований, установивших слабую патогенность таких штаммов микробов для некоторых видов лабораторных животных, а с другой — па отдельных клинических наблюдениях о якобы меньшей зараженности и заболеваемости лиц, соприкасающихся с больными, в мокроте которых находят тубазидоустойчивые микобактерии туберкулеза (А. Ш. Шерман, 1962).
Однако такая точка зрения не имеет достаточных обоснований. Установлено, например, что микобактерии туберкулеза, даже высокоустойчивые к препаратам ГИНК, характеризующиеся отрицательной каталазной и пероксидазной активностью, а также слабопатогенные и маловирулентные для морских свинок, вызывают генерализованный туберкулез у белых мышей, золотистых хомяков и патогенны для человека.
Gerbeaux и соавт. (1962) обнаружили в спинномозговой жидкости у нескольких детей, больных туберкулезным менингитом, микобактерии, устойчивые к изониазиду и вместе с тем обладавшие различной степенью вирулентности при испытании на морских свинках. У части привитых животных они вызывали генерализованный туберкулез, у других — слабо выраженные специфические изменения; у третьей группы морских свинок не только отсутствовали морфологические признаки процесса, но оставались отрицательными туберкулиновые пробы, а из внутренних органов не удавалось высеять возбудителя.
Аналогичные данные получили Ж. К. Кантарбаева и соавт. (1963) при изучении первично устойчивых к фтивазиду микобактерий, выделенных из мокроты больных фиброзно-кавернозным, инфильтративным и дис-семинированным туберкулезом легких. У 80% привитых этими микробами морских свинок развились ограниченные специфические изменения во внутренних органах, а у остальных образовался генерализованный туберкулез.
Вместе с тем наблюдения показали, что формы туберкулеза легких у больных, выделяющих первично устойчивые микобактерий, не отличаются от таковых у лиц, в мокроте которых были обнаружены лекарственночувствительные микробы (Canetti е. а., 1967).
На материале нашей клиники и диспансера № 13 мы в свою очередь смогли убедиться, что характер и частота различных форм туберкулеза легких среди 54 детей и взрослых, в мокроте которых были обнаружены микобактерий, первично устойчивые к основным туберкулостатическим препаратам, были такими же, как и среди больных, выделявших с мокротой чувствительные штаммы микобактерий.
В то же время хорошо известно, что течение различных форм туберкулеза при наличии лекарственнорезистентных микобактерий нередко оказывается неблагоприятным из-за недостаточной эффективности в этих случаях химиотерапии. Следует, наконец, указать, что некоторые данные о меньшей инфицированности и заболеваемости лиц, состоящих в контакте с больными, выделяющими микобактерий, устойчивые к изониазиду, не подтверждаются большинством авторов и, в частности, наблюдениями Н. Ю. Маргулис, Т. И. Виноградовой и др. (1971), Н. М. Рудого (1969, 1975).
Клиническое значение лекарственной зависимости микробов недостаточно выяснено вследствие ограниченности наблюдений. Кроме того, лекарственная зависимость — нестойкий признак, так как быстро теряется при пересевах таких штаммов. Тем не менее, по некоторым данным, применение препаратов, к которым развилась лекарственная зависимость, неблагоприятно отражается на течении болезни и состоянии организма больного. Таким образом, следует признать, что как лекарственная устойчивость, так и лекарственная зависимость микобактерий отрицательно отражаются на течении туберкулеза.
Известную роль в клинических проявлениях туберкулеза играет заражение микобактериями различного типа. Как известно, патогенными для человека являются главным образом микобактерий млекопитающих, т. е. человеческий, бычий и в меньшей степени птичий типы. Наибольшее этиологическое значение из них имеет первый тип возбудителя. По сводным данным Gervois (1966), на протяжении 1954—1966 гг. в различных странах он был обнаружен в среднем у 96,6% взрослых и детей, больных туберкулезом органов дыхания, и у 85% — при других локализациях процесса. По обобщенным материалам отечественных авторов за 1934— 1968 гг., микобактерий бычьего типа были выделены у 6,4% больных туберкулезом легких и у 14,8% — при кожном и костно-суставном процессах. При всех формах заболевания этот вид возбудителя у детей и подростков встречается чаще, чем у взрослых.
Таким образом, при заражении микобактериями бычьего типа чаще, чем при инфицировании человеческим типом возбудителя, развиваются различные внелегочные формы процесса: волчанка, периферический лимфаденит, костно-суставной и мочеполовой туберкулез, менингит. Тем самым структура клинических форм туберкулеза в какой-то мере зависит от эпидемической ситуации, т. е. от степени распространенности туберкулеза среди рогатого скота и других видов домашних животных и от условий контакта с ними человека.
Вот почему раньше, когда инфицированность домашних животных была высокой, у больных туберкулезом, особенно у детей, в мокроте и другом материале сравнительно часто обнаруживали микобактерии бычьего типа. С тех пор как во многих странах, особенно за последние 15— 20 лет, инфицированный и больной туберкулезом рогатый скот был забит, этот тип возбудителя стали реже находить у больных людей, в особенности у детей и подростков. Об этом свидетельствуют, например, данные, накопленные в ФРГ, где на протяжении 1952—1962 гг. был забит рогатый скот, больной туберкулезом, и осталось лишь 0,3% инфицированных животных. В результате этого мероприятия, указывает Meissner (1974), резко уменьшилась частота обнаружения микобактерии бычьего типа у больных туберкулезом легких, внутригрудных и наружных лимфатических узлов, а у детей, кроме того, — кожи, костей и суставов.
Однако и теперь, даже в тех странах и районах, где проводится энергичная борьба против туберкулеза у рогатого скота, встречаются больные, которые выделяют микобактерии бычьего типа. Такое явление наблюдается чаще среди сельских жителей. Так, в Саксонии этот тип возбудителя был обнаружен в среднем у 5,2% всех бацилловыделителей. Но среди проживавших в сельских местностях его находили у 17,2%, между тем как среди больных в небольших городах — у 1,4%, а в крупных городских центрах — всего у 0,2%. Надо полагать, что выделение больными в этих случаях микобактерии бычьего типа было обусловлено обострением туберкулезного процесса, который возник в свое время в результате заражения от больных животных.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Лабораторная диагностика туберкулеза. Выявление бактерий туберкулеза.
В распознавании и дифференциальной диагностике туберкулеза, а также в определении эффективности проводимого лечения важную роль играют лабораторные методы исследования. Среди них большое значение имеют прежде всего способы обнаружения микобактерии туберкулеза в различных выделениях, воспалительных экссудатах, жидкостях и тканях организма больного.
При туберкулезе легких микобактерии находят прежде всего в мокроте. Частота, массивность и постоянство бацилловыделения зависят от формы процесса. Оно часто имеет место при инфильтративном и особенно деструктивном туберкулезе легких. Реже или периодически выделяют микобактерии больные очаговыми, диссеминированными и цирротическими формами туберкулеза без явного распада легочной ткани. Существенное значение имеет при этом состояние бронхов. При их специфическом поражении, но сохраненной дренажной функции микобактерии выявляются с мокротой сравнительно чаще и с большим постоянством, чем при нормальном состоянии бронхов или при их стенозе, вызывающем блокаду каверны.
Микобактерии туберкулеза находят в большом количестве в обильно выделяющейся мокроте, а в скудном отделяемом, наоборот, они встречаются реже и в виде единичных экземпляров. У больных, не выделяющих мокроту, лучшие результаты дает применение раздражающих аэрозольных ингаля пий 10—15% раствора поваренной соли в 1% растворе питьевой соды Н. М. Рудой и соавт. (1971) применяют с этой целью смесь, состоящую из 5 мл 10% раствора хлорида натрия, 1 мл химопсина, растворенного в физиологическом растворе, и 20 капель солутана.
Второе место по эффективности выявления бацилловыделения у больных, не выделяющих мокроту, занимает исследование промывных вод трахеи и бронхов, которое предложил Я. С. Зобин (1939). В настоящее время для анестезии гортани у взрослых применяют 0,25% раствор дикаина, разведенный в 10% растворе новокаина. Этот раствор наливают во время фонации на голосовые связки в количестве 0,5—1 мл. У больных с повышенным глоточным рефлексом этим раствором смазывают заднюю стенку глотки. Затем в трахею шприцем с напаянной канюлей вводят 10—20 мл физиологического раствора комнатной температуры.
При этом в результате раздражения слизистой оболочки бронхов возникает кашель, при котором из глубоких дыхательных путей вместе с введенной жидкостью выделяются слизь и мокрота. Это отделяемое исследуют на присутствие микобактерии туберкулеза или другой микробной флоры.
Исследование промывных вод бронхов редко сопровождается серьезными осложнениями. Только при сильном, длительном и приступообразном кашле иногда появляется кровохарканье, может аспирироваться инфекционный материал в здоровые участки легочной ткани, нарастает сердечная недостаточность. Такие явления отмечаются главным образом у больных с сопутствующей бронхиальной астмой, пороком сердца, гипертонией. В подобных случаях, очевидно, не следует прибегать к данному методу исследования. При отсутствии таких противопоказаний, особенно у больных с ограниченными формами процесса, у которых чаще всего и возникает необходимость в исследовании промывных вод бронхов, обычно не наблюдается каких-либо осложнений, и поэтому его можно производить не только в клинических, но и в амбулаторных условиях.
Менее эффективно производимое натощак исследование промывных вод желудка, в которых может содержаться бациллярная мокрота или бронхиальная слизь, чаще заглатываемая детьми, а иногда и взрослыми (Аrmand-Dellille, 1927). Кроме того, микобактерии могут проникать в желудок через его слизистую оболочку при гематогенном распространении инфекции в организме, а также при забрасывании бациоллосодержащей желчи (М. Д. Розанова, 1950). Пользоваться этим методом рекомендуется в тех случаях, когда не удается получить мокроту при раздражающих ингаляциях, при противопоказаниях к применению промывания бронхов или при невозможности их проведения по другим причинам.
Наименее информативно определение бацилловыделения с помощью исследований мазков слизи из гортани, а также промывания только верхних отделов дыхательных путей.
У части больных можно выделить микобактерии из крови. По наблюдениям 49 авторов, обобщенным в 1954 г. Dalencour, бациллемия отмечалась в среднем у 5,3% больных различными формами туберкулеза. П. И. Беневоленский (1945) установил ее у 3,7% больных туберкулезом легких (исключая страдающих гематогенным процессом). Чаще обнаруживают микобактерии в крови при туберкулезе кожи, обширных гематогенных диссеминациях в легких, при менингите. Однако, по сводным данным Kallos (1937). основанным на изучении гемокультур, выделенных от 14 502 больных, туберкулезная бациллемия имела место всего лишь у 1,13% из них.
Частота выявления микобактерии зависит не только от формы заболевания, метода получения материала, но и от способа его исследования (бактериоскопия, посев, заражение животных). Микобактерии туберкулеза обнаруживают при прямой бактериоскопии мазков мокроты, окрашенных по Цилю—Нельсену, при микроскопии с использованием метода обогащения — флотации и люминесцентного способа исследования. Методы обогащения повышают частоту обнаружения микобактерии туберкулеза в мокроте, промывных водах желудка и бронхов, в экссудате, спинномозговой жидкости, в каловых массах на 10—20% по сравнению с результатами прямой бактериоскопии.
Среди бактериоскопических методов выявления бацилловыделения наиболее чувствительным является люминесцентная микроскопия, повышающая возможность обнаружения в мокроте микобактерии на 15—20% по сравнению с обычной бактериоскопией, а при исследовании мазков из флотационных колец — на 8—10%. При этом облегчается изучение некоторых биологических свойств возбудителя — старения культур, аутолиза клеток и др.
Некоторые авторы утверждают, что при флюоресцентной (люминесцентной) микроскопии микобактерии туберкулеза можно выявить даже чаще, чем при посевах мокроты и других материалов на различные питательные среды. Kolbel (1955) обнаружил их при простой бактериоскопии у 39,7% больных, при бактериологическом методе — у 52,1%, а при люминесцентной микроскопии — у 73,6%. На преимущество последнего метода указывают Т. Н. Ященко и И. С. Мечева (1973), Н. С. Страхов и соавт. (1973).
Для суждения об эффективности проводимой антибактериальной терапии придают прогностическое значение уменьшению (или сохранению) в динамике массивности бацилловыделения. Поэтому целесообразно не только констатировать бацилловыделение, но и оценивать его количественный показатель. При этом при бактериоскопии бацилловыделение оценивается как обильное, если находят микобактерии в каждом поле зрения, умеренное — при наличии «единичных микробов в 40—50 полях зрения и скудное — при нахождении их единичных экземпляров в препарате.
Читайте также:

