Фагоцитоз с культурой стафилококка сущность метода
Обновлено: 10.05.2024
Фагоцитоз. Механизмы и значение фагоцитоза
Наиболее важной функцией нейтрофилов и макрофагов является фагоцитоз — поглощение клеткой вредоносного агента. Фагоциты избирательны в отношении материала, который они фагоцитируют; иначе они могли бы фагоцитировать нормальные клетки и структуры организма. Осуществление фагоцитоза зависит главным образом от трех специфических условий.
Во-первых, большинство естественных структур имеют гладкую поверхность, которая препятствует фагоцитозу. Но если поверхность неровная, возможность фагоцитирования возрастает.
Во-вторых, большинство естественных поверхностей имеют защитные белковые оболочки, отталкивающие фагоциты. С другой стороны, большинство погибших тканей и инородных частиц лишены защитных оболочек, что делает их объектом фагоцитоза.
В-третьих, иммунная система организма образует антитела против инфекционных агентов, например бактерий. Антитела прикрепляются к мембранам бактерий, и бактерии становятся особенно чувствительными к фагоцитозу. Для осуществления этой функции молекула антитела также соединяется с продуктом С3 каскада комплемента — дополнительной частью иммунной системы, обсуждаемой в отдельной статье на сайте (просим вас пользоваться формой поиска выше). Молекулы С3, в свою очередь, прикрепляются к рецепторам на мембране фагоцитов, инициируя фагоцитоз. Этот процесс выбора и фагоцитоза называют опсонизацией.
Переработка содержимого пиноцитозных и фагоцитарных вакуолей с помощью лизосомальных ферментов. Стадии фагоцитоза
а) Фагоцитоз, осуществляемый нейтрофилами. Нейтрофилы, входящие в ткани, являются уже зрелыми клетками, способными к немедленному фагоцитозу. При встрече с частицей, которая должна быть фагоцитирована, нейтрофил сначала прикрепляется к ней, а затем выпускает псевдоподии во всех направлениях вокруг частицы. На противоположной стороне частицы псевдоподии встречаются и сливаются друг с другом. При этом образуется замкнутая камера, содержащая фагоцитируемую частицу. Затем камера погружается в цитоплазматическую полость и отрывается от наружной стороны клеточной мембраны, формируя свободно плавающий фагоцитарный пузырек (также называемый фагосомои) внутри цитоплазмы. Один нейтрофил обычно может фагоцитировать от 3 до 20 бактерий, прежде чем он сам инактивируется или погибает.
б) Фагоцитоз, осуществляемый макрофагами. Макрофаги представляют собой конечную стадию развития моноцитов, входящих в ткани из крови. При активации иммунной системой они становятся гораздо более мощными фагоцитами, чем нейтрофилы, и часто могут фагоцитировать до 100 бактерий. Макрофаги также способны поглощать гораздо более крупные частицы, даже целые эритроциты и иногда малярийных паразитов, тогда как нейтрофилы не могут фагоцитировать частички, размер которых значительно превышает размер бактерии. Кроме того, макрофаги могут выталкивать конечные продукты и часто живут и функционируют в течение многих месяцев.
в) Сразу после фагоцитирования большинство частиц перевариваются внутриклеточными ферментами. После фагоцитирования инородной частицы лизосомы и другие цитоплазматические гранулы нейтрофила или макрофага немедленно вступают в контакт с фагоцитарным пузырьком, их мембраны сливаются, в результате в пузырек вбрасываются многие переваривающие ферменты и бактерицидные вещества. Таким образом, фагоцитарный пузырек теперь становится переваривающим пузырьком, и сразу начинается расщепление фагоцитированной частицы.
И нейтрофилы, и макрофаги содержат громадное количество лизосом, наполненных протеолитическими ферментами, особенно приспособленными для переваривания бактерий и других чужеродных белковых веществ. Лизосомы макрофагов (но не нейтрофилов) содержат также большое количество липаз, которые разрушают толстые липидные мембраны, покрывающие некоторые бактерии, например туберкулезную палочку.
Видео стадии фагоцитоза и питание клетки
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Фагоцитоз. Механизмы и значение фагоцитоза
Наиболее важной функцией нейтрофилов и макрофагов является фагоцитоз — поглощение клеткой вредоносного агента. Фагоциты избирательны в отношении материала, который они фагоцитируют; иначе они могли бы фагоцитировать нормальные клетки и структуры организма. Осуществление фагоцитоза зависит главным образом от трех специфических условий.
Во-первых, большинство естественных структур имеют гладкую поверхность, которая препятствует фагоцитозу. Но если поверхность неровная, возможность фагоцитирования возрастает.
Во-вторых, большинство естественных поверхностей имеют защитные белковые оболочки, отталкивающие фагоциты. С другой стороны, большинство погибших тканей и инородных частиц лишены защитных оболочек, что делает их объектом фагоцитоза.
В-третьих, иммунная система организма образует антитела против инфекционных агентов, например бактерий. Антитела прикрепляются к мембранам бактерий, и бактерии становятся особенно чувствительными к фагоцитозу. Для осуществления этой функции молекула антитела также соединяется с продуктом С3 каскада комплемента — дополнительной частью иммунной системы, обсуждаемой в отдельной статье на сайте (просим вас пользоваться формой поиска выше). Молекулы С3, в свою очередь, прикрепляются к рецепторам на мембране фагоцитов, инициируя фагоцитоз. Этот процесс выбора и фагоцитоза называют опсонизацией.
Переработка содержимого пиноцитозных и фагоцитарных вакуолей с помощью лизосомальных ферментов. Стадии фагоцитоза
а) Фагоцитоз, осуществляемый нейтрофилами. Нейтрофилы, входящие в ткани, являются уже зрелыми клетками, способными к немедленному фагоцитозу. При встрече с частицей, которая должна быть фагоцитирована, нейтрофил сначала прикрепляется к ней, а затем выпускает псевдоподии во всех направлениях вокруг частицы. На противоположной стороне частицы псевдоподии встречаются и сливаются друг с другом. При этом образуется замкнутая камера, содержащая фагоцитируемую частицу. Затем камера погружается в цитоплазматическую полость и отрывается от наружной стороны клеточной мембраны, формируя свободно плавающий фагоцитарный пузырек (также называемый фагосомои) внутри цитоплазмы. Один нейтрофил обычно может фагоцитировать от 3 до 20 бактерий, прежде чем он сам инактивируется или погибает.
б) Фагоцитоз, осуществляемый макрофагами. Макрофаги представляют собой конечную стадию развития моноцитов, входящих в ткани из крови. При активации иммунной системой они становятся гораздо более мощными фагоцитами, чем нейтрофилы, и часто могут фагоцитировать до 100 бактерий. Макрофаги также способны поглощать гораздо более крупные частицы, даже целые эритроциты и иногда малярийных паразитов, тогда как нейтрофилы не могут фагоцитировать частички, размер которых значительно превышает размер бактерии. Кроме того, макрофаги могут выталкивать конечные продукты и часто живут и функционируют в течение многих месяцев.
в) Сразу после фагоцитирования большинство частиц перевариваются внутриклеточными ферментами. После фагоцитирования инородной частицы лизосомы и другие цитоплазматические гранулы нейтрофила или макрофага немедленно вступают в контакт с фагоцитарным пузырьком, их мембраны сливаются, в результате в пузырек вбрасываются многие переваривающие ферменты и бактерицидные вещества. Таким образом, фагоцитарный пузырек теперь становится переваривающим пузырьком, и сразу начинается расщепление фагоцитированной частицы.
И нейтрофилы, и макрофаги содержат громадное количество лизосом, наполненных протеолитическими ферментами, особенно приспособленными для переваривания бактерий и других чужеродных белковых веществ. Лизосомы макрофагов (но не нейтрофилов) содержат также большое количество липаз, которые разрушают толстые липидные мембраны, покрывающие некоторые бактерии, например туберкулезную палочку.
Видео стадии фагоцитоза и питание клетки
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Этиологическим фактором некоторых воспалительных заболеваний являются различные микробные ассоциации. Ассоциированные инфекции обладают рядом особенностей взаимодействий между микроорганизмами в сообществе. Микроорганизмы в ассоциации могут существенно влиять на формы и течение инфекционного процесса. Например, при изучении биологических свойств энтеробактерий в микробных ассоциациях они проявляли более высокую токсическую активность, чем их монокультуры. Клетки иммунной системы определенно действуют на отдельные микроорганизмы. В данной статье рассмотрен иммунный ответ на Staphylococcus aureus и Escherichia coli . Так, на первый – иммунный ответ проявляется в виде воспалительных процессов. Основную роль в защите от Staphylococcus aureus играют нейтрофилы. Escherichia coli – это один из микроорганизмов нормальной микрофлоры кишечника человека, но при атипичной локализации он может стать возбудителем заболевания. Также есть и патогенные штаммы Escherichia coli. Высокий уровень антител классов Е или G к условно-патогенной микрофлоре (в том числе и Escherichia coli) будет приводить к развитию и поддержанию инфекционно-аллергического воспаления. Но как клетки иммунной системы взаимодействуют с микробными ассоциациями? Этому вопросу посвящена данная статья.

2. Бабушкин С.А., Ивенских В.И., Мамаев А.В., Ожгибесов Г.П., Никулина Е.А., Шубина Н.В., Годовалов А.П. Эпидемиологические и микробиологические аспекты заболеваемости острыми фарингитами и тонзиллитами сотрудников МВД России по Пермскому краю // Вестник современной клинической медицины. – 2016. – Т. 9, № 6. – С. 27-33.
3. Большая советская энциклопедия: в 30 т. / Гл. ред. А. М. Прохоров. - Т. 16: Мезия—Моршанск - М.: Сов. энциклопедия, 1974.
4. Булатова. Е. М., Богданова Н. М., Лобанова Е. А., Габрусская Т. В. Кишечная микробиота: современные представления. / Педиатрия. –-Т. 87, №3. - 2009. – С. 105-109.
5. Годовалов А.П., Быкова Л.П., Никулина Е.А., Ожгибесов Г.П. Изучение микробного пейзажа толстого кишечника при кандидозном носительстве // Медицинский вестник МВД. – 2016. – Т. 80, № 1 (80). – С. 41-43.
6. Годовалов А.П., Быкова Л.П., Никулина Е.А., Ожгибесов Г.П., Ларин А.Э., Ларина П.М. Выявление Staphylococcus aureus при изменении микробиоценоза толстой кишки // Экспериментальная и клиническая гастроэнтерология. – 2016. – № 12 (136). – С. 36-38.
7. Годовалов А.П., Быкова Л.П., Ожгибесов Г.П. Характеристика Сandida spp. в грибково-бактериальных ассоциаций при воспалительных заболеваниях верхних дыхательных путей // Проблемы медицинской микологии. – 2009. – Т. 11, № 2. – С. 65.
9. Ипатова М.Г., Шумилов П.В., Мухина Ю.Г. и др. Дисрегуляция иммунного ответа на индигенную микрофлору у детей и подростков с воспалительными заболеваниями кишечника // Педиатрия. - 2010. - Т. 89, №2. - С. 45-49.
10. Красникова Л. В., Гунькова П. И. Микробиологическая безопасность пищевого сырья и готовой продукции: Учеб.-метод.пособие. – СПб.: НИУ ИТМО; ИХиБТ, 2014. – С. 3.
11. Кутенкова Н.Е. Роль атопической сенсибилизации к условно-патогенной микрофлоре в патогенезе рецидивирующих респираторных инфекций у детей раннего и дошкольного возраста: Автореф. дисс.…канд. мед. наук. - Кемерово, 2012. - 24 с.
12. Медицинская микробиология, вирусология и иммунология: учебник для студ. Высш. Мед. Учеб. Заведений: перевод с укр. Издания / [Андрианова Т. В., Бобырь В. В., Виноград Н. А. и др.]; под ред. В. П. Широбокова. – Винница: Нова Книга, 2015. – С. 691.
14. Слободчикова С. В. Влияние антител и цитокинов на эффективность фагоцитоза Staphylococcus aureus: дисс. … канд. мед. наук. Пермь, 2014. С. 18 – 35.
15. Условно-патогенные грамотрицательные и грамположительные бактерии: уч. пос. для студентов /Сост.: З. Г. Габидуллин, Т. А.Савченко, Ю. З Габидуллин, М. М. Туйгунов, А. К. Булгаков, Г. К. Давлетшина, Р. С. Суфияров, И. Н. Усманова, Р. Ф. Хуснаризано- ва. – Уфа: Изд-во ГБОУ ВПО БГМУ Минздрава России, 2014.- С. 41-43.
16. Шестакова А.В., Кадыралиев Б.К., Годовалов А.П., Быкова Л.П. Опсонизация Candida albicans иммуноглобулином для внутривенного введения // Медицинская иммунология. – 2015. – Т. 17, № S. – С. 434.
Микробные ассоциации – это естественные или искусственно созданные человеком сообщества микроорганизмов, которые основаны на симбиотических или метабиотических отношениях. Отдельные виды микроорганизмов, составляющих микробные ассоциации, обычно устойчивы к продуктам жизнедеятельности др. видов, участвующих в этой ассоциации, и используют эти продукты как источник энергии, углерода и азота или в качестве факторов роста [3].
Среди заболеваний, вызываемых микробными ассоциациями, можно выделить такие, как некоторые заболевания мочеполовой системы, перитониты [1], абсцессы и гангрены легких, острые пневмонии [12], тонзиллиты [2], ангина Симановского-Плаута-Венсана, заболевания верхних дыхательных путей [16] и др.
Ассоциированные инфекции обладают рядом особенностей межмикробных взаимодействий, которые могут существенно влиять на формы и течение инфекционного процесса [8]. Механизмы отягощенного течения ассоциированных инфекций следующие:
- микробы-ассоцианты усиливают действие детерминант вирулентности основного возбудителя;
- условно-патогенные энтеробактерии в микробных ассоциациях обладают резко выраженной протеолитической активностью, особенно протей и сине-гнойная палочка;
- микробы-ассоцианты нередко обладают множественной лекарственной устойчивостью, которая связана с выработкой адаптивных ферментов, разрушающих данный антибиотик.
Вышеизложенные положения можно доказать исследованием, проведенным на кафедре микробиологии Башкирского медицинского университета. Проводилось изучение роли условно-патогенных энтеробактерий в различных микробных ассоциациях. При изучении биологических свойств энтеробактерий в микробных ассоциациях они проявляли более высокую токсическую активность, чем их монокультуры. Например, вирулентность монокультуры Enterobacter - 26,3%, а вирулентность микробной ассоциации Enterobacter и Citrobacter - 57,1% [5, 15].
Иммунный ответ на представителей разных видов будет, безусловно, неодинаков [7]. Для того, чтобы проанализировать взаимодействие клеток иммунной системы с микробными ассоциациями, рассмотрим ассоциацию Staphylococcus aureus и Escherichia coli. Для начала обсудим защитные реакции макроорганизма на каждый вид отдельно.
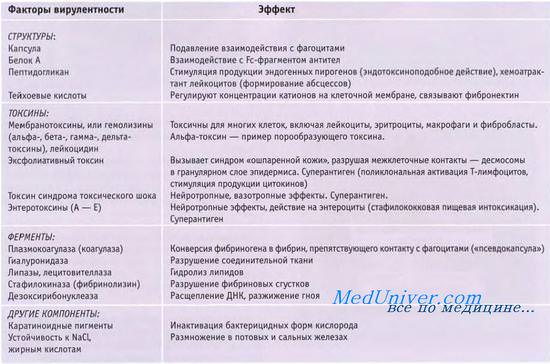
Staphylococcus aureus. Патогенность золотистого стафилококка связана с тремя группами факторов: колонизацией и адгезией, при которых важную роль играет тейхоевая кислота клеточной стенки; персистенцией, происходящей за счет факторов, препятствующих фагоцитозу; а также выработкой токсинов различного механизма действия (гемолизинов, лейкоцитов, энтеротоксинов, эксфолиатинов) и ферментов вирулентности (плазмокоагулазы, гиалуронидазы, фибринолизина, ДНК-азы, РНК-азы, лецитовителлазы, β-лактамазы и др.) [15].
TLR2 считается наиболее значимым для распознавания структур стафилококка – тейхоевые кислоты, пептидогликан, фенолрастворимые модулины и т.д. В распознавании также возможно участие Nod2 и TLR9. Рецепция инициирует в клетках макроорганизма синтез и секрецию провоспалительных цитокинов: TNF-α, IL-1β, IL-6, IL-12, хемокинов CXCL1, CXCL2, CXCL5, CXCL8 (IL-8) и т.д. Помимо регуляции численности лейкоцитов, цитокины оказывают влияние на функциональное состояние фагоцитов: осуществляют прайминг нейтрофилов. Развивается воспалительная реакция.
Следует отметить, что основную роль в защите макроорганизма от стафилококковой инфекции играют нейтрофильные лейкоциты, первыми пребывающие в очаг воспаления. Главной их функцией является поглощение и уничтожение бактерий. Ключевая роль нейтрофилов в борьбе против S. aureus обусловлена фагоцитарной функцией этих клеток, которая заключается в поглощении и последующем уничтожении бактерий. Конечный результат достигается благодаря мощному по сравнению с другими фагоцитами бактерицидному потенциалу нейтрофилов. При поглощении патогена клетки вырабатывают активные формы кислорода непосредственно в полость фагосомы с помощью мембранного фермента NADPH-оксидазы. Многочисленные гранулы нейтрофилов содержат антибактериальные белки (дефензины, катепсины, лизоцим и т.д.). При слиянии мембран фагосомы и гранул нейтрофилов эти соединения оказывают своё бактерицидное действие на патоген.
Что касается гуморального иммунитета, то основная функция антител в защите макроорганизма от S.aureus – это опсонизация. Среди всех классов иммуноглобулинов основную долю сывороточных антистафилококковых антител составляют антитела класса G. Хотя IgA, взаимодействующие с поверхностными антигенами бактерии, также представлены в большом количестве.
В гнойных ранах, возбудителем инфекции в которых является S. aureus, концентрация IgG в 5 раз больше, чем в экссудате стерильных ран. Тогда как концентрации других иммуноглобулинов при наличии или отсутствии инфицирования раны остаются неизменными.
Не менее важной функцией антител представляется нейтрализация микробных токсинов. Токсины S. aureus индуцируют выработку антитоксических антител, что позволяет снизить остроту клинических проявлений стафилококковых инфекций [14].
Escherichia coli в норме является представителем микрофлоры желудочно-кишечного тракта [10]. Иммуномодулирующая функция осуществляется как по отношению к неспецифическим факторам защиты, так и собственно адаптивному иммунному ответу. За счет микробиоты происходит запуск и последующая активация синтеза неспецифических факторов защиты как гуморальных (лизоцим, пропердин, комплемент), так и клеточных (фагоцитоз). Воздействие на иммунитет включает в себя стимуляцию созревания лимфоидного аппарата кишечника, активацию синтеза sIgA и стимуляцию продукции цитокинов и интерферонов колоноцитами [4]. Таким образом, современная концепция симбиоза микро- и макроорганизмов связана с индукцией последним толерантности к антигенам индигенной и условно-патогенной микрофлоры, а также с функцией индуцированных Т-регуляторных лимфоцитов (CD4+, CD25+, FOXP-3+), способных подавлять иммунный ответ на антигены этих бактерий [17].
Совсем иначе идут процессы взаимодействия клеток иммунной системы с E. coli в том случае, когда последняя оказывается в атипичном месте (или при попадании патогенных штаммов E. coli).
В подобных случаях происходит активация факторов неспецифического иммунитета и выработки антител. Высокий уровень антител классов Е или G к условно-патогенной микрофлоре будет приводить к развитию и поддержанию инфекционно-аллергического воспаления либо по атопическому (I) типу, либо по антителзависимой клеточной цитотоксичности (V типу) [9]. Значит, нарушенная иммунная толерантность к данным микроорганизмам будет приводить к поддержанию воспалительного процесса, что клинически будет проявляться рецидивирующими заболеваниями [11].
Немногочисленные исследования в этой области открывают большие перспективы перед нами, т.к. изучение действий иммунной системы против микробных ассоциаций дает возможность разработки способов помощи в иммунном ответе, ведь у микробных ассоциаций повышается резистентность ко многим антибиотикам, и антибиотикотерапия становится безрезультатной.
Патогенез поражений золотистым стафилококком. Факторы патогенности золотистого стафилококка. Адгезины. Компоненты клеточной стенки. Ферменты золотистого стафилококка. Липазы. Коагулаза.
Капсула защищает бактерии от комплемент-опосредованного поглощения полиморфно-ядерными фагоцитами, способствует адгезии микроорганизмов и их распространению по тканям. При выращивании in vitro капсула обычно не образуется.
Компоненты клеточной стенки золотистого стафилококка стимулируют развитие воспалительных реакций; усиливают синтез ИЛ-1 макрофагами, активируют систему комплемента и служат мощными хемоат-трактантами для нейтрофилов.
• Тейхоевые кислоты золотистого стафилококка активируют систему комплемента по альтернативному пути, свёртывающую и калликреин-кининовую системы, а также облегчают адгезию бактерий к эпителиальным поверхностям. Тейхоевые кислоты способны ингибировать поглотительную активность фагоцитов.
• Белок А (агглютиноген А) золотистого стафилококка неспецифически связывает Fc-фрагменты молекул IgG (что активирует систему комплемента по классическому и альтернативному путям) и усиливает активность естественных киллеров. Белок А проявляет свойства суперантигена, что совместно с активацией комплемента приводит к проявлению различных местных и системных реакций (например, анафилаксии, феномена Артюса, угнетению активности фагоцитов и т.д.).
Факторы патогенности золотистого стафилококка
Ферменты золотистого стафилококка. Липазы. Коагулаза.
Ферменты золотистого стафилококка проявляют разнонаправленное действие, часто не связанное непосредственно с патогенным эффектом.
Каталаза золотистого стафилококка разрушает Н2О2, защищая бактерии от действия токсических кислородных радикалов.
b-Лактамазы золотистого стафилококка разрушают молекулы b-лактамных антибиотиков; синтез ферментов кодируют плазмидные гены. Поскольку гены резистентности часто входят в состав транспозонов, они быстро распространяются в популяции. Особое значение имеют метициллин-резистентные штаммы, содержащие дополнительный ген, кодирующий синтез пептидогликановой транспептидазы, что обеспечивает повышенную устойчивость к b-лактамным антибиотикам.
Липазы золотистого стафилококка облегчают адгезию и проникновение в ткани. Е частности, ферменты способны разрушать сальные пробки, облегчая проникновение стафилококков в волосяные фолликулы.
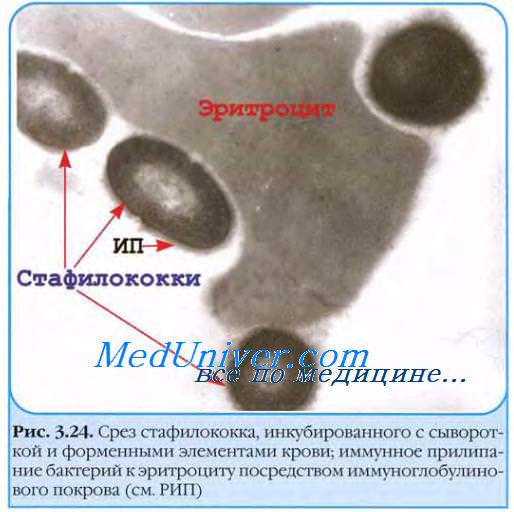
Коагулаза золотистого стафилококка вызывает свёртывание плазмы крови. Сам фермент не взаимодействует с фибриногеном, а образует тромбиноподобное вещество, предположительно взаимодействующее с протромбином. Образующаяся фибриновая плёнка играет роль своеобразной дополнительной капсулы, защищающей бактерию.
Среди прочих ферментов золотистого стафилококка в патогенезе стафилококковых инфекций принимают участие гиалуронидаза, дезоксирибонуклеаза, фибринолизин, стафилокиназа, лецитиназа и др.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

