Физиотерапевтический инфракрасный метод лечения вич
Обновлено: 25.04.2024
Oдним из первых препаратов, использованных для лечения ВИЧ-инфекции, был азидотимидин (АЗТ). У нас он выпускался под названием тимозид, на Западе известен как ретровир, зидовудин (ЗДВ). Суточная доза определяется стадией инфекции и переносимостью препара
Oдним из первых препаратов, использованных для лечения ВИЧ-инфекции, был азидотимидин (АЗТ). У нас он выпускался под названием тимозид, на Западе известен как ретровир, зидовудин (ЗДВ). Суточная доза определяется стадией инфекции и переносимостью препарата. Препарат относится к ингибиторам обратной траскриптазы.
Препаратами второго поколения являются дидеоксииназин (ДДИ), дидеоксицитидин (ДДС). В настоящее время спектр препаратов этой группы значительно расширился (ставудин-ДДТ, хивид, фосфозид и другие).
Эта группа лекарственных средств (ЛС) имеет ряд существенных недостатков. Указанные ЛС не подавляют полностью репликацию вируса, который может быть выделен у большинства больных во время терапии.
Как показали исследования, к ЗДВ достаточно быстро развивается устойчивость, в особенности на поздних стадиях болезни с усиленной репликацией ВИЧ, когда, по-видимому, возникает резистентность и к другим аналогам нуклеозидов.
Обычный фактор, существенно ограничивающий применение ЛС этой группы, — их токсичность. Для ЗДВ характерно главным образом токсическое действие на костный мозг, тогда как ДДИ и ДДС обладают нейротоксическим действием. Кроме того, ДДИ может вызывать тяжелый острый геморрагический панкреатит.
Установлена тесная связь между клинической неэффективностью ЗДВ и резистентностью к нему in vitro.
Вторая группа препаратов, открытая сравнительно недавно и уже широко используемая, — это ингибиторы протеаз: индиновир (криксиван), инвираза (саквиновир), вирасепт (нельфиновир) и другие.
В настоящее время речь не идет уже о монотерапии антиретровирусными средствами, а только о ди-, три- и даже тетратерапии. Такие методики позволяют снижать концентрацию вируса до величин, не определяемых с помощью современных тест-систем (< 200 копий/1 мл).
Предпочтительность комбинированной терапии обосновывается следующими положениями (В. В. Покровский).
- Использование многих этиотропных агентов более эффективно подавляет жизнедеятельность вируса, воздействуя на различные болевые точки или синергически воздействуя на одну из них.
- Это позволяет снизить дозы препаратов, что уменьшает частоту и выраженность побочных эффектов.
- Различные лекарства имеют различную способность проникать в ткани (головной мозг и т. д.).
- Комбинация лекарств затрудняет формирование устойчивости, или она появляется позднее.
Все описанные выше подходы к терапии ВИЧ-инфекции предполагали непосредственное воздействие на репликацию вируса. Другая возможная методика лечения ВИЧ-инфекции состоит в усилении защитных сил макроорганизма. Некоторые варианты такого подхода в большинстве случаев неспецифические, изредка специфические и могут воздействовать на защитные свойства клетки-хозяина.
Интерфероны, как природные, так и рекомбинантные, имеют ряд недостатков: антигенность, необходимость многократного введения для поддержания достаточной концентрации в организме, большое количество побочных эффектов и т. д.
Этих недостатков лишены многие индукторы эндогенного интерферона, некоторые из них способны включаться в синтез ИФН в некоторых популяциях клеток, что в ряде случаев имеет определенное преимущество перед поликлональной стимуляцией иммуноцитов интерфероном.
Специфическая активность циклоферона при ВИЧ-инфекции изучена в 1997 году в Институте гриппа РАМН
- Выявлена выраженная ингибирующая активность циклоферона на репродукцию ВИЧ в культуре клеток моноцитов.
- По показателям ингибирующей активности циклоферон значительно превосходит азидотимидин.
- Представленные экспериментальные данные обосновывают клиническое использование циклоферона для лечения больных ВИЧ-инфекцией.
Пятилетний опыт применения циклоферона у ВИЧ-инфицированных позволяет оценить результаты этой работы.
В период 1992 – 1997 годы в Санкт-петербургском городском центре по профилактике и борьбе со СПИД циклоферон получили 40 пациентов с разными стадиями ВИЧ-инфекции. Следует отметить, что 11 больных прошли два курса терапии циклофероном, в связи с чем общее число лиц, получивших один курс лечения циклофероном, составило 29 человек. В основном это были молодые люди в возрасте до 40 лет (20 человек), в том числе трое детей до 14 лет.
Все больные отмечали хорошую переносимость циклоферона, отсутствие пирогенных реакций после его введения.
Пациенты также констатировали улучшение общего состояния, сна и аппетита, повышение жизненного тонуса, работоспособности. 30% из числа получавших препарат и перенесших в осенне-зимний период грипп или ОРВИ отметили, что заболевание протекало непривычно легко и выздоровление наступило быстрее обычного.
Из клинической практики
После курса циклоферона отмечалось существенное снижение вирусной нагрузки (в 3,6 раза). Число CD4+ возросло на 62%. Монотерапия циклофероном оказала положительное стабильное влияние на изученные показатели у пациентов.
Определенный интерес представляют результаты многолетнего наблюдения больных ВИЧ-инфекцией, которые получали длительно циклоферон в своеобразном профилактическом режиме с целью стабилизации процесса и профилактики прогрессирования заболеваний.
В 1998 году на базе Российского научно-методического Центра по профилактике и борьбе со СПИД (руководитель член-корр. АМН В. В. Покровский) была изучена динамика суррогатных маркеров ВИЧ-инфекций (уровень CD4+) и вирусная нагрузка у больных ВИЧ-инфекцией при лечении циклофероном.
Оценка достоверности полученных результатов проводилась с помощью непараметрических критериев (критерий знаков, максимум-критерий, критерий Вилкоксона для сопряженных совокупностей).
В испытуемую группу вошли 10 взрослых больных ВИЧ-инфекцией в стадии первичных проявлений по Российской классификации ВИЧ-инфекции (В. И. Покровский, 1989 г.). Результаты исследования уровня CD4-лимфоцитов представлены в таблице и на рисунке, из которых видно, что после первых четырех недель исследования наметилась тенденция к повышению среднего уровня CD4-лимфоцитов, которое к 12-й неделе стало статистически достоверным. Это повышение сохранилось до конца исследования, несмотря на
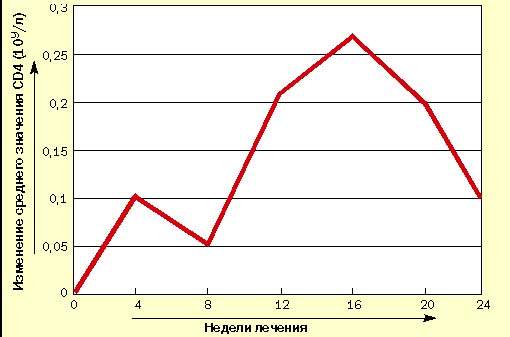 |
| Рисунок 1. Изменение уровня CD4-лимфоцитов у больных ВИЧ-инфекцией при лечении циклофероном (в сравнении с исходным уровнем) |
 |
| Рисунок 2. Средние значения изменения концентрации РНК ВИЧ (log10/мл) |
Таким образом, применение циклоферона в терапии ВИЧ-инфекций сопровождается стабилизацией клинических проявлений заболевания, улучшением состояния, а также гематологических и иммунологических показателей больных.
Циклоферон как монопрепарат оказывает иммуномодулирующее и противовирусное действие при лечении ВИЧ-инфицированных (стадии А1 3Б) в тех случаях, когда нет значительного снижения числа CD4+ клеток (<200). Хорошо зарекомендовало себя назначение циклоферона по следующей схеме.
- По 4 мл препарата в 1, 2, 4, 6, 8, 10, 13, 16, 19 и 22-й дни лечения (у детей по 2 мл). Первые две инъекции могут вводиться внутривенно, остальные внутримышечно. Повторные курсы циклоферона рекомендуется проводить через 6 месяцев под иммунологическим контролем.
- Циклоферон хорошо сочетается со всеми основными лекарственными средствами, его рекомендуется использовать в случае, когда имеются признаки активной репликации ВИЧ (высокие показатели вирусной нагрузки), у больных с обострениями различных оппортунистических заболеваний.
Исчезновение у некоторых больных иммунологических и вирусологических показаний для проведения противоретровирусной терапии может иметь важное значение для разработки новых подходов к проведению лечения больных ВИЧ-инфекцией, для снижения стоимости терапии и отсрочки развития резистентности к ней или преодолению последней.
Циклоферон может оказаться перспективным профилактическим средством при сомнительных контактах и контактах с заведомо ВИЧ-инфицированными партнерами.
Испытания лекарств от ВИЧ часто включает в себя аналитическое прерывание лечения, когда пациенты с ВИЧ прекращают прием антиретровирусной терапии (АРТ), чтобы ученые могли понаблюдать, как неконтролируемый вирус реагирует на исследуемые препараты.
Участие в такого рода клинических испытаниях может вызвать страх у человека с ВИЧ, который привык поддерживать неопределяемую вирусную нагрузку. Кроме того, предыдущее исследование, проведенное доктором Лау, показало, что многие люди с ВИЧ не были уверены в том, как работают эти испытания, и многие из них не были готовы к длительным периодам определяемой вирусной нагрузки.
Ученые работают над различными стратегиями излечения ВИЧ-инфекции. Некоторые методы нацелены на сокращение латентных резервуаров ВИЧ — инфицированных иммунных клеток, которые не производят новые вирионы в течение многих месяцев или лет. Другие виды терапии пытаются повысить способность иммунной системы контролировать вирус.
Существуют два типа исследований, основанных на прерывании лечения, которые используются для оценки потенциальной терапии: изучение времени до восстановления вирусной активности (TVR) и изучение контрольных точек. В исследованиях TVR после того, как участники прекращают АРТ, ученые измеряют время, необходимое, чтобы вирусная нагрузка сначала достигла обнаруживаемого уровня (50 копий/мл), а затем время, необходимое для достижения более высокого порога (часто 10 000 копий/мл), после чего участники возобновляют прием АРТ. Если тем, кто получает лечение, требуется больше времени для достижения этих пороговых значений по сравнению с контрольной группой, это указывает на то, что терапия замедляет восстановление вирусной активности. Исследования TVR часто используются для оценки методов терапии, нацеленной на резервуары, обычно они длятся всего несколько недель.
Исследования контрольных точек демонстрируют, насколько эффективно иммунная система участников контролирует ВИЧ самостоятельно. В этих гораздо более длительных исследованиях (до нескольких месяцев) исследователи позволяют вирусным нагрузкам участников достигать высоких уровней, имитируя острую фазу ВИЧ, чтобы проследить, сможет ли их иммунная система в дальнейшем снизить эту нагрузку. Порог для возобновления АРТ обычно устанавливается на высоком уровне (часто 100 000 копий/мл). Когда участники, получающие лечение, способны контролировать ВИЧ при более низких уровнях вирусной нагрузки и в течение более длительного времени, чем участники контрольной группы, это говорит о том, что терапия повышает их иммунитет против вируса.
Несмотря на то, что нет конкретных рекомендаций, определяющих, как планировать исследования с прерыванием лечения, группа ученых, занимающихся исследованием ВИЧ, встретилась в 2018 году, чтобы обсудить этические стороны и выработать методы для снижения риска. Прекращение АРТ во время этих исследований не просто подвергает участников риску длительных периодов определяемой, а в некоторых случаях и высокой вирусной нагрузки. Более высокие вирусные нагрузки также могут подвергать опасности и ВИЧ-отрицательных половых партнеров участников.
До сих пор в большинстве исследований риск снижался за счет небольшого числа участников и отсутствия контрольной группы, которая вместо лечения принимала неактивное плацебо. Включение контрольной группы важно, потому что это позволяет ученым сравнивать тех, кто принимает лекарства, с теми, кто находится на плацебо. Тем не менее научное сообщество обсуждало этичность использования контрольных групп в подобных испытаниях лекарств, потому что они подвергаются длительным периодам повышенной вирусной нагрузки в отсутствие каких-либо препаратов, даже экспериментальных.
Исследование
Доктор Лау и ее коллеги использовали данные предыдущих клинических испытаний для создания математических моделей, позволяющих оценить, как различные их параметры влияют на статистическую мощность испытания.
Статистическая мощность аналогична чувствительности. Например, тест на ВИЧ с чувствительностью 80% успешно идентифицирует вирус у 80% людей, которые на самом деле ВИЧ-положительны, но не выявит у остальных 20% ВИЧ-положительных людей. Когда клиническое испытание, оценивающее лечебную терапию, должно достигнуть статистической мощности в 80% (при условии, что терапия имеет реальную пользу для тех, кто ее принимает), в испытании будет 80-процентная вероятность обнаружить пользу и 20-процентная вероятность ее упустить.
Проще говоря, чем больше данных задействовано в испытании, тем большей статистической мощностью оно будет обладать. Такие факторы, как количество участников, число контрольных параметров, продолжительность испытания и частота анализов крови, влияют на статистическую мощность испытания.
Результаты пробного моделирования TVR
В отношении недавнего исследования TVR с участием 13 человек такая модель показала, что при мощности 80% исследование выявило бы только лечение со значительным снижением реактивации (от 70 до 80%). Чтобы исследование TVR выявило снижение реактивации на 30%, потребуется уже по 120 участников в группе терапии и в контрольной группе. Поскольку в большинстве исследований TVR задействовано малое число участников, они, вероятно, не устанавливают умеренных результатов терапии.
Может показаться нелогичным планирование исследования для выявления меньшего эффекта от лечения, когда конечной целью является поиск максимальной пользы (т. е. терапия, приводящая к 100% снижению реактивации). Тем не менее на начальных этапах поиска лекарства необходимо фиксировать даже умеренные результаты, чтобы решить, требует ли этот метод дальнейшего изучения.
Помимо рекомендации увеличить количество участников, команда предлагает использовать ретроспективные контрольные данные в дополнение к контрольным группам. Данные из предыдущих испытаний, в которых люди прерывали АРТ, могли бы повысить потенциал выявления умеренной пользы от лечения. Они смоделировали гипотетическое исследование TVR, в которое вошли 50 участников и 50 человек из контрольной группы. При мощности 80% эта конструкция может обнаруживать снижение реактивации до 43%. Добавление ретроспективных данных еще 150 участников позволило бы в том же испытании выявить снижение до 36%.
Такое моделирование также не показало практически никакого улучшения способности обнаруживать снижение реактивации при увеличении продолжительности испытаний TVR свыше пяти недель. После этого срока модель предсказала улучшение обнаружения не более чем на 1%. Точно так же они не обнаружили практически никакой пользы от проведения лабораторного мониторинга чаще, чем раз в неделю. Наблюдение за людьми два раза в неделю почти не помогло обнаружить снижение реактивации.
Ученые провели отдельный анализ для оценки максимального риска передачи ВИЧ во время исследований TVR на основе предыдущих данных. Они оценили максимальный риск передачи, предполагая, что участники занимались незащищенным сексом и что доконтактная или другие методы профилактики не использовались. Кроме того, если во время еженедельного мониторинга не сообщать пациенту показатель вирусной нагрузки сразу же, то участник, которому необходимо возобновить АРТ (если его вирусная нагрузка превысила 1000), скорее всего, отложит это до следующего еженедельного визита.
Было подсчитано, что в этом случае во время пятинедельного исследования TVR с порогом вирусной нагрузки 1000 для повторного начала АРТ максимальный риск передачи ВИЧ составил 3,6 на 1000 участников, занимающихся вагинальным сексом. При анальном сексе для вводящих партнеров максимальный риск составлял около 7 на 1000, а для принимающих партнеров — около 70 из 1000. Изменение схемы исследования, включающее экспресс-тестирование на вирусную нагрузку и возобновление АРТ в тот же день, снижает предполагаемый максимальный риск до 0,9, 1,8 и 18 на 1000 соответственно.
Результаты моделирования исследования по контрольным величинам
Исследования контрольных точек должны иметь достаточную статистическую мощность, чтобы отделять преимущества предлагаемой лечебной терапии от контроля после лечения. Используя результаты исследования CHAMP, ученые предположили, что исходный уровень контроллеров после лечения ниже 4%. Если целью исследования было определить увеличение количества контролеров до 20% (это означает, что терапия помогла людям, которые не являются естественными контроллерами, подавить вирус), их модель показала, что 24-недельное исследование со статистической мощностью 80% потребует участия 60 пациентов.
Из-за чрезвычайно высоких вирусных нагрузок в типичных исследованиях контрольных величин (до 100 000) авторы сравнили, как использование более консервативного порогового значения (1000) для возобновления АРТ повлияет на способность этих исследований обнаруживать увеличение числа контроллеров после лечения. CHAMP показало, что у 55% контроллеров после лечения первоначальные всплески вирусной нагрузки не превышали 1000 копий/мл, и в дальнейшем они сохраняли вирусную нагрузку ниже этого порога.
Используя эти данные, Лау и Кромер предположили, что использование порога в 1000 копий маскирует 45% естественных контроллеров после лечения, что может помешать обнаружить, когда терапия усиливает иммунный контроль участников над ВИЧ. Чтобы восстановить статистическую мощность, потребуется больше участников. Как и в приведенном выше примере, при мощности 80% и цели выявления 20-процентного повышение числа контроллеров после лечения свыше базового уровня 4%, более низкий порог вирусной нагрузки потребует увеличить количество участников с 60 до 120 как в лечебных, так и контрольных группах.
Как и в случае исследований TVR, ученые также оценили максимальный риск передачи ВИЧ во время определения контрольных величин, используя те же предположения, что и описанные выше (отсутствие стратегий профилактики и экспресс-тестирования на вирусную нагрузку, незащищенный секс, недельная задержка перед возобновлением АРТ). Из-за гораздо большей продолжительности испытаний и высоких пороговых значений вирусной нагрузки (для этого они сослались на исследование контрольных величин, в котором использовали данные 50 000 человек) они оценили максимальный риск передачи ВИЧ как 13 случаев на 1000 при вагинальных половых контактах, около 25 на 1000 — для вводящего партнера при анальном сексе, 214 на 1000 — крайне высокий — для принимающего партнера при анальном сексе.
Предлагаемая гибридная схема испытаний
Основываясь на собственном моделировании и оценках максимального риска передачи, ученые предлагают использовать гибридную модель для анализа прерывания лечения. В озвученной ими схеме прерывания будут начинаться с пятинедельного исследования TVR. Хотя оно, как правило, применяется, когда терапия нацелена на резервуары ВИЧ, у людей, отвечающих на терапию, направленную на усиление иммунитета, также будет наблюдаться более медленное восстановление вируса (если лечение было эффективным).
Начало испытания для оценки потенциального лечения с помощью исследования TVR подвергнет участников гораздо более коротким перерывам в лечении, что позволит исследователям определить, имела ли эта терапия достаточную эффективность, чтобы перейти к более длительному изучению заданных значений. Если медики согласятся с необходимостью дальнейшего исследования, а пациенты с вирусной нагрузкой ниже 1000 согласятся перейти к следующей фазе, они продолжат тщательное наблюдение в течение 24 недель или до тех пор, пока вирусная нагрузка участников не превысит 1000 копий/мл, после чего они возобновят АРТ.
Ученые рекомендуют провести экспресс-тестирование на вирусную нагрузку и возобновить АРТ в тот же день, чтобы свести к минимуму риск передачи инфекции. По их оценке, ограничение контрольной точки теми, кто уже демонстрирует контроль за вирусом, до вирусной нагрузки ниже 1000, снижение порога вирусной нагрузки для возобновления АРТ до 1000, ограничение продолжительности до 24 недель, а также включение тестирования по месту оказания медицинской помощи и возобновление АРТ в тот же день снижают максимальный риск передачи до 0,2 на 1000 при вагинальном сексе, до 0,35 на 1000 — для вводящего партнера при анальном сексе и до 3,1 на 1000 — для принимающего партнера при анальном сексе. И это значительное улучшение показателей по сравнению с оценкой, полученной в ходе традиционных исследований контрольных величин.
Если первоначальное исследование TVR показывает, что лечение не требует дальнейшего изучения (например, если не обнаружено позитивного эффекта), то ученые смогут избежать затрат на проведение длительного исследования контрольных величин.
Выводы
Ученые пришли к выводу, что в испытаниях лекарств недостаточно участников для обеспечения знаковой статистической мощности при умеренных результатах лечения. Поскольку чаще всего при испытаниях терапии также не используются контрольные группы, количественная оценка пользы лечения чрезвычайно сложна. Специалисты рекомендуют сотрудничать всем заинтересованным структурам для создания ретроспективной контрольной базы данных, которая позволила бы разработать схему испытаний, не полностью полагающуюся на контрольные группы плацебо. Тем не менее они отмечают, что задействование ретроспективных контрольных данных означает включение людей, которые с большей вероятностью начали АРТ во время хронической ВИЧ-инфекции, и тех, кто использует более старые схемы АРТ, которые могут действовать как искажающие факторы.
Тем не менее сокращение числа участников, получающих плацебо, снижение пороговых значений вирусной нагрузки, продолжительности испытаний и рисков передачи ВИЧ могут побудить большее число людей с ВИЧ участвовать в исследованиях с прерыванием лечения.
Вирусы могут размножаться только внутри клетки-хозяина, перестраивая ее работу так, что клетка начинает производить новые вирусные частицы. Это серьезно нарушает работу самой клетки и в большинстве случаев ведет к ее гибели. Процесс проникновения и размножения вируса в ней сложный и содержит много стадий, а значит, специальные лекарства могут тормозить его на различных этапах.
В случае с ВИЧ это выглядит так.

по теме

Лечение
Лучшие научпоп-статьи 2018 года
После того как вирусная частица приклеилась к рецепторам CD4 и CCR5/CXCR4 и закрепилась на поверхности клетки, другой специальный белок вируса gp41 соединяет оболочку вируса с мембраной клетки-мишени и помогает вирусу проникнуть внутрь клетки (цифра 2 на схеме). На этом этапе остановить вирус может другая группа препаратов — ингибиторы слияния, например, энфувиртид. Препарат связывается с вирусным белком gp41 и нарушает его работу.

На этом этапе размножение вируса блокирует очень большое количество препаратов из двух классов — нуклеозидные ингибиторы обратной транскриптазы (НИОТ — ламивудин, абакавир, тенофовир) и ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ — эфавиренз, рилпивирин). Принцип действия у веществ из обеих групп похожий: молекула лекарства связывается с обратной транскриптазой вируса, нарушает ее работу и так блокирует перенос генов вируса из РНК в ДНК. Это не позволяет генам вируса встроиться в ДНК клетки-хозяина и начать производство новых вирусных частиц.
На следующем этапе инфицирования (цифра 4 на схеме) готовая вирусная ДНК проникает в ядро и встраивается в ДНК клетки-хозяина с помощью специального вирусного фермента — интегразы. Работу этого фермента блокируют ингибиторы интегразы, например, долутегравир, не позволяя ДНК вируса встроиться в наши гены.
После того как вирусная ДНК встраивается в ДНК клетки-хозяина, клетка получает неправильную программу и начинает производить вирусные белки и РНК, необходимые для сборки новых частиц вируса (цифра 5 на схеме), используя для этого структуры, которые в норме производят собственные белки клетки. Такая перенастройка производства белка сильно нарушает работу клетки и через некоторое время вызывает ее гибель. Лекарств, которые бы влияли на этот этап размножения вируса, нет, так как здесь вирус использует собственные ферментные системы клетки-хозяина и блокирование их работы какими-то веществами навредит здоровым клеткам.
по теме

Лечение
Ошибка системы. Почему в регионах опять не хватает таблеток от ВИЧ
После синтеза вирусных белков клеткой-хозяином в работу вступает еще один фермент вируса — протеаза (цифра 6 на схеме). Дело в том, что белки ВИЧ синтезируются в виде длинных цепочек белков-предшественников, но они неактивные. Протеаза разрезает эти цепочки на более короткие фрагменты, которые становятся активными белками вируса: из одних собирается вирусная оболочка, другие выполняют функции ферментов (обратная транскриптаза, интеграза, протеаза, о которых мы говорили выше). Класс лекарств, нарушающих работу вирусной протеазы, включает большое количество препаратов от достаточно старого лопинавира до современного дарунавира. Основной недостаток препаратов этого класса — высокая степень перекрестной устойчивости: если вирус приобретает устойчивость к одному препарату, скорее всего, на него не подействует ни один другой препарат из этого класса.
На последнем этапе (цифра 7 на схеме) вирусные частицы собираются из готовых компонентов (синтезированных клеткой вирусных белков и РНК), как конструктор, и покидают клетку-хозяина. Лекарств, которые бы тормозили эти процессы, пока не существует.
ВИЧ имеет высокую склонность к мутациям, что позволяет ему быстро приобретать устойчивость к лекарствам. Мутации изменяют форму молекул ферментов вируса. Если при этом форма изменится существенно, то фермент не сможет нормально работать и такой вирус размножаться перестанет — это вредная для вируса мутация. Однако в некоторых случаях — при полезных мутациях — форма молекулы фермента меняется не сильно, а так, что сам фермент продолжает нормально работать, но молекула лекарства уже не может с ним связаться.
Поэтому для эффективного подавления размножения ВИЧ обычно назначают три разных препарата из разных групп, влияющих на разные ферменты вируса, блокируя его воспроизводство на разных этапах. Исключением является группа ингибиторов обратной транскриптазы (НИОТ и ННИОТ) — эти лекарства связываются с разными участками молекулы вирусного фермента, поэтому могут назначаться вместе, несмотря на то, что относятся к одной группе. В условиях такой терапии вирусу очень трудно выработать устойчивость, потому что одновременно должно произойти несколько полезных мутаций в разных генах вируса, а это бывает крайне редко.
Есть несколько перспективных технологий, например, CRISPR/Cas9, которые могут позволить полностью удалить вирусную ДНК из организма человека, но пока ни одна из них не прошла все необходимые исследования для подтверждения эффективности и безопасности. Исследования продолжаются.
В середине 1980-х ученые идентифицировали вирус иммунодефицита человека и сразу же стали искать лекарство. История антиретровирусной терапии началась в 1987 году, когда для лечения ВИЧ-инфекции стали использовать препарат зидовудин. Но его эффективность была невысокой, а побочные эффекты слишком сильными. Первая высокоэффективная терапия появилась только через десять лет — в 1996 году. Эта комбинация из нескольких лекарств блокирует размножение попавшего в организм вируса сразу на нескольких этапах его цикла. С тех пор ВИЧ-инфекция — не смертельное, а хроническое заболевание, которое можно контролировать при должном лечении.
Антиретровирусные препараты (АРВ) подавляют размножение ВИЧ, но неспособны полностью удалить вирус из организма, именно поэтому их нужно принимать постоянно в течение всей жизни. Как только концентрация препарата в крови падает ниже порогового значения, вирус снова начинает размножаться. Это особенно опасно, ведь если вирус размножается в присутствии небольшого количества лекарства, то он вырабатывает устойчивость к этому препарату.
Пить таблетки на протяжении всей жизни с точностью до минут — не самая простая задача. Этому мешают и банальная забывчивость, и разные случайные обстоятельства. А чем чаще человек нарушает время приема терапии, тем выше риск развития у вируса устойчивости. Именно поэтому врачи стараются назначать схемы с приемом лекарств один раз в день и с минимальным числом таблеток — чем реже и меньше нужно принимать лекарств, тем проще соблюдать режим. Правильное соблюдение режима приема терапии называют высокой приверженностью лечению.
Сейчас лучшими схемами считаются те, при которых пациенту нужно принимать одну таблетку один раз в день, да еще и независимо от приема пищи. Но настоящим прорывом в АРВТ станет разработка схем, при которых лекарство достаточно будет принимать всего один или несколько раз в месяц, — пролонгированных схем терапии. Хотя в настоящее время неизвестно, как поведут себя пролонгированные режимы в рутинной практике. Будет ли к ним сохраняться высокая приверженность — как это показывают исследования?
по теме

Общество
Грудное молоко VS смеси при ВИЧ: что говорят эксперты в 2020 году?
Основной недостаток таких таблеток — срок их действия ограничено временем нахождения таблетки в кишечнике и не превышает 12—24 часов. В случае же диареи таблетка может покинуть организм гораздо быстрее, а значит, уменьшится концентрация лекарства в крови, что может быть опасно. Для антиретровирусных препаратов создание таблеток или капсул с замедленным высвобождением лекарственного вещества не очень перспективно — современные схемы уже позволяют принимать терапию один раз в день. То есть удобство применения терапии такие таблетки не повысят.
Если нужно добиться продления эффекта препарата на дни и недели, а лекарство всасываться через кожу упорно не хочет, приходится прибегать к парентеральным пролонгированным формам. Можно зашить под кожу специальную стерильную таблетку, которая будет медленно растворяться и выделять лекарственное вещество: на коже делается небольшой разрез, в него вводят таблетку и зашивают рану.
Помимо таблеток, под кожу можно вводить специальные полимерные импланты, содержащие нужное лекарство. Преимущество имплантов — они могут выделять лекарственное вещество очень долго, до нескольких лет. Чаще всего такие импланты используют для гормональной контрацепции. Так как гормоны действуют в очень маленьких дозах, даже в небольшой по размерам имплант можно сразу поместить запас препарата на несколько лет. Например, противозачаточный препарат Имплантон, который вводится под кожу, продолжает действовать три года. Если действие препарата нужно прекратить — достаточно просто извлечь имплант.
Более простой вариант — ввести в мышцу взвесь маленьких крупинок лекарства в подходящем растворителе. Выглядит это как обычный укол, при этом крупинки лекарства задерживаются в мышце, медленно растворяются и попадают в кровь. Такие способы введения лекарства особенно удобны в случаях, когда пациент может часто пропускать прием препарата, или забывать, принял ли он лекарство. Например, в случае лечения психических заболеваний. Но есть и недостатки: вводить такой препарат должен медицинский работник, а в случае непереносимости или выраженных побочных эффектов лекарство очень трудно быстро удалить из организма.
Что уже доступно на рынке?
Многие фармацевтические компании проводят исследования пролонгированных АРВ-препаратов, но разработка одного такого препарата сама по себе очень большой пользы не принесет — ведь для лечения ВИЧ-инфекции необходимо сочетание нескольких препаратов, то есть нужна комбинированная пролонгированная схема.
Такую схему, разработанную ViiV Healthcare совместно с Janssen, одобрили в марте 2020 года в Канаде — первый пролонгированный комбинированный АРВ-препарат Cabenuva. Схема показала высокую эффективность и безопасность в клинических исследованиях LATTE-2, FLAIR, ATLAS с участием более тысячи пациентов. В состав Cabenuva входят каботегравир и рилпивирин, то есть это двухкомпонентная схема. Препарат вводят один раз в месяц внутримышечно.
Перед началом применения Cabenuva пациент не менее месяца принимает каботегравир в таблетках (называется Vocabria) в комбинации с Эдюрантом — таблетками рилпивирина. Это необходимо, чтобы проверить переносимость такой схемы у конкретного пациента и оценить побочные эффекты. Если схема переносится хорошо, пациенту вводят первую нагрузочную дозу Cabenuva — 3 миллилитра суспензии, содержащей 600 миллиграммов каботегравира, и 3 миллилитра суспензии, содержащей 900 миллиграммов рилпивирина. Суспензии вводятся в разные участки ягодичной мышцы, то есть делают два укола. После этого поддерживающие дозы вводят ежемесячно: 2 мл (400 мг) каботегравира и 2 мл (600 мг) рилпивирина. Если по каким-то причинам введение очередной ежемесячной поддерживающей дозы невозможно, пациент до момента следующей инъекции может принимать пероральную схему (Vocabria + Эдюрант). Пролонгированная форма каботегравира также имеет большие перспективы для использования в качестве доконтактной профилактики ВИЧ-инфекции.
Еще один препарат, который уже применяется в клинической практике, — ибализумаб (Трогарзо) — можно назвать пролонгированным с несколькими оговорками. По химической природе ибализумаб — моноклональное антитело, то есть близок к человеческим иммуноглобулинам. Ибализумаб связывается с некоторыми белками на поверхности вируса и мешает проникновению ВИЧ в клетки. Препарат вводят внутривенно один раз в две недели и часто сочетают с другими АРВ-препаратами. Такая схема — не самый удобный вариант, поэтому сейчас ибализумаб используется только для лечения ВИЧ с множественной лекарственной устойчивостью, когда другие схемы оказываются неэффективными. Поэтому ибализумаб правильнее будет отнести к нишевым препаратам.
К сожалению, на этом и заканчивается не очень длинный перечень пролонгированных АРВ-препаратов, которые уже применяются на практике. Дальше пойдет речь о препаратах, находящихся на разных стадиях исследований.
Что сейчас находится в разработке?
PRO 140
С точки зрения места в клинической практике на ибализумаб похоже еще одно моноклональное антитело, находящееся в стадии клинических исследований, — PRO 140. Этот препарат также можно будет использовать для лечения ВИЧ-инфекции, если у пациента не работают другие схемы. А по механизму действия PRO 140 похож на уже существующий на рынке препарат маравирок (Целзентри). Он связывается с CCR-5 рецепторами на поверхности клеток-мишеней и мешает проникновению вируса в клетку. Строение активного центра молекулы PRO 140 отличается от маравирока, поэтому он активен даже в тех случаях, когда вирус выработал устойчивость к маравироку. Как и маравирок, PRO 140 активен только против CCR-5-тропных подтипов ВИЧ, то есть подойдет не всем пациентам. Препарат вводят внутривенно, один раз в неделю.
Нейтрализующие антитела
На разных стадиях клинических исследований находятся несколько перспективных антител, которые связываются с вирусным белком gp120 и нейтрализуют вирус: VRC01, 3BNC117 и 10-1074. Предполагается, что эти препараты достаточно будет вводить раз в месяц или даже реже и их можно будет применять совместно с другими пролонгированными АРВ-препаратами.
Албувиртид
Аналог уже применяющегося на практике энфувиртида (Фузеон). Этот препарат связывается с вирусным белком gp-41 и мешает проникновению вируса в клетку. Основное отличие в том, что Фузеон вводят подкожно два раза в сутки, что очень неудобно, а албувиртид — только один раз в 2—4 недели. Препарат должен применяться совместно с другими АРВ-лекарствами.
Профилактический прием антиретровирусных препаратов для предотвращения заражения ВИЧ-инфекцией после возможного контакта с вирусом - постконтактная профилактика ВИЧ-инфекции (ПКП).
Клинические протоколы по ВИЧ-инфекции приняты Экспертным советом по оценке качества клинических руководств/протоколов и утверждены Приказом МЗ КР № 903 от 10.10.2017 г.
Врачи-инфекционисты, семейные врачи, эпидемиологи, гинекологи, медицинские работники станций скорой медицинской помощи, дерматовенерологи, организаторы здравоохранения, педиатры, эксперты ФОМС, преподаватели, ординаторы, аспиранты, студенты и др.
Профилактика
Жидкости организма, при контакте с которыми обосновано проведение ПКП ВИЧ:
Жидкости, характеризующиеся высоким содержанием ВИЧ, хотя список их не является исчерпывающим: кровь, окрашенная кровью слюна, грудное молоко, генитальные секреты, цереброспинальная, амниотическая, перитонеальная, синовиальная, перикардиальная или плевральная жидкости.
Медицинские работники должны принять решение относительно степени риска экспозиции.
Типы экспозиции:
1) слизистая оболочка (сексуальный контакт, попадание капель в глаз, нос или ротовую полость);
2) парентеральный попадание в кровь, на поврежденную кожу или слизистые.
- случаи, когда подвергшийся контакту индивидуум уже ВИЧ-положителен;
- случаи, когда источник является ВИЧ-отрицательным и воздействие жидкостей организма не представляют существенного риска, например, слезы не окрашенная кровью слюна, моча и пот.
- оказание первой помощи;
- проведение консультирования и оценка степени риска;
- тестирование на ВИЧ после получения письменного информированного согласия;
- предоставление короткого курса АРВ-препаратов (28 дней);
- оказание поддержки и последующего наблюдения.
Опасность заражения ВИЧ при выполнении служебных обязанностей представляют ранения загрязненными острыми инструментами (например, иглой), контакт через поврежденную кожу (трещины, ссадины, порезы, в т.ч. во время операций) или слизистые.
- повреждение целостности кожи и слизистой оболочки органов;
- использование общих игл и шприцев (ЛУИН);
- повреждение кожи медперсонала при хирургических вмешательствах.
- все случайные единичные контакты с кровью и другими биологическими жидкостями (спермой, влагалищными выделениями и др.);
- незащищенные половые контакты;
- использование общих шприцев либо общей посуды при введении или приготовлении наркотиков;
- случайные уколы иглами.
3. Оценка произошедшего контакта, обследование потенциального источника заражения и контактировавшего с ним
- форма контакта (чрескожное повреждение, через слизистые, открытую рану);
- тип материала (кровь, сперма, вагинальная, спинномозговая, синовиальная, плевральная, перитонеальная, перикардиальная или амниотическая жидкости);
- давность контакта.
- провести предтестовое и послетестовое консультирование;
- получить письменное информированное согласие на выявление ВИЧ;
- провести экспресс-тест на ВИЧ;
- учесть результаты предыдущего тестирования на ВИЧ (при наличии).
- оценка степени риска заражения;
- проведение предтестового и послетестового консультирований;
- проведение экспресс-теста на ВИЧ после получения письменного информированного согласия на тестирование;
- при необходимости получение письменного информированного согласия на получение ПКП (Приложение 3.1);
- назначение короткого курса АРВП;
- дальнейшее наблюдение и обследование через 1, 3 и 6 месяцев.
В местах возможной аварии в ОЗ должен быть журнал регистрации случаев аварий, в котором отмечается дата, время, место, характер аварии, ФИО пострадавшего лица и проведенные мероприятия, в соответствии с приказом МЗ КР № 502 от 22.08.2013 Заполняется акт о несчастном случае (Приложение 3.2).
О каждом аварийном случае необходимо немедленно сообщить заведующему отделением, руководителю данного учреждения.
Все медицинские работники обязаны знать алгоритм действий при аварийной ситуации (Приложение 3.3).
Оказание помощи после случайного контакта с ВИЧ или с биологическими жидкостями лица, с неизвестным ВИЧ-статусом, с предположительно высоким риском инфицирования
Первая помощь
Первая помощь после возможного контакта с ВИЧ – это действия, которые необходимо предпринять немедленно, с целью сокращения времени контакта с инфицированными биологическими жидкостями (в том числе с кровью) и тканями, правильно обработать место экспозиции, снизив тем самым риск инфицирования.
- Сразу вымыть поврежденное место с мылом;
- Поддержать раневую поверхность под струей проточной воды (несколько минут или пока кровотечение не прекратится), чтобы дать крови свободно вытекать из раны;
- Нельзя использовать сильнодействующие средства: спирт, отбеливающие жидкости и йод, так как они могут вызвать раздражение раневой поверхности и ухудшать состояние раны;
- Нельзя сдавливать или тереть поврежденное место;
- Нельзя отсасывать кровь из ранки, оставшейся от укола/ пореза.
- Немедленно вымыть загрязненный участок;
- Нельзя использовать сильнодействующие средства: спирт, отбеливающие жидкости и йод, так как они могут вызвать раздражение пораженной поверхности;
- Нельзя тереть или скрести место контакта;
- Нельзя накладывать повязку.
- Сразу промыть глаза водой или физиологическим раствором;
- Сесть, запрокинуть голову и попросить коллегу осторожно лить на глаза воду или физиологический раствор; чтобы вода и раствор затекали и под веки, их время от времени осторожно оттягивают;
- Не снимать контактные линзы на время промывания, так как они создают защитный барьер;
- После того как глаза промыли, контактные линзы снять и обработать как обычно, после этого они совершенно безопасны для дальнейшего использования;
- Нельзя промывать глаза с мылом или дезинфицирующим раствором.
в) В рот:
- Немедленно выплюнуть попавшую в рот жидкость;
- Тщательно прополоскать рот водой или физиологическим раствором и снова выплюнуть. Повторить полоскание несколько раз.
Время начала и продолжительность проведения ПКП:
ПКП необходимо начинать в течение первых 2-х часов и не позднее 72 часов после вероятного контакта с ВИЧ, продолжительностью 28 дней.
Схемы и АРВ-препараты для проведения постконтактной профилактики (ПКП) ВИЧ-инфекции для взрослых и подростков:
Схемы из трех АРВ-препаратов
Расширенная схема состоит из трех АРВ-препаратов (два НИОТ и ННИОТ/ИП).
Схема выбора: Тенофовир+ламивудин/эмтрицитабин + лопинавир/ритонавир

При невозможности проведения трехкомпонентной терапии лучше немедленно начать с двухкомпонентной схемы, чем задержать предоставление ПКП.

Базовая схема подразумевает использование двух НИОТ в схеме АРТ (обычно включающей 3 АРВ-препарата).

Альтернативные схемы ПКП: TDF/ FTC/ EFV; AZT+3TC+ LPV/r
По возможности в качестве альтернативных вариантов можно рассмотреть использование RAL, DRV/r.
NVP не следует использовать для ПКП у взрослых людей, подростков и детей старшего возраста в связи с риском опасных для жизни серьезных нежелательных явлений, ассоциирующих с применением этого препарата у ВИЧ-отрицательных взрослых людей.
EFV широко используется в качестве третьего препарата, так как этот препарат применяется как компонент предпочтительной АРТ-схемы первой линии.
EFV хорошо переносится в процессе лечения, однако имеет ограниченную приемлемость при использовании в рамках ПКП, поскольку применение этого препарата вызывает опасения в связи с ранними нейропсихическими нежелательными явлениями у ВИЧ-отрицательных людей, у которых тревога может быть связана с экспозицией ВИЧ.
- Схемы и АРВ-препараты для проведения ПКП ВИЧ-инфекции, детям до 10 лет:
AZT + 3TC рекомендуется в качестве предпочтительной базовой схемы для ПКП ВИЧ-инфекции у детей до 10 лет.

Схема выбора: AZT + 3TC + LPV/r

Альтернативная схема с учетом возраста может включать ATV/r, RAL, DRV/r, EFV или NVP.
NVP следует использовать у недоношенных детей и младенцев до двухнедельного возраста, когда пероральная профилактика жидким LPV/r использоваться не может. Тем не менее в связи с тем, что профиль токсичности NVP после периода младенчества остается неясным, следует избегать его применения у детей старше 2 лет.
Практика врачебных назначений

Консультирование по повышению приверженности включает оценку исходных потребностей человека, рекомендации по повышению приверженности лечению.
Приверженность приему АРВП – это одна из важнейших факторов подавления вирусной нагрузки, риска передачи ВИЧ, прогрессирования ВИЧ-инфекции и летального исхода.
- Тестирование на ВИЧ проводят сразу после контакта, а затем через 1 месяц, 3 месяца и 6 месяцев после контакта, даже если решено ПКП не проводить.
- У лиц, получающих АРВ-препараты, необходимо следить за появлением возможных побочных эффектов и соблюдением режима профилактического лечения.
- Если по окончании ПКП у контактировавшего произошла сероконверсия, его берут на диспансерное наблюдение.
- Через 6 месяцев, при отрицательных результатах тестирования на ВИЧ, наблюдаемый снимается с учета.
Информация
Источники и литература
Информация
Проведение обновления планируется по мере появления принципиально новых данных. Все поправки к данному протоколу будут публиковаться в периодической печати.
Совершенствование подходов к ведению больных ВИЧ-инфекцией на всех уровнях системы здравоохранения по консолидированным рекомендациям ВОЗ 2016 года.
Повышение качества оказания медицинской помощи больным с ВИЧ-инфекцией на всех уровнях системы здравоохранения.
4. Ногойбаева К.А. – к.м.н., доцент кафедры инфекционных болезней, ВИЧ/СПИД и дерматовенерологии КГМИПиПК
Др. Елена Вовк – специалист программы по контролю за ТБ, ВИЧ и ВГ Департамента по чрезвычайным ситуациям в области здравоохранения и инфекционным заболеваниям ЕРБ ВОЗ
Барыктабасова Б.К. – к.м.н., консультант МЗ КР по вопросам доказательной медицины и методологии разработки клинических руководств и протоколов
1. Тобокалова С.Т. – д.м.н., профессор, зав. кафедрой инфекционных болезней, ВИЧ/СПИД и дерматовенерологии КГМИПиПК
2. Тойгонбаева В.С. – д.м.н., профессор, зав. кафедрой общей и клинической эпидемиологии КГМА имени И.К. Ахунбаева
Перед началом работы по созданию данных клинических протоколов все члены рабочей группы дали согласие сообщить в письменной форме о наличии финансовых взаимоотношений с фармацевтическими компаниями. Никто из членов авторского коллектива не имел коммерческой заинтересованности или другого конфликта интересов с фармацевтическими компаниями или другими организациями, производящими продукцию для диагностики, лечения и профилактики ВИЧ-инфекции.
В процессе апробации и рецензирования клинических протоколов были получены комментарии и рекомендации, которые были учтены при его доработке.
Содержание Клинических протоколов полностью принадлежит авторам и не обязательно отражает официальное мнение Центров по контролю и профилактике заболеваний или Департамента здравоохранения и социальных служб.
Читайте также:

