Гнойная инфекция кисти у детей
Обновлено: 05.05.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Бурсит: причины появления, симптомы, диагностика и способы лечения.
Определение
Бурсит – это острое или хроническое воспаление бурсы (синовиальной сумки), которая выполняет функцию амортизатора в суставе, уменьшает трение между элементами сустава, облегчает движение. Она представляет собой специальное образование из прочной соединительной ткани снаружи и слизистой ткани внутри. Бурса отграничена от окружающих тканей капсулой и заполнена синовиальной жидкостью, которая вырабатывается в суставе и улучшает скольжение. Кроме того, именно эта жидкость содержит в себе компоненты, которые, проникая в хрящевую ткань, обеспечивают ее питание и увлажнение.
При воспалении бурсы увеличивается количество и меняется состав синовиальной жидкости – в ней появляются соли кальция, возрастает уровень белка, могут быть следы крови и воспалительные элементы. Суставная сумка отекает, причиняет боль, что приводит к нарушению подвижности в пораженном суставе.
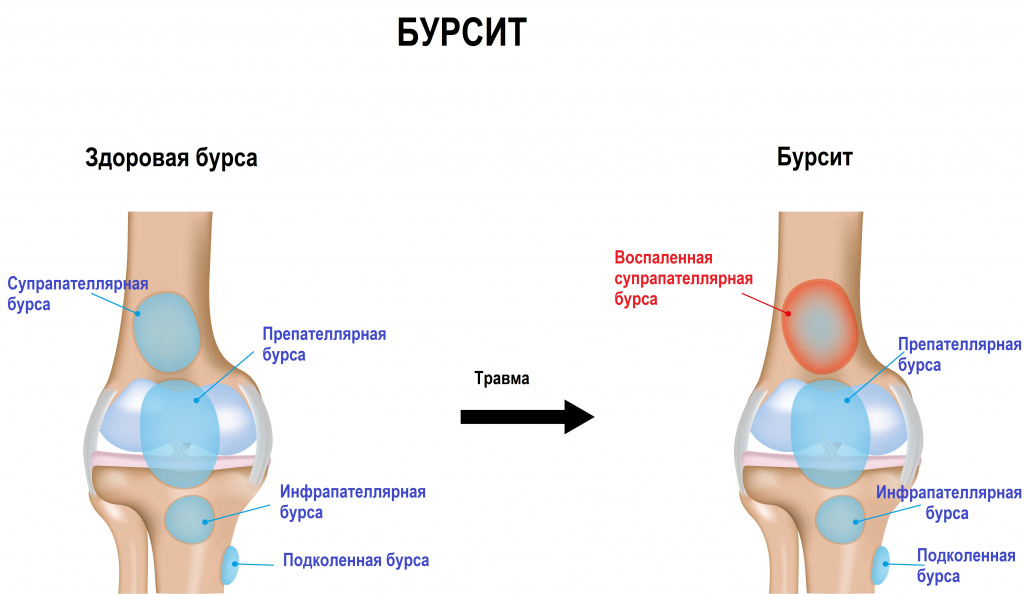
Чаще всего воспаление синовиальной сумки развивается в плечевом, локтевом, коленном или бедренном суставах, а также в области пяточной кости. Иногда бурсит индуцирует воспаление в смежном суставе.
Причины появления бурсита
Согласно современным представлениям, ключевым фактором развития бурсита является механическое повреждение околосуставной сумки, реже – инфекция, нарушения обмена веществ, интоксикация, аллергические реакции, аутоиммунные процессы. Механическое повреждение может быть связано с действием чрезмерной нагрузки или снижением толерантности к прежней нагрузке при возрастных изменениях тканей сустава.
К наиболее частым причинам бурсита относятся:
- профессиональная или другая деятельность, которая требует выполнения однообразных повторяющихся движений. Локтевые суставы часто поражаются у тех, кто работает за компьютером, занимается теннисом, бейсболом, тяжелой атлетикой, а также у кожевников, граверов, полировщиков, чеканщиков. Коленные – у тех, чья рабочая поза предусматривает опору на колени (у плиточников, паркетчиков, шахтеров, садоводов, механиков, представителей некоторых других профессий). Плечевые – у кузнецов, грузчиков; бурсит передней поверхности лопатки – у землекопов и пильщиков; пяточной бурсит – у продавцов, балерин и танцоров;
- бурсит может стать осложнением воспалительных процессов кожи и подкожной жировой клетчатки (пиодермии, флегмоны, фурункула, карбункула), костей (остеомиелита);
- аллергические реакции, аутоиммунные заболевания, интоксикации;
- воспалительные поражения суставов при подагре, ревматоидном артрите, псориатическом артрите, спондилите;
- инфекционные заболевания, например, сифилис, бруцеллез, туберкулез, гонорея;
- длительный прием антибиотиков, кортикостероидов и некоторых других препаратов;
- неправильно подобранная обувь и нарушение осанки;
- сахарный диабет, ожирение и другие заболевания, связанные с нарушениями обмена веществ;
- спортивные и бытовые травмы, в результате которых повреждается синовиальная сумка и ее сосуды. Это могут быть как однократные травмы (удары, падения на сустав с образованием гематом, разрывы сухожилий и связок), так и повторяющиеся повреждения, например, при занятиях контактными видами спорта.
Первоначально возникшее воспаление (острый бурсит) может развиться после непривычной нагрузки, травмы.
Хронический бурсит может развиться вследствие предыдущих эпизодов острого бурсита или повторных травм, может продолжаться несколько месяцев и часто рецидивировать. При этом заболевание имеет тенденцию обостряться каждый раз, когда снижается иммунитет.
Классификация заболевания
Формальной системы классификации бурсита не существует, но его можно описать согласно локализации воспаленной синовиальной сумки. Самыми распространенными являются:
- септический (инфицированный) бурсит появляется из-за бактериального заражения, чаще вызванного золотистым стафилококком (порядка 80% случаев), стрептококками, гонококками, пневмококками, туберкулезной или кишечной палочкой и др.;
- асептический (неинфицированный) бурсит развивается из-за неинфекционных причин.
- серозный – асептический воспалительный процесс, при котором в сумке образуется плазма с примесью небольшого количества форменных элементов крови;
- геморрагический – большое количество эритроцитов в экссудате;
- гнойный – в полости сумки присутствуют болезнетворные микроорганизмы и разрушенные клетки, вызывающие образование гноя.
Пациенты с острым бурситом обычно жалуются на боль, локализованную в месте синовиальной сумки, особенно при движении.
Если бурса расположена поверхностно, могут наблюдаться отек и эритема (покраснение).
В число основных признаков бурсита входят:
- боль в пораженном суставе, усиливающаяся при движении или давлении на сустав;
- округлая припухлость упругого типа в месте воспаления;
- отклонение, колебание отека при надавливании (подтверждает скопление выпота);
- ограничение движения в полном объеме или частично;
- локальное повышение температуры кожи над суставом и покраснение;
- слабость, повышенное потоотделение;
- иногда воспаление сопровождается местным целлюлитом.
При гнойных бурситах местные симптомы сочетаются с картиной общей интоксикации. Возможно повышение температуры до фебрильных значений, слабость, вялость, головная боль и озноб.
Септический бурсит чаще всего наблюдается в области коленного сустава и локтевого отростка по причине поверхностного размещения бурсы.
Диагностика бурсита
Для постановки диагноза в первую очередь назначают рентгенографическое исследование пораженного сустава:
-
рентгенография плечевого/локтевого, лучезапястного, коленного, голеностопного сустава;
Рентгенологические исследования суставов предназначены для поиска травм и других патологических изменений.
Похожие темы научных работ по клинической медицине , автор научной работы — Бабич И. И., Губарев А. В.
2. уровень VI помция 6 Э - 4. уровень VI. помммя 1-9
Рис. 1. Единая схема остеосинтеза низких переломов плечевой кости.
Рис. 2. Устройство для репозиции и фиксации низких переломов плечевой кости: А) схема устройства; Б) общий вид устройства
Устройство устанавливают незамкнутую дистальную дуговую опору 5 на уровне введения спиц по задней поверхности плеча и фиксируют к ней введенные спицы. Затем по задней поверхности плеча чрескостно вводят параллельно в диафиз плечевой кости проксимальнее линии перелома не менее двух резьбовых чрескостных стержней 2 и фиксируют их к проксимальной опорной планке 1. С помощью стержней 4 и 7 скрепляют дистальную и проксимальную опору в единую систему.
Репозицию костных отломков производят после окончательного закрепления устройства на плечевой кости. Для выравнивания костных отломков по ширине в сагиттальной плоскости перемещают резьбовые чрескостные стержни 2 относительно проксимальной опорной планки 1. Для коррекции положения костных отломков по ширине во фронтальной плоскости перемещают проксимальную опорную планку 1 с резьбовыми чрескостными стержнями 2 относительно дистальной дуговой опоры 6. Перемещая вдоль плечевой кости резьбовой конец 4 в репозиционном узле 3, сближают проксимальную опорную планку и незамкнутую дистальную дуговую опору с закрепленными в неё спицами 15, тем самым, проводя осевую коррекцию костных отломков. Дозировано поворачивая проксимальную опорную планку 1 вокруг своей оси, добиваются устранения ротационного смещения отломков. Затем стабилизируют все узлы в аппарате до полного сращения отломков. В течение 5-7 дней назначают анальгетики для купирования ранней послеоперационной боли и для профилактики формирования болевой миотеногенной контрактуры локтевого и плечевого суставов во время ранней функциональной реабилитации оперированной конечности. Проводят асептическую обработку кожи в месте введения спиц и стержней, смену салфеток с раствором рифампици-на через 4-7 дней. При отсутствии противопоказаний назначают физиотерапевтические процедуры (УВЧ-терапию или магнитотерапию), что способствует скорейшему снятию отёка с поврежденной конечности.
Особенностями ведения послеоперационного периода является ранняя функциональная нагрузка на суставы конечности. Пассивные движения в суставах выполняют с 1-го дня после операции, активную реабилитацию проводят с 3-5 дня по мере стихания болевого синдрома и продолжают весь период фиксации перелома. Динамическую осевую компрессию или дистракцию костных отломков проводят по 0,5 мм 2 раза в месяц. В период фиксации пациентам рекомендуют носить защитный чехол на аппарате. Рентгенологический контроль положения отломков проводят ежемесячно. Показанием для завершения фиксации в чрескостном аппарате являются рентгенологические признаки консолидации перелома, отсутствие подвижности отломков и боли при клинической пробе.
Предлагаемая технология остеосинтеза низких переломов плечевой кости применена у 22 пациентов в отделе новых технологий в травматологии СарНИИТО. Удалось добиться сращения перелома в сроки 10-12 недель, получить хорошие и удовлетворительные функциональные исходы лечения. При этой технологии в 4 случаях наблюдали поверхностное воспаление мягких тканей в зоне введенных чрескостных стержней и спиц, приведших к болевому синдрому и контрактуре в локтевом суставе. Профилактикой этих осложнений является правильная установка чрескостных элементов без натяжения и гофрирования кожи.
Заключение. Разработанная нами технология чрескостного остеосинтеза низких переломов плеча позволяет выполнить закрытую репозицию перелома любой сложности и может быть рекомендована как метод выбора.
1. Заявка № 2005109711 РФ. Способ лечения низких переломов плечевой кости / А.П.Барабаш, К.А.Гражданов // Роспатент. №19. 2005.
2. Патент на полезную модель № 74798 РФ. Устр-во для репозиции и фиксации низких переломов плечевой кости/ А.П.Барабаш, К.А.Гражданов//Офиц. бюл. Роспатент. № 20. 2008.
ЛЕЧЕНИЕ ФЛЕГМОН КИСТИ У ДЕТЕЙ С УЧЕТОМ ВОЗРАСТНЫХ АНАТОМИЧЕСКИХ ОСОБЕННОСТЕЙ
И.И. БАБИЧ, А.В. ГУБАРЕВ*
Ключевые слова: флегмона кисти, анатомия
Лечение флегмоны кисти является одной из наиболее сложных и недостаточно изученных проблем гнойной хирургии. Из общего числа первично обратившихся к хирургу поликлиники больных 40-60% приходится на гнойные заболевания кисти [1]. При этом в настоящее время в течение раневого процесса наблюдается тенденция к превалированию альтерации и снижению экссудативных явлений, что обусловливает более медленное очищение раны, сдерживает пролиферативные процессы. Флегмоны кисти составляют от 1 до 5% всех больных с гнойносептической патологией [2]. Несмотря на кажущуюся простоту в лечения гнойных процессов данной локализации, результаты лечения удовлетворительными считать нельзя. Количество больных, нуждающихся в повторных операциях при распространении гнойно-некротического процесса, колеблется от 8,2% до 22,5% [1]. Тугоподвижность пальцев кисти с частичным анкилозом суставов составляет от 1 до 11,5% [3].
Цель работы - разработка путей оптимизации хирургического лечения флегмон кисти у детей.
Материал и методы. Всего под наблюдением находилось 151 больных с флегмоной кисти. Больные клинической группы (п=86) оперированы по нашей методике. В группе сравнения (п=65) хирургическое лечение флегмон кисти происходило стандартным методом. Распределение больных клинической группы и группы сравнения по возрасту см. в табл.
Распределение больных клинической группы и группы сравнения по возрасту
Возраст Клиническая группа, п=86 Группа сравнения, п=65
Абс. кол-во % Абс. кол-во %
1-6 мес. 18 20,9 15 23,1
6-12 мес. 14 16,3 16 24,6
От 3 до 7 лет 17 19,8 13 20,0
От 7 до 14 лет 16 18,6 9 13,8
От 14 до 30 лет 21 24,4 12 18,5
Всего 86 100,0 65 100,0
Результаты проведенного лечения позволили выявить, что причинами флегмон кисти у детей в возрасте до 1 года явились предварительная длительная периферическая катетеризация (25 чел., 78,1%), гнойные инфекции (4 чел., 12,5%), раны (3 чел., 9,4%), в том числе укушенные (2 чел., 6,25%). У детей старшей возрастной группы в качестве причины флегмоны кисти выступали раны (п=23 чел., 69,7%), в том числе укушенные (п=8 чел., 24,2%), травмы (п=6 чел., 18,2%), прямое инфицирование (п=2 чел., 6,1%), длительное самолечение панариция (п=2 чел., 6,1%). У взрослых пациентов ведущей причиной флегмон кисти были травмы - бытовая (п=11 чел., 52,4%), производственная (п= 7 чел., 33,3%). Изучение катамнеза у 31 пациента из группы сравнения в возрасте до 1 года позволило выявить следующие недостатки в лечении флегмон кисти у детей раннего возраста: 1) быстрое распространение процесса на ладонную поверхность, требующее дополнительной хирургической коррекции (п= 14, 45,2%); 2) длительное течение процессов с образованием затеков (п=6, 19,4%); 3) ограничение подвижности и рубцовые контрактуры пальцев кисти (п=8, 25,8%). Неудовлетворенность результатами лечения диктовала необходимость совершенствования хирургического лечения больных с флегмонами кисти в раннем возрасте. При этом учитывались выявленные нами при патомор-
* Ростовский ГМУ, Ростов-на-Дону, 344718, пер. Нахичеванский, 29
фологическом исследовании анатомические особенности в строении кисти у детей: 1. Относительно большое количество
сообщающихся с клетчаточными пространствами.
Результаты. В клинической группе у больных с флегмоной кисти при вскрытии межфаланговых промежутков и использовании дренажно-промывной системы наблюдалась более благоприятная динамика раневого процесса - очищение, грануляция, эпителизация ран происходили с большей скоростью и у большего количества больных. Проведение цитологических исследований позволило доказать преимущество использованной оптимизации помощи больным. Так, у больных клинической группы за счет стимуляции фаз воспаления происходило более быстрое формирование грануляционной ткани и рубцов, выраженное утолщение эпидермиса, что препятствовало хронизации процесса, затягиванию фаз воспаления и рецидивированию гнойноинфекционного процесса. В результате цитологических исследований было доказано, что у больных клинической группы воспалительно-регенераторные процессы в ране быстро сменялись регенераторными, третья фаза воспаления наступала в более ранние сроки по сравнению с группой сравнения. В результате проведения микробиологических исследований было доказано, что использование дренажно-промывной системы сопровождалось более быстрой элиминацией микроорганизмов. Так, степень микробной обсемененности в динамике послеоперационного периода снижалась в обеих группах. У больных клинической группы данный показатель изменялся более динамично и опережал таковой в группе сравнения уже с третьих послеоперационных суток. Более эффективными были и отдаленные результаты: снижалась встречаемость рецидивирования, более высокими были функциональные результаты лечения.
Оценку непосредственных результатов лечения производили в течение госпитального периода лечения, а отдаленных результатов - через 1 год после выписки при активных врачебных осмотрах. Для оценки статистической достоверности результатов лечения больные были разделены на две группы в зависимости от применения разработанной методики хирургического вмешательства флегмоны кисти. С целью исследования функции кисти в отдаленном периоде были использованы три набора геометрических тел из 15-ти шаровидных, 15-ти цилиндрических и 15-ти плоскостных предметов, у которых диаметр каждого последующего тела отличался от предыдущего на 1,0 см. С помощью этих тел определяли способность кисти к захвату и удержанию геометрического тела возможно большего диаметра в течение 30 секунд. Полученные результаты сравнивали с результатами исследования здоровой кисти и оценивали как хорошие, удовлетворительные и неудовлетворительные.
Определяли подвижность кисти путем измерения объема движений в суставах. С этой целью использовали две градуированные линейки и угломер. Исследовали функции сгибания и разгибания, пронации и супинации, ротационных движений, отведения и шевеления в суставах пальцев и лучезапястном суставе. Полученные результаты сравнивали с данными здоровой кисти.
При подключении к базовому лечению вскрытия межфа-ланговых промежутков кисти с последующим дренированием риск развития рецидивов гнойно-некротических процессов в клинической группе был низким и составил 0,15. Оценка значимости дренажно-промывной системы в межфаланговых промежутках при оперативном лечении флегмоны кисти для развития рецидивов гнойно-некротических процессов позволила выявить, что критерий независимости х2 имел значение 4,54, был выше критического и свидетельствовал о достоверной статистической связи между оптимизацией хирургического лечения и склонностью к рецидивированию инфекционного процесса. В клиниче-
ской группе отсутствовало распространение процесса на сухожильные влагалища. В клинической группе в отдаленном послеоперационном периоде случаи тугоподвижности в пальцах кисти не было, встречаемость рубцовых контрактур в отдаленном послеоперационном периоде снизилась с 41,5% до 1,2%.
Проведение дополнительных разрезов с последующим дренированием и промыванием при хирургическом лечении флегмон кисти у детей является перспективным и оправданным.
Выводы. У детей при хирургическом лечении флегмон кисти рекомендовано использование следующей тактики: в возрасте до 1 года после некрэктомии необходимо осуществить вскрытие и дренирование межпальцевых промежутков, тыльной и ладонной поверхностей кисти, сухожильных влагалищ мышц. У детей от 1 до 3 лет целесообразно применять дренаж межпаль-цевых промежутков и тыла кисти. У детей от 3 до 7 лет и старше рекомендованы разрезы с последующим дренированием тыльной поверхности кисти. После выполнения разрезов в межпальцевых промежутках устанавливаются постоянные катетеры с последующим введением мирамистина либо раствора лавасепта. У детей при воспалительном процессе на тыльной поверхности кисти обязательное дренирование клетчаточных пространств ладонной поверхности кисти имеет цель профилактики тендова-гинитов. У детей старших возрастных групп показано вскрытие гнойного процесса только в зоне воспаления.
1.Мелешевич А.В. Панариций и флегмона кисти. Гродно,
2.Buck-Gr amcko D., Nigst H. Die handchirurgische Sprechstunde Hippokrates. Verlag Stuttgart, 2002.
З.Чадаев А.П., Любский А.С., Алексеев М.С., Бровкин А.Е. // Хирургия. 2001. № 7. С.70.
ДИАГНОСТИКА УРОЛОГИЧЕСКОЙ ПАТОЛОГИИ У НОВОРОЖДЕННЫХ И ГРУДНЫХ ДЕТЕЙ
Ключевые слова: новорожденные, урологическая патология
По данным ВОЗ, число детей, родившихся с пороками развития, не снижается. Очевидна их возрастающая роль в перинатальной заболеваемости и смертности. Снижение последней является одной из задач научных и организационных программ. Ранняя диагностика пороков развития мочевыделительной системы остается одной из наиболее сложных проблем в педиатрии и детской хирургии и представляет определенные трудности, вызванные скудностью клинической картины и физиологическими особенностями мочевой системы у детей данной возрастной группы. В связи с этим часто заболевания выявляются в поздние сроки, когда они приводят к достаточно тяжелой степени поражения мочевыделительной системы 3.
Цель - разработка комплексного подхода к диагностике урологической патологии у новорожденных и грудных детей.
Материалы и методы. Исследование проводилось на базе ДРКБ (г. Владикавказ) за период с 1996 г. по 2006 г. Нами обследовано 134 ребенка в возрасте от 2 дней до 1 года.
Результаты. Из 134 детей у 38 новорожденных урологическая патология выявлена внутриутробно с помощью ультразвукового исследования (у 23 - гидронефроз, у 12 - мегауретер, у 2 -экстрофия мочевого пузыря, у 1 - подковообразная почка).
Они госпитализированы в урологическое отделение и обследованы в ранние сроки. Поводом для урологического обследования у остальных 96 детей послужили такие симптомы, как нарушения диуреза, наличие пальпируемого объемного образования брюшной полости, изменения качества мочи, синдром сливового живота, неясные общеинфекционные симптомы, необоснованные подъемы температуры тела.
Нами разработан следующий алгоритм обследования. Обследование новорожденных начиналось с УЗИ мочевой системы. Выбор данного метода в качестве первоочередного основан на том, что УЗ-исследование является неинвазивным методом,
отличается простотой выполнения и информативностью, безопасен для пациента. С помощью УЗИ диагностировали гидронефроз, кистозные образования почек, аномалии развития почек, мегауретер, почечно-мочеточниковый рефлюкс.
Для определения почечного кровотока использовали импульсную доплерографию с помощью специального карандашного датчика с частотой 5 мГц. Сканирование почек осуществляли в трех взаимноперпендикулярных плоскостях: продольной,
поперечной и коронарной. Гемодинамические нарушения в почках выражались в меньшей степени или отсутствовали у новорожденных с обструктивными нефропатиями, более значительные нарушения кровотока в почках отмечались в старшем возрасте. У 40 детей анализ сонограмм позволил выявить утолщение стенок лоханки и мочеточника, что расценивалось нами как акустический критерий пиелонефрита, который даже при нормальных клинико-лабораторных данных позволяет достоверно констатировать осложненную обструкцию мочевой системы и предопределить тактику лечения.
Решающее значение в диагностике пороков развития и заболеваний мочевой системы мы отводим рентгенологическим методам исследования - экскреторной урографии при патологии верхних мочевых путей. У новорожденных проводили инфузи-онную урографию. В качестве контрастного вещества использовали омнипак в дозе 4 мл/кг массы тела с равным объемом 5% глюкозы. От урографии воздерживались у новорожденных до двух недель, в случаях повышенной чувствительности ребенка к контрастному препарату и наличии признаков почечной недостаточности. Для выявления патологии нижних мочевых путей выполняли микционную цистографию, уретроцистоскопию. Эндоскопические методы применялись нами у новорожденных ограниченно, только при абсолютных показаниях.
При недостаточной информации о функциональном состоянии почек и мочевых путей (10 детей) проводили динамическую сцинтиографию, как метод раздельной оценки паренхиматозной функции почек. В результате комплексного обследования у 134 детей выявлена патология мочевыделительной системы, которая представлена на табл. Завершающим методом диагностики явились патоморфологические исследования пораженных сегментов мочевых путей после удаления их во время операции или с помощью чрезкожной пункционной биопсии почки.
Результаты ранней диагностики урологической патологии у новорожденных и грудных детей
ДИАГНОЗ Число Возраст
больных новорожденные грудные
Гидронефроз 38 16 22
Мегауретер 36 6 30
Удвоение почки 19 19
Инфравезикальная обструкция: А) клапан уретры 5 5 3
Б) стеноз уретры 3
Поликистоз почек 8 8
Мультикистоз почки 6 6
Экстрофия мочевого пузыря 4 4
Подковообразная почка 1 1
ИТОГО 134 30 104
Выводы. Широкое использование УЗИ мочевыделительной системы в пре- и перинатальном периодах способствует раннему выявлению врожденной урологической патологии. При выявлении у новорожденных и грудных детей даже одного признака патологии мочевой системы следует проводить полное урологическое обследование. Своевременное выявление и правильная тактика лечения врожденной патологии мочевой системы позволяет уменьшить число осложнений и неблагоприятных исходов.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Панариций: причины появления, симптомы, диагностика и способы лечения.
Определение
Панариций — острое гнойное воспаление тканей пальцев верхних и, реже, нижних конечностей. Заболевание считается одним из самых частых в гнойной хирургии и составляет до 46% случаев от всех обращений, потребовавших хирургического лечения в условиях поликлиники.
Причины возникновения панариция
Панариций может образоваться в результате видимой или незаметной микротравмы. В 33% случаев за развитие воспаления ответственны мелкие колотые раны и занозы, в 25% – ссадины и мелкие царапины. Причиной панариция могут стать травмы, полученные во время выполнения маникюра или инъекции, заусенцы, вросший ноготь (из-за особенностей его анатомического строения или неправильного подстригания).
Некоторые химические вещества, попадая на кожу пальцев, оказывают на нее токсическое воздействие, создавая условия для проникновения возбудителей инфекции. Через поврежденную кожу пальца проникают бактерии, которые и вызывают гнойно-воспалительный процесс, – чаще всего речь идет о золотистом стафилококке, реже – о стрептококке, кишечной палочке, протее. Микрофлора в гнойном очаге может быть представлена микробными ассоциациями из трех и более микроорганизмов.

К возникновению панариция предрасполагают сахарный диабет 2 типа, авитаминозы, нарушения кровообращения.
Классификация заболевания
Выделяют поверхностные и глубокие формы панариция.
- костный панариций (острый и хронический),
- сухожильный панариций,
- суставной панариций,
- костно-суставной панариций,
- пандактилит.
Симптомы панариция
Основным симптомом заболевания всегда является интенсивная пульсирующая боль. Иногда боль усиливается в ночные часы и лишает пациента сна, служит признаком необходимости срочного обращения за медицинской помощью и, возможно, проведения операции.
Гнойник может самопроизвольно вскрыться, в этом случае болевой синдром стихает, что создает ложное впечатление улучшения состояния.
Боль сопровождается отеком мягких тканей и покраснением, но при глубоких панарициях покраснение может отсутствовать или быть незначительным. По мере развития воспалительного процесса ограничивается движение в пальце, особенно при глубоких формах с поражением суставов или сухожилий. У пациента могут наблюдаться повышением температуры тела, слабость, недомогание.
Самой легкой формой заболевания считается кожный панариций. Гнойный очаг формируется в толще кожи, под эпидермисом, в то время как остальные ткани не поражены. Образующийся серозный, серозно-геморрагический или гнойный экссудат приводит к отслойке эпидермиса и формированию пузыря. Около 80% случаев кожного панариция регистрируются на ладонной поверхности пальцев.
Одна из самых частых форм заболевания – подкожный панариций, проявляющийся воспалительным процессом в подкожной жировой клетчатке. В 80-90% случаев процесс локализуется на ладонной поверхности дистальной фаланги, чаще I, II и III пальцев руки. Воспаление клетчатки вызывает отек, который сдавливает сосуды и вызывает сильные пульсирующие боли.
Пораженная фаланга становится красной, отечной, горячей. При этой форме температура может повышаться до 38оС.
При подногтевом панариции воспаление развивается под ногтевой пластиной в результате травмы или попадания занозы под ноготь. Пациент испытывает постоянную распирающую боль, усиливающуюся при надавливании на ноготь, палец отекает, становится горячим. Накапливающийся гнойный экссудат может отслоить ноготь. Возможно повышение температуры тела.
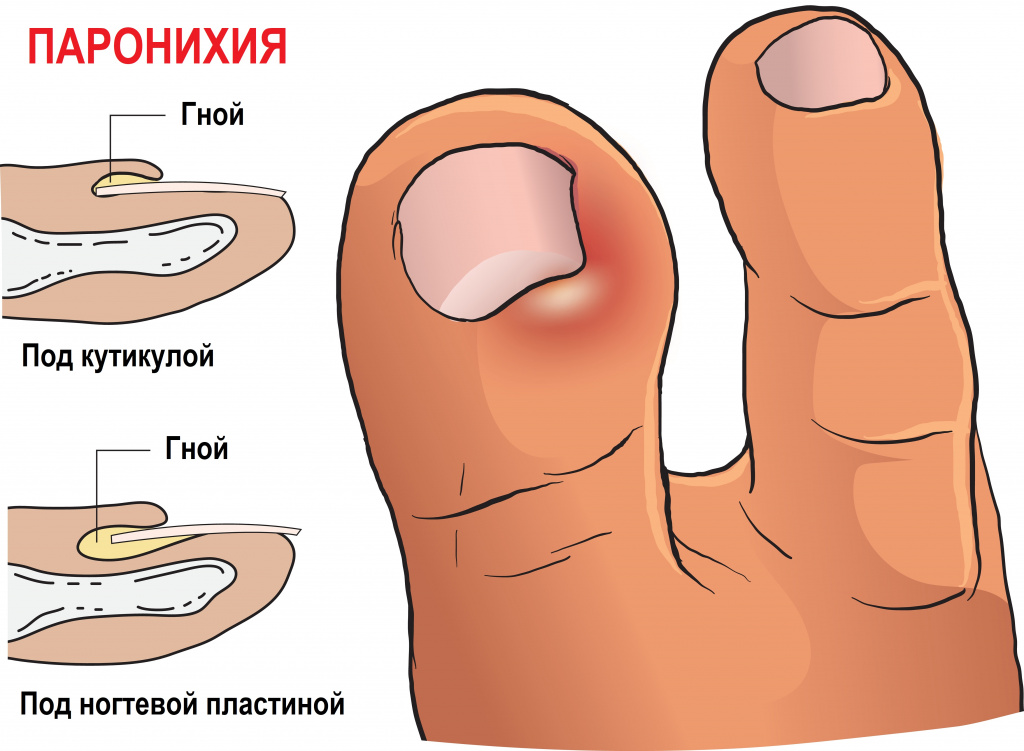
Паронихия – это воспаление околоногтевого валика, которое возникает при его повреждении. Валик становится отечным, гиперемированным, гной скапливается под ногтевым валиком и может просвечивать через кожу.
Сухожильный панариций (гнойный тендовагинит) представляет собой глубокую, тяжелую форму воспалительного процесса, который чаще всего развивается в результате позднего или неэффективного лечения подкожного панариция или как следствие травмы. При сухожильном панариции пациенты отмечают интенсивную дергающую и распирающую боль вдоль всего сухожилия, усиливающуюся при сгибании и разгибании пальца, пассивные движения сильно ограничены. Палец может находиться в вынужденном полусогнутом положении и отекать на всем протяжении, иногда воспаление переходит на кисть и предплечье.
Суставной панариций возникает как следствие прогрессирования подкожного и сухожильного панариция, а также в результате травмы тыльной стороны пальца с первичным повреждением капсулы межфалангового сустава. При суставном панариции воспаляются межфаланговые или пястно-фаланговые суставы, в которых накапливается воспалительный экссудат. В результате палец приобретает колбообразный или веретенообразный вид с максимальным объемом в области сустава. Кожа над суставом становится гладкой, блестящей и гиперемированной. Боль усиливается при попытке совершить любое движение. Длительное течение заболевания чревато разрушением суставных хрящей и распространением процесса на костную ткань.
Костный панариций – это воспалительный процесс, протекающий в костях пальцев. Он возникает в результате перехода инфекции с окружающих тканей на кость или как следствие обширной травмы. Для костного панариция характерна распирающая, пульсирующая боль. При локализации процесса на ногтевой фаланге возникает отек, а фаланга становится похожа на колбу. Кожа сильно гиперемирована, горячая. Появляются признаки общей интоксикации: повышение температуры, озноб, головная боль, слабость. Формирование гнойного свища свидетельствует о развитии хронического панариция.
Наиболее тяжелая гнойная патология пальца – пандактилит. Он характеризуется поражением всех анатомических структур пальца (кожи, клетчатки, сухожилий, костей и суставов) и распространяется минимум на две фаланги.
Пандактилит чаще всего рассматривается как следствие запоздалого/недостаточного лечения других форм панариция или как результат обширной травмы пальца. На всем протяжении воспаления наблюдается отек, палец резко утолщен, имеет багрово-синий цвет, очень болезненный, активные и пассивные движения невозможны. Часто образуются множественные свищи, из которых сочится гнойное отделяемое. Палец принимает вынужденное полусогнутое положение. Наблюдается общая интоксикация, регионарные лимфоузлы увеличены и болезненны. При этой форме очень высок риск потери фаланги или всего пальца.
Диагностика панариция
Диагноз панариция врач может установить на основании клинического осмотра. Рекомендованные обследования:
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Абсцесс: причины появления, симптомы, диагностика и способы лечения.
Определение
Абсцесс - это ограниченное скопление гноя, окруженное оболочкой (пиогенной капсулой).
Причины появления абсцессов
Абсцессы могут быть асептическими и септическими. Асептические абсцессы развиваются после подкожного введения некоторых раздражающих химических веществ (скипидара, керосина, хлоралгидрата, хлористого кальция), которые вызывают некроз тканей. При этом некротизированные ткани растворяются лейкоцитами с образованием гноя, не содержащего микробов. Септические абсцессы чаще всего формируются в результате внедрения в ткани микроорганизмов (стафилококков, стрептококков, кишечной палочки, синегнойной палочки и т.д.), вызывающих гнойное воспаление.
Инфекционные агенты (бактерии, грибы) могут проникать в организм экзогенно через поврежденный эпителий кожи или слизистые оболочки (входные ворота) или эндогенно (из очага инфекции в самом организме).
Открытые повреждения кожи, инородные тела, медицинские манипуляции (инъекции, блокады, пункции), гематомы, серомы, а также гнойно-воспалительные процессы в организме (сепсис, гнойный лимфаденит, гнойный лимфангит, гнойный тромбофлебит, фурункул, карбункул и др.) могут приводить к развитию абсцесса.
На месте внедрения инфекции и воспаления ткани отмирают, и формируется гнойная полость, вокруг которой на границе со здоровой тканью начинает образовываться пиогенная капсула. Эта капсула служит своеобразным биологическим барьером, препятствующим распространению инфекции по организму. Чем дольше существует абсцесс, тем толще становится пиогенная капсула.
По распространенности самым частым считается абсцесс кожи, подкожной жировой клетчатки и мышечной ткани, хотя возникнуть он может в любом органе и ткани.
При прогрессировании гнойного процесса повышается риск разрыва пиогенной капсулы, в результате чего инфекционный процесс распространяется за ее пределы.
Классификация абсцессов
По причине возникновения:
а) стафилококковые;
б) стрептококковые;
в) пневмококковые;
г) колибациллярные;
д) гонококковые;
е) анаэробные неспорообразующие;
ж) клостридиальные анаэробные;
з) смешанные;
и) грибковые и др.
По происхождению и путям проникновения инфекции:
- метастатические (гематогенные) абсцессы, возникающие из отдаленных гнойных очагов;
- контактные абсцессы, происходящие из близлежащих очагов воспаления;
- травматические абсцессы, являющиеся следствием открытых и проникающих повреждений;
- криптогенные абсцессы, происхождение которых и пути проникновения инфекции установить не представляется возможным.
- поверхностные (поражение кожи и подкожной клетчатки);
- глубокие (в органах и тканях):
- острые абсцессы;
- хронические абсцессы.
Симптомы абсцессов
В начальной стадии формирования поверхностного абсцесса определяется отграниченная болезненная припухлость, горячая на ощупь. Через 3-4 дня в центре появляется размягчение, кожа в центре инфильтрата становится более тонкой и темной, а границы абсцесса - более четкими. На 4-7 сутки абсцесс вскрывается и из него выходит гнойное содержимое. При этом болезненность воспаленного участка уменьшается.
Абсцесс печени чаще всего возникает в результате распространения инфекции по сосудистому руслу из воспалительных очагов других органов или тканей брюшной полости (аппендицит, холангит, язвенный колит). Абсцессы могут быть одиночными или множественными. Для заболевания характерна высокая температура, озноб, боль и тяжесть в области печени, увеличение ее размеров.
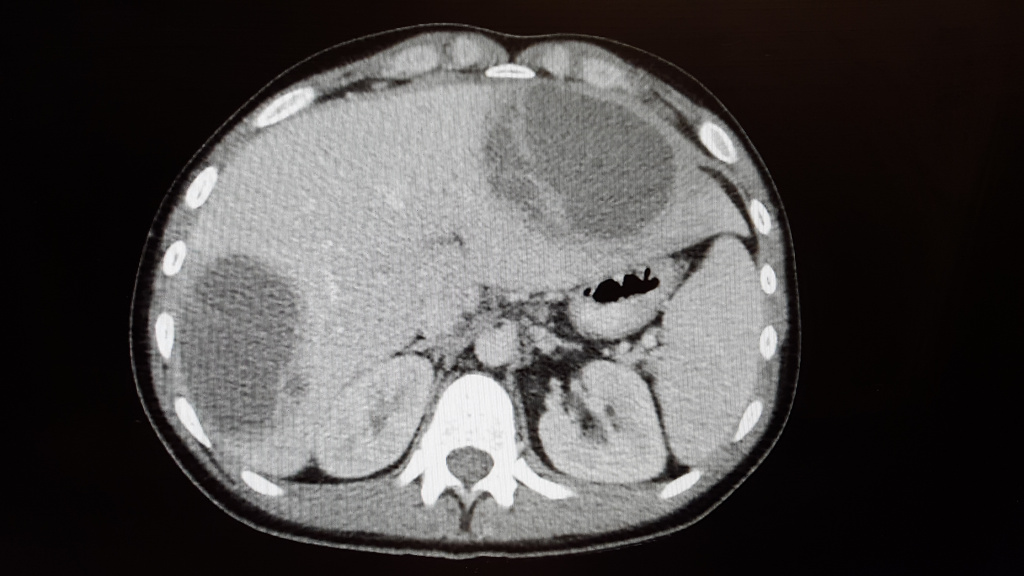
Абсцесс в печени
Абсцесс головного мозга может сформироваться в результате проникновения инфекции из среднего или внутреннего уха, придаточных пазух носа, из гнойных очагов мягких тканей головы. Абсцессы могут быть одиночными или множественными. Заболевание начинается с интоксикации, симптомов повышения внутричерепного давления (головной боли, тошноты и рвоты, сонливости, недомогания, нарушения памяти, расстройства внимания, нарушения зрения). Затем присоединяются общемозговые (головокружение, психомоторное возбуждение, галлюцинации) и очаговые симптомы (неврологические симптомы, свойственные местному поражению определенных структур центральной или периферической нервной системы).
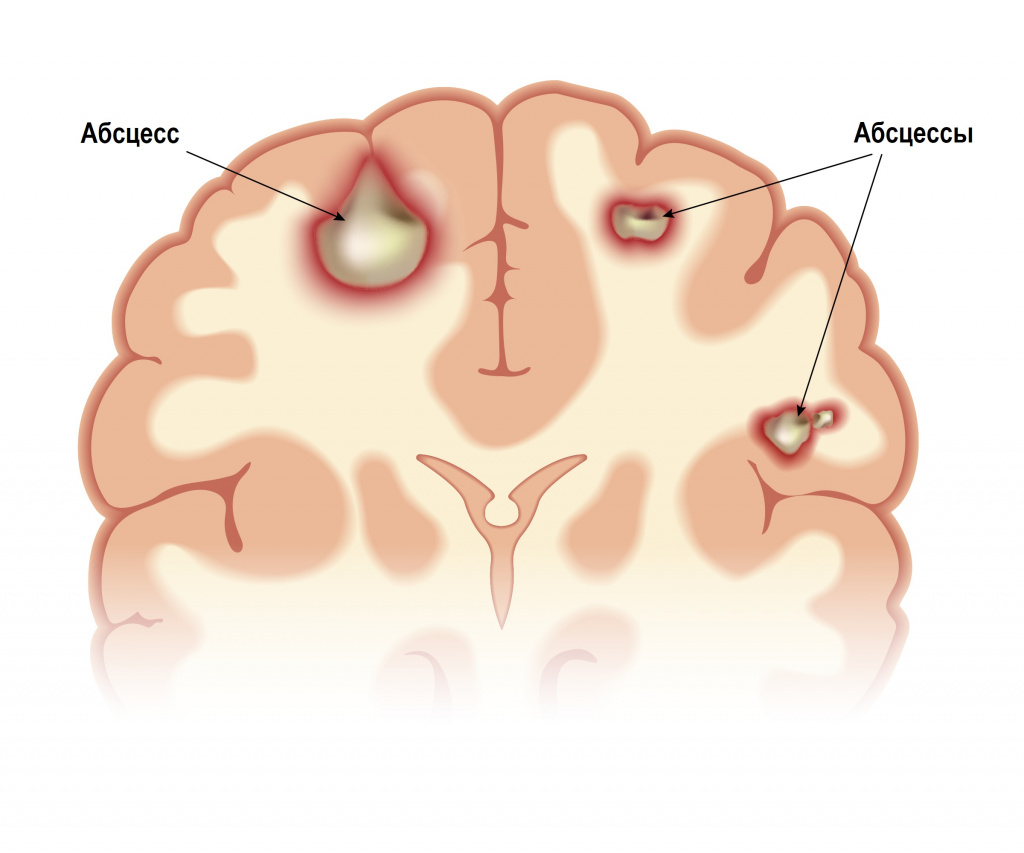
Внутримозговой абсцесс
Абсцессы брюшной полости встречаются в 30-35% у больных гнойным перитонитом. Обычно они располагаются в отлогих областях живота: подпеченочном, поддиафрагмальном пространстве, в подвздошных ямках и т.п. Клинике формирования абсцесса соответствует ухудшение состояния после небольшого светлого промежутка на фоне воспалительного заболевания брюшной полости (аппендицита, холецистита), наблюдается усиление интоксикации и боль в животе.
Внутрикостный абсцесс Броди – это отграниченный некроз губчатого вещества кости с преследующим расплавлением и образованием полости. Локализуется обычно в проксимальном отделе большеберцовой кости. Заболевание начинается с чувствительности к надавливанию. Нередко очаги ничем не проявляются, и боль носит эпизодический характер. Повышение температуры, озноб и другие симптомы интоксикации, как правило, отсутствуют, процесс может длиться годами.
Диагностика абсцессов
Диагностика поверхностного абсцесса не представляет трудностей. Диагноз устанавливается по совокупности жалоб и осмотра. Диагностика глубоких абсцессов может быть основана на результатах дополнительных лабораторных и инструментальных методов исследования.
-
Клинический анализ крови: общий анализ, лейкоформула, СОЭ (с микроскопией мазка крови при наличии патологических сдвигов) покажет присутствие в организме воспалительного процесса.
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Читайте также:

