Химиотерапия при эхинококкозе печени
Обновлено: 25.04.2024
1 ГБОУ ВПО Саратовского ГМУ им. В.И. Разумовского Минздрава России, кафедра хирургии и онкологии ФПК и ППС
В основу работы положен опыт хирургического лечения больных эхинококкозом печени (ЭП) с локализацией кист в 7-8 сегментах. Ключевыми этапами при выполнении эхинококкэктомии (ЭЭ) являются предотвращение рецидива заболевания и ликвидация остаточной полости. Оптимальное решение этих задач в первую очередь зависит от адекватного хирургического доступа. Использование торакофренолапаротомии облегчает задачу хирурга, позволяет снизить количество ранних послеоперационных осложнений и улучшить отдаленные результаты. К рецидиву ЭП приводят недиагностированные эхинококковые кисты, сохранение в фиброзной капсуле зародышевых элементов и обсеменение ими брюшной полости. Первым шагом профилактики рецидива заболевания является осуществление надежной антипаразитарной обработки полости кисты. Для обработки фиброзной капсулы использовали 90-100 % глицерин, 3 % перекись водорода. Следующим этапом операции, обеспечивающим благоприятное течение раннего послеоперационного периода, является выявление и ликвидация цистобилиарных свищей (ЦБС). При ЦБС с вовлечением сегментарных и более мелких протоков ликвидацию осуществляли плазменной коагуляцией устья свища и ушиванием атравматическим шовным материалом. Ликвидацию остаточной полости при неосложненном течении заболевания проводили путем иссечения свободной фиброзной капсулы и вворачивания оставшейся части в санированную полость, у части больных остаточные полости были ликвидированы методом капитонажа, при наличии ЦБС на 2-3 дня в остаточной полости оставляли микроирригатор. Выполнение закрытой и полузакрытой эхинококкэктомии при ЭП в 7-8 сегментах остается наиболее распространенной операцией. Использование торакофренолюмботомического доступа в этих случаях позволяет тщательно обрабатывать полость кисты и ликвидировать ЦБС, что снижает частоту ранних послеоперационных осложнений и улучшает отдаленные результаты.

2. Журавлев В.А., Гидатидозный эхинококкоз печени. Вопросы хирургического лечения / В.А. Журавлев, В.М. Русинов, Н.А. Щербакова // Хирургия. - 2004. - № 4. - С. 51 - 54.
3. 3.Радикальные операции при первичном и резидуальном эхинококкозе печени / В.А. Вишневский, М.Г. Ефанов, Р.З. Икрамов, Н.А. Назаренко // Анналы хирургической гепатологии . - 2011. Т. 16, № 4. - С.25 - 33.
4. Сберегающая хирургия при эхинококкозе печени / Лотов А.Н., Н.Р. Черная, С.А. Бугаев и соавт. // Анналы хирургической гепатологии. - 2011. - Т. 16, № 4. - С.11 - 18.
5. Химиотерапия и проблемы рецидивного эхинококкоза печени / Ф.Г. Назыров, А.В. Девятов, М.М. Акбаров, У.М. Махмудов, А.Х. Бабоджанов // Анналы хирургической гепатологии . - 2011. Т. 16, № 4. - С.19 - 24. Ташкент, Узбекистан.
6. Эхинококкоз печени: современные тенденции в хирургической тактике / Скипенко, О.Г. Паршин, В.Д. Шатверян и соавт. // Анналы хирургической гепатологии . - 2011. Т. 16, № 4. - С. 34.
7. Эволюция методов хирургического лечения эхинококкоза печени / Шевченко Ю.Л., Харнас С.С., Самохвалов А.В., Лотов А.Н. // Хирургия. - 2004. - 7. - С. 49.
Введение
В настоящее время в России и странах СНГ эхинококкоз печени (ЭП) является одной из наиболее распространенных составляющих современной хирургической гепатологии. В последние годы вопреки широкому внедрению высокоинформативных методов обследования и высокотехнологичных методов хирургического лечения больных с ЭП, их количество продолжает увеличиваться, более того, отмечается заметный рост частоты его осложненных форм и рецидивов заболевания [3,6]. По мнению многих хирургов решить эту проблему можно за счет выполнения радикальных операций в объеме резекции печени и перицистэктомии [2,3,7 и др.], однако доля этих операций у них составляет 27,33 %. Следует отметить, что проблема рецидива ЭП даже после выполнения радикальных вмешательств не может быть полностью решена. А.Н. Лотов с соавт. (2011) подчеркивают, что при выборе метода операции следует принимать во внимание паразитарную природу заболевания и реальную возможность повторного заражения [4]. Ф.Г. Назыров с соавт. (2011), анализируя результаты лечения 724 больных ЭП, пришел к выводу, что рецидив этого заболевания строго связан с областью первичной локализации паразитарной кисты лишь в 26,6 % наблюдений, что ставит под сомнение целесообразность радикальных операций, сопровождающихся достаточно большим количеством осложнений [1,5].
Главными критериями оценки эффективности хирургического лечения ЭП являются низкий уровень ранних послеоперационных осложнений, ликвидация остаточной полости, снижение количества рецидивов заболевания. Все эти проблемы успешно решаются путем совершенствования методик закрытой эхинококкэктомии.
Материалы и методы
В основу работы положен опыт хирургического лечения 87 больных ЭП с локализацией кист в 7-8 сегментах. У 9 больных кисты были небольших размеров до 5 см в диаметре, у 39 до 10 см, у 31 до 15 см и у 8 более 15 см.
Неосложненное течение заболевания диагностировано у 58 человек (66,7 %), у 29 (33,3 %) имело место осложненное течение в виде наличия цистобилиарных свищей (17), объизвествления кист (3), нагноения (8), у одного больного произошла перфорация кисты с прорывом ее содержимого в плевральную полость.
Сравнение результатов основных клинических и биохимических методов исследования крови у больного показал, что заметных различий их в лабораторных показателях нет. Однако по мере увеличения размеров кисты отчетливо прослеживается появление и нарастание признаков скрытой печеночной недостаточности. Так при размере кист более 15 см в диаметре у больных в 80 % наблюдений была отмечена гипо и диспротеинемия, в 40 % случаев - увеличение АСТ и АЛТ. При осложненном течении заболевания выявлено увеличение С-реактивного белка.
Ключевыми этапами при выполнении эхинококкэктомии (ЭЭ) являются надежное предотвращение рецидива заболевания и максимально возможная ликвидация остаточной полости. Достижение необходимого эффекта при выполнении этих этапов операции возможно лишь при обеспечении полноценной ревизии полости кисты и свободных манипуляций для ликвидации ЦБС и остаточной полости. Оптимальное решение этих задач в первую очередь зависит от адекватного хирургического доступа.
При локализации кист в 7-8 сегментах печени даже при мобилизации правой доли печени наибольшие сложности возникают при ликвидации ЦБС и остаточной полости. При больших размерах кист манипуляции, выполняемые из правостороннего подреберного доступа весьма затруднительны. Наш опыт показывает, что использование торакофренолапаротомии облегчает задачу хирурга и позволяет снизить количество ранних послеоперационных осложнений и улучшить отдаленные результаты.
Из 87 больных с локализацией кист на диафрагмальной поверхности печени у 38 закрытая и полузакрытая эхинококкэктомии были выполнены из трансторакального доступа. Противопоказанием для использования этого доступа считаем размеры кист до 5 см в диаметре (12 больных), гигантские кисты более 20 см в диаметре (4 больных), а также нагноение кисты (8 больных).
Известно, что к рецидиву ЭП приводят наличие недиагностированных мелких эхинококковых кист, сохранение в фиброзной капсуле внедренных зародышевых элементов и обсеменение ими брюшной полости во время операции.
Первым шагом профилактики рецидива заболевания является осуществление надежной антипаразитарной обработки полости кисты. С этой целью используется различные активные химические вещества, однако большинство из них обладают или низкой противопаразитарной активностью или высокой токсичностью. Наиболее выраженным губительным действием на зародышевые элементы гидатидного эхинококка обладают 90 %-100% глицерин и 3 % перекись водорода. Более того, оболочки живых кист непроницаемы для этих веществ, что исключает их токсическое воздействие на организм больного.
У 58 больных с неосложненным течением заболевания для антипаразитарной обработки фиброзной капсулы использовали 90-100 % глицерин, при осложненном ЭП у 29 больных применяли 3 % перекись водорода.
Следующим этапом операции, обеспечивающим благоприятное течение раннего послеоперационного периода, является выявление и ликвидация цистобилиарных свищей. Это осложнение было выявлено у 17 больных, следует отметить, что при локализации кист в 7-8 сегментах ни разу не встретились ЦБС с тяжелой желтушной формой течения, обусловленной прорывом содержимого кисты в крупные желчные протоки. При выявлении ЦБС с вовлечением сегментарных и более мелких протоков, ликвидацию их осуществляли плазменной коагуляцией устья свища и ушивания его атравматическим шовным материалом.
Ликвидацию остаточной полости при неосложненном течении заболевания у 49 больных выполняли путем иссечения свободной фиброзной капсулы и вворачивания оставшейся ее части в санированную полость, у 37 больных остаточные полости были ликвидированы методом капитонажа, при наличии ЦБС на 2-3 дня в остаточной полости оставляли микроирригатор.
Осложнения в раннем послеоперационном периоде развились у 14 больных (16,1 %), у 4 больных 4,6 % эхинококкэктомия была выполнена из торакотомного доступа, у 10 - 11,5 % лапаротомного (табл.1).
Эхинококкоз остается чрезвычайно актуальной проблемой не только медицины, но и социальной сферы. Наблюдается увеличение как числа заболевших, так и количества осложненных форм эхинококкоза [2, 3], при этом до 15% больных составляют дети до 14 лет. Несмотря на заметные успехи в диагностике и лечении данного заболевания, высокой остается частота до- и послеоперационных осложнений, показатель рецидивов заболевания колеблется от 2,7 до 30%, в ряде регионов летальность составляет 0,9-38,8% [2, 8, 9].
Перечисленные выше факторы требуют неотложных мер для комплексного решения проблем, касающихся диагностики, лечения и профилактики заболевания.
Традиционно в медицинской практике основным скрининговым методом выявления эхинококкоза служит УЗИ органов брюшной и грудной полости, рентгенография грудной клетки. В то же время в научной литературе недостаточно полно и однозначно определена роль иммуноферментного анализа (ИФА) в диагностике данного заболевания.
При лечении в зависимости от стадии заболевания, размеров паразитарных кист применяются различные методы: миниинвазивные (перкутанная пункционно-аспирационная эхинококкэктомия под контролем УЗИ или КТ, видеоторако- и видеолапароскопические вмешательства), традиционные эхинококкэктомия, перицистэктомия и резекция печени. Доказана достаточная эффективность консервативного лечения албендазолом, которое по рекомендации ВОЗ может применяться как самостоятельный метод [8, 11, 12, 15]. По данным некоторых авторов [11, 13], в 10-20% наблюдений албендазол оказывает угнетающее воздействие на белые и красные кровяные тельца и выраженное гепатотоксическое действие, проявляющееся резким повышением уровня трансаминаз. Однако исследований в области, касающейся методов консервативного лечения эхинококкоза у детей, недостаточно [4, 5]. В то же время многие авторы едины во мнении о необходимости послеоперационной противопаразитарной химиотерапии [3, 14]. Возникает проблема более глубокого анализа возможностей использования противопаразитарной химиотерапии как консервативного метода лечения эхинококкоза в педиатрической практике, что являлось целью нашего исследования.
Материал и методы
Тактику лечения эхинококкоза у детей выбирали в зависимости от размеров паразитарных кист и стадии заболевания, отдавая предпочтение щадящим, малотравматичным методам. При наличии эхинококковых кист диаметром до 35 мм отдавали предпочтение консервативной химиотерапии как самостоятельному методу лечения. Она была проведена в 7 наблюдениях при эхинококковых кистах печени и легких.
При единичных паразитарных кистах малых и средних размеров (до 100 мм), расположенных поверхностно, выполняли видеолапароскопическую эхинококкэктомию из печени. Операция произведена 75 пациентам, что составило 40,5% всех оперированных детей с эхинококкозом печени, выявленных со дня внедрения метода. Видеоторакоскопическая эхинококкэктомия из легких выполнены 11 детям.
При эхинококковых кистах больших и гигантских размеров, при множественном поражении органа и при локализации паразитарной кисты в глубине паренхимы проводилась традиционная эхинококкэктомия с ликвидацией остаточной полости.
Результаты и обсуждение
Башкортостан является эндемичным по эхинококкозу, где отмечается тенденция к увеличению количества больных детей. Считается, что у детей в отличие от взрослых чаще встречается эхинококкоз легкого [7, 8]. Нами также отмечено, что с 1974 по 1998 г. все наблюдения изолированного и сочетанного поражения легкого составили 53,9%, печени - 50,3%. Однако с 1999 по 2007 г. чаще диагностируется эхинококкоз печени (59,2%), чем легких (45,6%). Это, очевидно, связано с периодом широкого внедрения метода ультразвуковой диагностики заболеваний органов брюшной полости. Данный метод диагностики эффективен при паразитарных кистах малых и средних размеров. С 1999 по 2007 г. при ультрасонографии кисты, выявленные у 79,3% детей, имели малые и средние, у 20,7% - большие и гигантские размеры. Ранняя диагностика, позволяющая обнаружить кисты малых размеров, предоставляет дополнительные возможности для выбора более щадящих методов лечения.
ИФА, выполненный до операции у 79 детей с эхинококкозом печени, позволил выявить высокий титр антител у 38 (48%), низкий титр у 30 (38%), ложноотрицательный результат получен в 11 (13,9%) наблюдениях (табл. 1). Точность метода составила 91%, чувствительность - 86%. У 6 детей с ложноотрицательным результатом через 3-6 мес после операции обнаружены антитела, в том числе у 4 больных отмечено появление низкого, у 2 - высокого титра антител. К концу года у большинства оперированных больных прослеживается динамика снижения титра. Высокий титр антител в поздние сроки (т.е. через 3 года) во всех наблюдениях выявлялся при рецидиве заболевания. ИФА при поражении легких, выполненный до операции у 37 детей, выявил высокий титр в 10 (27%) наблюдениях, причем у 9 из 10 последних больных имелся осложненный эхинококкоз легких. Низкий титр антител отмечен у 11 (29,7%) и ложноотрицательный результат - у 16 (43,3%) пациентов. Точность метода составила 57%, чувствительность - лишь 55%. Через 3-6 мес после операции отмечается динамика повышения титра антител (табл. 2). К концу года после операции наблюдается тенденция к снижению титра антител. Высокий титр антител, выявленный через
3 года после операции, свидетельствовал о наличии рецидива заболевания.
Известно, что основные распространители эхинококкоза - собаки, одновременно они же являются проводниками не менее тяжелого паразитарного заболевания - токсокароза. В интересах исследования нами также проводилось определение антител к данному возбудителю. Известно, что прижизненно поставить диагноз токсокароза практически невозможно, поскольку обнаружить мигрирующие личинки довольно сложно [6]. Ведущими в диагностике токсокароза являются иммунологические методы. Титр специфической реакции 1:800 и выше свидетельствует о наличии заболевания с высокой долей вероятности, титр 1:200, 1:400 о носительстве токсокар или глазном токсокарозе [6, 9]. В наших исследованиях из 116 пациентов у 33 (28,4%) выявлен положительный результат реакции, в том числе у 25 при поражении печени, у 8 при поражении легких. У 23 (19,8%) детей титр антител составил 1:200, 1:400. Высокий титр антител выявлен у 10 (8,6%) обследованных: у 4 - 1:800, у 6 - в интервале от 1:1600 до 1:6400. После эхинококкэктомии титр антител на токсокароз сохранялся на прежнем уровне, в то же время при химиотерапии албендазолом отмечалась тенденция к значительному снижению титра. Указанные данные свидетельствуют скорее о наличии таксокароза в организме обследованных больных, чем о результате перекрестной реакции двух паразитарных заболеваний.

ИФА у последних 7 детей показал отсутствие антител к эхинококковому антигену у 5, низкий иммунный ответ у 2 больных. Основным диагностическим методом являлась ультросонография, на которой эхинококковая киста представлялась в виде округлого образования с четкими ровными гиперэхогенными контурами, что соответствовало I фазе жизнедеятельности паразита (см. рисунок а). Рисунок 1. Ультрасонограммы больного А., 8 лет. а - эхинококковая киста I сегмента печени. Двойной контур за счет хитиновой и фиброзной оболочек - эхографический признак, характерный для эхинококковых кист, в I фазе жизнедеятельности паразита не всегда определяется, что нередко вызывает определенные трудности при дифференциальной диагностике с непаразитарными кистами. В подобной ситуации у 2 больных нами проводилось динамическое наблюдение в течение 1-2 мес. За этот период отмечено увеличение размеров кисты, что характерно для эхинококкоза.
Консервативное лечение проводилось амбулаторно, только если пациент не относился к группе высокого риска. Препарат немозол (албендазол) назначался из расчета 10 мг/кг в сутки на 28 дней с перерывом 14 дней. 4 пациента получили 3 курса лечения, 3 детей - до 5 курсов. После каждого курса терапии проводился контрольный осмотр с клинико-лабораторным исследованием (общий анализ крови и мочи, биохимический анализ крови) и ультрасонографией печени. У большинства пациентов в конце первого курса лечения появлялись признаки интоксикации, связанные с разрушением оболочек эхинококковой кисты и всасыванием паразитарной жидкости, что сопровождалось повышением температуры тела, аллергическими проявлениями на коже, у 3 детей отмечены сыпь по типу крапивницы, кожный зуд. Общий анализ крови показал повышение уровня эозинофилов крови до 5-6%. ИФА выявил наличие высокого титра антител у 2 (1:800), низкого титра у 3 (1:100-1:200) и отсутствие антител у
Достаточно характерной являлась эхографическая картина: изменялась форма паразитарной кисты, появлялся двойной, неровный внутренний контур за счет отслойки хитиновой оболочки и отмечалось постепенное уменьшение размеров паразитарной кисты (см. рисунок, б). Рисунок 1. Ультрасонограммы больного А., 8 лет. б - эхинококковая киста I сегмента печени после одного курса химиотерапии. При дальнейшем наблюдении киста имела вид неоднородного жидкостного образования с гиперэхогенными слоистыми линейными структурами в просвете. Через 4-5 мес после лечения на месте бывшей кисты определялся участок неоднородности паренхимы (см. рисунок, в). Рисунок 1. Ультрасонограммы больного А., 8 лет. в - эхинококковая киста I сегмента печени после 3 курсов химиотерапии.
Консервативное лечение также назначено 2 пациентам при сочетанном эхинококкозе печени и легких после эхинококкэктомии из печени (в одном наблюдении удалены 20 кист). После первого курса медикаментозного лечения прекратился рост эхинококковой кисты легкого, после третьего-четвертого курса на рентгенограмме на месте паразитарных кист определялись участки затемнения (кальцификаты).
Консервативное лечение эхинококкоза у детей являлось комплексным и состояла из противопаразитарной и сопроводительной (посиндромной) терапии. В период аллергических проявлений детям назначались десенсибилизирующие препараты, после первого курса - гепатопротекторы, после третьего курса - энзимотерапия (вобензим по схеме) и пробиотики. Ранее проведенные нами исследования показали, что у детей с эхинококкозом имеются значительные нарушения микрофлоры кишечника [10]. Наиболее вероятно, что данные изменения являются вторичными, как следствие токсического воздействия продуктов жизнедеятельности паразита, поэтому в послеоперационном периоде необходима терапия, направленная на восстановление микрофлоры кишечника. Кроме того, на основании определения гуморального звена системы иммунитета у детей с эхинококкозом выявлен комбинированный характер изменений, патогномоничных для иммунного дисбаланса, в связи с чем в комплексном лечении использовали иммуномодулятор полиоксидоний. Мы не являемся сторонниками проведения химиотерапии на дооперационном этапе, особенно при больших и гигантских кистах. Дело в том, что в связи с разрушением хитиновой оболочки усиливается всасывание паразитарной жидкости. Это приводит к выраженной сенсибилизации организма до операции, к тому же имеется опасность разрыва паразитарной кисты во время хирургического вмешательства. Первоначально, исходя из опасности токсического действия препарата, мы чрезвычайно осторожно использовали албендазол, только для профилактики рецидива заболевания при осложненных формах. Однако практика показала, что токсическое действие препарата удается снизить при его использовании в комплексе с сопроводительной терапией. В дальнейшем мы стали более широко внедрять комплексное лечение не только для профилактики, но и как самостоятельный метод при кистах малых размеров. Препарат действительно токсичен, в самом начале комплексного лечения в одном наблюдении потребовалась его отмена в связи с аллергической реакцией. Однако эффективность данного метода подтверждается практикой при комплексном и своевременном назначении сопроводительной терапии.
Профилактика рецидива заболевания чрезвычайно важна в связи тем, что ретроспективный анализ данных нашей клиники при эхинококкозе печени показал возникновение рецидива у 11 (4,6%) больных, при поражении легких - у 4 (2,2%). Рецидив выявлялся в сроки от 1 года до 3 лет. Кроме того, у 12 пациентов во время диспансерного наблюдения обнаружен эхинококк других органов. Это свидетельствует о том, что у детей нередки сочетанные поражения и эхинококк может находиться на разных стадиях развития.
Послеоперационная профилактическая химиотерапия проведена у 115 пациентов при поражении печени (67), легкого (39), при сочетанном поражении печени и легкого (15) и при редких локализациях паразита (4). С начала внедрения химиотерапии, т.е. за последние 5 лет, рецидива заболевания у наблюдаемых детей не было. Исключением является ребенок, оперированный по поводу эхинококковой кисты головного мозга, у которого наступил рецидив, несмотря на проведенную химиотерапию. Вероятно, это связано с тем, что немозол недостаточно проникает через гематоэнцефалический барьер.
Проведение противопаразитарной химиотерапии оправдано еще тем, что у 28,4% пациентов до операции и во время диспансерного наблюдения сохраняется высокий титр антител к токсокарозу. Албендозол (немозол) является активным антигельминтным средством, в том числе к токсокарозу. После проведения химиотерапии отмечается стойкая тенденция к снижению титра антител.
Наши исследования показали что, результаты химиотерапии в качестве самостоятельного метода лечения можно оценить как успешные во всех наблюдениях. Противопаразитарная химиотерапия является радикальным методом лечения эхинококкоза у детей при кистах малых размеров. Она должна проводиться под врачебным контролем и сопровождаться посиндромной терапией. Такая тактика дает возможность снизить до минимума побочные реакции. Профилактическая химиотерапия в послеоперационном периоде позволяет снизить до минимума вероятность возникновения рецидива заболевай и, кроме того, провести эрадикацию других паразитов, например возбудителя токсокароза.
Таким образом, широкое применение ультразвукового исследования в эндемичных очагах позволяет выявлять эхинокковые кисты малых размеров, что в свою очередь дает дополнительные возможности для консервативного лечения эхинококкоза у детей.
Консервативное лечение должно быть комплексным, т.е. состоять из противопаразитарной и посиндромной терапии.
Иммуноферментный анализ наряду с ультрасонографией во время диспансерного наблюдения способствует своевременному выявлению рецидива заболевания и проведению консервативного лечения.
Комплексное использование ранней диагностики и методов лечения позволяет существенно повысить эффективность лечения эхинококкоза у детей.
Эхинококкоз – это паразитарная инвазия личиночной стадией ленточного гельминта эхинококка, протекающая с поражением внутренних органов (печени, легких, сердца, головного мозга и др.) и образованием в них эхинококковых кист. Неспецифические симптомы эхинококкоза включают слабость, крапивницу, преходящее повышение температуры; специфические зависят от места локализации паразита и могут быть представлены локальными болями, тошнотой, желтухой, кашлем, очаговой неврологической симптоматикой, кардиалгией, аритмией и пр. Диагностика эхинококкоза основывается на данных инструментальных исследований (рентгена, сцинтиграфии, УЗИ, КТ) и серологических проб. Лечение эхинококкоза хирургическое.
МКБ-10
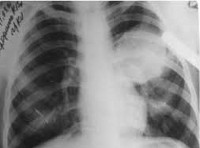
Общие сведения
Эхинококкоз – гельминтное заболевание из группы цестодозов, вызываемое паразитированием в организме человека эхинококка в стадии онкосферы. В мире наибольшая заболеваемость эхинококкозом отмечается в Австралии, Новой Зеландии, Северной Африке, Южной Америке, Южной Европе, Центральной Азии. В России гельминтоз встречается в Поволжье, Приуралье, Ставропольском и Краснодарском крае, Западной Сибири, на Дальнем Востоке.
В эндемичных регионах заболеваемость населения эхинококкозом достигает 5-10%. Распространенность эхинококкоза тесно связана с развитием животноводства. Учитывая тот факт, что при эхинококкозе могут поражаться различные внутренние органы, а единственно радикальным методом лечения является операция, заболевание лежит в сфере интересов торакоабдоминальной хирургии, нейрохирургии, кардиохирургии.

Причины эхинококкоза
Эхинококкоз человека вызывается личиночной стадией ленточного гельминта Echinococcus granulosus - лавроцистой. Окончательными хозяевами половозрелых гельминтов выступают животные (собаки, лисицы, волки, львы, рыси и др.), в кишечнике которых паразитируют цестоды. Человек, домашние и дикие травоядные животные (рогатый скот, свиньи, лошади, олени, лоси и др.) являются промежуточными хозяевами личиночных стадий и одновременно биологическим тупиком, поскольку не выделяют яйца эхинококка в окружающую среду и не могут служить источником инвазии.
Взрослые особи эхинококка – это мелкие гельминты длиной 2,5-8 мм и шириной 0,5-10 мм, имеющие головку с четырьмя присосками и двумя рядами крючьев, шейку и несколько члеников. В зрелых члениках содержатся яйца эхинококка с онкосферами и шестикрючной личинкой-зародышем внутри. Онкосферы выживают в большом диапазоне температур (от -30°С до +30°С), несколько месяцев сохраняются в почве, но вскоре погибают под действием солнечного света.
Из кишечника окончательного хозяина яйца с испражнениями выделяются во внешнюю среду. Заражение людей эхинококкозом происходит алиментарным (при употреблении загрязненных фекалиями овощей и фруктов, воды) или контактным путем (при разделке туш или контакте с животными, инвазированными эхинококком). Высокий риск заболеваемости эхинококкозом имеют лица, занятые животноводством и уходом за животными (животноводы, охотники, работники скотобоен и др.).
Патогенез
В ЖКТ человека под действием пищеварительных ферментов оболочка яйца и онкосферы растворяется, и наружу выходит личинка. С помощью крючьев она внедряется в слизистую кишки, откуда попадает в венозный кровоток и в портальную систему. Большая часть онкосфер оседает в печени; иногда через нижнюю полую вену онкосферы попадают в правые отделы сердца, а оттуда – в малый круг кровообращения и легкие. Реже через легочные вены и левые отделы сердца зародыши оказываются в большом круге кровообращения и могут быть занесены в любой орган: головной мозг, селезенку, почки, мышцы и др. В результате инвазии примерно в 70-80% случаев развивается эхинококкоз печени, в 15% - эхинококкоз легких, в остальных случаях происходит поражение других органов.
После оседания зародыша эхинококка в том или ином органе начинается пузырчатая или гидатидозная стадия развития паразита. Эхинококковый пузырь представляет собой кисту, покрытую двухслойно оболочкой, состоящей из внутреннего (зародышевого) и наружного (хитинового) слоев. Киста медленно увеличивается в размерах (примерно на 1 мм в месяц), однако спустя годы может достигать гигантских размеров. Внутри эхинококкового пузыря содержится прозрачная или беловатая опалесцирующая жидкость, в которой плавают дочерние пузыри и сколексы. Дочерние пузыри эхинококка могут образовываться и снаружи хитиновой оболочки; их общее количество может достигать 1000.
Проявления эхинококкоза связаны с сенсибилизирующим влиянием паразитарных антигенов и механическим давлением кисты на органы и ткани. Паразитирование эхинококка сопровождается выделением продуктов обмена, что приводит к развитию интоксикации и аллергической реакции замедленного типа. В случае полного разрыва кисты происходит истечение ее содержимого в плевральную или брюшную полость, что может вызвать анафилактический шок. Увеличивающаяся в размерах эхинококковая киста давит на окружающие структуры, нарушая функции пораженного органа. В некоторых случаях развивается нагноение кисты; реже возможно самопроизвольная гибель эхинококка и выздоровление.
Симптомы эхинококкоза
Эхинококкоз может бессимптомно протекать годами и десятилетиями; в случае возникновения клинической симптоматики патогномоничные признаки отсутствуют. Независимо от локализации паразита в организме, эхинококкоз проходит в своем развитии три стадии:
- I - бессимптомную. Течение латентного периода начинается от момента внедрения онкосферы в ткани и продолжается до тех пор, пока не появляются первые клинические признаки эхинококкоза.
- II - стадию клинических проявлений. Во время II стадии больных беспокоят боли в месте локализации кисты, слабость, крапивница, кожный зуд, а также специфические симптомы, обусловленные паразитированием кистозной формы эхинококка в том или ином органе.
- III - стадию осложнений. В стадии осложненного эхинококкоза может произойти разрыв кисты и истечение содержимого в брюшную или плевральную полость с развитием перитонита, плеврита. При нагноении эхинококковой кисты присоединяются высокая лихорадка, тяжелая интоксикация. Сдавление кистой органов и тканей может вызывать развитие механической желтухи, асцита, вывихов, патологических переломов.
Эхинококкоз печени
Для эхинококкоза печени характерны жалобы на тошноту, снижение аппетита, периодически возникающую диарею, тяжесть и боли в правом подреберье. Объективно обнаруживается гепатоспленомегалия; иногда эхинококковая киста печени пальпируется в виде округлого плотного образования. В случае сдавления кистой желчных протоков развивается механическая желтуха; при компрессии воротной вены возникает асцит, портальная гипертензия. Присоединение вторичной бактериальной флоры может приводить к формированию абсцесса печени. Наиболее тяжелым осложнением эхинококкоза печени служит перфорация кисты с развитием клиники острого живота, перитонита и тяжелых аллергических реакций. При этом происходит диссеминация эхинококков, в результате чего развивается вторичный эхинококкоз с множественный локализацией.
Эхинококкоз легких
Эхинококкоз легких протекает с повышением температуры тела, интоксикационным синдромом, болью в груди, кашлем, кровохарканьем. Давление кисты на легочную ткань приводит к формированию ателектазов легких. При прорыве пузыря в бронхи развивается сильный кашель, цианоз, нередко - аспирационная пневмония. Крайне опасным осложнением легочного эхинококкоза является прорыв кисты в плевру и перикард, что может привести к анафилактическому шоку, резкому смещению средостения, тампонаде сердца и внезапной смерти. Инфицирование эхинококковой кисты сопровождается формированием абсцесса легкого.
Эхинококкоз сердца
При эхинококкозе сердца беспокоят загрудинные боли, напоминающие стенокардию. Компрессия кистами венечных артерий может вызвать развитие инфаркта миокарда. Часто возникают нарушения ритма и проводимости: желудочковая тахикардия, неполная и полная блокады ножек пучка Гиса, полная поперечная блокада сердца. Причинами гибели пациента с эхинококкозом сердца могут стать злокачественные аритмии, сердечная недостаточность, тампонада сердца, кардиогенный шок, ТЭЛА, постэмболическая легочная гипертензия и др.
Эхинококкоз головного мозга
Клинка эхинококкоза головного мозга характеризуется гипертензионным синдромом и очаговой неврологической симптоматикой (нарушением чувствительности, парезами конечностей, эпилептиформными приступами).
Диагностика
Правильной диагностике эхинококкоза способствует подробно собранный эпидемиологический анамнез, указывающий на тесный контакт человека с животными, эндемичность заражения. При подозрении на эхинококкоз любой локализации назначаются серологические исследования крови (ИФА, РНИФ, РНГА), позволяющие обнаружить специфические антитела к эхинококку. Специфичность и чувствительность тестов достигает 80-98%. Примерно в 2/3 случаев оказывается информативной кожно-аллергическая проба - реакция Казони.
Диапазон инструментальной диагностики эхинококкоза включает ультразвуковые, рентгеновские, томографические, радиоизотопные методы. Перечень исследований зависит от локализации поражения:
- При эхинококкозе печени информативны УЗИ гепатобилиарной системы, ангиография чревного ствола (целиакография), МРТ печени, сцинтиграфия, диагностическая лапароскопия и др.
- Распознать эхинококкоз легких позволяет проведение рентгенографии легких и КТ грудной клетки, бронхоскопии, диагностической торакоскопии.
- Ведущими методами диагностики эхинококкоза головного мозга служат КТ или МРТ.
- При подозрении на поражение сердца выполняется ЭхоКГ, коронарография, вентрикулография, МРТ сердца.
При прорыве эхинококковой кисты в просвет полых органов сколексы паразита могут быть обнаружены в исследуемом дуоденальном содержимом, мокроте. Также в этих случаях прибегают к выполнению бронхографии, холецистографии, пункционной холангиографии. Эхинококковую кисту необходимо дифференцировать от альвеококкоза, бактериальных абсцессов, кист непаразитарной этиологии, опухолей печени, легких, головного мозга и пр.
Лечение эхинококкоза
Радикальное излечение эхинококкоза возможно только хирургическим путем. Оптимальным способом является проведение эхинококкэктомии – вылущивания кисты без нарушения целостности хитиновой оболочки. При наличии крупного пузыря вначале производится его интраоперационная пункция с аспирацией содержимого. Остаточная полость тщательно обрабатывается антисептическими растворами, тампонируется, дренируется или ушивается наглухо. В процессе операции важно не допустить попадания содержимого пузыря на окружающие ткани во избежание диссеминации эхинококка.
В случае невозможности иссечения кисты при эхинококкозе легкого выполняется клиновидная резекция, лобэктомия, пневмонэктомия. Аналогичная тактика используется при эхинококкозе печени. Если иссечение эхинококковой кисты печени представляется технически невозможным, осуществляется краевая, сегментарная, долевая резекция, гемигепатэктомия. В до- и послеоперационном периоде назначается противопаразитарная терапия препаратами празиквантел, альбендазол, мебендазол.
Прогноз и профилактика
В случае радикального удаления эхинококковых кист и отсутствия повторного заражения прогноз благоприятный, рецидивов эхинококкоза не возникает. В случае интраоперационной диссеминации сколексов через 1-2 года может возникнуть рецидив заболевания с формированием множественных эхинококковых пузырей и неблагоприятным прогнозом.
Эхинококкоз - лечение в Москве
Комментарии к статье
Вы можете поделиться своей историей болезни, что Вам помогло при лечении эхинококкоза.
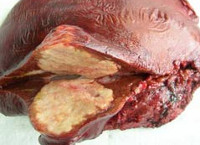
Эхинококкоз печени - это одно из наиболее распространенных паразитарных заболеваний, в основе которого лежит образование кист в печени. Основными признаками данной патологии являются общая слабость, существенное снижение аппетита, уменьшение массы тела, чувство тяжести в области печени, тошнота после употребления жареной или жирной пищи, расстройство стула. Для диагностики эхинококкоза печени применяются общий анализ крови, иммунологические методы, УЗИ органов брюшной полости, магнитно-резонансная томография, ОФЭКТ печени, лапароскопия и др. Наиболее эффективное лечение – оперативное иссечение кист; также применяются противогельминтные препараты.
МКБ-10
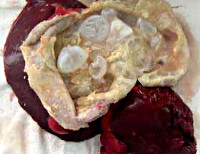
Общие сведения
Эхинококкоз печени – паразитарная патология, которая вызвана ленточным червем Echinococcus. Его личинки внедряются и размножаются в ткани органа, формируя кисты. Данное заболевание считается одним из наиболее распространенных гельминтозов. Встречаемость эхинококкоза в разных странах мира существенно различается. Болезнь в основном наблюдается в регионах, где активно занимаются сельскохозяйственной деятельностью.
Эхинококк паразитирует в человеческом организме исключительно в виде личинки, поражая не только печень, но и другие органы, такие как мозг и легкие. При этом вовлечение в процесс печени происходит в 65% всех случаев данного заболевания. Изучением патологии занимаются гастроэнтерология, инфектология. Лечение эхинококкоза входит в сферу деятельности таких специалистов, как инфекционист, гастроэнтеролог, гепатолог и хирург.

Причины
До внедрения в организм человека жизненный цикл эхинококка включает несколько стадий, которые следуют одна за другой. Заключительным хозяином среди домашних питомцев являются собаки и гораздо реже - кошки. Паразит обитает в кишечнике этих животных в виде зрелых червей. Их яйца с фекалиями переходят в водоемы, почву, на фрукты, овощи и так далее. В дальнейшем существует несколько вариантов попадания яиц в организм человека:
- Часть яиц проглатывается грызунами небольших размеров. В печени этих животных личинки эхинококка начинают созревать. После поедания грызунов дикими хищниками последние также заражаются паразитами. Поэтому при плохой термической обработке дичи охотники могут заболеть эхинококкозом печени.
- Другая часть яиц эхинококка оказывается в пищеварительной системе животных сельскохозяйственного предназначения, таких как свиньи, крупный рогатый скот и др. Яйца проникают в организм млекопитающего вместе с кормом, травой или водой, поражая его органы. Поэтому употребление в пищу мяса без соответствующей обработки может стать причиной развития эхинококкоза печени.
- Наиболее распространенным и актуальным для человека является третий путь попадания паразита в организм. Он отмечается при недостаточном соблюдении гигиенических правил, что особенно актуально для детей. Эхинококк может попасть в желудочно-кишечный тракт при употреблении немытых фруктов или игре с домашними животными, после которой не были тщательно вымыты руки.
В человеческом организме личинки изначально всасываются в кровь из кишечника и переходят в печень. В дальнейшем они способствуют возникновению эхинококкоза печени. Однако, многие паразиты не проходят из крови через печеночный барьер, распространяясь с кровотоком в другие органы.
Симптомы эхинококкоза печени
Эхинококкоз печени является хроническим заболеванием, которое не имеет резко выраженной симптоматики, заставляющей человека вовремя обратиться к врачу. После заражения симптомы начинают появляться не сразу, а через несколько месяцев или лет.
Чаще всего пациентов беспокоит общая слабость, уменьшение толерантности к физической нагрузке, снижение работоспособности, боли в голове, мелкая точечная сыпь на коже, периодическое незначительное повышение температуры. Данные клинические признаки являются следствием попадания в кровь токсических продуктов жизнедеятельности эхинококка и реакции организма на внедрение паразитов. Развитие эхинококка в печени происходит в несколько стадий, каждая из которых имеет свои клинические особенности.
Первая стадия
На первом этапе симптомов может вообще не наблюдаться. Поэтому зараженный человек чувствует себя нормально и ведет активный образ жизни. На данной стадии эхинококк внедряется в печеночную ткань и формирует защитную капсулу. Единственным проявлением заболевания может служить небольшой дискомфорт в правом подреберье после приема большого количества пищи.
Вторая стадия
Второй этап характеризуется четкой клинической симптоматикой. У больных нарушается аппетит и постепенно уменьшается масса тела. При приеме лекарственных средств у зараженных людей может наблюдаться более частое развитие побочных реакций, что связано со снижением детоксикационной функции печени на фоне эхинококкоза.
Специфичными симптомами, которые характерны для эхинококкоза печени, являются тошнота или рвота, тяжесть в области правого подреберья и диарея. Тошнота, как правило, развивается после употребления жирной, жаренной и острой пищи. Дискомфорт в правой половине живота беспокоит после еды или на фоне физической нагрузки. Больные эхинококкозом печени периодически отмечают диарею, которая связана с нарушением переваривания жирных кислот в кишечнике вследствие угнетения выработки желчи гепатоцитами.
Третья стадия
На третьем этапе развития эхинококкоз печени проявляется осложнениями, которые связаны с нарушением целостности эхинококковой кисты и распространением яиц паразита в другие органы. Как правило, при попадании паразита в кровь возникает аллергическая реакция, которая сопровождается спазмом бронхов и развитием дыхательной недостаточности. Кроме того, эхинококк может распространяться в костную ткань, мозг, легкие и другие органы, вызывая нарушение их функций.
Одним из самых частых осложнений считается нагноение содержимого кисты, которое при разрыве может выходить в брюшную или плевральную полость, вызывая гнойный перитонит или плеврит. При большом размере кистозной полости она может ущемлять близко расположенные сосуды и желчные протоки. Из кровеносных сосудов чаще всего сдавливается воротная вена, что проявляется повышением давления в венозной системе органов брюшной полости. В результате увеличивается селезенка и появляется асцит.
Реже эхинококковая киста сдавливает нижнюю полую вену, что приводит к развитию сердечной недостаточности. Это осложнение выражается одышкой, отеками нижних конечностей, почечной дисфункцией и нарушением кровоснабжения внутренних органов. Частым осложнением эхинококкоза печени является сдавление желчных путей, что сопровождается нарушением оттока желчи. Симптомы застоя желчи - пожелтение кожных покровов, зуд и расстройства стула с изменением его цвета.
Диагностика
Для диагностики эхинококкоза печени используются лабораторные и инструментальные методы обследования. Также осуществляется тщательный расспрос пациента, который позволяет уточнить возможные пути заражения данным паразитом. Как правило, высокий риск заболевания отмечается у людей, которые занимаются сельским хозяйством и часто контактируют с домашними животными.
- Лабораторная диагностика. Проводится общий анализ крови, клинический анализ мочи, иммунологические тесты (реакция связывания комплемента, реакция непрямой агглютинации) и аллергическая проба Каццони. В общем анализе крови отмечается повышение количества эозинофилов и увеличение скорости оседания эритроцитов. Иммунологические тесты используются для определения наличия антител к эхинококку в крови и содержимом кисты. Именно они позволяют точно диагностировать эхинококкоз печени. Поскольку при данном заболевании может нарушаться функция гепатоцитов, для ее оценки проводятся биохимические пробы печени.
- Инструментальная диагностика. Из инструментальных методов важную роль играет УЗИ печени и желчного пузыря, обзорная рентгенография органов брюшной полости, магнитно-резонансная томография и однофотонная эмиссионная компьютерная томография печени (ОФЭКТ печени). Данные визуализационные методики обследования позволят выявить кисту и определить ее размеры. Также они дают возможность оценить размеры печени, визуализировать расширенные желчные протоки, увеличенную селезенку или асцит.
- Инвазивная диагностика. Для того чтобы получить содержимое кисты и обнаружить паразитов, рекомендуется пункционная биопсия печени – но только с соблюдением методики, исключающей обсеменение окружающих тканей личинками эхинококка. Из инвазивных методик может быть использована лапароскопия, при помощи которой можно непосредственно осмотреть органы брюшной полости видеоэндоскопом.
Лечение эхинококкоза печени
Эхинококкоз печени является паразитарным заболеванием, которое никогда не проходит самостоятельно. При этом консервативные методы не позволяют добиться полного выздоровления. Поэтому единственным эффективным способом лечения является хирургическое вмешательство. На подготовительном этапе, перед операцией и в послеоперационном периоде показано назначение противогельминтного препарата мебендазола. Этот препарат тормозит рост кисты, уменьшает ее размеры, значительно снижает риск рецидивов патологии.
Наиболее эффективным методом лечения является оперативное удаление паразита. Операция сопряжена с высоким риском диссеминации личинок на окружающие ткани, поэтому должна проводиться специалистом, владеющим методикой малоинвазивных апаразитарных вмешательств, использующим современные инструменты. Из хирургических методик применяются иссечение кист печени и эндоскопическое дренирование кисты печени. После удаления кисты в образовавшуюся полость вводят гермициды (наиболее эффективны для предотвращения рецидива эхинококкоза печени 80-100% глицерин и 30% раствор хлорида натрия).
Прогноз и профилактика
Профилактика эхинококкоза печени направлена на предотвращение заражения данным паразитом. Необходимо тщательное мытье рук после контакта с животными и перед любым употреблением пищи. Также следует проводить полноценную термическую обработку мяса, что позволяет уничтожить находящиеся в нем личинки эхинококка.
Эхинококкоз печени при своевременном и грамотном оперативном вмешательстве излечим, однако при выявлении на поздних стадиях заболевания даже на фоне проведенного лечения значительно снижает качество жизни, а в некоторых случаях патология может приводить и к смерти пациента. Рецидивы возникают примерно у 7% больных.
Эхинококкоз головного мозга — это заболевание, обусловленное проникновением в мозг личинок эхинококка с формированием единичных или множественных кист-пузырей. В зависимости от расположения проявляется головными болями, эпилептическими приступами, парезами, нарушением зрения, расстройством психики. Основанием для постановки диагноза церебрального эхинококкоза является наличие кисты по данным томографии, нарастающий титр антиэхинококковых антител и положительная проба Касони. Проводится полное удаление кист с капсулой в сочетании с противогельминтной и симптоматической терапией. После операции требуется реабилитация и длительное наблюдение.
МКБ-10
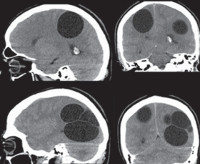
Общие сведения
Эхинококкоз головного мозга — редкое паразитарное поражение церебральных тканей. По различным данным, составляет от 0,4 до 9% всех случаев эхинококкоза. Поражения головного мозга в сочетании с эхинококкозом печени и лёгких встречается у 0,2% больных. Наибольшая заболеваемость отмечается в эндемичных зонах. Для России это Башкирия, Татарстан, Ставропольский и Краснодарский край, северные регионы.
Большинство случаев церебрального эхинококкоза представлено единичными пузырями, содержащими личинки паразита. Множественный эхинококкоз мозга встречаются крайне редко. Эхинококковые очаги локализуются преимущественно в белом веществе теменных, лобных и затылочных долей.

Причины
Церебральная форма эхинококкоза возникает вследствие проникновения личинок в мозговые ткани. Заражение человека происходит алиментарным путем — при проглатывании яиц (онкосфер) эхинококка. Последние выделяются в окружающую среду с фекалиями зараженных животных: волков, собак, лисиц. Длительно сохраняются в почве, с её высушенными частичками (пылью) разносятся ветром.
Яйца могут попадать на шерсть домашнего скота и собак, лежащих на траве, на одежду и руки людей. Наибольший риск заражения имеют лица, связанные с животноводством и разделкой туш, охотники, хозяева собак, находящихся в свободном выгуле. Больной эхинококкозом человек не выделяет паразитов и не опасен для окружающих.
Патогенез
В мозговых тканях вокруг личинки эхинококка образуется фиброзная капсула. Формируется пузырь, иногда окружённый воспалительной зоной — результатом реакции церебральных клеток на внедрение чужеродного организма. В воспалительный процесс могут вовлекаться расположенные вблизи кисты церебральные оболочки. Очаг эхинококкоза оказывает раздражающее действие на мозговые нейроны, что приводит к появлению эпилептических приступов. Постепенно эхинококковый пузырь увеличивается в размерах, оказывая все большее давление на окружающие ткани.
Возникает внутричерепная гипертензия — повышение давления внутри черепной коробки. Нарастание давления отражается на всех участках мозга и лежит в основе прогрессирующих общемозговых симптомов. Церебральные ткани и питающие их сосуды сдавливаются. Развиваются хроническая гипоксия и ишемия, приводящие к нарушению метаболизма и гибели нейронов. В первую очередь страдают нервные клетки, расположенные вокруг кисты. Выпадение их функций проявляется очаговой неврологической симптоматикой.
Классификация
Эхинококкоз головного мозга включает 2 основные формы. В отношении каждой из них в практической неврологии и нейрохирургии применяются разные подходы в лечении. От формы заболевания зависит прогноз.
- Солитарная форма характеризуется наличием одиночной кисты. Образование часто достигает значительных размеров — до 60 мм в диаметре. В клинической картине превалируют фокальные эпиприступы и очаговые симптомы. Возможно радикальное хирургическое удаление. Имеет относительно благоприятный прогноз.
- Рацимозная форма отличается формированием гроздевидного конгломерата пузырей и многоочаговостью поражения. Встречается редко. В клинике преобладают тяжелые общемозговые проявления. Хирургическое лечение затруднительно.
Симптомы церебрального эхинококкоза
Солитарная киста отличается постепенным развитием симптоматики. Заболевание начинается с периодической головной боли. Болят виски, лоб или вся голова. Характерно чувство давления на глаза. Длительность и интенсивность цефалгии постепенно нарастают. Она приобретает упорный характер, сопровождается тошнотой и рвотой. У ряда пациентов эхинококкоз дебютирует эпилептическим пароксизмом. Затем возникают головные боли. Множественные церебральные поражения манифестируют резким ликворно-гипертензионным синдромом с интенсивной цефалгией и многократной рвотой.
Очаговые проявления заболевания напрямую зависят от расположения эхинококкового пузыря. Типичны эпилептические припадки, которые длятся несколько лет и не поддаются медикаментозному лечению. Пароксизмы носят характер фокальной эпилепсии в виде онемения (сенсорный пароксизм) или судорожных мышечных сокращений (двигательный пароксизм).
В приступ вовлекается одна или обе конечности половины тела, противоположной локализации кисты в головном мозге. Возможна вторичная генерализация: судороги появляются в одной конечности, постепенно распространяются на все тело. В последующем в конечностях, подверженных фокальным двигательным эпиприступам, развивается мышечная слабость, спастическая скованность, теряется болевая чувствительность.
Осложнения
Сопровождающая эхинококкоз внутричерепная гипертензия вызывает сдавление зрительного тракта и приводит к атрофии зрительных нервов с падением остроты зрения. Устойчивое к антиконвульсантной терапии течение эпилепсии при эхинококкозе головного мозга зачастую осложняется развитием эпилептического статуса. Следующие непрерывно друг за другом эпиприступы опасны для жизни, поскольку провоцируют сбой в работе дыхательной и сердечно-сосудистой системы.
При отсутствии своевременной диагностики и адекватного лечения церебрального эхинококкоза увеличивающаяся киста вызывает смещение мозговых структур. Нарастающая гипертензия обуславливает сдавление головного мозга с дисфункцией жизненно важных нервных центров и последующим летальным исходом. Редким осложнением является разрыв эхинококкового пузыря с обсеменением окружающих тканей.
Диагностика
Эхинококкоз головного мозга имеет клиническую картину сходную с внутримозговыми опухолями, что нередко приводит к диагностическим ошибкам. Поэтому важное значение имеет последовательное осуществление всех этапов комплексной диагностики:
- Детализация анамнеза. Помогает выявить факт пребывания в эндемичном по эхинококкозу районе, работу в животноводческом хозяйстве и т. п. Устанавливает особенности начала заболевания.
- Осмотр невролога. Выявляет признаки повышенного внутричерепного давления, очаговую симптоматику — наличие гемипареза, психических отклонений, когнитивных нарушений.
- Осмотр офтальмолога. Предусматривает проведение офтальмоскопии, с помощью которой обнаруживаются отечные диски зрительных нервов, а при длительно существующей клинике — признаки атрофии.
- Рентгенография черепа. Пальцевые вдавления на черепных костях, расхождение швов между ними, признаки расширения диплоических вен свидетельствуют о длительно существующем повышении интракраниального давления. При этом заболевание может иметь небольшую длительность.
- Томографические исследования. Позволяют выявить внутримозговое образование с тонкими стенками, определить его локализацию и объем. КТ головного мозга более информативно в отношении кальциноза капсулы, МРТ головного мозга лучше визуализирует стенки кисты.
- Лабораторные анализы. В ОАК отсутствуют воспалительные изменения, наблюдается эозинофилия. Проводится иммуноферментное исследование на наличие антител к эхинококку. Имеет значение титр антител: чем он выше, тем с большей вероятностью подтверждает эхинококкоз.
- Аллергопробы с эхинококковым антигеном. Проводится внутрикожная проба Касони в её современной интерпретации (метод Шульца). Положительный результат отмечается у 85% больных церебральным эхинококкозом.
- Обследование других органов. Необходимо для исключения сочетанного поражения. Проводится УЗИ печени и рентгенография легких. При обнаружении изменении осуществляется углублённое исследование с назначением МРТ печени, КТ легких, консультаций гепатолога, пульмонолога и др.
Полученные результаты оценивают в совокупности, сопоставляя их с клиническими симптомами и течением заболевания. Дифференцировать эхинококкоз головного мозга необходимо от других объемных образований: арахноидальных кист, церебрального цистицеркоза, эпидермоидных кист, интракраниальных опухолей и абсцессов.
Лечение эхинококкоза головного мозга
Наиболее оправданным методом лечения является хирургический. Сегодня он эффективно сочетается с этиотропной, симптоматической и реабилитационной терапией. Комплексное лечение осуществляется целым рядом специалистов и включает:
- Хирургическое удаление кисты. Общепринятым стандартом выступает радикальное микрохирургическое иссечение без повреждения стенок пузыря. Операция требует от нейрохирурга тщательного планирования доступа. При локализации поражения в функционально значимых областях мозга проводится интраоперационная кортикография. Трудную задачу представляет лечение множественных очагов, поскольку необходимо удаление всех кист.
- Консервативную этиотропную терапию, которая проводится противогельминтными фармпрепаратами из группы бензимидазолов (например, альбендазолом). Ранее антигельминтное лечение назначалось в неоперабельных случаях и носило паллиативный характер. Последнее время доказано положительное влияние послеоперационной антигельминтной терапии на эффективность хирургического лечения.
- Симптоматическое лечение осуществляется в рамках предоперационной и восстановительной терапии. Проводится антиконвульсантами, препаратами, снижающими внутричерепное давление, обезболивающими средствами и т. п.
- Послеоперационную реабилитацию, состоящую из фармакотерапии (препараты для улучшения церебрального метаболизма и кровотока), лечебной физкультуры, психотерапии и занятий с логопедом (при нарушениях речи).
Прогноз и профилактика
Прогноз зависит от формы заболевания, количества, размеров и локализации эхинококковых пузырей. Наиболее благоприятный прогноз имеет своевременно прооперированный солитарный церебральный эхинококкоз. Частота послеоперационных рецидивов составляет 15-30%. Рецидив возникает, если в ходе операции произошло вскрытие пузыря. Но преимущественно он обусловлен способностью паразита распространять за пределы капсулы микроскопические отсевы, не диагностируемые современными способами нейровизуализации.
С целью своевременной диагностики рецидива прооперированные пациенты должны проходить регулярные обследования, включающие анализ на антитела, УЗИ печени, церебральную МРТ, рентгенографию ОГК. Рекомендованный ВОЗ срок наблюдения пациентов — 10 лет. К мероприятиям, способным предупредить эхинококкоз, относится соблюдение правил личной гигиены, ношение спецодежды при работе с животными и разделке туш, повышение санитарного состояния ферм, выявление и ликвидация источника заражения.
Читайте также:

