Хроническое воспаление при инфекционных болезнях
Обновлено: 25.04.2024
Хроническое воспаление – один из главных биологических маркеров старения и элементов патогенеза возрастных заболеваний. В обзоре рассмотрены молекулярно-генетические механизмы персистирующего системного воспаления, сопровождающего физиологическое старение
Хроническое воспаление при старении
Fumihiro Sanada1, Yoshiaki Taniyama1,2*, Jun Muratsu1,2, Rei Otsu1, Hideo Shimizu1, Hiromi Rakugi2 and Ryuichi Morishita1*
1Department of Clinical Gene Therapy, Graduate School of Medicine, Osaka University, Suita, Japan
2Department of Geriatric and General Medicine, Graduate School of Medicine, Osaka University, Suita, Japan
Оригинал статьи: © 2018 Sanada, Taniyama, Muratsu, Otsu, Shimizu, Rakugi and Morishita, распространяется по лицензии CC BY 4.0.
Аннотация
Хроническое воспаление – один из главных биологических маркеров старения и элементов патогенеза возрастных заболеваний. В обзоре рассмотрены молекулярно-генетические механизмы персистирующего системного воспаления, сопровождающего физиологическое старение
Ключевые слова: Хроническое Воспаление, Старение, Клеточное Старение, Старение Иммунитета, Провоспалительные Цитокины, Система Свертывания Крови, Дисбактериоз Кишечника, Chronic Inflammation, Aging, Cell Senescence, Immunosenescence, Proinflammatory Cytokines, Coagulation System, Gut Dysbiosis
При клеточном старении центральными звеньями патогенеза хронического воспаления являются иммунная дисрегуляция и нарушение активности системы свертывания крови. Обзор посвящен рассмотрению молекулярно-генетических механизмов персистирующего системного воспаления, сопровождающего физиологическое старение, и его роли в патогенезе возрастных заболеваний.
Введение
Системное воспаление при старении – один из главных элементов патогенеза сердечно-сосудистых, эндокринных и онкологических заболеваний (1), распространенность которых неуклонно растет с каждым годом. Несмотря на центральную роль немедикаментозной терапии (изменение образа жизни и рациона питания, снижение влияния сопутствующих факторов риска) в профилактике возрастных заболеваний, требуется разработка фармакологических подходов, основанных на регуляции ключевых клеточных и молекулярных механизмов, участвующих в прогрессировании хронического воспаления.
Важную роль в прогрессировании хронического воспаления играют диетические факторы, старение клеток, снижение уровня половых гормонов и курение. Кроме того, в процессе старения наблюдается повышение уровня циркулирующих провоспалительных факторов, включая интерлейкин-6 (ИЛ-6) и фактор некроза опухоли-α (ФНО-α) (2), способствующих повреждению ДНК, развитию мышечной атрофии, метаболических нарушений и онкологических заболеваний. Повышение образования и секреции ИЛ-6 и ФНО-α при старении также наблюдается в адипоцитах висцеральной жировой ткани (3, 4), увеличение количества макрофагов в которых пропорционально значениям индекса массы тела (ИМТ) и является важным биомаркером хронического воспаления и предиктором инсулинорезистентности у людей с ожирением (5, 6). Среди факторов внешней среды повышению уровня провоспалительных цитокинов – ИЛ-6, ФНО-α и интерлейкина-1-β (ИЛ-1-β) – в крови способствуют хроническое воздействие сигаретного дыма, психоэмоциональный стресс и воспалительные заболевания полости рта (7). Однако системное воспаление низкой интенсивности персистирует даже после коррекции провоспалительного статуса – уровня ЛПНП и активности РАС – и отказа курения, что указывает на существование секреторного фенотипа клеток, ассоциированного со старением (senescent associated secretory phenotype, SASP) и иммунологического импринтинга. В обзоре рассмотрены данные о ключевых биомаркерах, молекулярных механизмах и сигнальных каскадах, участвующих в развитии системного воспаления низкой интенсивности в процессе биологического старения (Рис. 1).
.jpg)
Рисунок 1. Молекулярные элементы системного воспаления, ассоциированного со старением: старение клеток, нарушение гемостаза, накопление клеточного детрита (в т.ч. циркулирующей митохондриальной ДНК, цмДНК), дисбактериоз и иммунная дисфункция. Дополнительные факторы: возраст, окислительный стресс, циркулирующие микроРНК и агалактозилированные N-гликаны.
Источники медиаторов хронического воспаления при старении
Острое воспаление – ключевой компонент в механизме формирования иммунного ответа на воздействие патогена или повреждение тканей и активации регенерации тканей. Системное воспаление низкой интенсивности, наоборот, вызывает хроническое повреждение клеток, способствуя развитию дегенеративных изменений в тканях (8). Воздействие провоспалительных цитокинов – ИЛ-6, ИЛ-1-β и ФНО-α – на структуры нервной и костно-мышечной систем (9) приводит к снижению активности анаболических процессов, опосредованных действием инсулина и эритропоэтина, вызывая развитие саркопении (10).
Клеточный детрит и накопление иммуноглобулинов
Накопление клеточного детрита и иммуноглобулинов в результате нарушения метаболических процессов в клетках стимулируют активацию иммунной системы и развитие системного воспаления. Важную роль в регуляции межклеточных и межмолекулярных взаимодействий и активности иммуноглобулинов играет гликозилирование – один из наиболее распространенных типов посттрансляционной модификации, основанный на присоединении углеводных остатков к аминокислотам (напр., к азоту аспарагиновых остатков в N-гликанах) (11, 12). Данные клинических (13–15) и экспериментальных исследований на животных (16–18) демонстрируют повышение уровня агалактозилированных N-гликанов, не имеющих в составе остатка галактозы в позиции Asn297 Fc-фрагмента IgG (IgG-G0), у пациентов с синдромом Гетчинсона-Гилфорда (прогерия) и некоторыми аутоиммунными заболеваниями.
Провоспалительный эффект IgG-G0 реализуется посредством усиления лектинового пути активации комплемента, связывания с Fcγ-рецепторами и образования агрегатов аутоантител. Кроме того, накопление IgG-G0 с возрастом служит независимым предиктором гиперактивации иммунной системы и развития системного воспаления.
Дополнительным биомаркером старения является митохондриальная дисфункция и высвобождение молекулярных паттернов, ассоциированных с повреждением (МПАП; damage-associated molecular patterns). Рядом исследований показана роль циркулирующих митохондриальных МПАП в патогенезе хронического воспаления и дегенеративных заболеваний (19, 20).
Нарушение баланса микрофлоры кишечника в большинстве случаев вызвано особенностями рациона питания и наиболее выражено у пожилых лиц, длительно находящихся в учреждениях стационарного социального обслуживания по сравнению с пациентами в частных домах престарелых (24).
Старение клеток
Клеточное старение – необратимая остановка клеточного цикла и потеря способности клетки к делению. Остановка клеточной пролиферации происходит в результате ряда молекулярно-генетических изменений, включая укорочение теломер, генотоксический стресс, действие митогенных стимулов и провоспалительных цитокинов, активацию белка-супрессора опухоли p53 и/или ингибитора циклин-зависимой киназы p16 (25). С возрастом в различных тканях и органах увеличивается количество клеток, утративших способность к пролиферации и приобретающих секреторный фенотип, ассоциированный со старением. Это сопровождается высвобождением провоспалительных цитокинов и инициацией системного воспаления и лежит в основе патогенеза атеросклероза, онкологических заболеваний и сахарного диабета (26–28).
В исследованиях на животных неоднократно показана центральная роль процесса клеточного старения в прогрессировании дегенеративных заболеваний, включая атеросклероз и остеоартрит (29–31). Удаление стареющих клеток и контроль провоспалительных каскадов, участвующих в приобретении клетками секреторного фенотипа, ассоциированного со старением, может служить потенциальной терапевтической мишенью при разработке подходов к профилактике и терапии возрастных заболеваний.
Старение иммунной системы
Таким образом, наряду с клеточным старением, возрастное снижение функции врожденной иммунной системы является важным элементом патогенеза системного воспаления низкой интенсивности при старении.
Система гемостаза: факторы свертывания крови и фибринолиза
Развитию возрастных заболеваний – атеросклероза и фиброза легких – у пациентов пожилого возраста способствует повышенная активация системы свертывания крови и стимуляция процесса фибринолиза, которые вызывают развитие хронического воспаления через активацию рецепторов, активируемых протеазами (protease-activated receptors, PAR; 35–38).
Увеличение сердечно-сосудистого риска, в частности риска развития тромботических заболеваний, с возрастом связано с повышением уровня факторов свертывающей системы плазмы крови I, V, VII, VIII и IX (39, 40) и концентрации фактора X в атеросклеротических бляшках эндотелиальных, гладкомышечных и иммунных клеток (41). Результаты клинического исследования ATLAS ACS 2–TIMI 51 Investigators показали, что высокоселективный прямой ингибитор фактора Xa ривароксабан снижает риск инфаркта миокарда, инсульта и сердечно-сосудистую смертность у пациентов с ишемической болезнью сердца (42). Увеличение активации системы свертывания крови и содержания фибриногена в плазме крови, наоборот, способствует развитию тромбоза, а повышение уровня фактора коагуляции Xa и тромбина усиливает провоспалительный каскад и вызываемую тромбином PAR-1/2-опосредуемую активацию тромбоцитов (43). Патогенетическая роль PAR-1/2-опосредованной сигнализации FXa и фибринолитического фактора плазмина в процессах клеточного старения и системного воспаления реализуется посредством повышения экспрессии протеина, связывающего инсулиноподобный фактор роста 5 (IGFBP-5; 37, 41, 44, 45). Как показали результаты работы Kojima et al., IGFBP-5, белок семейства сигнальных трансдукторов и активаторов транскрипции (STAT3), участвует в активации ИЛ-6-индуцированного образования активных форм кислорода (АФК), повреждению ДНК и гибели фибробластов (46).
Учитывая равное распределение FXa- и IGFBP-5-положительных областей в атеросклеротических бляшках (41), можно утверждать, что, как и тромбин, местный синтез фактора коагуляции Xa является ключевым индуктором экспрессии IGFBP-5 и патогенетическим фактором SASP-опосредованного клеточного старения (41, 48).
.jpg)
Рисунок 2. Активация каскада свертывания крови в патогенезе клеточного старения и хронического воспаления.
Заключение
Список литературы
Дисклеймер: все утверждения, высказанные в статье, относятся к суждениям авторов и необязательно согласуются с точкой зрения аффилированных организаций, издателя, редакторов и рецензентов. Любой продукт или утверждение производителя не гарантируются и не поддерживаются издателем.
Для эффективного лечения хронических инфекционнных заболеваний предлагаются инновационные подходы, включающие: диагностику - оценку аутоиммунитета, комплексную терапию, направленную на элиминацию возбудителей, восстановление иммунитета, в том числе иммуни
For effective treatment of chronic infectious diseases some innovative approaches were suggested that include: diagnostic, autoimmunity assessment, complex therapy targeted to eliminate the agents, immunity restoration including intestine immunity and further rehabilitation.
Нерешенные проблемы патогенеза, лечения хронических заболеваний встают все острее. В настоящее время показано, что при большинстве хронических заболеваний, ранее считавшихся неинфекционными, выявляются латентные или активные бактериально-вирусные процессы [1, 2].
Хронические инфекционные заболевания, как правило, являются сочетанными (микст-инфекции). Вcе чаще они трудно поддаются лечению, носят рецидивирующий характер, в ряде случаев отмечается их непрерывное течение.
Многократно проводимая антибактериальная терапия оказывается не всегда эффективной, часто имеет место иммуносупрессивное, выраженнное побочное действие антибиотиков. То есть иммуносупрессивная терапия при хронических инфекционных процессах и хронических заболеваниях патогенетически не всегда обоснована. Есть ли альтернатива?
При проведении вакцинации также могут отмечаться побочные эффекты, в том числе выраженные. Введение вакцин в ряде случаев вызывает развитие слабого специфического иммунного ответа, или, наоборот, выявляется гиперреактивность, при этом могут активироваться очаги хронической инфекции, нарушаться механизмы иммунорегуляции, приводящие к развитию аутоиммунных процессов [3].
К решению данных вопросов можно подойти с позиций современных знаний в области иммунофизиологии и иммунопатологии [1–3, 5–7].
Все болезни являются инфекционными, если не доказано другого [1]
Колонизация микроорганизмами слизистых начинается еще внутриутробно (во время беременности, от матери). После рождения микроорганизмы поступают во внутреннюю среду через дыхательные пути, пищеварительный тракт с пищей, по мере взросления этот процесс ассимиляции увеличивается.
Факторами, усиливающими поступление микроорганизмов, являются вредные привычки (например, курение), поездки в различные страны, заболевания желудочно-кишечного тракта.
Один из механизмов воздействия генов микроорганизмов на геном человека следующий. Гены микроорганизмов участвуют в активации ключевого ядерного фактора транскрипции NF-каппа-би, который запускает продукцию ряда белков, поддерживающих воспалительные процессы (ферменты, медиаторы, цитокины).
T. Marshall в своих исследованиях показал, что при аутоиммунных заболеваниях в клетках различных органов, в крови выявляются геномы вируса Эпштейна–Барр, цитомегаловируса, вируса гепатита С, Chlamydia trachomatis, грибов.
То есть геном микроорганизмов (в настоящее время обнаружено более 1 миллиона генов микроорганизмов по сравнению с 25 тысячами генов человека) при большинстве хронических заболеваний выявляется во многих клетках организма.
Феномен антигенной молекулярной мимикрии
При частых обострениях хронических инфекционных процессов, определенном генотипе (особенности HLA-системы), нарушениях в регуляции иммунного ответа может возникнуть аутоиммуный процесс.
Комплексная оценка аутоиммунитета — инновационный подход к диагностике при хронических заболеваниях
В настоящее время хорошо известно, что все основные события, связанные с воспалительными процессами, развиваются в органах, т. е. местно. Изменения в периферической крови указывают на системность, распространенность, наличие выраженной активности воспалительного процесса.
В течение 20 последних лет активно развивается инновационный подход к диагностике различных заболеваний: появился иммунологический метод, позволяющий оценивать наличие и степень выраженности воспалительного процесса в основных органах и системах [5, 6].
Новые подходы к лечению хронических инфекционных процессов
В клетках человека, в лимфоцитах присутствует ядерный рецептор (VDR-рецептор), который участвует в синтезе Toll-подобных рецепторов, распознающих общие детерминанты многих микроорганизмов. Этот механизм участвует в подавлении активности различных патогенов (бактерий, вирусов).
При хронических инфекционных процессах VDR-рецептор заблокирован, инактивирован микроорганизмами.
В настоящее время обнаружено [1], что препарат олмесартана медоксомил (Кардосал) обладает высокой противовоспалительной активностью при различных заболеваниях, в том числе аутоиммунных, он способен восстанавливать активность VDR-рецептора. При этом прием данного препарата должен осуществляться длительно, практически постоянно. Этот препарат относится к группе сартанов (антагонисты рецепторов ангиотензина II) (Диован, Лозап и др.), которые применяются для лечения артериальной гипертензии.
Противовоспалительным эффектом, основанным на новом механизме действия, обладают экстракты босвеллиевой кислоты (из ладанного дерева), экстракты семян сибирской кедровой сосны. При применении данных препаратов происходит блокада активности ядерного фактора NF-каппа-би [4], при этом подавляется синтез провоспалительных цитокинов и др. (интерлейкина-1, фактор некроза опухолей альфа, бета, ряда металлопротеиназ).
В комплексную терапию включается специфическое лечение активной, преобладающей в данный момент бактериально-вирусной инфекции с последующей длительной реабилитацией, которая может осуществляться в течение нескольких месяцев. При этом показали свою высокую эффективность препараты — Глицирам 2 табл. 3 раза в день, производные бетулина — Суперантитокс 50 мг 1 раз в день, экстракты из босвеллиевой кислоты 10 мг 1 раз в день.
В комплексном лечении и реабилитации пациентов с хроническими инфекционными (воспалительными) процессами нами обязательно применяется коррекция состояния кишечника (важнейшего органа иммунитета) и органов желудочно-кишечного тракта, билиарной системы. В частности, пробиотики рекомендуется применять длительно: 2 и более месяцев.
Немного фактов: более 60% всех иммунокомпетентных клеток находится в кишечнике, площадь которого в 10 раз больше площади кожных покровов и составляет более 300 м 2 , кишечник имеет большую метаболическую активность, чем печень, он синтезирует три четверти всех нейротрансмиттеров, в кишечнике находится клеток в 10 раз больше, чем во всем остальном организме.
Состояние иммунитета кишечника ослабляется наличием дисбиоза (синдрома избыточного бактериального роста, повышенной проницаемости, пищевой непереносимости).
Нарушенное состояние кишечника невозможно восстановить без нормализации работы вышележащих органов — желудка, печени, желчного пузыря, поджелудочной железы. Поэтому в комплексную терапию хронических инфекционных заболеваний входит лечение патологий желудочно-кишечного тракта (ЖКТ).
Вакцинация. Спорные вопросы. Предлагаемые решения
Известные иммунологи (академик РАН Черешнев В. А., Shoenfeld Y., 2012) указывают, что введение комплексных вакцин не всегда согласовывается с основными законами функционирования иммунитета: силы, конкуренции антигенов, интервалов, суммации раздражений.
При использовании вакцин описана еще одна достаточно новая проблема — синдром ASIA [3]. Адъюванты, используемые в вакцинах для усиления действия антигенов, могут вызывать у лиц с особенностями генотипа (HLA) повышенную предрасположенность к развитию аутоиммунных процессов. Подобный эффект могут оказывать латекс, силикон.
В наших работах [8, 9] убедительно показано, что у детей с увеличенной вилочковой железой, регистрируемой в момент вакцинации, или имевших гиперплазию тимуса в анамнезе у 60% не вырабатывался защитный титр антител к дифтерийному компоненту вакцин АКДС и АДС (независимо от фирмы-производителя вакцин и лабораторий, в которых контролировался уровень антител). После проведения иммунотропной терапии содержание специфических антител достигало защитного уровня.
В связи с этим мы рекомендуем перед вакцинациями, прежде всего у детей первых месяцев и первых лет жизни, определять величину тимуса (по УЗИ).
Можно ли избежать осложнений при проведении вакцинаций?
Заключение
Рекомендуется перед проведением первой вакцинации детям первых месяцев жизни проводить УЗИ тимуса (диагностика тимомегалии или гипоплазии тимуса) для определения дальнейшей тактики ведения ребенка.
Литература
А. В. Симонова*, доктор медицинских наук, профессор
Л. Г. Кузьменко**, доктор медицинских наук, профессор
И. С. Лебедева*
И. Д. Баранова*, кандидат медицинских наук
В. В. Арзямова**, кандидат медицинских наук
Что принято считать хроническим невоспалительным заболеванием кишечника? Какими методами можно подтвердить диагноз? Какая терапия наиболее эффективна? Рисунок 1. Слизистая кишечника при болезни Крона Хроническим воспалительным забо
Что принято считать хроническим невоспалительным заболеванием кишечника?
Какими методами можно подтвердить диагноз?
Какая терапия наиболее эффективна?
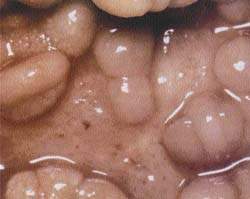 |
| Рисунок 1. Слизистая кишечника при болезни Крона |
Хроническим воспалительным заболеванием кишечника принято считать каждый длительный энтерит — как инфекционной, так и иммуноаллергической этиологии, который ведет к хроническому воспалительному процессу в кишечнике.
Помимо целиакии, эти заболевания включают в себя язвенный ректоколит, болезнь Крона и другие более редкие заболевания: колит при болезни Бехчета, некротизирующий энтероколит у детей младшего возраста. Все эти заболевания характеризуются:
— неизвестной этиологией (кроме целиакии);
— воспалительным характером поражений;
— хроническим течением и возможными рецидивами;
— ассоциацией с другими некишечными заболеваниями;
— хорошей реакцией на кортикостероидную терапию;
— возможностью хирургического разрешения (лечения).
В возникновении данных заболеваний большую роль играют как географический (встречаются чаще в Северной Европе), так и генетический факторы.
Болезнь Крона встречается чаще в западных странах и среди городского населения.
Этиология неизвестна, можно лишь предположить влияние инфекционных заболеваний и питания. Патогенез связан с нарушением ответной иммунной реакции со стороны слизистой кишечника, характер которой недостаточно изучен, известно лишь, что происходит активация Т- и В-лимфоцитов, увеличивается производство цитокинов и комплемента.
Гистопатологические наблюдения позволяют выявить два основных и множество промежуточных типов нарушений при хроническом воспалении кишечника.
Болезнь Крона. Характеризуется четко отграниченными трансмуральными сегментарными поражениями, разделенными между собой внешне неизмененной слизистой. Поражение распространяется на мезентериальные лимфоузлы. Может быть затронут любой участок желудочно-кишечного тракта, но чаще поражается кишечный отдел подвздошной кишки. Типично формирование стенозов, абсцессов и фистул. Характерны отек слизистой, изъязвления, атрофия и утолщение кишечной стенки, гиперплазия лимфоузлов.
Наблюдается гранулематозное поражение. В 60-70% случаев гранулема обнаруживается на хирургическом материале и лишь в 30-40% при биопсии. Гранулема состоит из эпителиоидных и гигантских клеток. Несмотря на тенденцию к некрозу, казеозного некроза не отмечается. Легко формируются язвы и фистулы.
Язвенный ректоколит. Это заболевание ободочной кишки. Начинается с ректального уровня и распространяется вверх. Процесс поверхностный, затрагивает подслизистую, слизистую и редко более глубокие слои. Для острой стадии характерны гиперемия слизистой, отек, легко кровоточащие эрозии и язвы. В промежутках между язвенными поражениями слизистая гипертрофирована, нередко образуются псевдополипы. Описанные поражения могут сочетаться с перианальными трещинами. Гистологически характерно образование крипт и абсцессов, в которых накапливаются лимфоциты, эозинофилы, нейтрофилы, плазматические клетки. Гранулематозная ткань отсутствует.
Варианты вышеописанных двух основных типов хронических воспалительных заболеваний кишечника:
1. Язвенный энтероколит. Некоторыми авторами считается врожденной формой болезни Крона. Поражения затрагивают весь пищеварительный тракт, но преимущественно локализуются в конечной части подвздошной кишки и в начальном участке ободочной кишки.
2. Синдром Бехчета, при котором к кишечным поражениям присоединяются ретинит, слепота, болезненные язвенные и некротические поражения слизистой рта и гениталий.
3. Некротизирующий энтероколит у грудных детей часто приводит к летальному исходу. Клинические проявления болезни приходятся на первую неделю жизни: диарея с примесью крови, признаки перитонита и шок. Характерны множественные язвенные поражения с перфорацией.
Классически хронические заболевания кишечника характеризуются как желудочно-кишечными (диарея, боли в животе, наличие крови в кале), так и общими (температура, потеря веса, задержка физического развития) симптомами.
Болезнь Крона: на фоне анорексии, типичной для этого заболевания, преобладают общие симптомы. Боли в животе напоминают приступы аппендицита. Кровь в кале обнаруживается редко. При осмотре отмечается болезненность в правой подвздошной области, там же иногда пальпируется масса.
Язвенный ректоколит: преобладают кишечные симптомы — тенезмы, диарея с примесью крови. При пальпации живота отмечается болезненность по ходу ободочной кишки.
Стенозы, абсцессы и фистулы, трещины, мегаколон, перфорации с массивным кровотечением, карцинома ободочной кишки, энтеропатия с потерей белка. Характерны такие общие осложнения, как воспаление радужки, сосудистой оболочки глаза, афтозный стоматит, артрит, перихолангит, склерозирующий холангит.
Хроническая диарея с болями в животе, кал с примесью крови позволяют думать о хроническом воспалительном заболевании кишечника.
Для подтверждения диагноза необходимо оценить данные лабораторного анализа: общий анализ крови; сидеремию; трансферинемию; иммуноглобулины; время свертываемости крови; содержание в крови кальция, фосфора, цинка, меди; костный возраст; С-реактивный белок, a1-антитрипсин; анализ кала. Особо важную роль для постановки диагноза приобрела контрастная рентгенография с барием. Широко используется рентгенография с двойным контрастированием, при которой отмечается:
— уменьшение просвета кишечной стенки;
— неоднородность рисунка;
— кистовидные участки.
Наличие этих трех признаков в терминальной части подвздошной кишки образует триаду Bodart, типичную для болезни Крона.
О распространении воспалительного процесса позволяют судить участки, заполненные лейкоцитами, меченными радиоактивным йодом I111. Компьютерная томография незаменима для выявления осложнений (фистул, абсцессов).
Окончательный диагноз ставится на основе биопсии.
Дифференциальный диагноз проводится с
— аллергическим колитом;
— узловой лимфоидной гиперплазией;
— хроническим гранулематозным заболеванием;
— аппендицитом;
— полипозом и лимфомой кишечника;
—болезнью Шенлейна — Геноха.
За последние годы значительно улучшился. Детская смертность практически исчезла (от 15 до 2%).
Большую тенденцию к рецидивам имеет язвенный ректоколит. Наблюдение за детьми заключается в
— контроле за ростом;
— контроле за показателями воспалительного процесса;
— за терапией [10].
Диетотерапия играет важную роль, особенно при болезни Крона, для которой характерна потеря веса и задержка роста [1, 2, 10, 15, 17].
Новый подход к терапии заключается в возможности достигнуть ремиссии с помощью диеты без гормональной терапии [1, 18, 21, 23, 24, 25].
Фармакотерапия основана на применении кортикостероидов [26], сульфасалазина, салазопирина [27, 28, 29], метронидазола [30]. Иммуносупрессоры малоприменимы из-за их токсичности.
Хирургическое лечение возможно при тяжелых осложнениях (мегаколон, стенозы, абсцессы, фистулы) и в случаях задержки роста в пубертатном и препубертатном периодах [13, 14].
Из клинической практики
Поражение печени, хотя и без явных клинических проявлений, встречается довольно часто при хронических заболеваниях кишечника. У взрослых в 70% случаев развивается перихолангит с портальной триадой. У 50% отмечаются жировые изменения печени. 10% приобретают заболевания печени. Цирроз печени развивается у 5%.
Другие, более тяжелые и редкие осложнения — это хронический активный гепатит, склерозирующий холангит и карцинома желчевыводящих путей.
Необходимо отметить, что у детей частым осложнением является хронический активный гепатит, в то время как перихолангит и склерозирующий холангит встречаются очень редко и протекают бессимптомно.
Представляем клинический случай язвенного колита у девочки трех лет. Начальная фаза заболевания протекала бессимптомно. Впоследствии развилась ярко выраженная гепатомегалия.
Девочка была госпитализирована в трехлетнем возрасте. За 8 месяцев до госпитализации отмечались раздражительность, потеря аппетита, непостоянные боли в животе, кал с примесью алой крови. С вышеописанной симптоматикой девочка была госпитализирована. При осмотре отмечалась значительная гепатомегалия (+4 см из-под реберной дуги по правой среднеключичной линии). В анализе крови СОЭ 104 мм в час; общий белок крови 9,9 гр%; альбумин 2,5 гр%; a1-глобулин 0,3; a2-глобулин 1,1; b-глобулин 1,0; g-глобулин 5,0; IgG 4810 мг%; щелочная фосфатаза 1273 МЕ; антитела противоядерные и против гладких мышц отсутствуют.
В период госпитализации девочка жаловалась на частые боли в животе. В кале примесь слизи и алой крови. При анализе слизи кала выявлено множество нейтрофильных лейкоцитов. Эндоскопически выявлен обширный воспалительный процесс по всей ободочной кишке с отеком слизистой. При контакте с инструментом слизистая легко кровоточила.
При множественных биопсиях проводился гистологический анализ, который выявил изрежение железистых протоков с моно- и полинуклеарной инфильтрацией.
Чрескожная печеночная биопсия выявила воспалительные и грануломатозные изменения преимущественно в портобилиарных пространствах. Более того, отмечался воспалительный процесс типа перихолангита и начального холангита в межлобулярных протоках.
Лечение преднизолоном в начальной стадии и далее салазопиридином (SAZP) привело к полной ремиссии кишечной симптоматики. Клиническая ремиссия с полной регрессией гепатомегалии (печень пальпировалась у реберной дуги) была подтверждена гистологически. Нормализовались и лабораторные показатели (IgG 997 мг%).
Известно, что язвенный колит нередко сопровождается непереносимостью белка коровьего молока, поэтому были проведены кожный тест и тест на определение специфичных IgE. IgE были значительно увеличены.
Быстрая клиническая ремиссия была обусловлена двумя факторами: назначением салазопиридина (SAZP) и одновременным исключением из диеты коровьего молока.
Chronic inflammatory bowel diseases
Summary
Chronic inflammatory bowel diseases are commonly believed to present in the form of two diseases with aetiologies of unknown origin, Ulcerative Rectocolitis and Chron’s Disease, which are characterised by important inflammatory events affecting the normal structure of the intestinal wall, with a tendency to relapse.
Both diseases share a variety of common characteristics and are thus considered by many as one single clinical entity.
The common features are the following:
- unknown aetiology
- inflammatory aspect of the lesions
- chronicity of the course of disease, with possible relapses
- association with extra-intestinal symptoms
- good response to corticosteroid therapy
- recourse to surgery (for a limited number of cases).
The aforenamed two paradigmatical pictures constitute the essentials of a spectrum comprising an indefinite number of intermediate pictures, for example Behcet’s Colitis, similar to Ulcerative Colitis but where ulcers can be found in the area of the mouth and the genitals, or Ulcerative Enterocolitis of the infant, thought to be a congenital form of Chron’s Disease.
Both pictures display gastrointestinal symptoms such as diarrhoea, tenesmus and bloody stools, usually prevailing in Ulcerative Colitis, and are accompanied by general symptoms such as fever and weight loss, usually found in Chron’s Disease.
One of the recent and most interesting aspects of Chron’s disease is the possibility to induce remission as well as restoration of the patient’s growth by administration of an elementary diet. The administration of a hypercaloric diet has also proved useful in correcting growth speed and in reducing the need of steroids, which also play an important role in inducing disease remission.
In order to further maintain remission, the administration of salazopirina (sulfosalazina) and corresponding salacylates, as well as of immunosoppressors such as azathioprine and cyclosporins, have proved useful. The administration of metronidazolo is indicated in the case of perineal injuries only. The use of surgery should be limited to complications and, in the presence of failure to thrive, only if the lesions are well delimited.

Внешние факторы не могут ни породить в организме, ни вызвать в нем ничего сверх того, что у него имеется в виде исторически развившихся потенций [8]. Каковы бы ни были внешние условия, они не могут напрямую произвести никаких изменений в организме. Эти изменения возникнут только при наличии соответствующего внутреннего основания. В конечном итоге именно внутренний фактор решает вопрос о возникновении болезни; он же придает ей свои черты в клиническом и морфологическом выражении.
Познание общепатологических механизмов немыслимо без анализа узловых проблем инфекционного процесса. Эволюционное становление воспалительной реакции определялось прежде всего бактериальной инвазией, что убедительно показано еще И.И. Мечниковым. В то же время понять специфические проявления той или иной инфекции, обособленно изучая микро- и макроорганизм, невозможно. Сущность инфекционного процесса открывается лишь в их взаимодействии. Более того, многие важные свойства патогенные микробы вообще не обнаруживают при их росте на искусственных питательных средах [6].
Патогенез инфекционных болезней не исчерпывается непосредственными результатами жизнедеятельности их возбудителей и повреждениями, причиняемыми бактериальными токсинами. Основные симптомы многих инфекционных болезней (лихорадка, кашель, понос и даже нагноение) носят приспособительный характер и отображают не столько повреждение, сколько активную реакцию организма. Так, пирогенные свойства микробных липополисахаридов долгое время представлялись совершенно бесспорными. Между тем выяснилось, что повышение температуры в таких случаях вызывает не сам эндотоксин, а эндогенные пирогены, выделяющиеся из погибающих лейкоцитов. Таким образом, речь идет не о повреждении, а об особом механизме, вступающем в действие под влиянием микробной инвазии и ведущем к температурной реакции, имеющей приспособительное значение. Образование эндогенного пирогена - уникальное свойство фагоцитов, специализирующихся на защите организма [6].
Однако в биологическом взаимодействии паразита с хозяином микроб также занимает свою активную позицию, направленную на выживание вида. Существование в природе многочисленных возбудителей инфекций поддерживается с помощью двух основных механизмов сохранения их видового состава: 1) путем длительной персистенции микробов в организме и 2) путем периодической смены хозяина в процессе бактериовыделения и последующего внедрения в новый организм. По-видимому, у возбудителей с узкой экологической нишей вероятность сохранения вида более надежно обеспечена при их длительном персистировании в организме, чем в процессе беспрерывной смены хозяина. Так, у Mycobacterium tuberculosis сохранение вида в значительной степени определяется их способностью к длительной персистенции, что обусловлено исключительно тесной адаптацией этих бактерий к одному виду хозяина [14]. Основными механизмами персистенции микробов в организме хозяина являются внутриклеточное паразитирование, антигенная мимикрия, образование L-форм, а также механизмы подавления факторов защиты макроорганизма [5, 12, 14]. Они являются биологической основой хронизации инфекционного процесса.
Эпителиальные клетки, подобно фагоцитам мезенхимального происхождения, способны к фагоцитозу. Б.М. Ариэль [2] выдвинул гипотезу, согласно которой при инфекционном процессе в определенных условиях может восстанавливаться фагоцитарная функция эпителия, присущая низко организованным животным и репрессированная в филогенезе. В ходе инфекционного процесса конвергентно сближаются морфологические и функциональные свойства фагоцитов и эпителиальных клеток различного гистогенеза. Эпителий дополняет элиминативную функцию мезенхимных элементов, когда они уже исчерпали свои возможности. Не обладая достаточно эффективными механизмами внутриклеточного разрушения бактерий, эпителиоциты транспортируют их в собственную оболочку, где они, встречаясь с фагоцитами, могут быть уничтожены. Здесь прослеживается один из механизмов отклонения тканевого гомеостаза - нарушение фагоцитарно-элиминативной функции эпителиального пласта. При повреждении (или истощении) этой функции микробы задерживаются, а затем размножаются в цитоплазме эпителиоцитов.
При изучении патогенных факторов микробов целесообразна сравнительная оценка скоростей развития некробиотических и репаративных изменений в тканях. Лишь в том случае, если первая скорость превышает вторую, патогенные факторы микробов приводят к развитию морфологически документируемого повреждения. При инфекционном процессе в первую очередь повреждаются не клетки как таковые, а клеточные популяции, ткани, состоящие из клеток разной дифференцированности и связанные единством происхождения и функции. Основное повреждающее действие на ткани при инфекционном процессе оказывают токсические факторы. Морфологические признаки такого повреждения проявляются в нарушении клеточной дифференцировки и межклеточных контактов, обеспечивающих целостность эпителия как тканевой системы.
Для хронического инфекционного процесса характерно волнообразное течение: фаза обострения при благоприятном течении заболевания сменяется фазой ремиссии и т.д. В фазе ремиссии хронического воспалительного процесса в зоне поражения находят признаки хронического воспаления - макрофагально-лимфоцитарную инфильтрацию (в фазе обострения - нейтрофильную). Что ее поддерживает? Значит, имеет место персистенция причинного фактора [12]. Морфологически в этой фазе наблюдается хроническая (перманентная) дисрегенерация. В чем ее сущность?
Здесь вырисовывается универсальный приспособительный механизм. В фазу ремиссии патогенная инфекция уходит во внутриклеточное персистирование, уклоняясь от иммунной защиты. В ответ на это организм активно включает механизм апоптоза, направленный на элиминацию микробной инфекции. Апоптоз, в свою очередь, вызывает активацию регенераторных процессов. Так поддерживается феномен приспособительного усиления пролиферативной активности ткани в зоне хронического инфекционного процесса (в регенерирующих тканях). В фазе обострения усиление пролиферативных процессов гораздо более выражено в связи с массовой гибелью клеток в зоне воспаления.
Инфекционный процесс во многих случаях начинается не с взаимодействия патогенного микроорганизма с восприимчивым макроорганизмом как таковым, а прежде всего с взаимодействия с микрофлорой хозяина. Микробы-антагонисты на слизистых оболочках осуществляют защитное действие. Так, кишечная микроэкологическая система является частью гомеостатической системы организма. Микроэкология желудочно-кишечного тракта (ЖКТ) включена в систему защиты организма, и при ее нарушении становится источником инфекционного процесса. Основной механизм защиты слизистой ЖКТ - колонизационная резистентность. Пристеночная микрофлора повышает колонизационную резистентность кишечника, конкурируя с патогенными микроорганизмами за взаимодействие с рецепторами эпителиальных клеток слизистой оболочки ЖКТ. Она способствует нормальному течению метаболических процессов в эукариотных клетках [7].
Таким образом, персистенция микробной инфекции в условиях отклонения тканевого гомеостаза барьерных тканей является фундаментальной биологической основой хронизации инфекционного процесса.
Читайте также:

