Ифа для диагностики лепры
Обновлено: 26.04.2024
Гипотетически многие вопросы становятся разрешимыми, а особенности лепры понятными, если предположить, что Mycobacterium leprae способны автономно существовать вне организма хозяина в окружающей среде.
Еще в конце XIX века Biedencap, Beaven-Racke, Lutz высказывали предположения о возможности заражения лепрой из окружающей среды, однако все они были чисто умозрительными (цит. по Д.Ф. Решетилло [1]).
1. Кислотоустойчивость и морфологические особенности (размеры, форма и окрашивание) такие же, как и у M. leprae, выделенных от нелеченых больных лепроматозной лепрой.
2. Способность размножаться в предлагаемых авторами условиях культивирования.
3. Невозможность культивирования на обычных питательных средах, в том числе и на средах, которые применяются для культивирования M. tuberculosis и других микобактерий, например на среде Левенштейна-Йенсена.
4. Способность размножаться в подошве лапы иммунологически нормальных мышей в характерной манере: со временем удвоения в период логарифмической фазы размножения, равным 10-15 сут, и максимальным количеством, достигающим у мышей линии СВА 1·106 - 1·106,3 микробных тел в подошве лапы через 6-10 мес.
5. Размножение в организме мыши должно тормозиться при постоянном назначении животным дапсона с пищей в концентрации 0,0001 г на 100 г корма, в том случае, если данный штамм M. leprae чувствителен к дапсону.
6. Вызывать реакцию Митсуды диаметром более 10 мм у больных туберкулоидной лепрой и не вызывать таковую у больных лепроматозной лепрой при внутрикожном введении микроорганизмов в дозе 1·106 - 1·107,2 в 0,1 мл раствора.
7. Вызывать характерные поражения в инокулированной задней лапе бестимусных мышей или мышей с другим иммунным дефектом через 12-18 мес после заражения исследуемыми микроорганизмами.
8. Содержать в ДНК 56% гуанинина + цитозина.
9. Обладать гомологией по ДНК с аутентичными M. leprae, равной 70%, в оптимальных условиях реассоциации.
10. Наличие миколевых кислот и пептидогликанов, характерных для M. leprae.
11. Наличие специфического для M. leprae пептидогликана и других антигенов или эпитопов, демонстрируемых в ходе реакции со специфическими моноклональными антителами.
Таким образом, мы имеем культуру микобактерий лепры, пригодную для использования при создании и совершенствовании диагностических и вакцинных препаратов при лепре, что и было продемонстрировано в наших работах.
Таким образом, причины существования эндемичных по лепре регионов можно объяснить не только наличием больных лепрой людей, но и комплексом природных факторов, главным из которых является наличие свободноживущих в окружающей среде M. leprae (как части экосистемы), способных вызвать при определенных условиях у восприимчивых людей и животных лепрозную инфекцию.
Решетилло Д.Ф. Проказа. Ст-Петербург 1904;515.
Portaels F. Study of unclassified dapsone sensitive mycobacteria isolated from the environment in Zaire. Ann Soc Belge Med Trop 1980;60:381-386.
Portaels F. Taxonomic studies of mycobacteria belonging to the "M.lufu" group. XII International Leprosy Congress: Abstracts. New Delhi 1984;IV/220:A.
Hansen G.A. Spedalskhedens Arsager. Norsk Magazin for Laegevidenskaben 1874;4:76-79.
Bapat C.V. Cultivation of Mycobacterium leprae: a new approach. Int J Lepr 1989;57:4:874-879.
Beaman B.L., Kwang-Shin Kim, Laneelle M.A., Barksdale L. Chemical characterization of organisms isolated from leprosy patients. J Bact 1974;117:3:1320-1329.
Laboratory Techniques for Leprosy. Geneva (WHO) 1987;165.
Калянина О.В., Юшин М.Ю., Дячина М.Н. и др. Сравнительная культурально-биохимическая и иммунохимическая идентификация лабораторных штаммов культивируемых микобактерий из лепрозных поражений больных и почвы. Пробл туб 2000;5:49-52.
Shepard С.С. The experimental disease that follows the infection of human leprosy bacilli into footpads of mice. J Exp Med 1960;112:445-454.
Вишневецкий Ф.Е., Фрейдлин И.С., Ющенко А.А. и др. Применение тафцина в экспериментальной лепрологии. Бюл экспер биол 1991;8:181-183.
Юшин М.Ю., Васильев А.Э., Калянина О.В. Изучение некоторых свойств M. lufu в опытах in vivo. Эпидемиология, клиника, диагностика, лечение и профилактика важнейших инфекционных болезней: Материалы.Тамбов- Астрахань 1994;137-138.
Юшин М.Ю., Маслов А.К., Бочановский В.А. и др. Биохимическое и электронно-цитохическое изучение ДОФА-оксидазной активности у M. lufu: Тезисы. Астрахань 1997;26.
Саламатина О.С., Дячина М.Н., Калинина О.А. и др. Выявление видоспецифических антигенных детерминант микобактерий лепры с помощью моноклональных антител. Актуальные вопросы дерматологии и венерологии: Сборник научных трудов. Астрахань 1998;115-117.
Саламатина О.С. Сравнительная характеристика антигенного состава микобактерий лепры и некоторых культивируемых микобактерий: Автореф. дис. . канд. мед. наук. М 2000;22.
Laemmli U.K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 1970;227:680-685.
Юшин М.Ю., Дячина М.Н., Бочановский В.А., Ющенко А.А. Обнаружение антител к M. leprae в слюне больных лепрой. Клин лаб диагност 2005;1:52-54.
Dastidar S.G., Chakrabarty A.N. A natural ecosystem for leprosy related chemoautotrophic nocardioform bacteria: transmission of leprosy bacillus to humans from fossil fuel rich soil. 14 International Congress: Abstracts. Orlando 1993;74A.
Chakrabarty A.N., Dastidar S.G. Is soil an alternative source of leprosy infection? Acta Lepr 2001-2002;12:2:79-84.
ИФА. Иммуноферментный анализ ( ифа ). Метод иммуноферментного анализа (ИФА). Схема, методика иммуноферментного анализа ( ифа ).
Метод иммуноферментного анализа (ИФА) во многом напоминает РИА, но включает использование коммерческих реагентов — Аг или AT, маркированных ферментами (например, пероксидазой или щелочной фосфатазой). После образования иммунного комплекса в систему вносят субстрат, расщепляемый ферментом, что приводит к окрашиванию среды в жёлто-коричневый (при использовании псроксидазы) или жёлто-зелёный цвет (при использовании фосфатазы).
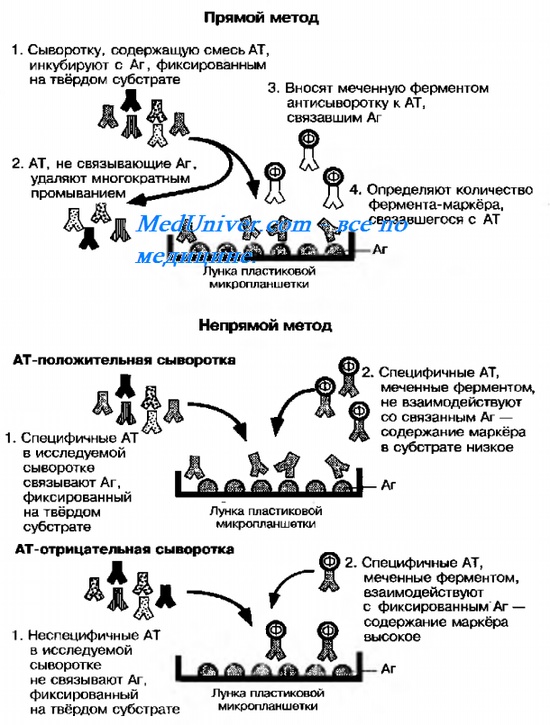
Рис. 10-19. Схема выявления Аг прямым и непрямым методами твердофазного ИФА.
По сравнению с классическими методами выявления Аг, иммуноферментный анализ ( ифа ) позволяет непосредственно регистрировать взаимодействие Аг с AT в специфической фазе, а не анализировать вторичные проявления взаимодействия — агглютинацию, преципитацию или гемолиз. Метод отличает высокая чувствительность — обычно достаточно присутствия Аг в концентрации I нг/мл. К настоящему времени созданы многочисленные модификации базовой методики.
Наибольшее распространение получил гетерогенный иммуноферментный анализ ( ифа ) на твёрдой фазе (твердофазный ИФА). Для этого коммерческие моноклональные AT или Аг фиксируют на лунках пластиковых панелей, куда затем вносят исследуемый материал (содержащий Аг или AT). Основные варианты твердофазного иммуноферментный анализ ( ифа ) представлены на рис. 10-19. На практике ИФА широко применяют для выявления Аг Chlamydia trachomatis в мазках из мочеиспускательного канала и влагалища, стрептококков группы А в мазках из зева и токсина Clostridium difficile в фекалиях. Метод позволяет не только выявлять AT, но и определять их принадлежность к различным классам lg, например выявлять IgM к Аг Mycoplasma pneumoniae.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Прогноз лепры. Диагностика лепры
Лепра редко является непосредственной причиной гибели больных, однако смертность среди лепроматозных пациентов вчетверо выше, чем в популяции в целом. Основными причинами смерти у нелеченных больных лепрой служат интеркуррентные Выявление больных лепрой производится на основании анализа комплекса клинико-эпидемиологических и лабораторных данных. В эндемических районах лепру необходимо предполагать у пациентов с наличием одного из следующих кардинальных признаков: 1) соответствующие лепре кожные поражения с четкой утратой чувствительности и с утолщением или без утолщения нервов; 2) положительный результат биопсии кожи.
Дифференциальный диагноз проводят с туберкулезом кожи, язвой Бурули, кожным лейшманиозом, дерматомикозами, сифилитическими поражениями, остеомиелитом, злокачественными новообразованиями кожи. Часто дифференцируют лепру и сирингомиелию, при которой, в отличие от лепры, нарушения чувствительности носят сегментарный характер, моторные расстройства превалируют над сенсорными.
Специфическая диагностика лепры заключается в обнаружении микобактерий в соскобе со слизистой оболочки носа и из очагов поражения кожи, в пунктате из лимфатических узлов при микроскопии препаратов, окрашенных по Ziehl-Neelsen. Соскоб из кожных элементов получают путем неглубокого (бескровного) надреза кожи в предварительно обескровленном при сжатии участке. Результаты исследования выражают в виде бактериологического индекса
Важное диагностическое значение, особенно в случаях РБ-лепры, имеет гистологическое изучение кожных биоптатов с определением морфологического индекса (morphological index — MI), позволяющее выявить характерные для различных типов лепры изменения.
Лепроминовый тест (реакция Mitsuda), выявляющий реакцию гиперчувствительности клеточного типа, применяется для более точного разграничения форм лепры, выбора терапии и контроля ее эффективности. Стандартный лепромин Mitsuda является ав-токлавированной суспензией М. leprae из гомогенизированной ткани лепром и содержит около 160 млн микобактерий в 1 мл. Лепромин вводится внутрикожно по 0,1 мл.
В случае положительной реакции через 48 ч в месте инъекции возникают эритема или папула (ранняя реакция Fernandez), а спустя 2-4 нед — бугорок или узел, в ряде случаев с последующим некрозом и рубцеванием (реакция Mitsuda), результаты оцениваются в баллах (1+, 2+ и 3+).
У больных ТТ-лепрой и 80-98% здоровых людей реакция Mitsuda положительна, но может на короткое время становиться отрицательной в период лепрозной реакции. При BB-лепре реакция Mitsuda может быть как положительной, так и отрицательной и изменяется в зависимости от направленности процесса по нисходящему (становится отрицательной) или по реверсивному (становится положительной) типам. У больных ZZ-лепрой лепроминовый тест стойко отрицателен.
При гистаминовой и морфинной пробах на поверхность исследуемого пятна наносят каплю раствора гистамина (1:1000) или 1% раствора морфина, затем производят укол иглой, не проникающий в дерму. На коже здоровых людей и в непораженных участках кожи у больных лепрой, а также у пациентов с нелепрозными высыпаниями возникает первичная и вскоре вторичная эритема диаметром несколько сантиметров, в центре которой через несколько минут появляются волдыри или папулы, иногда с некрозом (триада Lewis); в очагах лепрозных поражений вторичная эритема не выражена или отсутствует.
При пробе на потоотделение кожу смазывают реактивом Minor (2 г йода, 15 г крахмала и 98% спирта до 100 мл) или спиртовым раствором йода с последующим припудриванием крахмалом. После сухожаровой ванны участки кожи с нормальным потоотделением принимают синий цвет, пораженные участки с ангидрозом сохраняют цвет йода При применении горчичников в области лепрозного поражения кожи характерная эритема не развивается.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
В статье отражены современные представления о лепре, представлены современные данные литературы, посвященные вопросам эпидемиологии заболевания, особенностям клинической картины, диагностики, дифференциальной диагностики и лечения дерматоза.
The article summarizes information about the disease leprosy. Data of the literature on epidemiology of the disease, the features of the clinical picture, diagnosis, differential diagnosis and treatment of the dermatosis are presented.
Лепра (проказа, болезнь Хансена) — хроническое инфекционное заболевание из группы микобактериозов, характеризующееся продолжительным инкубационным периодом и рецидивирующим течением. Заболевание носит системный характер и поражает производные эктодермы — кожные покровы, слизистые оболочки и периферическую нервную систему. В настоящее время, несмотря на применение эффективной схемы антибиотикотерапии и устранение угрозы эпидемии лепры, по всему миру продолжают ежегодно выявляться новые случаи заболевания, поэтому перспектива полной ликвидации болезни ставится под сомнение [1–3].
Распространенность лепры в мире стабильно снижается из года в год. Согласно данным ВОЗ, количество новых случаев, каждый год выявляемых во всем мире, уменьшилось с 763 000 в 2001 г. до 249 000 в 2008 г. [1]. В 2013 г. было выявлено 215 656 новых случаев заболевания, в 2014 г. — 213 899, в 2015 г. — 211 973 [2, 3].
Глобальная статистика свидетельствует о том, что 96% (203 600 человек) новых случаев заражения лепрой были выявлены в 22 государствах (таких как Индия, Бразилия, Ангола, Конго, Судан, Эфиопия и др.). На долю других стран приходятся оставшиеся 4% [3].
Одной из шести стран мира с наиболее высокой распространенностью лепры является Бразилия, где ежегодно диагностируется более 30 000 новых случаев заболевания. В 2014 г. распространенность лепры в Бразилии составила 1,27 случая на 10 000 жителей. Уровень распространенности дерматоза по стране неравномерен: помимо эндемичных по лепре регионов существуют и такие, в которых отмечается низкий уровень распространенности лепры [4].
В России эндемичным регионом по лепре является Астраханская область. За последние десятилетия больные лепрой были выявлены и в других субъектах Российской Федерации: в Сибири, на Северном Кавказе и Дальнем Востоке [9, 10]. Однако стоит отметить, что, благодаря внедрению в практику целого комплекса противолепрозных мероприятий, заболеваемость лепрой в России носит устойчивый спорадический характер. В 2015 г. на учете состояло 240 больных, из них в Астраханской области — 135 [10].
Возбудителями лепры являются Mycobacterium leprae (M. leprae) и Mycobacterium lepromatosis (M. lepromatosis). M. leprae была впервые открыта норвежским врачом Герхардом Хансеном в 1873 г. [11]. Данный микроорганизм относится к семейству Mycobacteriaceae и является кислото- и спиртоустойчивой бактерией, которая представляет из себя грамположительную прямую или изогнутую палочку длиной 1–7 мкм и диаметром 0,2–0,5 мкм [12]. M. leprae может длительное время сохранять жизнеспособность при низких температурах и высушивании. Данному микроорганизму свойственен крайне медленный рост, который зачастую не характерен для бактерий (одно деление продолжается приблизительно 12 суток) [12]. Возбудитель заболевания является облигатным внутриклеточным паразитом. M. leprae способна продолжительно персистировать в макрофагах человека, что обеспечивается взаимодействием различных механизмов (антигенная изменчивость и пр.). Именно поэтому пациенты, выписанные из лепрозориев на амбулаторное лечение с персистирующими формами лепры, могут быть источником заражения [9].
В 2008 г. был открыт второй возбудитель лепры — M. lepromatosis, который, в отличие от M. leprae, является некислотоустойчивой бактерией и вызывает преимущественно тяжелый диффузный лепроматозный тип лепры [13, 14].
От других инфекционных заболеваний лепру отличает длительный инкубационный период, который варьирует от 2–3 месяцев до 50 лет (в среднем составляя 4–6 лет) [11].
Общепризнан воздушно-капельный путь передачи инфекционных агентов, однако не исключаются другие пути заражения — через укусы кровососущих насекомых и поврежденные кожные покровы. Лепра является малоконтагиозным заболеванием. Заражение микобактериями лепры происходит в результате длительного тесного общения с больным, не получающим лечения, вследствие сенсибилизации, нарастающей при повторяющихся контактах, снижения сопротивляемости организма (в результате неполноценного питания, тяжелых физических нагрузок, частых простудных заболеваний, алкоголизма и других интоксикаций) и иммуногенетической восприимчивости [11].
На восприимчивость к лепре оказывают влияние различные наборы генов, в том числе системы антигена лейкоцитов человека (HLA). В настоящее время изучаются изменения в генах-кандидатах, участвующих в ответной реакции организма хозяина на инфекционный агент. Исследования геномного сканирования выявили связывающие пики для лепры в областях хромосом 6p21, 17q22, 20p13 и 10p13 [15, 17].
Устойчивость к заражению M. leprae обеспечивается, с одной стороны, низкой вирулентностью M. leprae, с другой — индивидуальными особенностями врожденного иммунитета. Важную роль в поддержании врожденного иммунитета играет целостность эпителия, секрет желез и поверхностный иммуноглобулин A (IgA). Кроме того, уничтожать микобактерии, независимо от активации адаптивного иммунитета, могут NK-клетки, цитотоксические Т-лимфоциты и активированные макрофаги. При заражении регулирование воспалительных цитокинов и хемокинов приводит к пролиферации либо Т-хелперов 1-го типа (Th1), либо Т-хелперов 2-го (Th2) типа, что способствует активации клеточного или гуморального звена иммунитета, что определяет клиническую форму заболевания [16, 17].
Клеточный иммунитет неэффективен в отношении предотвращения развития заболевания у лиц с туберкулоидной формой лепры. Гуморальный иммунитет у лиц с лепроматозной формой заболевания, ответственный за продуцирование IgM против PGL-1 (фенольный гликолипид-1), не обеспечивает защиту и не предотвращает диссеминацию бактерий [17].
Высокий уровень ФНО-α в сыворотке крови у пациентов с туберкулоидной формой лепры свидетельствует об участии данного цитокина в деструкции M. leprae и образовании гранулемы. ФНО-α участвует в иммунной защите посредством активации макрофагов, однако гиперпродукция ФНО-α и его взаимодействие с ИФН-γ способствуют повреждению тканей и формированию узловатой лепрозной эритемы (ENL) [17].
При лепроматозной форме лепры наблюдается повышенный уровень трансформирующего фактора роста бета (ТФР-β), отсутствующего при туберкулоидной форме и проявляющегося в небольшом количестве при пограничной форме лепры. ТФР-β подавляет активацию макрофагов, что ингибирует продуцирование ФНО-α и ИФН-γ, способствуя персистенции инфекции [17].
О механизмах трансмиссии лепры известно, что микобактерии проникают в клетки эндотелия и оседают в Шванновских клетках нервов кожи, к которым имеют тропизм, где в дальнейшем происходит долговременный период их адаптации и размножения. Остается неизвестным, как колонизация Шванновских клеток микобактериями лепры приводит к распространению инфекции в другие ткани [18]. Нейронный тропизм M. leprae обусловлен его связыванием с областью G на мостике молекулы ламинина альфа-2, а альфа-дистрогликан служит рецептором для M. leprae на Шванновских клетках [18].
В работе Masaki и соавт. (2013), в исследовании in vitro и in vivo с использованием мышей, определялось взаимодействие M. leprae со Шванновскими клетками. Исследование показало, что M. leprae изменяют дифференцировку Шванновских клеток до клеток-предшественников [19]. Клеточная перестройка приводит к снижению регуляции Шванновской клеточной линии Sox10 [19]. Таким образом, M. leprae способствуют распространению инфекционного процесса через два механизма: прямая дифференцировка Шванновских клеток в мезенхимальные ткани и образование гранулемаподобных структур, которые выделяют бактерионесущие макрофаги [19]. Исследование расширяет понимание о пластичности зрелых клеток и демонстрирует свойства M. leprae, приводящих к перестройке взрослых клеток в стволовые [18]. Распространение инфекции путем дифференцировки Шванновских клеток возможно при их инфицировании большим количеством M. leprae. Методология, используемая на мышах, у которых нет Т-клеток, упрощает воспалительное микроокружение в преимущественно макрофаги [19]. Данная работа описывает перспективную in vitro модель для объяснения патогенеза M. leprae, но необходимы подробные исследования, прежде чем экстраполировать выводы на течение инфекционного процесса в организме человека [18].
Существует две классификации лепры: мадридская классификация, принятая в 1953 г., а также ее последующая модификация, предложенная Д. С. Ридли и В. Джоплингом в 1973 г. [11].
Согласно мадридской классификации выделяют два полярных типа лепры: туберкулоидный и лепроматозный и два промежуточных типа: недифференцированный и пограничный (диморфный) [11].
В классификации Ридли–Джоплинга выделяют три типа лепры — недифференцированный (I — Indeterminate), туберкулоидный (Tuberculoidtype — TT) и лепроматозный (Lepromatoustype — LL). Лепроматозный и туберкулоидный типы являются полярными. Кроме того, различают субполярные и пограничные группы заболевания. Классификация Ридли–Джоплинга не нашла широкого применения ввиду сложности, поэтому в практической деятельности различают лепроматозный и туберкулоидный тип лепры, а также пограничный тип, который в дальнейшем может трансформироваться в одну из первых двух форм [20].
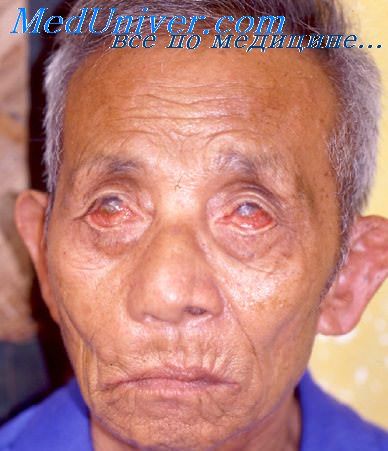
При лепроматозном типе лепры поражается как периферическая, так и центральная нервная система с развитием невротических расстройств, реже — психозов и поражений по типу невритов и полиневритов. В большинстве случаев поражаются лучевые, малоберцовые и большие ушные нервы: они утолщаются и становятся доступными для пальпации. В последующем развиваются двигательные и трофические расстройства, а также нарушения чувствительности. Больным свойственны невралгии, гиперестезии, парестезии, неадекватное или замедленное реагирование на раздражение, аналгезия. На фоне трофических нарушений развивается процесс мутиляции кистей и стоп. Поражение внутренних органов характеризуется неспецифическими изменениями в печени, легких, селезенке и нарушением функции некоторых желез внутренней секреции [11].
При недифференцированной форме лепры специфические высыпания отсутствуют. Для данной формы характерно появление небольшого количества бледных пятен различной величины с нечеткими границами, а также поражение периферической нервной системы по типу полиневрита. Как правило, выявить возбудителя у этой категории лиц удается крайне редко [11].
При развитии обострений лепрозного процесса форма заболевания может меняться. Несмотря на множество клинических проявлений лепры, окончательная постановка диагноза не всегда является простой задачей, так как отсутствуют патогномоничные клинические признаки заболевания [25].
При диагностике лепры учитывают данные эпидемиологического анамнеза (пребывание в эндемичном регионе, контакты с больными лепрой), объективного осмотра (обращают внимание на характер и длительность существования высыпаний, наличие признаков нарушений периферической иннервации).
Общепринятым лабораторным методом диагностики лепры считается бактериоскопическое исследование. Соскобы для исследования берут с очагов поражения на коже и слизистой оболочке носа путем легкого поскабливания. Мазок помещают на предметное стекло и окрашивают по Цилю–Нильсену. Также исследуют пунктат из бедренных или паховых лимфатических узлов. Однако бактериоскопическое исследование имеет очень низкую чувствительность, особенно у больных с промежуточной или туберкулоидной формой поражения [26].
Лепроминовая реакция (проба Митсуды) является показателем способности хозяина поддерживать в своем организме клеточный иммунитет к M. leprae. Проба Митсуды не всегда является достоверной, так как у 10% здоровых по лепре людей может наблюдаться отрицательная реакция. Ограничивают применение лепроминового теста и технические трудности, связанные с получением лепромина и его внутрикожным введением [11].
Наиболее чувствительным методом диагностики, позволяющим определять M. leprae, является полимеразная цепная реакция (ПЦР). ПЦР на данный момент считается наиболее перспективной из прямых диагностических методик и применяется для диагностики любого типа лепры [10, 18]. Преимуществом ПЦР являются неинвазивность и простота получения клинического материала, что предоставляет возможность проведения скрининга большого количества образцов при обследовании пациентов в высокоэндемичных по этому заболеванию регионах. Применение ПЦР позволяет усовершенствовать диагностику лепры и выявлять заболевание на ранней стадии [26].
Используемые в настоящее время традиционные методы диагностики, такие как лепроминовая проба и бактериоскопическое исследование, не всегда позволяют подтвердить диагноз лепры на ранних стадиях заболевания. При этом эффективность лечебных и профилактических мероприятий определяется возможностью ранней диагностики заболевания. В мире постоянно регистрируются новые случаи лепры, поэтому актуальным вопросом остается разработка и внедрение новых, более точных, методов диагностики, которые стали бы доступными для широкого использования и позволили с высокой степенью достоверности диагностировать лепру на ранних стадиях развития заболевания.
Лечение заболевания стандартизовано ВОЗ в 1981 г. [28]. Комбинированная лекарственная терапия включает в себя использование трех основных препаратов: дапсон, рифампицин и клофазимин [28].
Дапсон — бактериостатический препарат, действующий как конкурентный ингибитор ферментов дигидрофолатсинтетазы и дигидрофолатредуктазы, которые являются ключевыми ферментами путей биосинтеза фолатов в микобактериях лепры [28].
Рифампицин — оказывает в отношении M. leprae бактерицидное действие. Является селективным ингибитором ДНК-зависимой РНК-полимеразы и блокирует синтез РНК [29].
Клофазимин — жирорастворимый кристаллический краситель красноватого цвета с бактериостатическим и противовоспалительным свойствами. Механизм антибактериального действия клофазимина изучен недостаточно. Вероятно, он связан с блокировкой матричной функции ДНК, повышением фагоцитарной активности макрофагов и синтеза лизосомальных ферментов [28]. Клофазимин и рифампицин обладают эффективностью в отношении дапсонрезистентных микроорганизмов.
В 1997 г. ВОЗ была установлена продолжительность курса лечения: 6 месяцев для мультибациллярных форм лепры и 12 месяцев для олигобациллярных. Дапсон назначается в дозировке 100 мг для взрослых один раз в день, рифампицин в дозировке 600 мг один раз в месяц, клофазимин в дозировке 300 мг один раз в месяц. Для лечения детей применяются более низкие дозы препаратов [28]. В случае невозможности применения одного или двух препаратов из вышеперечисленных существуют схемы лечения с применением фторхинолонов, которые также показали свою эффективность в отношении M. leprae [30].
Своевременная диагностика лепры, профилактика распространения лепры беженцами и вынужденными переселенцами, особенно из высокоэндемичных государств (Бангладеш, Филиппинские острова, Индия, Ангола, Бразилия, Шри-Ланка и др.), являются серьезной и актуальной проблемой для мирового здравоохранения, одной из приоритетных задач при осуществлении контроля над здоровьем иностранных граждан и лиц без гражданства, въезжающих на территорию страны. В Российской Федерации, в соответствии с существующим порядком, установленным на законодательном уровне, для контроля над распространением заболеваний среди населения, нерезидентам Российской Федерации необходимо пройти медицинское освидетельствование в медицинских организациях. Однако данная процедура освидетельствования осложнена отсутствием комплексной методологической платформы.
Таким образом, несмотря на снижение распространенности лепры, представляется актуальным усиление контроля за обязательным обследованием на лепру прибывающих в страну иностранных граждан, разработка отечественных аналогов лекарственных препаратов и поиск новых схем лечения больных лепрой.
Литература
А. А. Кубанов*, доктор медицинских наук, профессор, член-корреспондент РАН
Т. В. Абрамова**, кандидат медицинских наук
Е. К. Мураховская* , 1 , кандидат медицинских наук
В. А. Ласачко*
* ФГБОУ ДПО РМАНПО МЗ РФ, Москва
** ФГБУ ГНЦДК МЗ РФ, Москва
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Напоминаем вам, что самостоятельная интерпретация результатов недопустима, и приводимая ниже информация носит исключительно справочный характер.
Сифилис RPR: показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
Определение
Антикардиолипиновый тест RPR (Rapid Plasma Reagin, тест быстрых плазменных реагинов, Nontreponemal test, syphilis screening test, STS) для выявления сифилиса - современный аналог реакции Вассермана (RW).
RPR-тест является самым высокочувствительным тестом среди нетрепонемных тестов (тестов, определяющих антитела к липоидным антигенам тканей хозяина или возбудителя) при первичном, скрытом и позднем сифилисе.
Показания к назначению исследования
Сифилис – инфекционное заболевание, вызываемое бледной трепонемой (Treponema pallidum), характеризуется периодичностью течения и поражением кожи, слизистых оболочек, внутренних органов и опорно-двигательного аппарата.
Заболевание может передаваться половым путем, трансплацентарным (от больной матери плоду через плаценту), трансфузионным (при переливании крови от донора, больного сифилисом), контактно-бытовым (встречается преимущественно среди детей при бытовом контакте с родителями, имеющими сифилитические высыпания на коже и/или слизистых оболочках), профессиональным (инфицированию подвержены врачи - акушеры-гинекологи, хирурги, стоматологи при выполнении профессиональных обязанностей).
Показаниями для обследования на сифилис являются:
- скрининговое обследование пациентов стационаров, беременных, доноров, медицинских работников, работников детских учреждений, торговли и общественного питания;
- обследование лиц, имевших половой или бытовой контакт с больным сифилисом;
- обследование лиц при подозрении на сифилис (присутствии симптомов, указывающих на возможное наличие заболевания);
- обследование новорожденных с целью выявления врожденного сифилиса;
- контроль эффективности терапии.
Подготовка к процедуре
Специальная подготовка к сдаче RPR-теста не требуется. Рекомендуется взятие крови не ранее чем через 4 часа после последнего приема пищи. Кроме того, не следует курить хотя бы 30 минут до исследования.
Синонимы: Анализ крови на сифилис; Неспецифический антифосфолипидный (реагиновый) тест, современный аналог реакции Вассермана (RW). Nontreponemal test; Rapid plasma reagin test; Syphilis screening test; STS. Краткое описание исследования RPR тест RPR тест – чувствительный нетрепонемный тес.
Читайте также:

