Инфекционные бактерии в печени
Обновлено: 25.04.2024
Бактериальные гепатиты - диагностика
Незначительные гистологические изменения и отклонения от нормальных биохимических показателей крови характерны для бактериальной септицемии. Например, при лептоспирозе, особенно если он вызван Leptospira icterohaemorrhagica (болезнь Вейла), могут наблюдаться тяжелые повреждения печени и почек в сочетании с геморрагическими высыпаниями.
Желтуха — частый симптом при данном процессе, хотя гистологические изменения ткани печени обычно легкой степени и неспецифичны.
Туберкулез печени встречается значительно чаще, чем принято считать. При этом наиболее характерный гистологический признак — гранулемы, часто с казеозным некрозом. В отсутствии некроза гранулемы неотличимы от саркоидных.
Наиболее часто подобные образования находят внутри долек, однако в них достаточно сложно обнаружить кислотоустойчивые бактерии. Для бруцеллеза также характерен гранулематозный процесс, при котором выявляют скопление небольшого количества лимфоцитов, плазматических клеток и гистиоцитов.
Гранулемы в печени считают неспецифическим симптомом, поскольку они образуются при широком спектре состояний, включая инфекционные заболевания, лимфому и употребление лекарственных препаратов. Для врожденного сифилиса характерны присутствие в ткани печени спирохет и диффузный фиброз паренхимы, который может прогрессировать с исходом в перицеллюлярный цирроз.
Гранулематозный гепатит — частый признак вторичного сифилиса. Гранулемы также можно встретить и при третичном сифилисе, однако классический симптом данной стадии — сифилитическая гумма — некротический узел, окруженный грануляционной тканью, по мере заживления которого образуются глубокие рубцы (hepar lobatum) и фиброз.
Гистологическая картина печени при туберкулезе: казеозная гранулема (а), окраска гематоксилин-эозином, х 125.
Кислотоустойчивые бактерии (б), окраска по Цилю-Нельсену. Гранулематозный гепатит, обнаруженный при поиске причин лихорадки. Окрашивание PAS (х 180). Гистологическая картина печени при врожденном сифилисе: диффузный перицеллюлярный фиброз (а), окраска гематоксилин-эозином (х 160).
Спирохеты (б), окраска по Левадити, х 600).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Паразитарные заболевания печени – группа разнородных болезней, вызываемых паразитами и гельминтами. Самые распространенные паразитозы печени: аскаридоз, эхинококкоз, амебиаз, описторхоз и др. К общим симптомам относят истощение, дистрофические изменения кожи и волос, повышенную утомляемость, нарушения сна, неприятный запах изо рта. В диагностике используют дуоденальное зондирование, исследование дуоденального содержимого, анализ кала на яйца гельминтов, УЗИ, КТ, сцинтиграфию печени. Лечение консервативное, заключающееся в назначении антипаразитарного препарата (специфического либо широкого спектра действия), либо оперативное.
Общие сведения
Паразитарные заболевания печени вызываются протозоозами и глистными инвазиями. Всемирная организация здравоохранения считает, что не менее 25% населения Земли заражено теми или иными паразитами. Паразитозы и гельминтозы занимают четвертое место среди заболеваний, приносящих наибольший вред здоровью человека. На данный момент не существует исследований, которые бы отражали истинную заболеваемость паразитарными болезнями и гельминтозами в России. По мнению экспертов в области инфекционных заболеваний и гастроэнтерологии, паразитарные инвазии могут быть выявлены не менее чем у двадцати миллионов россиян. Учитывая тот факт, что паразиты и глисты могут персистировать в организме долгие годы, заболевание нередко накладывает отпечаток на всю жизнь: вызывает задержку роста и развития в детском возрасте, ухудшает умственные способности школьников, провоцирует снижение работоспособности и активности взрослого населения.
Причины паразитарных заболеваний печени
Все паразитарные заболевания печени возникают либо при протозойном инфицировании, либо в результате глистной инвазии. Поражение печени в этой ситуации выступает одним из проявлений генерализованной инфекции. Среди протозойных инфекций печень чаще всего поражается при токсоплазмозе, амебиазе, лейшманиозе, малярии. Гельминтозы представлены нематодозами, цестодозами, трематодозами. Нематодозы вызываются круглыми червями (аскаридоз, стронгилоидоз, токсокароз, трихинеллез); трематодозы – сосальщиками (фасциолез, клонорхоз, описторхоз); цестодозы – ленточными глистами (альвеококкоз, эхинококкоз).
Разнообразие клинических проявлений паразитарных заболеваний печени обусловлены не только видом паразита либо гельминта, но и их жизненным циклом, местом внедрения в организм, локализацией различных жизненных форм, реакцией иммунитета на возбудителя.
Сосальщики обычно локализуются в желчевыводящих протоках, желчном пузыре. Присосками сосальщиков повреждается эпителий протоков, в которых образуются кисты, воспалительная реакция, формируется холангит и холестаз. При фасциолезе личинки с током крови проникают в ткань печени, затем мигрируют в желчевыводящие пути и там превращаются в половозрелого паразита. В дальнейшем гельминты повреждают ткань печени, формируя микроскопические гнойники в паренхиме и желчных ходах. Схожий патогенез заболевания имеет и аскаридоз.
При эхинококкозе и амебиазе в печени формируются объемные образования. Шистосомозы приводят к фиброзированию паренхимы печени. Заражение малярийным плазмодием, трипаносомами, шистосомами приводит к значительному увеличению размеров печени, воспалительному процессу, печеночной недостаточности.
Главную роль в поражении печеночной паренхимы играют патологические иммунные реакции. Паразиты и гельминты выделяют антигены, которые провоцируют избыточные иммунные реакции, приводящие к значительному поражению клеток и микрососудов печени. Личинки и взрослые особи глистов, находящиеся в ткани печени, выделяют ряд ферментов, повреждающих гепатоциты и стимулирующих синтез фибрина. Хроническое персистирование паразитов рано или поздно приводит к фиброзированию печени, хронической печеночной недостаточности. Ниже рассмотрены основные виды паразитарных заболеваний печени, встречающиеся в России.
Виды паразитарных заболеваний печени
Эхинококкоз печени
Эхинококкоз занимает ведущее место среди всех паразитарных заболеваний печени. В подавляющем большинстве случаев поражается правая половина печени, практически у половины пациентов эхинококковых кист несколько. У людей эхинококкоз печени может быть гидатидным (личиночная стадия, кистозная форма, человек является промежуточным хозяином) и альвеококковым. Основным хозяином являются псовые, в организме которых эхинококк созревает, а его терминальные членики с огромным количеством яиц попадают в окружающую среду, вызывая заражение человека фекально-оральным либо контактным путем. Попадая в желудок, оболочка яиц растворяется и гельминты проникают через стенку желудка или кишечника в кровь. С током крови возбудители мигрируют в печень, а затем и в другие органы, формируя в них кисты (изначально – около 1 мм диаметром). Эхинококковая киста печени имеет две оболочки, внутренняя продуцирует жидкую составляющую кисты, образует дочерние пузыри. Наружная оболочка может кальцифицироваться, содержимое ее может нагнаиваться. Кисты огромных размеров сдавливают паренхиму печени и сосуды, желчевыводящие пути.
Гидатидный эхинококкоз. В первые годы после заражения эхинококкоз может никак не проявляться. Первые клинические проявления обычно возникают по достижению кистой больших размеров – боли в правом боку, тошнота и рвота, слабость, исхудание, хроническая диарея, аллергические высыпания на коже, ломкость волос. Размеры печени увеличиваются, при поверхностном расположении кисты ее можно даже пропальпировать. Желтуха развивается только при сдавлении кистой протоков печени. Возможен прорыв кистозного образования в брюшную или грудную полость, сопровождающийся сильной болью, анафилактическим шоком (реакция на всасывание содержимого кисты). Нагнаивание содержимого кисты сопровождается болезненностью печени, лихорадкой, ухудшением общего состояния.
Диагностика эхинококкоза включает сбор анамнеза (контакт с собакой), пальпацию печени и выявление эхинококковой кисты. Специфическим методом диагностики является реакция Казони (положительна в 85% случаев), латекс-агглютинации (90%). Визуализировать паразита помогут УЗИ печени и желчного пузыря, ангиография чревного ствола, МРТ печени и желчевыводящих путей, статическая сцинтиграфия печени, диагностическая лапароскопия.
Лечение только оперативное. Производится иссечение эхинококковых кист печени, предварительно в кисту вводят формалин и отсасывают ее содержимое. Полость кисты ушивают наглухо. В последующем может сформироваться непаразитарная киста, гнойник. При маленьких размерах и краевом положении кисты возможна резекция печени вместе с кистой.
Альвеолярный эхинококкоз. Является более редкой формой паразитарного заболевания печени, вызываемого эхинококком. Возбудитель альвеококкоза отличается своей личиночной стадией. Заражение происходит при обработке шкур основного хозяина (лисы и др.), употреблении зараженных продуктов. Особенностью альвеококкоза является образование множества мелких кист, которые инфильтрируют паренхиму печени, плотно прилегая друг к другу и образуя опухолевидный узел в ткани печени. Пузырьки паразита способны прорастать в паренхиму печени, сосуды, желчные пути, соседние органы. В центре очага альвеококкоза формируется некроз, в дальнейшем альвеококковый очаг может обызвествляться. Дифференцировать заболевание следует с раком печени, циррозом печени.
Клиническая картина альвеококкоза сходна с гидатидной формой заболевания, однако имеет большую частоту механической желтухи. Лечение альвеококкоза печени имеет определенные особенности. Проведение операции затруднено инфильтративным ростом паразитов, прорастанием сосудов, желчных путей, круглой связки печени. Обычно операция назначается при значительном поражении печени, нагноении и прорыве кист. Чаще всего производится частичная резекция печени, оставшиеся кисты обрабатываются химиопрепаратами или формалином, подвергаются криодеструкции.
Аскаридоз печени и желчных путей
На сегодняшний день аскаридоз печени встречается достаточно редко. Человек заражается при употреблении в пищу зараженных яйцами аскарид продуктов. Попадая в кишечник, возбудители через кишечную стенку проникают в кровеносное русло, с током крови попадают в печень. В печени из-за персистирования паразитов формируются некрозы, микроабсцессы. В дальнейшем возбудители могут мигрировать по организму, попадая в другие органы и системы, а в кишечнике превращаясь в половозрелые формы.
Основными проявлениями аскаридоза являются холангиты, холестаз, абсцессы печени. Специфических симптомов аскаридоза не существует. Диагноз аскаридоза печени устанавливается на основании обнаружения аскарид и их яиц в рвотных массах, кале; также возможна визуализация гельминтов при УЗИ, КТ печени.
Лечение аскаридоза желчевыводящих путей только хирургическое. Применение противоаскаридозных средств при закупорке желчных путей противопоказано, так как приводит к кратковременной активизации паразитов и их дальнейшему проникновению в желчные пути и паренхиму печени. Для уточнения степени поражения протоков во время операции проводят РХПГ. Для профилактики персистирования аскаридоза, образования конкрементов желательно провести холецистэктомию. В послеоперационном периоде по дренажам вводят антиаскаридозные препараты для уничтожения оставшихся гельминтов.
Описторхоз печени
Данное паразитарное заболевание печени встречается достаточно редко, заражение человека происходит через сырую рыбу, зараженные водоемы. Размножение гельминта в желчных путях приводит к их расширению. Ткань печени становится очень плотной, расширенные внутрипеченочные протоки видны сквозь капсулу печени. Персистирование инвазии приводит к утолщению стенок желчных путей, формированию грубых рубцовых изменений вокруг них, которые напоминают цирроз печени, часто приводят к перфорации желчных протоков и перитониту. Закупорка желчных ходов благоприятствует застою и воспалительным изменениям в них. У пациентов с описторхозом часто в будущем развивает рак печени.
Описторхоз, как и другие паразитарные заболевания печени, не имеет специфической клиники. Частыми проявлениями являются увеличение и уплотнение печени, боли в правом подреберье, жидкий стул. В случае присоединения инфекции пациента беспокоят лихорадка, озноб, липкий пот.
Диагноз ставится на основании выявления особей и яиц гельминтов в кале и дуоденальном соке, полученном при зондировании. Лечение описторхоза печени хирургическое, заключается в дренировании протоков, введении антипаразитарных препаратов в дренажи.
Амебиаз печени
Заболевание часто встречается в тропических странах. Характеризуется преимущественным поражением толстого кишечника, диссеминацией возбудителя в паренхиматозные органы. Цисты амеб попадают в организм человека с зараженной водой, фруктами и овощами, зеленью.
Амебы вызывают образование язв в кишечнике, через которые возбудители попадают в кровоток, а затем в печень, приводя к формированию абсцессов печени примерно в 10% случаев. Особенность амебных абсцессов в том, что они не имеют капсулы, содержат в себе расплавленные ткани, кофейного цвета гной. Состояние пациентов обычно очень тяжелое, печень увеличена и болезненна. Кожные покровы иктерично-серые, сухие.
В диагностике абсцесса печени используют УЗИ гепатобилиарной системы, сцинтиграфию печени, КТ, пункционную биопсию печени (с целью выявления амеб). Лечение амебиаза обычно комплексное: антиамебные, антибактериальные и дезинтоксикационные препараты. Хирургическое лечение проводится при неэффективности консервативных мероприятий, возникновении осложнений.
Прогноз и профилактика паразитарных заболеваний печени
Прогноз при паразитарных заболеваниях печени зависит от многих факторов: длительности паразитарной инвазии, обширности поражения печени, наличия осложнений. При длительном течении паразитарного поражения печени с формированием фиброза, развитием печеночной недостаточности прогноз неблагоприятный.
Профилактика всех паразитарных заболеваний печени заключается в соблюдении правил личной гигиены (мыть руки после контакта с животными, пить только кипяченую воду, тщательно мыть овощи и фрукты перед употреблением в пищу, проводить термическую обработку мяса и рыбы), контроле за состоянием водоемов, из которых производится забор питьевой воды.
Амебный абсцесс печени – это отграниченное от окружающих тканей скопление гнойного экссудата в печени вследствие патогенного воздействия дизентерийной амебы Патология проявляется болью в правом подреберье различной интенсивности, гепатомегалией, лихорадкой, ознобом, потливостью, желтушностью кожи и склер, тошнотой и рвотой. Диагностика основывается на данных осмотра, УЗИ печени, анализа кала, серологического исследования крови. Консервативно назначают противопротозойные, антибактериальные препараты. По показаниям выполняют чрескожную или открытую аспирацию и санацию полости абсцесса.
МКБ-10
K77.0 Поражения печени при инфекционных и паразитарных болезнях, классифицированных в других рубриках
Общие сведения

Причины
Амебный абсцесс печени вызывается одноклеточным паразитом – дизентерийной амебой Entamoeba histolytica. Патогенный микроорганизм попадает в желудочно-кишечный тракт человека энтеральным путем при употреблении инфицированной воды, продуктов растительного происхождения, при контакте с загрязнёнными предметами обихода (тарелки, ложки и др.). Источником инфекции служит больной человек или носитель амебиаза. В кишечнике паразит переходит в активную фазу, размножается и питается биологическим материалом хозяина (бактериями, клетками крови). После достижения своей высшей формы развития (тканевой) амеба через подслизистый слой кишечника по системе воротной вены попадет в печень, где продолжает свой жизненный цикл и размножение.
По наблюдениям специалистов в сфере гепатологии и абдоминальной хирургии, развития патологии возрастает у лиц, злоупотребляющих алкоголем, принимающих глюкокортикоидные препараты, прошедших курс химиотерапии и лучевой терапии и имеющих онкологические заболевания. В большей степени болезни подвержены люди молодого возраста и беременные женщины.
Патогенез
Попав с током крови в печень, паразиты посредством выделения протеолитических ферментов оказывают токсическое действие на гепатоциты, вызывая их распад и разрушение. В результате возникает расплавление и некроз ограниченного участка паренхимы с образованием единичных или множественных обособленных полостей, заполненных некротическими массами и продуктами жизнедеятельности микроорганизма. При дальнейшем течении заболевания содержимое абсцесса может инфицироваться (чаще кишечной палочкой) с развитием гнойно-воспалительного процесса и окрашиванием содержимого в желто-зеленый цвет. В редких случаях происходит самостерилизация амебного абсцесса, при которой экссудат приобретает пастообразную консистенцию и темно-коричневую окраску.
Классификация
Амебные абсцессы печени могут быть одиночными и множественными. Одиночный (солитарный) гнойник, увеличиваясь в размерах, иногда достигает 10-15 см в диаметре. Множественные абсцессы возникают редко и имеют малый диаметр (от 0,5 до 2 см). Выделяют острое и хроническое течение заболевания. Острая форма возникает внезапно и сопровождается лихорадкой гектического типа, выраженными признаками интоксикации. При хроническом течении температура чаще субфебрильная, патология протекает без ярких клинических проявлений с периодами обострения и ремиссии.
Симптомы амебного абсцесса
Клиническая картина абсцесса печени зависит от остроты процесса, расположения абсцесса и выраженности интоксикационного синдрома. В некоторых случаях на первый план выступают симптомы амебного колита, на фоне которого развивается поражение печени. Клинические проявления заболевания могут возникать как через несколько дней, так и месяцев/лет от момента инфицирования. Острое течение болезни характеризуется повышением температуры тела вначале до субфебрильных, а после присоединения вторичной инфекции − до фебрильных значений, выраженной слабостью, обильным потоотделением, тошнотой, рвотой, снижением аппетита, резкой потерей веса, иктеричностью склер и кожных покровов.
В дебюте заболевания возникает тупая, ноющая боль и чувство тяжести в правой половине живота. По мере увеличения размеров печени возрастает интенсивность и частота болевых приступов, которые постепенно переходят в острую боль, стихающую при смене положения тела. При абсцессе правой доли органа боль локализуется в зоне правого подреберья и иррадиирует в правое плечо, лопатку, правую часть спины и шеи. При расположении гнойника в левой доле болевой синдром возникает в зоне эпигастрия и отдает в левую лопатку, околопупочную и левую боковую области живота.
Одним из основных признаков амебного абсцесса является гепатомегалия. Данный синдром наблюдается при больших размерах гнойника. Во время физикального исследования печень пальпируется и выступает из-под края реберной дуги на 3-6 см, а при огромных размерах абсцесса возможно выпячивание органа в области правого подреберья. Гепатомегалия приводит к сдавлению близлежащих органов (кишечника, диафрагмы), что может вызывать запоры, повышенное газообразование, затруднение дыхания, одышку. Хроническая форма амебного абсцесса отличается незначительной гипертермией, которая может сохраняться в течение долгого времени (недели, месяцы), слабостью и недомоганием.
Осложнения
Наиболее опасные осложнения связаны с нарушением целостности оболочки амебного абсцесса. При прорыве гнойника в брюшную полость развивается перитонит, в плевральную полость ‒ амебная эмпиема плевры. Попадание инфекции в кровоток приводит к сепсису, инфекционно-токсическому шоку. При проникновении патогенных микроорганизмов в легочную ткань возникает пневмония, абсцесс легкого, гепатобронхиальный свищ. Попадание паразитов в полость перикарда осложняется развитием сдавливающего перикардита, который может вызывать нарушение сердечного ритма, сердечную недостаточность и тампонаду сердца. В результате гематогенной диссеминации возбудителя возможно формирование абсцессов головного мозга.
Диагностика
В связи с длительным бессимптомным периодом и частым отсутствием специфических проявлений верификация диагноза амебный абсцесс печени может вызывать значительные трудности. Часто заболевание обнаруживается на поздних стадиях при развитии осложнений. При подозрении на патологию назначаются следующие обследования:
- Осмотр врача. При расспросе важную роль играет эпидемиологический анамнез (пребывание в жарких странах, употребление воды из непроверенных источников, немытых фруктов и овощей). Во время пальпации живота специалист (гастроэнтеролог, абдоминальный хирург, инфекционист) обращает внимание на увеличенные границы печени и боль в подреберье справа.
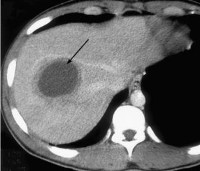
- УЗИ печени. Проведение ультразвукового исследования позволяет определить локализацию, размеры и структуру амебного абсцесса. При исследовании визуализируется округлое гипоэхогенное подкапсульное образование в печёночной паренхиме с неоднородным содержимым.
- Лабораторная диагностика. В общем анализе крови отмечается лейкоцитоз, ускорение СОЭ, в биохимическом анализе - повышение уровня АЛТ, АСТ, щелочной фосфатазы, билирубина, общего белка. Для выявления тканевой формы возбудителя назначают исследование кала. Серологические тесты (РГА, РНИФ, ИЭФ, РСК и др.) проводятся для определения специфических антител в сыворотке крови.
В сложных и спорных ситуациях для более детального изучения структуры органа выполняют МСКТ печени. Дифференциальная диагностика заболевания проводится с абсцессами другой этиологии (бактериальной, туберкулезной, эхинококковой и др.), доброкачественными и злокачественными новообразованиями печени.
Лечение амебного абсцесса печени
Лечение патологии направлено на угнетение тканевых форм паразитов и прекращение гнойного процесса. Все пациенты с подозрением на амебный абсцесс подлежат госпитализации в профильное отделение. Основу консервативной терапии составляет комбинированное назначение противопротозойных, противомикробных, антибактериальных препаратов. Наряду с этиотропным лечением проводят дезинтоксикационную и симптоматическую терапию противовоспалительными, обезболивающими средствами.
Тяжелым коморбидным пациентам, не ответившим на начальный терапевтический курс, под контролем УЗИ осуществляют тонкоигольную аспирацию содержимого абсцесса с целью взятия материала для исследования и санации очага. После удаления содержимого в полость вводят растворы антибиотиков или антисептиков. Открытое хирургическое вмешательство проводится при неэффективности консервативной терапии в течение 2-3 суток, при множественных и огромных гнойниках. В этом случае выполняют вскрытие, дренирование, тщательную обработку полости антисептическим раствором, после чего санируют брюшную полость и ушивают рану.
Прогноз и профилактика
Прогноз заболевания зависит от величины амебного абсцесса и наличия осложнений. При своевременной диагностике и грамотном лечении прогноз благоприятный. Развитие осложнений может привести к тяжелым жизнеугрожающим последствиям вплоть до летального исхода (20% при легочных осложнениях, 40-70% при кардиальных осложнениях). Профилактические мероприятия направлены на обеспечение населения качественной питьевой водой, соблюдение правил личной гигиены (мытье рук, овощей и фруктов). Большое значение имеет раннее выявление больных и носителей инфекции, их лечение и предупреждение заражения здоровых людей. После выздоровления пациенты в течение года подлежат диспансерному наблюдению. Медицинский контроль заключается в ежеквартальном прохождении лабораторных исследований (анализ кала, серологические реакции).
3. Абдоминальная хирургия. Национальное руководство / под ред. Затевахина И.И., Кириенко А.И., Кубышкина В.А. – 2017
Приводится информация о существующих знаниях в области влияния микробиоты кишечника на заболевания человека, в частности, неалкогольную жировую болезнь печени, алкогольную болезнь печени, воспалительные заболевания кишечника и инфекционные заболевания жел
The data on the existing knowledge in the field of intestinal microbiota influence on human diseases were presented, in particular, non-alcoholic fat liver disease, alcoholic liver disease, inflammatory intestinal diseases and infectious gastrointestinal diseases. Possibility of intestinal microbiota correction in wide-spread liver diseases was evaluated, considering the recent and most significant evidence related to antibiotics, probiotics, prebiotics and metabiotics.
Кишечная микробиота (далее — микробиота) представляет собой множество различных видов микроорганизмов, населяющих кишечник человека. Количество видов бактерий колеблется от 2,5 до 10 тыс., а количество штаммов — до 70 тыс. Численность различных микроорганизмов постепенно увеличивается по ходу кишечника. Это может объясняться наличием в верхних отделах кишечника более агрессивной среды из-за поступающего кислого содержимого желудка, действия пищеварительных ферментов, быстрого продвижения химуса. Преобладающих в тонкой кишке аэробов по мере движения вниз по желудочно-кишечному тракту (ЖКТ) сменяют факультативные, а затем облигатные анаэробы [1]. Однако у каждого человека структура популяции микроорганизмов уникальна и различна. В табл. 1 представлен состав кишечной микробиоты в различных отделах ЖКТ [2].
Микробиота включает облигатных представителей (постоянно присутствующих в организме хозяина) и транзиторных (поступающих из внешней среды и неспособных к длительному существованию в здоровом организме). Находиться микробы могут в просвете кишечника (полостная микрофлора) и в пристеночной слизи (пристеночная, мукозная микрофлора) [1]. Пристеночная микробиота взаимодействует со слизистой оболочкой ЖКТ, образуя микробно-тканевой комплекс — микроколонии бактерий и их метаболиты, эпителиальные клетки, муцин бокаловидных клеток, фибробласты, иммунные клетки пейеровых бляшек, фагоциты, лейкоциты, лимфоциты, нейроэндокринные клетки. Просветная микробиота находится в просвете ЖКТ, не взаимодействует со слизистой оболочкой. Субстратом для жизнедеятельности просветной микробиоты являются неперевариваемые пищевые волокна, на которых она и фиксируется.
По типу метаболизма различают протеолитические бактерии, осуществляющие гидролиз белков (кишечная палочка, бактероиды, протей, клостридии), и сахаролитические (бифидобактерии, лактобактерии, энтерококки), получающие энергию из углеводов [3].
Исследования последнего десятилетия показали, что микробиота участвует в основных биологических процессах человека, в том числе модулируя метаболический фенотип, регулируя эпителиальное развитие и влияя на врожденный иммунитет [4]. Влияние микробиоты человека на формирование и развитие различных заболеваний объясняется с помощью нескольких механизмов. Во-первых, микробиота имеет способность увеличивать извлеченную из пищи энергию, пополнять накопления питательных веществ и изменять аппетит. Микробиота содержит гораздо более универсальные метаболические гены, чем в геноме человека, и обеспечивает людей уникальными специфическими ферментами и биохимическими путями. Кроме того, значительная часть метаболических микробиотических процессов, которые являются полезными для человека, участвует либо в приобретении питательных веществ, либо при обработке ксенобиотиков, включая метаболизм непереваренных углеводов и биосинтез витаминов. Во-вторых, кишечная микробиота также обеспечивает физический барьер, защищающий его хозяина от чужеродных патогенных микроорганизмов путем конкурентного исключения и производства противомикробных веществ. Наконец, микробиота необходима для развития слизистой оболочки кишечника и иммунной системы хозяина.
Функции микробиоты
Множества симбиотических микроорганизмов развиваются в организме человека и играют важную роль в этиологии многих заболеваний. Хронические заболевания, такие как ожирение, воспалительные заболевания кишечнинка (ВЗК), сахарный диабет, метаболический синдром, атеросклероз, алькогольная болезнь печени (АБП), неалькогольная жировая болезнь печени (НАЖБП), цирроз и гепатоцеллюлярная карцинома, связаны с микробиотой человека (рис. 2) [6, 7].
Заболевания печени и микробиота
Неалкогольная жировая болезнь печени
В настоящее время патогенез НАЖБП представляется моделью, обобщающей взаимодействие таких сложных факторов, как инсулинорезистентность (ИР), образование свободных жирных кислот (СЖК), действие адипоцитокинов и микробиоты кишечника, которая участвует в регуляции метаболизма, системного воспаления и ИР. При этом на первый план выдвигается роль иммунной системы в формировании воспалительных процессов при НАЖБП [11, 12]. На рис. 3 представлена модель патогенеза НАЖБП. Первоначально в условиях ИР происходит накопление СЖК в гепатоцитах, которое приводит к стеатозу печени. На фоне стеатоза и образования активных форм кислорода (ROS) за счет сложных взаимодействий между гепатоцитами, цитокинами, эндотоксинами, макрофагами и микробиотой увеличивается липолиз в жировой ткани. В итоге количество СЖК в цитоплазме гепатоцитов возрастает, формируется жировая дистрофия гепатоцитов, развивается окислительный стресс с формированием воспалительной реакции.
Изменение состава микробиоты стимулирует секрецию хемокина CCL5, что может привести к повышенной проницаемости энтероцитов, и приток микробиологических компонентов. Микробная ДНК и липополисахариды активируют в печени толл-рецепторы TLR4 и 9, что приводит к росту фактора некроза опухоли α (ФНО-α) и трансформации стеатоза в стеатогепатит и далее в неалкогольный цирроз печени (рис. 4).
Ниже приведем известные метаболические механизмы, которые ассоциируют микробиоту с ожирением и стеатозом печени [14]:
Таким образом, НАЖБП — это многофакторное расстройство, включающее группу заболеваний. Генетические, эпигенетические и экологические факторы взаимодействуют друг с другом во время развития этого заболевания. Неалкогольный стеатогепатит (НАСГ) является печеночным проявлением метаболического синдрома. Ожирение и резистентность к инсулину часто являются факторами, способствующими развитию НАСГ. Накопление триглицеридов в гепатоцитах является наиболее часто встречающимся фенотипом в НАЖБП [16]. Изменения в микробиоте кишечника считаются ключевым фактором, способствующим НАЖБП, а наличие метаболического синдрома, диабета и заболевания печени у пациентов с НАЖБП оказывает дополнительное влияние на микробиоту [17]. Поскольку индекс массы тела (ИМТ) может быть основным фактором, определяющим композиционные изменения в микробных сообществах [7, 18], непосредственно оценивали фекальную микробную композицию и ее корреляцию с биохимическими показателями печени у взрослых пациентов с ожирением с НАЖБП. Было обнаружено, что при изучении дисбактериоза кишечника по спектру поражений НАЖБП, включающему 57 пациентов с подтвержденной биопсией НАЖБП, значительный фиброз ассоциируется с большими количествами Bacteroides spp. и Ruminococcus spp. и пониженным уровнем Prevotella spp. Наряду с особенностями метаболизма, анализ микробиоты полезен для прогнозирования развития НАЖБП и степени ее тяжести. Например, увеличение Bacteroides spp. коррелировано с развитием НАСГ, а обилие Ruminococcus spp. связано с фиброзом > F2 [19].
Алкогольная болезнь печени
Поскольку не у всех пациентов, страдающих от приема алкоголя, развивается повреждение печени, то хроническое злоупотребление алкоголем необходимое, но недостаточное условие для формирования дисфункции печени. Результаты исследований показывают, что бактериальные продукты кишечника, такие как эндотоксины, могут опосредованно вызывать воспаление и быть кофакторами для развития поражения печени, связанной с алкоголем [6]. Эндотоксины стимулируют купферовские клетки, вырабатывающие цитокины и свободные радикалы [20]. Вследствие этого усиливается лейкоцитарная инфильтрация и активизируется процесс воспаления печени с возможным формированием гепатита (рис. 5).
Аспекты патофизиологии алкогольного поражения печени
Этанол способствует транслокации липополисахарида (LPS) из просветов тонкой и толстой кишки в портальную вену, откуда он поступает в печень. В здоровой печени находятся кровеносные сосуды (синусоиды), стенки которых содержат эндотелиальные клетки. Клетки Купфера расположены в синусоидах, а клетки Ито (звездчатые клетки) расположены между эндотелиальными клетками и гепатоцитами. В купферовских клетках липополисахарид (LPS) связывается с CD14, который сочетает в себе толл-подобные рецепторы 4 (TLR4) и, в конечном счете, активирует несколько генов цитокинов. NADPH оксидаза выпускает реактивные формы кислорода (ROS), активирующие гены цитокинов в купферовских клетках, которые могут воздействовать на гепатоциты и звездчатые клетки в печени. Цитокины, такие как ФНО-α, обладают паракринным воздействием на гепатоциты и имеют системные эффекты, такие как лихорадка, анорексия и потеря веса. Интерлейкин-8 и моноциты эозинофильных белков 1 (МСР-1) привлекают нейтрофилы и макрофаги.
Аутоиммунные заболевания печени
ПБЦ — хроническая холестатическая болезнь печени с неопределенной этиологией. В целом считается, что это аутоиммунное заболевание, вызванное факторами окружающей среды у людей с генетической восприимчивостью. ПБЦ характеризуется активацией иммунных клеток и направленным повреждением холангиоцитов, что приводит к холестазу, который в конечном итоге приводит к фиброгенезу печени и печеночной недостаточности у 26% пациентов в течение 10 лет после постановки диагноза [26]. Отличительной чертой пациентов с ПБЦ является наличие антимитохондриальных антител (AMA) в сыворотке крови. Эти антитела обнаруживаются примерно в 95% образцов крови пациентов с ПБЦ. Взаимодействие АМА с бактериальными компонентами, включая белки E. coli, рассматривается как критическое событие в патогенезе ПБЦ [27].
Таким образом, дисбиоз кишечника может приводить к эндотоксемии у пациентов через бактериальную транслокацию (БТ). Эндотоксемия может вызывать иммунную дисфункцию, что приводит к дальнейшему некрозу клеток печени и печеночной недостаточности. На рис. 6 представлена схема взаимосвязи кишечной микробиоты и заболеваний печени. Результаты исследований показывают, что хронические заболевания печени обычно сопровождаются кишечным дисбиозом, который характеризуется увеличением Enterobacteriaceae и уменьшением Bifidobacterium. Это может привести к бактериальной транслокации, затем к эндотоксемии и даже спонтанному бактериальному перитониту и, наконец, к прогрессированию заболевания печени. Важно отметить, что поддержание нормального микробного сообщества с помощью метабиотиков может значительно улучшить профилактический и лечебный эффект заболевания печени [6, 7].
Коррекция микробиоты при заболеваниях печени
Исходя из возможных нарушений состава микробиоты при функциональных нарушениях ЖКТ, существуют подходы к лечению, направленные на коррекцию дисбиоза либо путем проведения антибактериальной терапии, либо путем назначения пробиотиков, пребиотиков или метабиотиков.
Классификации продуктов, применяемых для восстановления нормальной микрофлоры кишечника
Их можно подразделить на три основные группы: пробиотики, пребиотики (синбиотики) и метабиотики (рис. 7) [28]. К пробиотикам относят средства, содержащие либо монокультуру микроорганизмов, либо их комбинацию (симбиотики). Пробиотики — это живые микроорганизмы, оказывающие при естественном способе введения благоприятное действие на физиологические функции, биохимические и поведенческие реакции организма через оптимизацию его микроэкологического статуса. В лечебных препаратах — пробиотиках и пищевых (пробиотических) продуктах, как правило, используются бифидобактерии, лактобациллы, лактококки, кишечная палочка, энтерококки, стрептококки, пропионибактерии, грибы-сахаромицеты. Но на сегодняшний день концепция применения пробиотиков как факторов длительной колонизации находит все меньше сторонников.
Пробиотики продемонстрировали свою эффективность в улучшении повреждения печени путем снижения бактериальной транслокации и воспаления печени [29]. Результаты метаанализа показывают, что пробиотики могут уменьшать уровень активности аминотрансфераз печени, общий холестерин, ФНО-α и улучшать инсулинорезистентность у пациентов с НАЖБП [30]. Прием пробиотиков может привести к снижению портальной гипертензии у пациентов с циррозом печени и асцитом [31].
К пребиотикам следует отнести препараты или биологические активные добавки немикробного происхождения, которые не перевариваются в кишечнике, но способны оказывать позитивное действие на организм через стимуляцию роста и/или метаболической активности нормальной микробиоты кишечника. Основными представителями этой группы препаратов являются: олиго- и полисахариды натурального происхождения (например, пищевые волокна злаковых, овощей, фруктов (в частности, инулин), трав (псиллиум); дисахариды искусственного происхождения (лактулоза), парааминобензойная кислота, лизоцим, кальция пантотенат.
Прежде чем говорить о метабиотиках, стоит отметить, что применение пробиотиков на протяжении более чем 50 лет показало: они являются безопасными и полезными, однако до сих пор не определено оптимальное количество бактерий, необходимое для получения пробиотического эффекта; не существует единого для всех пробиотиков механизма действия. Кроме того, положительный эффект от применения пробиотиков может быть кратковременным, отсутствовать или быть недостаточно определенным. Эти и другие аспекты данной проблемы заставляют исследователей посмотреть на нее под другим углом, а именно прийти к решению вопроса, используя новый класс продуктов — метабиотики [28].
Метабиотики имеют известную химическую структуру, четкие мишени приложения, их лучше дозировать, их безопасность лучше контролировать. Метабиотики лучше абсорбируются, метаболизируются, распределяются по организму, тканям и органам, а также быстрее и в большей степени элиминируются из организма. Как класс метабиотики выделены в практических рекомендациях Всемирной гастроэнтерологической организации (World Gastroenterology Organisation, WGO), в определениях экспертного комитета ФАО и ВОЗ в 2008 г. [33].
В табл. 2 представлены основные свойства метабиотиков и их преимущества [33, 34].
Одним из представителей класса метабиотиков является Бактистатин [33, 35, 36]. В его состав входят активные метаболиты Bacillus subtilis (пробиотическая составляющая), цеолит (энтеросорбент), гидролизат соевой муки (пребиотическая составляющая). В состав Бактистатина входят не сами бактерии Bacillus subtilis, а содержатся только продукты их жизнедеятельности — активные метаболиты, действующие сразу при попадании в кишечник. Комплексный состав Бактистатина позволяет работать сразу в нескольких направлениях:
- Метаболиты с антибактериальной активностью воздействуют на патогенную и условно-патогенную флору и способствуют укреплению иммунитета.
- Метаболиты с ферментной активностью (гидролитические энзимы) способствуют полноценному пищеварению.
- Сорбент цеолит селективно поглощает вредные вещества с низкой молекулярной массой (сероводород, аммиак и т. д.), уменьшая интоксикацию.
- Пребиотический компонент, гидролизат соевой муки, является естественным источником аминокислот и олигосахаров, обеспечивает благоприятные условия для роста и восстановления нормальной микрофлоры кишечника.
Бактистатин — комплекс трех дополняющих друг друга природных компонентов, его действие направлено на восстановление собственной нормальной микрофлоры, которая уникальна у каждого человека.
Кишечная микробиота играет важную роль в благополучии человеческого организма и активно участвует в развитии широкого спектра заболеваний. Благодаря новым методам исследования функций микробиоты, новым моделям взаимодействия организма человека с микробиотой и новым аналитическим и симуляционным подходам будущие достижения помогут прояснить потенциальную роль микробиоты в механизмах развития различных заболеваний. Критические роли микробиоты человека следует исследовать на гораздо более глубоком уровне, а стратегии диагностики и лечения на основе микробиома будут использоваться для будущей персонализированной медицины. Путем лучшего понимания механизмов и вклада микробиоты в болезни печени удастся разработать новые терапевтические средства и методы коррекции микробиоты для лечения или профилактики заболеваний. Кроме того, в некоторых случаях будет возможно использование микробиома для обнаружения заболеваний ЖКТ до проведения традиционной диагностики. Множество доказательств указывает на то, что микробиота кишечника является природным фактором в метаболизме лекарств. Если мы хотим реализовать видение персонализированной революции в области здравоохранения, мы должны изучать, какую роль играет микробиота в патогенезе различных заболеваний.
Литература
Т. Е. Полунина, доктор медицинских наук, профессор
ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
Микробиота и заболевания печени/ Т. Е. Полунина
Для цитирования: Лечащий врач № 8/2018; Номера страниц в выпуске: 7-14
Теги: желудочно-кишечный тракт, пробиотики, пребиотики, метабиотики
ЭРХПГ, КТ, МРТ, УЗИ признаки паразитов желчных протоков и протока поджелудочной железы
а) Определение:
• Поражение желчных протоков, протока поджелудочной железы, обусловленное паразитарными инфекциями (например, аскаридозом, клонорхозом, эхинококкозом, фасциолезом)
б) Визуализация:
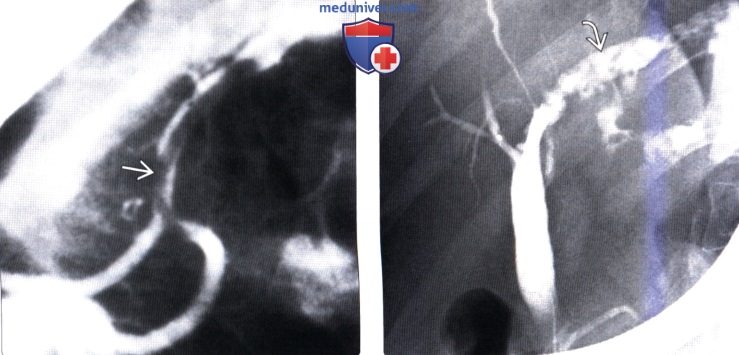
(Слева) На рентгенограмме (ЭРХПГ) визуализируется аскарида в главном панкреатическом протоке, поражение которого происходит значительно реже по сравнению с желчными протоками, скорее всего, из-за его относительно небольшого диаметра. Воспаление поджелудочной железы может быть обусловлено паразитарной инвазией панкреатического протока или желчных протоков.
(Справа) На рентгенограмме (ЭРХПГ) определяется расширение левого печеночного протока с наличием множественных дефектов наполнения, обусловленных трематодами. Вытянутая форма дефектов больше характерна для трематод в просвете внутрипеченочного протока, чем для конкрементов.
5. Рентгенография:
• ЭРХПГ: дефекты наполнения линейной, эллиптической или округлой формы в расширенных желчных протоках или панкреатическом протоке
в) Дифференциальная диагностика паразитов желчных протоков и протоков поджелудочной железы:
1. Бактериальный холангит:
• Пиогенная инфекция желчных протоков, обусловленная их обструкцией
• Расширение желчных протоков, утолщение и интенсивное контрастное усиление их стенок, а также неравномерное накопление контраста в паренхиме печени
2. Рецидивирующий пиогенный холангит:
• Заболевание, проявляющееся формированием пигментных кон крементов во всех отделах билиарного дерева, множественными стриктурами желчных протоков, а также повторяющимися эпизодами холангита
• Практически во всех случаях возникает у людей родом из Юго-Восточной Азии
• Непропорциональное расширение центральных внутрипеченочных и внепеченочных желчных протоков, а также наличие камней в их просвете
• Может быть обусловлен паразитарной инвазией (аскаридоз, клонорхоз) или бактериальной инфекцией желчных протоков
4. Холангиокарцинома:
• Опухоль желчных протоков с характерным отсроченным контрастным усилением при многофазных исследованиях
• Холангиокарцинома чаще всего приводит к расширению желчных протоков, атрофии печени в периферических отделах по отношению к опухоли, а также ретракции капсулы печени
• Опухоль с преобладающим внутрипротоковым типом роста больше напоминает объемное образование (и имеет инфильтративный характер) по сравнению с паразитами
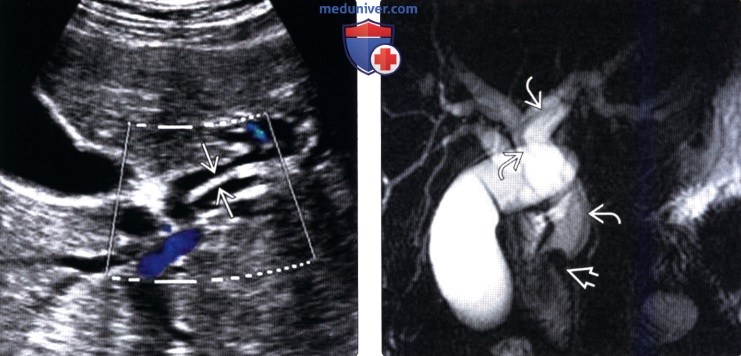
(Слева) На сонограмме (цветовая допплерография) у пациента с лихорадкой и желтухой в расширенном левом печеночном протоке определяется эхогенный дефект наполнения вытянутой формы, обусловленный наличием паразитического червя.
(Справа) На корональной МРХПГ у этого же пациента определяется расширение внутри- и внепеченоч-ных желчных протоков; в левом общем печеночном протоке (и вплоть до дистальных отделов общего желчного протока) виден дефект наполнения (аскарида). Дефект наполнения в дистальных отделах общего желчного протока, как выяснилось в конечном итоге, был обусловлен холангиокарциномой - известным осложнением аскаридоза.
г) Патология. Общая характеристика:
• Этиология:
о Аскаридоз: попадание в пищеварительный тракт яиц, из которых в тонкой кишке вылупляются личинки:
- Проникновение личинок через слизистую оболочку кишечника в циркуляторное русло → миграция в легкие
- Инвазия альвеол → восходящее поражение трахеобронхиального дерева → проглатывание → созревание взрослых особей в тонкой кишке
о Клонорхоз: попадание трематод в пищеварительный тракт с сырой пресноводной рыбой → разрушение оболочки метацеркария в двенадцатиперстной кишке — миграция в фатерову ампулу и восходящее поражение желчных протоков
- Трематоды могут существовать в желчных протоках (обычно малого и среднего размера) на протяжении 15-20 лет
о Эхинококкоз: промежуточный хозяин-овца, окончательный хозяин-собака:
- Проглатывание яиц — попадание паразитов в печень по системе воротной вены
- Личиночная стадия эхинококкоза: гидатидная киста
- Гидатидная киста часто сообщается с малыми желчными протоками
- Явный прорыв кисты в желчные протоки возникает в 5-15% случаев
о Фасциолез: попадание в пищеварительный тракт человека зараженного водяного кресса или употребление контаминированной воды с цистами личинок → пенетрация личинками стенки двенадцатиперстной кишки → выход личинок в брюшную полость → пенетрация глиссоновой капсулы и проникновение в паренхиму печени:
- В конечном счете паразиты попадают в желчные протоки и могут существовать в их просвете в течение многих лет
• Сопутствующие патологические изменения:
о При клонорхозе и аскаридозе в 6-8 раз повышается риск возникновения холангиокарциномы
о Клонорхоз очень часто сочетается с рецидивирующим пиогенным холангитом
д) Клинические особенности:
1. Проявления паразитов желчных протоков и протоков поджелудочной железы:
• Наиболее частые признаки/симптомы:
о Бессимптомное течение у пациентов с заболеванием легкой степени тяжести, низкой паразитарной нагрузкой
о Боль в правом подреберье (симптомы напоминают желчную колику):
- Лихорадка, лейкоцитоз, сепсис позволяют заподозрить острый холангит, острый холецистит, абсцесс печени
о Снижение веса, диарея, желтуха, отсутствие желания принимать пищу, учащенное сердцебиение
о Обструкция тонкой кишки (часто возникает при аскаридозе, особенно если аскариды находятся в дистальных отделах подвздошной кишки)
2. Демография:
• Возраст:
о Аскаридоз чаще встречается у детей, тем не менее, поражение печени и билиарной системы больше типично для взрослых, поскольку желчные протоки детей могут оказаться слишком маленькими для проникновения паразитов
о Возбудители клонорхоза могут существовать в желчных протоках до 25 лет, симптомы возникают чаще у пожилых пациентов по мере нарастания тяжести заболевания (паразитарной нагрузки) со временем
о Фасциолез чаще всего поражает детей младшего возраста
• Пол:
о Аскаридоз печени и желчных протоков чаще встречается у женщин (3:1)
• Эпидемиология:
о Аскаридоз-превалирующая гельминтная инфекция в мире:
- Заражены, предположительно, 33% населения земного шара
- Заболевание больше всего распространено в тропических странах (Южная Азия, Юго-Восточная Азия) в связи с неправильным питанием и загрязнением питьевой воды неочищенными сточными водами, а также использованием содержимого канализации в качестве удобрения
о Клонорхоз - заболевание, эндемичное для Азии; в странах Запада случаи клонорхоза связаны с путешествиями и иммиграцией:
- Более чем в 80% случаев заболевание обнаруживается в Китае
о Эхинококковая инфекция (Echinococcus granulosus) эндемична для слабо развитых пастбищных регионов (Средиземноморья, Африки, Южной Америки)
о Фасциолез встречается в регионах с развитым овцеводством (обычно с умеренным климатом), в т.ч. в Южной Америке, Европе, Китае, Африке, на Ближнем Востоке
3. Течение и прогноз:
• На ранних стадиях заболевание может проткать бессимптомно, поскольку для возникновения симптоматики необходима высокая паразитарная нагрузка
• Осложнения обычно связаны с тяжелым течением заболевания и включают в себя острый холангит, острый холецистит, абсцесс печени, острый панкреатит
4. Лечение:
• Антигельминтные препараты: празиквантел (умеренно эффективен при клонорхозе, эффективность лечения составляет 20% при разовом приеме); альбендазол больше эффективен для лечения аскаридоза; триклабендазол-высокоэффективный препарат для лечения фасциолеза
• Для пациентов с признаками острого холангита, с недостаточным ответом на медикаментозную терапию, может потребоваться эндоскопическая экстракция паразитов или декомпрессия/стентирование желчных протоков:
о При вовлечении желчного пузыря, как правило, требуется холецистэктомия
• Резекция печени и билиарное стентирование в случае гидатидной кисты (при билиарной инвазии/разрыве)
е) Список использованной литературы:
1. Das АК: Hepatic and biliary ascariasis. J Glob Infect Dis. 6(2):65-72, 2014
Читайте также:

