Особенности лечения вич инфекции на современном этапе
Обновлено: 08.05.2024
В середине 1980-х ученые идентифицировали вирус иммунодефицита человека и сразу же стали искать лекарство. История антиретровирусной терапии началась в 1987 году, когда для лечения ВИЧ-инфекции стали использовать препарат зидовудин. Но его эффективность была невысокой, а побочные эффекты слишком сильными. Первая высокоэффективная терапия появилась только через десять лет — в 1996 году. Эта комбинация из нескольких лекарств блокирует размножение попавшего в организм вируса сразу на нескольких этапах его цикла. С тех пор ВИЧ-инфекция — не смертельное, а хроническое заболевание, которое можно контролировать при должном лечении.
Антиретровирусные препараты (АРВ) подавляют размножение ВИЧ, но неспособны полностью удалить вирус из организма, именно поэтому их нужно принимать постоянно в течение всей жизни. Как только концентрация препарата в крови падает ниже порогового значения, вирус снова начинает размножаться. Это особенно опасно, ведь если вирус размножается в присутствии небольшого количества лекарства, то он вырабатывает устойчивость к этому препарату.
Пить таблетки на протяжении всей жизни с точностью до минут — не самая простая задача. Этому мешают и банальная забывчивость, и разные случайные обстоятельства. А чем чаще человек нарушает время приема терапии, тем выше риск развития у вируса устойчивости. Именно поэтому врачи стараются назначать схемы с приемом лекарств один раз в день и с минимальным числом таблеток — чем реже и меньше нужно принимать лекарств, тем проще соблюдать режим. Правильное соблюдение режима приема терапии называют высокой приверженностью лечению.
Сейчас лучшими схемами считаются те, при которых пациенту нужно принимать одну таблетку один раз в день, да еще и независимо от приема пищи. Но настоящим прорывом в АРВТ станет разработка схем, при которых лекарство достаточно будет принимать всего один или несколько раз в месяц, — пролонгированных схем терапии. Хотя в настоящее время неизвестно, как поведут себя пролонгированные режимы в рутинной практике. Будет ли к ним сохраняться высокая приверженность — как это показывают исследования?
по теме

Общество
Грудное молоко VS смеси при ВИЧ: что говорят эксперты в 2020 году?
Основной недостаток таких таблеток — срок их действия ограничено временем нахождения таблетки в кишечнике и не превышает 12—24 часов. В случае же диареи таблетка может покинуть организм гораздо быстрее, а значит, уменьшится концентрация лекарства в крови, что может быть опасно. Для антиретровирусных препаратов создание таблеток или капсул с замедленным высвобождением лекарственного вещества не очень перспективно — современные схемы уже позволяют принимать терапию один раз в день. То есть удобство применения терапии такие таблетки не повысят.
Если нужно добиться продления эффекта препарата на дни и недели, а лекарство всасываться через кожу упорно не хочет, приходится прибегать к парентеральным пролонгированным формам. Можно зашить под кожу специальную стерильную таблетку, которая будет медленно растворяться и выделять лекарственное вещество: на коже делается небольшой разрез, в него вводят таблетку и зашивают рану.
Помимо таблеток, под кожу можно вводить специальные полимерные импланты, содержащие нужное лекарство. Преимущество имплантов — они могут выделять лекарственное вещество очень долго, до нескольких лет. Чаще всего такие импланты используют для гормональной контрацепции. Так как гормоны действуют в очень маленьких дозах, даже в небольшой по размерам имплант можно сразу поместить запас препарата на несколько лет. Например, противозачаточный препарат Имплантон, который вводится под кожу, продолжает действовать три года. Если действие препарата нужно прекратить — достаточно просто извлечь имплант.
Более простой вариант — ввести в мышцу взвесь маленьких крупинок лекарства в подходящем растворителе. Выглядит это как обычный укол, при этом крупинки лекарства задерживаются в мышце, медленно растворяются и попадают в кровь. Такие способы введения лекарства особенно удобны в случаях, когда пациент может часто пропускать прием препарата, или забывать, принял ли он лекарство. Например, в случае лечения психических заболеваний. Но есть и недостатки: вводить такой препарат должен медицинский работник, а в случае непереносимости или выраженных побочных эффектов лекарство очень трудно быстро удалить из организма.
Что уже доступно на рынке?
Многие фармацевтические компании проводят исследования пролонгированных АРВ-препаратов, но разработка одного такого препарата сама по себе очень большой пользы не принесет — ведь для лечения ВИЧ-инфекции необходимо сочетание нескольких препаратов, то есть нужна комбинированная пролонгированная схема.
Такую схему, разработанную ViiV Healthcare совместно с Janssen, одобрили в марте 2020 года в Канаде — первый пролонгированный комбинированный АРВ-препарат Cabenuva. Схема показала высокую эффективность и безопасность в клинических исследованиях LATTE-2, FLAIR, ATLAS с участием более тысячи пациентов. В состав Cabenuva входят каботегравир и рилпивирин, то есть это двухкомпонентная схема. Препарат вводят один раз в месяц внутримышечно.
Перед началом применения Cabenuva пациент не менее месяца принимает каботегравир в таблетках (называется Vocabria) в комбинации с Эдюрантом — таблетками рилпивирина. Это необходимо, чтобы проверить переносимость такой схемы у конкретного пациента и оценить побочные эффекты. Если схема переносится хорошо, пациенту вводят первую нагрузочную дозу Cabenuva — 3 миллилитра суспензии, содержащей 600 миллиграммов каботегравира, и 3 миллилитра суспензии, содержащей 900 миллиграммов рилпивирина. Суспензии вводятся в разные участки ягодичной мышцы, то есть делают два укола. После этого поддерживающие дозы вводят ежемесячно: 2 мл (400 мг) каботегравира и 2 мл (600 мг) рилпивирина. Если по каким-то причинам введение очередной ежемесячной поддерживающей дозы невозможно, пациент до момента следующей инъекции может принимать пероральную схему (Vocabria + Эдюрант). Пролонгированная форма каботегравира также имеет большие перспективы для использования в качестве доконтактной профилактики ВИЧ-инфекции.
Еще один препарат, который уже применяется в клинической практике, — ибализумаб (Трогарзо) — можно назвать пролонгированным с несколькими оговорками. По химической природе ибализумаб — моноклональное антитело, то есть близок к человеческим иммуноглобулинам. Ибализумаб связывается с некоторыми белками на поверхности вируса и мешает проникновению ВИЧ в клетки. Препарат вводят внутривенно один раз в две недели и часто сочетают с другими АРВ-препаратами. Такая схема — не самый удобный вариант, поэтому сейчас ибализумаб используется только для лечения ВИЧ с множественной лекарственной устойчивостью, когда другие схемы оказываются неэффективными. Поэтому ибализумаб правильнее будет отнести к нишевым препаратам.
К сожалению, на этом и заканчивается не очень длинный перечень пролонгированных АРВ-препаратов, которые уже применяются на практике. Дальше пойдет речь о препаратах, находящихся на разных стадиях исследований.
Что сейчас находится в разработке?
PRO 140
С точки зрения места в клинической практике на ибализумаб похоже еще одно моноклональное антитело, находящееся в стадии клинических исследований, — PRO 140. Этот препарат также можно будет использовать для лечения ВИЧ-инфекции, если у пациента не работают другие схемы. А по механизму действия PRO 140 похож на уже существующий на рынке препарат маравирок (Целзентри). Он связывается с CCR-5 рецепторами на поверхности клеток-мишеней и мешает проникновению вируса в клетку. Строение активного центра молекулы PRO 140 отличается от маравирока, поэтому он активен даже в тех случаях, когда вирус выработал устойчивость к маравироку. Как и маравирок, PRO 140 активен только против CCR-5-тропных подтипов ВИЧ, то есть подойдет не всем пациентам. Препарат вводят внутривенно, один раз в неделю.
Нейтрализующие антитела
На разных стадиях клинических исследований находятся несколько перспективных антител, которые связываются с вирусным белком gp120 и нейтрализуют вирус: VRC01, 3BNC117 и 10-1074. Предполагается, что эти препараты достаточно будет вводить раз в месяц или даже реже и их можно будет применять совместно с другими пролонгированными АРВ-препаратами.
Албувиртид
Аналог уже применяющегося на практике энфувиртида (Фузеон). Этот препарат связывается с вирусным белком gp-41 и мешает проникновению вируса в клетку. Основное отличие в том, что Фузеон вводят подкожно два раза в сутки, что очень неудобно, а албувиртид — только один раз в 2—4 недели. Препарат должен применяться совместно с другими АРВ-лекарствами.
В середине 1980-х ученые идентифицировали вирус иммунодефицита человека и сразу же стали искать лекарство. История антиретровирусной терапии началась в 1987 году, когда для лечения ВИЧ-инфекции стали использовать препарат зидовудин. Но его эффективность была невысокой, а побочные эффекты слишком сильными. Первая высокоэффективная терапия появилась только через десять лет — в 1996 году. Эта комбинация из нескольких лекарств блокирует размножение попавшего в организм вируса сразу на нескольких этапах его цикла. С тех пор ВИЧ-инфекция — не смертельное, а хроническое заболевание, которое можно контролировать при должном лечении.
Антиретровирусные препараты (АРВ) подавляют размножение ВИЧ, но неспособны полностью удалить вирус из организма, именно поэтому их нужно принимать постоянно в течение всей жизни. Как только концентрация препарата в крови падает ниже порогового значения, вирус снова начинает размножаться. Это особенно опасно, ведь если вирус размножается в присутствии небольшого количества лекарства, то он вырабатывает устойчивость к этому препарату.
Пить таблетки на протяжении всей жизни с точностью до минут — не самая простая задача. Этому мешают и банальная забывчивость, и разные случайные обстоятельства. А чем чаще человек нарушает время приема терапии, тем выше риск развития у вируса устойчивости. Именно поэтому врачи стараются назначать схемы с приемом лекарств один раз в день и с минимальным числом таблеток — чем реже и меньше нужно принимать лекарств, тем проще соблюдать режим. Правильное соблюдение режима приема терапии называют высокой приверженностью лечению.
Сейчас лучшими схемами считаются те, при которых пациенту нужно принимать одну таблетку один раз в день, да еще и независимо от приема пищи. Но настоящим прорывом в АРВТ станет разработка схем, при которых лекарство достаточно будет принимать всего один или несколько раз в месяц, — пролонгированных схем терапии. Хотя в настоящее время неизвестно, как поведут себя пролонгированные режимы в рутинной практике. Будет ли к ним сохраняться высокая приверженность — как это показывают исследования?
по теме

Общество
Грудное молоко VS смеси при ВИЧ: что говорят эксперты в 2020 году?
Основной недостаток таких таблеток — срок их действия ограничено временем нахождения таблетки в кишечнике и не превышает 12—24 часов. В случае же диареи таблетка может покинуть организм гораздо быстрее, а значит, уменьшится концентрация лекарства в крови, что может быть опасно. Для антиретровирусных препаратов создание таблеток или капсул с замедленным высвобождением лекарственного вещества не очень перспективно — современные схемы уже позволяют принимать терапию один раз в день. То есть удобство применения терапии такие таблетки не повысят.
Если нужно добиться продления эффекта препарата на дни и недели, а лекарство всасываться через кожу упорно не хочет, приходится прибегать к парентеральным пролонгированным формам. Можно зашить под кожу специальную стерильную таблетку, которая будет медленно растворяться и выделять лекарственное вещество: на коже делается небольшой разрез, в него вводят таблетку и зашивают рану.
Помимо таблеток, под кожу можно вводить специальные полимерные импланты, содержащие нужное лекарство. Преимущество имплантов — они могут выделять лекарственное вещество очень долго, до нескольких лет. Чаще всего такие импланты используют для гормональной контрацепции. Так как гормоны действуют в очень маленьких дозах, даже в небольшой по размерам имплант можно сразу поместить запас препарата на несколько лет. Например, противозачаточный препарат Имплантон, который вводится под кожу, продолжает действовать три года. Если действие препарата нужно прекратить — достаточно просто извлечь имплант.

Более простой вариант — ввести в мышцу взвесь маленьких крупинок лекарства в подходящем растворителе. Выглядит это как обычный укол, при этом крупинки лекарства задерживаются в мышце, медленно растворяются и попадают в кровь. Такие способы введения лекарства особенно удобны в случаях, когда пациент может часто пропускать прием препарата, или забывать, принял ли он лекарство. Например, в случае лечения психических заболеваний. Но есть и недостатки: вводить такой препарат должен медицинский работник, а в случае непереносимости или выраженных побочных эффектов лекарство очень трудно быстро удалить из организма.
Что уже доступно на рынке?
Многие фармацевтические компании проводят исследования пролонгированных АРВ-препаратов, но разработка одного такого препарата сама по себе очень большой пользы не принесет — ведь для лечения ВИЧ-инфекции необходимо сочетание нескольких препаратов, то есть нужна комбинированная пролонгированная схема.
Такую схему, разработанную ViiV Healthcare совместно с Janssen, одобрили в марте 2020 года в Канаде — первый пролонгированный комбинированный АРВ-препарат Cabenuva. Схема показала высокую эффективность и безопасность в клинических исследованиях LATTE-2, FLAIR, ATLAS с участием более тысячи пациентов. В состав Cabenuva входят каботегравир и рилпивирин, то есть это двухкомпонентная схема. Препарат вводят один раз в месяц внутримышечно.

Перед началом применения Cabenuva пациент не менее месяца принимает каботегравир в таблетках (называется Vocabria) в комбинации с Эдюрантом — таблетками рилпивирина. Это необходимо, чтобы проверить переносимость такой схемы у конкретного пациента и оценить побочные эффекты. Если схема переносится хорошо, пациенту вводят первую нагрузочную дозу Cabenuva — 3 миллилитра суспензии, содержащей 600 миллиграммов каботегравира, и 3 миллилитра суспензии, содержащей 900 миллиграммов рилпивирина. Суспензии вводятся в разные участки ягодичной мышцы, то есть делают два укола. После этого поддерживающие дозы вводят ежемесячно: 2 мл (400 мг) каботегравира и 2 мл (600 мг) рилпивирина. Если по каким-то причинам введение очередной ежемесячной поддерживающей дозы невозможно, пациент до момента следующей инъекции может принимать пероральную схему (Vocabria + Эдюрант). Пролонгированная форма каботегравира также имеет большие перспективы для использования в качестве доконтактной профилактики ВИЧ-инфекции.
Еще один препарат, который уже применяется в клинической практике, — ибализумаб (Трогарзо) — можно назвать пролонгированным с несколькими оговорками. По химической природе ибализумаб — моноклональное антитело, то есть близок к человеческим иммуноглобулинам. Ибализумаб связывается с некоторыми белками на поверхности вируса и мешает проникновению ВИЧ в клетки. Препарат вводят внутривенно один раз в две недели и часто сочетают с другими АРВ-препаратами. Такая схема — не самый удобный вариант, поэтому сейчас ибализумаб используется только для лечения ВИЧ с множественной лекарственной устойчивостью, когда другие схемы оказываются неэффективными. Поэтому ибализумаб правильнее будет отнести к нишевым препаратам.
К сожалению, на этом и заканчивается не очень длинный перечень пролонгированных АРВ-препаратов, которые уже применяются на практике. Дальше пойдет речь о препаратах, находящихся на разных стадиях исследований.
Что сейчас находится в разработке?
PRO 140
С точки зрения места в клинической практике на ибализумаб похоже еще одно моноклональное антитело, находящееся в стадии клинических исследований, — PRO 140. Этот препарат также можно будет использовать для лечения ВИЧ-инфекции, если у пациента не работают другие схемы. А по механизму действия PRO 140 похож на уже существующий на рынке препарат маравирок (Целзентри). Он связывается с CCR-5 рецепторами на поверхности клеток-мишеней и мешает проникновению вируса в клетку. Строение активного центра молекулы PRO 140 отличается от маравирока, поэтому он активен даже в тех случаях, когда вирус выработал устойчивость к маравироку. Как и маравирок, PRO 140 активен только против CCR-5-тропных подтипов ВИЧ, то есть подойдет не всем пациентам. Препарат вводят внутривенно, один раз в неделю.

Нейтрализующие антитела
На разных стадиях клинических исследований находятся несколько перспективных антител, которые связываются с вирусным белком gp120 и нейтрализуют вирус: VRC01, 3BNC117 и 10-1074. Предполагается, что эти препараты достаточно будет вводить раз в месяц или даже реже и их можно будет применять совместно с другими пролонгированными АРВ-препаратами.
Албувиртид
Аналог уже применяющегося на практике энфувиртида (Фузеон). Этот препарат связывается с вирусным белком gp-41 и мешает проникновению вируса в клетку. Основное отличие в том, что Фузеон вводят подкожно два раза в сутки, что очень неудобно, а албувиртид — только один раз в 2—4 недели. Препарат должен применяться совместно с другими АРВ-лекарствами.
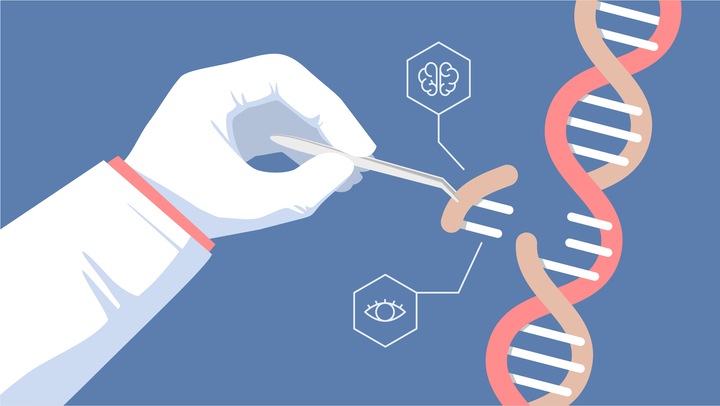
CRISPR! CAS!
В этом году группе исследователей из США удалось уничтожить генетический материал аналогичного ВИЧ вируса (это вирус иммунодефицита обезьян (ВИО)) во всех клетках и тканях двух подопытных животных.
Почему это важно? Если ранее главным потенциальным способом излечения ВИЧ считалась пересадка генетически устойчивого к вирусу донорского материала (в первую очередь костного мозга), то теперь ему появляется важная альтернатива.
Интересно, что вторая сенсация года связана, собственно, и с той, и с другой технологией. Дело в том, что устойчивый к ВИЧ ген распределен по человеческой популяции весьма неравномерно. Большинство его носителей происходят из стран Северной Европы, а стало быть, их материал вряд ли удастся пересадить ввиду определенных особенностей трансплантации костного мозга представителям азиатских народов, в том числе китайцам, равно как и представителям этнических групп, почти не вступающих в смешанные браки.
Компенсировать несправедливость природы взялся китайский профессор Хэ Цзянькуй из Южного университета науки и технологий в Шэньчжэ.

Профессор Хэ Цзянькуй из Южного университета науки и технологий в Шэньчжэ
Почти год назад, в январе, китайские власти подтвердили, что в этой стране действительно имел место успешный эксперимент, в ходе которого ученый имплантировал в матку зародыш, подвергнутый геномному редактированию методом CRISPR/CAS9.
Ученый смог удалить участок ДНК, содержащий ген CCR5, который кодирует белок, позволяющий ВИЧ проникать в иммунную клетку и инфицировать ее.
Ученый еще до начала исследования сфабриковал заключение комиссии по этике, а также данные о ВИЧ-статусе некоторых участников, так как экстракорпоральное оплодотворение для ВИЧ-позитивных людей в Китае запрещено. Мировое научное сообщество резко осудило изыскания китайского профессора как аморальные и опасные.
Чуть позже оказалось, что в курсе эксперимента, еще до того как информация просочилась в СМИ, были лауреат Нобелевской премии биолог Крейг Мелло и профессор физики и биоинженерии из университета Райса в Хьюстоне Майкл Дим. Оба они также понесли репутационные потери. Но больше всего досталось самому изобретателю.
Уже зимой появилась информация о том, что китайскому генетику может грозить смертная казнь, так как власти страны обвинили его в коррупции и взяточничестве. А в декабре уходящего года суд все-таки приговорил ученого за преднамеренное нарушение государственных нормативов в области научных исследований к трем годам тюремного заключения.
Интересно, что эксперимент, очень похожий на опыт с обезьянами, но уже на человеческом материале в октябре этого года завершился в Китае частичным провалом. От ВИЧ-инфекции пересадка модифицированного (а не природно-устойчивого) донорского материала 27-летнего пациента не спасла, зато доказала, что сама процедура безвредна, а стало быть, технология CRISPR/CAS9 на данный момент остается самым вероятным претендентом на то, чтобы стать доказанным методом излечения от ВИЧ-инфекции взрослых пациентов. Отдельным пунктом стоит подчеркнуть: вполне вероятно, впервые эта технология окажется применена и запущена в массовое использование не на Западе, а, собственно, в странах Юго-Восточной Азии.

Новые препараты, пациенты и антитела
Западные ученые тем временем отчитываются в успехах технологии пересадки родного, не модифицированного, материала с целью элиминации вируса.
В Сиэтле весной 2019 года на крупнейшей Конференции по ретровирусам и оппортунистическим инфекциям (CROI 2019) безусловной сенсацией стало известие о фактическом излечении, а вернее элиминации, вируса иммунодефицита в организме сразу двух пациентов — из Германии (дюссельдорфский пациент) и Англии (лондонский пациент).
Обоим мужчинам в ходе терапии рака был пересажен костный мозг от донора, имеющего врожденную резистентность (устойчивость) к ВИЧ.
Всего на данный момент это третий случай подобного исцеления. Первый имел место также в Германии (берлинский пациент) — осенью прошлого года мы публиковали интервью с врачом, который работал с ним. Однако до последнего времени считалось, что повторить берлинской эксперимент невозможно. В этом году стало окончательно ясно, что несмотря на все издержки (весьма токсичная химиотерапия перед пересадкой) эта технология может быть распространена и на других пациентов, живущих с вирусом.
Главной альтернативой пересадке костного мозга и генной модификации по-прежнему остаются так называемые широко нейтрализующие антитела, способны распознавать штаммы ВИЧ и блокировать их проникновение в здоровые клетки.
Как считается, введение их пациенту может стать более безопасным методом терапии, способным заменить актуальную антиретровирусную терапию препаратами, препятствующими репликации вируса в организме за счет ингибирования работы того или иного фермента вируса в клетке.

Как стало известно в этом году, дальнейшими их разработками займется такой фармгигант, как ViiV Healthcare GSK. Антитела, исследуемые ее подразделениями, носят название N6LS и действуют целенаправленно против вирусов, которые прикрепляются к белку gp120 на поверхности CD4+ T-лимфоцита. На фазе исследований IIа, к которым приступает компания, будут оценены эффективность и безопасность использования антител у людей.
Кроме того, в октябре этого года исследователи из Глэдстоуна в сотрудничестве с компанией Xyphos Biosciences предложили новую технологию для борьбы с резервуарами ВИЧ-инфекции.
Наличие этих резервуаров остается главной причиной, по которой традиционная АРВТ пока не в силах полностью уничтожить вирус в организме. Ученые из Глэдстоуна считают, что можно сократить количество инфицированных клеток при помощи новой технологии, разработанной на основе CAR-T и получившей название convertible CAR. Она создает иммунные клетки — цитоксичные Т-лимфоциты, на поверхность которых выводятся антитела, позволяющие Т-лимфоциту прикрепиться к необходимой клетке, а затем атаковать и уничтожить ее.
Преимущество convertible CAR в том, что с ее помощью к лимфоцитам можно прикрепить любое количество антител, тогда как CAR-T предполагает борьбу только с одним типом заболевания. Это делает новую технологию пригодной для лечения ВИЧ, у которого огромное количество генотипов.
На этом следует сделать паузу в перечислении сложных терминов. Год ознаменовался и другими свершениями, хоть, на первый взгляд, и меньшими по масштабу.
Так, первого апреля 2019 года хирурги из госпиталя Джонса Хопкинса пересадили ВИЧ-положительному пациенту почку, полученную от ВИЧ-положительного донора. Это была первая в истории трансплантация органа от живого донора с ВИЧ — раньше органы пересаживали только от умерших людей, живших с вирусом иммунодефицита.
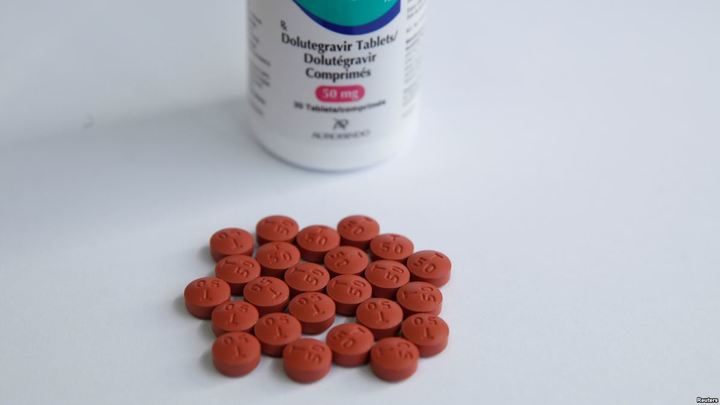
На международной конференции IAS 2019 в Мехико было представлено исследование, согласно которому риск возникновения дефекта нервной трубки у плода от приема долутегравира крайне низок — он составляет лишь 0,3 %. Именно опасность такого побочного эффекта терапии делала этот препарат недоступным для значительного числа ВИЧ-положительных пациентов а Африке — за счет процентного перевеса там среди людей, живущих с вирусом, женщин детородного возраста.
Кроме того, ученым удалось доказать эффективность двойного режима терапии на основе долутегравира и ламивудина. Этот режим может прийти на смену традиционной АРВТ из трех компонентов.
Там же были представлены исследования экспериментальной вакцины от ВИЧ. В ближайшее время стартует третья — последняя — фаза ее испытаний. В первую очередь она будет апробирована среди мужчин-геев и транссексуалов.
Что касается PrEP, компания Merck представила имплантаты со своим новым препаратом — ислатравиром — в этом качестве. Имплантат будет способен предоставлять защиту от ВИЧ на срок более года. Не требуя ежедневного приема таблеток.
Новые клинические рекомендации
В 2019 году Европейское клиническое общества по борьбе со СПИДом (EACS) опубликовало новые рекомендации, традиционно являющиеся основой для национальных рекомендаций по лечению ВИЧ-инфекции во многих странах.
Тут впервые появились отдельные разделы для трансгендерных и пожилых людей, а в список рекомендованных схем впервые была включена двухкомпонентная терапия долутегравир + ламивудин, о которой мы писали в предыдущем разделе.
Преимущество в обновленных рекомендациях получили небустированные ингибиторы интегразы с высоким генетическим барьером (долутегравир или биктегравир). А нуклеозидная основа тенофовир + ламивудин была признана эквивалентной схеме тенофовир + эмтрицитабин.
Для нашей страны важно, что в самый канун нового года Россия выпустила собственные обновленные рекомендации. Отражающие некоторые принципы, упомянутые в европейском документе.
Проект рекомендаций уже опубликован на сайте Национальной ассоциации специалистов по профилактике, диагностике и лечению ВИЧ-инфекции. В документе впервые регламентирован тот факт, что антиретровирусная терапия должна назначаться всем ВИЧ-позитивным пациентам вне зависимости от количества CD4-клеток и уровня вирусной нагрузки. А это огромный шаг для российской медицины, пусть все западные страны сделали его еще много лет назад. Именно за него бились многие российские инфекционисты все последние годы.
Отдельно раннее начало лечения оказалось прописано для беременных женщин: АРВТ должна назначаться в минимально короткий срок после постановки диагноза. И это тоже очень важно. Вторым новшеством стало утверждение долутегравира в качестве предпочтительного препарата первой линии.
Теперь он должен будет заменить использовавшийся ранее эфавиренз (600 мг). То есть предпочтительная схема первой линии для взрослых в России теперь будет выглядеть как: долутегравир + ламивудин (или эмтрицитабин) + тенофовир.
Перебои и госзакупки
Несмотря на такой новогодний подарок и включение в рекомендации современных препаратов, главной российской новостью 2019 года все-таки стали бесконечные и катастрофические перебои с поставкой лекарств от ВИЧ в российские регионы. В частности ламивудина — самого распространенного препарата класса НИОТ.
В конце августа стало известно о проблемах с этим препаратом в Краснодарском крае, до этого — в Туле, где лекарства не было около двух месяцев, список же всех субъектов федерации, столкнувшихся с этой нехваткой, покрывает почти всю географию страны.
Причиной перебоев стала череда сорванных Министерством здравоохранения аукционов. Началась история с провала зимних, состоявшихся с конца февраля по март, и последовавших за ними весенних торгов. Более того, частично сорваны оказались даже летние.
Дело в том, что каждый раз цена, заявленная министерством, оказывалась заниженной, вынуждая фармкомпании не выдвигаться по тем или иным позициям. По словам представителей самого Минздрава, виной этому стала неадекватность референтных цен, указанных в каталоге лекарственных препаратов, обязательном к использованию по новым правилам, вступившим в силу с января 2019 года. По результатам года министерство обещало пересмотреть правила закупок и скорректировать инструкции по определению минимальной цены на аукционе, правила приобретения у единственного поставщика и некоторые другие пункты своих регламентов. Проект приказа можно прочитать по этой ссылке.
Инъекционная терапия, FDA и страсти по тенофовиру
Инъекционная схема АРВ-терапии — отдельный сюжет этого года. Как ранее уже писал СПИД.ЦЕНТР, она подразумевает введение двух препаратов — каботегравира (ингибитор интегразы) и рилпивирина (ненуклеозидный ингибитор обратной транскриптазы (ННИОТ)) — пациентам раз в месяц или даже реже, что может стать современной альтернативной ежедневному приему препаратов в виде таблеток, особенно для тех, кто демонстрирует низкую приверженность.
Ранее опубликованные на конференции CROI результаты испытаний подтвердили эффективность схемы в подавлении вируса при весьма невысокой вероятности побочных эффектов.
Ее разработчики, Janssen и ViiV, подали долгожданное (это действительно так!) новшество на одобрение в Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в апреле этого года. Именно с этого, как правило, стартует распространение по миру большинства передовых западных препаратов, однако американское надзорное ведомство не одобрило инъекционную схему, сославшись на необходимость уточнения ряда производственных вопросов и отложив свое решение на 2020 год.
Стоит напомнить, что испытания этих двух лекарств в России параллельно с мировым исследованием стартовали еще осенью 2018 года. Тогда СПИД.ЦЕНТР связался с участником этого этапа испытаний, чтобы расспросить о плюсах и минусах такого лечения.
Из новостей фармбизнеса стоит также отметить появление препарата Quadramine (лопинавир, ритонавир, абакавир и ламивудин) как схемы, специально разработанной для новорожденных пациентов с ВИЧ. И презентацию новых препаратов для лиц с полирезистентным ВИЧ — ибализумаба (торговое наименование Trogarzo) и фостемсавира (Fostemsavir).
Это особенно важно, так как за последние годы в России число ВИЧ-положительных пациентов с резистентностью выросло вдвое. На данный момент резистентность имеется уже у 7 % пациентов, хотя 3-4 года назад этот показатель составлял всего 3-4 %.
В октябре FDA одобрило Дескови в качестве второго после Трувады средства для PrEP. Этот препарат компании Gilead содержит новую версию тенофовира (TAF), менее токсичную, как утверждают ее разработчики. Впрочем, большое число исследований, опубликованных в этом году (к примеру это, это и это), ставят под сомнение преимущества TAF перед старой версией тенофовира (TDF), чей эксклюзивный патент компания Gilead недавно потеряла.
Как потенциально более дешевый препарат старый тенофовир будет доступен большему числу пациентов, убеждены эксперты. А учитывая патентный скандал вокруг выпуска Трувады, может быть, и более предпочтителен в качестве PrEP, поскольку компания не славится взвешенностью своей ценовой политики и ответственностью при выборе методов максимизации коммерческой прибыли.
Для России ключевыми событиями стали также следующие.
Конференция PROHIV, состоявшаяся в третий раз при поддержке фонда СПИД.ЦЕНТР и совпавшая с мировым подведением итогов программы UNAIDS 90-90-90. И пусть пока наша страна не в силах похвастаться масштабными успехами по достижению заветных параметров, с которыми мировое сообщество ассоциирует контроль над эпидемией, на конференции все же прозвучал ряд важных докладов, касающихся ситуации с эпидемией в нашей стране.
Кроме того, привлекали внимание продолжающиеся попытки ФАС запустить в стране механизм принудительного лицензирования препаратов, чреватый уходом с рынка крупных западных производителей.
Дальнейшее развитие политики импортозамещения и подготовка связанных с нею каталогов взаимозаменяемости препаратов могут в будущем стать актуальны и для сферы терапии ВИЧ-инфекции. На примере замены препаратов от муковисцидоза российскими дженериками эта политика уже успела зарекомендовать себя не с лучшей стороны.
Вслед за передачей Минздравом права на закупки АРВТ для тюрем Федеральной системе исполнения наказаний (ФСИН) последовали перебои в организации таких поставок и весьма негативные экспертные доклады относительно тюремной медицины в России. Это обернулось попытками передать всю медицинскую службу ФСИН (в том числе и обеспечение АРВТ) обратно Минздраву.
Что принесет новый 2020 год по каждому из этих сюжетов — пока сказать сложно. Но сайт СПИД.ЦЕНТР продолжит наблюдать, а стало быть, и оповещать своих читателей. До встречи в Новом году
Испытания лекарств от ВИЧ часто включает в себя аналитическое прерывание лечения, когда пациенты с ВИЧ прекращают прием антиретровирусной терапии (АРТ), чтобы ученые могли понаблюдать, как неконтролируемый вирус реагирует на исследуемые препараты.
Участие в такого рода клинических испытаниях может вызвать страх у человека с ВИЧ, который привык поддерживать неопределяемую вирусную нагрузку. Кроме того, предыдущее исследование, проведенное доктором Лау, показало, что многие люди с ВИЧ не были уверены в том, как работают эти испытания, и многие из них не были готовы к длительным периодам определяемой вирусной нагрузки.
Ученые работают над различными стратегиями излечения ВИЧ-инфекции. Некоторые методы нацелены на сокращение латентных резервуаров ВИЧ — инфицированных иммунных клеток, которые не производят новые вирионы в течение многих месяцев или лет. Другие виды терапии пытаются повысить способность иммунной системы контролировать вирус.
Существуют два типа исследований, основанных на прерывании лечения, которые используются для оценки потенциальной терапии: изучение времени до восстановления вирусной активности (TVR) и изучение контрольных точек. В исследованиях TVR после того, как участники прекращают АРТ, ученые измеряют время, необходимое, чтобы вирусная нагрузка сначала достигла обнаруживаемого уровня (50 копий/мл), а затем время, необходимое для достижения более высокого порога (часто 10 000 копий/мл), после чего участники возобновляют прием АРТ. Если тем, кто получает лечение, требуется больше времени для достижения этих пороговых значений по сравнению с контрольной группой, это указывает на то, что терапия замедляет восстановление вирусной активности. Исследования TVR часто используются для оценки методов терапии, нацеленной на резервуары, обычно они длятся всего несколько недель.
Исследования контрольных точек демонстрируют, насколько эффективно иммунная система участников контролирует ВИЧ самостоятельно. В этих гораздо более длительных исследованиях (до нескольких месяцев) исследователи позволяют вирусным нагрузкам участников достигать высоких уровней, имитируя острую фазу ВИЧ, чтобы проследить, сможет ли их иммунная система в дальнейшем снизить эту нагрузку. Порог для возобновления АРТ обычно устанавливается на высоком уровне (часто 100 000 копий/мл). Когда участники, получающие лечение, способны контролировать ВИЧ при более низких уровнях вирусной нагрузки и в течение более длительного времени, чем участники контрольной группы, это говорит о том, что терапия повышает их иммунитет против вируса.
Несмотря на то, что нет конкретных рекомендаций, определяющих, как планировать исследования с прерыванием лечения, группа ученых, занимающихся исследованием ВИЧ, встретилась в 2018 году, чтобы обсудить этические стороны и выработать методы для снижения риска. Прекращение АРТ во время этих исследований не просто подвергает участников риску длительных периодов определяемой, а в некоторых случаях и высокой вирусной нагрузки. Более высокие вирусные нагрузки также могут подвергать опасности и ВИЧ-отрицательных половых партнеров участников.
До сих пор в большинстве исследований риск снижался за счет небольшого числа участников и отсутствия контрольной группы, которая вместо лечения принимала неактивное плацебо. Включение контрольной группы важно, потому что это позволяет ученым сравнивать тех, кто принимает лекарства, с теми, кто находится на плацебо. Тем не менее научное сообщество обсуждало этичность использования контрольных групп в подобных испытаниях лекарств, потому что они подвергаются длительным периодам повышенной вирусной нагрузки в отсутствие каких-либо препаратов, даже экспериментальных.
Исследование
Доктор Лау и ее коллеги использовали данные предыдущих клинических испытаний для создания математических моделей, позволяющих оценить, как различные их параметры влияют на статистическую мощность испытания.
Статистическая мощность аналогична чувствительности. Например, тест на ВИЧ с чувствительностью 80% успешно идентифицирует вирус у 80% людей, которые на самом деле ВИЧ-положительны, но не выявит у остальных 20% ВИЧ-положительных людей. Когда клиническое испытание, оценивающее лечебную терапию, должно достигнуть статистической мощности в 80% (при условии, что терапия имеет реальную пользу для тех, кто ее принимает), в испытании будет 80-процентная вероятность обнаружить пользу и 20-процентная вероятность ее упустить.
Проще говоря, чем больше данных задействовано в испытании, тем большей статистической мощностью оно будет обладать. Такие факторы, как количество участников, число контрольных параметров, продолжительность испытания и частота анализов крови, влияют на статистическую мощность испытания.
Результаты пробного моделирования TVR
В отношении недавнего исследования TVR с участием 13 человек такая модель показала, что при мощности 80% исследование выявило бы только лечение со значительным снижением реактивации (от 70 до 80%). Чтобы исследование TVR выявило снижение реактивации на 30%, потребуется уже по 120 участников в группе терапии и в контрольной группе. Поскольку в большинстве исследований TVR задействовано малое число участников, они, вероятно, не устанавливают умеренных результатов терапии.
Может показаться нелогичным планирование исследования для выявления меньшего эффекта от лечения, когда конечной целью является поиск максимальной пользы (т. е. терапия, приводящая к 100% снижению реактивации). Тем не менее на начальных этапах поиска лекарства необходимо фиксировать даже умеренные результаты, чтобы решить, требует ли этот метод дальнейшего изучения.
Помимо рекомендации увеличить количество участников, команда предлагает использовать ретроспективные контрольные данные в дополнение к контрольным группам. Данные из предыдущих испытаний, в которых люди прерывали АРТ, могли бы повысить потенциал выявления умеренной пользы от лечения. Они смоделировали гипотетическое исследование TVR, в которое вошли 50 участников и 50 человек из контрольной группы. При мощности 80% эта конструкция может обнаруживать снижение реактивации до 43%. Добавление ретроспективных данных еще 150 участников позволило бы в том же испытании выявить снижение до 36%.
Такое моделирование также не показало практически никакого улучшения способности обнаруживать снижение реактивации при увеличении продолжительности испытаний TVR свыше пяти недель. После этого срока модель предсказала улучшение обнаружения не более чем на 1%. Точно так же они не обнаружили практически никакой пользы от проведения лабораторного мониторинга чаще, чем раз в неделю. Наблюдение за людьми два раза в неделю почти не помогло обнаружить снижение реактивации.
Ученые провели отдельный анализ для оценки максимального риска передачи ВИЧ во время исследований TVR на основе предыдущих данных. Они оценили максимальный риск передачи, предполагая, что участники занимались незащищенным сексом и что доконтактная или другие методы профилактики не использовались. Кроме того, если во время еженедельного мониторинга не сообщать пациенту показатель вирусной нагрузки сразу же, то участник, которому необходимо возобновить АРТ (если его вирусная нагрузка превысила 1000), скорее всего, отложит это до следующего еженедельного визита.
Было подсчитано, что в этом случае во время пятинедельного исследования TVR с порогом вирусной нагрузки 1000 для повторного начала АРТ максимальный риск передачи ВИЧ составил 3,6 на 1000 участников, занимающихся вагинальным сексом. При анальном сексе для вводящих партнеров максимальный риск составлял около 7 на 1000, а для принимающих партнеров — около 70 из 1000. Изменение схемы исследования, включающее экспресс-тестирование на вирусную нагрузку и возобновление АРТ в тот же день, снижает предполагаемый максимальный риск до 0,9, 1,8 и 18 на 1000 соответственно.
Результаты моделирования исследования по контрольным величинам
Исследования контрольных точек должны иметь достаточную статистическую мощность, чтобы отделять преимущества предлагаемой лечебной терапии от контроля после лечения. Используя результаты исследования CHAMP, ученые предположили, что исходный уровень контроллеров после лечения ниже 4%. Если целью исследования было определить увеличение количества контролеров до 20% (это означает, что терапия помогла людям, которые не являются естественными контроллерами, подавить вирус), их модель показала, что 24-недельное исследование со статистической мощностью 80% потребует участия 60 пациентов.
Из-за чрезвычайно высоких вирусных нагрузок в типичных исследованиях контрольных величин (до 100 000) авторы сравнили, как использование более консервативного порогового значения (1000) для возобновления АРТ повлияет на способность этих исследований обнаруживать увеличение числа контроллеров после лечения. CHAMP показало, что у 55% контроллеров после лечения первоначальные всплески вирусной нагрузки не превышали 1000 копий/мл, и в дальнейшем они сохраняли вирусную нагрузку ниже этого порога.
Используя эти данные, Лау и Кромер предположили, что использование порога в 1000 копий маскирует 45% естественных контроллеров после лечения, что может помешать обнаружить, когда терапия усиливает иммунный контроль участников над ВИЧ. Чтобы восстановить статистическую мощность, потребуется больше участников. Как и в приведенном выше примере, при мощности 80% и цели выявления 20-процентного повышение числа контроллеров после лечения свыше базового уровня 4%, более низкий порог вирусной нагрузки потребует увеличить количество участников с 60 до 120 как в лечебных, так и контрольных группах.
Как и в случае исследований TVR, ученые также оценили максимальный риск передачи ВИЧ во время определения контрольных величин, используя те же предположения, что и описанные выше (отсутствие стратегий профилактики и экспресс-тестирования на вирусную нагрузку, незащищенный секс, недельная задержка перед возобновлением АРТ). Из-за гораздо большей продолжительности испытаний и высоких пороговых значений вирусной нагрузки (для этого они сослались на исследование контрольных величин, в котором использовали данные 50 000 человек) они оценили максимальный риск передачи ВИЧ как 13 случаев на 1000 при вагинальных половых контактах, около 25 на 1000 — для вводящего партнера при анальном сексе, 214 на 1000 — крайне высокий — для принимающего партнера при анальном сексе.
Предлагаемая гибридная схема испытаний
Основываясь на собственном моделировании и оценках максимального риска передачи, ученые предлагают использовать гибридную модель для анализа прерывания лечения. В озвученной ими схеме прерывания будут начинаться с пятинедельного исследования TVR. Хотя оно, как правило, применяется, когда терапия нацелена на резервуары ВИЧ, у людей, отвечающих на терапию, направленную на усиление иммунитета, также будет наблюдаться более медленное восстановление вируса (если лечение было эффективным).
Начало испытания для оценки потенциального лечения с помощью исследования TVR подвергнет участников гораздо более коротким перерывам в лечении, что позволит исследователям определить, имела ли эта терапия достаточную эффективность, чтобы перейти к более длительному изучению заданных значений. Если медики согласятся с необходимостью дальнейшего исследования, а пациенты с вирусной нагрузкой ниже 1000 согласятся перейти к следующей фазе, они продолжат тщательное наблюдение в течение 24 недель или до тех пор, пока вирусная нагрузка участников не превысит 1000 копий/мл, после чего они возобновят АРТ.
Ученые рекомендуют провести экспресс-тестирование на вирусную нагрузку и возобновить АРТ в тот же день, чтобы свести к минимуму риск передачи инфекции. По их оценке, ограничение контрольной точки теми, кто уже демонстрирует контроль за вирусом, до вирусной нагрузки ниже 1000, снижение порога вирусной нагрузки для возобновления АРТ до 1000, ограничение продолжительности до 24 недель, а также включение тестирования по месту оказания медицинской помощи и возобновление АРТ в тот же день снижают максимальный риск передачи до 0,2 на 1000 при вагинальном сексе, до 0,35 на 1000 — для вводящего партнера при анальном сексе и до 3,1 на 1000 — для принимающего партнера при анальном сексе. И это значительное улучшение показателей по сравнению с оценкой, полученной в ходе традиционных исследований контрольных величин.
Если первоначальное исследование TVR показывает, что лечение не требует дальнейшего изучения (например, если не обнаружено позитивного эффекта), то ученые смогут избежать затрат на проведение длительного исследования контрольных величин.
Выводы
Ученые пришли к выводу, что в испытаниях лекарств недостаточно участников для обеспечения знаковой статистической мощности при умеренных результатах лечения. Поскольку чаще всего при испытаниях терапии также не используются контрольные группы, количественная оценка пользы лечения чрезвычайно сложна. Специалисты рекомендуют сотрудничать всем заинтересованным структурам для создания ретроспективной контрольной базы данных, которая позволила бы разработать схему испытаний, не полностью полагающуюся на контрольные группы плацебо. Тем не менее они отмечают, что задействование ретроспективных контрольных данных означает включение людей, которые с большей вероятностью начали АРТ во время хронической ВИЧ-инфекции, и тех, кто использует более старые схемы АРТ, которые могут действовать как искажающие факторы.
Тем не менее сокращение числа участников, получающих плацебо, снижение пороговых значений вирусной нагрузки, продолжительности испытаний и рисков передачи ВИЧ могут побудить большее число людей с ВИЧ участвовать в исследованиях с прерыванием лечения.
Категории МКБ: Болезнь, вызванная вирусом иммунодефицита человека [вич], проявляющаяся в виде других состояний (B23), Болезнь, вызванная вирусом иммунодефицита человека [вич], неуточненная (B24), Болезнь, вызванная вирусом иммунодефицита человека [вич], проявляющаяся в виде других уточненных болезней (B22), Болезнь, вызванная вирусом иммунодефицита человека [вич], проявляющаяся в виде злокачественных новообразований (B21), Болезнь, вызванная вирусом иммунодефицита человека [вич], проявляющаяся в виде инфекционных и паразитарных болезней (B20), Острый ВИЧ-инфекционный синдром (B23.0)
Общая информация
Краткое описание
ВИЧ-инфекция - инфекционная болезнь, развивающаяся в результате многолетнего персистирования в лимфоцитах, макрофагах и клетках нервной ткани вируса иммунодефицита человека (далее - ВИЧ), характеризующаяся медленно прогрессирующим дефектом иммунной системы, который приводит к гибели больного от вторичных поражений, описанных как синдром приобретенного иммунодефицита (далее - СПИД) [1].
B20 Болезнь, вызванная вирусом иммунодефицита человека (ВИЧ), проявляющаяся в виде инфекционных и паразитарных болезней;
B21 Болезнь, вызванная вирусом иммунодефицита человека (ВИЧ), проявляющаяся в виде злокачественных новообразований;
B22 Болезнь, вызванная вирусом иммунодефицита человека (ВИЧ), проявляющаяся в виде других уточненных болезней;
Пользователи протокола: инфекционисты, терапевты, врачи общей практики, клинической лабораторной диагностики, фтизиатры.
Класс I - польза и эффективность диагностического метода или лечебного воздействия доказана и и/или общепризнаны
Класс III - имеющиеся данные или общее мнение свидетельствует о том, что лечение неполезно/ неэффективно и в некоторых случаях может быть вредным
Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+).
Результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию.
Классификация
• нейтропения (
• хронический герпес (оролабиальный, генитальный или аноректальный длительностью более месяца или висцеральный любой локализации);
Диагностика
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
• число лимфоцитов CD4 (абсолютное и процентное содержание) - двукратное измерение с интервалом не менее 7 дней;
Минимальный перечень обследования, который необходимо провести при направлении на плановую госпитализацию: не проводится.
Заболевание начинается постепенно.
• половые контакты (гетеро- или гомосексуальные; тип контактов: оральный, вагинальный, анальный) с ВИЧ-статус партнерами (если известно);
• патологическое увеличение лимфатических узлов, персистирующая генерализованная лимфоаденопатия.
Ротоглотка: стоматит, язвенно-некротические поражения, разрастание слизистой полости рта, преимущественно боковой поверхности языка.
Мочеполовая система и перианальная область: признаки следующих заболеваний: нефропатия, инфекция, вызванная вирусом папилломы человека (остроконечные кондиломы половых органов и заднего прохода, рак шейки матки).
Неврологический и психический статус: нарушение когнитивных функций (Приложение 1), парезы, симптомы нейропатии, нарушение сознания, менингеальные синдром.
Биохимический анализ крови: повышение уровня креатинина и мочевины в крови, гипонатриемия, гипокалиемия (при развитии ОПП).
• полимеразная цепная реакция РНК ВИЧ: определяемая вирусная нагрузка.
МРТ/КТ головного мозга: отек головного мозга, признаки менингоэнцефалита, дисциркуляторная энцефалопатия, объемные процессы;
• консультация невропатолога: при признаках/подозрении на криптококковый менингит, ВИЧ-энфефалопатию, токсоплазмоз ЦНС, ПМЛ, лимфомы головного мозга, периферической полинейропатии;
• консультация психиатра: при признаках/подозрении психического расстройства. ВИЧ-энцефалопатии/деменции;
Дифференциальный диагноз
Дифференциальный диагноз: проводится с оппортунистическими инфекциями и другими вторичными заболеваниями по результатам консультаций специалистов.
Лечение
Курс лечения АРТ – пожизненный, применяется тройная схема, кратность приема АРВ препаратов зависит от формы выпуска.
• эмтрицитабин (FTC) 200 мг, капсула; 200 мг 1 раз в сутки.
• рилпивирин* (RPV) 25 мг таблетка; 25 мг 1 раз в сутки.
• дарунавир (DRV) 400 мг, 600 мг, 800 мг таблетка; 600 мг 2 раза в сутки в комбинации с ритонавиром в дозе 100 мг 2 раза в сутки;
• типранавир* (TPV) 250 мг капсула; применяется усиленный ритонавиром, 2 раза в сутки 500 мг+200 мг ритонавира.
ИИ с целью: блокирования фермента ВИЧ, участвующий во встраивании провирусной ДНК в геном клетки-мишени.
• долутегравир (DTG) 50 мг таблетка; 50 мг 1 раз в сутки.
• элвитегравир 150 мг/кобицистат 150 мг /эмтрицитабин 200 мг /тенофовир 300 мг* 1 таблетка 1 раз в сутки;
* При регистрации в Республике Казахстан.
В приоритетном порядке АРТ назначается всем пациентам в 3-4 стадии ВИЧ-инфекции или пациентам с количеством CD4+ лимфоцитов ≤ 350 кл/мкл.
− ВИЧ-позитивным лицам в дискордантных парах (для снижения риска трансмиссии ВИЧ неинфицированным партнерам), при условии предварительного консультирования обоих партнеров;
− при подготовке ВИЧ-инфицированного пациента к применению вспомогательных репродуктивных технологий.
Схема АРТ состоит не менее, чем из трех антиретровирусных препаратов. Предпочтение отдается комбинированным препаратам в фиксированных дозировках.
b NVP использовать у лиц с низким числом лимфоцитов CD4 (у женщин с СД4 менее 250/мкл, у мужчин с СД4 менее 400/мкл)
с вместо AZT при умеренной анемии или гранулоцитопении (уровень гемоглобина> 90 г/л или количество нейтрофилов> 1000 клеток/мкл) рекомендуется назначать ABC, или TDF, а при более выраженной анемии или гранулоцитопении – АВС или TDF.
d использование комбинированного препарата фиксированной дозировки DRV/c (при регистрации)
При невозможности использования вышеперечисленных препаратов ddI может быть назначен в качестве НИОТ в комбинации 3TC/FTC +EFV.
• пациенты, получающие противотуберкулезные препараты.
− при количестве CD4+ лимфоцитов от 50 до 250 клеток/мкл и нормальном уровне АЛТ или АСТ – NVP в сочетании с АВС, или TDF, или AZT + 3ТС, или FTC;
− при любом количестве CD4+ лимфоцитов – LPV/r или DRV/r или ATV/r в сочетании с АВС, или TDF, или AZT + 3ТС, или FTC.
Рекомендуемые схемы АРТ: назначается схема из предпочтительных АРВП – 2 НИОТ + 1 ИП/r, или 2НИОТ + 1 ННИОТ, или 2 НИОТ + 1 ИИ.
LPV/r в сочетании с AZT/3TC. В качестве третьего компонента схемы АРТ являются LPV/r в таблетках (400/100 мг 2 раза в сутки).
При непереносимости LPV/r можно использовать (в порядке приоритетности) – DRV/r (600/100 мг 2 раза в сутки), NVP (при CD4 < 250 клеток/мкл и нормальном уровне АЛТ и АСТ). Частота назначения LPV/r и DRV/r – не реже 2 раз в сутки.
При непереносимости LPV/r и DRV/r, можно назначить ATV/r или другие ИП/р. В качестве нуклеозидной основы рекомендуется ZDV/3TC. Применение EFV не рекомендуется в I триместрe беременности.
Для лечения пациентов с низким уровнем CD4+-лимфоцитов рекомендуется применять схемы, включающие бустированный ИП.
В качестве нуклеозидной основы рекомендуется применять комбинацию ABC с 3TC или TDF с 3TC в стандартных дозах (или комбинированный препарат TDF/FTC). Однако у пациентов с ВН более 100 000 копий/мл препараты, содержащие ABC, применять не рекомендуется.
В качестве альтернативы третьим препаратом можно назначить FPV/r из-за минимального влияния на функцию почек либо LPV/r.
ТDF не рекомендуется больным с почечной недостаточностью.
более чем в 2,5 раза выше верхней границы нормы (ВГН) – EFV или RPV (при наличии противопоказаний к приему EFV и при уровне РНК ВИЧ < 100000 копий/мл) в сочетании с TDF+3TC или TDF/FTC;
• при уровне активности АЛТ или АСТ более чем в 2,5 раза выше ВГН – DTG, бустированный RTV ИП (DRV/r или LPV/r) в сочетании с TDF+3TC или TDF/FTC.
При снижении числа CD4+ лимфоцитов менее 500 клеток/мкл рекомендуют начать АРТ одновременно с терапией ХГС.
При количестве CD4+лимфоцитов менее 350 клеток/мкл начинают лечение ВИЧ-инфекции, а затем присоединяют терапию ХГС.
Не рекомендуется сочетание рибавирина с зидовудином (увеличивается частота развития анемии), диданозином (повышается вероятность декомпенсации заболевания печени).
Оптимальным сочетанием НИОТ является TDF + 3TC или FTC в стандартных дозировках. При невозможности применять TDF назначают АВС.
• при нормальном уровне активности АЛТ/АСТ или повышении его не более чем в 2,5 раза выше ВГН – EFV, RPV (при наличии противопоказаний к приему EFV и при уровне РНК ВИЧ < 100000 копий/мл) или DTG (при наличии противопоказаний к приему EFV и при уровне РНК ВИЧ >100000 копий/мл) в сочетании с АВС или TDF + 3TC или TDF/FTC.
• при уровне активности АЛТ/АСТ более чем в 2,5 раза выше ВГН – DTG или бустированный ИП (LPV/r или DRV/r) в сочетании с АВС или TDF + 3TC или TDF/FTC.
У больных при сочетании ВИЧ-инфекции и ХГС, не получающих лечения ХГС, в состав схемы АРТ может быть включено сочетание ZDV+3TC.
Все ЛЖВ с диагностированным туберкулезом нуждаются в лечении ТБ и ВИЧ-инфекции, независимо от числа лимфоцитов CD4.
Первым начинают противотуберкулезное лечение, а затем как можно быстрее (в первые 8 недель лечения) назначают АРТ.
Больным ВИЧ/ТБ, имеющим выраженный иммунодефицит (число лимфоцитов CD4 менее 50 клеток/мкл), необходимо начать АРТ немедленно – в течение первых 2 недель после начала лечения ТБ.
При наличии туберкулезного менингита начало АРТ следует отложить до завершения фазы интенсивной терапии ТБ.
В начале АРТ у больных, получающих противотуберкулезное лечение, предпочтительным ННИОТ является EFV, который назначают вместе с двумя НИОТ.
При отсутствии EFV рекомендована схема лечения - 3TC (или FTC) + ZDV + ABC (или TDF).
В таблице 3 представлены варианты замены антиретровирусных препаратов при развитии нежелательныхэффектов.
Неудача лечения определяется как постоянно выявляемая вирусная нагрузка более 1000 копий/мл по результатам двух последовательных измерений, проведенных с интервалом в 2-4 недели, но не ранее, чем через шесть месяцев после начала использования АРВ-препаратов.
Основные лекарственные средства, имеющие 100% вероятность применения: см пункт Медикаментозное лечение, оказываемое на амбулаторном уровне.
• эмтрицитабин (FTC) 200 мг, капсула;
• рилпивирин* (RPV) 25 мг таблетка;
• дарунавир (DRV) 400 мг, 600 мг, 800 мг таблетка; 600 мг в комбинации с ритонавиром в дозе 100 мг 2 раза в сутки;
• типранавир* (TPV) 250 мг капсула; применяется усиленный ритонавиром, 2 раза в сутки 500 мг+200 мг ритонавира.
• элвитегравир 150 мг/кобицистат 150 мг /эмтрицитабин 200 мг /тенофовир 300 мг* 1 таблетка 1 раз в сутки;
• элвитегравир 150 мг/кобицистат 150 мг* 1 таблетка 1 раз в сутки.
Хирургические вмешательства: нет.
• туберкулеза (при исключении у пациента активного туберкулеза) –однократно изониазид (5 мг/кг), но не более 0,3 г в сутки + пиридоксин (при наличии) в дозе 25 мг/сут не менее 6 месяцев;
• пневмоцистной пневмонии в случае CD4 < 200 клеток/мкл, токсоплазмоза, в случае CD4 < 100 клеток/мкл – котримоксазол (960 мг 3 раза/неделю). Отменить профилактику если у пациента более 3 месяцев количество CD4+ - лимфоцитов стабильно превышает 200 кл/мкл, возобновить при падении количества CD4+ - лимфоцитов
• Диспансерное наблюдение пациентов получающих АРТ осуществляется совместно ПМСП и территориальным центром СПИД с кратностью посещений не менее 1 раза в 3 месяца.
• Вирусная нагрузка определяется перед началом АРТ. В дальнейшем следует измерять ВН первый раз не позднее 3 месяцев, затем 1 раз в 6 месяцев, при достижении неопределяемого уровня ВН.
• В случае отсутствия снижения ВН через 6 месяцев от начала лечения на 1 lоg10 или последовательного двукратного повышения ВН после исходной супрессии, следует провести генотипический тест на определение резистентности ВИЧ к антиретровирусным препаратам.
• Число лимфоцитов CD4 нужно измерять через 3 месяца, затем каждые 6 месяцев, при необходимости чаще в течение 1-го года АРТ, далее не реже 1 раз в год (за исключением случаев неэффективности лечения).
• Лабораторные исследования необходимо проводить не менее одного раза в 6 месяцев.
Таблица 4. Сроки проведения лабораторных исследований
х - лабораторное исследование показано независимо от используемых АРВ-препаратов;
x (АРВ-препарат) - исследование показано пациентам, которые получают указанный в скобках препарат.
b Пациентам с хроническими гепатитами биохимические показатели определяют согласно клиническому протоколу диагностики и лечения хронического вирусного гепатита В и С у взрослых в РК.
Через 3 месяца после начала приема АРВ-препарата клинически проявляющиеся побочные эффекты должны отсутствовать (а также субклинические, которые со временем могут проявиться клинически )
b Вирусная нагрузка уменьшается постепенно: у большинства пациентов (за исключением имеющих изначально высокую вирусную нагрузку) через 24 недели АРТ она должна быть < 50 копий/мл либо демонстрировать выраженную тенденцию снижения до этого уровня.
При расхождении между вирусологическими и иммунологическими показателями, приоритет за вирусологическими.
Число лимфоцитов CD4 необходимо определять каждые 3 месяца, по стабилизации СД4 лимфоцитов на фоне АРТ - 1 раз в 6 месяцев.
Цель АРТ - снижение ВН до неопределяемого уровня (пороговый уровень
При показателях ВН от 200 до 400 коп/мл – развитие резистентности возможно, необходимо усилить работу по соблюдению приверженности к АРТ.
Госпитализация
III степень (тяжелая) - повседневная жизнь существенно нарушена, часто требуется дополнительная помощь близких, медицинская помощь и лечение, возможно в стационаре;
IV степень (крайне тяжелая, жизнеугрожающая) - нормальная повседневная жизнь невозможна, требуется постоянная помощь посторонних, серьезное лечение, чаще всего в стационаре.
Информация
Источники и литература
Информация
5) Трумова Жанна Зиапеденовна – доктор медицинских наук, профессор РГП на ПХВ «Казахский национальный медицинский университет имени С.Д.
Указание условий пересмотра протокола: пересмотр протокола через 3 года после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Оценку нарушений познавательной деятельности (когнитивных функций) целесообразно проводить у всех ВИЧ-инфицированных пациентов без отягощающих факторов(тяжелые психиатрические заболевания, злоупотребление психоактивными веществами, в том числе алкоголем, текущие оппортунистические инфекции центральной нервной системы, другие неврологические заболевания) в течение 6 мес. со времени постановки диагноза. Данный подход позволяет точно определить исходные показатели и, соответственно, более точно оценить дальнейшие изменения. Для раннего скрининга когнитивных функций необходимо задать пациенту 3 вопроса (S.Simionietal. AIDS 2009, EACS 2012):
1. Часто ли у Вас бывают случаи потери памяти (например, Вы забываете значительные события, даже самые недавние, назначенные встречи и т.д.)?
Нейропсихологическое обследование должно включать в себя тесты для изучения следующих характеристик познавательной деятельности: слухоречевая и зрительная память, счет, скорость восприятия информации, внимание, , двигательные навыки. (Antinorietal.Neurology, 2007). В случае выявления патологии требуется обследование пациента у невролога, проведение МРТ головного мозга и исследовании спинномозговой жидкости (СМЖ) на вирусную нагрузку и, если есть к тому показания, провести исследование генотипической резистентности к препаратам в двойной пробе СМЖ и плазмы крови. Если у пациента выявлена патология нейрокогнитивных функций на этапе скрининга или при дальнейшем нейропсихологическом обследовании, необходимо рассмотреть возможность включения в схему препаратов, потенциально воздействующих на центральную нервную систему. К ним относятся либо те препараты, проникновение которых в СМЖ было продемонстрировано в исследованиях, проведенных у здоровых ВИЧ-инфицированных пациентов(концентрация выше IC90 у более чем 90% обследуемых пациентов), либо те, для которых доказана краткосрочная (3–6 мес.) эффективность воздействия на когнитивные функции или на снижение ВН на СМЖ, при условии, что оценка проводится в отсутствие каких-либо других совместно принимаемых препаратов или в рамках контролируемых исследований, результаты которых рецензируются экспертами (EACS 2012).
Читайте также:

