Инфекция нервной системы у новорожденных
Обновлено: 11.05.2024
В последние десятилетия, в связи с достижениями новейших медицинских технологий (экстракорпоральное оплодотворение, пролонгирование патологической беременности, реанимация новорожденных), особую актуальность приобрела проблема повышения качества жизни де
В последние десятилетия, в связи с достижениями новейших медицинских технологий (экстракорпоральное оплодотворение, пролонгирование патологической беременности, реанимация новорожденных), особую актуальность приобрела проблема повышения качества жизни детей с перинатальной патологией нервной системы [1, 2, 3]. Существенные нарушения: вначале постнатальной адаптации, затем снижение возможности усвоения социального опыта и, как следствие, социальная дезадаптация ребенка — возникают у большинства детей с тяжелыми поражениями нервной системы. По данным ведущих неврологов [3], эти поражения обусловливают основную часть причин детской инвалидности. Кроме того, у детей с нетяжелыми формами перинатальной патологии в последующие годы нередко отмечаются проявления минимальных церебральных дисфункций, существенно затрудняющих их обучение и образование [2]. Поэтому проблемы своевременного лечения и адекватной реабилитации детей с перинатальными поражениями привлекают пристальное внимание врачей различных специальностей: педиатров, неврологов, ортопедов, реабилитологов и др., — а также специалистов по коррекционной педагогике.
Основные методологические принципы реабилитации детей при перинатальной патологии ЦНС, разработанные за последние 10–12 лет [4], могут также лежать в основе терапии этих состояний, задачи которой как в остром периоде, так и в ходе реабилитации, вторичной профилактики отсроченных проявлений заболевания по сути одни и те же. Тем не менее некоторые неврологи понимают под реабилитацией в детском возрасте абилитацию, т. е. создание возможностей для поступательного развития ребенка и коррекцию постепенно выявляющихся отклонений в развитии [3]. С учетом этого общая методология лечения и реабилитации при перинатальном поражении мозга базируется на следующих принципах.
На каждом из этапов оказания помощи больному новорожденному и грудному ребенку существуют свои ведущие задачи. Так, на первом этапе — в родильном зале, палате интенсивной терапии и отделении реанимации новорожденных — в соответствии с приказом МЗ РФ № 372 от 1995 г. прежде всего решаются задачи компенсации системных нарушений жизненно важных функций — дыхания, кровообращения, выделительной функции почек, энергетического баланса и общего метаболизма.
Медикаментозно-инструментальная терапия предполагает на этом этапе в первую очередь коррекцию кислотно-основного состояния, гипер- или гипогликемии, гиповолемии, артериальной гипотензии или гипертензии, сердечного выброса. По показаниям, с учетом данных мониторирования и лабораторных анализов, применяются осмотические и петлевые диуретики, антигеморрагические, противосудорожные средства (препарат первого выбора — фенобарбитал в стандартной дозе до 20 мг/кг массы тела в сутки). Применение на этом этапе антиоксидантов и ноотрофов (церебропротекторов — пирацетам, эссенциале, ГОМК) не всегда обосновано. Особая осторожность необходима при назначении вазоактивных препаратов: так, некоторые специалисты рекомендуют с 4-го дня жизни инстенон [3], тогда как другие говорят о возможных побочных действиях сосудистых средств [5]. Адекватное лечение в раннем неонатальном периоде (при создании максимально щадящих условий для ребенка и температурного комфорта) способствует адаптационным процессам саногенетической направленности и является основой последующей реабилитации.
Фармакопрепараты, используемые в реабилитации как доношенных, так и недоношенных новорожденных, условно могут быть разделены на применяющиеся посиндромно (симптоматические) и средства преимущественно патогенетической коррекции, хотя некоторые препараты обладают и тем и другим воздействием. Рассмотрим их подробнее.
Медикаментозная реабилитация детей с перинатальными поражениями ЦНС — поздний неонатальный период, начало восстановительного периода
Преимущественно посиндромные (симптоматические) средства: противосудорожные: фенобарбитал, ГОМК, дроперидол, реланиум, вальпроаты — при некупируемых другими средствами судорогах и тщательном мониторинге функций печени и кроветворения; дегидратационные: диакарб (со 2–3-й недель жизни, у глубоконедоношенных — позднее), триампур, верошпирон, гомеопатические препараты (гелиборус, апис, магнезия фосфорика), сборы трав — отвары и настои; седативные (сульфат магния, сборы трав — отвары и настои, лечебные ванны, реланиум, радедорм, гомеопатические препараты — валерианахель, нервохель, вибуркол), эфирные масла, ароматерапия (анис, ромашка, лаванда); спазмолитики и прокинетики (при вегетативных нарушениях): но-шпа, церукал, риабал, мотилиум, гомеопатические препараты (нуксвомика, гомакорд, вибуркол, хапель).
Средства патогенетической направленности: нейропротекторы (ноотропы, ноотрофы, ингибиторы нейрального апоптоза) — пирацетам (ИСВ), кортексин, семакс, минисем, церебролизин, пантогам, глиатилин, глицин, аминокислотные композиты, стволовые клетки; вазоактивные препараты (нормализаторы общей и мозговой гемодинамики) назначаются при отсутствии угрозы кровотечений под контролем допплерографии: кавинтон, циннаризин, сермион, димефосфон, кверцетин, гомеопатические препараты (эскулюс композитум, траумель); модуляторы синаптической проводимости: мидокалм, дибазол; aнтиоксиданты и антигипоксанты: танакан, мексидол, токоферол, соевое масло, кудесан, димефосфон, биолан, актовегин; метаболиты и поливитаминные комплексы: глицин, биотредин, лимонтар, эссенциале, элькар, кудесан, корилип, кверцетин, бета-каротин, киндер биовиталь, поливит беби, церебрум композитум, мульти-табс, капли Береш Плюс.
Обеспечить минимизацию лекарственной терапии помогает раннее (начиная с первого этапа) включение в программу комплексной реабилитации немедикаментозных воздействий. На втором и третьем этапах реабилитации детей с перинатальной патологией эти методики должны быть признаны приоритетными [1]. Несомненно, в обеспечении успешной реабилитации важная роль принадлежит адекватному вскармливанию и оптимальной организации окружающей среды (лечебно-охранительный режим), но в настоящей статье эти вопросы не рассматриваются. Тем не менее некоторые аспекты организации выхаживания тяжелобольных детей (ограничение сенсорной нагрузки в остром периоде поражения мозга, температурный комфорт, ограничение электромагнитных воздействий, выхаживание на колышащихся матрасиках или на шерсти ягнят) могут быть отнесены к методам немедикаментозной реабилитации [1, 5, 6].
Перечислим средства немедикаментозного лечения и реабилитации, весьма условно разделив их на физические и психолого-педагогические, поскольку любое физическое воздействие на маленького ребенка предполагает обязательный психоэмоциональный контакт с ним.
Немедикаментозная реабилитация детей первого года жизни с перинатальными поражениями ЦНС
Методика музыкотерапии для доношенных и недоношенных новорожденных детей, разработанная в клинике НЦЗД РАМН, включает как подбираемые индивидуально программы, записанные на магнитофон, так и пение кормящих матерей [4]. Матери обучаются комплексной мягкой психосенсорной стимуляции ребенка, напевают колыбельные и другие рекомендованные песни, учатся проведению мелоритмического воздействия (движение и тактильная стимуляция в сочетании с пением и чтением стихов) — элементам эвритмической терапии по Р. Штайнеру, который доказал благотворное влияние на организм ребенка ритмических движений под музыку [10].
В настоящей статье не затрагиваются некоторые специальные аспекты реабилитации (коррекция зрительных нарушений при ретинопатии недоношенных, нейросенсорной тугоухости, ортопедической патологии).
Использование широкого спектра немедикаментозных воздействий на втором и третьем этапах реабилитации больных детей позволяет (по данным клиники НЦЗД РАМН) уменьшить дозировки и длительность курсов фармакотерапии (по вазоактивным препаратам — на 15–20% и 3–3,5 дня; по мочегонным (диакарб) — на 20–30% и 2–3 дня; по седативным препаратам — на 30–40% и 4–5 дней). Эффективность комплексной реабилитации оценивалась в клинике по достижении детьми 1,5–2 лет. Функциональная компенсация неврологических и нейросенсорных нарушений имела место почти у всех детей со среднетяжелыми и легкими формами перинатальных поражений мозга и у 80% детей с тяжелыми (по оценке в периоде новорожденности) нарушениями. Кроме того, даже у детей, имевших в конце периода наблюдения инвалидность вследствие сенсорного или моторного дефекта, удавалось добиться некоторого смягчения моторных или сенсорных расстройств и соответственно несколько улучшить качество жизни.
Е. П. Бомбардирова, доктор медицинских наук, профессор
Г. В. Яцык, доктор медицинских наук, профессор
А. А. Степанов, кандидат медицинских наук
НЦЗД РАМН, Москва
Клиника внутриутробной инфекции. Перинатальные поражения нервной системы у новорожденных
Клинические проявления внутриутробных инфекций полиморфны и зависят не столько от этиологии/сколько от локализации и тяжести процесса. Наиболее типичны задержка внутриутробного развития, гепатомегалия, спленомегалия, желтуха, сыпь, синдром дыхательных расстройств, сердечнососудистая недостаточность и неврологические нарушения. Тяжесть клинических проявлений в большей мере зависит от того, на каких сроках гестации произошло инфицирование.
При развитии инфекции во второй половине беременности заболевание у новорожденного клинически манифестирует как генерализованная инфекция или как поражение отдельных органов. У всех наблюдавшихся больных, госпитализированных в Центр детской гепатогии с перинатальной патологией гепато-билиарной системы, были выражены и поражения центральной нервной системы, по поводу которых они получали специальное обследование и лечение невропатолога.
Последствия перинатальных инфекционных заболеваний ЦНС в плане этиологии и патогенетической основы рассматриваются как:
1) поражения вследствие перенесенного (врожденного) энцефалита, менингита, менингоэнцефалита (TORCH-синдром — цитомегаловирусная инфекция, герпетическая инфекция, токсоплазмоз, врожденная краснуха, ECHO — вирусы и другие, сифилис);
2) поражения ЦНС вследствие перенесенного неонатального сепсиса (менингит, менингоэнцефалит, вентрикулит, энцефалит).
Варианты клинических форм в первой группе — перинатальное постинфекционное (врожденное) органическое поражение мозга с различными клиническими синдромами, исходы которых могут варьировать от легких до тяжелых форм умственной отсталости, ДЦП, симптоматических резистентных эпилепсии. Варианты клинических форм во второй группе — постинфекционная
3) энцефалопатия или постинфекционное поражение ЦНС, проявляющиеся клиническими синдромами гидроцефалии, гиперактивного поведения, нарушений (задержки) моторного развития, очаговых нарушений (парезы и параличи), тяжелых нарушений моторного развития (формирующиеся и сформированные ДЦП) и другими. Исходы поражений ЦНС зависят от ранней диагностики и определяются своевременностью адекватной терапии, могут варьировать от легких функциональных до тяжелых психоневрологигеских нарушений.
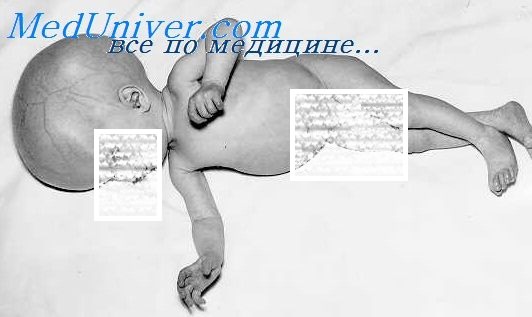
Новорожденный с врожденным токсоплазмозом
Целью исследований К. Е. Скляр с соавторами было выявление клинико-патогенетических закономерностей формирования врожденных пороков развития при внутриутробной инфекции у новорожденных. Проведено обследование 86 новорожденных с врожденными пороками развития различной локализации (у 50 % — врожденные пороки сердца) и клиническими признаками внутриутробной инфекции. Положительные результаты ПЦР получены у 43 (53 %) детей, в том числе РНК краснухи — у 36, ДНК токсоплазмоза — у 2, ДНК хламидий и вируса простого герпеса — в двух случаях, смешанная инфекция — у трех.
Анализ анамнестических данных и клинического течения заболевания не позволил авторам выделить каких-либо симптомов, соответствующих этиологии инфекции. У 30 (34,9%) оперативное лечение проведено в периоде новорожденности, из них — у 8 (9,3 %) в первые сутки после рождения. При морфологическом исследовании интраоперационно полученных биоптатов выявлены нарушения гистоархитектоники, склеротические и дистрофические явления, признаки нарушения локального кровообращения. Развитие указанных процессов в органах, по всей видимости, отражает исход инфекционного процесса.
По мнению авторов, именно склеротические процессы в аномальных тканях могут оказывать влияние на дальнейшее развитие детей и проявляться в различных формах хронических состояний, в том числе хронического гепатита и атрезии желчевыводящих путей при поражении пегени.
Желтуха и поражение печени наряду с поражением центральной нервной системы — ведущие клинические признаки большинства перинатальных инфекций.
В подтверждении диагноза и выяснении этиологии поражения пегени у новорожденных велика ответственность спектра, кагества проведения и клинического толкования результатов лабораторных исследований. Характеристика диагностических методов внутриутробной инфекции, применяемых в повседневной практике, предполагает определение титра специфических антител IgG в динамике (если он не снижается в возрасте от 6 до 12 недель, диагностируется врожденная инфекция). В 6 месяцев титр пассивно приобретенных от матери антител должен быть не выше 1:8.
Однако диагностика иммунохимическими методами у беременных и новорожденных может быть затруднена из-за недостаточной выработки специфических маркеров острой инфекции — антител класса IgM, трансплацентарной передачи антител класса IgG, низкого уровня продукции антигенов. В связи с этим клиническую значимость приобретает метод полимеразной цепной реакции.
Диагностика предполагает использование методов этиологической расшифровки с помощью генодиагностики. В то же время выявление ДНК вируса и тем более микоплазм и хламидий не может служить основанием для верификации этиологии инфекции и назначения лечения. Е. М. Малковой с соавторами из 117 новорожденных с признаками ВУИ у 112 обнаружены ДНК 26 возбудителей. Отмечено значительное количество вирусно-вирусных, микоплазменно-вирусных, вирусно-вирусно-микоплазменных, вирусно-хламидийных и прочих ассоциаций, составивших 22,1% среди положительных результатов исследований.
Клиническая картина не имела специфических признаков, была выраженной дыхательная недостаточность с развитием пневмонии, раннее и затяжное тегение желтухи, неврологические нарушения. Развитие фетального гепатита преобладало при сочетанных инфекциях. Наиболее тяжелое состояние отмечалось у детей при положительных результатах ПЦР сразу в нескольких биоматериалах. Необходимость терапии латентных форм заболеваний у новорожденных при детекции ДНК возбудителей определяется способностью многих из них длительно сохраняться в условиях иммунокомпетентного организма (персистировать с сохранением патогенных свойств).
При изменении иммунного статуса происходит быстрое восстановление вирулентности, которое становится основой рецидивирующего характера хронических инфекций и возможной инвалидизации ребенка. Однако, по данным авторов, результаты ПЦР-иследований у беременных женщин и их детей совпали только в 33,3 % слугаев, поэтому их трактовка, с нашей тогки зрения, должна быть осторожной.
Особенности вирусной инфекции нервной системы у детей в зависимости от возбудителя
а) Паралитический полиомиелит. С широким распространением вакцинации случаи полиомиелита стали крайне редкими, и повсеместное уничтожение вируса остается приоритетной задачей ВОЗ. Около 90-95% инфекций полиовируса являются субклиническими, 5% проявляются в виде легкой формы заболевания с фебрилитетом и 1-2% в основном дают симптоматику поражения ЦНС либо менингоэнцефалита, либо полиомиелита.
При полиомиелите в патологический процесс вовлекаются клетки передних рогов, двигательные и чувствительные черепные ядра продолговатого мозга, ретикулярная формация, червь мозжечка и в меньшей степени, таламус и III и V слои моторной зоны коры. Нейроны подвергаются дегенеративным изменениям, сопровождающимся вначале полиморфноядерной реакцией, которая позднее становится мононуклеарной.
Клинические проявления возникают после инкубационного периода, который длится 3-35 дней. Первоначальные симптомы включают головную боль, тошноту и лихорадку, а вслед за ними в течение 2-5 дней менингеальные симптомы раздражения и сильную боль в нижней части спины и конечностях. В серьезных случаях паралич появляется в течение первых двух дней.
Обычный спинальный полиомиелит характеризуется асимметричным вялым параличом, затрагивающим ноги, руки и/или туловище с отсутствием сухожильных рефлексов. Задержку мочи при начале заболевания демонстрируют 20-30% пациентов. Бульбарная форма редко бывает изолированной, распространяясь по меньшей мере на шейный отдел спинного мозга в 90% случаев. Могут поражаться все мышцы, иннервируемые черепными нервами. Кроме того, дыхательная недостаточность и гипертензия может быть результатом повреждения стволовой ретикулярной субстанции. Заболевание может сопровождаться энцефалитическими признаками, но они могут также вызываться и дыхательной недостаточностью из-за паралича диафрагмальных и межреберных мышц.
В анализе СМЖ обнаруживают 30-200 клеток/мм3. Изначально преобладают полиморфноядерные клетки, затем через 5-7 дней сменяющиеся лимфоцитарным плеоцитозом. Содержание белка повышается поздно, достигая максимальных значений примерно на 25 день заболевания.
По данным МРТ описано развитие отека спинного мозга с патологическим сигналом от центральной его части (Kibeetal., 1996). До начала клиники вирус может выделяться из кала и ротоглотки первые 19 дней и до трех месяцев после первых клинических проявлений (в среднем пять недель). При типировании вируса определяют один из трех типов полиовируса. Серологический диагноз ставится на основании повышения титра нейтрализующих или комплемент-связывающих антител.
Прогноз паралитического полиомиелита зависит от степени вовлечения. Восстановление поврежденных мышц часто происходит в течение года и более, но если через месяц мышцы все еще остаются парализованными, то обычно окончательно. Прогрессирующая болезнь моторных нейронов (постполиомиелитный синдром), напоминающий амиотрофический склероз, иногда наблюдается у взрослых через 20 и более лет после острого начала заболевания (Dalakas et al., 1986).
Случаи паралитического полиомиелита, связанного с живой вакциной, могут встречаться у пациентов с иммунодефицитом, получивших вакцину или контактировавших с вирусом (Nkowane et al., 1987; Sen et al., 1989; Groom et al., 1994). При этом возможны атипичные проявления. Поскольку редкие случаи полиомиелита могут также возникать у детей без иммунодефицита после живой вакцины (Dussaix et al., 1987), с уменьшением уровня заболеваемости во всем мире, в большинстве развитых стран сейчас используют убитую инъекционную полиовакцину при плановой вакцинации для предупреждения этого осложнения.
Постановка диагноза не представляет трудностей при условии, если не упускать из вида именно это заболевание. Синдром Гийена-Барре отличается от полиомиелита по характеру начала, симметричности распределения слабости и по данным ликвора. Регистрировались редкие случаи паралитического заболевания, связанного с другими вирусами (Kylleman et al., 1993). Вирус Западного Нила вызывал эпидемии заболеваний, напоминающих паралитический полиомиелит.
Случаи интоксикации химикатами или укусов насекомыми также могут имитировать сходную клиническую картину (Gear, 1984).

б) Энтеровирусы. Первоначальная классификация энтеровирусов, до геномного анализа, была основана на цитопатическом эффекте различных культивируемых клеток и инфицированных животных. Были выделены три типа полиовирусов, 24 коксаки-вируса типа А и 6 коксаки-вирусов типа В вирусов и 34 типа ЕСНО-вирусов. Последующие выделенные энтеровирусы обозначались номером, начиная от энтеровируса 68 без дальнейшего подразделения. Позднее геномный анализ последовательности частично подтвердил первоначальную культуральную классификацию.
Эти вирусы внедряются в организм хозяина через желудочно-кишечный тракт, где реплицируются и вызывают виремию, способную привести к инфекции ЦНС. В большинстве случаев отмечается слабый желудочно-кишечный вирусный продром, а в анамнезе присутствуют данные о наличии у членов семьи схожих симптомов. Большая часть случаев протекает в легкой форме с быстрым выздоровлением. Микроорганизмы можно обнаружить с помощью ПЦР или выделить из ликвора, а также из крови, кала и ротоглотки. При экспресс-диагностике ПЦР результаты можно получить через несколько часов. Инфекция встречается в любом возрасте, включая первые недели жизни (Kaplan et al., 1983).
Энтеровирусы Коксаки В1-5 и Коксаки А7, 9 и 25, ЕСНО-вирусы 4,6,9,11,14,16,18,20 и 30, так же как полиовирусы обычно вызывают асептический менингит. Острый эпидемический конъюнктивит, связанный с энтеровирусом 70, может осложняться менингитом, параличом черепных нервов или поражением конечностей, изолированно или совместно. Характерны сильные боли и фасцикуляции (Wadia et al., 1983; Chopra et al., 1986).
Менингит, вызванный вирусом Коксаки группы А, может сопутствовать или предшествовать герпангине, респираторным инфекциям и паротиту. Среди заболеваний группы В могут встречаться плевродиния (болезнь Борнхольма или эпидемическая миалгия) или диарея. Осложнением менингита могут быть миокардит и энцефалит, особенно у детей раннего возраста (Kaplan et al., 1983). Инфекции ЕСНО-вирусов могут вызывать как спорадические случаи, так и эпидемии. Пятнистопапулезная сыпь особенно характерна при инфекциях вирусов ECHO 4, 9 и 16. Иногда сыпь появляется при Коксаки А9 и А23. Также может быть петехиальной.
В литературе сообщалось о последствиях энтеровирусных менингитов (Kaplan et al., 1983). Вероятней всего, они являются результатом развития энцефалита, сопутствующего менингиту. Они особенно характерны при неонатальном энтеровирусном менингите, который также представлен лихорадкой, плохим аппетитом, диареей, гепатомегалией и сыпью (Huang et al., 2003).
Энтеровирусы также могут быть причиной других проявлений заболеваний ЦНС, включая паралич нижних двигательных нейронов (вирус Коксаки А4, 7, 9, В5, вирус ECHO 70); синдром Гийена-Барре и поперечный миелит (Коксаки А9, В1, 4, ECHO 6, 70); церебральную атаксию (Коксаки А9, 4, 7, В3, 4, ECHO 6, 9, 71); периферический неврит (ECHO 9). Энтеровирусы обычно вызывают самопроходящие заболевания, которые, хотя и связаны с заболеваемостью, редко заканчиваются смертельным исходом. Однако в некоторых более уязвимых группах пациентов (например, у младенцев или детей с иммунодефицитом) энтеровирусы могут вызывать угрожающие жизни инфекции.
Плеконарил — антивирусный препарат, который встраивается в капсид пикорнавирусов, включая энтеровирусы, предупреждая прикрепление вирусов к клеточным рецепторам и высвобождение вирусной РНК в клетку. Клинические испытания плеконарила показали некоторую эффективность у пациентов с тяжелой формой заболевания (Rotbart и Webster, 2001); к сожалению, этот лекарственный препарат не выпускался в промышленном масштабе.
в) Вирус эпидемического паротита. Среди неиммунизированного населения свинка выявляется как наиболее частая причина вирусного асептического менингита. Классическая клиническая картина лептоменингита встречается у 0,5-2% пациентов, больных эпидемическим паротитом. Однако плеоцитоз наблюдался только у 56% таких пациентов с паротитом (Russell и Donald, 1958). Паротит в 30-40% случаев может отсутствовать (Levitt et al, 1970), и в таких случаях диагноз можно получить при ПЦР амплификации вирусного генома в СМЖ или серологическими методами. Симптомы менингита появляются с 8 по 20 день после начала паротита. Часто сопровождаются выраженной лихорадкой.
В ликворе наблюдается лимфоцитарный плеоцитоз, нередко значительный, с сотнями клеток/мм 3 . Содержание глюкозы может быть снижено (Wilfert, 1969). Хотя заболевание обычно протекает в легкой форме, плеоцитоз может присутствовать на протяжении нескольких месяцев с длительным сохранением специфических интратекальных олигоклональных IgG (Vandvik et al., 1978a).

г) Вирусы герпеса. Некоторые представители семейства герпесвирусов могут вызывать лимфоцитарный менингит.
• Вирус простого герпеса. ВПГ 2 типа (Nahmias et al., 1982) чаще отвечающий за болезнь, чем 1 тип, который главным образом вызывает энцефалит. Менингит, вызванный ВПГ-2, может быть проявлением первичной инфекции у сексуально активных подростков. Иногда, легкие случаи ВПГ-1 инфекции могут проявляться только в виде раздражения мозговых оболочек (Whitley et al„ 1982а) с выздоровлением пациентов через 7-14 дней.
• Вирус опоясывающего герпеса. Вирус может вызывать асептический менингит, а также более сложное поражение ЦНС, описанное в следующем разделе. Могут встречаться пре-эруптивные неврологические проявления (Tsolia et al., 1995). В этом исследовании, у двоих детей с энцефалитом сопутствующей патологией была атаксия. Другие очаговые неврологические дефициты, кроме атаксии, развились у семи детей: у троих паралич лицевого нерва, у одного сопровождающая гемиплегия, двое имели парез верхних конечностей, у одного был радикулит, перешедший в парез ноги, и у одного ребенка паралич отводящего нерва. У двоих детей наблюдался изолированный менингит. В этой группе только двое детей переживали длительные последствия: у одного наблюдался стойкий паралич руки, у другого паралич отводящего нерва.
Другие синдромы ЦНС, связанные с вирусом ветряной оспы, включают вирусный миозит, радикулопатию, миелит и отсроченный гемипарез после ветряной оспы (Kamholz и Tremblay, 1985; Ichiyama et al., 1990; Rosenfeld et al., 1993; Herrold и Hahn, 1994; Gilden, 2004; Mariotti et al., 2006). Сообщалось также о поражении базальных ганглиев (Silverstein и Brunberg, 1995) и латеральном медуллярном синдроме (Kovacs et al., 1993). Сосудистые явления ишемического характера, часто поражающие крупные мозговые артерии, нередко отмечаются после ветряной оспы (Amlie-Lefond et al., 1995; Tsolia et al., 1995; Lanthier et al., 2005; Losurdo et al., 2006).
Острые артериопатии, приводящие к ишемическим инсультам, могут быть причиной четверти случаев тромбоза мозговых артерий в детском возрасте; в исследовании Guillot et al. (2005) наиболее вероятным этиологическим фактором в 60% случаев определена ветряная оспа (Guillot et al., 2005). Вероятно, при постинфекционных состояниях действует несколько механизмов, а в некоторых случаях важны воспалительные процессы в стенке артерий, так же как повышенная секреция прокоагулянтов, таких как антикардиолипин (Kurugol et al., 2000, 2001).
Кроме того, иммунная реакция хозяина на вирус ветряной оспы включает образование антител, способные на перекрестную реакцию и инактивацию белка S, важного фактора антикоагуляции хозяина. Это может привести к состоянию гиперкоагуляции и развитию молниеносной пурпуры, также как к ишемическому инсульту после Varicella zoster (Josephson et al., 2001).
• Вирус Эпштейна-Барр (ЭБВ). Большинство инфекций ЭБВ в раннем периоде жизни протекает бессимптомно, неврологические осложнения редки; они могут включать в себя асептический менингит, проявления энцефалита и некоторые другие осложнения ЦНС (Hung et al., 2000). Менингит может предвещать некоторые другие неврологические осложнения, такие как инфекционный полиневрит (синдром Гийена-Барре), энцефаломиелит или поражение черепных нервов (Hausler et al., 2002) или паркинсонизм (Hsieh et al., 2002). Примерно у трети пациентов с инфекционным мононуклеозом при исследовании СМЖ обнаруживают >5 клеток/мм 3 и такие показатели могут сохраняться месяцами, часто после полного клинического выздоровления (Pejme, 1964). Полное выздоровление может откладываться на несколько недель и месяцев.
• Вирус герпеса человека (ВГЧ) 6 и 7. ВГЧ-6 инфекция является причиной внезапной экзантемы (exanthema subitum), и в редких случаях вызывает менингоэнцефалит у здоровых прежде детей (Asano et al., 1992; Jones et al., 1994). Хотя большинство первичных инфекций ВПГ-6 (и тесно связанного ВПГ-7) протекают бессимптомно, оба вируса причастны к более 30% фебрильных судорог, встречающихся в первые два года жизни (Hall et al., 1994; Barone et al., 1995; Ward, 2005).
г) Аденовирусные инфекции нервной системы. Выделено множество типов аденовирусов; большинство вызывает легкие инфекции желудочно-кишечного тракта, дыхательной системы или почек и только в редких случаях они являются причиной синдромов поражения ЦНС. Проявления включают асептический менингит, миелит, подострый очаговый энцефалит, Рейе-подобный синдром и преходящую энцефалопатию (Linssen et al., 1991; Straussberg et al., 2001).
д) Парвовирус В19. Большинство инфекций парвовируса В19 имеют бессимптомное течение, но симптоматическая инфекция у детей обычно проявляется в виде лихорадки и сыпи, а у взрослых могут быть артропатии. Также сообщалось о редких случаях ЦНС инфекции с признаками менингоэнцефалита и определением вирусной ДНК в ликворе (Barah et al., 2001, 2003). Иммунный ответ хозяина к парво В19 в ЦНС считается предположительной причиной воспаления с подтверждением повышенного уровня цитокинов в ликворе, так же как специфического HLA-генома хозяина (Kerr et al., 2002).
е) Вирус лимфоцитарного хориоменингита (вирус ЛХМ). Вирус ЛХМ является человеческим зоонозом, вызываемым распространяемым грызунами ареновирусом, поражающим полевых мышей. Вирус передается человеку после контакта с выделениями зараженных мышей, морских свинок и хомяков. Внутриутробная инфекция у человека может привести к поражению плода (Barton и Mets, 2001; Barton et al., 2002), тогда как постнатальное инфицирование обычно протекает бессимптомно или как простудное заболевание, но может встречаться и синдром вовлечения ЦНС (Barton и Hyndman, 2000).
ж) Другие и неопределенные вирусы. Они, вероятно, являются причиной многих случаев заболеваний — в действительности большинства, в которых не могут быть выделены патогенные микроорганизмы. Понятно, что число возможных вирусных агентов велико, и поскольку заболевание обычно протекает в легкой форме, сложные исследования не проводятся.
Негнойные бактериальные инфекции нервной системы у ребенка
а) Сифилис нервной системы. Врожденный сифилис является на сегодняшний день наиболее распространенной формой заболевания у детей, приобретенный сифилитический менингит встречается редко, но тем не менее, его важно диагностировать в связи с эффективностью лечения. Сифилис вызывается спирохетами Treponema pallidum, которые способны проникать в ЦНС на ранних и поздних стадиях заболевания и вызывать разнообразные неврологические проявления. Бессимптомный нейросифилис встречается на ранней стадии инфекции и диагностируется у пациентов с клиническими признаками сифилиса, аномальным плеоцитозом в СМЖ и реактивными анализами, но без неврологических симптомов.
При симптоматическом течении сифилиса классические менингеальные знаки могут быть связаны с другими неврологическими признаками, включая паралич черепного нерва, гемиплегию, судороги и гипоакузию (Marcus, 1982; Dodge и Storch, 1992). Часты нарушения зрения, среди причин которых выделяются неврит зрительного нерва, перинев-рит, хориоретинит и увеит. Спинной мозг также может поражаться в виде менингомиелита. Артериит может привести к тромбозам и инфарктам. Паренхиматозный нейросифилис встречается исключительно редко с ювенильным парезом, являющимся наиболее частой формой с началом через 5-20 лет после перенесенной инфекции. Начальный симптом — психические расстройства.
Неврологические признаки появляются позднее и включают в себя спазмы мышц в половине случаев и мозжечковые симптомы в четверти. Припадки развиваются в 30% случаев, а атрофия зрительного нерва в 10-15%. Могут присутствовать глухота и множественные дефициты черепно-мозговых нервов. Ювенильный парез следует дифференцировать от многих более распространенных прогрессирующих метаболических и дегенерирующих заболеваний. Сифилис легко выявляется скрининговыми тестами или экспресс-тестом с реагинами плазмы, который столь же надежен и дает немедленный результат. В настоящее время для подтверждения имеются и более специфичные методы (Doroshenko et al., 2006). В ликворе отмечается лимфоцитарный плеоцитоз, повышенный уровень белка и иногда сниженное количество глюкозы. Обнаруживаются олигоклональные антитела. При лечении на всех стадиях нейросифилиса используют пенициллин G.
б) Лептоспироз нервной системы. Лептоспироз — системное сосудистое заболевание, причиной которого являются различные спирохеты Leptospira interrogans. Заражение человека происходит через контакт с инфицированными жидкостями животных. Вначале появляются признаки системного заболевания с ознобом, конъюнктивитом и иногда желтухой (болезнь Вейля), а затем симптомы раздражения мозговых оболочек. В ликворе имеется плеоцитоз с повышенным уровнем белка, что может обнаруживаться в течение нескольких недель, но исход всегда благоприятный. Развитие энцефалита наблюдается только в исключительных случаях. Диагноз ставится на основании выделения патогенных микроорганизмов Эффективно лечение пенициллином.
в) Боррелиоз (болезнь Лайма) нервной системы. Болезнь Лайма является эндемичной по всей Северной Америке, Европе и Азии. Вызывается спирохетами из группы Borrelia burgdorferi и передается человеку от животного-носителя через укусы клещей рода Ixodes. Большинство случаев регистрируется поздней весной и летом, чаще всего среди возрастной группы 5-14 лет. Инфекция может протекать бессимптомно, вызывая только специфическую сыпь или с диссеминацией во многие органы, включая ЦНС. Заболевание делится на 3 стадии. Первая стадия начинается через 7-10 дней после укуса и характеризуется сыпью, известной как мигрирующая хроническая эритема, расположенная вокруг места укуса и распространяющаяся кнаружи от него. На этой стадии могут присутствовать минимальные системные симптомы. Вторая стадия, которая встречается у 5-15% пациентов, развивается в результате диссеминации инфекции через несколько недель или месяцев.
Наиболее характерными проявлениями являются сильные боли (Stanek и Strle, 2003). Среди редких проявлений отмечают дисфункции других черепных нервов, атаксию, хорею, энцефалит симметричную нейропатию типа Гийена-Барре (Christen, 1993, Bingham et al., 1995) или поперечный миелит (Linssen et al., 1991). У 95% детей в ликворе присутствует плеоцитоз с повышенным уровнем белка. Но олигоклональные антитела обнаруживаются только в трети случаев. Менингеальная реакция склонна к хронизации, и болезнь Лайма вместе с эпидемическим паротитом являются основной причиной продолжительного стерильного менингита, насчитывающего 11,7% случаев по данным Christen (1993). Третья стадия стойкой инфекции может наблюдаться у нелеченных пациентов через год или несколько лет после начала заболевания. Обычно проявление в виде хронического артрита, но В. Burgdorferi может стать причиной поздних синдромов поражения как центральной, так и периферической нервной системы у взрослых, и реже, у детей. Пределы спектра этих нарушений до сих пор не определены и широки, с прогрессирующим энцефаломиелитом в качестве главного осложнения (Finkel, 1988; Kollikowski et al., 1988; Halperin et al., 1989; Pachner, 1989).
В частности, все еще обсуждается роль нейроборрелиоза в когнитивных расстройствах и расстройствах настроения, сна и аппетита (Ackermann et al., 1988). Описаны проявления со стороны ЦНС в детском возрасте (Feder et al., 1988b). Могут наблюдаться тонкие неврологические проявления, такие как парестезии, корешковые боли или изменения памяти (Wokke et al., 1987а, b).
Диагностика болезни Лайма основана на анамнезе, клинических проявлениях и лабораторных данных о инфекции Borrelia. Факт укуса часто упускается, а кольцевидная эритема встречается только в 67% случаев (Williams и Schned, 1990; Williams et al., 1990). Три четверти случаев регистрируются с июня по октябрь. Серологические методы диагностики, чаще с использованием ферментного иммуносорбентного теста анализа, не всегда надежны, как и многие нестандартизованные коммерческие анализы, как правило, серонегативность не выявляется в начале заболевания, а только на поздних стадиях доказанных случаев.
Положительные результаты часто встречаются в эндемичных областях, но не всегда связаны с текущим неврологическим заболеванием (Halperin et al., 1989). Более того, возможна перекрестная реакция с вирусом Эпштейна-Барр и вирусом опоясывающего герпеса. Более надежным критерием является наличие IgM антител к В. burgdorferi (Christen et al., 1993). Для подтверждения диагноза рекомендуется выполнение иммуноблот-анализа (Golightly, 1997), но этот метод не всегда доступен. ПЦР при положительном результате может быть полезной, так как ложно-позитивные результаты указываются только в 3% случаев, хотя у этого метода низкая чувствительность (Pachner и Delaney, 1993; Golightly, 1997; Tuerlinckx et al., 2003). Недавно было установлено, что относительно частым и специфичным является определение специфичных антигенов В. burgdorferi при отсутствии антител (Coyle et al., 1995).
В таких случаях выявлялись патологические изменения на МРТ в виде точечных (или больше) участков усиления сигнала в Т2-режиме в белом веществе, которые могут симулировать множественный склероз (Belman et al., 1992). Атипичные случаи могут имитировать опухоль ствола мозга (Curless et al., 1996).
Лечение включает применение амоксициллина или цефуроксима для ранних стадий болезни и цефтриаксона или цефотаксима для более тяжелых форм. Отсутствие эффекта приводило к продолжению лечения до 2-4 недель, хотя никаких преимуществ при этом не выявлялось (Stanek и Strle, 2003; Wormser et al., 2003).

д) Микоплазменные инфекции нервной системы. Mycoplasma pneumoniae может приводить к неврологической патологии у более 7% инфицированных пациентов, причем половина случаев относится к детям (Guleria et al., 2005). Механизм вовлечения ЦНС сложен и включает как прямое внедрение (Abramovitz et al., 1987), так и непрямое воздействие токсинов или иммунологических нарушений. Клиническими проявлениями могут быть менингит, энцефалит, мозжечковая атаксия, поперечный миелит (Francis et al., 1988; Mills и Schoolfield, 1992; Guleria et al., 2005), невриты черепных нервов и синдром Гийена-Барре (Fernandez et al., 1993). Культуральный метод определения не имеет практического значения из-за высокой требовательности микроорганизмов к питательным средам и диагностика основывается на серологических анализах—либо на холодовой агглютинации, либо определении повышения титров при реакции связывания комплемента для М. pneumoniae, который начинается примерно через неделю после начала инфекции и присутствует в течение нескольких лет. ИФА с IgM и IgG обладает и чувствительностью и специфичностью.
ПЦР также может быть информативна. В лечении применяют макролиды, но из-за отсутствия у них клеточной стенки, бета-лактамные антибиотики бесполезны. При наличии признаков прямого вовлечения ЦНС может рассматриваться ципрофлоксацин, так как макролиды плохо проникают через гемато-энцефалический барьер. Возможно тяжелое течение с развитием последствий в одной трети случаев и уровнем смертности почти 10%.
е) Инфекция Listeria monocytogenes (листериоз) нервной системы. Инфекция L. monocytogenes наблюдается главным образом у новорожденных и у пациентов с ослабленным иммунитетом, в том числе и у детей (Frith et al., 1987). Передается с зараженной пищей, такой как молоко или мягкий сыр. Может быть причиной менингита или ромбоэнцефалита с формированием множественных абсцессов. В ликворе обнаруживают преобладание мононуклеаров и низкий уровень глюкозы. Диагноз выставляется при прямом окрашивании СМЖ или культуральном методе. Обязательна активная антибиотикотерапия ампициллином, а иногда гентамицином (см. табл. 10.2).
ж) Болезнь кошачьих царапин (БКЦ) нервной системы. Болезнь кошачьих царапин — самоограничивающее заболевание, вызываемое Bartonella henselae и обычно поражающее детей и подростков. При типичной БКЦ кожная папула развивается через 7-10 дней после царапины или укуса котенка или кошки. Затем развивается регионарная лимфаденопатия, лихорадка, иногда с ночной потливостью, потерей веса и системными признаками. Неврологическое поражение встречается редко. При его наличии головная боль сопровождает менингоэнцефалит, иногда прогрессирующий до припадков, галлюцинаций и комы. Возможны и локализованные формы с поражением спинного мозга или корешков и/или параличами черепно-мозговых нервов (Lewis и Tucker, 1986). Сообщалось и об артериите мозга (Selby и Walker, 1979) и зрительной нейропатии (Sweeney и Drance, 1970).
В ликворе может быть плеоцитоз с небольшим повышением уровня белка. Диагностика проводиться по серологическим реакциям или ПЦР. Кожные пробы с антигеном кошачьих царапин обычно не выполняются. Изредка может потребоваться биопсия лимфатического узла для подтверждения диагноза. Эффективное лечение проводят триметоприм-сульфаметоксазолом, а также ципрофлоксацином, рифампицином или азитромицином.
з) Другие редкие причины поражения ЦНС при бактериальной инфекции. В эту группу включены инфекции Legionella, которые вызывают судороги, энцефалопатию и периферическую нейропатию (Heath et al., 1986). Болезнь Уиппла обычно поражает взрослых, но наблюдалась и у детей (Barakat et al., 1973). Вызывается Tropheryma whipplei и имеет исключительно неврологические формы (Duprez et al., 1996; Louis et al., 1996), из которых основными являются атаксия, слабоумие, гиперсомния, гиперфагия, припадки, офгальплегия и нистагм. Нейровизуализация может быть нормальной или показывать множественные поражения. Неврологические проявления также могут сопровождаться гастроинтестинальными и ревматоидными симптомами и признаками. В лечении используют триметоприм сульфаметоксазол, цефтриаксон или фторхинолоны. Риккетсиозные инфекции следует упомянуть, даже при том, что они не являются обычными бактериальными агентами. Риккетсиозные поражения редко встречаются в западных странах, за исключением пятнистой лихорадки скалистых гор, которая часто встречается на востоке США и вызывает картину менингоэнцефалита (Bell и Lascari, 1970).
Перинатальные поражения центральной нервной системы (ЦНС) — это общий термин, обозначающий страдания нервной системы у новорождённых детей, вызванные различными причинами.
Как часто встречаются перинатальные поражения центральной нервной системы?
От 5 до 55% детей первого года жизни получают такой диагноз, поскольку в это число иногда включают детей с лёгкими преходящими нарушениями со стороны нервной системы. Тяжёлые формы перинатальных поражений ЦНС наблюдаются у 1,5–10% доношенных и у 60–70% недоношенных детей.
Почему возникают перинатальные поражения центральной нервной системы?
Основная причина перинатального поражения ЦНС у плода и новорождённого — гипоксия (кислородная недостаточность), возникающая под влиянием различных факторов. Неблагоприятные условия для развития плода в утробе матери могут быть заложены задолго до наступления беременности вследствие различных заболеваний у девочки-подростка, будущей матери. Инфекционные и неинфекционные заболевания, гормональные нарушения, вредные привычки, производственные вредности во время беременности вызывают усиление гипоксии будущего ребёнка. Предшествующие аборты приводят к нарушению кровотока между матерью и плодом и, следовательно, к внутриутробной гипоксии. Важную роль в развитии перинатальных поражений ЦНС играют инфекции, передающиеся половым путём (хламидиоз, герпес, сифилис). Причиной острой асфиксии в родах могут быть различные нарушения нормального течения родов, стремительные или затяжные роды, неправильное положение петель пуповины. Механическая травма ребёнка реже приводит к перинатальному повреждению ЦНС (особенно головного мозга). Риск травматизации ребёнка и острой асфиксии повышается, если роды проходят вне медицинского учреждения, в том числе при родах в воде. У недоношенных детей в связи с их незрелостью перинатальное поражение ЦНС наблюдают чаще.
Опасны ли перинатальные поражения центральной нервной системы?
Тяжёлые перинатальные поражения мозга (в том числе внутричерепные кровоизлияния, тяжёлая ишемия мозга) представляют реальную угрозу для жизни и здоровья ребёнка, даже при своевременно оказанной высококвалифицированной медицинской помощи в условиях перинатального центра. Среднетяжёлые и лёгкие формы поражения мозга непосредственной угрозы для жизни не представляют, но они могут быть причиной нарушений психики и развития двигательной активности у ребёнка.
Как проявляются перинатальные поражения центральной нервной системы?
Особенности нарушений при перинатальном поражении ЦНС зависят от характера поражения мозга (кровоизлияние в различные структуры мозга, ишемия, инфекционные поражения), их тяжести, степени зрелости ребёнка, стадии заболевания.

При среднетяжёлых поражениях мозга могут преобладать вегетативно-висцеральные проявления: упорные срыгивания, задержка или учащение стула, вздутие живота, расстройства терморегуляции (реакции организма на тепло и холод), бледность и мраморность кожи, лабильность сердечно-сосудистой и дыхательной систем и т.д.
У детей с тяжёлым перинатальным поражением ЦНС уже с конца первого месяца жизни отмечают задержку развития психики и движений: реакция на общение вялая, монотонный крик (эмоционально не окрашенный). Возможно раннее (в 3–4 мес) формирование стойких двигательных нарушений по типу детского церебрального паралича.
Как диагностируют перинатальное поражение центральной нервной системы?
Диагноз основывается на данных врачебного осмотра, анамнестических данных и подтверждается инструментальными исследованиями. Большое значение имеет ультразвуковое исследование (УЗИ) мозга с оценкой состояния его сосудов (допплерографией). При необходимости используют рентгенологическое исследование черепа, позвоночника, компьютерную томографию (КТ), магнитно-резонансную томографию (МРТ).
Какие методы лечения и профилактики перинатального поражения центральной нервной системы существуют?
В остром периоде тяжёлых перинатальных поражений мозга лечение проводят в отделении реанимации и интенсивной терапии новорождённых. В первую очередь устраняют нарушения в работе дыхательной, сердечно-сосудистой системы и нарушения обмена веществ, ликвидируют судороги (при необходимости проводят искусственную вентиляцию лёгких, внутривенные вливания, парентеральное питание). Далее новорождённых переводят в специальное отделение, где продолжают индивидуальное лечение в зависимости от характера и тяжести поражения мозга: применяют противосудорожные препараты, при развивающейся гидроцефалии — дегидратационные, а также средства, стимулирующие рост капилляров и улучшающие питание повреждённых тканей мозга. Эти же препараты по назначению невролога можно применять на протяжении первого года жизни повторными курсами. При среднетяжёлых и особенно лёгких поражениях ЦНС используют в основном нелекарственную терапию.
В восстановительном периоде (с конца первого года жизни) решающее значение имеют нелекарственные методы реабилитации: лечебный массаж и гимнастика, упражнения в воде, физиотерапия, педагогические методики музыкотерапии (оздоровление и лечение организма с помощью музыки).
Профилактика перинатальных поражений мозга может быть первичной и вторичной

Первичная профилактика подразумевает укрепление здоровья подростков (будущих родителей), плановое наблюдение за беременными женщинами, чтобы как можно раньше выявить нарушения течении беременности, грамотное родовспоможение (в том числе плановое кесарево сечение при высоком риске родового травматизма).
Вторичная профилактика – это предотвращение неблагоприятных для ребёнка последствий перинатальной патологии, проведение комплексного лечения и эффективное восстановление его здоровья.
Читайте также:

