Инфекция после операций на коленном суставе
Обновлено: 26.04.2024
Парапротезная инфекция – это инфекционный процесс в области сустава, возникающий после эндопротезирования и патогенетически связанный с наличием имплантата. Проявляется локальными признаками воспаления: отеком, болезненностью, местной гиперемией и гипертермией, нарушением функции конечности в сочетании с симптомами общей интоксикации. Нередко протекает со стертой клинической симптоматикой. Диагностируется с учетом анамнеза, лабораторных анализов, рентгенологических методик, МРТ, УЗИ. В зависимости от вида параэндопротезной инфекции выполняются ревизии с сохранением эндопротеза либо удаление имплантата с реэндопротезированием, артродезом, костно-мышечной пластикой.
МКБ-10
Общие сведения
Парапротезная инфекция – актуальная проблема современной травматологии и ортопедии. Последние десятилетия ознаменовались широким распространением эндопротезирования. Увеличилось не только общее количество операций, но и количество протезируемых суставов. Если раньше замене, в основном, подвергали тазобедренный сустав, то в наши дни рутинной практикой стало протезирование коленного, плечевого, других средних и мелких суставов конечностей. Соответственно, возросло число случаев развития инфекционного процесса в области оперативного вмешательства. Распространенность патологии при первичном эндопротезировании составляет 0,3-1%. Частота осложнения при повторной установке искусственного сустава, по различным данным, колеблется от 9 до 40%. В большинстве случаев осложнение возникает в первые два года после операции.

Причины
Непосредственной причиной парапротезной инфекции становятся болезнетворные бактерии, при этом существует определенная связь между типом возбудителя и видом протеза, обусловленная склонностью микробов к адгезии к тем или иным инородным материалам, находящимся в организме пациента. Так, в области металлических частей имплантата инфекция чаще вызывается золотистым стафилококком, в зоне полимерных – эпидермальным стафилококком. Наряду со стафилококковой флорой воспаление могут провоцировать стрептококки, кишечная палочка и некоторые другие микроорганизмы. Обстоятельствами, способствующими возникновению воспалительного процесса, считаются:
- Особенности вмешательства. Установлено, что при длительности операции более 3 часов вероятность осложнения увеличивается, что связано с продолжительным контактом тканей с внешней средой, нарушениями кровообращения, локальными обменными расстройствами и общей реакцией организма на стресс. Большое значение имеют интраоперационные осложнения, технические трудности и значительная кровопотеря, усугубляющие действие перечисленных факторов.
- Особенности установки эндопротеза. Риск развития инфекции в зоне искусственного сустава повышается при применении дополнительных биологических и синтетических материалов, нестабильности имплантата. В первом случае имеет значение реакция организма на наличие чужеродных элементов, во втором появляется постоянный источник травматизации окружающих тканей, создаются благоприятные условия для внедрения инфекционных агентов.
К числу особенностей организма пациента, способствующих появлению данного осложнения, относят пожилой возраст, наличие тяжелой соматической патологии и иммунные нарушения различного генеза. Негативную роль играет многократное или длительное применение антибиотиков перед операцией, обуславливающее устойчивость микроорганизмов к антибактериальной терапии, нарушение рекомендаций врача относительно режима активности и реабилитационных мероприятий в послеоперационном периоде.
Патогенез
Парапротезная инфекция – разновидность имплантат-ассоциированной инфекции, которая возникает после эндопротезирования вследствие способности патогенных микробов к колонизации имплантатов. Бактерии, вызывающие это осложнение, обладают свойством формировать биофильмы (биологические пленки) на поверхностях чужеродных материалов в организме больного. Выделяют два механизма возникновения биопленок. Первый – неспецифическое взаимодействие непосредственно между поверхностью протеза и микроорганизмами за счет сил поверхностного натяжения, водородных связей, гидрофобности, электростатического поля и т. д.
Второй – контакт бактерий с белками, располагающимися на поверхности искусственной конструкции. После установки части эндопротеза очень быстро покрываются слоем белков, среди которых преобладают альбумины. При адгезии микробов к этим белкам формируются микроколонии. Вначале имплантат колонизируется аэробными микроорганизмами, в последующем в глубоких слоях биофильма создается благоприятная среда для развития анаэробной микрофлоры. При увеличении биопленки или под влиянием внешних воздействий ее части отрываются от поверхности имплантата, происходит диссеминация процесса. Исследование перечисленных механизмов позволило объяснить устойчивость инфекции и неэффективность консервативной терапии этого осложнения.
Классификация
Существует много вариантов классификации параэндопротезной инфекции, однако общепризнанная международная систематизация этого осложнения пока отсутствует. Обычно травматологи-ортопеды используют классификацию Ковентри-Фитцджеральда, в основе которой лежит временной период между операцией и манифестацией инфекционного процесса. Различают четыре типа парапротезной инфекции:
- Острая послеоперационная. Признаки инфицирования определяются в течение месяца после вмешательства.
- Поздняя хроническая. Осложнение диагностируется во временном промежутке от 1 месяца до 1 года с момента операции.
- Острая гематогенная. Симптомы патологии возникают через 1 и более год после установки искусственного сустава.
- Положительная интраоперационная культура. Характеризуется бессимптомным течением при выявлении бактерий в 2-х и более интраоперационных образцах ткани.
В российской клинической практике также применяют систематизацию инфекций в области хирургических вмешательств, разработанную сотрудниками Новосибирского НИИТО. Согласно этой классификации различают три вида послеоперационных инфекционных процессов: ранний острый (возникший в первые 3 месяца), поздний острый (развившийся в течение 3-12 месяцев), хронический (диагностированный спустя 1 год и более после операции). При постановке диагноза отмечают наличие или отсутствие нестабильности эндопротеза.
С учетом формы выделяют флегмоноподобную, свищевую, латентную и атипичную инфекции, с учетом глубины – поверхностную и глубокую. Несмотря на то, что поверхностная инфекция протекает без вовлечения эндопротеза (то есть, имеет другой патогенез), поражает только кожные покровы и подкожную клетчатку, поддается консервативной терапии, специалисты рассматривают ее в рамках параэндопротезной инфекции, поскольку такой подход позволяет учесть все возможные варианты инфекционных осложнений эндопротезирования.
Симптомы парапротезной инфекции
Проявления патологии зависят от времени возникновения и глубины процесса. Поверхностная инфекция развивается в период восстановления после операции, сопровождается воспалением мягких тканей при интактности оперированного сустава. Характеризуется гиперемией, локальной припухлостью, повышением местной температуры, незначительными или умеренными болями, нарушением заживления раны, расхождением ее краев, наличием гнойного отделяемого. Возможно образование участков поверхностного некроза, формирование лигатурных свищей. Выраженность общей интоксикации определяется распространенностью поражения кожи и жировой клетчатки.
Глубокая парапротезная инфекция может манифестировать как в раннем послеоперационном периоде, так и спустя продолжительное время после вмешательства. Поражает мышцы и фасции. Проявляется отечностью мягких тканей, болью в проекции сустава, ограничением функции конечности, общими интоксикационными симптомами: повышением температуры тела до 38 °С и выше, ознобами, слабостью, разбитостью, тахикардией, тахипноэ. Возможно сочетание глубокого и поверхностного процесса, рассматриваемое специалистами как разновидность глубокой инфекции. Из-за распространенности иммунологических нарушений в популяции патология часто протекает со сглаженной симптоматикой. Снижение иммунитета усугубляют переливания крови, лекарственная терапия и другие лечебные мероприятия, проводимые на пред- и послеоперационном этапе.
Осложнения
Наиболее частые осложнения параэндопротезной инфекции обусловлены распространением гнойного процесса. Наблюдается образование абсцессов и флегмон. Особенно опасны глубокие затеки в полость таза, иногда формирующиеся при поражении оперированного тазобедренного сустава. В тяжелых случаях возможно развитие сепсиса. При часто рецидивирующей патологии снижается или утрачивается трудоспособность, ухудшается качество жизни больных, персистирующий очаг инфекции оказывает негативное влияние на деятельность внутренних органов.
Диагностика
Диагноз обычно выставляют специалисты в области ортопедии, наблюдающие пациентов, перенесших эндопротезирование сустава. Из-за часто встречающихся стертых форм и неспецифичности результатов дополнительных методик распознавание парапротезной инфекции может представлять определенные затруднения. Программа обследования обычно включает следующие методы:
- Опрос, осмотр. Признаком, указывающим на вероятность возникновения данной патологии, является замена сустава в анамнезе. Ортопед уточняет жалобы, время появления и динамику развития симптомов, оценивает внешний вид и функцию сустава, выявляет признаки воспаления, участки некроза, свищевые ходы и пр.
- Ультразвуковое сканирование. УЗИ сустава применяется в качестве скринингового метода, позволяет обнаружить абсцессы или гематомы, выполнить прицельную пункцию гнойного очага для последующего изучения содержимого в процессе бактериологического исследования.
- Рентгенологические методики. Результаты обычной рентгенографии часто неоднозначны. О наличии заболевания могут свидетельствовать остеолиз и периостальная реакция, без видимых причин возникшие после успешного вмешательства. Для оценки динамики процесса обязательно выполняют контрольные снимки. При свищах производят рентгенофистулографию для определения локализации свищевых ходов и затеков.
- Магнитно-резонансная томография. Является уточняющим методом, назначается на этапе предоперационного обследования для оценки размеров и расположения глубоких (в том числе – внутритазовых) абсцессов, уточнения объема хирургического вмешательства.
- Лабораторные анализы. При острой патологии в ОАК обнаруживаются признаки воспаления: лейкоцитоз, нейтрофилез, лимфоцитопения, сдвиг формулы влево, повышение СОЭ. При хронических формах изменения крови могут быть выражены незначительно. Более специфичны результаты исследования на С-реактивный белок, отражающие динамику воспалительного процесса, а также данные бакпосева раневого отделяемого. Микробиологический анализ синовиальной жидкости часто отрицательный из-за формирования биопленок.
Лечение парапротезной инфекции
В случаях поверхностного инфекционного процесса тактика такая же, как при других инфицированных ранах. Осуществляется санация поверхностного гнойного очага на фоне антибиотикотерапии, операции на суставе не требуются. При глубокой инфекции тактика определяется типом патологии с учетом времени ее возникновения, наличием либо отсутствием нестабильности сустава, расположением и размером гнойных затеков, состоянием костей и мягких тканей, устойчивостью флоры к антибактериальным препаратам и некоторыми другими факторами. Лечение только хирургическое. Существуют следующие варианты вмешательств:
- Ревизия с сохранением имплантата. Проводится при раннем инфицировании, сохранении стабильности сустава, незначительном поражении элементов эндопротеза. Сустав вскрывают, исследуют его поверхности. Инфицированные окружающие ткани иссекают, полиэтиленовый вкладыш заменяют (при необходимости – вместе с головкой протеза), рану ушивают, дренируют.
- Ревизионное эндопротезирование. Рекомендуется при поздней хронической и иногда – острой гематогенной парапротезной инфекции, предполагает одно- двух- или трехэтапную замену имплантата. Чаще всего используют двухэтапное реэндопротезирование, на первом этапе выполняют ревизию раны, затем после курса антибиотикотерапии устанавливают новый протез. При трехэтапном вмешательстве на втором этапе производят костную пластику.
- Артродез сустава. Показан при рецидивирующей инфекции, резистентности патогенной флоры к антибиотикам. Предусматривает удаление эндопротеза и наложение аппарата внешней фиксации для создания неподвижного соединения между концами костей.
- Ампутация или экзартикуляция. Осуществляется редко, в качестве показаний рассматривается наличие упорно рецидивирующего очага инфекции, представляющего угрозу для жизни больного, при одновременной утрате функции конечности.
Прогноз и профилактика
1. Медицинские и социальные проблемы эндопротезирования суставов конечностей/ Москалев В.П., Корнилов Н.В., Шапиро. К.И. - 2001
2. Инфекционные осложнения после эндопротезирования крупных суставов как актуальная проблема современной ортопедии/ Муконин А.А.// Новые медицинские технологии - 2006 -№ 8
3. Лечение параэндопротезной инфекции тазобедренного сустава: клинические рекомендации/ Министерство здравоохранения РФ - 2013
Артроскопия коленного сустава – эндоскопическая операция, применяемая с целью развернутой диагностики и хирургического лечения различных суставных повреждений. Высокоинформативная визуальная методика позволяет высококачественно обследовать и лечить сустав закрытым способом, используя пункционные порталы, что существенно уменьшает степень операционной травмы, минимизирует болезненные ощущения и в значительной мере сокращает сроки восстановительного периода.
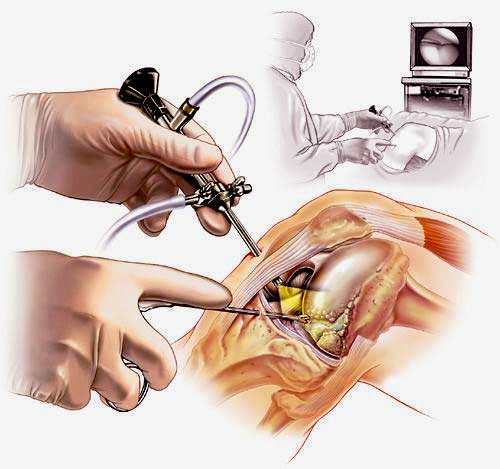
Наглядная схема проведения операции.
Как операцию, стали применять еще на рассвете 20 столетия. Но до нашего времени процедура прошла еще множество этапов совершенствования. И сейчас она стала по-настоящему незаменимым направлением в ортопедии, благодаря минимальной травматичности, стопроцентной диагностической достоверности и высокой эффективности.
Понятие и преимущества процедуры
Хирургия проводится с использованием специализированной волоконной оптики современного поколения, встроенной в инновационный прибор под названием артроскоп. Благодаря уникальному прибору процедура и получила свое название. В процессе производится внутреннее изучение костных и хрящевых тканей, менисков, сухожилий, мышц, связок, соединительнотканных элементов, синовиальной жидкости.
Изображение полости сустава.
Доказано, что артроскопия превосходит любые существующие способы диагностики. Она четко показывает изнутри все структурные единицы костного соединения в самых мельчайших подробностях, позволяет определить даже мелкие скрытые повреждения, которые нельзя выявить при помощи стандартной рентгеноскопии или артрографии, ультразвука, МРТ, КТ и прочих популярных методов визуализации.
Метод используется не только как средство диагностики, но и в качестве лечебно-восстановительной тактики. Обнаружив те или иные нарушения хрящевой поверхности, доктор может сразу же их ликвидировать. Оперативные манипуляции он выполнит через дополнительный разрез (размер около 6 мм) с использованием микрохирургических инструментов, при этом весь процесс он будет совершать, глядя на монитор.
Показания и противопоказания
Сразу отметим, что к негативным последствиям лечение приводит крайне редко. Однако такое не исключается, если ее стали делать вопреки противопоказаниям. Но сначала осветим рекомендации, а уже после ограничения.

Частичный надрыв боковой связки коленного сустава.
Процедура может быть назначена при:
- неясной причине патологических симптомов, когда другие способы бессильны ее установить;
- разрывах связок, поврежденных сухожилиях;
- подозрении на вывих чашечки (надколенника);
- наличии свободных тел в полости;
- воспалении синовиальной оболочки неопределенного генеза; головки суставной кости;
- травмах, дегенеративно-дистрофических заболеваниях мениска; болезни и гонартрозе;
- внутрисуставных переломах и пр.
Она противопоказана при наличии таких недугов, как:
- гипертония;
- сахарный диабет в стадии декомпенсации;
- нарушенный баланс свертываемости крови;
- тяжелая дисфункция легочной или сердечной систем;
- локальные кожные воспаления.
С осторожностью выполняется лечебно-диагностическая артроскопия, последствия могут носить непредсказуемый характер, при аллергии на местный/общий анестетик. Поэтому обязательно сообщите специалисту, если у вас имеется склонность к аллергическим реакциям на любые медикаменты.
Подготовка пациента к операции
Подготовка заключается в тщательном осмотре пациента, сборе анамнеза, проведении основных инструментальных и лабораторных тестов. Пока врач не убедится, что это безопасная операция, не взвесит все за и против, операция невозможна. Поэтому вначале всегда назначают обход некоторых специалистов узкого профиля, например, кроме ортопеда или травматолога, в зависимости от ситуации, еще кардиолога, эндокринолога, пульмонолога, аллерголога и пр.
Предельно важно учесть абсолютно все результаты предварительной диагностики. Они будут влиять на выбор наркоза, особенная роль отводится подбору оптимально подходящего вида анестетика, который не причинит вреда организму.
Кроме врачебного обхода, пациенту выдают направления на ЭКГ и флюорографию, на прохождение лабораторных анализов крови и мочи. Удостоверившись, что за эту операцию браться целесообразно, проводят консультацию по подготовке. На консультации предупреждают, что за 12 часов до начала процедуры потребуется остановить прием пищи, за пару недель до нее прекратить прием антикоагулянтов (аспирина, гепарина и лекарств на их основе).
Пациенты, оставившие отзывы, сообщают о предостерегающих рекомендациях врачей по поводу курения и приема алкоголя. С вредными привычками придется расстаться за 10-14 суток до вмешательства и, конечно, постараться к ним после вообще не возвращаться или хотя бы свести к минимуму дозу. При намерении прибегнуть только к диагностике предоперационная подготовка осуществляется аналогичным правилам.
Описание микрохирургического процесса
В отзывах пациенты рассказывают, как быстро и безболезненно перенесли процедуру, при этом без общего наркоза. Это вполне вероятно, но не забывайте, что клинические случаи не у всех одинаковы, да и физиологический статус у каждого пациента свой. Поэтому было бы правильнее сказать, что боль, благодаря сильной местной анестезии практически невозможна. Однако постоперационные неприятные ощущения в области прооперированного участка немного беспокоить какое-то время, скорее всего, будут.
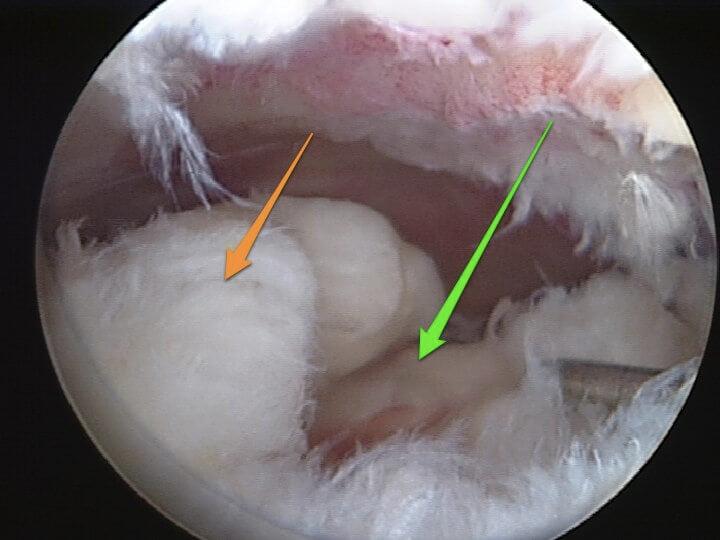
Разволокнение связок при их разрыве.
Видео позволяет разобраться во всех тонкостях процесса. Их предостаточно на просторах интернета. Но ввиду того, что специфические сюжеты не каждый сможет досмотреть до конца, мы предлагаем о важных моментах просто и спокойно почитать.
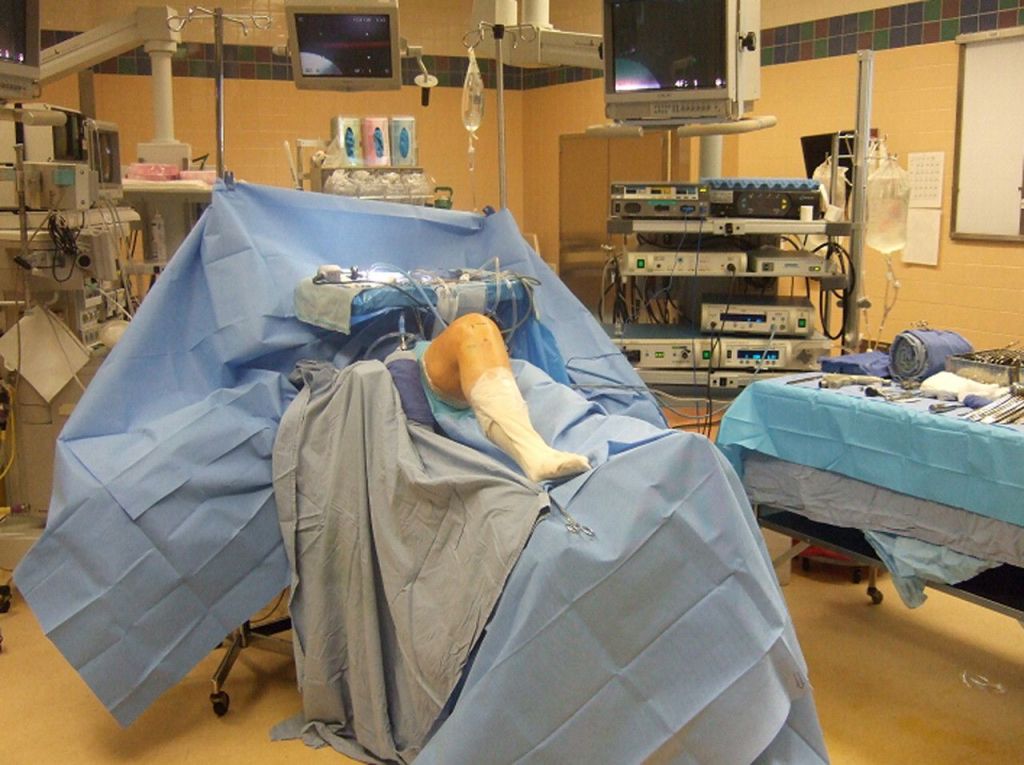
Расположение пациента на операционном столе.
Исходя из этиологии и степени патологических изменений, состояния больного и сопутствующих заболеваний, анестезиологическое средство подбирается индивидуально. Чаще всего применяется местный наркоз, то есть анестезия регионарного типа (эпидуральная или проводниковая). Регионарный анестетик содержит лидокаин, ропивакаин или бупивакаин. К основному раствору для усиления анестезирующего эффекта могут добавить в мини-дозе лекарство из категории опиатов. В некоторых ситуациях, все же, уместен общий внутривенный наркоз.
Сначала, вне зависимости от планов хирурга, будет осуществлена диагностическая артроскопия. Она предусматривает введение эндоскопического зонда в виде стержня в полость костного соединения. Когда наркоз вступит в силу, тогда начинается диагност-хирургия. Для этого полусогнутую в колене конечность ближе к бедру жгутируют для уменьшения кровотока, после чего делают прокол (6 мм), через который подается контраст-вещество, чтобы усилить видимость суставных и околосуставных структур. Далее через этот операционный порт вводится трубка. Специалист досконально осматривает каждый миллиметр проблемного органа.
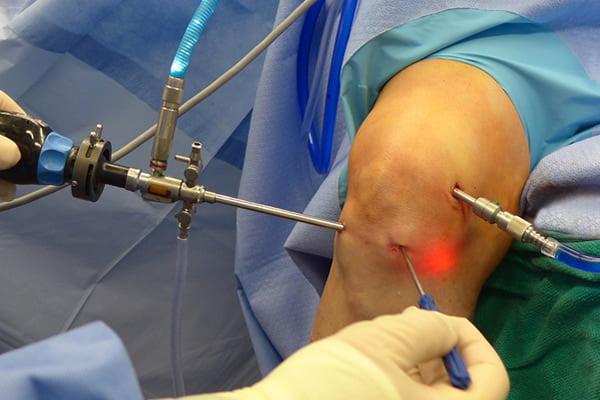
Операционное поле, можно видеть свечение внутри.
Видео в реальном времени транслируется на экране, выявляет любые существующие дефекты в больном сочленении. Если врач посчитает нужным выполнить регенерацию патологических элементов, он создаст дополнительный разрез (6-8 мм), через который нужным инструментом из микрохирургического набора устранит обнаруженный дефект. Он может сделать частичную резекцию костно-хрящевых тканей, пластику связок и сухожилий, сшивание или удаление (частичное, полное) мениска, экспроприировать хондромные тела, извлечь выпот и гной, ввести противовоспалительные лекарства, взять фрагмент тканей или синовии для изучения их состава и др.
По окончании хирургии операционное поле промывается, а весь инструментарий извлекается. Доктор производит обработку дезинфицирующими составами рану, ставит дренаж и делает маленький шов, который закрывает стерильным лейкопластырем. На прооперированное колено, чтобы придать ему максимальную обездвиженность, накладывается плотная фиксирующая повязка от стопы до середины бедра.
На весь сеанс уходит в среднем 1 час, в отдельных случаях – до 3 часов. Восстановительные меры несложные, но их нужно строго соблюдать, чтобы не спровоцировать опасные осложнения. О негативных явлениях, которые способны развиться, речь пойдет дальше.
Осложнения после артроскопии коленного сустава
Как любой хирургический способ, данный метод, даже при всей своей миниинвазивности, может иметь неблагоприятный исход. К осложнениям приводят несоблюдение реабилитационных норм, нарушение принципов асептики и антисептики, врачебные ошибки. Неблагополучная картина возникает нечасто, поэтому паниковать не стоит. Нужно изначально со всей долей ответственности отнестись к выбору клиники.

Отзывы пациентов после артроскопии коленного сустава вместе с данными официальной статистики позволили нам сформировать список самых частых эксцессов. В него входят следующие негативные явления, возникающие в ранний или отдаленный послеоперационный период:
- повышение общей температуры тела;
- ярко выраженный перманентный или периодический болевой синдром в области сустава, нередко иррадирующий в голень, тазобедренный сегмент;
- локальная гиперемия, отечность, гипертермия;
- местные инфекции, абсцессы;
- тромбоэмболия сосудов;
- внутрисуставное кровоизлияние;
- артрит на фоне воспаления, бурсит;
- кровотечение из раны;
- боль и онемения из-за повреждения нервных образований;
- нарушение целостности связок, как следствие некорректных манипуляций хирурга.
Особенности восстановления
Для предупреждения отекания мягких тканей покрывающих колено к ране прикладывают холод. Сухие компрессы со льдом положены каждые 60-90 минут на начальных этапах реабилитации. Человеку необходимо оставаться в стационаре под наблюдением специалистов минимум двое суток. Ему прописываются хорошие болеутоляющие препараты, а также средство из серии антибиотиков для профилактики инфекционного патогенеза. Вставать разрешается уже на 3 день, но ходить позволяется исключительно с ходунками или костылями. Оберегать ногу от полной нагрузки надо не менее одной недели.

Успех артроскопической операции на коленном суставе всецело завит от качества постоперационного ухода. Полное восстановление наступает примерно через 1-1,5 месяца, все это время нужно выполнять в строгом порядке все пункты реабилитационной программы, индивидуально составленной высококомпетентным реабилитологом.
Интенсивными темпами восстановиться помогают массаж, комплекс ЛФК, физиотерапия, упорный труд и терпение. Приблизительно через 7-10 дней возможна отмена поддерживающих средств для передвижения, человеку разрешается передвигаться так, как этого требует природа, а именно, без поддержки на двух ногах с равнозначной нагрузкой, движения при этом плавные и медленные, шаг мелкий. Лечебная гимнастика и ходьба определенный промежуток времени осуществляются в специальном функциональном ортезе, надетом на проблемную ногу.
Занятия лечебной физкультурой на ранних сроках щадящие. В первую неделю занимаются, как правило, в положении лежа. Основу комплекса составляют напряжение/сокращение тазобедренных мышц, поднятие прямой конечности на 45 градусов с 5-секундным удержанием, разминка голеностопа. К лимфодренажному массажу прибегают с целью снятия послеоперационного отека. Он выполняется профессионально обученным массажистом вручную или посредством микротокового аппарата. В поздний период прописываются велотренировки, плаванье, ходьба и бег в воде.
Заключение
Процедура очень высоко ценится специалистами, ведь помимо такого высокоинформативного обследования, она позволяет параллельно исправлять обнаруженные недостатки, причем делать это высокотехнологично, без травматического рассечения надсуставных мягких тканей и без обнажения костного соединения.
Предпочтительнее будет обследовать, а если потребуется, прооперировать колено, в одной из высокоспециализированных клиник Европы. Там данной методикой владеют на высшем уровне. Замечательные хирурги-ортопеды по этой части работают в Чехии, об этом значится в европейских научно-медицинских источниках. Да и, как показывают отзывы, артроскопия голеностопного сустава, коленного сочленения в Чехии, пациентов привлекает цена.

1. Masters J.P., Smith N.A., Foguet P. et al. A systematic review of the evidence for single stage and two stage revision of infected knee replacement. BMC Musculoskeletal Disorders // Jul 2013; 14:222 DOI: 10.1186/1471-2474-14-222.
2. Mittag F., Leichtle C.I., Schlumberger M. et al. Clinical outcome after infected total knee and total hip arthroplasty // Acta Ortopedica Brasileira. Jan 2016; 24 (1):43-47 DOI: 10.1590/1413-785220162401150767.
4. Uçkay I. [et al.] Low incidence of haematogenous seeding to total hip and knee prostheses in patients with remote infections // J. Infect. 2009; 59 (5):337-345.
5. Клюшин Н.М., Абабков Ю.В., Ермаков А.М. Парапротезная инфекция как причина ревизионных вмешательств после тотального эндопротезирования коленного сустава: этиология, диагностика, лечение // ЭНИ Забайкальский медицинский вестник. – 2015. – № 2. – С. 189-197.
6. Корнилов Н.Н. Артропластика коленного сустава / Н.Н. Корнилов, Т.А. Куляба // СПб., 2012. – 228 с.
7. Хирургическое лечение хронического гнойного поражения тазобедренного и коленного суставов после тотального эндопротезирования / В.П. Волошин, А.В. Еремин, Г.А. Оноприенко, К.И. Савицкая // Эндопротезирование в России: Всерос. монотем. сб. науч. статей. – Казань; СПб.: АБАК, 2008. – Вып. IV. – C. 201-212.
9. Lichstein P., Su S., Hedlund H. et al. Treatment of periprosthetic knee infection with a two-stage protocol using static spacers // Clinical Orthopaedics and Related Research. Aug 2015; 474 (1):120-125 DOI: 10.1007/s11999-015-4443-2.
10. Lima A.L., Oliveira P.R., Carvalho V.C. et al. Periprosthetic joint infections // Interdisciplinary Perspectives on Infectious Diseases. Aug 2013; 2013:542796 DOI: 10.1155/2013/542796.
11. Cancienne J.M., Granadillo V.A., Patel K.J. et al. Risk Factors for Repeat Debridement, Spacer Retention, Amputation, Arthrodesis, and Mortality after Removal of an Infected Total Knee Arthroplasty with Spacer Placement // J. Arthroplasty 2017 Sep; S0883-5403(17)30760-X. doi: 10.1016/j.arth.2017.08.037.
12. Nodzo S.R., Boyle K.K., Spiro S. et al. Success rates, characteristics, and costs of articulating antibiotic spacers for total knee periprosthetic joint infection // Knee. 2017 Oct; 24 (5):1175-1181. doi: 10.1016/j.knee.2017.05.016. Epub 2017 Aug 8.
Увеличение средней продолжительности жизни, несомненно, положительная тенденция настоящего времени, но обратной стороной медали является не всегда высокое качество жизни, особенно в старшем возрасте. Одним из факторов, снижающих это качество, всё чаще становятся заболевания суставов. Боль и ограничение способности к движению при этих заболеваниях со временем значительно осложняют жизнь пациентам. Наиболее эффективным способом лечения в этих случаях считается хирургическое вмешательство. Для лечения пациентов с тяжелыми посттравматическими осложнениями и дегенеративными заболеваниями суставов оптимальным методом считается эндопротезирование. Однако, несмотря на то что после тотального эндопротезирования коленного сустава наблюдается значительное улучшение состояния пациента, существует риск осложнения в виде парапротезной инфекции, при котором увеличиваются сроки и стоимость лечения. Кроме того, инфекционное осложнение может привести к неблагоприятному исходу хирургического лечения. Согласно исследованиям, проведенным в ряде разных центров, после тотального эндопротезирования коленного сустава инфицирование происходило в 0,5-5% случаев 2.
I. Uçkay с соавт. выполнили ретроспективный анализ 6101 случая реэндопротезирования крупных суставов с 1996 по 2008 г. Из них 2099 случаев – после эндопротезирования коленного сустава. Всего было удалено 234 (11,15%) протеза коленного сустава, из них по поводу инфекции удалено 24 (1,14%) протеза. Полученные результаты позволили авторам сделать вывод, что парапротезная инфекция – редкое осложнение [4; 5].
Внедрение эндопротезирования в клиническую практику в России происходило постепенно, и первоначальные результаты не внушали оптимизма. По данным H.Н. Корнилова с соавт., частота инфекционных осложнений в некоторых лечебных учреждениях, где выполнялось лишь несколько эндопротезирований в год, достигала 17% [5; 6].
Волошин В.П. с соавт. проанализировали опыт лечения 66 пациентов с тотальным эндопротезированием крупных суставов. В 87,9% случаев (58 пациентов), в сроки от 1,5 до 3 лет после эндопротезирования, отмечалось развитие гнойной инфекции. Глубокое нагноение отмечено у 6 пациентов (9,1%). В итоге 10 пациентам было выполнено артродезирование коленного сустава аппаратом Илизарова [5; 7].
Т.А. Куляба с соавторами проанализировали результаты лечения 44 пациентов, у которых после первичного и ревизионного эндопротезирования коленного сустава развилось инфекционное воспаление. Происходило это в разные сроки, у 18 пациентов (40,1%) в раннем послеоперационном периоде, а у 26 (59,1%) в отдаленном, но так или иначе, купировать воспаление и сохранить эндопротез удалось только у 10 (22,7%) больных. В подавляющем большинстве случаев потребовалось провести двухэтапное хирургическое лечение, которое позволило купировать гнойный процесс в 89,3% случаев. Артродез был выполнен у 4 (9,1%) больных [5; 8].
Инфицирование может происходить через прямую или гематогенную передачу бактериальной флоры. Некоторыми примерами прямой передачи являются: несоблюдение условий стерильности в операционных, передача от инфицированного пациента, небрежность хирургов и обслуживающего персонала. Гематогенное инфицирование наблюдается после эпизода бактериемии. Например, стрептококковая инфекция может развиться после стоматологического вмешательства, стафилококковая – как следствие кожного инфекционного заболевания, энтерококковая и анаэробные инфекции – в результате желудочно-кишечных инфекционных заболеваний и инфекций мочеполовой системы [9].
Отек, боль и дисфункция коленного сустава возникают после эндопротезирования коленного сустава и усиливаются по мере прогрессирования инфекции. На фоне инфекции происходит перипротезный остеолиз, приводящий к нестабильности эндопротеза. У пациентов, не получающих своевременного лечения, может развиться сепсис и опасный для жизни септический шок [10].
На основе метаанализа, проведенного Cancienne J.M. с соавт., описаны исходы лечения 18 533 пациентов с ранними инфекционными осложнениями (в течение 1 года) после тотального эндопротезирования коленного сустава [11]. Среди них:
- 691 пациент (3,7%) умер в стационаре;
- 574 пациентам (3,1%) потребовалась ампутация конечности;
- 852 пациента (4,5%) перенесли артродез коленного сустава;
- 2683 пациентам (14,5%) проведена вторичная хирургическая обработка, без реимплантации;
- 13743 (74,1%) пациента прошли через двухэтапное реэндопротезирование коленного сустава, из них 11420 пациентам (61,6%) в течение 1 года проведено удаление спейсера и реимплантация, а 2323 пациентам (12,5%) оставлен спейсер.
Nodzo S.R. и соавторы, при проведении двухэтапного реэндопротезирования, разделили пациентов на три группы в зависимости от типа используемого спейсера [12]. В первой группе использовались преформованные артикулирующие спейсеры, во второй – спейсеры из цемента изготавливались интраоперационно. В третьей группе – в качестве спейсера использовали автоклавированный бедренный компонент удаленного эндопротеза. Признаки санации инфекционного процесса отметили в первой группе пациентов в 82,7% случаях, во второй группе – в 88,4%. Наименьшее количество положительных результатов отмечено в третьей группе – 79,4%. Таким образом, использование цементных спейсеров, изготовленных интраоперационно с использованием антибиотика по чувствительности флоры, приносит максимально положительный результат.
Цель исследования: провести анализ частоты, структуры и причин возникновения инфекционных осложнений при тотальном эндопротезировании и реэндопротезировании коленного сустава и определить оптимальную тактику лечения при этих осложнениях.
Материал и методы. В Новосибирском НИИТО за период с 2007 по 2016 год было проведено 12 245 операций первичного эндопротезирования коленного сустава. Инфекционные осложнения возникли у 470 (3,84%) человек. При этом эпифасциальная (поверхностная) инфекция была зафиксирована у 252 (2,06%) пациентов. В эту группу включены пациенты с некрозом послеоперационного шва и подкожной клетчатки, лигатурными свищами. В случае распространения процесса в пределах 5-6 см по ходу операционного шва, пациентам проводилась одномоментная санация и ушивание кожного дефекта. В случаях распространения процесса на весь шов, пациентам проводились этапные санационные перевязки до очищения стенок раны с последующим вторичным швом раны. Как результат применения такой методики лечения, у всех пациентов отмечался положительный результат.
Группу пациентов с субфасциальной (глубокой) инфекцией, развившейся в разные сроки, составили 218 пациентов (1,8%), что соответствует мировым тенденциям. По нашим убеждениям, в случае глубокой парапротезной инфекции, на фоне сформированной биопленки, эндопротез сохранять бесполезно, и он подлежит удалению. Однако дальнейшая тактика зависит от патологической флоры и других факторов. После удаления выполняется либо одномоментная имплантация нового эндопротеза, либо проведение этапного лечения с целью санации и последующего реэндопротезирования. В случае невозможности выполнения последующего этапа реэндопротезирования, в рассматриваемых случаях выполнялся артродез коленного сустава.
Бактериальное исследование пациентов с глубокой парапротезной инфекцией дало следующие результаты:
· у 172 (78,9%) пациентов была выделена грамположительная кокковая флора: у 113 пациентов – MSSA, у 33 – MSSE, у 8 пациентов – MRSA, и у 18 пациентов – MRSE;
· грамотрицательные палочки (Klebsiella, Pseudomonas, E.coli) были выделены у 33 пациентов (15,1%);
· грамположительные палочки (Korinebacterium, Propionobacter) – у 2 пациентов (0,9%);
· у 11 пациентов (5,0%) была выявлена смешанная флора.
При выборе тактики хирургического лечения больных с глубокой парапротезной инфекцией анализировались сроки возникновения инфекции, степень стабильности компонентов эндопротеза и степень вирулентности возбудителя. Также немаловажную роль в выборе тактики оперативного лечения играли сопутствующая патология и желания самого пациента.
Одномоментное реэндопротезирование после удаления эндопротеза выполнялось пациентам без выраженной сопутствующей патологии, в раннем послеоперационном периоде (до 6 мес.), при отсутствии признаков нестабильности эндопротеза и в случае чувствительности флоры к возможному проведению антибиотикотерапии. В ходе данного вида оперативного лечения выполняли удаление эндопротеза, патологических грануляций мягких тканей и имплантировали новый эндопротез с добавлением в цемент антибактериальных препаратов, подобранных по чувствительности к флоре. В последующем проводили адресную антибиотикотерапию в течение 6 недель.
Этим способом были пролечены 28 пациентов. В 26 случаях инфекция была купирована. У двух пациентов наблюдался рецидив, потребовавший проведения двухэтапного ревизионного вмешательства. Таким образом, выживаемость имплантата составила 93%.
Клинический пример 1. Больная К., 62 года. Выполнено первичное эндопротезирование КС по поводу левостороннего гонартроза III ст.
Через 3 месяца после проведения оперативного лечения развилось осложнение в виде глубокой парапротезной инфекции. По результатам бактериологического исследования выявлен патогенный микроорганизм – MSSA. Больной выполнено удаление эндопротеза и одномоментное реэндопротезирование коленного сустава.
На контрольных осмотрах через 1 год, 3 и 5 лет признаков рецидива инфекции не было.
В зависимости от степени сохранности связочного аппарата устанавливался артикулирующий либо неартикулирующий спейсер с добавлением антибиотика по чувствительности бактериальной флоры. После первого этапа пациенты получали антибиотикотерапию в течение 6-8 недель. Второй этап лечения – удаление цементного спейсера и реэндопротезирование коленного сустава, проводился по истечении 3-8 месяцев при условии нормализации клинических анализов и отсутствии положительных бактериологических исследований пунктата синовиальной жидкости.
Клинический пример 2. Больная Г., 62 года. Первичное эндопротезирование коленного сустава было проведено по поводу гонартроза III ст. Через 3 года после проведенной операции перенесла рожистое воспаление голени, осложнившееся глубокой парапротезной инфекцией. По результатам бактериологического исследования был выявлен патогенный микроорганизм – MRSA. Больной было выполнено удаление эндопротеза, санация и имплантация цементного артикулирующего спейсера (рис. 1).

Рис. 1. Клинический пример 2. Рентгенограмма коленного сустава после
имплантации артикулирующего спейсера коленного сустава
Антибиотикотерапия поводилась в течение 6 недель. Через 6 месяцев, когда признаки инфекции были полностью купированы, больной выполнен второй этап оперативного лечения – удаление цементного спейсера и реэндопротезирование коленного сустава (рис. 2). На контрольных осмотрах через 1 и 3 года признаков рецидива инфекции не обнаружено.

Рис. 2. Клинический пример 2. Рентгенограмма коленного сустава
после удаления спейсера и реэндопротезирования коленного сустава
За период наблюдения двухэтапное оперативное лечение было проведено 146 пациентам. У 124 пациентов признаки инфекции были купированы. Процедив отмечен у 22 пациентов. С целью купирования инфекционного процесса этим больным выполнялся артродез коленного сустава в аппарате внешней фиксации.
Первично артродез коленного сустава выполнялся пациентам с вирулентной флорой, на поддающейся антибиотикотерапии, с выраженной сопутствующей патологией, позволяющей оперировать пациента только по жизненным показаниям, и в случае желания пациента.
Клинический пример 3. Больная Л., 52 года. Первичное эндопротезирование коленного сустава было проведено по поводу вторичного артрозо-артрита коленного сустава III ст. на фоне ревматоидного полиартрита.
Через 6 месяцев после проведенного оперативного вмешательства у больной развилась глубокая парапротезная инфекция. Учитывая высокую активность основного заболевания, пациентка предпочла отказаться от дальнейших оперативных вмешательств, в связи с чем было выполнено удаление и артродез коленного сустава в аппарате внешней фиксации (рис. 3).

Рис. 3. Рентгенограмма коленного сустава после удаления эндопротеза и артродеза коленного сустава в аппарате внешней фиксации
По различным причинам артродез коленного сустава выполнялся в 66 случаях. В 54 случаях у пациентов сформировался костный анкилоз, и только в 12 случаях отмечалось формирование фиброзного анкилоза или неоартроза. Рецидива инфекции при выполнении артродеза коленного сустава зафиксировано не было.
Результаты. Таким образом, за 10 лет через отделение эндопротезирования коленного сустава Новосибирского НИИТО прошли 470 пациентов с парапротезной инфекцией. Эти пациенты получили следующее лечение:
- 252 (53,6%) пациентам с поверхностной инфекцией проведена вторичная хирургическая обработка, реимплантация эндопротеза не требовалась;
- 26 (5,5%) пациентам проведено одномоментное реэндопротезирование коленного сустава;
- 126 (26,8%) пациентов перенесли двухэтапное оперативное лечение;
- 66 (14,0%) пациентам по различным причинам выполнен артродез коленного сустава.
Ампутаций конечности и летальных исходов, вызванных инфекционным процессом, в отделении не отмечено.
Инфекция костей и суставов с наличием имплантатов - грозное осложнение. При неадекватном лечении, воспалительный процесс может привести к нарушению функции суставов, снижению качества жизни пациента, деструкции костей и даже летальному исходу. С целью воздействия на микрофлору в очаге инфекции применяется хирургическая санация воспаления, удаление имплантов, тщательный дебриджемент и замещение костных полостей, дренирование раны. В последующем проводится длительная антибиотикосупрессия. Несмотря на проводимое лечение, рецидив инфекции остается высоким. Для купирования воспаления применяются местные способы доставки антибиотика. При лечении перипротезной инфекции крупных суставов применяется двухэтапный метод с установкой временного цементного спейсера с антибиотиком для замещения остаточной полости после удаления компонентов эндопротеза для последующего ревизионного эндопротезирования.

3. Захарова Н.М., Шатохина И.С., Волошин В.П., Еремин А.В., Зубиков В.С. Ошкуков С.А., Цыбин А.А. Особенности местной воспалительной реакции в области хирургического вмешательства при эндопротезировании крупных суставов // Альманах клинической медицины. - 2012. - №27. - С. 14-18.
6. Чеканов А.С., Волошин В.П., Лекишвили М.В., Очкуренко А.А., Мартыненко Д.В. Реконструкция тазобедренного сустава деминерализованными аллоимплантатами при ревизионном эндопротезировании // Вестник травматологии и ортопедии им. Н.Н. Приорова. - 2015. - №1. - С.43-46.
8. El-Husseini, M., Patel, S., MacFarlane, R.J., Haddad, F.S. / Biodegradable antibiotic delivery systems // J Bone Joint Surgery. – 2011. 93 (Part 2). - Р.151-7.
9. Gitelis S., Brebach G.T. / The treatment of chronic osteomyelitis with a biodegradable antibiotic-impregnated implant. // J OrthopaedSurg (Hong-Kong). – 2002. 10 – Р. 53-60.
10. Hou, T., Xu, J., Li, Q., Feng, J., Zen, L. / In vitro evaluation of a fibrin gel antibiotic delivery system containing mesenchymal stem cells and vancomycin alginate beads for treating bone infections and facilitating bone formation. // Tissue Engineer. – 2008. 14 (Part 1). - Р.1173-1182.
Лечение инфекции костей и суставов является одной из сложных проблем в травматологии и ортопедии. Имплант-ассоциированная инфекция костей и суставов приводит к неэффективности антибактериальной терапии в связи с наличием биопленок [8]. С целью купирования воспаления проводятся неоднократные хирургические вмешательства с использованием материалов, способных доставлять и создавать локальную концентрацию антибиотика непосредственно в очаге инфекции [9].
В современной клинической медицине достигнуты значительные успехи в лечении периимплантной костной и суставной инфекции с применением различных материалов [4,6,7].
Остается много вопросов, которые необходимо решить при лечении данной патологии: как доставить антибиотик к месту назначения в необходимой концентрации для купирования воспаления; какой группы антибиотик использовать; какова его фармакокинетика; есть ли возможность использовать антибиотик совместно со средствами, усиливающими остеообразование и/или ослабляющими остеолиз; как удалить местную форму препарата из тканей, если это будет необходимо [5].
Все системы транспорта антибиотика к очагу инфекции можно разделить на нерассасывающиеся и рассасывающиеся (биодеградируемые)[10].
Цель исследования: улучшение результатов хирургического лечения периимплантной инфекции костей и суставов.
Материалы и методы исследования: в ОТО МОНИКИ с 2004 г. – по сентябрь 2015 г., при сочетании инфицирования с дестабилизацией компонентов эндопротеза у пациентов с перипротезным воспалением тазобедренного сустава в 34 случаях и с глубоким перипротезным нагноением коленного сустава в 8 случаях использован нерассасывающийся метод. Применяются временные спейсеры, импрегнированные антибиотиками с целью заполнения остаточной полости, воздействия на микрофлору очага воспаления и создание благоприятных условий для выполнения повторного тотального эндопротезирования на фоне стойкого купирования воспалительного процесса. Мужчин среди них – 24, женщин – 18, в возрасте от 31 до 75 лет.
При лечении имплант-ассоциированной костной инфекции с наличием костной деструкции в ОТО МОНИКИ с января 2015 г. – по сентябрь 2015 г. применен рассасывающий метод с использованием аутотрансплантата без фиксации и с фиксацией его биодеградируемым винтом с антибиотиком у 7-и пациентов, в возрасте от 36 до 60 лет. Мужчин – 6, женщин – 1.
Результаты и обсуждение:
Критерии для проведения двухэтапного эндопротезирования:
- Наличие местных проявлений перипротезного инфицирования;
- Стабильные компоненты эндопротеза при наличии положительной полирезистентной микрофлоры;
- Хроническое продуктивное воспаление с преобладанием сегментоядерных нейтрофилов [3].
- Гистопатологическое исследование: отсутствие при цитологическом исследовании остеокластов, наличие более 5 нейтрофилов в поле зрения при гистологическом исследовании свежезамороженных параартикулярных тканях;
- Неэффективность проведенных ранее хирургических санаций;
- Возможность проведения супрессивной антибиотикотерапии;
- Согласие больного на проведение двухэтапного метода лечения;
- Отсутствие тяжелых соматических заболеваний;
- Отсутствие критической потери костной ткани;
Первым этапом осуществляется хирургическая санация с широкой ревизией возможных путей распространения инфекции и удалением вертлужного, бедренного компонентов эндопротеза и фиксирующих материалов.
После завершения санации проводится интраоперационное формирование цементного спейсера в соответствии с формой и размерами вертлужной впадины с последующим укреплением его к проксимальному отделу бедренной кости (рис. 1)
а)б)в)
Рис. 1. Рентгенограмма таза больной К-ой, 1951 г.р., и/б 21813/18278
Нестабильность вертлужного компонента эндопротеза справа с комбинированным дефектом тазовой кости и повреждением бедренного компонента. а) – при поступлении в клинику; б) – удаленные компоненты эндопротеза с повреждением бедренного компонента; в) – рентгенограмма после первого этапа хирургического лечения – удаление компонентов эндопротеза справа, установка цементного спейсера, остеосинтез бедренной кости.
Фиксированный к бедренной кости цементный спейсер погружается в вертлужную впадину, заполняя пространство для последующего установления вертлужного компонента ревизионного эндопротеза (2-й этап).
Для изготовления цементного спейсера используется рентгеноконтрастный цементоподобный материал, обеспечивающий установку и крепление протезов к костям. Варианты антибиотиков, которые добавляют в спейсер: аминогликозиды (тобрамицин, гентамицин); Цефалоспорины 1-ого поколения (цефазолин), 2-ого поколения (цефуроксим), 3-его поколения (цефтазидим), 4-ого поколения (цефотаксим), 5-ого поколения (цефтаролин); фторхинолоны (ципрофлоксацин); гликопептиды (ванкомицин); оксазолидиноны (линезолид); противогрипковые (вориконазол).
Для формирования цементного спейсера достаточно полутора – двух доз, хотя требуемое количество зависит от характера хирургического вмешательства и применяемого метода. После окончания полимеризации приготовленный спейсер фиксируется к проксимальному отделу бедренной кости с помощью дополнительной дозы цемента. Перед установкой спейсера следует обеспечить тщательную санацию и высушивание проксимальной части костномозгового канала бедренной кости непосредственно перед погружением временного имплантата.
В случаях, когда нестабильность обоих компонентов эндопротеза сочетается с глубокой перипротезной инфекцией возможно применение преформированных (фабричных) спейсеров.
После тщательной хирургической санации очага воспаления выполняется удаление обоих компонентов эндопротеза тазобедренного сустава и фиксирующего материала. В канал бедренной кости устанавливается артикулирующий преформированный спейсер, импрегнированный антибиотиками (гентамицин, ванкомицин), а затем вправляются в вертлужную впадину, рана дренируется в течение двух дней (рис. 2).
а)б)в)
г)д) е)
Рис. 2. Рентгенограмма правого тазобедренного сустава больного Г-на, 1963 г.р., и/б 16697/8454
Глубокое перипротезное инфицирование правого тазобедренного сустава. Комбинированный дефект правой вертлужной впадины и проксимального отдела бедренной кости. а) – при поступлении в клинику фистулограмма правого тазобедренного сустава; б) – внешний вид мягких тканей после удаления компонентов эндопротеза; в) – первый этап – санирующая операция на правом тазобедренном суставе с установкой спейсера в канал бедренной кости; г) – вправление спейсера; д) – рентгенограмма правого тазобедренного сустава после установки спейсера; е) – рентгенограмма правого тазобедренного сустава после второго этапа – удаление спейсера, повторное тотальное эндопротезирование правого тазобедренного сустава с установкой ревизионной конструкции и костной аутопластикой дефекта бедренной кости.
Среди 34 пациентов с перипротезным инфицированием тазобедренного сустава рецидив воспаления отмечен у 2 пациентов, что составило – 5,8%, которым выполнено удаление спейсера, формированием опорного неоартроза тазобедренного сустава. Три пациента отказываются от реэндопротезирования, что составляет – 8,8%. Купирование воспаления достигнуто в 94,2% случаев.
Среди 8 пациентов с глубоким нагноением эндопротеза коленного сустава рецидивов воспаления не отмечено. Двум пациентам планируется выполнить повторное эндопротезирование коленного сустава.
Необходимость проводить повторную операцию по замене спейсера на ревизионный эндопротез остается главным недостатком нерассасывающихся материалов [1].
С целью профилактики рецидивов перипротезного инфицирования суставов применен рассасывающийся биополимерный биодеградируемый материал на основе коллагеновой губки, содержащий антибиотик гентамицин. При имплантации 1 губки в полостях и тканях создается высокая локальная концентрация (666,66 мг/мл) гентамицина. Перед применением коллагеновой губки с гентамицином необходимо максимально просушить область аппликации.
а) б)
Рис. 3. а) – биополимерный биодеградируемый материал на основе коллагеной губки с гентамицином (collatampEG); б) – коллагеновая губка с гентамицином покрывает металлические участки эндопротеза тазобедренного сустава
Преимущества биополимерного биодеградируемого материала на основе коллагеновой губки с антибиотиком: создает высокую концентрацию антибиотика в областях с низкой перфузией крови в тканях; профилактики ранних и поздних инфекционных осложнений у пациентов из группы риска благодаря высокой концентрации антибиотика; обладает местным гемостатическим действием; является биодеградируемым материалом (не требует дальнейших манипуляций по удалению).
Критерии для лечения имплант-ассоциированной инфекции рассасывающимся методом с использованием аутотрансплантата без фиксации и с фиксацией его биодеградируемым винтом с антибиотиком.
- Наличие местных проявлений перииплантной костной и суставной инфекции;
- Возможность использовать аутотрансплантат для замещения костных дефектов;
- Отсутствие аллергической реакции на компоненты биодеградируемого винта;
- Чувствительность микрофлоры к антибиотику[2].
У 4-х пациентов с наличием дестрекции костей и суставов проводилась тщательная хирургическая санация очага воспаления, секвестрэктомия, замещение костного дефекта аутотрансплантатом из гребня подвздошной кости, дренирование послеоперационной раны (рис.4)
а) б)в)
г)
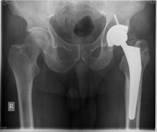
Рис. 4. Пациент К-н, 1957 г.р., и/б 14426
Глубокое перипротезное инфицирование левого тазобедренного сустава с наличием дефекта большого вертела, без дестабилизации комопнентовэндопротеза. а) – рентгенограмма левого тазобедренного сустава при поступлении в клинику; б) – внешний вид костного дефекта большого вертела после хирургической санации; в) – замещение костного дефекта трансплантатом из гребня подвздошной кости; г) – рентгенограмма левого тазобедренного сустава после оперативного лечения.
У одного пациента через четыре месяца после операции замещения костного дефекта большеберцовой кости по данным рентгенограмм отмечено рассасывания аутотрансплантата. У одного пациента после костной пластики костей стопы рецидив воспаления с формированием свищевого хода.
Трем пациентам с длительным вялотекущим процессом с наличием костной деструкции костей и суставов проведена хирургическая санация с замещением костного дефекта аутотрансплантатом и фиксация его биодеградируемым винтом с антибиотиком.
а)б)в) г)
Рис. 5. Пациент Г., и/б 2485. Хронический остеомиелит большеберцовой кости справа с наличием секвестра, состояние после удаления погружного металлофиксатора большеберцовой кости, свищевая форма. а) – рентгенограмма правой голени с наличием очага деструкции большеберцовой кости, размером 9х2 см, б) – аутотрансплантат из гребня подвздошной кости, в) – фиксация аутотрансплантата винтами с антибиотиком,
г) – рентгенограмма правой голени после оперативного лечения
Послеоперационное ведение проводилось в соответствии со стандартным ведением пациентов с высоким риском инфекции.
У одного пациента в послеоперационном периоде отмечено длительное заживление послеоперационной раны. На контрольных рентгенограммах – рассасывания трансплантата ни в одном случае не произошло. Рецидива воспаления не отмечено ни в одном случае.
Заключение: использование спейсера с антибиотиком является золотым стандартом при лечении перипротезной инфекции крупных суставов и позволяет добиться стойкого купирования воспалительного процесса в 95,3% случаях. С целью профилактики перипротезного инфицирования у пациентов с высоким риском послеоперационного нагноения рекомендовано использовать биополимерный биодеградируемый материал на основе коллагеновой губки, содержащий антибиотик гентамицин.
При лечении имплант-ассоциированной костной инфекции с наличием костной деструкции использование биодеградируемого винта с антибиотиком позволяет воздействовать на микрофлору непосредственной в очаге инфекции, фиксация аутотрансплантата способствует его остеоинтеграции, повторной операции для удаления винта не требуется.
Рецензенты:
Оноприенко Г.А., д.м.н., профессор, ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, г. Москва;
Дорожко И.Г., д.м.н., профессор, ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, г. Москва.
Читайте также:

