Инфекция тазобедренного сустава у детей
Обновлено: 13.05.2024
Одной из актуальных проблем современной педиатрии является диагностика и лечение воспалительных заболеваний суставов. Наиболее распространен среди ревматических заболеваний детского возраста реактивный артрит (РеА), который встречается
Одной из актуальных проблем современной педиатрии является диагностика и лечение воспалительных заболеваний суставов. Наиболее распространен среди ревматических заболеваний детского возраста реактивный артрит (РеА), который встречается у 86,9 на 100 000 детского населения [1].
В настоящее время к РеА относят воспалительные негнойные заболевания суставов, развивающиеся вследствие иммунных нарушений, после кишечной или урогенитальной инфекции. В преобладающем большинстве случаев РеА ассоциируется с острой или персистирующей кишечной инфекцией, вызываемой энтеробактериями (Yersinia enterocolitica, Yersinia pseudotuberculosis, Salmonella enteritidis, Salmonella typhimurium, Shigella flexneri, Shigella sonnei, Shigella Newcastle, Campylobacter jejuni), и с острой или персистирующей урогенитальной инфекцией, вызываемой Chlamydia trachomatis. Инфекции респираторного тракта, связанные с Mycoplasma pneumoniae, и особенно Chlamydophila pneumonia, также могут служить причинами развития РеА. Имеются также данные о связи РеА с кишечной инфекцией, вызванной Clostridium difficile и некоторыми паразитарными инфекциями.
РеА, ассоциированный с кишечной инфекцией и инфекцией, вызванной Chlamydia trachomatis, развивается преимущественно у генетически предрасположенных лиц (носителей HLA-B27) и относится к группе серонегативных спондилоартритов [2, 3, 6]. Было обнаружено, что антитела к ряду микроорганизмов перекрестно реагируют с HLA-B27. Это объясняется феноменом молекулярной мимикрии, согласно которой белки клеточной стенки ряда кишечных бактерий и хламидий имеют структурное сходство с отдельными участками молекулы HLA-B27. Предполагается, что перекрестно реагирующие антитела способны оказывать повреждающее действие на собственные клетки организма, которые в наибольшей степени экспрессируют молекулы HLA-B27. Но при этом считают, что такое перекрестное реагирование может препятствовать осуществлению адекватного иммунного ответа, способствуя персистированию и хронизации инфекции. Имеются данные, что у носителей НLA-B27 после перенесенной кишечной и урогенитальной инфекции РеА развивается в 50 раз чаще, чем у лиц, не имеющих этого антигена гистосовместимости.
Диагноз РеА ставится в соответствии со следующими диагностическими критериями, принятыми на III Международном совещании по РеА в Берлине в 1996 г. [7].
– Олигоартрит (поражение до 4 суставов).
– Преимущественное поражение суставов ног.
– Время возникновения: за 2–4 нед до развития артрита.
– Необязательно, но желательно при наличии клинических проявлений инфекции.
– Обязательно, при отсутствии явных клинических проявлений инфекции.
Вместе с тем в реальной практике термин РеА ошибочно используется ревматологами гораздо шире и включает артриты после перенесенной вирусной инфекции, поствакцинальные артриты, постстрептококковый артрит и некоторые другие.
В настоящее время одной из наиболее распространенных причин развития РеА является хламидийная инфекция.
В структуре РеА хламидийные артриты составляют до 80% [8, 9, 10]. Это связано с пандемией хламидиоза в мире, особенностями путей передачи хламидийной инфекции, цикла развития хламидий и реакции на терапию. Восприимчивость к хламидиям всеобщая, существует множество путей передачи инфекции в том числе и контактно-бытовой путь (в отношении Chlamydia pneumonia). Триггерная роль кишечной инфекции в развитии РеА также остается актуальной.
Классическим проявлением РеА является болезнь Рейтера или уретро-окуло-синовиальный синдром, впервые описанный Бенджамином Броди, а затем Гансом Рейтером, под именем которого синдром и вошел в медицину. Болезнь Рейтера в настоящее время рассматривается как особая форма РеА и характеризуется классической триадой клинических симптомов: уретрит, конъюнктивит, артрит. При наличии кератодермии говорят о тетраде болезни Рейтера. Синдром Рейтера чаще всего начинается с симптомов поражения урогенитального тракта через 2–4 нед после перенесенной инфекции или предполагаемого заражения хламидиями или бактериями кишечной группы. При синдроме Рейтера триггерными инфекционными факторами чаще всего являются Chlamydia trachomatis, Shigella flexneri 2а, либо их сочетание.
Клиническая картина
Болезнь Рейтера, ассоциированная с хламидийной инфекцией, характеризуется менее выраженной остротой клинической картины [8, 10]. Поражение урогенитального тракта характеризуется стертостью клинической картины. У мальчиков могут развиваться баланит, инфицированные синехии, фимоз. У девочек поражение урогенитального тракта может ограничиваться вульвитом, вульвовагинитом, лейкоцитурией и/или микрогематурией, а также клиникой цистита. Поражение урогенитального тракта может на несколько месяцев опережать развитие суставного синдрома.
Поражение глаз характеризуется развитием конъюнктивита: чаще катарального, невыраженного, непродолжительного, но склонного к рецидивированию. У 1/3 больных может развиться острый иридоциклит, угрожающий слепотой. Поражение глаз также может на несколько месяцев или лет опережать развитие суставного синдрома.
Экссудативный артрит (моно- или олигоартрит) при болезни Рейтера хламидийной этиологии может протекать без боли, скованности, выраженного нарушения функции, но с большим количеством синовиальной жидкости и непрерывно рецидивируя. Поражение суставов при этом характеризуется длительным отсутствием деструктивных изменений, несмотря на рецидивирующий синовит.
Нередко РеА протекает без отчетливых внесуставных проявлений, относящихся к симптомокомплексу синдрома Рейтера (конъюнктивит, уретрит, кератодермия). В таких случаях ведущим является суставной синдром, который также характеризуется преимущественным поражением суставов нижних конечностей, асимметричного характера. Несмотря на отсутствие внесуставных проявлений у этих детей также имеется высокий риск развития ювенильного спондилоартрита. Наличие характерного суставного синдрома, сопровождающегося выраженной экссудацией и связанного с перенесенной кишечной или урогенитальной инфекцией или с наличием серологических маркеров кишечной или урогенитальной инфекции, позволяет с большой долей вероятности отнести заболевание к разряду реактивных артритов.
Диагностика РеА
Диагностика РеА основывается на клинико-анамнестических данных, включающих наличие характерного суставного синдрома, связанного с инфекционным процессом. В связи с тем, что инфекция, предшествующая развитию РеА, не всегда бывает ярко выражена, в процессе диагностики особую значимость приобретают данные дополнительных лабораторных исследований. Для постановки точного диагноза необходимо выделение возбудителя, вызвавшего инфекцию, и/или обнаружение в сыворотке крови высоких титров антител к нему. Для идентификации триггерных инфекций используют различные микробиологические, иммунологические и молекулярно-биологические методы. Этиологическая диагностика включает следующее.
1.1. Выявление антигена хламидий в эпителиальных клетках, полученных в результате соскобов из уретры и конъюнктивы, а также в синовиальной жидкости (прямой иммунофлюоресцентный анализ и др.).
1.2. Выявление антител к антигенам хламидий в сыворотке крови и в синовиальной жидкости (реакция связывания комплемента, прямая и непрямая иммунофлюоресценция):
- острая фаза хламидиоза или обострение хронического процесса — наличие иммуноглобулин (Ig) M в течение первых 5 дней, IgA — в течение 10 дней, IgG — через 2–3 нед;
- реинфекция или реактивация первичной хламидийной инфекции — повышение уровня IgG, определяются IgA, могут быть единичные IgM;
- хроническое течение хламидиоза — наличие постоянных титров IgG и IgA;
- бессимптомное течение хламидиоза, персистенция возбудителя — низкие титры IgA;
- перенесенная хламидийная инфекция — низкий титр IgG.
1.3. Выявление антител к бактериям кишечной группы в сыворотке крови (при помощи реакции прямой гемагглютинации и реакции связывания комплемента).
Наиболее доказательным является выделение триггерных микроорганизмов классическими микробиологическими методами (посевы кала, перенос соскоба с эпителия уретры и/или конъюнктивы на культуру клеток). Чаще удается выделить хламидии из урогенитального тракта, значительно реже — энтеробактерии из кала.
Трудности диагностики РеА часто обусловлены стертым субклиническим течением первичного инфекционного процесса. Артрит развивается чаще при нетяжелых формах кишечной или урогенитальной инфекций, и к моменту развития артрита признаки триггерной инфекции в большинстве случаев проходят. Кроме того, в условиях нарушенного иммунного ответа возможно развитие хронических персистирующих форм инфекции. Поэтому в дебюте суставного синдрома необходимо в первую очередь исключить скрытую кишечную и хламидийную инфекции. Кроме того, диагностику РеА затрудняет сочетание предшествовавших инфекционных процессов различной локализации. Установлено также, что поражение кишечника и мочевыводящих путей может быть как первичным по отношению к РеА, так и развиваться одновременно с ним и даже позже, что нередко затрудняет определение причинно-следственных связей.
Дифференциальный диагноз РеА от других видов ювенильных артритов часто бывает затруднен. Наиболее распространенной патологией, требующей дифференциальной диагностики с РеА, являются инфекционные артриты, заболевания, связанные с инфекцией, сопровождающиеся артритами, а также ортопедическая патология и разные формы ювенильного идиопатического артрита.
Вирусный артрит. В настоящее время известно, что около 30 вирусов могут вызывать развитие острого артрита. К ним относятся: вирусы краснухи, парвовирус, аденовирус, вирус гепатита В, вирусы герпеса различных типов, вирус паротита, энтеровирусы, Коксаки-вирусы и др. Диагностика основана на связи с вирусной инфекцией или проведенной вакцинацией. Клиническая картина чаще представлена артралгиями, чем артритами. Клинические симптомы наблюдаются в течение 1–2 нед и исчезают без остаточных явлений.
Диагностические критерии постстрептококкового артрита включают:
- появление артрита на фоне или спустя 1–2 нед после перенесенной носоглоточной инфекции (стрептококковой этиологии);
- одновременное вовлечение в процесс преимущественно средних и крупных суставов;
- возможную торпидность суставного синдрома к действию нестероидных противовоспалительных препаратов (НПВП), нерезкие сдвиги в лабораторных показателях;
- наличие повышенных титров постстрептококковых антител;
- выявление хронических очагов инфекции в носоглотке (хронический тонзиллит, фарингит, гайморит).
Клещевой боррелиоз (болезнь Лайма). Диагностика боррелиоза основана на данных анамнеза: пребывание пациента в эндемичной зоне, наличие в анамнезе факта укуса клеща, а также характерную клиническую картину. Подтверждают диагноз серологическими методами, которые выявляют антитела к Borrelia burgdorferi.
Диагноз септического артрита ставится на основании клинической картины инфекционного процесса, определения характера синовиальной жидкости, результатов посева синовиальной жидкости на флору с определением чувствительности к антибиотикам, а также рентгенологических данных (в случае развития остеомиелита).
Клиническая картина туберкулезного артрита представлена общими симптомами туберкулезной инфекции: интоксикацией, субфебрильной температурой, вегетативными нарушениями и локальными симптомами — боли в суставах, преимущественно в ночное время, явления артрита. Для подтверждения диагноза необходимы рентгенологические данные, анализ синовиальной жидкости, биопсия синовиальной оболочки.
Ювенильный спондилоартрит. Данное заболевание является возможным исходом хронического течения РеА у предрасположенных лиц (HLA-B27 носителей). Суставной синдром так же, как и при РеА, представлен асимметричным моно- или олигоартритом с преимущественным поражением суставов ног. Кардинальными признаками, позволяющими поставить диагноз ювенильного спондилоартрита, являются рентгенологические данные, свидетельствующие о наличии сакроилеита (одно- или двустороннего).
Лечение
Выделяют три вида терапии: этиотропную, патогенетическую, симптоматическую.
Этиотропное лечение РеА, ассоциированного с хламидийной инфекцией. Поскольку хламидии являются внутриклеточными паразитами, то выбор антибактериальных препаратов ограничивается только теми, которые способны накапливаться внутриклеточно. К таким препаратам относятся макролиды, тетрациклины и фторхинолоны. Однако тетрациклины и фторхинолоны достаточно токсичны, их применение ограничено в детской практике. В связи с этим для лечения хламидийного артрита у детей используются макролиды. Азитромицин — для детей в первый день приема доза препарата составляет 10 мг/кг, а в последующие 5–7 дней — 5 мг/кг в один прием. Лучший эффект достигается при использовании антибиотика в течение 7–10 дней. Рокситромицин — для детей суточная доза составляет 5–8 мг/кг массы тела. Джозамицин (вильпрафен) суточная доза препарата составляет 30–50 мг/кг массы тела, разделенные на три приема. Кларитромицин используется у детей старше 6 мес — 15 мг/кг/сут в 2 приема, спирамицин — детям массой более 20 кг из расчета 1,5 млн МЕ/10 кг массы тела в сутки. Кратность приема — 2–3 раза.
У подростков возможно применение тетрациклинов и фторхинолоновых препаратов.
В отношении РеА, связанных с кишечной инфекцией, однозначных рекомендаций по антибактериальной терапии не существует. Наличие антител к бактериям кишечной группы и особенно бактериологическое подтверждение кишечной инфекции является основанием для назначения антибиотиков. Используются аминогликозиды — амикацин в/м или в/в — до 15 мг/кг/сут в одно-два введения, 7 сут, гентамицин в/м или в/в 5–7 мг/кг/сут в два введения, 7 сут, фторхинолоновые препараты (для детей старше 12 лет).
Патогенетическая терапия. Монотерапия антибиотиками оказывает недостаточный эффект при затяжном и хроническом течении РеА, неадекватности иммунного ответа. Целесообразно для лечения хронического хламидийного артрита использовать различные иммуномодулирующие средства (тактивин, ликопид, полиоксидоний) в сочетании с антибиотиками.
Наиболее эффективной, по результатам многолетних контролируемых исследований, оказалась схема с использованием ликопида [8, 10, 13].
Схема комбинированной терапии ликопидом и антибиотиками у больных с хроническим течением РеА, ассоциированного с хламидийной инфекцией, следующая.
- Ликопид применяется в виде сублингвальных таблеток. Детям до 5 лет целесообразно назначать ликопид по 1 мг 3 раза в день, дети старше 5 лет — ликопид по 2 мг 3 раза в день. Курс лечения составляет 24 дня.
- На 7-й день приема ликопида назначается антибиотик. Возможно использование любого антибиотика, обладающего противохламидийной активностью. Так как необходимо перекрыть 2–3 жизненных цикла хламидий, курс лечения антибиотиком должен составлять не менее 7–10 дней.
- После завершения курса антибактериальной терапии дети продолжают получать ликопид до 24 дня.
Использование иммуномодуляторов противопоказано при трансформации РеА в спондилоартрит, высокой иммунологической активности.
Симптоматическая терапия. С целью лечения суставного синдрома при РеА применяют НПВП. Диклофенак внутрь 2–3 мг/кг/день в 2–3 приема или напроксен внутрь 15–20 мг/кг/день в 2 приема или ибупрофен внутрь 35–40 мг/кг в 2–4 приема или нимесулид внутрь 5 мг/кг в 2–3 приема или мелоксикам внутрь 0,3–0,5 мг/кг в 1 прием.
Глюкокортикостероиды как наиболее мощные противовоспалительные средства используются в период обострения суставного синдрома. Их применение ограничивается преимущественно внутрисуставным способом введения. При необходимости можно воспользоваться коротким курсом пульс-терапии метилпреднизолоном, который предполагает быстрое (в течение 30–60 мин) внутривенное введение больших доз метилпреднизолона (5–15 мг/кг в течение 3 дней).
При тяжелом и торпидном течении заболевания, появлении признаков спондилоартрита, высокой клинической и лабораторной, в том числе иммунологической, активности возможно применение иммуносупрессивных препаратов. Наиболее часто используется сульфасалазин (в дозе 30–40 мг/кг массы в сутки), реже метотрексат ( в дозе 10 мг/м 2 в неделю).
У большинства детей РеА заканчивается полным выздоровлением. У части больных эпизоды РеА рецидивируют и в дальнейшем появляются признаки спондилоартрита, особенно у HLA-B27 позитивных больных. Мерами профилактики являются своевременное выявление хламидийной инфекции у ребенка и членов его семьи, адекватная терапия урогенитальной инфекции.
Литература
Е. С. Жолобова, доктор медицинских наук, профессор
Е. Г. Чистякова, кандидат медицинских наук, доцент
Д. В. Дагбаева
ММА им. И. М. Сеченова, Москва
Болезнь Пертеса (полное название болезнь Легга–Кальве–Пертеса) является довольно частой патологией тазобедренного сустава у детей в возрасте от 3 до 15 лет и представляет собой асептический некроз головки бедренной кости и нарушение кровоснабжения хрящевой ткани сустава. Некроз асептический и не связан с инфекциями. Болезнь Пертеса встречается больше у мальчиков, но у девочек это заболевание протекает тяжелее. Как правило, идет поражение одного сустава, но в определенном проценте случаев бывает двухстороннее поражение суставов.
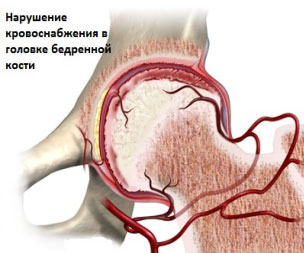
Причины возникновения этого заболевания до конца не выяснены, но определенные механизмы патогенеза стали понятны в последние годы.
В первую очередь, необходима определенная генетическая детерминированность (то есть наличие миелодисплазии). Миелодисплазия означает недоразвитие спинного мозга. Как правило миелодиспазия бывает умеренной и проявляется только – нарушением в развитии иннервации тазобедренного сустава, что и проявляется различными ортопедическими заболеваниями (в том числе и болезнью Пертеса). Недоразвитие иннервации сопровождается недоразвитием и сосудистой сети, отвечающей за кровоснабжение сустава и снижением тонуса сосудов. Но для развития асептического некроза необходимо полное прекращение кровотока к головке тазобедренной кости. Такие условия возникают при воспалении сустава или травмы сустава.
Воспалительный процесс в суставе может быть реактивного характера на перенесенные инфекции (ОРЗ, ЛОР заболевания). Как правило, симптоматика болезни Пертеса имеет связь с небольшими травмами или перенесенными вирусными заболеваниями, что и отмечается родителями пациентов. В результате сочетания генетической недоразвитости иннервации и кровоснабжения и при наличии провоцирующих факторов (травма или инфекции) происходит нарушение кровообращения головки бедра, что приводит к частичному или полному некрозу участка с нарушенным кровоснабжением. Вначале происходит некроз в в ядре окостенения головки бедренной кости, затем возможен компрессионный перелом в этой части бедренной кости и, потом рассасывание некротизированной ткани и замещением костной ткани соединительной тканью, которая в свою очередь через некоторое время кальцинируется. Все это приводит к укорочению шейки бедренной кости, нарушению структуры вертлужной впадины и, эти анатомические нарушения ведут к нарушению биомеханики движений в тазобедренном суставе.
Симптомы
Симптоматика при болезни Пертеса зависит от степени некротизации и величины очага некроза. При начальной стадии болезни Пертеса симптомы могут отсутствовать или быть незначительными. Дети могут жаловаться на умеренные болевые ощущения в области бедра тазобедренного сустава или коленного сустава.
Кроме того, может отмечаться нарушение походки (приволакивание ноги). Такое латентное лечение при начальной стадии болезни Пертеса (стадия остеонекроза) приводит к тому, что диагностировать и соответственно лечить это заболевание на ранней стадии удается редко. По мере развития некроза развивается деформация головки бедра, что приводит к изменению биомеханики сустава и появлению таких симптомов, как хромота, боли в ноге, в суставе. Последствиями импрессионных переломов в зоне некроза может быть укорочение конечности, что возможно будет обнаружено при визуальном осмотре.
Диагностика
Основным методом диагностики болезни Пертеса является рентгенография. Как правило, назначается рентгенография тазобедренного сустава в передне-задней проекции и в проекции Лауэнштейна. Кроме того, возможно для более четкой визуализации морфологических изменений назначение МРТ и УЗИ тазобедренных суставов. Лабораторные методы исследования необходимы в случае дифференциации с другими возможными заболеваниями тазобедренного сустава.
Лечение
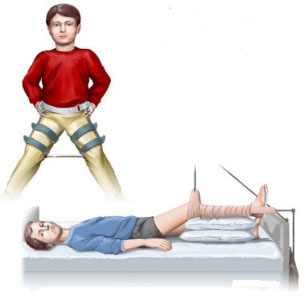
Лечение болезни Пертеса может быть консервативным и оперативным.
В основе консервативного лечения проводятся лечебные мероприятия направленные на обеспечение центрации головки бедра (то есть полного погружения головки бедра в вертлужную впадину). Сразу после постановки диагноза болезни Пертеса назначается постельный режим и полное исключение нагрузок на ногу (ходить можно только на костылях). Для поддержания центрации применяются специальные ортопедические изделия (шины Вилеского, Мирзоева, гипсовые повязки Ланге и другие). Постоянная центрация особенно необходима при большой зоне некроза. Кроме ортопедических приспособлений применяются также массаж, медикаментозное лечение, физиотерапия и лечебная гимнастика. Комплекс лечебных мероприятий проводится курсами по 2-4 недели с перерывами в 1 месяц. Лечебная же гимнастика должна проводиться ежедневно. Продолжительность консервативного лечения проводимого в условиях полной (или частичной разгрузки) больной ноги составляет в среднем от 1 до 4 лет. Длительность лечения зависит от возраста ребенка и степени патологических изменений на начало лечения. Дозированные нагрузки допускаются только на основании положительной динамики на рентгенографии (МРТ) сустава.
Но когда происходит значительная деформация бедренной кости и подвывих бедра,то нередко необходимо оперативная реконструкция сустава. Кроме того, преимуществом операционного лечения при больших некрозах является отсутствие необходимости в длительном ношение ортопедических изделий и сокращение сроков реабилитации.
Использование материалов допускается при указании активной гиперссылки на постоянную страницу статьи.
Описание заболевания
Болезнь Легга-Кальве-Пертеса – это асептический некроз головки бедренной кости. Если говорить простым языком, то это заболевание, при котором из-за частичного или полного временного отсутствия кровоснабжения головки бедренной кости происходит инфаркт её костной ткани с последующим формированием очага некроза (секвестра), размеры и локализация которого зависят от количества сосудов, по которым временно прекратился кровоток.
Важно! Болезнь Легга-Кальве-Пертеса преимущественно развивается в детском возрасте, в 4-12 лет. Мальчики более подвержены патологии, но у девочек она протекает тяжелее.
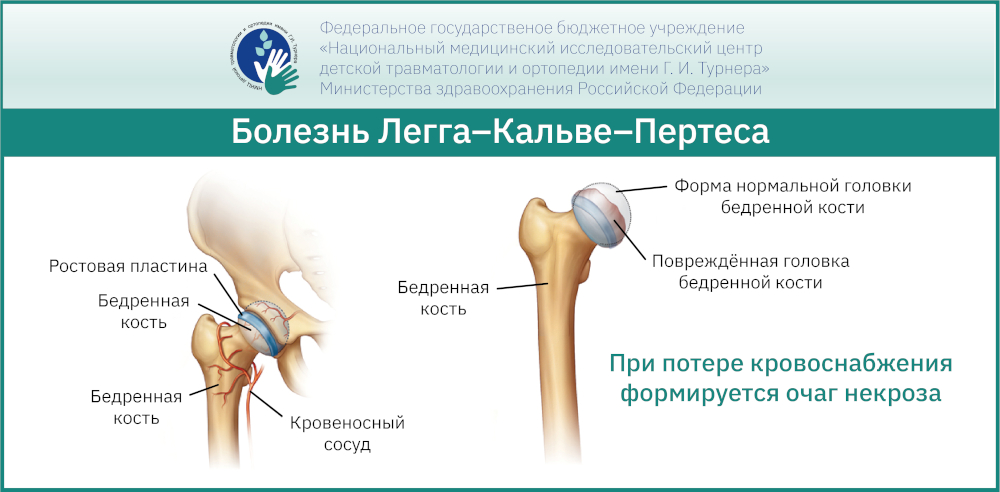
Причины возникновения
Несмотря на огромное количество исследований, направленных на изучение причин, вызывающих нарушение кровоснабжения в головке бедренной кости, до сих пор ни одна из представленных теорий не является решающей. Очевидно, что заболевание является мультифакторным и сопряжено со множеством предрасполагающих к его проявлению причин, протекающих одновременно.
Предрасполагающими факторами могут стать врождённые и приобретённые патологии:
- чрезмерные нагрузки (частые микротравмы);
- мутации генов, ответственных за синтез коллагена II типа, кодирующих фактор V Лейдена, повышение концентрации лептин-гормона, нарушение синтеза инсулиноподобного фактора роста, а также избыточная секреция IL6;
- недоразвитие поясничного отдела спинного мозга (миелодисплазия), из-за чего нарушается нервная регуляция тазобедренного сустава;
- гипоплазия и аплазия артериальных и венозных сосудов, спазм или стеноз эпифизарных сосудов;
- воспалительные процессы вследствие перенесенных инфекций (ангины, гриппа, ОРВИ);
- пассивное курение;
- неблагоприятная экологическая обстановка;
аномалии строения тазобедренного сустава.
По статистике мальчики с весом менее 2 кг. при рождении болеют болезнью Легга-Кальве-Пертеса в 5 раз чаще, нежели малыши с массой тела более 3,5 кг.
Клинические проявления
Признаки заболевания появляются не сразу, поэтому начало болезни, как правило, пропускается. На начальных стадиях ребёнок может вести активный образ жизни, изредка жалуясь на боль в области бедра или колена. Это первый звоночек для родителей, сигнализирующий о том, что нужно немедленно обращаться в больницу.
Примечание! Даже небольшая боль после физических нагрузок у ребёнка, которая самостоятельно проходит, является причиной, по которой требуется профильный осмотр ребёнка специалистом.
По мере прогрессирования появляются такие симптомы:
В 5% случаев болезнь затрагивает оба тазобедренных сустава.
Тяжёлым исходом нелеченной болезни Легга-Кальве-Пертеса становится коксартроз, который проявляется выраженными болевыми ощущениями, хромотой, порочным положением всей нижней конечности с резким ограничением привычного образа жизни и социальной дезадаптацией.
Стадии развития
Заболевание имеет 5 стадий:
- I. Это стадия остеонекроза, на которой ярко-выраженная симптоматика отсутствует, поэтому за лечением редко обращаются.
- II. Импрессионный перелом – ходьба, прыжки и другая двигательная активность приводит к формированию участка перелома костной ткани под хрящом.
- III. Фрагментация – происходит разделение деформированной головки бедра на секвестры. При тяжёлом поражении в эту стадию происходит укорочение и расширение шейки бедра, формируется coxa magna – увеличение размеров головки бедренной кости.
- IV. Восстановление. Место поражённых участков занимает новая костная ткань, однако прочность кости остаётся сниженной. Также возобновляется рост головки бедра.
- V. Исход. Полное восстановление структуры губчатого вещества. В случаях отсутствия адекватной терапии возможно формирование грубых многоплоскостных деформаций головки бедра.
Завершение течения заболевания может иметь несколько возможных исходов:
- Благоприятный – восстановление структуры и сферичности головки бедренной кости, конгруэнтность суставных поверхностей вертлужной впадины и головки бедра с нормальной или минимально изменённой функцией сустава и длиной нижней конечности.
- Неблагоприятный – формирование грубых многоплоскостных деформаций головки бедра, подвывиха бедра с выраженным нарушением функции тазобедренного сустава, болевым синдромом и как следствие этого – ранним артрозом тазобедренного сустава.
Исход течения заболевания зависит не только от размеров и локализации очага некроза, но и от характера проводимого лечения. Кроме того, если распознать заболевание на I стадии, то все изменения могут иметь обратимый характер. При правильном лечении можно предотвратить развитие деформаций и развитие коксартроза.
Диагностика
Чтобы поставить верный диагноз, потребуется минимум обследований:
- рентгенограмма тазобедренного сустава в проекции Лауэнштейна, в передне-задней проекции;
- КТ или МРТ.
В редких случаях применяется диагностическая артроскопия.
Лечение
Тактика лечение детей с болезнью Легга-Кальве-Пертеса зависит от стадии и возраста ребёнка и включает в себя:
- медикаментозное лечение (противовоспалительные препараты, остео- и хондропротекторы);
- физиотерапевтические процедуры, лечебную физкультуру;
- массаж;
- использование ортопедических приспособлений (например, гипсовых повязок, функциональных шин);
- санаторно-курортное оздоровление.
- Форма и размеры вертлужной впадины при данном заболевании остаются приближенными к нормальным вплоть до его завершения.
- Болезнь протекает в детском возрасте, когда, несмотря на наличие очага некроза в эпифизе, продолжается рост хрящевой модели головки бедренной кости, который может способствовать восстановлению её формы и размеров.
- В стадии восстановления имеют значительную выраженность процессы реваскуляризации очага некроза и новообразования костной ткани.
- Исключение компрессии тазобедренного сустава, обусловленной напряжением окружающих его мышечных групп, а также продолжающейся осевой нагрузкой на конечность;
- Изменение пространственного положения тазового, бедренного или обоих компонентов поражённого сустава при помощи одного из консервативных или хирургических методов для полного погружения головки бедренной кости в вертлужную впадину с созданием степени костного покрытия, равной единице.
В случаях торпидного течения заболевания с формирующимся или уже существующим подвывихом бедра максимальной эффективностью обладает хирургическое лечение, а наиболее адекватной методикой – тройная остеотомия таза. Цель хирургического лечения:
С 2021 года в отделении патологии тазобедренного сустава в комплексном лечении детей с тяжёлым поражением эпифиза и подвывихом бедра с целью улучшения процессов ревитализации костной ткани в очаге некроза, улучшения формы головки бедренной кости и сокращения сроков течения заболевания применяется ортопедический электрет – активный диэлектрик, способный после снятия внешнего воздействия сохранять длительное время остаточную поляризацию и генерировать сравнительно сильное квазистатическое электрическое поле, играющее значительную роль в пролиферации, миграции и ремоделировании костных клеток. Полученные ближайшие результаты применения ортопедического электрета внушают осторожный оптимизм и требуют дальнейшего изучения.
Септический артрит тазобедренного сустава. Диагностика и лечение
Септический артрит — заболевание детского возраста, а для тазобедренного сустава средний возраст даже ниже, чем для артритов другой локализации: 70% случаев приходится на детей до 4-летнего возраста. Чем меньше ребенок, тем хуже исход артрита тазобедренного сустава. Отказ ребенка ходить часто связан с бактериальными инфекциями тазобедреннего сустава.
В одном исследовании, при проведении которого авторы исключили всех больных, отказывавшихся ходить из-за явной предшествующей патологии, было установлено, что у 21 из 22 больных причиной была бактериальная инфекция. Остеомиелит и септический артрит встречались с равной частотой и составляли 14 случаев из 22. Также в значительном числе случаев встречались дисциты.
Повышенная температура была у 82% больных с бактериальной инфекцией, но только у 17% из тех, у кого не было инфекции. Количество лейкоцитов в крови и СОЭ повышены не были.
Патогенез септического артрита тазобедренного сустава
При септическом артрите тазобедренного сустава воспалительном процессе чаще всего высевают золотистый стафилококк. Инфекция обычно поражает полость сустава из остеомиелитического очага внутри суставной капсулы. Остеомиелит, как правило, гематогенного происхождения и поражает метафиз бедра, проникая по питающим сосудам. Инфекция может выйти на поверхность в виде субпериостального абсцесса.
Воспаление тазобедренного сустава обычно развивается вследствие проникновения возбудителя из очага остеомиелита в шейке бедренной кости внутрь суставной капсулы. Имеется существенная разница между развитием заболевания у детей старшего и младшего возраста. У старших детей это заболевание, как правило, является следствием остеомиелита шейки бедра. У младенцев оно может быть результатом гематогенной диссеминации при генерализованной септицемии.
Суставной хрящ не может выдержать повышенного внутрисуставного давления, вызываемого гноем, продуцируемым стафилококками. Кроме того, стафилококк продуцирует активатор стафилокина-зу, способствующую деструкции суставного хряща. Хрящ может противостоять этим силам в течение 4—5 дней до начала деструктивных изменений. К другим микроорганизмам, которые могут вызвать септический артрит тазобедреннего сустава у детей, относятся пиогенный стрептококк и палочка Пфейфера.
Стрептококковой инфекции обычно сопутствует гораздо более быстрое нарастание признаков и симптомов. Инфекция, вызываемая палочкой Пфейфера, обычно ответственна за септический артрит, который развивается у детей первых 12 мес жизни, хотя может встречаться и в первые 2 года жизни. У молодых людей следует подозревать гонококковый артрит.
Клиническая картина септического артрита тазобедренного сустава
Как правило, ребенок поступаете отделение неотложной помощи с высокой температурой, повышенной возбудимостью и с сильными болями в пораженном тазобедренном суставе, сопровождающимися значительным ограничением движений в нем во всех направлениях и мышечным спазмом. Ребенок ходит хромая или совсем отказывается ходить. Пораженное бедро согнуто, ротировано кнаружи и отведено. При обследовании у пациента отмечаются болезненность в паху и над тазобедренным суставом, интоксикация.
Число лейкоцитов в синовиальной жидкости в среднем равно 57 000 мкл, однако оно может варьироваться в пределах от 10 000 до 250 000 мкл. Характерен сдвиг формулы влево, посев крови оказывается положительным более чем в 50% случаев. Уровень муцина в суставной жидкости во всех случаях понижен, так же как и уровень глюкозы по сравнению с ее содержанием в крови у большинства обследованных больных. Скорость оседания эритроцитов обычно повышена.
Morey и соавт., рекомендуют ставить диагноз, если имеются любые четыре признака из следующих пяти:
1) температура выше 38,3°С;
2) боль в тазобедренном суставе, усиливающаяся при незначительном пассивном движении;
3) припухлость пораженного сустава;
4) общая симптоматика — апатичность, возбудимость или интоксикация без явных проявлений другого патологического процесса;
5) положительная реакция на антибиотикотерапию.
В одном исследовании у всех больных отмечалась некоторая степень припухлости мягких тканей в области тазобедренного сустава. Чем меньше ребенок, тем больше вероятность обнаружить расширение суставной щели. В другом исследовании у многих больных рентгенограммы сначала были в норме. Самым типичным был патологический подвывих бедра с расширением суставной щели. У некоторых больных был обнаружен остеомиелит проксимального отдела бедра.

Дифференциальный диагноз септического артрита тазобедренного сустава
Септический артрит тазобедренного сустава следует дифференцировать от ряда других заболеваний. Транзиторный синовит может проявляться интенсивными болями, выраженной хромотой и ограничением движений в тазобедренном суставе. Дифференцировать это заболевание от септического артрита помогает радиоизотопное сканирование. Если нет возможности провести его, поставить дифференциальный диагноз поможет проводимое накожное вытяжение на кровати в больнице. Значительное улучшение состояния с уменьшением симптоматики в течение 24 ч указывает на транзиторный синовит.
Если врач подозревает септический артрит, следует сделать пункцию сустава, удалить выпот и начать лечение антибиотиками. Гемофилию может оказаться трудно дифференцировать, однако такие больные обычно состоят на учете по данному заболеванию. При подозрении на это заболевание показана неотложная декомпрессия, чтобы предотвратить повреждения головки бедра из-за повышенного внутрисуставного давления.
Ревматическая атака может проявиться значительной болью и ограничением движений в тазобедренном суставе. Как правило, при этом заболевании имеются артрит летучего характера и артралгия, что помогает в дифференциальной диагностике.
Лечение септического артрита тазобедренного сустава
Возможно, самый важный момент, о котором должен знать врач неотложной помощи, — это то, что задержка в постановке диагноза этого заболевания и позднее начало лечения ухудшают прогноз и исход этого заболевания. В одном исследовании плохой исход был отмечен почти во всех случаях, когда лечение было начато позже 4 дней после появления симптоматики.
Цель лечения — удаление выпота из сустава для предотвращения деструкции суставного хряща и образования спаек, а также декомпрессия сустава для предупреждения нарушения кровоснабжения эпифиза. Адекватные дозы парентеральных антибиотиков обязательны. Griffin рекомендовал сначала назначать пенициллин, однако в последнее время предпочтение оказывается другим препаратам. Важной составляющей лечения являются пункция полости сустава и ее промывание. Врачу следует выбрать соответствующий антибиотик в зависимости от наиболее вероятного микроорганизма, который предполагают, исходя из возраста больного и особенностей начала заболевания. При выборе антибиотика важную роль играют посев и окраска культуры по Граму.
Чаще всего встречается стафилококковый артрит, поддающийся терапии метициллином или оксациллином. При подозрении на гонококковый артрит для взрослых рекомендуют назначать пенициллин внутривенно в дозе 10 млн ЕД/сут.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Транзиторный синовит тазобедренного сустава. Диагностика и лечение
Транзиторный синовит тазобедренного сустава очень часто встречающееся кратковременное неспецифическое воспаление синовиальной оболочки тазобедренного сустава у детей, чаще мальчиков, в возрасте 4—10 лет.
Развитие процесса часто связывают с небольшой травмой или заболеванием с невысокой субфебрильной температурой, например тонзиллитом или острым отитом. Этот процесс обычно односторонний, хотя изредка может быть и двусторонним.
На снимках изменений вначале нет, однако в выраженных случаях мягкие ткани, предлежащие к внутритазовой поверхности вертлужной впадины, отечны и образуют сильно выступающую тень, известную под названием запирательного симптома.
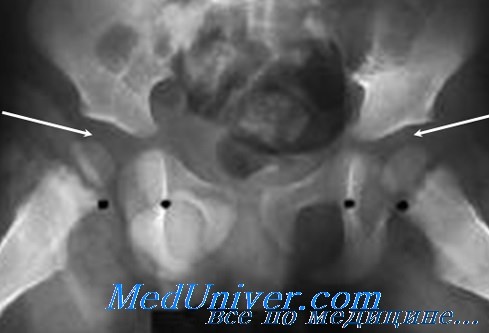
Клиническая картина транзиторного синовита тазобедренного сустава
Начало заболевания обычно постепенное. Ребенок жалуется на боль в тазобедренном суставе, иррадиирующую вниз в бедро и коленный сустав. Конечность находится в положении сгибания, приведения и внутренней ротации, в то время как ребенок сопротивляется любым попыткам пассивных движений из-за мышечного спазма. У этих детей почти всегда отмечаются хромота и болезненность сустава при пальпации.
Температура обычно нормальная или слегка повышена и редко бывает высокой.
Транзиторный синовит тазобедренного сустава необходимо дифференцировать от остеомиелита, гнойного артрита и эпифизеолиза головки бедра. Дифференциации помогает выявление в анамнезе предшествующего заболевания с субфебрильной температурой и типичное кратковременное течение транзиторно-го синовита. В случае сомнений показаны пункция тазобедренного сустава и посев синовиальной жидкости.
Лечение транзиторного синовита тазобедренного сустава
Лечение транзиторного синовита тазобедренного сустава заключается в постельном режиме, а при наличии значительной боли и мышечного спазма — в кратковременном вытяжении, которое обычно ведет к быстрому выздоровлению. Показано продолжительное последующее наблюдение, поскольку у некоторых больных впоследствии развивается болезнь Легга—Кальве—Пертеса.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

