Иванов д о сепсис новорожденных
Обновлено: 11.05.2024
Обследовано 214 новорожденных детей, перенесших тяжелую перинатальную патологию (постгипоксический синдром, сепсис, хирургические вмешательства в связи с врожденными пороками развития). Исследовались 27 параметров системы гемостаза. По результатам проведенного исследования, было доказано, что ДВС-синдром у новорожденных имеет различные гемостазиологические паттерны, обусловленные генезом основного заболевания. Установлено, что ДВС-синдром при неонатальном сепсисе имеет два типа - суперкомпенсированный и декомпенсированный. Проявления тромбогемморагических расстройств и их характер зависят от генеза ДВС-синдрома. Наиболее часто тромбогеморрагические расстройства манифестируют при гипербилирубинемиях и инфекционных осложнениях.
Ключевые слова
Об авторах
Список литературы
1. Исаков Ю.Ф., Белобородова Н.В. Сепсис у детей. - Москва: Издатель Мокеев, 2000. - 369 с.
2. Antonelli M. Sepsis and septic shock: pro-inflammatory or anti-inflammatory state? // J. Chemother. - 1999. - Vol. 11, № 6. - Р. 536-440.
3. Pugh M. DIC screening in the newborn // Neonatal Netw. - 1997. - Vol. 16, № 7. - P. 57-60.
4. Veldman A., Fischer D., Nold M.F., Wong F.Y. Disseminated intravascular coagulation in term and preterm neonates // Semin Thromb Hemost. - 2010. - Vol. 36, № 4. - P. 419-428.
5. Шабалов Н.П., Иванов Д.О., Шабалова Н.Н. Гемостаз в динамике первой недели жизни как отражение механизмов адаптации ко внеутробной жизни новорожденного // Педиатрия. Журнал им. Г.Н. Сперанского. - 2000. - № 3. - С. 22.
6. Курзина Е.А., Жидкова О.Б., Петренко Ю.В. и др. Прогнозирование состояния здоровья в катамнезе у детей, перенесших тяжелую перинатальную патологию // Детская медицина Северо-Запада. - 2010. - Т. 1., № 1. - С. 22-27.
7. Иванов Д.О. Клинико-лабораторные варианты течения сепсиса новорожденных: автореф. дис. д-ра. мед. наук. - СПб., 2002. - С. 62.
8. Петренко Ю.В., Иванов Д.О., Курзина Е.А. Оценка органной недостаточности у новорожденных // Бюллетень Федерального Центра сердца, крови и эндокринологии им. В.А. Алмазова. - 2011. - № 2. - С. 43-50.
9. Иванов Д.О. Особенности сосудисто-тромбоцитарного и коагуляционного гемостаза у новорожденных с тяжелой перинатальной патологией. автореф. дис.. кан. мед. наук. - СПб., 1996. - С. 28.
10. Сурков Д.Н., Иванов Д.О., Оболонский А.И. и др. Современные стратегии выхаживания недоношенных детей // Детская медицина Северо-Запада. - 2012. - Т. 3. № 1. - С. 4-9.
11. Шабалов Н.П., Иванов Д.О. Сепсис новорожденных // Педиатрия. Журнал им. Г.Н. Сперанского. - 2003. - № 5. - С. 46-56.
13. Шабалов Н.П., Иванов Д.О., Шабалова Н.Н. Сепсис новорожденных // Медицинский академический журнал. - 2001. - Т. 1., № 3. - С. 81-89.
14. Иванов Д.О., Шабалов Н.П., Петренко Ю.В. Неонатальный сепсис. Опыт построения гипотезы // Детская медицина Северо-Запада. - 2012. - Т. 3, № 3. - С. 37-45.
15. Лычев В.Г. Диагностика и лечение диссеминированного внутрисосудистого свертывания крови. - М., Медицина, 1993. - 160 с.
16. Иванов Д.О., Петренко Ю.В., Шемякина О.О., Фот А.Ю. Антенатальные факторы риска, приводящие к формированию врожденных пороков у новорожденных детей // Вопросы практической педиатрии. - 2012. - Т. 7, № 4. - С. 60-64.
17. Жидкова О.Б., Курзина Е.А., Иванов Д.О., Петренко Ю.В. Возможности прогнозирования развития критических состояний у новорожденных в зависимости от состояния здоровья матери // Вестник Российской военно-медицинской академии. - 2012. - Т. 4. - С. 213-216.
18. Иванов Д.О., Петренко Ю.В., Шемякина О.О., Фот А.Ю. Анализ антенатальных факторов риска формирования врожденных пороков внутренних органов у детей // Бюллетень Федерального Центра сердца, крови и эндокринологии им. В.А. Алмазова. - 2012. - № 1. - С. 61-68.
19. Stanworth S.J., Bennett C. How to tackle bleeding and thrombosis in the newborn // Early Hum Dev. - 2008. - Vol. 84, № 8. - Р. 507-513.
20. Marks P.W. Coagulation disorders in the ICU // Clin. Chest. Med. - 2009. - Vol. 30, № 1. - P. 123-129.
21. Ganter M.T., Hofer C.K. Principles of perioperative coagulation management // Chirurg. - 2011. - Vol. 82, № 7. - P. 635-443.
24. Иванов Д.О., Петренко Ю.В., Курзина Е.А., Федосеева Т.А. Гипергликемия у новорожденных // Детская медицина Северо-Запада. - 2012. - Т. 3, № 3. - С. 3-14.
25. Иванов Д.О., Петренко Ю.В., Курзина Е.А., Петрова Н.А. Показатели клинического анализа крови у новорожденных, заболевших неонатальным сепсисом // Бюллетень Федерального Центра сердца, крови и эндокринологии им. В.А. Алмазова. - 2012. - № 3. - С. 41-52.
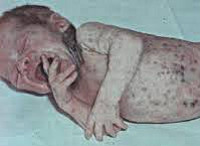
Сепсис новорожденных – генерализованная гнойно-септическая инфекция, характеризующаяся наличием первичного очага и циркуляцией инфекции в крови. Сепсис новорожденных проявляется признаками инфекционного токсикоза (температурной реакцией, вялостью, диспепсией, землистой окраской кожных покровов) и образованием гнойных метастатических очагов в различных органах (мозговых оболочках, легких, костях, печени и пр.). Диагноз сепсиса у новорожденных устанавливается на основании клинических критериев и выделения возбудителя при бактериологическом посеве крови. Лечение сепсиса новорожденных включает системную антибиотикотерапию, санацию первичного и метастатических гнойных очагов, посиндромную терапию.
Общие сведения
Сепсис новорожденных – общий инфекционный процесс, обусловленный попаданием условно-патогенной и гноеродной микрофлоры из локальных очагов в кровяное русло и сопровождающийся тяжелыми системными проявлениями. По данным зарубежной педиатрии, частота сепсиса новорожденных составляет 0,1-0,8%; среди недоношенных и детей с перинатальной патологией, находящихся в ОРИТ, - 14%. Неонатальная смертность, обусловленная сепсисом новорожденных, высока и стабильна – около 30-40%. Развитию сепсиса способствуют недостаточная сформированность барьерных механизмов и иммунитета у новорожденных, пограничные состояния периода новорожденности, патологическое протекание перинатального периода, сложность ранней диагностики септических состояний.

Причины
В настоящее время доминирующее место (около 50%) среди возбудителей сепсиса новорожденных принадлежит грамположительной флоре (главным образом, стафилококкам, гемолитическому стрептококку группы А). Чуть реже (до 40% случаев) выявляется грамотрицательная микрофлора (кишечная палочка, синегнойная палочка, клебсиелла и др.); в 10% этиологическими агентами выступает смешанная флора (часто ассоциация стафилококка с грибами Candida).
Со стороны матери факторами, способствующими бактериальной контаминации новорожденного, выступают бактериальный вагиноз, кольпиты, эндометрит. Большое значение имеет степень и характер иммуносупрессии у новорожденного, которые могут быть связаны с неполноценным питанием или приемом лекарств беременной, наследственным иммунодефицитом или ВИЧ-инфекцией. В отдельных случаях причиной вспышек сепсиса новорожденных становится несоблюдение санитарного режима в родильных или детских отделениях.
Классификация
По времени развития выделяют внутриутробный и постнатальный (ранний неонатальный и поздний неонатальный) сепсис новорожденных. Внутриутробный сепсис предполагает антенатальное или интранатальное инфицирование плода; при этом первичный гнойно-септический очаг располагается вне организма ребенка (чаще всего в его роли выступает плацентит, хорионит, хориоамнионит и т. д.). В случае постнатального сепсиса первичный гнойно-воспалительный очаг всегда располагается в организме самого новорожденного.
Ранний неонатальный сепсис новорожденных развивается в первые 4-ро суток жизни ребенка. Клинические течение заболевания обычно молниеносное, с быстрым развитием полиорганнной недостаточности, летальным исходом в 5-20% случаев. Поздний неонатальный сепсис новорожденных манифестирует на 5-й день и позднее. Характеризуется медленно прогрессирующим течением, возникновением вторичных септических очагов, 5-10%-ной летальностью.
Течение сепсиса новорожденных может быть молниеносным (3-7 дней), острым (до 4-8 недель), подострым (до 1,5-3 месяцев), затяжным (более 3 месяцев). С учетом локализации первичного септического очага и входных ворот различают: пупочный, кожный, легочный, ринофарингеальный, отогенный, риноконъюнктивальный, кишечный, урогенный, катетеризационный и др. виды сепсиса новорожденных. Сепсис новорожденных может протекать в форме септицемии или септикопиемии.
Симптомы сепсиса новорожденных
Септицемия или сепсис новорожденных без метастазов обычно развивается на фоне предшествующего мокнущего пупка, конъюнктивита, гнойничковой сыпи, опрелостей, стоматита. Предвестниками сепсиса новорожденных могут выступать вялость или беспокойство, снижение аппетита, обильные частые срыгивания, плохая прибавка в весе. В период разгара развивается температурная реакция (гипер- или гипотермия), отечный синдром или эксикоз, гипотрофия. Характерным признаком сепсиса новорожденных является грязновато-серый (землистый) оттенок кожных покровов, желтушность, мраморность кожи, сыпь.
Вследствие токсического поражения различных органов возникают гепатоспленомегалия, пневмопатия (тахипноэ, цианоз), кардиопатия (тахикардия или брадикардия, артериальная гипотензия), диспепсия, мочевой синдром (олигурия, анурия, ОПН), геморрагический синдром, надпочечниковая недостаточность. Чаще всего септицемия осложняется присоединением пневмонии, которая выступает как самостоятельное интеркуррентное заболевание.
Септикопиемия или сепсис новорожденных с гнойными метастазами характеризуется возникновением на фоне интоксикации вторичных очагов отсева в мозговых оболочках, легких, костях, печени, других органах. Чаще всего септикопиемия протекает с развитием гнойного менингита, абсцедирующей пневмонии, остеомиелита; реже – с формированием абсцесса печени, гнойного артрита, панофтальмита, медиастинита, флегмоны желудка или кишечника. В восстановительном периоде происходит санация пиемических очагов, стихание токсикоза, постепенное восстановление нарушенных функций.
Молниеносная форма сепсиса новорожденных протекает с развитием септического шока: стремительным ухудшением состояния ребенка, снижением температуры тела, брадикардией, кровоточивостью, отеком легких, острой почечной недостаточностью. Летальный исход при молниеносном течении сепсиса новорожденных наступает в течение 3-5 суток.
Диагностика сепсиса новорожденных
Диагноз сепсиса новорожденного может быть заподозрен неонатологом или педиатром на основании лихорадки свыше 3 дней или прогрессирующей гипотермии; гиперлейкоцитоза, сменяющегося лейкопенией; повышением содержания в крови маркеров инфекционного процесса (СРБ, интерлейкина-8, прокальцитонина).
Факт бактериемии при сепсисе новорожденных подтверждается путем посева крови на стерильность. Важное значение имеет выявление первичного гнойного очага и метастатических очагов, микробиологического исследование отделяемого из них (бактериологическое исследование мазка с конъюнктивы, мочи на микрофлору, соскоба/отделяемого с кожи на микрофлору, мазка из глотки, кала на дисбактериоз и т. п.).
Дифференциальная диагностика сепсиса новорожденных осуществляется с локализованными гнойно-воспалительными заболеваниями (пневмонией, медиастинитом, перитонитом, менингитом, энтероколитом), генерализованными вирусными инфекциями (цитомегалией, герпесом, энтеровирусной инфекцией) и микозами (кандидозом, аспергиллезом) и др. Для этого используются дополнительные лабораторные методы – ПЦР, ИФА, микроскопия.
Лечение сепсиса новорожденных
Терапия при сепсисе новорожденных проводится одновременно в нескольких направлениях и включает санацию септического и пиемических очагов, подавление циркуляции возбудителя в крови, коррекцию нарушенных функций.
Основу этиологического лечения сепсиса новорожденных составляет антибиотикотерапия: эмпирическая комбинированная до уточнения характера микрофлоры) и целенаправленная после получения антибиотикограммы. Противомикробные препараты вводятся внутривенно, в максимальных возрастных дозировках в течение 10-15 суток с последующей сменой. Чаще всего в клинической практике для лечения сепсиса новорожденных в различных сочетаниях используются цефалоспорины, аминогликозиды, аминопенициллины, карбапенемы и др.
С целью местного лечения гнойных очагов производится вскрытие фурункулов и абсцессов, перевязки с антибактериальными и ферментными препаратами; назначается УВЧ, СВЧ, электрофорез.
Патогенетическая терапия сепсиса новорожденных включает иммунокоррекцию (плазмаферез, гемосорбцию, введение иммуноглобулинов), проведение дезинтоксикационной терапии (внутривенной инфузии глюкозо-солевых растворов и свежезамороженной плазмы), адекватную кислородотерапию и т. д. При сепсисе новорожденных обязательно проводится мониторинг состояния жизненно-важных функций: АД, ЧСС, ЭКГ, КОС и газового состава крови, биохимических показателей (сахара крови, креатинина, электролитов), гематокрита.
В остром периоде сепсиса целесообразно пребывание новорожденных в кувезе, кормление материнским молоком, тщательный уход. В восстановительном периоде к лечению подключается гимнастика, массаж, лечебные ванны.
Прогноз и профилактика сепсиса новорожденных
Прогноз сепсиса новорожденных серьезный: летальность составляет от 30-40% до 60% среди глубоко недоношенных детей. У выздоровевших детей в отделенном периоде могут отмечаться частые ОРВИ, пиелонефрит, анемия, перинатальная энцефалопатия.
Профилактика сепсиса новорожденных включает выявление и санацию инфекций мочеполовой сферы у беременной, соблюдение противоэпидемических мероприятий медперсоналом родильных домов и отделений новорожденных, тщательный гигиенических уход за новорожденным, естественное вскармливание. Вопрос о сроках вакцинации новорожденных с сепсисом против туберкулеза и против гепатита В , проводимой в первые дни жизни, решается в индивидуальном порядке.
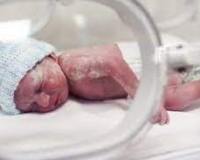
Пупочный сепсис – это генерализованное инфекционное заболевание новорожденных, возникающее при проникновении возбудителей через пупочную ранку. Заболевание развивается при инфицировании стафилококками, кишечной палочной, условно-патогенными грибами. Клинически неонатальный сепсис проявляется лихорадкой или гипотермией, сердечно-легочной недостаточностью, угнетением сознания и рефлексов. Диагностика болезни включает бактериологический посев крови, определение острофазовых показателей, УЗИ пупочной области. Основу лечения составляет массивная антибиотикотерапия, которая дополняется патогенетической терапией и иммунокоррекцией.
МКБ-10


Общие сведения
Специалисты в области неонатологии регулярно сталкиваются с проблемой сепсиса новорожденных: он диагностируется у 0,1-0,2% доношенных и 1-1,5% недоношенных детей. По времени развития выделяют ранний, возникающий в первые 72 часа после рождения, и поздний, который проявляется после 3-х дней жизни младенца. Первый вид в основном вызван внутриутробным или интранатальным инфицированием младенца. Пупочный сепсис относится к позднему, он развивается при заражении патогенными бактериями, проникшими через пупочную ранку из окружающей среды.

Причины
Основные возбудители пупочного сепсиса – грамположительные бактерии Staphylococcus epidermidis и Staphylococcus aureus. Эти микроорганизмы в небольших количествах обитают на коже, входят в состав вагинальной микрофлоры у 60% женщин. Заражение новорожденного происходит дома при общении с родителями и гигиеническом уходе, в отделении новорожденных при осмотре врачом и проведении медицинских манипуляций.
Второй по частоте возбудитель инфекции – кишечная палочка (Escherichia coli). Бактерия является постоянным обитателем толстого отдела кишечника, поэтому она способна колонизировать пупочную рану. Для позднего госпитального сепсиса новорожденных типичны грибково-бактериальные ассоциации: одновременное заражение грибами рода Кандида, стафилококками, стрептококками и другими видами бактерий.
Факторы риска
Сепсис зачастую вызван условно-патогенной микрофонной, которая у провоцирует тяжелые инфекции у одних детей и не влияет на здоровье других. В связи с этим значимую роль приобретают предрасполагающие факторы, которые способствуют заражению, генерализации инфекционного возбудителя и реализации его системных эффектов на организм младенца. К факторам риска относятся следующие:
- Осложнения беременности и родов. Сепсис чаще развивается у новорожденных, матери которых страдали длительными гестозами, имели очаги хронической инфекции урогенитального или желудочно-кишечного тракта. Вероятность инфекционных заболеваний повышается при трудных родах, недоношенности, низкой оценке по шкале Апгар.
- Ненадлежащий уход за ребенком. При позднем внебольничном сепсисе источником инфекции становятся родители и ближайшие родственники, которые общаются с ребенком. Несоблюдение санитарно-гигиенических норм при смене подгузника, обработке пупочного остатка и купании – основные причины заражения инфекцией. Сначала развивается омфалит, который затем осложняется сепсисом.
- Медицинские манипуляции. Новорожденные, которые госпитализируются в реанимационные отделения, подвергаются риску заражения госпитальными штаммами бактерий. Вероятность заболевания коррелирует с длительностью стационарного лечения, объемом инвазивных диагностических и лечебных процедур.
- Иммунодефицитные состояния. Генерализация бактериальной и грибковой инфекции чаще наблюдается у детей со сниженным иммунным статусом. В периоде новорожденности причиной такого состояния выступают врожденные иммунодефициты: синдром Ди Джорджи, атаксия-телеангиэктазия Луи-Бар, ТКИД и многие другие.
Патогенез
Пупочный сепсис начинается с первичного очага инфекции, которым выступает гнойный омфалит. Поскольку у новорожденных наблюдается незрелость фагоцитарно-макрофагальной системы и физиологическое угнетение Т- и В-системы лимфоцитов, бактериальное воспаление не ограничивается пупочной ранкой. Возбудители легко проникают в системный кровоток и взаимодействуют с факторами иммунной защиты.
В основе заболевания лежит неадекватная реакция иммунитета, которая сопровождается резким повышением уровня провоспалительных медиаторов, повреждением клеточных мембран, генерализованными нарушениями микроциркуляции. Одновременно с этим развивается гипоксия тканей и критически снижается продукция макроэргов, что способствует развитию полиорганной недостаточности.

Симптомы пупочного сепсиса
Заболевание возникает на фоне уже имеющегося омфалита на 3-14 дне жизни новорожденного. У ребенка резко ухудшается состояние: температура тела повышается более 40°С или снижается менее 35°С, наблюдается учащенное дыхание и сердцебиение. Новорожденный становится вялым, отказывается от груди и бутылочки. Кожа приобретает землистый оттенок, черты лица заостряются, возникают мелкие подкожные кровоизлияния.
Наблюдаются характерные изменения пупочного остатка. Пупок и окружающие ткани ярко-красные и горячие на ощупь, вокруг них усиливается рисунок венозной сети и появляются красные полосы – признак лимфангита. При надавливании на кожу вокруг пупка из раны выделяется гной с резким неприятным запахом. При некротической форме воспаления кожа становится темно-багровой.
Осложнения
Тяжелой формой сепсиса является септикопиемия – образование метастатических гнойных очагов. Чаще всего развивается гнойный перитонит, остеомиелит, менингит, плеврит и абсцессы легких. Возможны флегмоны мягких тканей разных участков тела. Уровень смертности остается стабильно высоким и составляет 30-40%. При септических осложнениях чаще умирают недоношенные и маловесные дети, имеющие сопутствующую соматическую патологию.
Диагностика
Осмотр новорожденного с признаками генерализованной инфекции проводится врачом-неонатологом. При первичном обследовании обращают внимание на состояние пупочной ранки, наличие клинических проявлений сепсиса, анамнез беременности и родов. По показаниям к диагностике привлекают детского хирурга. Для уточнения диагноза и идентификации возбудителя назначают следующие методы исследования:
- УЗИ.Сонография мягких тканей проводится при подозрении на флегмону, чтобы оценить степень и глубину поражения клетчатки. При подозрении на перитонит и внутрибрюшные абсцессы назначают УЗИ органов брюшной полости.
- Посев крови. Бактериологическое исследование требуется для определения вида возбудителя сепсиса и его чувствительности к антибиотикам. Для получения наиболее достоверных результатов забор биоматериала проводят на высоте лихорадки до начала антибиотикотерапии.
- Базовая лабораторная диагностика. Признаками сепсиса в клиническом анализе крови является высокий лейкоцитоз или лейкопения, резкое возрастание СОЭ. Информативны биохимические показатели системного воспаления: повышенный С-реактивный белок и прокальцитонин.
Дифференциальная диагностика
При выявлении очага гнойного омфалита и характерных клинико-лабораторных признаков диагноз пупочного сепсиса не подвергается сомнению. В неясных случаях неонатологу необходимо исключить диссеминированную цитомегаловирусную, аденовирусную и энтеровирусную инфекцию. Дифференциальная диагностика проводится с респираторным дистресс-синдромом новорожденных, некротическим энтероколитом, абсцессом мозга.

Лечение пупочного сепсиса
Консервативная терапия
При первых признаках сепсиса новорожденного обязательно госпитализируют в реанимационное отделение. При тяжелом состоянии ребенка диагностика выполняется параллельно с лечебными мероприятиями, поскольку начало терапии в первые 6 часов от появления симптомов значительно повышает шансы на выздоровление. Медицинская помощь при сепсисе включает несколько направлений:
Реабилитация
Второй этап лечения начинается по мере исчезновения признаков пупочного сепсиса. В этот период возможно развитие вторичных инфекционных процессов, нарушений обмена веществ, психоневрологических осложнений. Для реабилитации после пупочного сепсиса применяется метаболическая терапия, которая стимулирует анаболические реакции, нормализует окислительно-восстановительные процессы. С этой целью применяют ферменты, витаминно-аминокислотные комплексы.
Прогноз и профилактика
Несмотря на усовершенствование этиопатогенетической терапии сепсиса, большой процент новорожденных умирает от полиорганной недостаточности в первые дни от начала заболевания. Более благоприятный прогноз для иммунокомпетентных младенцев, которые родились доношенными и не имеют признаков септикопиемии. Профилактика пупочного сепсиса включает правильный гигиенический уход за новорожденным, минимизацию инвазивных процедур, рациональное ведение беременности и родов.
1. Неонатальный сепсис. Руководство. 2-е издание, переработанное и дополненное/ Г.А. Самсыгина. – 2020.

Аннотация. В структуре инфекционных заболеваний новорожденных ведущее место занимает сепсис. По данным мировой статистики, в случаев причиной развития раннего неонатального сепсиса являются клебсиеллы, бактерии рода Enterobacteriaceae. В статье рассматривается основные клинико-патоморфологические изменения плода при клебсиеллезном раннем неонатальном сепсисе.
Ключевые слова: дети; ранний неонатальный сепсис; клебсиелла.
В структуре инфекционных заболеваний новорожденных ведущее место занимает сепсис, что связано с высокой распространенностью в данной возрастной группе, тяжелыми клиническими проявлениями и сохраняющейся высокой летальностью при этой нозологии[6]. Этиология неонатального сепсиса разнообразна и в значительной мере определяется сроками развития заболевания с момента рождения ребенка.
По данным мировой статистики, в случаях причиной развития неонатального сепсиса являются клебсиеллы, бактерии рода Enterobacteriaceae. Наибольшее эпидемиологическое значение имеет K.pneumoniae, на долю которой приходится всех случаев клебсиеллеза [2]. Одной из эпидемиологических особенностей инфекции является способность микроба длительно сохраняться в факторах внешней среды и формировать устойчивые очаги внутрибольничного заражения [1]. Среди новорожденных группу риска по данному заболеванию составляют недоношенные, родившиеся с очень низкой или экстремально низкой массой, дети [6]. Это объясняется низкой выраженностью их иммунного ответа по сравнению с доношенными детьми [5].
Было исследовано 7 протоколов патологоанатомических вскрытий новорожденных (6 мальчиков, 1 девочка) с ранним неонатальным сепсисом клебсиеллезной этиологии. 4 ребенка родились путем операции Кесарево сечения, 2 при преждевременных родах, в одном случае была проведена вакуум-экстракция плода. Недоношенными родились 5 детей, причем 2 в сроке гестации до 30 недель, 2 в сроке гестации 30 недель, и 1 в сроке гестации 33 недели. В 1 случае отмечалась очень низкая масса тела новорожденного.
Органная патология была выявлена у 100% детей.
У 6 детей обнаружились поражения легочной системы в виде пневмонии, причем у 5 двусторонняя полисегментарная, у 1 двусторонняя нижне-долевая. Поражения легких имели серозно-фибринозный (2), фибринозный (1), фибринозно-геморрагический (2) и фибринозно-гнойный (1) характер. В 3 случаях была выявлена аспирация околоплодными водами, что позволяет предположить вероятный путь инфицирования у данных детей [4].
В 7 случаях были обнаружены поражения ЦНС в виде менингита: серозно-гнойного (2), серозно-геморрагического (2), серозного (3) [7].
Патология ЖКТ была выявлена у 4 детей в виде язвенного гастрита (3), в одном из случаев осложнившегося перитонитом, энтерита (1), панкреатита (2), гепатита (3).
В 3 случаях сепсис, вызванный K.pneumoniae, осложнился септическим шоком, чаще у недоношенных (2), чем у доношенных (1).
В 5 случаях клебсиеллезный сепсис осложнился ДВС-синдромом. При этом обнаруживались кровоизлияния в мягкую мозговую оболочку (1), твердую мозговую оболочку (1), миндалину мозжечка (1); внутрижелудочковые кровоизлияния (1), легочные (3) и желудочные (2) кровотечения [4]. В 2 случаях наблюдался венозный тромбоз мезентериальных сосудов, в 1 случае — тромбоз сагиттального синуса. ДВС синдром сопровождался геморрагическим некрозом надпочечников (3), печени (2); некротическим нефрозом в шоковой стадии (4).
Степень ацидентальной инволюции тимуса колебалась от 2 стадии (1) до стадий (2).
Проводилось посмертное бактериологическое исследование фрагментов головного мозга (4) и легких (6). При этом в легких высеивались клебсиеллы в количестве 10 5 (3) и 10 6 , причем в одном случае бактерии продуцировали бета-лактамазы расширенного спектра действия. Из головного мозга в количестве 10 3 (1) и 10 5 (3), в двух случаях продуцировали бета-лактамазы расширенного спектра действия.
Во всех случаях основным диагнозом был поставлен клебсиеллезный ранний неонатальный сепсис, причем в 2 случаях имелись конкурирующие заболевания: двусторонняя фибринозно-геморрагическая пневмония на фоне аспирации элементами околоплодных вод и генерализованная внутриутробная инфекция [7].
Время жизни колебалось от 2 до суток.
Механизм танатогенеза: мозговой (1) и легочный (6).
Следует отметить, что у 5 из 7 матерей, наблюдались патологии во время беременности такие как уреаплазменный кольпит; вирусный гепатит В; маловодие; преждевременный разрыв плодных оболочек; гестационная АГ; угроза прерывания беременности; хронический пиелонефрит.
В 4 случаях наблюдались признаки воспаления плаценты, у 1 ребенка фибринозно-гнойный плацентит явился причиной развития сепсиса. У 2 женщин обнаружилась плацентарная недостаточность в стадии субкомпенсации. В 1 случае наблюдались признаки краевой отслойки плаценты с наличием инфицированной гематомы.
K.pneumoniae, эпидемиологической особенностью которой является способность микроба длительно сохраняться в факторах внешней среды и формировать устойчивые очаги внутрибольничного заражения, является одной из наиболее распространенных причин развития раннего неонатального сепсиса. Многочисленные данные, отраженные в научных источниках, и наши наблюдения указывают на то, что недоношенность является предрасполагающим фактором его развития, наряду с отягощенным акушерско-гинекологическим анамнезом матери, и отличается более выраженными патологическими процессами, что объясняется низкой выраженностью их иммунного ответа по сравнению с доношенными детьми. Клебсиеллезный ранний неонатальный сепсис влечет полиорганное поражение всех органов и систем с летальным исходом. Основными органами мишенями закономерно считать органы дыхательной, пищеварительной и нервной систем, а основным синдромом, наблюдавшимся у большинства детей, определившим тяжесть состояния и оказавшим влияние на исход, был ДВС-синдром.
Читайте также:

