Кишечная палочка источники возбудителя в лпу
Обновлено: 26.04.2024
Темой нынешнего разговора будет, с точки зрения автора, королева внутрибольничных инфекций любого стационара – Klebsiella pneumonia (или палочка Фридлендера).
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С., врач – клинический фармаколог
Темой нынешнего разговора будет, с точки зрения автора, королева внутрибольничных инфекций любого стационара – Klebsiella pneumoniae (или палочка Фридлендера). Да-да, автор не ошибся, именно она, а не синегнойки или ацинетки, а именно ее величество – клебсиелла, практически абсолютная убийца тяжелых и крайне тяжелых пациентов. Почему это именно так, мы сегодня и поговорим.
Микробиологические аспекты
Первое и главное, о чем надо знать, – Klebsiella pneumonia – это представитель нормальной микрофлоры кишечника. Еще раз и большими буквами – НОРМАЛЬНОЙ! Не надо ее там лечить (как и стафилококк в носоглотке) – она там живет, и это ее естественный ареал обитания.
А все остальные локации, где она может быть обнаружена: нижние дыхательные пути, мочевыводящий тракт, секрет простаты или содержимое полости матки (анальный сексуальный акт без презерватива – зло, имейте это в виду при сборе анамнеза, особенно у женщин с послеродовым эндометритом, автор такого навидался в достатке… мужчин это тоже касается, и обнаружение подобной зверюшки в секрете простаты должно навести на определенные мысли и вопросы, и пока пациент не закончит данную практику, простатит вы ему при всем желании не вылечите), кровь и в раны при раневых инфекциях после хирургического вмешательства на брюшной полости – могут указывать на возбудителя текущего состояния.
Что вызывает:
- Пневмонию
- Абсцессы легких
- Перитониты
- Инфекции мочевыводящих путей
- Менингиты
- Эндокардиты
- Раневые инфекции
- Инфекции матки и влагалища
- Сальпингиты
- Остеомиелиты
- Инфекции кожи
- Сепсис
Общим у всех этих патологий является одно – они все тем или иным образом связаны с вмешательством, и чаще всего (опуская уже упомянутые анальные сексуальные акты) это вмешательство носит ятрогенный характер. Клебсиелла не умеет ни летать, ни ходить, ни даже ползать, в очаг ее приносят либо неправильно вымытые руки, либо плохо обработанное медицинское оборудование.
Эпидемиологические аспекты
С клебсиеллой все намного сложнее. Эта, не побоюсь громкого слова, зверища, живет в кишечниках всего персонала медицинских учреждений. И в первую очередь, как понятно из ее названия, поражает нижние дыхательные пути. А если персонал работает с антибиотиками, то клебсиелла еще и устойчивая ко всему арсеналу применяемых препаратов (это к вопросу о разумном ограничении доступа к препаратам резерва). Так как сама клебсиелла не имеет ножек и крылышек, то попадает в оные пути она двумя способами: или в случае аспирации, или на руках персонала и с оборудования. Иного не дано. При аспирации это будет личная дикая зверюшка пациента, в случае грязных шаловливых ручек или оборудования (например, эндоскопов) – клебсиелла, высеваемая в отделении в процессе микробиологического мониторинга. А если этот мониторинг углубленный, то напрямую покажет, какая именно хрюшка, выйдя из туалетной комнаты, не соизволила помыть руки, понадеявшись на перчатки. И нет, перчатки, даже стерильные в данном случае, не спасают, они не презерватив. Руки надо мыть и обрабатывать правильно, обязательно соблюдая технологию и экспозицию.
Как вы понимаете, истребить медицинский персонал мы не можем, поэтому и полностью очистить стационар от данной проблемы не получится. И она обязательно выскочит, стоит на секунду расслабиться, и выскочит на самом тяжелом больном, где еще умудрится смутировать в такого урода, которого не достанешь никаким антибиотиком.
На общемировом клебсиеллу тоже очень сильно боятся, и когда в 2010 году вдруг в Великобритании обнаружили штамм NDM (он устойчив вообще ко всему набору существующих антибиотиков и обозван абсолютным убийцей), паника была знатной. В результате проведенного эпидемиологического расследования, по итогам которого большая группа видных ученых стала персонами non-grata в Индии, было установлено, что данный штамм привезен оттуда и из Пакистана. Присутствие в сточных водах возбудителей, имеющих карбапенемазы (то есть это уже не внутрибольничная флора, это то, что там живет на улице) на момент проведения расследования составляла 90% по CTX-M15 и 36% по NDM. С чем связан сей факт? С безрецептурным масштабным использованием карбапенемов и… проблемами с проточной канализацией. Ее либо нет, либо ей не пользуются, а делают все по старинке. А так как земной шар оказался очень маленьким, теперь NDM-штаммы обнаруживаются по всей планете. У нас, например, очень быстро данным штаммом заселились клиники Санкт-Петербурга. И медицина перед ними бессильна. До тех пор, пока не налажен эпиднадзор, а персонал не моет руки после каждого посещения туалета.
Так как любого врага надо знать в лицо, то наиболее часто встречаемые портреты у автора тоже есть.
Итак, дикая и ничем ни разу не пуганная клебсиелла выглядит вот так:
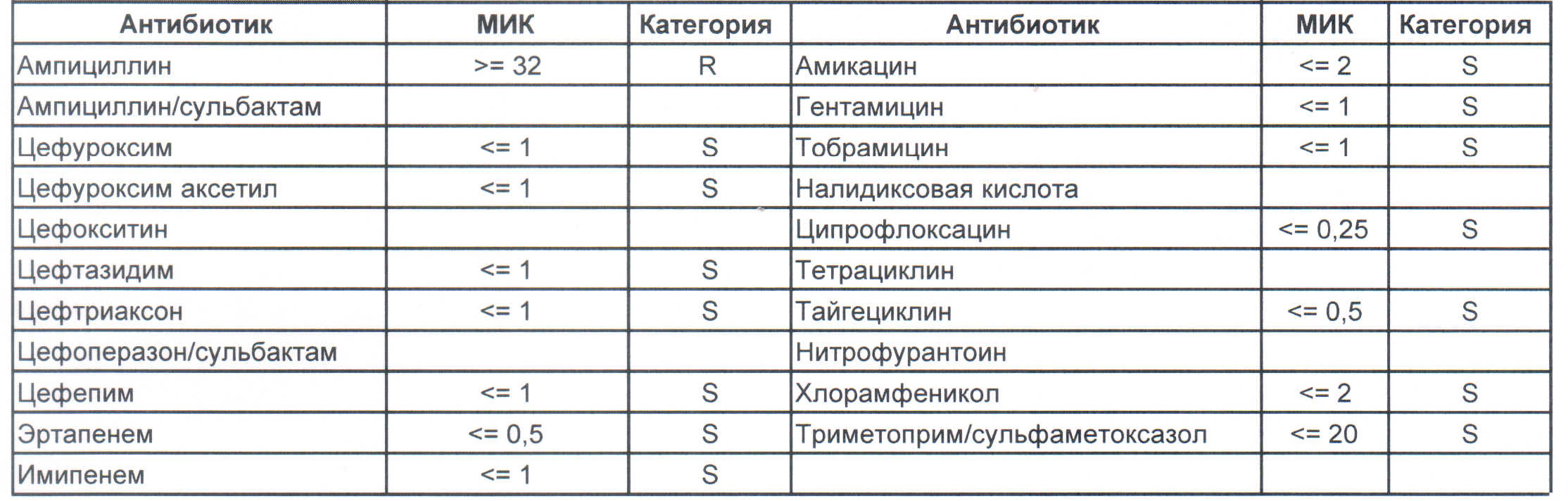
Где встречается? Те самые послеродовые эндометриты, как результат плотских утех, простатиты, а также раневые инфекции после оперативных вмешательств на брюшной полости у ранее не леченных пациентов.
На этом рисунке:
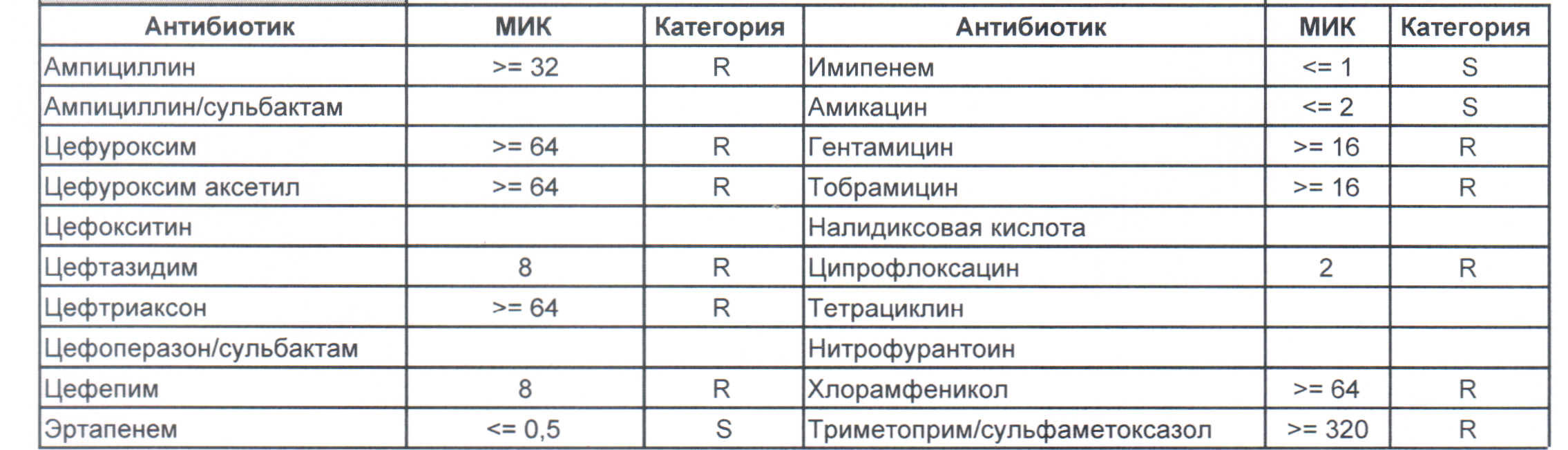
– вы можете увидеть устойчивый внутрибольничный штамм, который еще можно чем-то полечить, но это будет тяжело и дорого, проще персонал научить руки мыть и бороды брить (фекальной микрофлоры в мужских бородах в таком достатке, что единственный вариант для тех, кто хоть как-то соприкасается с ранами, данное украшение не носить или не оперировать).
На следующей картинке:
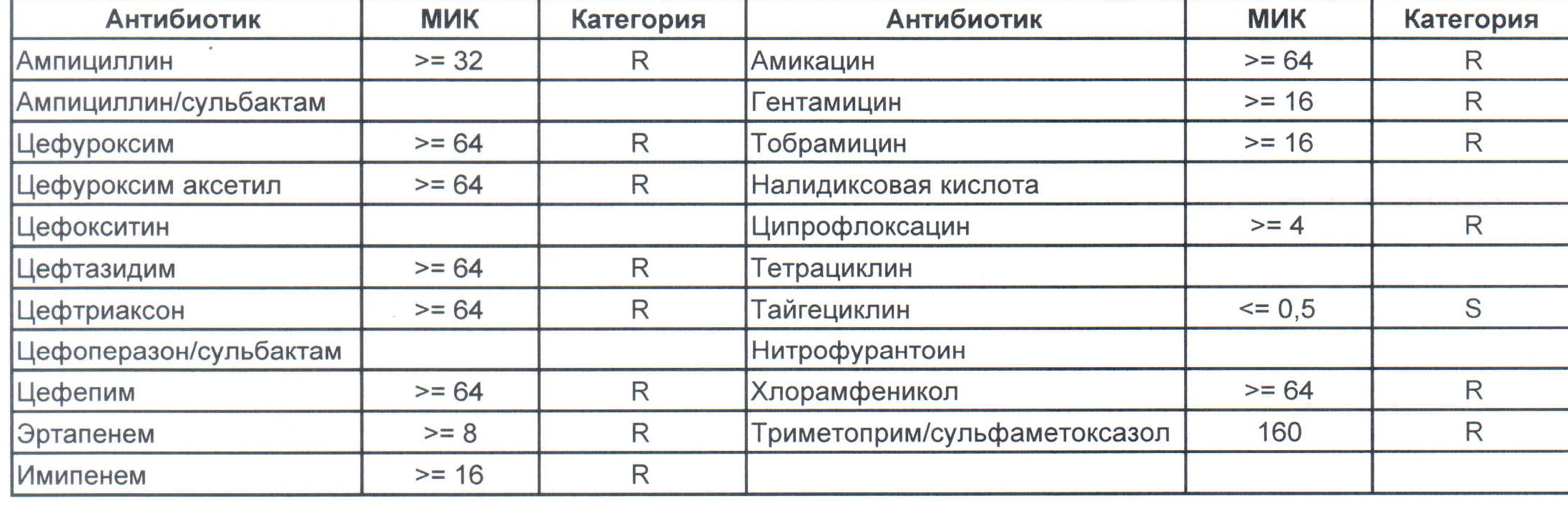
– мы видим практически неубиваемого зверя, который сам по себе вбивает тот самый последний гвоздь в гроб пациента. Но как же Тигециклин, спросите вы. Отвечу – тигацил является бактериостатиком, и пока он наберет необходимую силу, пациента уже отнесут и закопают. Но даже это еще не предел. Предел на следующем рисунке, и нет, Имипенем при указанной MIC уже бессилен:
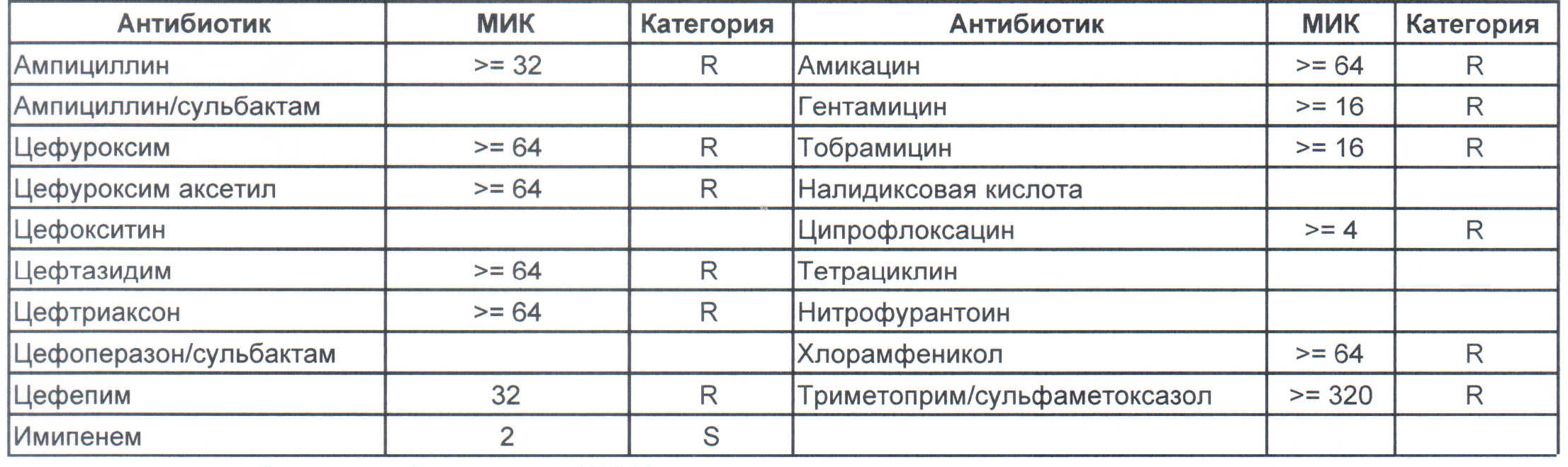
Чем лечить?
Дикая клебсиелла отлично лечится препаратами группы цефалоспоринов третьего ряда.
Ежегодно в США регистрируют около 1,7 млн случаев внутрибольничных инфекций, вызванных микроорганизмами, при этом 99 тыс. из них заканчиваются летально. В развитых странах Европы смертность от внутрибольничных инфекций составляет 25 тыс. случаев в год, из них две трети обусловлены грамотрицательными бактериями. В нашей стране внутрибольничные инфекции в два раза повышают риск летального исхода
Внутрибольничные инфекции
Изучение внутрибольничных инфекций (ВБИ) началось более 150 лет назад, но по-прежнему они остаются серьезной проблемой, приводя к удлинению сроков лечения, хронизации процесса, инвалидности, а в наиболее тяжелых случаях — к смерти больных. Согласно определению ВОЗ, внутрибольничными инфекциями считаются любые клинически выраженные заболевания микробного происхождения, поражающие больного в результате его госпитализации или посещения лечебного учреждения либо возникающие в течение 30 дней после выписки из больницы.
К внутрибольничным инфекциям также относятся инфицирование сотрудников больницы, связанное с их профессиональной деятельностью. Эти болезни отличаются механизмами и факторами передачи, особенностями течения эпидемиологического и инфекционного процессов, а также особой ролью медицинского персонала в возникновении, поддержании и распространении инфекции. Подобные инфекции могут быть обусловлены широким внедрением в практику инструментальных, эндоскопических, биохимических и других методов диагностики, которые сопряжены с нарушением целости покровов тела человека. Проблема в том, что конструкция некоторых медицинских приборов не позволяет произвести их полную стерилизацию после каждой процедуры, оставляя лазейку для проникновения нежелательных микробов во внутреннюю среду организма человека.
Агенты ВБИ
Всего насчитывается более 200 агентов, которые могут быть причиной внутрибольничных инфекций. До появления антибиотиков основными из них были стрептококки и анаэробные палочки. Однако после начала клинического применения антибиотиков возбудителями основных внутрибольничных инфекций стали ранее непатогенные или условно-патогенные микроорганизмы. К ним относятся стафилококки (Staphylococcus aureus, St. epidermidis, St. saprophiticus), стрептококки (Streptococcus spp.), энтерококки (Enterococcus faecalis, Enterococcus durans), эшерихия (Escherichia coli), клебсиелла (Klebsiella spp.), энтеробактер (Enterobacter spp.), протей (Proteus mirabilis), серрация (Serratia marcescens), псевдомонада (Pseudomonas aeruginosa). Нередко встречаются ВБИ, вызываемые Providencia spp., Stenotrophomona smaltophilia, Acinetobacter baumannii, Citrobacter spp., Clostridium difficile и другими микроорганизмами.
Всего насчитывается более 200 агентов, которые могут быть причиной внутрибольничных инфекций
Роль облигатно-патогенных микроорганизмов в развитии внутрибольничных инфекций невелика. В неинфекционных стационарах регистрируют несколько нозологических форм инфекций, вызванных возбудителями этой группы. К ним относятся вирусы гепатитов В, С, D, ВИЧ, гриппа и других ОРВИ, острых кишечных вирусных инфекций, герпеса, цитомегаловирусной инфекции, а также анаэробные клостридии и хламидии.
ВОЗ предупреждает
Эксперты ВОЗ совместно с отделом инфекционных заболеваний при Тюбингенском университете (Германия) назвали 12 бактерий, которые представляют наибольшую опасность для здоровья человека.
В первую критическую группу вошли Acinetobacter baumannii, Pseudomona saeruginosa и Enterobacteriaceae, которые часто выявляют в больницах и домах престарелых, причем заражение ими может привести к развитию смертельных инфекций, например пневмонии и заболеваний крови. Эти бактерии устойчивы к большинству антибиотиков, в том числе карбапенемам и цефалоспоринам.
Основные пути приспособления больничных штаммов — это устойчивость к одному или нескольким антибиотикам широкого спектра действия и снижение чувствительности к антисептикам
Во вторую группу списка ВОЗ включены Enterococcus faecium, Staphylococcus aureus, Helicobacter pylori, Campylobacter spp., Salmonellae и Neisseria gonorrhoeae. К третьей категории отнесены Streptococcus pneumoniae, Haemophilus influenzae и Shigella spp.
Госпитальные штаммы
Основные пути приспособления больничных штаммов — это устойчивость к одному или нескольким антибиотикам широкого спектра действия и снижение чувствительности к антисептикам. Госпитальные штаммы очень разнообразны, в каждой больнице или отделении возможно появление своего характерного штамма со свойственным только ему набором биологических свойств. При этом популяции возбудителей внутрибольничных инфекций отличаются не только гетерогенностью, но и динамичностью во времени.
Из больниц антибиотикорезистентные штаммы, особенно это касается грамотрицательных бактерий, постепенно начинают распространяться во внебольничную среду.
Эковары
Эковары — это варианты одного вида микроорганизма, которые приспособились к обитанию в определенной экосистеме. В данном случае выделяют больничные и внебольничные эковары. Больничными эковарами люди заражаются в основном во время инъекций, операций, переливания крови, гемосорбции, гемодиализа, мануальных и эндоскопических исследований и др.
Госпитальные инфекции, обусловленные внебольничными эковарами, часто возникают при нарушении целости покровов тела на фоне общего снижения иммунитета. Возбудители инфекций проникают во внутреннюю среду организма при повреждении слизистых оболочек, через ожоги, травматические раны, открытые гнойно-воспалительные очаги.
Устойчивые к большинству антибиотиков штаммы золотистого стафилококка (methicillinresistant Staphylococcus aureus — MRSA) стали настоящим бичом больниц. Несмотря на все усилия, ликвидировать инфекцию не удается
Больничные эковары способны вызывать госпитальную инфекцию не только при снижении функции иммунной системы, но и при нормальном иммунном ответе после инъекций или операций. Причем инфицирующая доза больничного эковара может быть относительно небольшой. Для появления инфекции, вызванной внебольничным эковаром, кроме снижения иммунитета, необходимо еще два условия: пассивное проникновение возбудителя во внешнюю среду организма и массивная инфицирующая доза.
Генетическая стабильность больничных инфекций Pseudomonas aeruginosa
Прежде считалось, что в больничной среде бактерии изменяются ускоренными темпами, увеличивая таким образом генетическое разнообразие внутрибольничной микрофлоры. Для изучения этого вопроса датские ученые проследили генетические изменения бактерии Pseudomonas aeruginosa, которые произошли с 70-х годов прошлого века в пределах одной из больниц Копенгагена. Для этого они использовали бактериальные штаммы, выделенные в анализах больных муковисцидозом, поскольку Pseudomonas aeruginosa является источником инфекций дыхательных путей, осложняя течение этой болезни.
Хирург и специалист по инфекционным заболеваниям Марк Шпигельман из Университетского колледжа в Лондоне считает, что повышенные требования к гигиене в хирургических клиниках парадоксальным образом способствуют распространению внутрибольничных инфекций
Один вариант штамма в течение 35 лет дал около 200 000 поколений, переходя от одного пациента к другому. В связи с высокой неоднородностью условий и длительным временем можно было бы ожидать широкой генетической диверсификации исходного штамма, но оказалось, что внутрибольничные инфекционные возбудители после периода быстрых адаптаций изменяются относительно мало, скорость мутирования у них низкая и расщепления на отдельные линии не происходит.
Эти наблюдения на первый взгляд кажутся противоречивыми, так как долгая эволюция в нестабильных условиях могла бы способствовать повышению генетического разнообразия. Тем не менее выяснилось, что, несмотря на то что внутренняя среда больного весьма неустойчива и разнородна из-за инфекций и постоянного лечения всевозможными препаратами, эта разнородность не способствует быстрому увеличению генетического разнообразия.
Clostridium difficile
Спорообразующая бактерия Clostridium difficile относится к стойким и трудноискоренимым возбудителям больничных инфекций. Заражение происходит через руки медицинского персонала, например, при измерении ректальной температуры, причем не помогает даже использование индивидуальных чехлов для датчиков.

У получавших антибиотики больных (даже однократно перед операцией) под влиянием токсинов Clostridium difficile возможно развитие псевдомембранозного колита, основным проявлением которого является диарея. У некоторых больных профузная диарея сопровождается интоксикацией, высокой лихорадкой, лейкоцитозом. Если пациент продолжает получать антибиотики вплоть до выписки, то псевдомембранозный колит может начаться дома.
MRSA — повод для изменений правил больничной гигиены
Устойчивые к большинству антибиотиков штаммы золотистого стафилококка (methicillinresistant Staphylococcus aureus — MRSA) стали настоящим бичом больниц. Несмотря на все усилия, ликвидировать инфекцию не удается. Вне больниц бактерия, как правило, теряет активность. Однако в последнее время все чаще отмечают случаи, когда инфекция выходит за пределы медицинских учреждений.
Хирург и специалист по инфекционным заболеваниям Марк Шпигельман из Университетского колледжа в Лондоне считает, что повышенные требования к гигиене в хирургических клиниках парадоксальным образом способствуют распространению внутрибольничных инфекций. При этом он указывает на два принципиальных факта, которые должны объяснить неэффективность борьбы с инфекцией в больницах. Во-первых, избыточные меры гигиены, применяемые в больницах, особенно в хирургических отделениях, уничтожают безвредные бактерии, создавая тем самым среду для заселения бактериями MRSA. Во-вторых, применение антибиотиков с гигиенической целью, в частности использование антибактериального мыла, не только приводит к появлению устойчивых к антибиотикам штаммов, но и активизирует защитные механизмы у бактерий, которые в менее агрессивной среде не действуют.
Как специалист по истории и развитию инфекционных заболеваний в древних человеческих популяциях Марк Шпигельман предлагает предпринять ряд мер по борьбе с инфекцией. Прежде всего надо строго разделить больницы, где используют антибиотики, от тех, где их не применяют (прежде всего это касается хирургических отделений). Разделение должно быть очень жестким. Персонал не должен совмещать работу в больницах разного типа.
В случае необходимости использовать антибиотики в клинике, где они запрещены, больного следует перевести в другое медицинское учреждение. Кроме того, выдвинуто неожиданное предложение по изменению гигиенических процедур. Предлагается вместо антибиотиков при подготовке к операции использовать пробиотики, которые помогут противостоять болезнетворным бактериям.
Важнейшая тема – как для нас, врачей, так и для наших пациентов – внутрибольничное инфицирование, точнее, методы его профилактики. Поговорим об этом более подробно.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: врач – клинический фармаколог Трубачева Е.С.

Давайте посмотрим на проблему более конкретно, тем более, что от нее напрямую зависит жизнь самых тяжелых и сложных пациентов. Предупредим сразу, теоретическую часть вопроса вы можете прочитать в огромном количестве публикаций научного и научно-популярного характера. Мы поговорим как врачи-практики, что и откуда берется, и как от этого избавиться.
Итак, первое и основное, что уже неоднократно сказано, но что необходимо запомнить, – МИКРОБЫ, ВЫЗЫВАЮЩИЕ ВБИ, НЕ УМЕЮТ НИ ЛЕТАТЬ, НИ ХОДИТЬ, НИ ПОЛЗАТЬ, и оказываются в организме пациента только с нашей медицинской помощью, потому эти состоянии и названы – инфекции, связанные с медицинским вмешательством. А под вмешательством может рассматриваться вообще любое действие с пациентом – перевязка, установка зонда или дренажа, отсасывание мокроты, эндоскопические манипуляции и т.д. и т.п.
Кто более других подвержен рискам ВБИ?
- Соматически тяжелые пациенты
- Пациенты с сопутствующими заболеваниями
- Дети и пожилые пациенты
- Все, вне зависимости от возраста, ранее получавшие антибиотики или находившиеся по любому поводу в ОРИТ, ПИТ или просто в стационаре (если это только не ваше отделение, и вы точно знаете, что с ним происходило)
- Пациенты, переведенные из других ЛПУ (на них обычно просто лютый зоопарк всего, и они опасны не только сами для себя, но еще и для всех остальных пациентов не только отделения, но и вообще больницы)
Какие ЛПУ и отделения наиболее рискованны по ВБИ?
- Стационары, выстроенные в виде единого здания, либо имеющие общие переходы. В больницах, выстроенных в виде отдельных, несообщающихся корпусов, поддерживать cанэпидрежим и режим нераспространения ВБИ несопоставимо проще.
- Стационары, в которых гнойные отделения находятся в одном здании с чистыми, – тут можно убиться вусмерть, но синегнойку с ацинеткой вывести будет невозможно в принципе, если только не обстраивать классический санпропускник на входе и выходе из гнойных в чистые.
- Стационары, чьи отделения не имеют палат-изоляторов. Можно опять же расшибиться в лепешку, но если вы не можете изолировать пациента с устойчивой микрофлорой от остальных, эти самые все остальные и полягут.
- Самыми опасными же являются отделения реанимации и ПИТЫ, ввиду высочайшего процента использования антибиотиков, кроме того, онкологические и онкогематологические отделения, гнойные же отделения скорее опасны для чистых, чем сами для себя.
- Вообще, любой стационар с отсутствующим микробиологическим мониторингом, без собственной бак. лаборатории и службы эпиднадзора в виде эпидемиологов и натасканного на тему клинического фармаколога, – это не самое лучшее место для того, чтобы там оказаться в качестве пациента, тем более врачу (вы же помните, что в каждом из нас свой зоопарк?)
Что делать?
1. Мыть руки. Нет, даже вот так – МЫТЬ РУКИ – и делать это правильно. Методику мытья вы все прекрасно знаете. Если не знаете – берите СанПин и внимательно его изучайте по всем пунктам:
12.4. Гигиеническая обработка рук
12.4.1. Гигиеническую обработку рук следует проводить в следующих случаях:
- перед непосредственным контактом с пациентом;
- после контакта с неповрежденной кожей пациента (например, при измерении пульса или артериального давления);
- после контакта с секретами или экскретами организма, слизистыми оболочками, повязками;
- перед выполнением различных манипуляций по уходу за пациентом;
- после контакта с медицинским оборудованием и другими объектами, находящимися в непосредственной близости от пациента;
- после лечения пациентов с гнойными воспалительными процессами, после каждого контакта с загрязненными поверхностями и оборудованием.
12.4.2. Гигиеническая обработка рук проводится двумя способами:
- гигиеническое мытье рук мылом и водой для удаления загрязнений и снижения количества микроорганизмов;
- обработка рук кожным антисептиком для снижения количества микроорганизмов до безопасного уровня.
12.4.3. Для мытья рук применяют жидкое мыло с помощью дозатора (диспенсера). Вытирают руки индивидуальным полотенцем (салфеткой), предпочтительно одноразовым.
12.4.4. Гигиеническую обработку рук спиртосодержащим или другим разрешенным к применению антисептиком (без их предварительного мытья) проводят путем втирания его в кожу кистей рук в количестве, рекомендуемом инструкцией по применению, обращая особое внимание на обработку кончиков пальцев, кожи вокруг ногтей, между пальцами. Непременным условием эффективного обеззараживания рук является поддержание их во влажном состоянии в течение рекомендуемого времени обработки.
12.4.5. При использовании дозатора новую порцию антисептика (или мыла) наливают в дозатор после его дезинфекции, промывания водой и высушивания. Предпочтение следует отдавать локтевым дозаторам и дозаторам на фотоэлементах.
12.4.6. Кожные антисептики для обработки рук должны быть легко доступны на всех этапах лечебно-диагностического процесса. В подразделениях с высокой интенсивностью ухода за пациентами и с высокой нагрузкой на персонал (отделения реанимации и интенсивной терапии и т.п.) дозаторы с кожными антисептиками для обработки рук должны размещаться в удобных для применения персоналом местах (у входа в палату, у постели больного и др.). Следует также предусматривать возможность обеспечения медицинских работников индивидуальными емкостями (флаконами) небольших объемов (до 200 мл) с кожным антисептиком.
12.4.7. Использование перчаток.
12.4.7.1. Перчатки необходимо надевать во всех случаях, когда возможен контакт с кровью или другими биологическими субстратами, потенциально или явно контаминированными микроорганизмами, слизистыми оболочками, поврежденной кожей.
12.4.7.2. Не допускается использование одной и той же пары перчаток при контакте (для ухода) с двумя и более пациентами, при переходе от одного пациента к другому или от контаминированного микроорганизмами участка тела к чистому. После снятия перчаток проводят гигиеническую обработку рук.
12.4.7.3. При загрязнении перчаток выделениями, кровью и т.п. во избежание загрязнения рук в процессе их снятия следует тампоном (салфеткой), смоченным раствором дезинфицирующего средства (или антисептика), убрать видимые загрязнения. Снять перчатки, погрузить их в раствор средства, затем утилизировать. Руки обработать антисептиком.
Руки под перчатки надо мыть! Ибо они имеют свойство рваться, причем в самый неподходящий момент. Потом будете следователю долго объяснять, как вы торопились и вообще никогда такого не было, а тут… Лучше все-таки до автоматизма отработать навык, чем потом расхлебывать его отсутствие.
3. Регулярно терзать эпидемиологическую службу на предмет результатов мониторингов или служебок по расходникам и т. п. Не все же им вас терзать. Приставать лучше всего письменно, чтобы следы этих приставаний оставались, они могут очень сильно пригодиться в будущем.
4. Ну и учиться, учиться и еще раз учиться. Или менять специальность, так как к огромному сожалению все, что связано с медициной, особенно критических состояний, стало слишком опасным.
Но несмотря на такой невеселый разговор, автор и редакция Видаль от всей души хотела бы поздравить Вас с наступающим 2020 годом и выражает надежду, что наш цикл стал полезной частичкой уходящего 2019 года.
Этой статьей мы начинаем рассмотрение представителей микробиологического мира, с которыми чаще всего встречаем в ежедневной клинической практике, и темой сегодняшнего разговора будет кишечная палочка, она же Escherichia coli (E.coli).
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С.,
врач – клинический фармаколог
Этой статьей мы начинаем рассмотрение представителей микробиологического мира, с которыми чаще всего встречаем в ежедневной клинической практике, и темой сегодняшнего разговора будет кишечная палочка, она же Escherichia coli (E.coli).
Микробиологические аспекты
E.coli относится к типичным представителям семейства Enterobacteriaceae, являясь грамотрицательной бактерией, факультативным анаэробом в составе нормальной кишечной микрофлоры человека. Но тут же становится патогеном, выбравшись из среды нормального обитания, хотя отдельные штаммы являются патогенными и для желудочно-кишечного тракта. То есть кишечная палочка относится к кишечным комменсалам, кишечным патогенам и внекишечным патогенам, каждый из которых мы кратко разберем.
К штаммам E.coli, действующим как кишечные патогены и встречающимся чаще других, относятся:
- Штамм серотипа O157:H7 (STEC O157) или так называемый энтерогеморрагический штамм E.coli, который является причиной 90% случаев геморрагических колитов и 10% случаев гемолитико-уремического синдрома. Встречается достаточно часто, а если вы работаете в стационарах плановой помощи, то это один из обязательных анализов для принятия решения о госпитализации, так что так или иначе он на слуху. Проблема инфицирования этим возбудителем связана с употреблением плохо термически обработанной пищи и передачи штамма контактным путем от человека к человеку, проще говоря, через руки.
- Второй крайне опасный высоко-патогенный штамм кишечной палочки – O104:H4, вызвавший в Германии 2011 году эпидемию с высоким уровнем смертности среди пациентов с пищевыми токсико-инфекциями вследствие развития гемолитико-уремического синдрома. Если помните, это была очень громкая история с перекрытиями границ для испанских огурцов, потом вообще для всей плодоовощной продукции из Европы в Россию, пока искали хотя бы источник, не говоря уж о виновнике тех событий. Окончательно виновными тогда были обозначены листья салата, в поливе которых использовалась вода с признаками фекального заражения, а затем речь пошла уже о пророщенных семенах, которые так же полили фекально-зараженной водичкой. Так вышли на конкретный штамм E.coli – O104:H4, который, подвергшись санации антибиотиком, выплескивает эндотоксин, вызывающий гемолиз и острую почечную недостаточность. В итоге – массовая летальность пациентов, получавших антибиотики.
Затем тот же штамм обнаружился при вспышке ПТИ в Финляндии, но к тому времени пациентов с диареями до появления микробиологических результатов перестали лечить бактерицидными антибиотиками и ситуация была купирована в зародыше.
И третий громкий (для нашей страны) случай – это массовое заболевание питерских школьников в Грузии, где так же был выявлен этот штамм (пресс-релиз Роспотребнадзора по данному случаю лежит здесь).
Когда кишечная палочка выступает внекишечным патогенном? Почти всегда, когда обнаруживается вне места своего нормального обитания.
- Заболевания мочевыводящий путей. Здесь E.coli является абсолютным лидером и играет ведущую роль в развитии:
- Острых циститов
- Пиелонефритов
- Абсцессов почек и
- Простатитов
Этот факт объясняется близким анатомическим расположением двух систем и огрехами в личной гигиене, что позволяет на этапе эмпирической терапии вышеперечисленных заболеваний сразу же назначать препараты, активные в отношении кишечной палочки.
- Заболевания желудочно-кишечного тракта:
- Диарея путешественников
- Интраабдоминальные абсцессы и перитониты, чаще всего носящие вторичный характер (прободение кишки в результате первичного заболевания, либо при дефектах оперативного вмешательства)
- Инфекции центральной нервной системы у очень ослабленных пациентов, результатом чего будет развитие менингитов. Встречается в основном у лиц старческого возраста и новорожденных. Кроме того, в случае внутрибольничного заражения менингит может развиться в результате плохой обработки рук медицинского персонала перед оперативным вмешательством или перевязками.
- Инфекции кровотока, а именно сепсис, как продолжение развития заболеваний мочевыводящих путей, ЖКТ и билиарного тракта вследствие метастазирования очага инфекции. Лечению поддается крайне тяжело, особенно если задействованы внутрибольничные штаммы, летальность чрезвычайно высокая.
- Инфекции кожи и мягких тканейкак следствие раневых инфекций после вмешательств на органах брюшной полости.
- Внутрибольничные пневмонии, вызванные устойчивыми штаммами кишечной палочки, целиком связаны с дефектами ухода за пациентом и фактором чистоты, точнее ее отсутствия, рук медицинского персонала или ухаживающих родственников. Факт внутрибольничного заражения доказывается элементарно, что будет наглядно продемонстрировано в следующем разделе.
- Послеродовые (и не только) эндометриты. Вынуждены упомянуть и эту патологию, так как инфицирование кишечной палочкой встречается все чаще и чаще, а большой настороженности нет. Как результат, можно очень сильно промахнуться с антибактериальной терапией и, как следствие, прийти к экстирпации органа в виду неэффективности антибиотикотерапии. Натолкнуть на мысль может более позднее, чем обычно, поступление и более агрессивное, чем обычно течение. Дополнительный осмотр прианальной области так же может натолкнуть на вероятность развития именно такого инфицирования.
(часть вторая) Практические вопросы диагностики и лечения.
Когда мы можем заподозрить, что перед нами пациент с инфекцией, вызванной кишечной палочкой?
- Пациенты с диареей, приехавшие из отпуска и все-таки смогшие прийти на прием (диарея путешественников или энтеротоксигенные штаммы E.coli).
- Пациенты со всеми заболеваниями мочевыделительной системы, в том числе беременные, но строго с наличием симптоматики (не надо лечить бессимптомную бактериурию, иначе вырастите резистентные штаммы и создадите проблему и себе, и женщине, и роддому в последующем).
- В стационарах – нозокомиальные пневмонии, послеоперационные менингиты, перитониты, сепсисы и т. д., носящие вторичный характер.
Подтвердить или полностью исключить кишечную палочку из возбудителей может только микробиологическое исследование. Конечно, в современных условиях микробиология уже становится практически эксклюзивом, но мы пришли учиться, а учится надо на правильных примерах, поэтому далее будет рассмотрен ряд антибиотикограмм, выполненных автоматизированными системами тестирования. Вдруг вам повезет, и в вашем лечебном учреждении все уже есть или в ближайшее время будет, а вы уже умеете с этим всем работать?
Если вы читаете данный цикл по порядку, то в базовом разделе по микробиологии был выложен ряд антибиотикограмм некоего микроорганизма в контексте нарастания антибиотикорезистентности, и это была наша сегодняшняя героиня – кишечная палочка.
- Начнем с дикого и крайне симпатичного штамма E.coli, который живет в кишечнике и обеспечивает синтез витамина К. С ним сталкиваются доктора амбулаторной службы у пациентов с инфекциями мочевыводящих путей или в случае госпитализации у пациентов, которые не получали антибиотики около года. И именно такую чувствительность мы имеем в виду, когда назначаем эмпирическую антибиотикотерапию
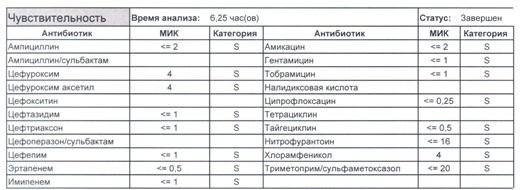
- Как видите, зверь чувствителен абсолютно ко всему, и это как раз тот случай, когда можно свободно пользоваться табличными материалами справочников или клинических рекомендаций, так как механизмы резистентности полностью отсутствуют.
- Если в ваши руки попал пациент, которого в течение последнего полугодия лечили антибиотиками пенициллинового ряда, то антибиотикограмма может выглядеть следующим образом.
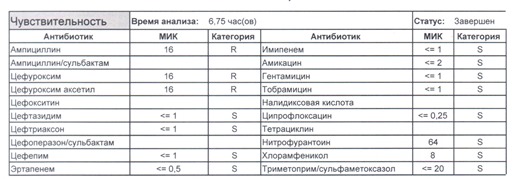
Если такая кишечная палочка окажется внекишечным патогенном, и перед вами будет беременная и ИМП (самый частый случай), то нам необходимо преодолеть резистентность к пенициллинам, то есть подавить деятельность пенициллиназ. Соответственно высокую эффективность продемонстрируют препараты с ингибиторами бета-лактамаз, чаще всего амоксициллина/клавуланат, как наиболее безопасный и эффективный. Единственное, пациентку необходимо предупредить, что в результате стимуляции рецепторов кишечника может развиться антибиотик-ассоциированная диарея.
- Отдельно хотелось бы обратить внимание на следующий штамм E.coli, как типичного обладателя бета-лактамаз расширенного спектра. И эти БЛРС чаще всего вырабатываются в результате неуемного использования цефалоспоринов третьего поколения и совершенно конкретного его представителя – цефтриаксона.
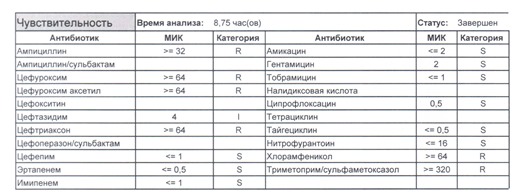
В каких ситуациях мы можем увидеть (или подумать) о таком звере:
- Пациент сам рассказывает, что получал цефтриаксон в промежутке полугодия
- Пациент был переведен из другого стационара (хотя там можно будет и следующую картинку обнаружить)
- Пациент ничего не получал, и вообще в больнице не лежал, но возбудитель попал с рук медицинского персонала, вызвав внутрибольничную инфекцию
- И самый простой случай – посев был взят в момент проведения терапии цефтриаксоном
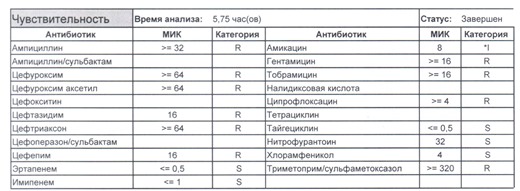
Подобный пациент не придет к вам своими ногами, его не увидит амбулаторная служба, это абсолютно стационарные больные, и если их привезут, то только из другого лечебного учреждения. Чаще всего это пациенты палат интенсивной терапии или реанимации, и такой возбудитель носит на 100% нозокомиальный характер.
Когда можем его обнаружить:
- вторичные перитониты,
- нозокомиальные пневмонии,
- пиелонефриты,
- послеоперационные менингиты,
- сепсис и т. п.
- Для эрадикации такого возбудителя нужен не просто отдельный обученный специалист и имеющая весь набор препаратов резерва аптека, но и напряженная работа эпидемиологической службы, так как подобный пациент должен быть изолирован в отдельную палату, а лучше изолятор (не подумайте, что бред – при правильной организации такие вещи вполне реальны) с проведением карантинных мероприятий, так как основная проблема появления подобного рода возбудителей в том, что они очень быстро разбегаются по всему корпусу (или стационару, если корпуса не изолированы) и обсеменяют все и вся, нанося вред другим ослабленным тяжелой болезнью пациентам и заселяя кишечники всего медицинского персонала.
- И еще одно крайне мерзкое свойство таких возбудителей – они умеют осуществлять горизонтальный перенос механизмов резистентности с другой флорой семейства Enterobacteriaceae, и даже если вы избавились от E.coli, неприятным сюрпризом может стать ее подруга клебсиелла, наносящая еще больший вред и по сути добивающая больного. Избавится полностью от этих возбудителей невозможно, для этого надо избавится от медицинского персонала как основных носителей, но контролировать можно – мероприятия подробно расписаны в действующих СанПиН 2.1.3.2630-10. Так что в случае выявления подобного возбудителя речь пойдет не только о лечении того пациента, у которого он обнаружен, но и проведения мероприятий по недопущению инфицирования всех остальных пациентов (а это, напомню, почти всегда ПИТ или ОРИТ), находящихся рядом.
- И в заключение необходимо упомянуть о панрезистентной E.coli, вооруженной полным спектром механизмов резистентности. В антибиотикограмме будут тотальные R, а МПК возбудителей пробьют все возможные потолки. К счастью для автора, она с таким зверем пока не сталкивалась, что связано с наличием работающей системы эпиднадзора, поэтому картинки не будет, хотя ее несложно представить. Такие пациенты, если кишечная палочка окажется патогеном, а не колонизатором (мало ли с чьих рук, например, в рану упала), к сожалению, почти не выживают, так как изначально являются крайне тяжелыми соматически, а кишечная палочка обычно подводит черту к их существования на бренной земле.
- Не допускать развития такой, не побоюсь этого слова, зверюги в ваших стационарах, а если появилась – гонять эпидемиологическую службу, чтобы избавляла руки и поверхности от такого рода заражения, что возможно только при условии наличия достаточного количества расходных материалов, перчаток и дезинфицирующих средств.
А теперь подведем небольшой итог нашего непростого разговора:
- Кишечная палочка – возбудитель очень серьезный и не следует его недооценивать. В ее типах также необходимо четко ориентироваться.
- В первую очередь о ней мы думаем при лечении инфекций мочевыводящих путей, особенно у беременных.
- Если перед нами пациент с признаками кишечной инфекции, то подход к терапии антибиотиками должен быть сугубо индивидуальным, и если состояние позволяет, то до получения микробиологии – вообще без антибиотиков. Если не позволяет – это должны быть бактериостатики.
- Мы никогда не лечим только анализ, и даже микробиологическое заключение, мы всегда лечим пациента со всем комплексом его симптомов и синдромов. Но микробиология помогает решить как дифференциально-диагностические задачи, что и позволяет отделить безусловный патоген от мирно живущего комменсала.
- Микробиологическая диагностика носит ключевое значение как для подтверждения самого возбудителя, так и для выбора необходимого антибиотика
- В случае выявления резистентных и панрезистентных возбудителей, помимо лечения самого пациента должна в полной мере задействоваться эпидемиологическая служба лечебного учреждения

В последние годы инфекционисты отмечают рост заболеваний, обусловленных нетрадиционными микроорганизмами. Особое место занимает протейная инфекция. Ее кишечная форма, вызванная бакетриями рода Протей — P. vulgaris протекает тяжелее у детей раннего возраста. Не менее опасны гнойно-воспалительные заболевания мочевыводящей системы, вызываемые P. mirabilis, P. rettgeri и P. morganii.
В греческой мифологии Протей – божество, способное менять облик. Отсюда название полиморфных, мелких, нитевидных палочек, отличающихся активной подвижностью. Размеры клеток составляют 0,5 — 3 мкм. P. morganii, P. rettgeri — менее полиморфны и малоподвижны.
Протейная инфекция: причины, развитие, опасность для организма
Возбудителями протейной инфекции являются грамотрицательные условно-патогенные микроорганизмы семейства энтеробактерий, которые присутствуют в нормальной микрофлоре кишечника, а также повсеместно распространены в воздухе, почве и воде. Бактерии рода Proteus в течение долгого времени не причислялись к возбудителям серьезных инфекционно-воспалительных заболеваний. Однако в связи с последними достижениями в области диагностики было обнаружено, что эти микроорганизмы способны вызывать трудно поддающиеся лечению патологии (протеозы), поражающие преимущественно ЖКТ и мочеполовую систему.
Протей – факультативный анаэроб, палочковидная, неспороносная, подвижная, грамотрицательная бактерия. В микробиологическом анализе кала протей встречается в комплексе с другими условно-патогенными бактериями семейства энтеробактерий. Кроме протея, в составе нормальной микрофлоры кишечника человека определяются: клебсиелла, энтеробактер, гафния, серратия, морганелла, провиденция, цитробактер. В 1 г кала должно быть меньше 10 4 общего количества этих бактерий. Большее количество перечисленных бактерий является признаком дисбактериоза.
В природе бактерии рода Proteus обнаруживаются: в сточных водах, в земле, в водоемах, на овощах, в разлагающихся органических веществах. Эти микроорганизмы — сапрофиты, они живут на слизистых оболочках, на коже, в кишечнике человека и животных. Протеи устойчивы во внешней среде и сохраняют жизнедеятельность в слабых растворах фенола и других средств. Выявлена также резистентность ко многим антибиотикам.
Причины протейной инфекции
Протейная палочка, присутствующая в кишечной микрофлоре в небольших количествах, не причиняет организму никакого вреда. При определенных обстоятельствах (снижение иммунитета, неправильное питание, длительный прием антибиотиков) она может активизироваться и начать интенсивно размножаться. Также инфицирующее количество этих бактерий способно проникнуть в организм из внешней среды.
Основными путями передачи инфекции являются пищевой и контактно-бытовой. Чаще всего заражение происходит при употреблении белковых продуктов (мяса, рыбы, молока, колбасы), которые хранились с нарушением надлежащих сроков и условий. Значительно реже инфицирование осуществляется через немытые руки, во время купания или при употреблении зараженной воды.
Инфицирование протеем может произойти через полуфабрикаты, сырые продукты или готовые блюда из мяса, рыбы, молока, колбасы, студня. В них происходит быстрое размножение бактерий с образованием токсинов. Реже отмечают водный путь передачи: при купании в загрязненных водоемах или употреблении инфицированной воды. Возможен и контактный путь передачи на инфицированных руках зараженного человека.
Развитие патологии
При непосредственном попадании протея в ЖКТ вместе с продуктами питания инфекционное заболевание развивается очень стремительно. Первые симптомы ярко выражены, а общая клиническая картина совпадает с проявлениями сильного пищевого отравления. При контактно-бытовом способе заражения развитие признаков инфекции обычно происходит медленнее.
Если инфекционный процесс протекает в легкой форме, больной испытывает слабость, у него отмечаются повышение температуры, рвота, боль в животе, частый водянистый стул, в котором могут обнаруживаться слизь и зеленые включения. При тяжелом течении заболевания приступы рвоты случаются около 10 раз за сутки и более, а температура обычно поднимается до 40°С.
При условии своевременного и адекватного лечения вся острая симптоматика протеоза легкой или средней степени тяжести исчезает спустя несколько дней, после чего больной быстро идет на поправку.
Протеи выделяют токсические вещества — эндотоксины с гемолитическими свойствами и с различной степенью биохимической активности. У штаммов P. vulgaris обнаружена лецитиназная активность. Протеи обладают способностью адгезии к уротелию при помощи ресничек. Отмечают, что резистентность к антибиотикам связана с адгезивной способностью уропатогенных протеев.
Острой кишечной протейной инфекцией, протекающей по типу гастроэнтерита, гастрита и колиэнтерита часто болеют дети раннего возраста с пониженным иммунитетом и после бесконтрольного назначения антибиотиков. Заболевание сопровождается симптомами токсикоза — повышением температуры, рвотой, метеоризмом, схваткообразными болями в животе, нарушением аппетита, кратковременными судорогами, появлением водянистого, зловонного, учащенного стула.
В тяжелых случаях могут развиться осложнения: гемолитико-уремический синдром, а также симптомы острой гемолитической тромбопении, анемии или острой почечной недостаточности.
Клинические проявления внутрибольничной инфекции протейной этиологии весьма разнообразны: поражения мочевыводящей системы, отиты, холециститы, нагноения ран и септические состояния. Попадание протеев в пупочную ранку новорожденного может привести к бактериемии или развитию менингита.
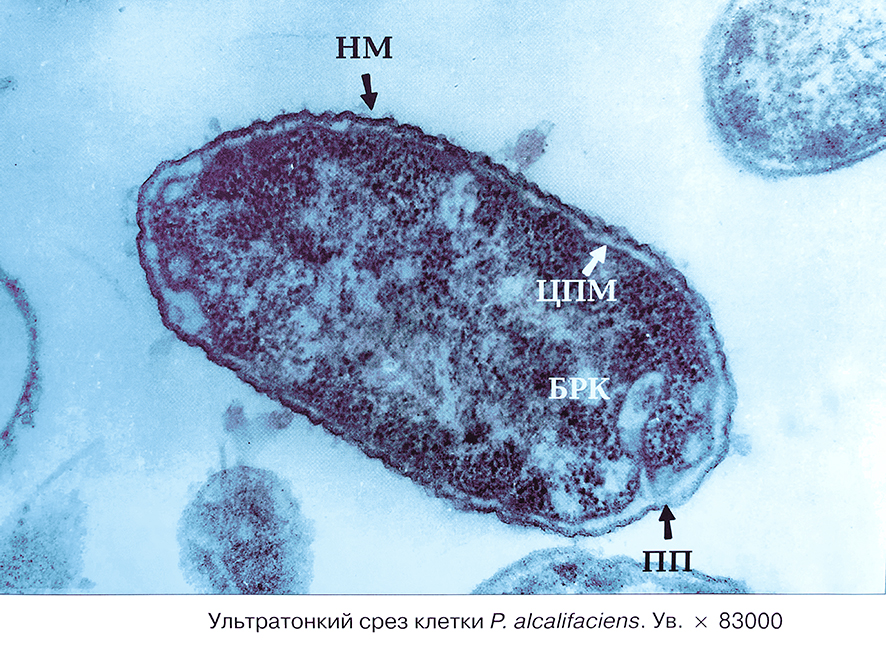
Данные заболевания могут развиться: при передаче возбудителя контактно-бытовым или воздушно-капельным путями, при заносе с катетером, другими урологическими инструментами.
Ультратонкий срез клетки Proteus alcalifaciens. Увеличение *83000
Если в мазках исследуемого материала (участки ожоговой ткани, гной, раневое отделяемое, испражнения) обнаруживаются грамотрицательные палочки, то бактериоскопический метод позволяет сделать предварительное заключение. Бактериологическим методом на средах определяют колонии протея в виде тонкого стелющегося налета. Активно размножаются протеи на белковой питательной среде вызывают гниение мяса, рыбы, других белковых продуктов.
Важнейшие профилактические меры — это соблюдение санитарного режима в детских учреждениях и стационарах, проведение общесанитарных мероприятий. Для профилактики протея каждому необходимо соблюдать правила личной гигиены, исключить потребление подозрительных продуктов в питании, избегать контактов с больными детьми и взрослыми.
При лечении протейной инфекции следует придерживаться лечебной щадящей диеты с исключением жареных, острых блюд, белковых продуктов. В острый период протейного инфицирования, при поражении желудочно-кишечного тракта — необходимо обеспечить восполнение потерянной жидкости. Полезно употреблять отвары трав – тысячелистника, алтея, зверобоя, ромашки, календулы; морсы, компоты с клюквой, черной смородиной, абрикосами, черникой, яблоками. Применять антибиотики можно только по назначению врача, в соответствии с данными анализов чувствительности бактерии протея к ним.
Обязательно нужно принимать препараты – пробиотики, пребиотики, синбиотики для восстановления нормальной флоры кишечника.
Синбиотические комплексы Нормофлорины, содержащий живые активные лакто- и бифидобактерии, секретирующие молочную, уксусную, масляную, пропионовую кислоты, оказывающие защитное, антисептическое, противовоспалительное, сорбционное действие – уменьшает интоксикацию, улучшает моторику кишечника, функцию печени, повышает иммунную реактивность. Это помогает в борьбе с протейной инфекцией, восстанавливает работу желудочно-кишечного тракта, общее самочувствие, повышает иммунитет.
Схема (возрастные дозировки для детей или взрослых): (взрослый) нормофлорин Л – 20 мл (при диарее) – 40 (при запорах) мл утром перед едой, Д — 40 мл вечером за 20 мин до еды, Б – 20-30 мл на ночь в клизме. При диарее в обед можно добавить Д – 30-40 мл, при запорах в обед + Л – 30-40 мл.
Курс приема нормофлоринов — 1 — 1,5 месяца, для выведения токсинов, патогенной микрофлоры, восстановления полезных собственных бактерий. Уникальный состав нормофлоринов, не содержащих белков коровьего молока, молочного сахара, консервантов позволяет при протейной инфекции успешно применять его у детей с первых дней жизни, беременных, кормящих, больных сахарным диабетом, аллергическими заболеваниями, т.е. у взрослых при любой сопутствующей патологии.
Опасность протейной инфекции

Протейная инфекция
Тяжелые формы патологии могут осложняться состояниями, требующими срочной госпитализации больного, такими как сильное обезвоживание, судороги, инфекционно-токсический шок.
protey_mirabilis
Помимо острых инфекций пищеварительной системы бактерии Proteus способны поражать другие органы, распространяясь через кровь или по лимфатическим сосудам. Очаг воспаления может локализоваться в мочеполовой системе, глазах, ушах, легких и даже в костной ткани или мозговых оболочках. Данные патологии достаточно часто переходят в хроническую форму с упорным рецидивирующим течением, которая тяжело поддается терапии.
Если протейная инфекция заносится на незажившие поверхности кожи и слизистых оболочек (послеоперационные раны, ожоги), вызванный ею воспалительный процесс значительно замедляет регенерацию тканей и снижает эффективность лечебных мероприятий.
Следует отметить, что даже незначительное превышение нормального количества протейной палочки в кишечной микрофлоре может негативно отразиться на состоянии здоровья. Так, если у человека имеются аутоиммунные болезни, существует высокий риск их обострения из-за возросшей активности протейной палочки. Атопический дерматит, астма, аллергические заболевания и другие иммунозависимые патологии могут впервые развиться или обостриться под воздействием бактерий Proteus.
Читайте также:

