Комиссия по гриппозным вакцинным и
Обновлено: 12.05.2024
Для цитирования: Малахов А.Б., Дронов И.А. Иммунопрофилактика гриппа в свете нового российского национального календаря профилактических прививок. РМЖ. Медицинское обозрение. 2014;22(31):2207.
Грипп – острая вирусная инфекция, характеризующаяся явлениями выраженной интоксикации и поражением респираторного тракта. Грипп является высококонтагиозным антропонозом с воздушно-капельным путем передачи. Возбудители гриппа – РНК-содержащие вирусы из семейства ортомиксовирусов. В настоящее время известны 3 типа вируса гриппа: А, В и С. Вирусы содержат различные антигены: внутренний S-антиген включает РНК и вирусный белок, поверхностный V-антиген – гемагглютинин (H) и нейраминидазу (N). Для вируса гриппа типа А, в отличие от типов В и С, характерно быстрое изменение поверхностного антигена с образованием новых подтипов и штаммов вируса, которые вызывают массовые и тяжелые эпидемии заболевания. С вирусом гриппа типа В, как правило, связаны лишь редкие локальные эпидемии, а типа С – только спорадические случаи заболевания. После перенесенного гриппа формируется стойкий иммунитет, однако он носит типо- и штаммоспецифический характер, что обусловливает повторные случаи заболевания [1, 2].
Грипп занимает особое место среди ОРВИ в связи с его широким повсеместным распространением, более тяжелым течением и более высоким риском неблагоприятного исхода. Наиболее восприимчивы к гриппу дети раннего возраста (со 2-го полугодия жизни), еще не имеющие собственных антител к вирусу, а также лица после 65 лет, у которых утрачиваются накопленные за жизнь антитела к разным антигенным вариантам вируса. Повышенный уровень заболеваемости гриппом наблюдается у лиц, в силу профессиональной деятельности имеющих широкий круг контактов – медицинские работники, педагоги, работники общественного транспорта и коммунальных служб [3].
В большинстве случаев грипп имеет благоприятный исход, и заболевание разрешается в пределах 2-х нед. В то же время, с гриппом связан целый ряд серьезных проблем, представляющих угрозу для жизни пациента:
– ухудшение течения хронических заболеваний (сердечно-сосудистых, бронхолегочных и др.);
– развитие первичной вирусной или вторичной бактериальной пневмонии;
– развитие серьезных осложнений – энцефалопатия, поперечный миелит, синдром Рейе, миозит, миокардит, перикардит и др. [1–4].
ВОЗ выделяет следующие основные положения относительно гриппа:
• Грипп – это острая вирусная инфекция, легко передающаяся от человека к человеку.
• Грипп циркулирует во всем мире, и им может заболеть любой человек из любой возрастной группы.
• Грипп вызывает ежегодные сезонные эпидемии, пик которых в районах с умеренным климатом приходится на зиму.
• Грипп представляет собой серьезную проблему общественного здравоохранения, т. к. вызывает тяжелые заболевания и приводит к смертельным исходам в группах населения повышенного риска.
• Эпидемия может оказывать негативное воздействие на экономику в связи со снижением производительности трудовых ресурсов и создавать чрезмерную нагрузку для служб здравоохранения.
• Для лечения имеются противовирусные препараты, однако у вирусов гриппа может развиваться устойчивость к лекарствам.
• Вакцинация – это самый эффективный путь профилактики инфекции [5].
Вакцинация – это наиболее экономичная медицинская технология, направленная на специфическую профилактику возникновения и распространения инфекционного заболевания. Считается, что по силе влияния на снижение смертности населения массовая вакцинация оказала воздействие, сопоставимое только с чистой питьевой водой [4]. Внедрение массовой иммунизации позволило в 1970-е гг. полностью ликвидировать натуральную оспу в мире, что дало возможность отменить прививку. Также к достижениям вакцинопрофилактики относятся ликвидация полиомиелита и врожденной краснухи в подавляющем большинстве стран мира, значительное снижение заболеваемости корью, дифтерией, коклюшем, столбняком, эпидемическим паротитом, существенное снижение смертности от туберкулеза в детском возрасте. Наибольшая медицинская и экономическая эффективность достигается при проведении массовой вакцинации [3, 4].
Национальный календарь профилактических прививок – основной нормативный документ, согласно которому реализуется государственная программа иммунопрофилактики – определяются сроки вакцинации и ревакцинации и прочие регламентирующие положения. Изменяющаяся эпидемическая обстановка в различных регионах мира, развитие системы здравоохранения, разработка новых иммунобиологических препаратов диктуют необходимость регулярного обновления национальных календарей профилактических прививок и внедрения программ иммунизации в различных странах. В 2014 г. в Российской Федерации был утвержден новый Национальный календарь профилактических прививок [6], предыдущий действовал с 2011 г. [7]. Согласно действующему российскому Национальному календарю профилактических прививок вакцинации против гриппа подлежат [6]:
– дети с 6 мес.;
– учащиеся 1–11 классов;
– обучающиеся в профессиональных образовательных организациях;
– студенты высших профессиональных и средних профессиональных учебных заведений;
– взрослые, работающие по отдельным профессиям и должностям (работники медицинских и образовательных учреждений, транспорта, коммунальной сферы и др.);
– беременные женщины;
– лица старше 60 лет;
– лица, подлежащие призыву на военную службу;
– лица с хроническими заболеваниями, в т. ч. заболеваниями легких, сердечно-сосудистыми заболеваниями, метаболическими нарушениями и ожирением.
По сравнению с предыдущей редакцией Национального календаря прививок вакцинация против гриппа претерпела изменения: расширен список групп лиц взрослого возраста (в частности, включены беременные женщины, что является важным мероприятием по защите от гриппа детей первых месяцев жизни).
Большое практическое значение имеют вопросы вакцинопрофилактики у детей с хроническими заболеваниями органов дыхания. Эта категория пациентов имеет повышенный уровень заболеваемости вакциноуправляемыми инфекциями, у них чаще отмечается тяжелое течение и развитие осложнений при интеркуррентных респираторных инфекциях, чаще наблюдаются неблагоприятные исходы заболеваний [8]. Нередко интеркуррентные острые респираторные инфекции у этих пациентов провоцируют обострение хронического заболевания [9]. Однако в течение длительного времени в нашей стране проведение профилактических прививок у данной группы пациентов было ограничено. Современная концепция иммунопрофилактики у детей с хроническими заболеваниями респираторной системы предполагает проведение прививок против гриппа, пневмококковой и гемофильной инфекции типа В [3].
Вакцинопрофилактика гриппа является самым эффективным методом снижения уровня заболеваемости, осложненного течения и смертности как лиц из групп риска, так и среди населения в целом. Многолетние исследования, проводимые в Японии, показали: избыточная смертность (разница между смертностью в период подъема заболеваемости ОРВИ и среднегодовой) от пневмонии и гриппа у детей существенно повысилась после уменьшения охвата вакцинацией против гриппа [10]. Российские эпидемиологические исследования, проводившиеся в 2000–2013 гг., продемонстрировали, что увеличение числа привитых (как взрослых, так и детей) ведет к обратно пропорциональному снижению количества случаев заболевания гриппом [11]. Необходимо также отметить, что у вакцинированных против гриппа детей наблюдается достоверное снижение заболеваемости отитами от 5 до 31% в зависимости от их формы и течения [12, 13].
Проведенные клинические исследования показали, что эффективность вакцинации в отношении лабораторно-подтвержденного гриппа составляет от 45 до 95% (в среднем 70–80%). Столь широкий разброс результатов исследования объясняется тем, что антигенный состав вакцины не всегда совпадает с антигенными вариантами циркулирующих вирусов гриппа, а также использованием разных типов вакцин и неоднородностью контингента лиц, входивших в различные исследования [3, 4].
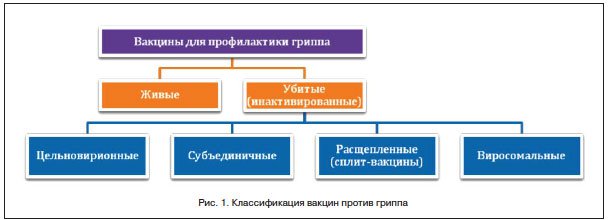
Для иммунопрофилактики гриппа в настоящее время используют различные виды вакцин (рис. 1). Существует 2 основных вида вакцин – живые, т. е. содержащие живые аттенуированные вирусы, и убитые (инактивированные), содержащие вирус целиком (цельновирионные) или его отдельные антигены (субъединичные и расщепленные или сплит-вакцины). Живые вакцины против гриппа вводятся интраназально, они существенно стимулируют клеточный и гуморальный иммунитет. Однако данные вакцины противопоказаны лицам с иммунодефицитными состояниями и членам их семей, беременным женщинам, детям раннего возраста (до 2 лет). Цельновирионные вакцины обладают высокой эффективностью. Но в то же время, из-за содержания токсина вируса, они наиболее реактогенны среди убитых вакцин, в связи с чем противопоказаны для применения у детей. Наиболее безопасны для вакцинопрофилактики гриппа у детей, беременных женщин и лиц с хроническими заболеваниями субъединичные и расщепленные вакцины. Субъединичные вакцины содержат только наружные антигены вирусов гриппа – Н и N. Подавляющее большинство современных вакцин содержат антигены 3-х актуальных штаммов вируса. При этом состав вакцин ежегодно пересматривается. Расщепленные вакцины (сплит-вакцины) содержат не только указанные наружные антигены вируса, но и внутренние типоспецифические белки. Благодаря этому сплит-вакцины могут оказать некоторый эффект в случаях, когда заболевание вызвано невакцинным штаммом вируса и даже другими возбудителями респираторных вирусных инфекций [3, 10].
В Российской Федерации разработана виросомальная вакцина Ультрикс®, которая содержит смесь высокоочищенных протективных поверхностных и внутренних антигенов 3-х актуальных штаммов вирусов гриппа. В одной дозе вакцины содержатся инактивированные расщепленные вирусы гриппа (культивированные на куриных эмбрионах), представленные штаммами А(H1N1), А(H3N2) и В. Содержание каждого штамма вируса составляет 15±2,2 мкг. Состав вакцины Ультрикс® ежегодно пересматривается в соответствии с рекомендациями ВОЗ для Северного полушария и решением по составу гриппозных вакцин на предстоящий эпидемический сезон Комиссии по гриппозным вакцинным и диагностическим штаммам Минздрава России [11].
Начиная с 2007 г. был проведен ряд клинических исследований вакцины Ультрикс® у лиц взрослого возраста (в т. ч. из групп риска) и у детей старше 6 лет. Исследования проводились на базе ведущих российских учреждений: НИИ гриппа РАМН (г. Санкт-Петербург), Пермская государственная медицинская академия им. Е.А. Вагнера, Сибирский государственный медицинский университет (г. Томск). Общее число лиц, входивших в исследования, составило более 10 тыс. Полученные результаты этих исследований показали, что вакцина демонстрирует высокую иммуногенность и клиническую эффективность, обладает высоким профилем безопасности [11, 15, 17, 18]. Установлено, что вакцина Ультрикс® по иммуногенности и безопасности не уступает сплит-вакцинам против гриппа ведущих зарубежных фармацевтических компаний [15, 17].
1. Комиссия является экспертным органом Минздрава России. Ее деятельность направлена на повышение требований к качеству вакцинных производственных и диагностических штаммов вируса гриппа, на совершенствование системы подготовки, испытания и ускорения их внедрения в производство гриппозных вакцин и диагностических препаратов.
2. Задачами Комиссии являются:
2.1. Рассмотрение информации НИИ гриппа РАНМ об эпидемически актуальных разновидностях вирусов гриппа, циркулирующих на территории страны и в мире, принятие решений о штаммовом составе гриппозных вакцин и диагностических препаратов на следующий эпидсезон.
2.2. Разрешение проведения испытания реактогенности и специфической активности новых вакцинных штаммов на ограниченных группах людей, утверждение программ этих испытаний.
2.3. Рассмотрение результатов лабораторного и клинического изучения на ограниченных группах людей свойств новых вакцинных производственных и диагностических штаммов вирусов гриппа для оценки соответствия их требованиям действующей нормативно-технической документации с целью решения вопроса о внедрении их в производство вакцин и диагностикумов.
2.4. Принятие решений о включении новых гриппозных вакцинных производственных и диагностических штаммов в производство вакцин и диагностических препаратов, а также об исключении из производства антигенно-неактуальных штаммов.
2.5. Представление решения Комиссии в Минздрав России и передача информации о принятых решениях в НИИ и предприятия, занятых разработкой и производством гриппозных вакцин и диагностических препаратов.
2.6. Осуществление контроля за соблюдением сроков подготовки и внедрения новых гриппозных вакцинных штаммов в производство вакцин и диагностикумов.
Руководитель Департамента
госсанэпиднадзора Минздрава России
Откройте актуальную версию документа прямо сейчас или получите полный доступ к системе ГАРАНТ на 3 дня бесплатно!
Если вы являетесь пользователем интернет-версии системы ГАРАНТ, вы можете открыть этот документ прямо сейчас или запросить по Горячей линии в системе.
от 7 мая 1998 года N 156
РОССИЙСКАЯ АКАДЕМИЯ МЕДИЦИНСКИЙ НАУК
от 7 мая 1998 года N 29
О подготовке новых вакцинных производственных и диагностических штаммов вируса гриппа и их внедрение в производство вакцин и диагностических препаратов
____________________________________________________________________
Утратил силу на основании
приказа Минздрава России от 7 мая 2018 года N 207/2
____________________________________________________________________
Для своевременной подготовки и внедрения новых вакцинных и диагностических штаммов вируса гриппа в производство вакцин и диагностических препаратов
1. Создать Межведомственную комиссию по гриппозным вакцинным и диагностическим штаммам (приложения 1, 2).
2. Возложить на Государственный институт стандартизации и контроля им.Л.А.Тарасевича ответственность за своевременную передачу на предприятия производственных штаммов для инактивированных гриппозных вакцин, полученных из ВОЗ (приложение 3).
3. Возложить на НИИ экспериментальной медицины РАМН ответственность за своевременную подготовку актуальных вакцинных штаммов вируса гриппа для живых гриппозных вакцин (приложение 3).
4. Возложить на НИИ гриппа РАМН ответственность за своевременную подготовку актуальных штаммов вируса гриппа для диагностических препаратов (приложение 3).
5. Научно-исследовательскому институту гриппа РАМН:
5.1. Ежегодно представлять в Межведомственную комиссию по гриппозным и диагностическим штаммам рекомендации по антигенной структуре кандидатов в вакцинные и диагностические штаммы на предстоящий эпидемический сезон в соответствии с эпидемической ситуацией по гриппу в стране и мире и обеспечить институты, готовящие новые вакцинные штаммы, образцами актуальных эпидемических вирусов, выделенные в России или полученных из Всемирной организации здравоохранения.
5.2. По решению рабочей группы Межведомственной комиссии проводить проверку реактогенности и иммуногенности вакцинных штаммов, подготовленных на основе базовых доноров аттенуации для живых гриппозных вакцин в соответствии с действующей нормативно-технической документацией на данный препарат, одновременно проводить контроль вакцинных штаммов в Государственном НИИ стандартизации и контроля медицинских биологических препаратов им.Л.А.Тарасевича.
Вакцинные штаммы, подготовленные на основе новых доноров аттенуации, апробировать в соответствии с требованиями, предъявляемыми к новым профилактическим препаратам (приложение 4).
6. Органам управления здравоохранением субъектов Российской Федерации направлять необходимые контингенты добровольцев для испытания вакцинных штаммов (приложение 5).
7. Возложить на Федеральное госпредприятия НПО "Иммунопрепарат" подготовку маточного материала для инактивированных гриппозных вакцин и штаммоспецифической сыворотки.
8. Государственному НИИ стандартизации и контроля иммунобилогических препаратов им.Л.А.Тарасевича проводить контроль маточного материала вакцинных штаммов для живых и инактивированных гриппозных вакцин.
9. Предприятиям по производству противогриппозных препаратов в недельный срок с момента получения информации Государственного НИИ стандартизации и контроля медицинских иммунобилогоических препаратов им.Л.А.Тарасевича о новом вакцинном штамме направлять курьеров для приобретения маточного материала вакцинных штаммов.
10. Предприятию по производству диагностических препаратов при НИИ гриппа РАМН обеспечить выпуск диагностикумов из актуальных штаммов вируса гриппа и диагностических сывороток для идентификаци возбудителей.
11. Приказ Минздрава СССР от 11.04.90 N 150/140 "О подготовке новых вакцинных и диагностических штаммов вируса гриппа и их внедрение в производство вакцин и диагностических препаратов" считать недействующим на территории Российской Федерации.
12. Контроль за выполнением настоящего приказа возложить на первого заместителя министра Онищенко Г.Г.
Министр задравоохранения
Российской Федерации
Т.Б.Дмитриева
Президент Российской академии
медицинских наук
В.И.Покровский
Приложение 1
к приказу Минздрава
России и РАМН
от 7 мая 1998 года
N 156/29
Состав
Комиссии по гриппозным вакцинным производственным
диагностическим штаммам Минздрава России
Председатель
Киселев О.И.
директор НИИ гриппа РАМН
Заместитель председателя
Лонская Н.И.
руководитель лаборатории государственного НИИ стандартизации и контроля медицинских иммунобиологических препаратов им.Л.А.Тарасевича
Секретарь
Руденко Л.Г.
руководитель лаборатории НИИ
экспериментальной медицины РАМН
руководитель лаборатории НИИ эпидемиологии и микробиологии им.Пастера Минздрава России
руководитель отдела НИИ экспериментальной медицины РАМН
руководитель лаборатории Московского НИИ вирусных препаратов
ведущий научный сотрудник НИИ гриппа РАМН
заместитель директора НИИ гриппа РАМН по научной работе
руководитель лаборатории НИИ вирусологии им.Д.И.Ивановского РАМН
заместитель директора НИИ гриппа РАМН по лечебной работе
ведущий научный сотрудник НИИ экспериментальной медицины РАМН
начальник отдела госэпиднадзора и целевых программ Департамента госсанэпиднадзора Минздрава России
Члены рабочей группы:
руководитель лаборатории НИИ экспериментальной медицины РАМН
руководитель лаборатории НИИ эпидемилогии и микробиологии им. Пастера Минздрава России
заместитель директора НИИ гриппа РАМН по научной работе
заместитель директора НИИ гриппа РАМН по лечебной работе
ведущий научный сотрудник НИИ экспериментальной медицины
Руководитель
Департамента
госкомсанэпиднадзора
Минздрава России
А.А.Монисов
Приложение 2
к приказу Минздрава
России и РАМН
от 7 мая 1998 года
N 156/29
ПОЛОЖЕНИЕ
о Комиссии по гриппозным вакцинным производственным
и диагностическим штаммам
1. Комиссия является экспертным органом Минздрава России. Ее деятельность направлена на повышение требований к качеству вакцинных производственных и диагностических штаммов вируса гриппа, на совершенствование системы подготовки, испытания и ускорения их внедрения в производство гриппозных вакцин и диагностических препаратов.
2. Задачами Комиссии являются:
2.1. Рассмотрение информации НИИ гриппа РАМН об эпидемических актуальных разновидностях вирусов гриппа, циркулирующих на территории страны и в мире, принятие решений о штаммовом составе гриппозных вакцин и диагностических препаратов на следующих эпидсезон.
2.2. Разрешение проведения испытания реактогенности и специфической активности новых вакцинных штаммов на ограниченных группах людей, утверждение программ этих испытаний.
2.3. Рассмотрение результатов лабораторного и клинического изучения на ограниченных группах людей свойств новых вакцинных производственных и диагностических штаммов вирусов гриппа для оценки соответствия их требованиям действующей нормативно-технической документации с целью решения вопроса о внедрении их в производство вакцин и диагностикумов.
2.4. Принятие решений о включении новых гриппозных вакцинных производственных и диагностических штаммов в производство вакцин и диагностических препаратов, а также об исключении из производства антигенно-неактуальных штаммов.
2.5. Представление решений Комиссии в Минздрав России и передача информации о принятых решениях в НИИ и предприятия, занятых разработкой и производством гриппозных вакцин и диагностических препаратов.
2.6. Осуществление контроля за соблюдением сроков подготовки и внедрения новых гриппозных вакцинных штаммов в производство вакцин и диагностикумов.
Руководитель
Департамента
гскомсанэпиднадзора
Минздрава России
А.А.Монисов
Приложение 3
к приказу Минздрава
России и РАМН
от 7 мая 1998 года
N 156/29
Порядок испытания и внедрения новых вакцинных производственных
и диагностических штаммов вируса гриппа
Настоящая фармакопейная статья распространяется на вакцину гриппозную инактивированную (вакцину цельновирионную, которая представляет собой цельный вирус; вакцину расщепленную (сплит-вакцину), которая состоит преимущественно из разрушенных вирусных частиц; вакцину субъединичную, которая содержит в основном поверхностные антигены вируса гриппа: гемагглютинин и нейраминидазу). Антигены получают из очищенного вируса или очищенных вирусов гриппа типов А и В, одного, двух, трех или четырех штаммов, выращенных раздельно в развивающихся куриных эмбрионах.
Вакцина может содержать адъювант и консервант.
Производство
Производство вакцины включает ряд последовательных стадий с обязательным внутрипроизводственным контролем: получение главного и рабочего посевных материалов; накопление вируса; очистку и концентрацию; расщепление вируса (при необходимости); производство препарата; маркировку; фасовку. На каждой стадии должны быть предусмотрены: система и схема анализа показателей качества в ходе технологического процесса и испытания конечного продукта; соблюдение условий и сроков хранения промежуточных и конечного продукта, обеспечивающее стабильность качества в течение срока годности продукта.
Штаммовый состав вакцин ежегодно рекомендуется ВОЗ и национальной Комиссией по гриппозным вакцинным и диагностическим штаммам. Для каждого нового штамма необходима валидация процесса расщепления вируса в моновалентном препарате сплит-вакцины и подтверждение наличия преимущественного содержания гемагглютинина и нейраминидазы в субъединичных моновакцинах. Производственные штаммы должны соответствовать по антигенной структуре вирусов гриппа подтипов и и типа В на текущий эпидемический сезон, с известной историей пассажей и источника выделения.
В случае использования в производстве в течение более одного эпидемического сезона производственные штаммы должны контролироваться не реже 1 раза в год.
Куриные эмбрионы должны быть получены из птицеводческих хозяйств, благополучных по возбудителям, патогенным для человека. Качество поставляемых эмбрионов должно быть подтверждено ветеринарными свидетельствами, должно соответствовать требованиям ОФС "Испытание вирусных вакцин на присутствие посторонних агентов" и ОФС "Вирусная безопасность".
Все производственные процессы, технологическое оборудование и методы контроля должны быть валидированы и должны осуществляться с соблюдением установленных требований к правилам организации производства и контроля качества лекарственного препарата, гарантирующих его качество и безопасность для человека. Производство вакцины должно проводиться в помещениях, исключающих работу с другими патогенными микроорганизмами и антибиотиками. Не допускается производство препарата на территории, на которой расположены производственные здания по производству антибиотиков, если не соблюдены требования к защитным зонам, согласно действующим санитарным правилам. Обязательным условием технологического процесса производства вакцины является соблюдение поточности, исключающей возможность перекреста промежуточных продуктов и полуфабрикатов, получаемых на разных стадиях производства, и их контаминацию посторонними веществами, в первую очередь посторонней микрофлорой.
Работа с живым и инактивированным вирусом должна проводиться в разных помещениях. Качество исходного сырья и материалов, используемых в производстве, должно быть подтверждено соответствующими документами (допустимо использование компонентов только фармакопейного качества). В состав вакцины должны входить вспомогательные компоненты, разрешенные к медицинскому применению и в дозах, не вызывающих токсические, аллергические или иные нежелательные реакции у человека.
Из главного посевного материала готовят рабочий посевной материал (посевной вирус), который должен быть представлен не более чем 15 пассажем от соответствующего производственного штамма. Финальный сбор представляет собой первый пассаж от рабочего посевного вируса.
Пенициллин или стрептомицин нельзя использовать ни на одной из стадий производства.
Испытания
Описание. Бесцветная или опалесцирующая желтоватая жидкость. Определение проводят визуально.
Подлинность. Каждый подтип и тип антигена должен нейтрализоваться гомологичной сывороткой. Титр с гетерологичной сывороткой должен быть ниже титра с гомологичной сывороткой не менее, чем в 4 раза. Определение проводят на стадиях получения полуфабрикатов: объединенного вирусного концентрата или моновакцины в реакции торможения гемагглютинации (РТГА).
Метод постановки РТГА с вирусом гриппа (макрометод). РТГА применяют для установления типа и подтипа вируса, т.е. специфичности, а также для определения нарастания титров специфических антител. Постановка РТГА включает следующие этапы: приготовление взвеси эритроцитов, определение гемагглютинирующего титра антигена в реакции гемагглютинации (РГА) и рабочей дозы вируса, постановка самой реакции. Для постановки реакции необходимы следующие ингредиенты:
- исследуемый антиген (субъединичная моновакцина, вируссодержащая жидкость - аллантоисная или культуральная);
- иммунные/диагностические сыворотки к различным типам (А и В) и подтипам типа А вируса гриппа;
- фосфатный буферный раствор рН 7,20,2 (ФБР);
- суспензия куриных эритроцитов, 1%.
1. Приготовление взвеси куриных эритроцитов. Для постановки РТГА используют эритроциты петухов. Кровь у петухов берут из сердца или подкрыльцевой вены.
Свежеполученную кровь от 3-5 петухов помещают во флакон со стеклянными бусами или с одним из антикоагулянтов (раствор Альсевера, 5%-й раствор натрия цитрата). Дефибринирование крови проводят немедленно путем интенсивного встряхивания флакона со стеклянными бусами в течение 5-7 мин при температуре (205)°С до выпадения волокон фибрина.
Дефибринированную кровь фильтруют через 4 слоя марли, затем трехкратно отмывают ФБР путем центрифугирования при 1500 об/мин в течение 5 мин или 800200 об/мин в течение (155) мин. Надосадочную жидкость удаляют. Из осадка, принимаемого за 100%, готовят 1% суспензию куриных эритроцитов по объему.
2. Определение гемагглютинирующего титра антигена. В лунках агглютинационного планшета готовят двукратные разведения антигена в объеме 0,4 мл на фосфатном буферном растворе, начиная с 1:10 до 1:1280. В каждую лунку вносят по 0,4 мл 1% суспензии эритроцитов. Содержимое лунок перемешивают встряхиванием планшета и оставляют при температуре (205)°С на 40-45 мин (до оседания эритроцитов в отрицательном контроле).
Реакцию оценивают по "четырехкрестовой" системе. За титр антигена, или одну агглютинирующую единицу (АЕ), принимают наибольшее разведение антигена, дающее четко выраженную агглютинацию эритроцитов (+++ или ++++).
Определение титра антигена сопровождается отрицательным контролем на отсутствие спонтанной агглютинации эритроцитов. С этой целью в контрольную лунку того же агглютинационного планшета вносят 0,4 мл фосфатного буферного раствора и 0,4 мл 1% суспензии эритроцитов. При отсутствии спонтанной агглютинации на дне лунки выпадает гомогенный с ровными краями осадок эритроцитов (отрицательная реакция).
3. Приготовление рабочей дозы антигена. В РТГА рабочей дозой антигена является то разведение антигена, в 0,2 мл которого содержится 4 агглютинирующие единицы (4 АЕ). Для вычисления ее следует установленную величину титра антигена разделить на 8. Полученная цифра указывает во сколько раз нужно развести антиген, чтобы в 0,2 мл его содержалось 4 АЕ (рабочая доза).
Перед постановкой основного опыта проверяют точность приготовления рабочей дозы (4 АЕ). Для этого в пять лунок горизонтального ряда агглютинационного планшета, начиная со второй, вносят по 0,2 мл фосфатного буферного раствора. В 1-ю и 2-ю лунки добавляют по 0,2 мл приготовленной рабочей дозы антигена. После перемешивания переносят 0,2 мл смеси из лунки в лунку, начиная со 2-й по 5-ю лунку, из 5-й лунки 0,2 мл удаляют. Затем в каждую лунку добавляют по 0,2 мл фосфатного буферного раствора и по 0,4 мл 1% суспензии куриных эритроцитов. В 6-й лунке ставят контроль на отсутствие спонтанной агглютинации эритроцитов. После встряхивания смесь оставляют при температуре (205)°С на 40-45 мин (до оседания эритроцитов в контроле).
При правильном выборе рабочей дозы полная (++++) агглютинация эритроцитов должна наблюдаться только в первых трех лунках. В 4-й и 5-й лунках агглютинация должна отсутствовать. В случае отклонения от указанного выше, разведение антигена должно быть изменено путем добавления соответствующего количества антигена или фосфатного буферного раствора для получения необходимой рабочей дозы. При этом необходимо повторно проверить правильность приготовления рабочей дозы.
4. Постановка реакции торможения гемагглютинации. Готовят двукратные разведения сывороток в лунках агглютинационного планшета, начиная с 1:10 до 1:640 и выше в объеме 0,2 мл. К каждому разведению сыворотки добавляют по 0,2 мл рабочей дозы антигена (4 АЕ). Смесь встряхивают и после контакта антигена и сыворотки (от 30 мин до 1 ч) при температуре (205)°С в каждую лунку добавляют по 0,4 мл 1% суспензии куриных эритроцитов. Смесь повторно встряхивают, оставляют при температуре (205)°С в течение 40-45 мин (до оседания эритроцитов в контроле), после чего производят учет результатов реакции.
При наличии в сыворотке специфических антител наступает задержка агглютинации эритроцитов. За титр сыворотки принимают предельное разведение, вызывающее полную задержку гемагглютинации.
Задержка гемагглютинации указывает на соответствие типа антигена и взятой сыворотки; отсутствие задержки гемагглютинации свидетельствует о несоответствии типа взятой сыворотки антигену.
* При исследовании сывороток привитых в РТГА (изучение иммуногенности вакцины) следует учитывать, что сыворотки людей содержат различные полисахариды, которые могут связывать гемагглютинин вируса гриппа и затруднять связывание специфических гриппозных гемагглютинирующих антител. Для удаления неспецифических ингибиторов гемагглютинации образцы сыворотки обрабатывают при помощи нейраминидазы холерных вибрионов или ферментом RDE (receptor destroying enzyme).
При наличии готового реактива необходимо следовать требованиям, изложенным в инструкции по применению.
При необходимости длительного хранения обработанную сыворотку (разведение 1:10) хранят при температуре не выше минус 20°С.
Приготовление 0,1 М раствора фосфатного буферного (рН 7,20,2).

Раствор 1. В мерную колбу вместимостью 1000 мл помещают 17,8 г натрия фосфата двузамещенного 2-водного (), растворяют в 500 мл воды очищенной, доводят объём раствора тем же растворителем до метки и перемешивают.

Раствор 2. В мерную колбу вместимостью 1000 мл помещают 15,6 г натрия фосфата однозамещённого 2-водного (), растворяют в 500 мл воды очищенной, доводят объём раствора тем же растворителем до метки и перемешивают.
В мерную колбу вместимостью 1000 мл вносят 720 мл раствора 1, прибавляют 280 мл раствора 2 и перемешивают. Затем в мерную колбу вместимостью 1000 мл помещают 100 мл приготовленного 0,1 М фосфатного буферного раствора доводят объём раствора водой очищенной до метки, перемешивают, прибавляют 8,5 г натрия хлорида и вновь перемешивают. рН полученного раствора должен быть 7,20,02. Если показатель рН выше или ниже требуемого, его соответственно доводят 1 М раствором хлористоводородной кислоты или 1 М раствором натрия гидроксида.
Приготовление раствора Альсевера
- 0,42% натрия хлорида;
- 0,8% натрия цитрата;
- 100,0 мл воды очищенной.
рН раствора доводят с помощью 5% раствора лимонной кислоты до рН 5,6 (примерно 10 мл 5% раствора лимонной кислоты на 1 л раствора Альсевера). Раствор стерилизуют фильтрацией или автоклавированием в течение 3 последовательных дней при температуре 100°С и давлении 0,7 атм. Для консервирования добавляют на 1 мл крови 1,2 мл раствора Альсевера. В данном растворе эритроциты могут храниться при температуре (42)°С в течение 1-2 нед. Перед использованием эритроциты необходимо трехкратно отмыть фосфатным буферным раствором с помощью центрифугирования при (800200) об/мин в течение 10 мин.
Приготовление консервирующего 5% раствора натрия цитрата.
5% раствор натрия цитрата перед использованием разводят в 2 раза 0,1 М фосфатным буферным раствором (рН 7,20,2). К одной части полученного раствора натрия цитрата добавляют 2 части крови петухов. В данном растворе эритроциты могут храниться при температуре (42)°С в течение 3-5 сут.
Метод постановки РТГА с вирусом гриппа (микрометод). Принцип метода, его учет и ингредиенты, те же, что и для проведения РТГА макрометодом. Отличие методов заключается в изменении концентрации и объемов ингредиентов.
Реакцию ставят в микропланшетах с "V"-образными лунками.
1. Приготовление 0,5% взвеси куриных эритроцитов. Взвесь готовят из 1%-й суспензии эритроцитов (см. макрометод) разведением ее в 2 раза фосфатным буферным раствором.
2. Определение гемагглютинирующего титра антигена. В каждую лунку микропланшета одного ряда вносят фосфатный буферный раствор в объеме 50 мкл. Затем в первую лунку вносят 50 мкл антигена в разведении 1:10 и далее проводят титрование по принципу двукратного разведения. Из последней лунки удаляют 50 мкл. Затем в каждую лунку вносят по 50 мкл 0,5%-й суспензии эритроцитов. Содержимое лунок перемешивают встряхиванием и оставляют при температуре (205)°С на 40-45 мин до оседания эритроцитов в контроле.
Реакцию оценивают по "четырехкрестовой" системе. За титр антигена, или одну агглютинирующую единицу (АЕ), принимают наибольшее разведение антигена, дающее четко выраженную агглютинацию эритроцитов (+++ или ++++).
Определение титра антигена сопровождается постановкой отрицательного контроля на отсутствие спонтанной агглютинации эритроцитов.
3. Приготовление рабочей дозы антигена. Рабочая доза антигена при постановке РТГА микрометодом равна 8 АЕ. Для её расчета и последующего приготовления гемагглютинирующий титр делят на 16. Полученное значение указывает, во сколько раз необходимо развести антиген.
Пример: титр антигена равен 160. Разделив 160 на 16, получаем цифру 10, указывающую на то, что антиген необходимо развести в 10 раз.
Перед постановкой основного опыта проверяют точность приготовления рабочей дозы (8 АЕ). Для этого в шесть лунок микропланшета, начиная со второй, вносят по 25 мкл фосфатного буферного раствора. В 1 и 2 лунки добавляют по 25 мкл приготовленной рабочей дозы антигена. После перемешивания 25 мкл смеси переносят из 2 лунки в 3, из 3 - в 4 и т.д. Из последней лунки панели 25 мкл удаляют. Затем во все лунки добавляют по 25 мкл фосфатного буферного раствора и по 50 мкл 0,5% суспензии эритроцитов. После встряхивания смесь оставляют при температуре (205)°С на 40-45 мин до оседания эритроцитов в контроле.
При правильном выборе рабочей дозы агглютинация эритроцитов должна наблюдаться только в четырех лунках микропланшета. В остальных лунках агглютинация должна отсутствовать. В случае отклонения от указанного результата добавляют антиген или фосфатный буферный раствор для получения необходимой рабочей дозы.
4. Постановка реакции торможения гемагглютинации. Метод постановки реакции микрометодом соответствует таковому, описанному для макрометода, за исключением объемов используемых ингредиентов реакции.
Готовят двукратные разведения сыворотки в объеме 25 мкл, вносят рабочую дозу антигена (8 АЕ) в объеме 25 мкл и после контакта антигена и сыворотки (от 30 мин до 1 ч) при температуре (205)°С в каждую лунку панели вносят по 50 мкл 0,5% взвеси эритроцитов. После оседания эритроцитов в контроле (как правило, через 40-45 мин) проводят учет результатов.
Читайте также:

