Корь дифтерия цинга гемофилия артрит
Обновлено: 25.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Гемофилия: причины появления, симптомы, диагностика и способы лечения.
Определение
Гемофилия является редким, но серьезным наследственным заболеванием, связанным с нарушением функции свертывания крови, что приводит к неконтролируемым и часто спонтанным кровотечениям и кровоизлияниям в различные органы и ткани. При гемофилии организм человека не может естественным способом остановить кровотечение, возникшее из-за повреждения кровеносного сосуда в результате травмы, хирургического вмешательства или стресса. Интенсивность кровотечения сопоставима с таковой у здорового человека, однако оно продолжается значительно дольше.
Кровь содержит много белков, называемых факторами свертывания, которые помогают остановить кровотечение. Существует два различных типа гемофилии. Каждый отличается дефицитом определенного фактора свертывания крови. Заболевание появляется в результате мутации гена фактора свертывания крови VIII (гемофилия А) или фактора свертывания IX (гемофилия В). Наиболее распространенным типом заболевания является гемофилия А, которая встречается у 80-85% больных гемофилией. В типичном случае человек с тяжелой формой гемофилии А страдает кровотечением 35 раз в год.
Тяжесть гемофилии определяется количеством фактора свертывания крови — чем он ниже, тем больше вероятность возникновения кровотечения, которое может привести к серьезным проблемам со здоровьем.
Гемофилия известна человечеству более 2000 лет. Первые сведения о заболевании содержатся в Талмуде, согласно которому мальчику не делали обрезание, если двое его старших братьев умерли из-за кровопотери, вызванной этой же манипуляцией.
Причины появления гемофилии
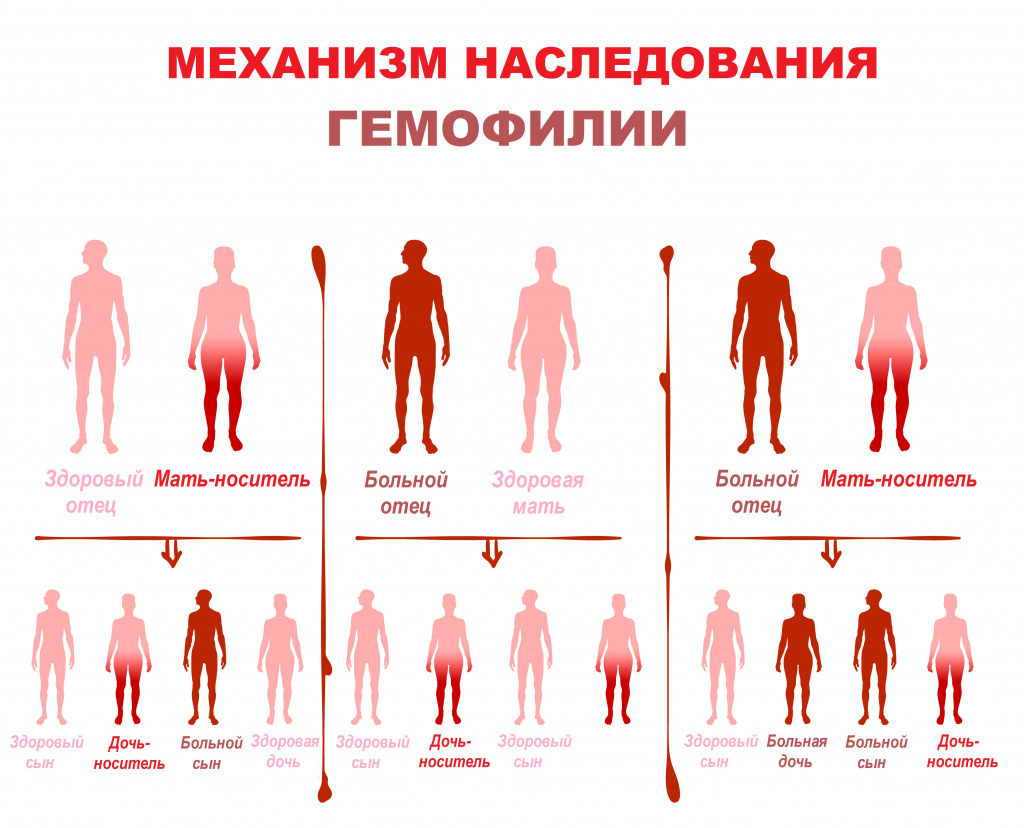
Заболевание передается от родителей к ребенку, хотя примерно в трети случаев вызвано спонтанной мутацией. Гены, кодирующие оба фактора свертывания крови, локализованы в Х-хромосоме. У женщин имеются две половые хромосомы ХХ. Хромосомный набор мужчин — ХY. При рождении девочек одна Х-хромосома наследуется от матери, а другая — от отца. Мужчина, больной гемофилией, имеет одну аномальную Х-хромосому и одну неповрежденную Y-хромосому. В случаях рождения мальчиков Y-хромосома наследуется от отца, а одна из Х-хромосом — от матери.
Сыновья мужчины, больного гемофилией, и здоровой женщины будут со 100% вероятностью здоровыми, а дочери — со 100% вероятностью носительницами гемофилии. В среднем, носительницы гемофилии будут иметь 30-50% от нормального уровня фактора свертывания.
Если женщина — носительница гемофилии имеет одну Х-хромосому здоровую, а другую аномальную, то от здорового мужчины у нее с равной долей вероятности могут родится как здоровые сыновья (50%), так и больные (50%) гемофилией, а дочери также с равной долей вероятности будут или здоровыми (50%), или носительницами (50%) гемофилии. Именно поэтому гемофилией страдают в основном пациенты мужского пола, которые наследуют пораженную X-хромосому от матери.
Дочери могут болеть гемофилией с вероятностью 25%, если она есть у отца, а мать – носительница гена. Но это случается крайне редко.
Классификация заболевания
Кодирование по Международной классификации болезней 10-го пересмотра:
- D66.0 – Наследственный дефицит фактора VIII.
- D67.0 – Наследственный дефицит фактора IХ.
- легкая – активность фактора 5-40% (0,05–0,40 МЕ/мл);
- средняя – активность фактора 1-5% (0,01–0,05 МЕ/мл);
- тяжелая – активность фактора менее 1% (менее 0,01 МЕ/мл).
- Типичные:
- гемартрозы крупных суставов 70-90%,
- гематомы (кровоизлияния в мышцы/мягкие ткани) 20-40%,
- кровотечения из слизистых (носовые, десневые, луночковые) 10%,
- гематурии 5-10%.
- в ЦНС – 5%,
- в ЖКТ – 5%,
- в области шеи/горла – 5%,
- забрюшинные гематомы – 5%.
Гемофилия средней тяжести имеет сходные проявления. Первые признаки, как правило, манифестируют после года. У пациентов с активностью факторов более 2% реже возникают кровоизлияния в суставы, забрюшинные гематомы и гематурии. Наиболее типичны посттравматические гематомы и длительные кровотечения, особенно при травмах слизистых оболочек.
Геморрагический синдром обычно возникает вследствие значительных травм или в результате хирургического лечения. Поражение опорно-двигательного аппарата встречается чрезвычайно редко.
Общие признаки гемофилии:
- длительные кровотечения после травм;
- внутрисуставные кровотечения, вызывающие отек и боль;
- кровоизлияние в кожу (гематомы) или мышцу и мягкие ткани;
- десневые кровотечения, которое трудно остановить после удаления или потери зуба;
- постинъекционные кровотечения;
- кровь в моче или кале;
- частые и трудно останавливаемые носовые кровотечения.
Диагностика гемофилии начинается с выявления наличия геморрагического синдрома в анамнезе у пациента и членов семьи. Сбор жалоб и анамнеза вкупе с физикальным осмотром позволяют определить необходимый объем обследования пациента.
Лабораторная диагностика
Рекомендуется проведение поэтапного лабораторного коагулологического исследования с целью верификации диагноза и исключения приобретенного дефицита фактора VIII или IX, а также исключения дефицита других факторов свертывания крови.
В качестве первого этапа выполняют коагулологический скрининг, в ходе которого определяются следующие показатели:
-
активированное частичное тромбопластиновое время;
АЧТВ – скрининговый тест для оценки внутреннего пути активации свертывания крови (факторы XII, XI, IX, VIII, X, V и II) и мониторинга пациентов, получающих гепариновую терапию. Синонимы: Анализ крови на АЧТВ; Активированное парциальное тромбопластиновое время; Кефалин-каолиново.
Синонимы: Анализ крови на протромбин; Протромбин; Протромбиновое время; Протромбиновый индекс; Международное нормализованное отношение; МНО; Фактор свертывания крови II. Prothrombin; PT; Protime; INR; International normalized ratio; Coagulation Factor II; FII. Краткое описание исследования Прот.
Фибриноген – белок, предшественник фибрина, составляющего основу сгустка при свертывании крови. Исследование направлено на оценку способности организма к тромбообразованию и выявлению связанных с этим процессом нарушений. Синонимы: Анализ крови на фибриноген; Фибриноген; Фактор I (первый).
-
активность факторов VIII, активность факторов IX;
Синонимы: Фактор свертывания VIII; Антигемофилический фактор (АГФ); Антигемофильный глобулин. Factor VIII Coagulant Activity (VIII); Coagulation Factor VIII; Factor VIII Activity Blood Test; Antihemophilia Factor A Test; AHF, Factor VIII; Antihaemophilic globulin. Краткая характери.
Синонимы: Фактор свертывания крови IX; Антигемофильный глобулин B. Factor IX (FIX, Christmas Factor) Activity; Coagulation Factor IX Activity; Blood Clotting Factor 9 Activity; Factor IX Activity; Antihemophilic factor IX. Краткое описание исследования «Фактор свертывания IX.
Для исключения приобретенных дефицитов факторов VIII или IX требуется молекулярно-генетическая диагностика.
Исследование мутаций фактора IX при гемофилии B. Тип наследования. Х-сцепленный рецессивный. Гены, которые контролируют выработку FVIII или FIX , находятся в Х-хромосоме. Так как мужчины имеют только одну Х-хромосому, при мутациях соответствующего гена буде.
Инструментальная диагностика позволяется визуализировать кровотечения/кровоизлияния различных локализаций, а также выявить осложнения, развившиеся в результате геморрагических проявлений. По показаниям проводятся следующие обследования:
Исследование слизистой оболочки верхнего отдела желудочно-кишечного тракта с возможностью выполнения биопсии или эндоскопического удаления небольших патологических образований.
Ультразвуковое сканирование структуры крупных суставов и определение их функциональной активности.
Сканирование внутренних органов брюшной полости для оценки его функционального состояния и наличия патологии.
Комплексное ультразвуковое сканирование органов мочевыделительной системы, позволяющее обнаружить патологию на ранних стадиях развития.
Безопасное и информативное сканирование структур головного мозга для диагностики его патологий.
Исследование, позволяющее получить данные о состоянии органов грудной клетки и средостения.
Сканирование головного мозга, черепа и окружающих их тканей, позволяющее диагностировать различные патологии.
Лечением больных гемофилией занимается врач-гематолог. Для подтверждения наличия геморрагических проявлений или их последствий также рекомендуется проведение консультации специалистов. По показаниям возможны консультации:
- неонатолога или врача-педиатра ;
- врача-генетика;
- травматолога-ортопеда;
- хирурга ;
- уролога ;
- невролога ;
- оториноларинголога ;
- стоматолога.
Гемофилия является неизлечимым заболеванием, поэтому основная цель терапии – купирование симптомов. Главный принцип лечения – специфическая заместительная терапия концентратами факторов свертывания. Концентраты фактора производятся либо из человеческой плазмы (плазматические), либо они генетически модифицированы (рекомбинантные).
Если препараты произведены из плазмы, принимается ряд мер, чтобы убедиться в том, что в продукте отсутствует вирусная инфекция, и что пациенты не заразятся такими вирусами, как гепатит С или ВИЧ. С этой целью применяются строгие критерии к выбору доноров плазмы. Кроме того, производители разработали различные методы по очищению и дезактивации вирусов во время производственного процесса препаратов крови. Тем не менее, пациентам следует знать, что есть теоретическая вероятность заражения через использование препаратов плазмы.
Рекомбинантные препараты создают из живых клеток, таких как моноклональные антитела. Они считаются технологически более продвинутыми и несут меньший риск вирусного заражения.
В настоящее время нет оснований для предпочтительного выбора между плазматическими или рекомбинантными препаратами.
Концентраты факторов свертывания крови вводятся внутривенно. Однако примерно у 30% пациентов с тяжелой гемофилией организм начинает вырабатывать антитела, что крайне затрудняет лечение, а в некоторых случаях делает его невозможным.
Существует два вида специфической терапии – профилактическая и лечение по факту возникновения кровотечений (по требованию). Во всех случаях рекомендовано сразу использовать достаточную дозу и соблюдать кратность введения препарата.
Для лечения гемофилии среди более новых лекарственных средств можно отметить фитусиран (снижает выработку природного антикоагулянтного белка – антитромбина) и концизумаб (увеличивает выработку тромбина). Генная терапия с использованием аденовирусного вектора для доставки гена фактора VIII или IX также подвергается клиническим испытаниям.
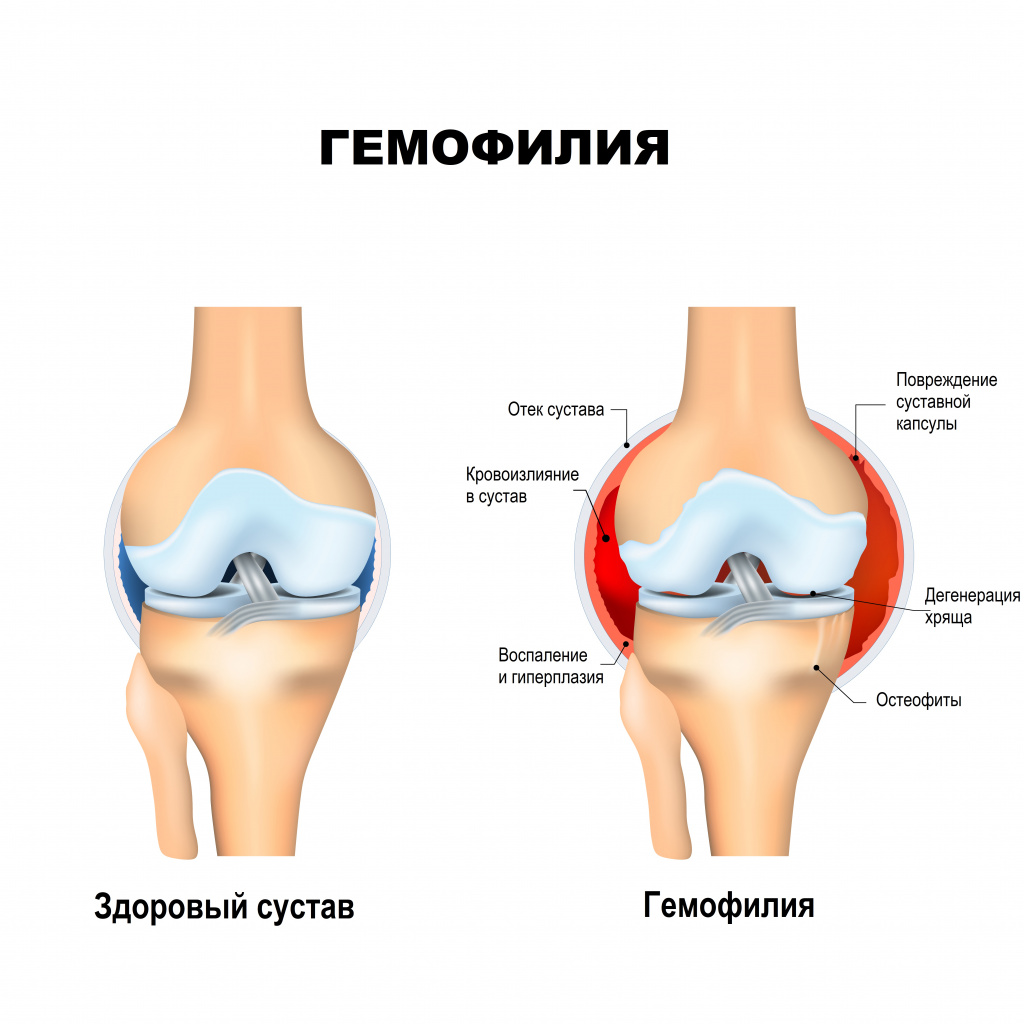
Серьезные осложнения встречаются при тяжелой и умеренной гемофилии и чаще всего проявляются в виде разрушений суставов и развития артрита. Кровотечения в сустав приводят к разрушению его нормальных тканей и развитию хронического артрита, очень болезненного и приводящего к нарушению функции сустава. Кровоизлияния в суставы отмечаются и у детей с 2-3 летнего возраста. Чаще всего поражаются крупные суставы – коленные, локтевые, голеностопные. Если кровотечение продолжается, то крайне высок риск инвалидизации и ограничения движения в суставе (в худшем случае человек может потерять конечность).
![Сустав.jpg]()
Помимо негативного влияния на качество жизни человека, кровоизлияния нередко становятся жизнеугрожающими, если происходят в жизненно важных органах, например, в мозге.
Профилактика гемофилии
Профилактическая заместительная терапия концентратами факторов свертывания крови – необходимое условие сохранения физического и психологического здоровья пациентов с тяжелой и среднетяжелой гемофилией. Профилактическое лечение обычно назначается детям, чтобы снизить риск кровотечений и повреждений суставов. В последнее время с этой же целью профилактику стали назначать и пожилым людям. Профилактика предполагает вливание фактора свертывания крови на регулярной основе (через день), чтобы сохранить нормальное свертывание крови у больного и предотвратить спонтанные кровотечения.
Детей с гемофилией необходимо оберегать от травм, предотвращать удаление зубов путем тщательной санации полости рта и квалифицированной стоматологической помощи.
Пациентам перед оперативным вмешательством или удалением зуба проводят заместительную терапию фактором (предпочтительно с использованием рекомбинантного препарата).
Молодые люди должны осознать, что поддержание физической активности очень важно для укрепления мышц, связок и суставов. Мышечная слабость, плохая координация движений значительно повышают вероятность травмы сустава и последующего развития воспаления (артрита). Хорошая физическая форма, крепкий мышечный каркас снижают риск спорадических кровотечений. Оптимальный вид спорта для людей, страдающих гемофилией, – плавание.
Людям с гемофилией рекомендуется носить на себе медальон с информацией о болезни. Это может спасти жизнь в критической ситуации.
Для профилактики кровотечений больные гемофилией должны избегать применения аспирина и нестероидных противовоспалительных препаратов, поскольку они замедляют тромбоцитарную функцию.
Прививки для больного гемофилией не представляют большой опасности. Более того, в список обязательных входит вакцина против гепатита В. Большинство лекарственных препаратов все же следует принимать перорально из-за опасности кровотечения при внутримышечном введении.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Что такое корь? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
![Александров Павел Андреевич, инфекционист, гепатолог, паразитолог, детский инфекционист - Санкт-Петербург]()
Определение болезни. Причины заболевания
Корь (Measles) — острое инфекционное заболевание, вызываемое вирусом кори, который поражает эпителий верхних дыхательных путей и кожные покровы. Клинически характеризуется выраженным синдромом общей инфекционной интоксикации, патогномоничной энантемой, макуло-папулёзной сыпью, конъюнктивитом и синдромом поражения респираторного тракта (дыхательных путей).
Этиология
вид — возбудитель кори (Polinosa morbillarum)
Синдромально заболевание было описано в 1890 году доктором Бельским (Псков), в 1895 году детским доктором Филатовым и в 1898 году доктором Копликом (США).
![Вирус кори]()
Оболочка вируса имеет 3 слоя: белковую мембрану, липидный слой и наружные гликопротеидные комплексы, образующие своеобразные выступы. Штаммы вирусов идентичны в антигенном отношении, обладают комплементсвязывающими, гемагглютинирующими, гемолизирующими свойствами и симпластообразующей активностью. СД-46 является рецептором у человека к вирусу кори.
Вирус неустойчив во внешней среде – чувствителен к ультрафиолету, в каплях слюны погибает за 30 минут, при высыхании и действии дезинфицирующих средств — мгновенно. Хорошо переносит пониженные температуры. Вирус можно выделить из различных сред организма (кровь, моча, кал, смывы со слизистых ротоглотки, конъюнктив, цереброспинальной жидкости). [2] [5]
Эпидемиология
Антропоноз. Источник заболевания – исключительно заражённый человек, также с атипичной формой заболевания кори. Инфицированный заразен с последних 2-х дней инкубации и до 4-го дня с момента появления высыпаний включительно — с 5 дня заразность пропадает.
Передача заболевания
Механизм передачи: воздушно-капельный (путь аэрозольный), редко трансплацентарный (при заболевании женщины в конце беременности). Теоретически возможно заражение от недавно привитых (но на практике такое случается чрезвычайно редко).
Существует весенне-зимняя сезонность. После перенесённой инфекции, полного курса вакцинации развивается стойкий пожизненный иммунитет.
Корь — одна из основных причин смерти среди детей раннего возраста.
В 2015 году в глобальных масштабах произошло 134 200 случаев смерти от кори. [1] [3]
Кто подвергается риску
Заразиться корью может любой человек, не имеющий иммунитета — тот, кто не был вакцинирован или тот, у кого не выработался иммунитет после вакцинации.
Самому высокому риску заболевания корью и развития осложнений, включая смертельный исход, подвергаются невакцинированные дети раннего возраста. Корь — одна из основных причин смерти среди них.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы кори
Инкубационный период
Инкубационный период при типичной форме — от 9 до 11 суток (в некоторых случая до 13).
Симптомы кори у взрослых
Начало заболевания подострое (т.е. основной синдром появляется на 2-3 сутки от начала заболевания), однако при должной подготовке врача (выявлении патогномоничной энантемы — сыпи на слизистых оболочках) можно определить острое начало (в течении первых суток). Во взрослом возрасте из-за особенностей иммунной системы эти критерии могут не соблюдаться.
- синдром выраженной общей инфекционной интоксикации;
- синдром патогномоничной энантемы (пятна Бельского-Филатова-Коплика);
- синдром макуло-папулёзной экзантемы;
- синдром конъюнктивита (выраженный);
- синдром поражения респираторного тракта (фарингит, трахеобронхит);
- синдром генерализованной лимфаденопатии (ГЛАП);
- гепатолиенальный синдром.
Описана так называемая ранняя диагностика кори, включающая:
- затруднение носового дыхания;
- покраснение правого века;
- субфебрилитет (лихорадка постоянного типа).
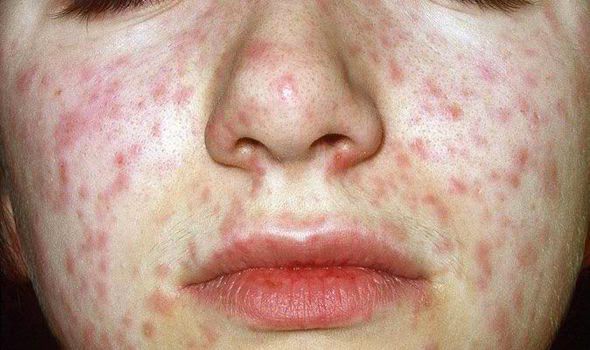
![Сыпь при поражении вирусом кори]()
Объективно: можно отметить возникновение макуло-папулёзной сыпи, появляющейся в типичных случаях на 3-4 день болезни, с выраженной этапностью (лицо, шея; после туловище, руки, бёдра; затем олени и стопы, а на лице в этот момент бледнеет). Высыпания представляют собой папулы, окруженные красным пятном, предрасположенные к слиянию (но при наличии чистых участков), иногда появляются петехии. Спустя 3-4 дня сыпь становятся бледной и оставляет после себя бурые пятна и отрубевидное шелушение. Увеличиваются и приобретают чувствительность периферические лимфоузлы (затылочные, заднешейные и подмышечные). Ярко выражен конъюнктивит (конъюнктивы масштабно гиперемированы, отёчны, быстро присоединяется гнойное отделяемое). Характерным является вид больного: одутловатое лицо, красные (как у кролика) глаза, отёчность носа и век, сухие потрескавшиеся губы. При аускультации в лёгких прослушиваются сухие хрипы. Выражена тахикардия, снижение артериального давления. Увеличиваются размеры печени и селезёнки (генерализация инфекции).
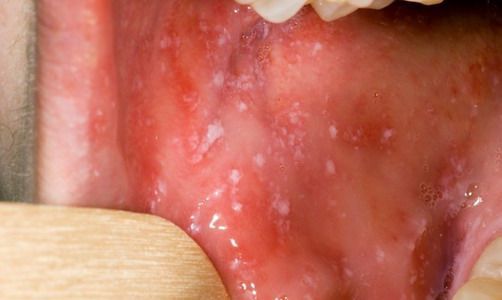
![Пятна Бельского — Филатова — Коплика]()
При фарингоскопии в ротоглотке визуализируется гиперемия мягкого нёба, на слизистой поверхности щёк в начале заболевания пятна Бельского — Филатова — Коплика (мелкие белесоватые пятнышки с узкой красноватой каёмкой), которые пропадают при появлении экзантемы. Иногда появляется пятнистая энантема на слизистой мягкого нёба.
Описана митигированная корь (у людей, получивших специфический противокоревой иммуноглобулин в период инкубации), характеризующаяся удлинением инкубационного периода до 21 дня, лёгким течением.
При абортивной форме заболевания характерно типичное начало, но спустя 1-2 суток клинические проявления исчезают.
Существует понятие — реакция на прививку (при первичном введении живой противокоревой вакцины), характеризующееся повышением температуры тела, катаральными явлениями (воспалениями) со стороны верхних дыхательных путей, скудной малозаметной сыпью (чаще развивается у детей и лиц с иммунодефицитом).
У больных с наличием тяжелого иммунодефицита – СПИДа (ВИЧ, онкологические больные, лица, получающие системные цитостатики после трансплантации органов) — течение заболевания крайне тяжёлое (летальность до 80%). [4] [5]
Врожденные заболевания являются одной из распространенных причин младенческой и детской смертности, развития хронических болезней у детей и инвалидизации.
Быстрый переход
Врожденные заболевания могут быть обусловлены генетическими мутациями (передающимися по наследству или спонтанными), инфекциями матери во время беременности (цитомегаловирус, ветряная оспа, краснуха), воздействием лекарств и химических веществ, загрязняющих воздух, воду или пищу. Причины множества врожденных дефектов до сих пор неизвестны.
Генетическими или наследственными факторами обусловлены около 20 % врожденных заболеваний. К ним относятся нарушения, при которых мутация затрагивает один ген (серповидно-клеточная анемия); хромосомные нарушения, при которых хромосомы (или их части) отсутствуют (синдром Тернера) или имеют структурные изменения (увеличение количества хромосом или трисомия при синдроме Дауна); многофакторные нарушения, вызванные мутациями двух и более генов. Врожденные дефекты и нарушения развития могут вызывать делеции или дупликации отдельных генов (изменения митохондриальной ДНК). Примером такого заболевания является муковисцидоз, характеризующееся поражением экзокринных желез и жизненно-важных органов (легких и желудочно-кишечного тракта). Врожденные заболевания также ассоциированы со случайными (новыми) повреждениями генов, спонтанными (не наследующимися от родителей) мутациями (большинство случаев ахондроплазии).
По статистике, врожденные заболевания имеют 2–3 % младенцев. К возрасту 1 года их число увеличивается до 5 %, поскольку не все эти патологии диагностируются сразу после рождения.
Врожденные (наследственные) заболевания также классифицируют по типу наследования. При аутосомно-доминантном наследовании заболевание может передаваться от родителя к ребенку в 50 % случаев (мышечная дистрофия Дюшенна, хорея Гентингтона). При аутосомно-рецессивном наследовании генетическая аномалия передается ребенку только в том случае, если оба родителя наделены одним и тем же дефектным геном (муковисцидоз, серповидно-клеточная анемия). Здесь частота наследования составит 25 %, то есть в среднем у 1 ребенка из 4 детей этих родителей будет аутосомно-рецессивное заболевание.
Патологические состояния могут передаваться и при наследовании, сцепленном с полом (наследование гена, находящегося в половых хромосомах). Х-сцепленные рецессивные заболевания почти всегда ограничены мужским полом (гемофилия, дальтонизм, мышечная дистрофия Дюшенна). Х-сцепленные доминантные заболевания встречаются как у мальчиков, так и у девочек, однако у детей мужского пола имеют более тяжелое течение (Х-сцепленный гипофосфатемический рахит). Y-сцепленные заболевания встречаются довольно редко, поскольку Y-хромосома содержит всего несколько генов (ихтиоз).
Некоторые врожденные заболевания формально не относятся к генетическим, но имеют ту или иную выраженность наследования: наследуются факторы риска либо сам ген, но с низкой пенетрантностью (частотой проявления гена в признаках).
Гемофилия
Гемофилия — группа редких наследственных нарушений свертываемости крови, вызванных дефицитом необходимого белка (фактора свертывания крови).
Гемофилия A (классическая) встречается чаще (>80 % случаев) и связана с дефицитом VIII фактора свертывания крови, гемофилия B (болезнь Кристмаса) — реже (>10 % случаев), она обусловлена недостаточностью IX фактора свертывания крови. Гемофилия C встречается очень редко, обусловлена дефицитом XI фактора свертывания крови, чаще всего в классификации группы ее не упоминают.
Заболевание относится к X-сцепленным с полом, наследуется по рецессивному признаку по женской линии. Классическую гемофилию вызывают мутации гена F8, расположенного на X-хромосоме. Примерно в 70 % случаев заболевание наследуется по Х-сцепленному образцу, в остальных случаях оно возникает спонтанно (новая мутация), в дальнейшем спонтанное заболевание становится наследственным. Гемофилией A болеют практически исключительно мужчины, редкие случаи заболевания у женщин, носительниц дефектного гена, почти всегда характеризуются легким течением. Гемофилию B вызывают мутации гена F9, так же расположенного на X-хромосоме, она характерна для мужчин, женщины болеют очень редко. В некоторых случаях заболевание возникает спонтанно (приобретенная гемофилия A или B) и тоже связано с недостаточностью VIII или IX факторов свертывания крови. Приобретенная гемофилия является аутоиммунным заболеванием, при котором организм вырабатывает антитела, атакующие факторы свертывания крови (чаще всего VIII фактор). Примерно в половине случаев приобретенной гемофилии у пациента имеется связанное с ней основное состояние или заболевание (беременность, аутоиммунные заболевания, миелопролиферативные заболевания, воспалительные заболевания кишечника и др.), в остальных эпизодах причина остается невыясненной.
Гемофилия A затрагивает примерно 1 из 5 000 новорожденных мальчиков, гемофилия B — примерно 1 из 25 000. Около 60 % пациентов имеют тяжелую форму гемофилии, обычно им ставят диагноз при рождении или в течение первых 2 лет жизни.
Возраст манифестации гемофилии и тяжесть течения заболевания зависят от уровня активности факторов свертывания крови. Легкая форма характеризуется уровнем фактора свертывания крови (VIII или IX), превышающим 5 % от нормы, средняя — 1–5 %, тяжелая — ниже 1 %. У большинства пациентов, независимо от тяжести течения заболевания, эпизоды кровотечения чаще встречаются в раннем детском, детском и подростковом возрасте, чем в дальнейшей взрослой жизни.
При легкой и умеренной формах гемофилии длительные кровотечения могут возникнуть только в результате травмы, хирургического вмешательства или стоматологической процедуры. Нередко диагноз гемофилии ребенку устанавливают к 5–6 годам, обратив внимание на длительное посттравматическое кровотечение, длительное кровотечение во время стоматологического лечения или операции. К другим заметным симптомам легкого и умеренного течения гемофилии относятся непроходящие гематомы (синяки), частые носовые кровотечения, кровоточивость десен.
Для тяжелой формы гемофилии характерны эпизоды спонтанного кровотечения, которые приводят к кровоизлияниям различной локализации — в мягкие ткани, мышцы, суставы. При гемартрозах (кровоизлияние в полость сустава) возникает ограничение подвижности суставов, сопровождающееся острой болью и воспалением. У пациентов с тяжелой формой гемофилии спонтанные кровотечения чаще всего происходят в мышцы и суставы, однако могут затрагивать любой внутренний орган, включая почки, органы ЖКТ, головной мозг (гематурия, мелена, гематохезия, желудочно-кишечные кровотечения, внутричерепные кровотечения). Тяжелая форма гемофилии A обычно проявляется в раннем детском возрасте, диагноз чаще всего устанавливается к 2 годам ребенка. Обычными симптомами (при отсутствии лечения заболевания) здесь являются кровотечения из-за незначительных травм ротовой полости (прикусывание губ, языка, щек), подкожные гематомы, большие шишки после удара головой, спонтанные кровотечения (2–5 эпизодов в месяц).
Диагноз гемофилии A или B устанавливается на основании симптомов, истории личного и семейного анамнеза пациента, лабораторных исследований (общего анализа крови, коагулограммы, оценивающей состояние системы свертывания крови и активности ее белков, молекулярно-генетического исследования). Парам из группы риска по рождению ребенка с гемофилией необходимо получить генетическую консультацию на этапе планирования беременности. Определение конкретной мутации гена F8 (или F9) помогает не только выявить женщин-носительниц дефектного гена в конкретной семье, но и полезно для пренатальной диагностики гемофилии (амниоцентез, биопсия хориона).
Некоторым пациентам с легкой формой гемофилии назначается синтетический аналог вазопрессина — десмопрессин, повышающий VIII фактор свертывания крови (вводится внутривенно или интраназально), а также антифибринолитические средства, замедляющие распад факторов свертывания крови.
Примерно в 30 % случаев лечения тяжелых случаев гемофилии длительная заместитетельная терапия может приводить к изоиммунизации — образованию антител к вводимым факторам свертывания крови (иммунная система распознает вводимый фактор VIII как чужеродный). Этот процесс может сопровождаться аллергическими реакциями (разной степени тяжести), возрастает риск жизнеугрожающих кровотечений. В этом случае пациенту назначается альтернативное лечение — плазмаферез, иммунодепрессанты.
Гемохроматозы
Гемохроматоз — наследственное заболевание, характеризующееся нарушением обмена железа и его накоплением в тканях и органах.
Заболевание сопровождается повышенным всасыванием железа в желудочно-кишечном тракте и накоплением в печени, сердце, поджелудочной железе, суставах, гипофизе, что приводит к полиорганной недостаточности и развитию таких болезней, как цирроз печени, рак печени, диабет, болезни сердца и суставов.
Наследственный гемохроматоз вызывают мутации генов HFE, HFE2, HAMP, SLC40A1 и TfR2, он классифицируется в зависимости от возраста начала, генетической причины и способа наследования: гемохроматоз 1 типа, гемохроматоз 2 типа, гемохроматоз 3 типа, гемохроматоз 4 типа. Вторичный гемохроматоз ассоциирован с другими заболеваниями (не является наследственным) — анемией, хронической болезнью печени, инфекциями.
Гемохроматоз, редко возникающий в младенческом возрасте и не имеющий явной причины, называют неонатальным гемохроматозом. При этой форме заболевания избыточное накопление железа в тканях и органах начинается еще до рождения ребенка. Неонатальный гемохроматоз быстро прогрессирует и характеризуется поражениями печени, которые выявляют при рождении или в первые дни жизни. Дети с этим заболеванием часто рождаются недоношенными или имеют нарушения внутриутробного развития. Точная причина неонатального гемохроматоза неизвестна, есть версия, что он развивается в том случае, если иммунная система матери распознает клетки печени ребенка как чужеродные. Симптомы обычно включают гипогликемию, нарушения свертываемости крови, пожелтение кожных покровов и склер глаз, отеки. Диагноз устанавливается на основании признаков и симптомов, лабораторных и инструментальных исследований, биопсии печени. Лечение включает переливание крови, внутривенное введение иммуноглобулинов, трансплантацию печени.
Гемохроматоз 1 типа ассоциирован с мутациями в гене HFE, расположенном на коротком плече 6–й хромосомы, наследуется по аутосомно-рецессивному типу, является наиболее распространенным типом наследственного гемохроматоза и поражает в основном мужчин. Вероятность того, что ребенок унаследует мутацию в гене HFE от родителя составляет 25 %, вероятность того, что он станет носителем дефектного гена — 50 %.
Начальные симптомы заболевания обычно отмечаются в возрасте 40–60 лет и включают боль в животе, снижение полового влечения, усталость, слабость, боли в суставах, сухость кожи. В дальнейшем проявляются такие симптомы и осложнения, как изменение пигментации кожи (бронзовая кожа), выпадение волос на голове и туловище, аритмия, кардиомиопатия, хроническая сердечная недостаточность, сахарный диабет, гепатомегалия, цирроз печени, спленомегалия, атрофия яичек, аменорея (у женщин) и другие.
Диагноз устанавливается на основании симптомов заболевания, лабораторных исследований (уровень железа, ферритина, трансферрина, железосвязывающей способности сыворотки крови, маркеры функции печени, уровень глюкозы крови и др.), инструментальных исследований (рентгенография суставов, электрокардиография и эхокардиография сердца, УЗИ органов брюшной полости, МРТ печени и др.), биопсии печени, молекулярно-генетического исследования (в том числе для выявления родственников — имеющих гемохроматоз или носителей).
Лечение гемохроматоза направлено на удаление избытка железа из организма (флеботомия, хелатирование) с помощью забора крови (как при взятии анализов или донорстве крови, только в большем объеме) и специальных препаратов, образующих комплексное соединение с железом и способствующих его удалению из железосодержащих белков (дефероксамин).
Терапевтическая флеботомия сначала проводится 1–2 раза в неделю, поддерживающая — каждые 2–4 месяца. Вместе с этим проводится симптоматическое лечение сахарного диабета, патологий сердца, цирроза печени и других заболеваний, вызванных гемохроматозом. Пациентам запрещен прием препаратов железа и любых медикаментозных средств или комплексов, которые могут содержать железо и витамин C, запрещен алкоголь во избежание дальнейшего повреждения печени (если оно имеется), рекомендуется придерживаться диеты, исключающей продукты с высоким содержанием железа (красное мясо, яблоки, печень, шпинат).
Гемохроматоз 2 типа вызывают мутации в генах HFE2 или HAMP, он наследуется по аутосомно-рецессивному типу и проявляется чаще всего в детском возрасте. Для этого типа заболевания характерны следующие симптомы: высокие уровни ферритина и трансферрина, врожденный фиброз печени, артропатия, кардиомиопатия, генерализованная гиперпигментация кожи, мышечная слабость, гипогонадизм, задержка полового созревания, сахарный диабет, цирроз печени, остеопороз, спленомегалия, гепатомегалия и другие. Диагностика и лечение гемохроматоза 2 типа проводятся аналогично диагностике и лечению гемохроматоза 1 типа.
Гемохроматоз 3 типа вызывают мутации в гене TFR2, он наследуется по аутосомно-рецессивному типу. Симптомы обычно проявляются до 30 лет и, помимо вышеперечисленных, могут включать снижение уровня лимфоцитов и нейтрофилов в крови, красные или пурпурные пятна на коже. Диагностика и лечение гемохроматоза 3 типа проводятся аналогично диагностике и лечению гемохроматоза 1 и 2 типов.
Симптомы гемохроматоза 4 типа могут проявиться как в детском, так и во взрослом возрасте. Этот тип заболевания вызывают мутации гена SLC40A1, наследуется оно по аутосомно-доминатному типу. Вероятность того, что ребенок унаследует мутацию в гене SLC40A1 от родителя составляет 50 %, соответственно, вероятность того, что он станет носителем дефектного гена — тоже 50 %. Симптомы гемохроматоза 4 типа могут проявляться в виде повышенной утомляемости, слабости, болей в суставах, изменения пигментации кожи, затруднения дыхания, сердечной недостаточности, сахарного диабета, анемии, врожденного фиброза печени, цирроза печени, остеоартроза, катаракты. Диагностика и лечение гемохроматоза 4 типа проводятся аналогично диагностике и лечению гемохроматоза 1, 2 и 3 типов.
Наследственный гемохроматоз — заболевание с пониженной пенетрантностью (вероятностью того, что ген будет иметь любые фенотипические проявления) дефектного гена, т. е. у некоторых людей с мутациями гена HFE никогда не проявятся симптомы, при этом у их детей или других членов семьи с мутацией гена произойдет манифестация заболевания.
Мышечная дистрофия Дюшенна
Мышечная дистрофия Дюшенна — редкое наследственное заболевание, характеризующееся нарастающей мышечной слабостью с последующей атрофией мышц. Ассоциировано с мутацией гена DMD, расположенного на половой X-хромосоме (X-сцепленный рецессивный тип наследования).
В ряде случаев требуется консультация кардиолога, невролога.
Острая ревматическая лихорадка (ОРЛ) — негнойное осложнение, которое возникает через 2-4 недели после перенесенного стрептококкового тонзиллофарингита.
Стрептококковый тонзиллофарингит (далее БГСА-фарингит) — острое инфекционное заболевание с поражением лимфоидного аппарата и слизистой оболочки глотки.
Особую опасность представляют осложнения БГСА-фарингита, которые делятся на:
- ранние (гнойные), развивающиеся на 4-6-й день от начала заболевания — отит, синусит, паратонзиллярный абсцесс, шейный лимфаденит, пневмония и др.;
- поздние (негнойные) — острая ревматическая лихорадка, постстрептококковый гломерулонефрит, токсический шок.
Эпидемиология ОРЛ
Острую ревматическую лихорадку и ревматическую болезнь сердца называют болезнями бедности и экономического неблагополучия. Осложнения, вызванные БГСА, являются основной причиной смерти от сердечно-сосудистых заболеваний у людей в возрасте до 50 лет, проживающих в развивающихся странах. ОРЛ может возникнуть в любом возрасте.
Во всем мире ежегодно регистрируется около 470 000 новых случаев ОРЛ и 275 000 случаев смерти, связанных с ревматическим пороком сердца.
Чаще всего ОРЛ встречается у детей от 5 до 15 лет. ОРЛ развивается в 0,5-3% случаев, если БГСА-фарингит не лечили.
Причины развития ОРЛ
Причины развития ОРЛ определены не полностью, но роль БГСА в этом процессе очевидна: ОРЛ возникает только после БГСА-фарингита или скарлатины с сопутствующим фарингитом и не возникает после инфекций кожи и мягких тканей. Предполагается, что это связано с различным иммунным ответом на кожную и глоточную инфекцию, а также с отсутствием ревматогенного потенциала у штаммов, вызывающих кожные инфекции.
Диагностика ОРЛ
Для диагностики ОРЛ используются большие и малые критерии Джонса (Jones Criteria), разработанные американской кардиологической ассоциацией.
Пять больших критериев:
1. Кардит и вальвулит — развивается в 50-70% случаев.
Поражение слоев и клапанов сердца. Возникает в течение 3 недель после БГСА-фарингита. Начинается как правило с эндокардита с последующим развитием панкардита, из клапанов сердца чаще поражаются митральный и аортальный. Прогрессирование заболевания может длиться годами после ОРЛ и приводить к сердечной недостаточности.
2. Артрит (мигрирующий полиартрит) — развивается в 35-66% случаев.
Воспаление сустава — самое раннее проявление ОРЛ, возникает в течение 21 дня после БГСА-фарингита, длится 4 недели и проходит без следа. Чаще поражается коленный, голеностопный, локтевой, лучезапястный суставы. Артрит носит мигрирующий характер — последовательно поражаются несколько суставов.
Резкие, неритмичные, непроизвольные движения конечностей, мышечная слабость, эмоциональные расстройства. Возникает через 1-8 месяцев после острого БГСА-фарингита. Чаще затрагивается мимическая мускулатура, могут наблюдаться нарушения речи. Эмоциональные изменения проявляются вспышками неуместного поведения, включая плач и беспокойство. У 17-35% пациентов может перерастать в обсессивно-компульсивное расстройство.
4. Ревматическая эритема — развивается менее, чем в 6% случаев.
Розовая или бледно-красная не зудящая кольцевидная сыпь. Локализуется на теле или конечностях, но не на лице. Сыпь может появляться, исчезать, возникать снова.
5. Подкожные узелки — развиваются менее, чем в 10% случаев.
Плотные безболезненные образования от нескольких миллиметров до 2 см. Сохраняются не более месяца. Локализация узелков — чаще над костью, на разгибательных поверхностях, симметрично. Кожа над узелком не воспалена, подвижная.
- Артралгия — боль в суставах.
- Лихорадка (выше 38,5 °C).
- Повышенная скорость оседания эритроцитов (СОЭ) — выше 60 мм/ч, С-реактивного белка (СРБ) — выше 30 мг/л.
- Удлинение интервала PR на ЭКГ.
Диагноз ОРЛ устанавливается на основании:
- факта перенесенного БГСА-фарингита — подтверждается положительным экспресс-тестом, бактериологическим исследованием в момент острой инфекции или увеличением титра антистрептолизина-О (АСЛО) уже во время возникновения осложнений;
- критериев Джонса: 2 больших критерия, 1 большой и 2 малых критерия или 3 малых критерия, если пациент ранее перенес ОРЛ.
Всем пациентам с подозрением на ОРЛ обязательно проводится ЭКГ и ЭхоКГ (УЗИ сердца) для выявления морфологических изменений клапанов сердца и признаков патологической регургитации (обратного заброса крови). Лабораторные исследования по показаниям (так как они являются неспецифическими) — СОЭ и СРБ. При признаках хореи необходим неврологический осмотр.
Лечение ОРЛ
Эрадикация БГСА-инфекции необходима независимо от того, есть ли признаки фарингита. Антибактериальная терапия проводится аналогично терапии при остром тонзиллофарингите.
- артрит — нестероидные противовоспалительные средства для облегчения боли и предотвращения вовлечения в процесс новых суставов;
- кардит — лечение проводится только при развитии сердечной недостаточности;
- хорея — обычно не требует лечения, но иногда может потребоваться назначение нейролептиков, противосудорожных препаратов;
- эритема и подкожные узелки — лечение не проводится.
Профилактика ОРЛ
Первичная — своевременная диагностика и лечение БГСА-фарингита.
Вторичная — предотвращение новых эпизодов БГСА-инфекции, в том числе эрадикация БГСА даже при бессимптомном носительстве.
Длительность антибиотикопрофилактики определяется на основании особенностей имеющегося патологического процесса. Если речь о постстрептококковом артрите, ее можно ограничить 1-2 годами. При ОРЛ без кардита длительность приема антибиотиков составляет 5 лет или до 21 года пациента (что дольше), ОРЛ с кардитом без последствий — 10 лет или до 21 года (что дольше), ОРЛ с поражением клапанов сердца — 10 лет или до 40 лет (что дольше), а иногда пожизненно.
Как происходит лечение ОРЛ в клинике Рассвет?
Мы проводим своевременную диагностику и адекватное лечение БГСА-фарингита, что снижает частоту ОРЛ почти на 70%. При выборе антибактериальной терапии всегда отдаем предпочтение антибиотикам пенициллинового ряда — как самым эффективным препаратам, доказанно снижающим частоту развития ОРЛ. Мы никогда не сокращаем курс антибактериальной терапии при клиническом улучшении. При выявлении БГСА-фарингита не назначаем местное лечение (полоскания, спреи) в ущерб системной антибактериальной терапии.
Мы проводим адекватную эрадикационную терапию БГСА при ОРЛ с целью предотвращения рецидивов и прогрессирования ревматической болезни сердца. Предлагаем полное обследование при диагностированной ОРЛ — ЭКГ, ЭХО-КГ, консультирование у кардиолога и невролога с подбором необходимой терапии.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Дифтерия: причины, симптомы, диагностика и способы лечения.
Дифтерия – одна из самых грозных инфекций, представляющая высокий риск для жизни пациента. Не случайно первая Нобелевская премия по физиологии и медицине была присуждена в 1901 г. Э.А. Берингу за разработку лечебной сыворотки против этого заболевания.
Несмотря на то, что многие считают дифтерию исключительно детской болезнью, она встречается и у взрослых.
Источником инфекции является больной или бактерионоситель, возбудитель передается воздушно-капельным, контактно-бытовым и пищевым путями.
Дифтерия – бактериальная инфекция, возбудителем которой является Corynebacterium diphtheriae (дифтерийная палочка, или бацилла Леффлера).
Этот микроорганизм обладает высокой устойчивостью к воздействию факторов окружающей среды. Это необходимо знать и учитывать при проведении дезинфекции в очаге распространения.
Отрицательное воздействие на С. diphtheriae оказывают прямые солнечные лучи, высокая температура и некоторые химические вещества (дезинфектанты).
Распространение токсина по организму приводит к поражению органов и систем, среди которых наиболее часто страдают сердце, надпочечники, почки и нервные волокна.
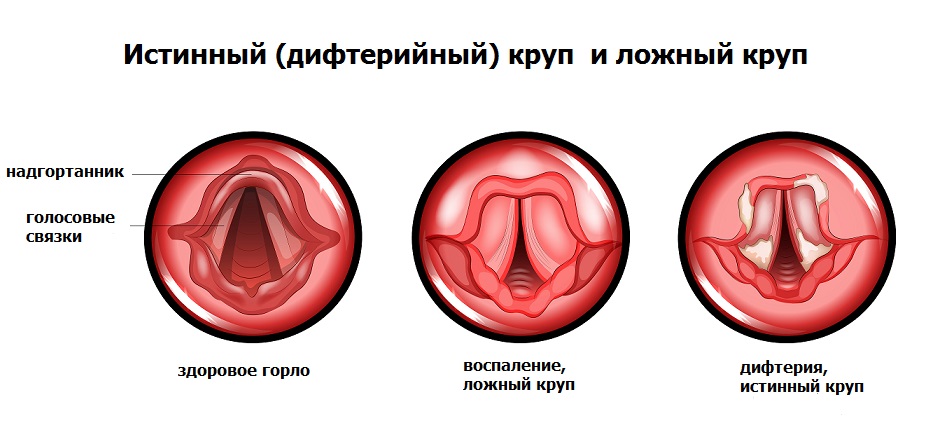
Характерным признаком болезни является образование плотных серовато-белых фибриновых пленок на слизистых ротоглотки. Дифтерийный налет покрывает миндалины, а также глотку и гортань, что вызывает сужение их просвета и нарушает прохождение воздуха в нижележащие дыхательные пути. Закупорка дыхательных путей пленкой и отек могут привести к развитию крупа, особенно у детей раннего возраста.
Классификация форм заболевания
Проявления заболевания могут быть связаны с местом проникновения бактерий в организм: дифтерия ротоглотки, гортани, носа, глаз, половых органов, ран и т. д. В зависимости от распространенности поражения выделяют локализованную, распространенную, комбинированную, а также токсическую формы болезни. Токсическая форма протекает тяжелее остальных и характеризуется поражением внутренних органов.
Дифтерия различается по степени тяжести: легкая, среднетяжелая и тяжелая, которая, в свою очередь, также подразделяется на три степени. Для этого заболевания, особенно при тяжелом течеении, характерно развитие осложнений, присоединение вторичной инфекции, а также обострение хронических заболеваний.
Симптомы дифтерии
Наиболее часто встречается дифтерия ротоглотки и гортани. Большинство форм дифтерии сопровождаются лихорадкой (повышением температуры тела с ознобом), отеком и некрозом слизистой оболочки миндалин, увеличением лимфоузлов.
Дифтерия ротоглотки отличается появлением на небных миндалинах пленок беловато-серого цвета, которые могут распространяться на нёбные дужки, язычок, нёбо.
Ощущается болезненность во время глотания. При попытке снять пленки обнажается кровоточащая слизистая. Для дифтерии ротоглотки, особенно у непривитых пациентов, характерно развитие осложнений.
В отличие от дифтерии ротоглотки, при дифтерии гортани (истинном крупе) токсическое поражение внутренних органов нетипично. Опасность в данном случае представляют легко отслаивающиеся от слизистой фибриновые пленки, которые приводят к сужению дыхательных путей вплоть до полной их закупорки и развития асфиксии (удушья).
Необходимо различать истинный круп при дифтерии и ложный круп при острой респираторной вирусной инфекции.
![дифтерия.jpg]()
Для истинного крупа характерно постепенное ухудшение состояния больного, появление лающего кашля с изменением голоса иногда до полной афонии. Приступы ложного крупа можно облегчить ингаляциями с глюкокортикостероидными препаратами, что, к сожалению, не действенно при дифтерийном крупе.
Диагностика
Диагностика дифтерии начинается со сбора жалоб, истории заболевания, клинического осмотра пациента.
Врачу важно знать, есть ли у ребенка прививки от дифтерии, а также есть ли в его окружении больные с подозрением на дифтерию.
Основным методом лабораторной диагностики дифтерии является бактериологическое исследование (посев) мазка из зева.
Подтверждение диагноза дифтерии. Дифтерия вызывается Corynebacterium diphtheridae. Это грамположительная, аэробная неподвижная бактерия. У непривитых детей и взрослых возникает сильная интоксикация организма, воспаление горла и дыхательных путей. Возможны тяжёлые осложнения: отёк горла, нар.
Читайте также: