Козлов р с инфекции кожи и мягких тканей
Обновлено: 26.04.2024
Инфекции кожи и мягких тканей — наиболее частая причина обращения больных в хирургический стационар или поликлинику.
В 2004 году во Франции, Германии, Италии, Испании, Великобритании 1,3 миллиона пациентов были госпитализированы по поводу ИКМТ, в том числе из-за целлюлита (52,7 процента), локальной хирургической инфекции (15,8 процента), диабетической стопы (15,3 процента), пролежней (12 процентов).
По экспертным оценкам, в России инфекции кожи и мягких тканей составляют от 480 до 700 тысяч пациентов в год. Ежегодно в России за помощью в медицинские учреждения обращаются до 1,5 миллионов больных с трофическими язвами, около 500 тысяч больных с синдромом диабетической стопы.
Что вызывает инфекции кожи и мягких тканей?
Инфекции кожи и мягких тканей обычно вызываются несколькими микробами одновременно, но наиболее частым возбудителем в большинстве случаев является золотистый стафилококк (S. Aureus). Особую опасность представляет широкое распространение штаммов устойчивых к большинству антимикробных препаратов — бета-лактамным антибиотикам, аминогликозидам, линкозамидам, фторхинолонам.
Кроме того, в лечебных учреждениях широко распространены грамотрицательные бактерии семейства Enterobacteriaceae (Klebsiellaspp., Enterobacterspp., E. Coli), которые обычно резистентны к цефалоспоринам.
Как выбрать препарат для лечения инфекций кожи и мягких тканей?
При выборе средств антибактериальной терапии крайне важен подход к выбору препаратов, который определяется уровнем поражения мягких тканей, особенностями течения заболевания и наличием лекарственной устойчивости.
Следует помнить, что любая рана, независимо от места ее локализации и происхождения, всегда содержит определенное количество микроорганизмов (первичное микробное загрязнение). Главное назначение любой первичной повязки заключается в остановке кровотечения и предупреждении инфицирования раны, независимо от того, накладывают ли ее дома, врачи скорой помощи, врачи поликлиник или стационаров. В последующем лечение проводится в соответствии с фазой раневого процесса, видовым составом попавших в рану микробов.
Какие средства пришли на смену мази Вишневского?
В последние два десятилетия при лечении гнойно-воспалительных процессов и гнойных ран широко используются новые антисептики (йодопирон, мирамистин, диоксидин, лавасепт). Малоэффективные мази на ланолин-вазелиновой основе (мазь Вишневского, ихтиоловая мазь, стрептоцидовая, эритромициновая, тетрациклиновая, фурациллиновая и др.) практически полностью вытеснены из практики лечения больных с инфекцией кожи и мягких тканей. На смену этим препаратам пришли мази на полиэтиленгликолевой (ПЭГ) основе.
Особенные сложности всегда возникают при лечении больных с инфекцией кожи и мягких тканей (трофические язвы, пролежни, термические поражения кожи, послеоперационные и посттравматические раны) на фоне аллергии, лекарственных и микробных дерматитов, повторяющегося инфицирования ран госпитальными высокорезистентными микроорганизмами (S.аuereus, S.pyogenes, Enterococcus spp., P.аeruginosa, Enterobacteriaceae, Bacteroides sp.). Эта инфекция может попасть в ткани с кожи пациента при недостаточном соблюдении правил личной гигиены, а также гигиены постельных принадлежностей, рук медицинского персонала и т.д. Реинфицирование вызывает грубое нарушение процессов заживления раны.
Крем Аргосульфан
В современном мире, где широко распространены штаммы микроорганизмов устойчивых к большинству лекарственных средств, препаратами выбора в таких ситуациях можно считать серебросодержащие лекарственные средства, например 2% крем сульфатиазола серебра (крем Аргосульфан). Крем Аргосульфан обладает высокой антимикробной активностью по отношению ко всем потенциальным возбудителям инфекций мягких тканей (в том числе при пролежнях и трофических язвах). Гидрофильная основа Аргосульфана защищает молодую эпителиальную ткань, активизирует рост поверхностного эпителия, тем самым крем позволяет быстро восстановить целостность кожных покровов. Основа крема также обеспечивает болеутоляющее действие и хорошую переносимость. Слабая растворимость серебряной соли сульфатиазола позволяет поддерживать постоянную концентрацию лекарства в тканях, а также обуславливает отсутствие токсичности. Особое значение имеет тот факт, что многолетние наблюдения показывают отсутствие устойчивости микробов к этому препарату.
Таким образом, Аргосульфан сегодня может рассматриваться как препарат выбора для местного лечения и профилактики инфекции кожи и мягких тканей: трофических язв, пролежней, ожогов, посттравматических и послеоперационных длительно незаживающих ран.
Инфекции кожи и мягких тканей: причины, диагностика, лечение, профилактика
Бактериальные инфекции кожи. Передача кожных инфекций осуществляется посредством контактного механизма. Заболевания быстро распространяются в местах скопления людей и в условиях антисанитарии. Возбудителями кожных инфекций могут быть многие микроорганизмы. Наиболее распространены Staphylococcus aureus и Streptococcus pyogenes.
Бактерии возбудители инфекций кожи и мягких тканей:
- S. aureus: импетиго, фурункулёз, невскрывающийся фурункул, токсический эпидермальный некролиз, острая паронихия
- S. pyogenes: целлюлит, рожа, импетиго
- С. diphtheriae: дифтерия (кожная форма)
- М. tuberculosis: волчанка обыкновенная
- М. marinum: хронические язвенные поражения кожи
- М. ulcerans: деструктивные язвы (язва Бурули)
- С. minutissimum: эритразма
- Pseudomonas aeruginosa: колонизация ожогов
- Erysipelothrix rhusiopathiae: эризипелоид
При целлюлите, вызванном S. pyogenes, S. aureus, Pasteurella multocida, реже вибрионами, обитающими в морской воде, и грамотрицательными бациллами, происходит поражение всех слоев кожи. Микроорганизмы проникают в организм человека через повреждённые участки кожи, раны и места укусов насекомых. Эмпирическое лечение флуклоксациллином необходимо начинать до получения результатов бактериологического исследования. В тяжёлых случаях применяют внутривенные антибактериальные препараты (бензилпенициллин и флуклоксациллин).
Некротизирующий фасцит — быстро прогрессирующая инфекция, поражающая также кожу и подкожную клетчатку. Заболевание развивается в результате микст-инфекции, вызванной аэробными и анаэробными микроорганизмами, а также вследствие моноинфекции S. pyogenes. Болезнь быстро прогрессирует и может привести к смерти пациента за очень короткое время. Большую роль в лечении играет успешное иссечение инфицированных некротических тканей, проводимое на фоне лечения бензилпенициллином, цефалоспоринами третьего поколения и метронидазолом.
Эритразма — поверхностная инфекция, возникающая на сгибательных поверхностях конечностей и вызываемая Corynebacterium minutissimum. Очаги поражения флюоресцируют в ультрафиолетовом свете. Возбудитель может быть выделен при посеве. Для лечения применяют эритромицин или тетрациклин.
Рожа — стрептококковая инфекция, поражающая органические участки кожи на лице или голенях. При обследовании отмечают обычно повышение количества лейкоцитов в периферической крови. Для лечения назначают приём внутрь амоксициллина и флуклоксациллина; в тяжёлых случаях может потребоваться внутривенное введение антибиотиков.
Эризипелоид — зоонозная инфекция, вызываемая Erysipelothrix rhusiopathiae. Местный очаг (обычно пальцы рук) характеризуется развитием эритемы красно-фиолетового цвета. В группу риска входят мясники (поражаются пальцы рук при работе с инфицированным мясом, чаше свиньи) и рыбаки. В большинстве случаев заболевание разрешается самостоятельно, но применение внутрь пенициллина или тетрациклина позволяет ускорить процесс выздоровления, назначение антибиотиков обязательно при развитии вторичной бактериемии.
Ожоги могут стать причиной инфекции, вызванной Pseudomonas aeruginosa, S. aureus, S. pyogenes и иногда бактериями кишечной группы. Возможно заражение антибиоти-коустойчивыми формами микроорганизмов. Бактериальное поражение может привести к отторжению пересаженной кожи и вторичной бактериемии.
Паронихия. Паронихия, или воспаление околоногтевой ткани, — распространённое заболевание, возникающее вследствие бактериальной инвазии (например, S. aureus) в местах повреждения кутикулы. При этом возникают боль, отёчность с последующим формированием небольшого абсцесса. Абсцесс дренируют и назначают антибактериальную терапию (флуклоксациллин и др.).
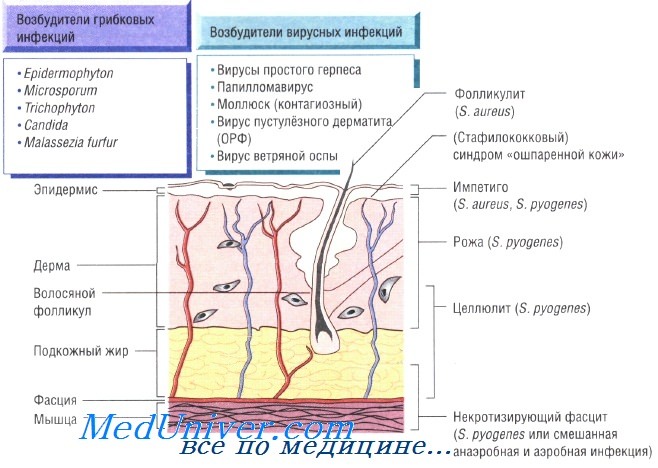
Причины инфекций кожи
Кожные проявления системных инфекций
На коже могут отражаться проявления системных инфекций. Ярким примером может служить петехиальная сыпь при менингококковой септицемии — несомненный признак тяжёлого сепсиса. У пациентов с синегнойной септицемией на коже возникают гангренозные очаги (гангренозная эктима). Менее выражены кожные изменения при эндокардите (кровоизлияния у оснований ногтей). При стафилококковой септицемии возникают участки инфаркта кожи, а при некоторых вирусных заболеваниях высыпания на коже становятся частью характерной клинической картины (ветрянка и корь).
Для вируса простого герпеса кожные покровы — первичный очаг инфекции. Некоторые штаммы Staphylococcus aureus и бета-гемолитических стрептококков вызывают системные заболевания, обусловленные действием токсинов и сопровождающиеся различными кожными изменениями: при синдроме токсического шока — генерализованная и сыпь на ладонях, при скарлатине — сыпь с бледностью носогубного треугольника, а при синдроме ошпаренной кожи у новорождённых — сильное шелушение.
Бородавки как инфекция кожи
Папилломавирус человека поражает клетки кожи и усиливает их репликацию, в результате чего формируется бородавка (папиллома). Существуют папулёзные, пятнистые и мозаичные виды папиллом, а также подошвенная (роговая) бородавка. Заболевание передаётся при непосредственном контакте с больным, а также через предметы общего пользования особенно при повышенной влажности (при совместном купании в бассейне).
Передача генитальных бородавок (остроконечных кондилом) осуществляется половым путём. Диагноз устанавливают на основании клинических признаков. Для определения вируса остроконечных кондилом применяют реакцию иммунофлюоресценции и полимеразную цепную реакцию.
Папилломавирусы вызывают злокачественные новообразования шейки матки (тип 16 и 18) и гортани (тип 6 и 11). В настоящее время существуют вакцины против виусов типа 16 и 18, которые формируют продолжительный иммунитет.
Папилломы со временем самостоятельно исчезают, не оставляя рубцов (за исключением случаев у людей со сниженным иммунитетом). Очень часто для самолечения применяют местные кератолитические вещества (салициловая кислота). При генитальных бородавках используют подофил щитовидный*. В качестве альтернативы применяют криотерапию, ускоряющую исчезновение папиллом. Прижигание в настоящее время не рекомендуют для частого использования у одного пациента.
Некоторые штаммы поксвирусов поражают кожный покров и вызывают возникновение характерных симптомов (например, контагиозный моллюск и контагиозный пустулёзный дерматит).
Дерматофитозы - грибковые инфекции кожи
Клинические признаки дерматофитозов. При дерматофитии (стригущем лишае) возникают бляшки, сопровождаемые зудом и покраснением. Со временем их диаметр увеличивается, а в центре образуется бледное пятно. При хроническом поражении ногтей наблюдают обесцвечивание и истончение ногтей, а при заболеваниях кожи головы — облысение и рубцевание. В основе названия заболевания лежит место заражения, например дерматофития головы (tinea capitis — стригущий лишай), дерматофития туловища (tinea corporis).
Лабораторная диагностика грибковых инфекций кожи. При инфекции кожного покрова отмечают свечение поражённых участков в ультрафиолетовом свете.
В лабораторию доставляют сухие соскобы с поражённых участков кожи, образцы ногтей и волос. При нагревании в растворе натрия гидроксида они обесцвечиваются, и во время микроскопии становятся видны гифы грибов. Дерматофиты растут на декстрозосодержащем агаре Сабурада при температуре 30 °С в течение четырёх недель.
В основе идентификации лежат морфологические свойства колоний, особенности микроскопической картины (окраска лактофеноловым синим), биохимическое исследование, а также секвенирование 18S рибосомальной РНК гена.
Лечение грибковых инфекций кожи. При дерматофитозах применяют местные препараты группы имидазола (миконазол, клотримазол, тиоконазол или аморолфин). При некоторых формах инфекции назначают тербинафин (внутрь) в течение нескольких недель.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Methicillin-resistantStaphylococcusaureus (MRSA) – являются ведущими возбудителями госпитальных инфекций, они впервые были описаны в 1961 г. в Англии, а в настоящее время распространены по всему миру. Важнейшая особенность MRSA – это устойчивость к большинству β-лактамных антибиотиков, а также высокая частота ассоциированной устойчивости к антибиотикам других групп. Особую тревогу вызывает появление и распространение MRSA со сниженной чувствительностью к ванкомицину и изолятов, устойчивых к даптомицину, линезолиду, тигециклину и цефтаролину. Изоляты со сниженной чувствительностью к этим препаратам уже регистрируются и в Российской Федерации. В обзоре представлены современные данные о распространении, антибиотикорезистентности, молекулярной эпидемиологии MRSA. Обсуждаются современные средства лечения и перспективы терапии MRSA-инфекций.
Введение
Золотистый стафилококк (Staphy-lococcus aureus) – наиболее частый патоген человека, вызывающий различные гнойные процессы: инфекции кожи и мягких тканей (ИКМТ), остеомиелиты, пневмонии, бактериемии. Кроме того, S. aureus является представителем нормальной микробиоты человека, считается, что он встречается у 30–60% человеческой популяции и бессимптомно колонизирует слизистые крыльев носа, крылья носа, подмышечные впадины, пах, подколенную область. Как известно, внедрение первых β-лактамов почти полностью решало проблему стафилококковых инфекций, связанных с хирургическим вмешательством. Однако у стафилококков достаточно быстро появилась устойчивость к пенициллину за счет приобретения плазмидной β-лактамазы.
В 1960-х гг. вскоре после внедрения в практику пенициллиназостабильных β-лактамов (метициллин) были описаны первые S. aureus, устойчивые к этим антибиотикам (Methicillin-resistant Staphylococcus aureus, MRSA) [1]. Достаточно быстро было установлено, что устойчивость к метициллину является маркером устойчивости ко всем β-лактамам, известным в то время. Впервые появившись в Англии, MRSA теперь циркулируют на всей планете. По количеству летальных исходов MRSA лидируют среди других мультирезистентных бактерий; так, в последнем (2013) опубликованном отчете CDC morrigan сообщается, что в США от инфекций, обусловленных мультирезистентными бактериями, погибают около 23 тыс. американцев в год, из них 11 тыс. приходится на MRSA [2]. Долгое время MRSA считался исключительно госпитальной инфекцией, но с 1990-х гг. стали описывать случаи тяжелых инфекций среди людей, не связанных с учреждениями здравоохранения (внебольничные MRSA) [3]. Позже, в середине 2000-х, появились MRSA, ассоциированные с инфекциями у животных, которые могут передаваться и человеку. Основным препаратом для лечения MRSA-инфекций длительное время оставались гликопептиды, однако в середине 1990-х впервые были описаны изоляты со сниженной чувствительностью к ванкомицину [4], а с 2002 г. – абсолютно резистентные фенотипы [5]. Появление изолятов, устойчивых к гликопептидам, послужило стимулом для разработки и внедрения новых антибиотиков и даже принципиально новых классов препаратов: оксазолидинонов, глицилциклинов, липопептидов, цефалоспоринов с анти-MRSA-активностью. Однако уже описаны клинические изоляты, проявляющие устойчивость и к этим антибиотикам. Биологические особенности основных генотипов MRSA кратко представлены в табл. 1.

Распространение и молекулярная эпидемиология MRSA в мире
В 1970–1980 гг. MRSA стали абсолютным лидером в структуре внутригоспитальных инфекций. Тем не менее частота регистрации случаев таких инфекций в разных странах колеблется в очень широком диапазоне. На рисунке представлены данные Европейской системы по надзору за распространением резистентности (European Antimicrobial Resistance Surveillance Network – EARS-Net), где показана доля выявляемых MRSA в разных странах за 2013 г. [9]. В таких странах, как Румыния, Италия, Греция, Португалия, Мальта, частота выявления MRSA очень высока (35–65%), напротив, в скандинавских странах эта доля не превышает 5%.
Азия – один из неблагоприятных регионов, где соотношение CA-MRSA и HA-MRSA составляет 25 и 75%. Особенно неблагоприятна ситуация в Корее, Шри-Ланке и Вьетнаме. Вместе с тем в некоторых странах отмечается появление и распространение клонов со сниженной чувствительностью к гликопептидам. На территории всего азиатского региона циркулирует ST239, который является ведущим нозокомиальным патогеном. Среди CA-MRSA преобладают клоны ST8, ST30, ST59, ST22, ST772 и ST72 [11].

В Австралии инфекции, вызванные MRSA, не превышают 30%, но остро стоит проблема CA-MRSA, с 2000-х гг. периодически описываются вспышки в местах повышенной скученности людей. К числу основных клонов CA-MRSA относятся ST93, ST75, ST30, ST1, ST45, ST78 и ST5 [13].
В связи с крайне высокой значимостью негативных клинических факторов, ассоциированных с MRSA, в США, Австралии и ряде стран Европы были приняты жесткие противоэпидемические меры по сдерживанию этой инфекции, что способствовало существенному снижению распространения MRSA [15]. В частности, в Европе удалось снизить частоту выделения c 24% в 2005 г. до 16% в 2013-м (см. рисунок).
Проблема снижения чувствительности к гликопептидам
В 2002 г. в Мичигане (США) был описан первый клинический изолят ванкомицинустойчивого S. aureus (VRSA-1). У этого изолята был обнаружен мобильный генетический элемент, полученный от ванкомицинрезистентного энтерококка [23]. С 2002 по 2009 г. в США было выявлено 11 изолятов VRSA: 7 – из Мичигана (VRSA-1, VRSA-5-10), изоляты из Пенсильвании (VRSA-2), Нью-Йорка (VRSA-3), а также из Индии и Ирана. По всему миру к 2013 г. всего было описано 33 клинических изолята VRSA [24–26]. Очевидно, что подобные фенотипы не распространяются и элиминируют из стафилококковой популяции.
Проблема MRSA в России
В России ситуацию с распространением MRSA, c одной стороны, нельзя оценить в силу отсутствия централизованной системы по сбору данных о циркуляции госпитальных и внегоспитальных патогенов, с другой – имеющиеся исследования показывают крайнюю неравномерность их распространения. Так, частота встречаемости MRSA может колебаться от 0 до 80% в зависимости от стационара и географического региона. Анализ популяционной структуры MRSA еще раз подчеркивает ее высокую клональность. Другая особенность – в России циркулируют только HA-MRSA. Изолят CA-MRSA, несущий токсин PVL, был обнаружен только в одном случае во Владивостоке [27]. Среди HA-MRSA доминируют два клона – ST8 и ST239, при этом первый превалирует [28, 29]. Проведенные авторами исследования показывают, что среди изолятов ST239 преобладают фенотипы с устойчивостью более чем к трем не-β-лактамным антибиотикам. Кроме того, ST239 встречается только среди больных инвазивными формами стафилококковых инфекций. Клон ST8, напротив, более гетерогенен по спектру антибиотикоустойчивости, а также может встречаться среди носителей. В работах О.А. Дмитренко было показано, что эти клоны циркулируют на территории России с 1990-х гг. [30]. По нашим данным, в Санкт-Петербурге и Москве с 2011 г. стал регистрироваться не характерный для России клон ST228, который характеризуется множеством различных детерминант устойчивости к не-β-лактамам, а также сниженной чувствительностью к новому цефалоспорину – цефтаролину. Помимо вышеперечисленных клонов гораздо реже, но встречаются ST1, ST5 и ST22.
Диагностика инфекций, вызываемых MRSA, детекция метициллинрезистентности
В современную диагностику инфекций, вызываемых MRSA, как и в другие области микробиологической диагностики, происходит постепенное внедрение молекулярных методов. На сегодняшний день существуют коммерческие тест-системы, основанные в основном на ПЦР, позволяющие выявлять MRSA непосредственно в биологических образцах, не выделяя чистую культуру возбудителя. Шире всего молекулярные методы применяются при диагностике бактериемии (сепсиса) и при скрининге на носительство MRSA, т.е. в тех ситуациях, когда скорость ответа имеет существенное значение. В случае бактериемии (сепсиса) быстрый ответ необходим для принятия решения об антибактериальной терапии, а в случае скрининга – для принятия решения о необходимости изоляции пациента. Скрининг на носительство широко распространен в Европе и США, где это исследование применяется в системе инфекционного контроля для предотвращения импорта MRSA в стационары.

При всей перспективности молекулярной диагностики классические методы вряд ли утратят свое значение в обозримом будущем. Если классическая микробиологическая диагностика инфекций, вызываемых MRSA, ничем не отличается от диагностики других стафилококковых инфекций, то детекция метициллинрезистентности имеет некоторые особенности. Прежде всего метициллин уже давно не применяется не только в клинической медицине, но и в лабораторной диагностике. На протяжении многих лет метициллинрезистентность выявляли ДДМ-использованием диска с оксациллином. Однако сравнительно недавно было показано, что использование диска с цефокситином обеспечивает большую чувствительность и специфичность детекции метициллинрезистентности. На основании этих данных CLSI и EUCAST рекомендуют использовать для детекции метициллинрезистентности только диски с цефокситином. Здесь же уместно еще раз напомнить, что, согласно рекомендациям CLSI и EUCAST, оценивать чувствительность стафилококков к другим β-лактамам, кроме цефтаролина и цефтобипрола, нецелесообразно из-за высокой вероятности получения ложной чувствительности. Для прогноза чувствительности к β-лактамам необходимо использовать результаты, получаемые при оценке чувствительности культуры к цефокситину.
Гораздо более серьезную проблему из-за невозможности использовать ДДМ представляет определение чувствительности стафилококков к ванкомицину (выявление фенотипов VISA и hVISA). Молекулярные тесты также отсутствуют, поскольку точный механизм формирования устойчивости не известен. Для выявления снижения чувствительности необходимо использовать фенотипические методы определения МПК в серийных разведениях или разные варианты эпсилометрических тестов. Однако перечисленные методы недостаточно стандартизованы и не обладают необходимой специфичностью и чувствительностью. Наиболее достоверным методом служит популяционный анализ (PAP), требующий для своей постановки специальной аппаратуры [39]. Естественно, что такой метод достаточно трудоемок и может быть выполнен только в специализированных референс-лабораториях. В отличие от детекции hVISA/VISA фенотип VRSA легко можно определять даже ДДМ.
Лечение инфекций, вызываемых MRSA
Наиболее детальные рекомендации по тактике терапии MRSA-инфекций изложены в двух обновляемых протоколах: Американского общества инфекционистов – IDSA (Infectious Diseases Society of America) [40] и Британского общества по микробной химиотерапии BSAC (British Society for Antimicrobial Chemotherapy) [41]. Описываемые ниже возможности лечения MRSA-инфекций основаны на этих протоколах.
Прежде всего это касается режимов дозирования антибиотика, наиболее современные рекомендации по этому вопросу приведены в консенсусном документе, принятом рядом профессиональных сообществ [42]. Основу этих рекомендаций составляют клинические наблюдения, а также анализ фармакокинетических и фармакодинамических закономерностей. Показано, что предиктором эффективности ванкомицина является отношение площади под фармакокинетической кривой ванкомицина (area under the curve – AUC) к минимальной подавляющей концентрации (minimal inhibitory concentration – MIC) антибиотика в отношении возбудителя. Высокая вероятность клинического и бактериологического эффекта отмечается при значении AUC/MIC≥400. Обеспечить эту величину удается в отношении бактерий с МПК ванкомицина 1,0 мкг/мл при разовой дозе антибиотика 5–20 мг/кг, вводимой с интервалом 8–12 часов. При МПК ванкомицина в отношении возбудителя более 1,0 мкг/мл для лечения рекомендуется использовать альтернативные препараты.
Важным моментом правильного клинического применения ванкомицина служит учет того факта, что при лечении инфекций, вызванных метициллинчувствительными стафилококками, антибиотик по эффективности существенно уступает β-лактамам. Этот факт исключает возможность эмпирического применения ванкомицина при стафилококковых инфекциях без подтверждения метициллинрезистентности.
Бактериемии делят на осложненные и осложненные, последние определяют как развившиеся на фоне эндокардита или при наличии имплантированных устройств. Основу терапии составляют ванкомицин и даптомицин, при неосложненных формах достаточной считается 2-недельная длительность применения, при осложненных – 4–6 недель. Обсуждается вопрос о дозах даптомицина. Разрешенная доза составляет 6,0 мг/кг/сут, высказывается предположения о необходимости использовать при эндокардите дозы до 10,0 мг/кг/сут. Целесообразность использования комбинаций ванкомицина с аминогликозидами или рифампицином не доказана.
Ни один из новых препаратов не рекомендован для лечения интраабдоминальных MRSA-инфекций. Тигециклин, разрешенный по этому показанию при MSSA-инфекциях, на практике применяют и при MRSA- инфекциях.
Лечение нозокомиальной пневмонии, в т.ч. и вентиляторассоциированной, – один из немногих случаев, в котором показано достоверное преимущество линезолида перед ванкомицином. Даптомицин при легочных инфекциях практически неэффективен, поскольку ингибируется легочным сурфактантом [45].
При инфекциях мочевыводящих путей ни один из новых антибиотиков не показан, рекомендуется использовать нитрофурантоин или ко-тримоксазол, при осложненных формах – ванкомицин и даптомицин. Концентрации линезолида и тигециклина не достигают терапевтических значений в моче, соответственно, их использование нецелесообразно [46].
Новые антибиотики также не рекомендованы для лечения инфекций ЦНС; базовым препаратом считается ванкомицин, некоторые эксперты рекомендуют его комбинацию с рифампицином. Несмотря на отсутствие официальных показаний, имеется положительный опыт применения при менингитах и других инфекциях ЦНС линезолида и даптомицина.
Помимо существующих высокоэффективных антибиотиков в настоящее время в клиническую практику внедряются новые препараты, активные в отношении MRSA, VISA, VRSA. К их числу относятся тедизолид (Tedizolid), далбаванцин (Dalbavancin) и телаванцин (Telavancin). Тедизолид – бактериостатический антибиотик группы оксазолидинонов второго поколения, механизм его действия – нарушение сборки бактериального рибосомального комплекса, что приводит к нарушению биосинтеза белка клетки. Основной особенностью тедизолида считается преодоление резистентности к линезолиду. Препарат ориентирован на терапию ИКМТ у взрослых (FDA, 2014), также ведутся клинические испытания по поводу возможности использования тедизолида для лечения нозокомиальных пневмоний [47, 48]. Далбаванцин – дериват гликопептидов, относится ко второму поколению липогликопептидов, одобрен FDA в 2014 г. для лечения ИКМТ. Этот антибиотик, аналогичный ванкомицину, нарушает биосинтез клеточной стенки бактерии [49]. Телаванцин – парентеральный липогликопептид, нарушает биосинтез клеточной стенки, одобрен в 2009 г. для лечения стафилококковых ИКМТ, внутрибольничных пневмоний и вентиляторассоциированных пневмоний [50].
Заключение
Литература
Об авторах / Для корреспонденции

Разнообразный объем лечебно-диагностических манипуляций и расширение объемов медицинской помощи, оказываемых врачом хирургом на этапе оказания первичной медико-санитарной помощи пациентам предполагает наличие в арсенале используемых лекарственных средств эффективных и доступных антибактериальных препаратов. В обзоре рассмотрены возможности применения комбинированного антибактериального препарата ципрофлоксацин + тинидазол в амбулаторной хирургической практике с позиций клинической эффективности и лекарственной безопасности.
Для цитирования: Е.Н. Деговцов, Д.И. Трухан, А.Ф. Сулимов Комбинированный антибактериальный препарат в амбулаторной хирургической практике с позиций клинической эффективности и лекарственной безопасности. Стационарозамещающие технологии. Амбулаторная хирургия. 2019;(3-4):
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Combined antibacterial drug in ambulatory surgical practice with a position of clinical efficiency and drug safety
The diverse amount of therapeutic and diagnostic manipulations and the expansion of the volume of medical care provided by the surgeon at the stage of providing primary health care to patients suggests the availability of effective, safe and affordable antibacterial drugs in the arsenal of drugs used. the review considers the possibility of using the combined antibacterial drug ciprofloxacin + tinidazole in outpatient surgical practice from the standpoint of clinical efficacy and drug safety.
For citation: Degovtsov E.N., Trukhan D.I., Sulimov A.F. Combined antibacterial drug cyprfloxacins + tinidazol in ambulatory surgical practice with a position of clinical efficiency and drug safety. Ambulatornaya khirurgiya = Нospital-replacing technologies: Ambulatory surgery. 2019;(3-4):74-82. (In Russ.). doi: 10.21518/1995-1477-2019-3-4-74-82
Conflict of interest: The authors declare that there is no conflict of interest regarding the publication of this article
Одним из приоритетных направлений деятельности Российского общества хирургов является оптимизация оказания хирургической помощи населению в различных регионах страны, улучшение ее доступности, качества и безопасности.
Хирургическая помощь населению может оказываться в следующих условиях: амбулаторно (в условиях, не предусматривающих круглосуточное медицинское наблюдение и лечение); в дневном стационаре (в условиях, предусматривающих медицинское наблюдение и лечение в дневное время, не требующих круглосуточного медицинского наблюдения и лечения); стационарно (в условиях, обеспечивающих круглосуточное медицинское наблюдение и лечение).
Перспективным направлением является развитие стационарзамещающих хирургических технологий (амбулаторная хирургическая помощь, центры амбулаторной хирургии, стационары одного дня и т.п.) [3, 4].
Работа врача на хирургическом приеме больных в поликлинике характеризуется некоторыми особенностями, в значительной степени определяющими не только качество лечебно-диагностической помощи амбулаторным больным, но и многие стороны деятельности хирургического стационара. Большое место в деятельности амбулаторного хирурга занимают оперативные методы лечения. Объем и характер их зависит от категории поликлиники, опыта хирурга и условий, в которых он работает. В практической деятельности хирурга поликлиники весьма часты также операции по поводу гнойных заболеваний мягких тканей, различного рода блокады, пункции суставов конечностей [5, 6].
Разнообразный объем лечебно-диагностических манипуляций и расширение объемов медицинской помощи, оказываемых врачом хирургом на этапе оказания первичной медико-санитарной помощи пациентам предполагает наличие в арсенале используемых лекарственных средств эффективных и доступных антибактериальных препаратов [7–9].
В данном обзоре рассмотрим возможности применения комбинированного антибактериального препарата, представляющего собой фиксированную комбинацию ципрофлоксацина (500 мг) и тинидазола (600 мг) в виде таблеток.
Ципрофлоксацин – антибиотик широкого спектра действия, активный в отношении большинства аэробных грамположительных и грамотрицательных микроорганизмов, таких как Escherichia coli, Klebsiella spp., Salmonella typhi и других штаммов Salmonella, Proteus mirabilis, Proteus vulgaris, Yersinia enterocoilitica, Pseudomonas aeruginosa, Shigella flexneri, Shigella sonnei, Haemophilus ducreyi, Haemophilus influenzae, Neisseria gonorrhoeae, Moraxella catarrhalis, Vibrio cholerae, Bacteroides fragilis, Staphylococcus aureus (включая метициллин устойчивые штаммы), Staphylococcus epidermidis, Streptococcus pyogenes, Streptococcus pneumoniae, Mycoplasma, Legionella и Mycobacterium tuberculosis.
Ципрофлоксацин широко применяется при лечении больных с хирургической инфекцией, в том числе с инфекцией кожи и мягких тканей [11, 12].
Вместе с тем, необходимо отметить, что ципрофлоксацин обладает довольно низкой активностью в отношении анаэробных микроорганизмов, тогда как при некоторых осложненных инфекциях мягких тканей и кожи, развитие патологического процесса связано не только с традиционными аэробными возбудителями, но и с анаэробными микроорганизмами, которые наиболее клинически значимы при таких состояниях и заболеваниях, как диабетическая стопа у больных сахарным диабетом или атеросклеротическое поражение магистральных сосудов, пролежни, остеомиелит с вовлечением мягких тканей, окружающих кость. При лечении такой патологии необходимо применять препараты, проявляющие активность как в отношении аэробных, так и анаэробных микроорганизмов. При отсутствии таких лекарственных средств применяют комбинированную терапию, включающую препараты, действующие на аэробную микрофлору, и препараты с антианаэробной активностью [11, 12].
Добавление к ципрофлоксацину тинидазола – противомикробного и противопротозойного средства, производного имидазола, эффективного в отношении анаэробных микроорганизмов, таких как Clostridium difficile, Clostridium perfringens, Bacteroides fragilis, Peptococcus и Peptostreptococcus anaerobius, расширяет антимикробный спектр комбинированного препарата.
В гинекологической практике продемонстрирована клиническая и микробиологическая эффективность комбинированного препарата в лечение пациенток с неосложненным сальпингоофоритом [13], латентными формами воспаления придатков матки [14, 15], бактериальным вагинозом [16, 17]. В сравнительном исследовании эффективность терапии воспалительных заболеваний малого таза комбинацией ципрофлоксацин+тинидазол в течение 7 дней составила 96%, что превосходило другие комбинации антибактериальных препаратов флуконазол+азитромицин+секнидазол и доксициклин+метронидазол [18]. Отмечена эффективность применения комбинации ципрофлоксацин+тинидазол и в профилактике инфекционно-воспалительных осложнений внутриматочной хирургии и послеабортной реабилитации пациенток [19, 20].
В РФ количество пациентов с сахарным диабетом, по мнению Международной диабетической федерации, составляет на начало текущего десятилетия 11,5% взрослого населения, что соответствует приблизительно 12,6 млн человек [42]. Среди больных сахарным диабетом наблюдается рост численности пациентов пожилого и старческого возраста, что приводит к ежегодному увеличению числа больных с так называемыми поздними осложнениями диабета, к которым относятся ретинопатия, нефропатия и синдром диабетической стопы [43]. Главными патогенетическими факторами, приводящими к поражению стоп при сахарном диабете, являются периферическая нейропатия и поражение магистральных артерий нижних конечностей, на фоне которых развивается инфекция [44, 45].
Самым частым проявлением синдрома диабетической стопы являются язвенные дефекты, представляющие собой хронические раны, наличие которых определяет течение сахарного диабета, качество жизни и ее продолжительность. Частота их возникновения у пациентов с сахарным диабетом достигает 25%, предполагает возможную ампутацию нижней конечности, которая существенно изменяет и сокращает жизнь больного. В настоящее время доказано, что своевременная и адекватная консервативная терапия синдрома диабетической стопы в большинстве случаев позволяет предотвратить обширное повреждение тканей, заживить рану, снизить риск ампутации нижней конечности и развитие рецидива после заживления [46, 47].
Проведенные авторами клинико-лабораторные исследования показали, что комбинированный препарат, состоящий из ципрофлоксацина 500 мг и тинидазола 600 мг проявляет высокую клиническую и бактериологическую эффективность при лечении больных гнойными ранами кожи и мягких тканей аэробной и анаэробной этиологии. При применении комбинированного препарата в комплексном лечении клинический эффект наблюдался в 97,5% случаев, а бактериологическая эффективность – в 75% случаев. Благоприятное клиническое течение раневого процесса позволило у большинства больных успешно выполнить основные этапы хирургического лечения: первичную хирургическую обработку гнойного очага с наложением швов на раны, закрытие раны свободными перфорированными кожными лоскутами.
Клинический пример
Приведем клинический пример из нашей практики. Пациентка Т., бухгалтер, 52 лет перед корпоративным мероприятием выдавила фурункул в подбородочной области. Через 3 дня отметила появление болезненности в этой области, появилась гиперемия, напряженный отек, местная гипертермия. Лечилась самостоятельно, применяла повязки с мазью Вишневского. Через 3 дня повысилась температура до 38,2 0 С, увеличилась гиперемия, боли, отек в подбородочной области. К хирургу поликлиники обратилась через 6 дней. При осмотре в центре на месте бывшего фурункула, участок грязно-серого цвета 2 х 2 см. Отмечается флюктуация. Пальпируются подчелюстные лимфоузлы до 1,0 см 2 , чувствительные при пальпации и не спаянные с окружающей тканью. Общий анализ крови по cito: Нв-128 г/л, лейкоциты – 11,2 х 10 9 , СОЭ – 31 мм/ч, в лейкоцитарной формуле: нейтрофилы 45%, палочкоядерные 10%, лимфоциты – 35%, моноциты – 9%, эозинофилы – 1%.
Вместе с тем, при выборе лекарственного препарата наряду с его клинической эффективностью [52], надо учитывать и его безопасность [53, 54].
Изучение побочных эффектов ципрофлоксацина и других фторхинолонов постоянно продолжается [55–59]. В частности, обращается внимание на необходимость их осторожного применения у пожилых пациентов, ввиду наличия неблагоприятных реакций со стороны ЦНС и удлинения интервала QT на ЭКГ [55].
В марте 2018 года были опубликованы результаты исследования шведских ученых, которые изучили истории болезни более 360 тысяч пациентов, принимавших фторхинолоны (в 78 % случаев это был ципрофлоксацин) и пришли к выводу, что фторхинолоны на 66 % увеличивают риск аневризмы и расслоения аорты. Частота таких случаев составила 1,2 на 1000 человек против 0,7 на 1000 больных, принимавших другие антибиотики [60].
В октябре 2018 г. Комитет по оценке рисков в сфере фармаконадзора (Pharmacovigilance Risk Assessment Committee, PRAC), входящий в состав Европейского агентства лекарственных средств (European Medicines Agency, EMA), рекомендовал ограничить применение фторхинолонов. В соответствии с его рекомендациями европейским врачам не следует назначать препараты для лечения нетяжелых инфекций, а также использовать фторхинолоны для профилактики диареи и рецидива инфекций нижних мочевых путей [4].
Министерство здравоохранения Российской Федерации в ноябре 2018 года опубликовало информационное письмо [5] с требованием для производителей внести изменения в инструкции по применению антимикробных препаратов, относящихся к фторхинолонам системного действия. Это же относится и к препаратам, в составе которых фторхинолоны идут в комбинации с другими действующими веществами.
Читайте также:

