Красная волчанка последние новости
Обновлено: 25.04.2024
Системная красная волчанка (СКВ) – аутоиммунное заболевание, этиология которого остается неизвестной. Кожный синдром при СКВ зачастую имеет первостепенное диагностическое значение – поражение кожи в 20-30% случаев является самым ранним симптомом, а у 60-
Systemic lupus erythematosus: alertness in the practice of a dermatologist / M. M. Tlish, Zh. Yu. Naatyzh1, T. G. Kuznetsova, E. A. Chernenko /State Budgetary educational institution of higher professional education Kuban State Medical University of the Ministry of Healthcare of the Russian Federation, Krasnodar, Russia
Abstract. Systemic lupus erythematosus (SLE) is an autoimmune disease, the etiology of which remains unknown. Skin syndrome in SLE is often of paramount diagnostic value – skin lesion is the earliest symptom in 20-30% of cases, and in 60-70% it manifests itself at various stages of the course of the disease, which leads to the patient's primary referral to a dermatologist. Frequent diagnostic errors are due to the absence of clinical symptoms of systemic lesions in the presence of cutaneous manifestations of lupus erythematosus (LE). In this case, laboratory tests are an integral part of the algorithm for managing patients with LE at the stage of contacting a dermatologist. The most specific laboratory test is the determination of antinuclear antibodies by an indirect immunofluorescence reaction, referred to as antinuclear factor (ANF). An elevated ANF titer is included in the list of diagnostic criteria for SLE, its detection allows one to suggest a diagnosis of SLE and determine a further algorithm for the provision of medical care. The article presents two clinical cases illustrating that against the background of an isolated skin lesion and the absence of visible somatic pathology, abnormalities in immunological tests were identified. This made it possible to suspect the systemic course of the process at an early stage and refer patients to a rheumatologist's consultation, where the diagnosis of SLE was confirmed. For citation: Tlish M. M., Naatyzh Zh. Yu., Kuznetsova T. G., Chernenko E. A. Systemic lupus erythematosus: alertness in the practice of a dermatologist // Lechaschy Vrach. 2020; vol. 23 (11): 23-26. DOI: 110.26295/OS.2020.35.78.005
Согласно современным представлениям, системная красная волчанка (СКВ) – аутоиммунное заболевание неустановленной этиологии, характеризующееся гиперпродукцией органонеспецифических аутоантител с развитием иммуновоспалительного повреждения тканей внутренних органов [1]. Широкий ряд вырабатываемых аутоантител и их прямое или опосредованное воздействие на клеточные мишени обуславливают многообразие клинических проявлений при красной волчанке (КВ) [2]. СКВ может проявляться изолированным или сочетанным поражением систем и органов, включающим поражение кожи и слизистых оболочек (волчаночная бабочка, дискоидная эритема, фотосенсибилизация, алопеция, телеангиэктазии, сетчатое ливедо, язвы в полости рта), сердечно-сосудистой системы (перикардит, миокардит, эндокардит, коронарит), почек (волчаночный нефрит), центральной нервной системы (судороги, психоз), опорно-двигательного аппарата (артралгии, артриты), легких (плеврит, волчаночный пневмонит), гематологическими нарушениями (гемолитическая анемия, лейкопения, тромбоцитопения) и т. д. [3].
Ключевую роль в диагностике СКВ играет обнаружение клинических проявлений заболевания и данные лабораторной диагностики [3]. Кожный синдром при СКВ зачастую имеет первостепенное диагностическое значение – поражение кожи в 20-30% случаев является самым ранним симптомом, а у 60-70% проявляется на различных этапах течения болезни, что приводит к первичному обращению больного именно к дерматологу [4]. Поражения кожи при СКВ полиморфны и представлены различными изменениями – от незначительных телеангиэктазий до буллезных поражений [2]. Выделяют волчаночно-специфичные и волчаночно-неспецифичные поражения кожи, последние встречаются в несколько раз чаще. К волчаночно-специ-фичным относят различные проявления хронической, подострой и острой КВ [5]. Группа неспецифических поражений включает: фотосенсибилизацию, лейкоцитокластический и уртикарный васкулит, телеангиэктазии, сетчатое ливедо, злокачественный атрофический папулез и синдром Рейно [5]. Широкая вариабельность клинических проявлений кожного синдрома обуславливает необходимость проведения тщательного дифференциального диагноза [1].
Важным инструментом ранней диагностики системных заболеваний является обнаружение аутоантител с помощью лабораторных тестов [3]. Наиболее специ-фичными для СКВ являются антинуклеарные антитела (АНА) – это гетерогенная группа аутоантител к компонентам клеточного ядра, среди которых выделяют антитела к двуспиральной дезоксирибонуклеиновой кислоте (ДНК), гистонам, нуклеосомам, экстрагируемым ядерным антигенам, ядрышковым антигенам и другим клеточным структурам [6]. Стандартным методом обнаружения группы АНА является непрямая реакция иммунофлюоресценции (НРИФ) с использованием линии эпителиальных клеток аденокарциномы гортани человека (HЕp-2) [7]. Определение АНА методом НРИФ принято обозначать как антинуклеарный фактор (АНФ), содержание которого оценивается по максимальному выявленному титру в сыворотке крови, с указанием интенсивности и типа флюоресценции [8]. Количественное увеличение титра свыше 1:160 входит в перечень диагностических критериев СКВ согласно рекомендациям Американской коллегии ревматологов (American College of Rheumatology, ACR) и Европейской лиги борьбы с ревматизмом (European League Against Rheumatism, ULAR) и используется для оценки активности процесса, прогноза, так как является предиктором развития СКВ на доклинической стадии [8].
Длительное формирование патогномоничного клинического симптомокомплекса СКВ, отсутствие проведения необходимых лабораторных исследований и междисциплинарного взаимодействия являются причиной частых диагностических ошибок, приводящих к отсутствию своевременной противовоспалительной и иммуносупрессивной терапии у врача-ревматолога. Учитывая вышесказанное, считаем целесообразным привести собственные клинические наблюдения.
Клиническое наблюдение № 1
Данные со стороны других органов и систем: предъявляет жалобы на ноющие боли в мелких суставах кистей и коленных суставах, чувство утренней скованности. Соматически не обследована.
Объективно: кожный патологический процесс носит ограниченный симметричный характер, локализуется на коже крыльев носа, щек, подбородка. Представлен: эритематозные пятна, чешуйки, телеангиэктазии.
На коже лица (в области крыльев носа, щек, подбородка) расположены ярко-розовые эритематозные очаги, с четкими границами, слегка инфильтрированные, правильной округлой формы, диаметром 3-4 см, покрытые небольшим шелушением в центре очагов; в периферической зоне очагов визуализируются телеангиэктазии (рис. 1). Удаление чешуек сопровождается болезненностью (симптом Бенье–Мещерского).
.jpg)
Определена биодоза 20 секунд.
Результаты гистоморфологического исследования кожи из патологического очага на правой щеке: фолликулярный гиперкератоз; эпидермис с тенденцией к атрофии; вакуольная дистрофия клеток базального слоя. Под эпидермисом сосуды расширены. Во всех отделах дермы – густые диффузные и периваскулярные лимфогистиоцитарные инфильтраты с примесью нейтрофилов и плазмоцитов. Вокруг сально-волосяных фолликулов – густой лимфогистиоцитарный инфильтрат с примесью нейтрофилов, тучных клеток и фибробластов, проникающий в наружное эпителиальное влагалище. В дерме – участки мукоидного набухания коллагеновых волокон. Заключение: морфологическая картина может соответствовать красной волчанке.
Данные общеклинических исследований: общий и биохимический анализ крови – показатели в пределах нормы; общий анализ мочи – показатели в пределах нормы.
Настораживающими факторами в плане трансформации кожной формы в системный процесс у пациентки М. явились: дебют заболевания в молодом возрасте, длительная инсоляция в анамнезе, II фототип кожи, биодоза 20 секунд, наличие выраженного суставного синдрома.
Для исключения диагноза СКВ было проведено иммунологическое исследование:
- Антинуклеарный фактор на НЕр-2 клетках: 1:320 титр (норма менее 160); мелкогранулярный тип свечения.
- Антитела к двуспиральной ДНК (a-dsDNA) – 53 МЕ/мл (норма – менее 25 МЕ/мл).
- Анализ крови на антитела к фосфолипидам класса IgG (скрининг) – 10,13 МЕ/мл (референсные значения: до 10 МЕ/мл – не обнаружено).
- Анализ крови на антитела к фосфолипидам класса IgM (скрининг) – 12,68 МЕ/мл (референсные значения: до 10 МЕ/мл – не обнаружено).
С полученными данными больная направлена к ревматологу в Краевую клиническую больницу № 2, где был подтвержден диагноз СКВ. Больная взята на диспансерный учет ревматологом для определения дальнейшей тактики ведения и лечения.
Клиническое наблюдение № 2
Объективно: кожный патологический процесс носит распространенный характер, локализован на коже лица, шеи. Представлен: пятна, телеангиэктазии, чешуйки.
На коже лица в области щек, левой околоушной области и шеи расположены отечные эритематозные очаги розовато-красного цвета, диаметром 2–3 см, преимущественно правильно-округлой формы с небольшим шелушением, визуализируются единичные телеангиэктазии. Удаление чешуек сопровождается болезненностью (симптом Бенье–Мещерского) (рис. 2).
.jpg)
Результаты гистоморфологического исследования кожи из патологического очага: на коже левой щеки – фолликулярный гиперкератоз; участки паракератоза; эпидермис местами атрофичен; вакуольная дистрофия клеток базального слоя эпидермиса; подэпидермальные пузыри. В сосочковом слое – отек, стенки сосудов утолщены. В дерме – густые очаговые и периваскулярные лимфогистиоцитарные инфильтраты с примесью нейтрофилов. Вокруг сально-волосяных фолликулов – густой лимфогистиоцитарный инфильтрат с примесью нейтрофилов, тучных клеток и фибробластов, проникающий в наружное эпителиальное влагалище. В дерме – участки мукоидного набухания коллагеновых волокон. Заключение: морфологическая картина больше соответствует красной волчанке.
Данные общеклинических исследований: в общем и биохимическом анализах крови выявлены следующие отклонения – лейкоциты 3,7 × 10 9 /л; холестерин 8,7 ммоль/л.
Учитывая длительность течения кожного патологического процесса, отсутствие результатов обследования смежных специалистов, для исключения диагноза СКВ было проведено иммунологическое исследование:
- Антинуклеарный фактор на НЕр-2 клетках: 12 560 титр (норма менее 160); крупногранулярный тип свечения.
- Антитела к двуспиральной ДНК (a-dsDNA) – 0,5 МЕ/мл (норма – менее 25 МЕ/мл).
- Анализ крови на антитела к фосфолипидам класса IgG (скрининг) 16,65 МЕ/мл (референсные значения: до 10 МЕ/мл – не обнаружено).
- Анализ крови на антитела к фосфолипидам класса IgM (скрининг) – 14,68 МЕ/мл (референсные значения до 10 МЕ/мл – не обнаружено).
Таким образом, иммунологические исследования и их комплексный анализ являются неотъемлемой составляющей алгоритма ведения больных с КВ уже на этапе обращения к врачу-дерматологу и способствуют высокому качеству оказания медицинской помощи данному контингенту больных.
Литература/References
М. М. Тлиш, доктор медицинских наук, профессор
Ж. Ю. Наатыж 1 , кандидат медицинских наук
Т. Г. Кузнецова, кандидат медицинских наук
Е. А. Черненко
ФГБОУ ВО КубГМУ Минздрава России, Краснодар, Россия
Системная красная волчанка: настороженность в практике дерматолога/ М. М. Тлиш, Ж. Ю. Наатыж, Т. Г. Кузнецова, Е. А. Черненко
Для цитирования: Тлиш М. М., Наатыж Ж. Ю., Кузнецова Т. Г., Черненко Е. А. Системная красная волчанка: настороженность в практике дерматолога // Лечащий Врач. 2020; т. 23 (11), 23-26. DOI: 110.26295/OS.2020.35.78.005
Теги: аутоиммунное заболевание, кожный синдром, алгоритм лечения
Полвека кряду это аутоиммунное заболевание оставалось без специфической фармакотерапии.

Изображение: Daniel Schreurs/Dreamstime.
Несмотря на множество проведенных клинических испытаний экспериментальной терапии системной красной волчанки, только одно таргетное лекарственное средство, белимумаб (belimumab), смогло за минувшие 60 лет добиться регуляторного одобрения. Разработка новых препаратов связана с рядом проблемных факторов, включающих вопросы к протоколам клинических исследований и гетерогенность пациентской популяции. Особенно удручает нехватка достоверных показателей эффективности лечения.
Так, для системной красной волчанки не предложено ни надежного золотого стандарта измерения активности заболевания, ни унифицированного способа оценки ответа на терапию. Фактически разработка лекарств движется быстрее, чем разработка методов анализа их эффективности. Зачастую фармкомпаниям приходится внедрять собственные конечные точки результативности лечения, являющиеся, впрочем, модификациями хорошо известных инструментов, и потому существует весомый риск, что какой-либо препарат-кандидат, который в действительности работает, не уложится в существующие каноны регуляторов ввиду негибкости их парадигм одобрения новых медикаментов.
Узнать подробности
Baricitinib for systemic lupus erythematosus: a double-blind, randomised, placebo-controlled, phase 2 trial. Lancet 2018; 392: 222–31. [PDF ] [источник ]
A double-blind, randomized, placebo-controlled, phase II trial of baricitinib for systemic lupus erythematosus: how to optimize lupus trials to examine effects on cutaneous lupus erythematosus. Br J Dermatol. 2019 May; 180(5): 964–965. [PDF ] [источник ]
Тем не менее фармотрасль вплотную подошла к тому, чтобы предложить новые и весьма эффективные лекарственные препараты против системной красной волчанки. Рассмотрим некоторые из них.

Таргетные биологические препараты против системной красной волчанки. Изображение: F1000Research 2018, 7(F1000 Faculty Rev):970.
Системная красная волчанка
Системная красная волчанка (SLE) — хроническое гетерогенное аутоиммунное заболевание соединительной ткани, характеризующееся наличием аутоантител против ядерных антигенов, ремиссиями и обострениями, а также чрезвычайно изменчивыми клинической картиной, течением болезни и ее прогнозом. Патология может поражать почти любой орган, включая почки, кожу, опорно-двигательный аппарат, сердечно-сосудистую систему, центральную и периферическую нервную систему, кровь. Заболеванию чаще подвержены женщины. Причина остается неизвестной: считается, что развитию системной красной волчанки способствует потеря аутотолерантности, приводящая к аутоиммунным реакциям, у генетически предрасположенных лиц после воздействия определенных факторов окружающей среды в условиях иммунологической и гормональной нестабильности.
Терапия системной красной волчанки направлена на минимизацию органных повреждений, предотвращение обострений в периоды стабильности, оптимизацию качества жизни пациентов. Среди назначаемых препаратов: противомалярийные (гидроксихлорохин), глюкокортикостероиды (преднизон/преднизолон, метилпреднизолон), иммуномодуляторы и иммуносупрессанты (метотрексат, азатиоприн, микофенолата мофетил, циклофосфамид).
Анифролумаб
Анифролумаб (anifrolumab) — полностью человеческое моноклональное антитело, связывающее субъединицу 1 интерферонового рецептора типа I (IFNAR1), и тем самым, в отличие от множества антител только против интерферона альфа (IFN-α), блокирующее все интерфероны типа I, включая IFN-α, интерферон бета (IFN-β) и интерферон омега (IFN-ω). Указанные цитокины вовлечены в воспалительные сигнальные пути. Приблизительно 60–80% пациентов с системной красной волчанкой характеризуются усиленным профилем экспрессии генов, регулирующих интерфероны типа I, что напрямую коррелирует с активностью заболевания.
Клиническое исследование TULIP 2 (NCT02446899) фазы III (рандомизированное, двойное слепое, плацебо-контролируемое, многоцентровое, международное) охватило взрослых пациентов (n=365) с активной умеренно-тяжелой системной красной волчанкой с наличием аутоантител. Участники получали стандартное лечение. Каждые четыре недели внутривенно назначали анифролумаб в дозе 300 мг или плацебо. Первичная конечная точка была установлена пропорцией пациентов, по истечении 52 недель терапии показавших ответ, установленный композитным показателем на базе индекса Британской группы по изучению системной красной волчанки (BICLA).
В группе анифролумаба к первичной конечной точке вышли 47,8% пациентов против 31,5% в группе плацебо, что оказалась статистически и клинически значимым (p=0,001). Анифролумаб также обеспечил статистически значимое расхождение с контрольной группой в отношении ряда вторичных конечных точек, включая уменьшение необходимости применения пероральных кортикостероидов (p=0,014) и снижение индекса распространенности и степени тяжести кожной красной волчанки (CLASI) [p=0,039]. Назначение анифролумаба отметилось численно меньшим количеством обострений заболевания в пересчете на год: 0,43 против 0,64 (p=0,081).


Профиль безопасности анифролумаба выдал повышенную частоту развития опоясывающего лишая (Herpes zoster), который, всё же носил легко-умеренную степень выраженности, был исключительно кожным и проходил после антивирусной терапии.
Узнать подробности
Trial of Anifrolumab in Active Systemic Lupus Erythematosus. N Engl J Med. 2020 Jan 16;382(3):211-221. [PDF ] [источник ]
Впрочем, не всё так радужно: в августе 2018 года анифролумаб провалил аналогичное по дизайну клиническое исследование TULIP 1 (NCT02446912) фазы III, когда у него не получилось достичь первичной конечной точки, оформленной пропорцией участников, показавших снижение индекса активности заболевания SLEDAI-2K как минимум на 4 балла (SRI-4) вкупе с другими обязательными условиями.
Узнать подробности
Узнать подробности
Anifrolumab in lupus: the promise and the caution – Author’s reply. [PDF ] [источник ]
Anifrolumab, a monoclonal antibody to the type I interferon receptor subunit 1, for the treatment of systemic lupus erythematosus: an overview from clinical trials. Mod Rheumatol. 2020 Sep 17;1-12. [PDF ] [источник ]
Efficacy of anifrolumab in systemic lupus erythematosus: a critical analysis of the TULIP trials. Lupus. 2020 Jul;29(8):1002-1003. [PDF ] [источник ]
Spotlight on anifrolumab and its potential for the treatment of moderate-to-severe systemic lupus erythematosus: evidence to date. [PDF ] [источник ]
Анализ объединенного пула данных, собранных в TULIP 1 и TULIP 2, подтвердил клиническую состоятельность анифролумаба для лечения системной красной волчанки.
Узнать подробности
Early and sustained responses with anifrolumab treatment in patients with active systemic lupus erythematosus (SLE) in 2 phase 3 trials. [PDF ] [источник ]
Efficacy of anifrolumab in active systemic lupus erythematosus: patient subgroup analysis of BICLA response in 2 phase 3 trials. [PDF ] [источник ]
Flare assessments in patients with active systemic lupus erythematosus treated with anifrolumab in 2 phase 3 trials. [PDF ] [источник ]
Ценеримод


Узнать подробности
First use of cenerimod, a selective S1P1 receptor modulator, for the treatment of SLE: a double-blind, randomised, placebo-controlled, proof-of-concept study. Lupus Sci Med. 2019; 6(1): e000354. [PDF ] [источник ]
Ценеримод (cenerimod) представляет собой пероральный избирательный агонист сфингозин-1-фосфатных рецепторов подтипа 1 (S1PR1). Ценеримод, связываясь с S1PR1 на поверхности T- и B-лимфоцитов, приводит к интернализации первого, тем самым последние теряют способность считывать градиент сфингозин-1-фосфата (S1P), циркулирующего в периферической крови, и перестают мигрировать из лимфоузлов в направлении высокой концентрации S1P. Ценеримод, сдерживая выход лимфоцитов из вторичных лимфоидных органов, не дает им мигрировать к местам воспаления.
Телитацицепт


Телитацицепт (telitacicept, RC18) — рекомбинантный гибридный белок, состоящий из внеклеточного домена рецептора трансмембранного активатора и партнера кальциевого модулятора и лиганда циклофилина (TACI) и Fc-домена иммуноглобулина IgG человека. Телитацицепт, нейтрализуя BAFF и индуцирующий пролиферацию лиганд (APRIL), подавляет развитие и выживаемость зрелых B-клеток, тем самым препятствуя образованию аутоантител, что является основополагающим в патофизиологии аутоиммунных воспалительных заболеваний.
Телитацицепт проходит параллельную проверку в терапии множества других аутоиммунных патологий: ревматоидного артрита, нейромиелита зрительного нерва со спектральным расстройством, рассеянного склероза, IgA-нефропатии (болезнь Берже), миастении гравис, синдрома Шегрена.
Ригеримод
Ригеримод (rigerimod, IPP-201101, P140) — полипептид, соответствующий последовательности 131–151 малого ядерного нуклеопротеина и компонента сплайсосомы snRNP70 с фосфорилированным серином в позиции 140. Механизм действия ригеримода до конца не ясен, но, есть мнение, что он выступает иммуномодулятором: путем связывания с главным комплексом гистосовместимости (MHC) класса II осуществляется подавление T-клеточной реактивности с сопутствующим восстановлением иммунной толерантности. Не исключено, одним из центральных эффектов ригеримода является аутофагия: лекарственное соединение вмешивается в сигнальный путь лизосомальной деградации, вызывая нестабильность MHCII-молекул, которые должны презентировать эндогенные антигены аутореактивным T-клеткам; при этом работа нормальных лимфоцитов не затрагивается. На мышиных моделях показано , что ригеримод сдерживает протеинурию, васкулит и дерматит, препятствует выработке аутоантител против dsDNA.
Устекинумаб
В клиническом испытании NCT02349061 фазы II (рандомизированном, двойном слепом, плацебо-контролируемом, многоцентровом, международном) среди взрослых пациентов (n=102) с умеренно-тяжелой системной красной волчанкой назначение устекинумаба поверх стандартной терапии привело к тому, что по истечении 24 недель 62% участников добрались до показателя SRI-4 — против 33% больных в контрольной группе (p=0,006). Указанное достижение сохранилось по прошествии 48 недель у 63,3% участников, получавших устекинумаб.
Узнать подробности
Efficacy and safety of ustekinumab, an IL-12 and IL-23 inhibitor, in patients with active systemic lupus erythematosus: results of a multicentre, double-blind, phase 2, randomised, controlled study. Lancet. 2018 Oct 13;392(10155):1330-1339. [PDF ] [источник ]
Maintenance of Efficacy and Safety of Ustekinumab Through One Year in a Phase II Multicenter, Prospective, Randomized, Double-Blind, Placebo-Controlled Crossover Trial of Patients With Active Systemic Lupus Erythematosus. Arthritis Rheumatol. 2020 May;72(5):761-768. [PDF ] [источник ]
Энтузиазм следует умерить до подведения итогов продолжающегося клинического исследования NCT03517722 фазы III, поскольку чрезвычайно гетерогенная природа волчанки зачастую не оставляет шансов на успех в ходе завершающей проверки.
Устекинумаб (ustekinumab) — полностью человеческое моноклональное антитело, которое связывается с белковой p40-субъединицей, общей для интерлейкина 12 (IL-12) и интерлейкина 23 (IL-23). Считается, что оба этих цитокина вовлечены в патогенез системной красной волчанки: IL-12 необходим для клеточного развития T-хелперов типа 1 (Th1) и фолликулярных T-хелперов (TFH), а также цитотоксической T-клеточной активации и функционирования, а IL-23 отвечает за экспансию и выживаемость патогенных Th17 и других клеток, продуцирующих интерлейкин 17 (IL-17), который промотирует воспаление в тканях.
Управление по контролю за продуктами и лекарствами США (FDA) 2 августа одобрило препарат Saphnelo (anifrolumab) от AstraZeneca для лечения средней и тяжелой форм системной красной волчанки (СКВ) у взрослых в сочетании со стандартной терапией. Saphnelo стал единственным лексредством, одобренным для терапии СКВ за последние 10 лет. До этого в 2011 году американский регулятор разрешил к применению Бенлиста (белимумаб) от GlaxoSmithKline для лечения этого аутоиммунного заболевания.
Англо-шведская AstraZeneca приобрела глобальные права на Saphnelo в 2004 году в ходе заключения соглашения о сотрудничестве с американской биофармацевтической компанией Medarex, однако в 2009 году эту компанию приобрела Bristol-Myers Squibb (BMS). Согласно условиям соглашения, AstraZeneca будет выплачивать BMS роялти с продаж препарата.
Saphnelo является антагонистом рецепторов интерферона I типа (IFN типа I), играющего центральную роль в патофизиологии волчанки. В Европе и Японии регулирующие органы рассматривают документы на препарат для одобрения его использования для терапии СКВ.
Результаты КИ TULIP-1 были размещены в декабре 2019 года в The Lancet Rheumatology, результаты КИ TULIP-2 опубликованы в январе 2020 года в The New England Journal of Medicine.
СКВ – наиболее распространенная форма волчанки. В США ею страдают 300 тысяч человек, в большей мере болезни подвержены афроамериканцы, латиноамериканцы и азиаты.
Весной 2011 года FDA одобрило Бенлиста для лечения пациентов с СКВ, получающих стандартную терапию, в том числе кортикостероидами, противомалярийными препаратами, иммунодепрессантами или нестероидными противовоспалительными лексредствами. В 2019 году американский регулятор разрешил применять препарат для терапии волчанки у детей от 5 лет, с 2020 года лексредство применяется для терапии волчаночного нефрита у взрослых.
В России, согласно клиническим рекомендациям по диагностике и лечению системной красной волчанки от 2020 года, заболеваемость СКВ колеблется от 4 до 250 случаев на 100 тысяч человек. Пик заболеваемости приходится на возрастную группу 15–25 лет.
В начале июня 2021 года FDA впервые за последние семь лет также одобрило препарат для терапии ожирения – Wegovy (семаглутид) от Novo Nordisk. До этого в 2014 году ведомство одобрило Contrave (налтрексон+бупропион) от Orexigen Therapeutics.

Новость
Автор
Редакторы
Системная красная волчанка — это мультифакторное заболевание, развивающееся на основе генетического несовершенства иммунной системы и характеризующееся выработкой широкого спектра аутоантител к компонентам клеточного ядра. Молекулярно-генетические основы болезни изучены довольно плохо, в связи с чем специфического лечения до сих пор не создано, а в основе проводимой в клинике патогенетической терапии лежат иммунодепрессанты — глюкокортикостероиды и цитостатики. И вот, после более чем 50 лет попыток разработать специфическое лечение волчанки, произошел сдвиг: Управление по контролю за качеством пищевых продуктов и лекарств США официально утвердило в качестве лекарства от волчанки препарат Бенлиста (Benlysta) на основе моноклональных антител, специфически блокирующих B-лимфоцит-стимулирующий белок (BLyS).
Системная красная волчанка (СКВ) — одно из самых распространённых аутоиммуных заболеваний, в основе которого лежит генетически обусловленное комплексное нарушение иммунорегуляторных механизмов. При заболевании происходит образование широкого спектра аутоантител к различным компонентам ядра клеток и формирование иммунных комплексов. Развивающееся в различных органах и тканях иммунное воспаление приводит к обширным поражениям микроциркуляторного кровяного русла и системной дезорганизации соединительной ткани [1], [2].
Патогенез СКВ

Рисунок 1. Патогенез СКВ
Волчанка во многом связана с нарушениями на уровне пролиферации различных клонов В-клеток, активируемых многочисленными антигенами, в роли которых могут выступать медицинские препараты, бактериальная или вирусная ДНК и даже фосфолипиды мембраны митохондрий. Взаимодействие антигенов с лейкоцитами связано либо с поглощением антигенов антиген-презентирующими клетками (АПК), либо с взаимодействием антигена с антителом на поверхности В-клетки.
В результате поочередной активации то T-, то B-клеток увеличивается продукция антител (в том числе, аутоантител), наступает гипергаммаглобулинемия, образуются иммунные комплексы, чрезмерно и неконтролируемо дифференцируются Т-хелперы. Разнообразные дефекты иммунорегуляции, свойственные СКВ, связаны также с гиперпродукцией цитокинов Th2-типа (IL-2, IL-6, IL-4, IL-10 IL-12).
Одним из ключевых моментов в нарушении иммунной регуляции при СКВ является затрудненное расщепление (клиренс) иммунных комплексов, — возможно, вследствие их недостаточного фагоцитоза, связанного, в частности, с уменьшением экспрессии CR1-рецепторов комплемента на фагоцитах и с функциональными рецепторными дефектами.
Распространённость СКВ колеблется в пределах 4–250 случаев на 100 000 населения; пик заболеваемости приходится на возраст 15–25 лет при соотношении заболевших женщин к мужчинам 18:1. Наиболее часто заболевание развивается у женщин репродуктивного возраста с увеличением риска обострения во время беременности, в послеродовом периоде, а также после инсоляции и вакцинации.
СКВ часто становится причиной инвалидности. В развитых странах в среднем через 3,5 года после постановки диагноза 40% больных СКВ полностью прекращают работать, — в основном, в связи с нейрокогнитивными дисфункциями и повышенной утомляемостью. К потере трудоспособности чаще всего приводят дискоидная волчанка и волчаночный нефрит.
Клинические проявления СКВ чрезвычайно разнообразны: поражение кожи, суставов, мышц, слизистых оболочек, лёгких, сердца, нервной системы и т.д. У одного пациента можно наблюдать различные, сменяющие друг друга варианты течения и активности заболевания; у большинства больных периоды обострения заболевания чередуются с ремиссией. Более чем у половины больных есть признаки поражения почек, сопровождающиеся ухудшением реологических свойств крови [4].
Поскольку молекулярные и генетические механизмы, лежащие в основе заболевания, до сих пор как следует не изучены, специфического лечения волчанки до недавнего времени не существовало. Базисная терапия основана на приёме противовоспалительных препаратов, действие которых направлено на подавление иммунокомплексного воспаления, как в период обострения, так и во время ремиссии. Основными препаратами для лечения СКВ являются:
- глюкокортикоиды (преднизолон, метилпреднизолон);
- цитостатические препараты (циклофосфамид, азатиоприн, метотрексат, мофетила микофенолат, циклоспорин).
Исследователи, желая специфически блокировать BLyS, сделали ставку на человеческое моноклональное антитело, разработанное совместно с английской биотехнологической фирмой Cambridge Antibody Technology, и названное белимумаб (belimumab). В начале марта 2011 года американское Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) впервые за 56 лет одобрило препарат, предназначенный для специфического лечения системной красной волчанки. Эти препаратом стал Бенлиста — коммерческое название антитела белимумаба, производством которого уже занимается компания GlaxoSmithKline. До того FDA одобряла для терапии СКВ гидроксихлорохин — лекарство от малярии; было это в 1956 году.
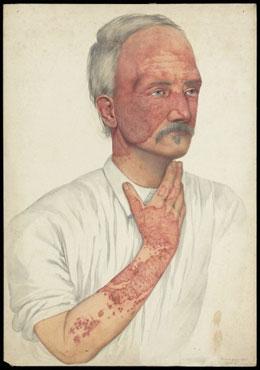
Рисунок 2. Человек, больной системной красной волчанкой (акварель 1902 года кисти Мэйбл Грин). Свое название заболевание получило ещё в средневековье, когда людям казалось, что характерная волчаночная сыпь на переносице напоминает волчьи укусы.
Целенаправленная терапия
Следующие на очереди
Читайте также:

